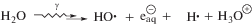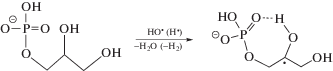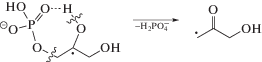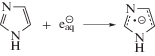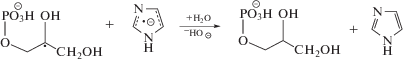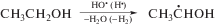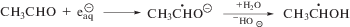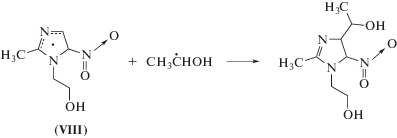Химия высоких энергий, 2021, T. 55, № 2, стр. 155-165
Влияние имидазола и его производных на радиационно-индуцированное дефосфорилирование глицеро-1-фосфата в деаэрированных водных растворах
С. Д. Бринкевич a, А. Я. Малиборский a, b, М. Э. Мельничук c, Р. Л. Свердлов a, b, Ю. В. Григорьев b, О. И. Шадыро a, b, *
a Белорусский государственный университет
220030 Минск, просп. Независимости, 4, Беларусь
b Научно-исследовательский институт физико-химических проблем Белорусского государственного университета
220006 Минск, ул. Ленинградская, 14, Беларусь
c Контрольно-аналитическая лаборатория Республиканского унитарного предприятия “Минская Фармация”
223034 Заславль, ул. Советская, 128, Беларусь
* E-mail: shadyro@tut.by
Поступила в редакцию 09.09.2020
После доработки 23.10.2020
Принята к публикации 26.10.2020
Аннотация
В работе исследовано влияние имидазола, гистамина, гистидина и их нитропроизводных на радиационно-индуцированные превращения глицеро-1-фосфата и этанола в деаэрированных водных растворах при pH 7. Установлено, что в эквимолярных с глицеро-1-фосфатом концентрациях исследуемые вещества ингибируют радиационно-индуцированное дефосфорилирование за счет акцептирования радикальных продуктов радиолиза воды. При соотношении добавка : субстрат 1 : 100 нитропроизводные гистидина, а также метронидазол эффективно ингибируют радиационно-индуцированное дефосфорилирование глицеро-1-фосфата за счет взаимодействия с его углеродцентрированными радикалами с константами (3.1–5.1) × 109 л моль–1 с–1. С использованием радиолиза 1 М водного раствора этанола было продемонстрировано, что 5-нитроимидазолы количественно окисляют α-гидроксиэтильные радикалы, что проявляется в отсутствии бутандиола-2,3 среди продуктов радиолиза и ~20-ти кратном увеличении выхода ацетальдегида по сравнению с контролем. Таким образом, метронидазол и нитропроизводные гистидина способны подавлять радиационно-индуцированное дефосфорилирование глицеро-1-фосфата и, вероятно, глицерофосфолипидов за счет окисления их α-гидроксилсодержащих углеродцентрированных радикалов.
ВВЕДЕНИЕ
Лучевая терапия является одним из основных методов лечения онкологических заболеваний. Однако некоторые виды новообразований, обладающие пониженным парциальным давлением кислорода, то есть развивающиеся в условиях аноксии или гипоксии из-за особенностей своего метаболизма, морфологии или бурного роста, имеют низкую радиобиологическую чувствительность в отношении ионизирующих излучений [1]. Более того, такие опухоли, как правило, устойчивы и к химиотерапевтическим препаратам, что сильно ограничивает возможности лечения пациентов с гипоксическими новообразованиями. Применяющиеся в клинической практике радиосенсибилизаторы обладают высокой токсичностью, в частности, поражают периферическую нервную систему, почки и мочеполовую систему, вызывают аллергические реакции [2, 3]. Кроме того, механизм их радиационно-индуцированных превращений in vivo не изучен надлежащим образом.
Мы полагаем, что новые малотоксичные радиосенсибилизаторы могут быть найдены среди модифицированных физиологически активных природных соединений. Например, имидазольный цикл, присутствующий в составе используемых в клинической практике нитроазолов, присутствует также в L-гистидине. Эта протеиногенная α-аминокислота входит в состав большого количества ферментов человека, играет важную роль в метаболизме белков, в синтезе гистамина, фолиевой кислоты, нуклеиновых кислот, гемоглобина [4–6]. Потому радиосенсибилизаторы на основе нитропроизводных L-гистидина могут потенциально обладать приемлемым уровнем токсичности.
Ранее было установлено, что под действием ионизирующего излучения на различные фосфолипиды происходит элиминирование фосфатидных кислот [7, 8], которые стимулируют пролиферацию клеток [9]. Причем дефосфорилирование наиболее интенсивно происходит именно в отсутствие кислорода [8]. Мы полагаем, что радиационно-индуцированная фрагментация фосфолипидов в биомембранах гипоксических опухолей может ускорять пост-радиационную пролиферацию раковых клеток. Это может быть одной из причин низкой эффективности лучевой терапии в отношении гипоксических злокачественных новообразований.
Наиболее удобной моделью для исследования способности веществ ингибировать радиационно-индуцированные процессы фрагментации гидроксилсодержащих фосфорорганических соединений, в частности, глицерофосфолипидов, является радиолиз разбавленных водных растворов глицеро-1-фосфата [10]. Для установления механизма взаимодействия веществ с α-гидроксилсодержащими углеродцентрированными радикалами, которые играют важную роль в свободнорадикальных превращениях гидроксилсодержащих органических соединений, можно использовать радиолиз водных растворов этанола [11, 12].
В настоящей работе методом стационарного радиолиза было исследовано взаимодействие гистидина, его нитропроизводных, а также гистамина, имидазола и радиосенсибилизатора метронидазола, применяющегося при лучевой терапии онкологических заболеваний, с гидроксилсодержащими углеродцентрированными радикалами, образующимися в ходе радиационно-индуцированных превращений деаэрированных водных растворов глицеро-1-фосфата и этанола.
МЕТОДИКА ЭКСПЕРИМЕНТА
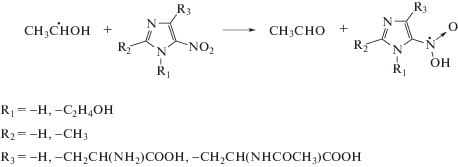
Структурные формулы тестируемых в работе производных имидазола (I-VI) приведены в табл. 1. Без предварительной очистки использовали коммерчески доступные глицеро-1-фосфат; KH2PO4, FeSO4 ⋅ 7H2O, (NH4)2MoO4, этанол, бутандиол‑2,3, имидазол (I), L-гистидин (II), гистамина гидрохлорид (III), метронидазол (VI). Высокоочищенный ацетальдегид получали по методике [13].
Таблица 1.
Структурные формулы используемых в работе соединений
| № | Название | Структура |
|---|---|---|
| Ι | Имидазол | 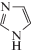 |
| ΙΙ | Гистидин | 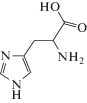 |
| ΙΙΙ | Гистамин | 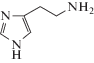 |
| IV | [2-Амино-3-[5-нитро-1H-имидазол-4-ил]пропановая кислота | 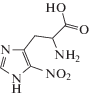 |
| V | [2-Ацетамидо-3-[5-нитро-1H-имидазол-4-ил]пропановая кислота | 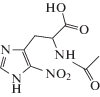 |
| VI | Метронидазол | 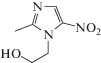 |
2-Ацетамидо-3-(1Н-имидазол-4-ил)пропионовую кислоту (VII) синтезировали следующим образом. К раствору L-гистидина (II) в ледяной CH3COOH при комнатной температуре добавляли раствор уксусного ангидрида в ледяной CH3COOH. Реакционную смесь нагревали до 100°С и выдерживали при этой температуре 2–3 мин, после чего к смеси добавляли 150 мл воды и полученный раствор упаривали в вакууме. К остатку добавляли еще 50 мл воды и вновь упаривали в вакууме. К твердому остатку добавляли 30 мл воды, выдерживали при температуре 0–5°С в течение 48 ч, после чего продукт отфильтровывали и сушили при комнатной температуре до постоянной массы. Выход соединения (VII) составляет 82%.
К раствору 2-ацетамидо-3-(1Н-имидазол-4-ил)пропионовой кислоты (VII) в 20 мл конц. H2SO4 медленно (~40 мин) прикапывали HNO3 (~90%), поддерживая температуру в диапазоне 40–45°С. Реакционную смесь перемешивали 2 ч при этой температуре, после чего охлаждали до комнатной температуры и выливали в 110 мл льда, полученный раствор нейтрализовали Na2CO3 до рН ~ 0.4. Образовавшийся осадок немедленно отфильтровали и промыли на фильтре охлажденной водой. После перекристаллизации из воды выход 2-ацетамидо-3-(5-нитро-1Н-имидазол-4-ил)пропионовой кислоты (V) составил 47%.
Для получения 2-амино-3-(5-нитро-1Н-имидазол-4-ил)пропионовой кислоты (IV) к соединению (V) добавляли 40 мл 2 М HCl, потом реакционную смесь кипятили с обратным холодильником 2 ч. По окончании процесса реакционную смесь охлаждали до комнатной температуры, нейтрализовали раствором NaOH до рН ~ 5. Образовавшийся осадок отфильтровывали и сушили в вакууме при 60°С. Выход 2-амино-3-(5-нитро-1Н-имидазол-4-ил)пропионовой кислоты (IV) составил 49%.
Перед использованием подлинность и чистоту синтезированных веществ подтверждали с использованием хромато-масс-спектрометрии, элементного анализа и ЯМР.
Для радиационно-химического эксперимента использовали деионизированную воду I типа с удельным сопротивлением не менее 15 МОм. Образцы готовили непосредственно перед облучением, для чего точные навески исследуемых соединений (I–VI) растворяли в водных растворах глицеро-1-фосфата с концентрацией 10–3 моль/л или 10–1 моль/л, а также водных растворах этанола с концентрацией 1 моль/л. Концентрации производных имидазола (I–VI) во всех растворах составляли 10–3 моль/л.
Корректировку значений рН водных растворов до 7 ± 0.05 выполняли путем добавления небольших количеств хлорной кислоты или гидроксида калия. Измерение рН проводили на рН-метре Hanna HI 9321. Приготовленные растворы разливали в стеклянные ампулы, деаэрировали аргоном высокой степени очистки по методике [14], после чего запаивали.
Для инициирования радиационно-индуцированных процессов в растворах гидроксилсодержащих органических соединений использовали γ-излучение изотопа 60Co. Облучение образцов проводили на установке MPX-γ-25М. Мощность дозы составляла 0.110 ± 0.003 Гр/с. Интервал поглощенных доз – 0.20–1.2 кГр.
Концентрацию неорганического фосфата на фоне глицеро-1-фосфата определяли с использованием реагентно-спектрофотометрической методики, описанной в работе [10]. Концентрацию производных имидазола (I–VI) в растворе измеряли на спектрофотометре Specord S600 (Analytik Jena, Германия). Анализ продуктов радиационно-индуцированных превращений этанола выполняли на газожидкостном хроматографе Shimadzu GC-17A (Япония) с капиллярной колонкой RTX-WAX аналогично [15].
Идентификацию структуры продуктов радиационно-индуцированных превращений имидазола выполняли на газожидкостном хроматографе с масс-спектрометрическим детектором Shimadzu GCMS-QP2010+ с колонкой “StabilWAX DA” (длина 30 м, внутренний диаметр – 0.25 мм, толщина неподвижной фазы – 0.25 мкм). Условия анализа: газ-носитель – гелий, линейная скорость потока в колонке – 0.365 м/с, программа термостата – нагрев с 40 до 250°С со скоростью 5°С/мин, температура инжектора – 250°С; температура ионного источника и интерфейса – 250°С. В случае гистамина, гистидина и нитропроизводных имидазола использовали жидкостной хроматограф с масс-спектрометрическим квадрупольным детектором Shimadzu LCMS‑2020 [16]. Обработка экспериментальных данных и расчет радиационно-химических выходов (G, молекула/100 эВ) подробно описаны в работе [17].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основным процессом, который происходит при радиолизе деаэрированных водных растворов глицеро-1-фосфата, а также более сложных фосфатов углеводов и гидроксилсодержащих фосфолипидов является свободнорадикальное дефосфорилирование [10]. Ключевой стадией этого процесса является распад α-гидроксилсодержащих углеродцентрированных радикалов (α-ГУР) с константой ~3.5 × × 106 с–1 [18] по реакции (3) с одновременным разрывом 2 σ-связей в β-положении по отношению к радикальному центру.
Радиационно-индуцированное дефосфорилирование происходит с высокими радиационно-химическими выходами при γ-радиолизе даже разбавленных (с концентрацией 10–3 моль/л) деаэрированных водных растворов глицеро-1-фосфата. Представленные в табл. 2 данные свидетельствуют о том, что в этих условиях 75–80% от суммарного радиационно-химического выхода окисляющих радикальных продуктов радиолиза воды G•ОН + G•Н конвертируется в неорганический фосфат.
Таблица 2.
Влияние гистамина, гистидина, имидазола и его нитропроизводных на радиационно-химические выходы неорганического фосфата, образующегося при радиолизе деаэрированных водных растворов глицеро-1-фосфата
| Тестируемое соединение | Радиационно-химический выход (G), молекула/100 эВ |
|
|---|---|---|
| Неорганический фосфат | Разложение добавки |
|
| Концентрация глицеро-1-фосфата 1 × 10-3 моль/л | ||
| Без добавок | 2.56 ± 0.08 | ‒ |
| Имидазол (I) | 1.03 ± 0.07 | ‒ |
| Гистидин (II) | 1.36 ± 0.04 | –1.00 ± 0.08 |
| Гистамин (III) | 0.65 ± 0.09 | –0.37 ± 0.04 |
| 2-Амино-3-[5-нитро-1H-имидазол-4-ил]пропановая кислота (IV) | 0.88 ± 0.02 | –1.45 ± 0.02 |
| 2-Ацетамидо-3-[5-нитро-1H-имидазол-4-ил]пропановая кислота (V) | 0.84 ± 0.04 | –1.09 ± 0.05 |
| Метронидазол (VI) | 0.43 ± 0.05 | –2.29 ± 0.04 |
| Концентрация глицеро-1-фосфата 1 × 10–1 моль/л | ||
| Без добавок | 3.15 ± 0.20 | ‒ |
| Имидазол (I) | 2.53 ± 0.12 | ‒ |
| Гистидин (II) | 2.61 ± 0.14 | ~0 |
| Гистамин (III) | 2.44 ± 0.17 | ~0 |
| 2-Амино-3-[5-нитро-1H-имидазол-4-ил]пропановая кислота (IV) | 1.67 ± 0.07 | –0.82 ± 0.02 |
| 2-Ацетамидо-3-[5-нитро-1H-имидазол-4-ил]пропановая кислота (V) | 1.61 ± 0.13 | –0.52 ± 0.05 |
| Метронидазол (VI) | 1.28 ± 0.03 | –1.59 ± 0.04 |
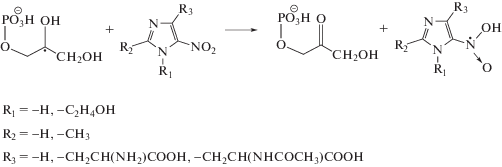
Снижение радиационно-химических выходов неорганического фосфата при облучении растворов, содержащих эквимолярные концентрации глицеро-1-фосфата и тестируемых соединений, происходит в основном в результате конкуренции растворенных веществ за радикальные продукты радиолиза воды. Нитропроизводные гистидина (IV) и (V) значительно превосходят исходную аминокислоту (II) по способности подавлять радиационно-индуцированное дефосфорилирование глицеро-1-фосфата, но при этом заметно уступают метронидазолу (VI), используемому в клинической практике для радиосенсибилизации гипоксических опухолей. Необходимо также отметить, что при незначительных отличиях в структуре веществ ${\text{G}}\left( {{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{4}}}^{ - }} \right)$ в присутствии гистамина (III) в 2 раза меньше, чем в присутствии гистидина (II). При этом радиационно-химический выход разложения гистамина (III) в 2.7 раза меньше, чем у гистидина (II), что свидетельствует с одной стороны о высокой реакционной способности гистамина (III) по отношению к радикалам, образующимся в этой системе, а с другой – о возможности регенерации его радикалов до исходного соединения (III) в свободнорадикальных реакциях. Ранее мы показали, что наличие аминоалкильного фрагмента обуславливает высокую антирадикальную активность производных триптофана [15].
Имидазол (I) лишь немного уступал нитропроизводным (IV–VI) и превосходил гисти-дин (II) по способности ингибировать радиационно-индуцированное дефосфорилирование глицеро-1-фосфата в деаэрированных 0.001 М водных растворах. На этом основании можно сделать заключение, что именно азотсодержащий гетероцикл в составе тестируемых соединений обуславливает их реакционную способность по отношению к радикальным продуктам радиолиза воды.
Поскольку величины констант скорости реакции •ОН радикалов с глицеро-1-фосфатом и имидазолсодержащими соединениями примерно равны (см. табл. 3), можно было бы ожидать двукратное снижение радиационно-химического выхода неорганического фосфата в присутствии тестируемых соединений (I–VI), как это наблюдается для гистидина (II). Более сильное ингибирование дефосфорилирования в присутствии соединений (I, III–VI) может быть вызвано их взаимодействием с α-ГУР глицеро-1-фосфата. В частности, высокая активность гистамина (III) может быть связана с наличием в структуре аминоалкильного фрагмента. Большинство ароматических нитросоединений проявляют сильные окислительные свойства в отношении углеродцентрированных радикалов [14, 19]. Поэтому нитропроизводные имидазола (IV–VI) скорее всего также будут окислять α-ГУР глицеро-1-фосфата:
Таблица 3.
Константы взаимодействия веществ с основными радикальными продуктами радиолиза воды по данным [21]
| Соединение | Константы взаимодействия, л моль–1 с–1 | |
|---|---|---|
| ${\text{e}}_{{{\text{aq}}}}^{ - }$ | •OH | |
| Имидазол (I) | 2.0 × 107 | 3.9 × 109 |
| Гистидин(II) | 9.0 × 108 (pH 6.5) | 4.8 × 109(pH 7.5) |
| Гистамин(III) | 3.7 × 108 (pH 5.3) | 5.6 × 109 (pH 7.4) |
| Глицеро-1-фосфат | ~106 | 4.9 × 109 (pH 7.0) |
| Метронидазол (VI)* | – | 4.8 × 109 |
| 2-Метил-5-нитроимидазол | 3.0 × 1010 | – |
| 2-Нитроимидазол | 3.7 × 1010 | – |
Имидазол (I) имеет на порядок более высокую константу скорости реакции с гидратированным электроном по сравнению с глицеро-1-фосфатом (см. табл. 3). Образующиеся в реакции (5) анион-радикалы будут проявлять сильные восстановительные свойства в отношении углеродцентрированных радикалов, поэтому можно предположить, что снижение ${\text{G}}\left( {{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{4}}}^{ - }} \right)$ в присутствии имидазола (I) обусловлено в том числе и взаимодействием его анион-радикала с α-ГУР глицеро-1-фосфата по реакции (6).
При радиолизе деаэрированного 0.1 М водного раствора глицеро-1-фосфата ${\text{G}}\left( {{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{4}}}^{ - }} \right)$ ≈ ${{{\text{G}}}_{{\centerdot {\text{OH}}}}}$ + + ${{{\text{G}}}_{{\centerdot {\text{H}}}}}$. Поэтому можно констатировать, что, во-первых, окисляющие радикальные продукты радиолиза воды количественно реагируют с органическим фосфатом по реакции (2). Во-вторых, в условиях γ-радиолиза α-ГУР глицеро-1-фосфата не вступают в бирадикальные реакции диспропорционирования и рекомбинации, а расходуются исключительно в монорадикальном процессе – свободнорадикальной фрагментации (3). Следовательно при соотношении субстрат : добавка 100 : 1 подавление дефосфорилирования при введении в систему соединений (I–VI) будет обусловлено их взаимодействием с α-ГУР глицеро-1-фосфата.
Представленные в табл. 2 данные свидетельствуют о том, что нитропроизводные имидазола (IV–VI), эффективно подавляют свободнорадикальную фрагментацию глицеро-1-фосфата в деаэрированном 0.1 М водном растворе, снижая ${\text{G}}\left( {{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{4}}}^{ - }} \right)$ в 1.9–2.5 раза. При этом соединения (IV, V) немного уступают по активности метронидазолу (VI), но их радиационно-химические выходы разложения ниже соответственно в 2 и 3 раза по сравнению с радиосенсибилизатором (VI), используемым в клинической практике. Наиболее вероятной причиной высокой активности нитроимидазолов (IV–VI) является их способность окислять α-ГУР глицеро-1-фосфата по реакции (4), предотвращая фрагментацию последних.
С использованием инструментария метода конкурирующих реакций для радиационно-индуцированных процессов [13, 20] можно рассчитать константу скорости реакции окисления α‑ГУР глицеро-1-фосфата нитропроизводными имидазола (IV–VI). Концентрация добавок (IV–VI) в растворе составляет 10–3 моль/л, а константа монорадикальной фрагментации гидроксилсодержащих органических фосфатов составляет ~3.5 × 106 с–1 [18]. Соответственно, искомая константа взаимодействия с α-ГУР для метронидазола (VI) составит 5.1 × 109 л моль–1 с–1, для соединения (IV) – 3.1 × 109 л моль–1 с–1, для соединения (V) – 3.4 × 109 л моль–1 с–1.
Имидазол (I), гистидин (II), гистамин (III) ингибируют радиационно-индуцированное дефосфорилирование глицеро-1-фосфата лишь на ~20%, значительно слабее, чем их нитропроизводные (IV–VI). Поскольку соединения (II) и (III) практически не разлагаются в ходе радиолиза, наблюдаемое в их присутствии снижение ${\text{G}}\left( {{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{4}}}^{ - }} \right)$ может быть обусловлено вовлечением гистидина (II) и гистамина (III) в реакции аналогичные (5) и (6).
Для того, чтобы установить механизм взаимодействия тестируемых соединений (I–VI) с α-ГУР мы изучили их радиационно-индуцированные превращения в деаэрированном 1 М водном растворе этанола, в котором образуются простейшие представители α-ГУР – α-гидроксиэтильные радикалы (α-ГЭР) в результате отщепления атома водорода от этанола под действием •ОН и •Н по реакции (7). В отсутствие добавок α-ГЭР с примерно равной вероятностью расходуются в реакциях диспропорционирования (8) и рекомбинации (9) с образованием, соответственно, ацетальдегида и бутандиола-2,3. В деаэрированных водных растворах под действием гидратированных электронов происходит частичное восстановление ацетальдегида до α-ГЭР по реакции (10), в результате чего в отсутствие добавок радиационно-химический выход бутандиола-2,3 превышает соответствующую величину для ацетальдегида в 10 раз (табл. 4).
Таблица 4.
Влияние гистамина, гистидина, имидазола и его нитропроизводных на радиационно-индуцированные превращения деаэрированного 1 М водного раствора этанола
| Тестируемое соединение | Радиационно-химический выход (G), молекула/100 эВ |
||
|---|---|---|---|
| Ацетальдегид | Бутандиол-2,3 | Разложение добавки | |
| Без добавок | 0.19 ± 0.04 | 2.02 ± 0.05 | – |
| Имидазол (I) | 1.30 ± 0.02 | 0.20 ± 0.01 | –1.98 ± 0.04 |
| Гистидин (II) | 2.08 ± 0.20 | 0.21 ± 0.01 | –1.54 ± 0.09 |
| Гистамин (III) | 2.68 ± 0.09 | 0.21 ± 0.04 | –1.55 ± 0.14 |
| 2-Амино-3-[5-нитро-1H-имидазол-4-ил]пропановая кислота (IV) | 3.82 ± 0.12 | н/о | –0.84 ± 0.06 |
| 2-Ацетамидо-3-[5-нитро-1H-имидазол-4-ил]пропановая кислота (V) | 3.77 ± 0.11 | н/о | –0.83 ± 0.07 |
| Метронидазол (VI) | 3.75 ± 0.16 | 0.08 ± 0.07 | –2.68 ± 0.10 |
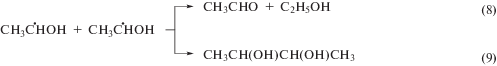
При введении в систему тестируемых соединений (I–VI) наблюдается кардинальное изменение соотношения радиационно-химических выходов основных молекулярных продуктов радиолиза деаэрированного 1 М водного раствора этанола в пользу ацетальдегида, что свидетельствует о наличии выраженных окислительных свойств у имидазола (I) и его производных (II–VI). В присутствии нитропроизводных гистидина (IV, V) бутандиол-2,3 не детектируется в облученных пробах, а в случае метронидазола (VI) – радиационно-химические выходы этого продукта рекомбинации α-ГЭР близки к нулю. При этом G (CH3CHO) в присутствии нитроимидазолов (IV–VI) даже превышает ${{{\text{G}}}_{{\centerdot {\text{OH}}}}}$ + ${{{\text{G}}}_{{\centerdot {\text{H}}}}}$. Таким образом, нитропроизводные гистидина (IV, V) и метронидазол (VI) количественно окисляют α-ГЭР по реакции (11), подавляя реакции их рекомбинации (9).
Можно заметить, что при сходном влиянии на образование основных молекулярных продуктов радиолиза деаэрированного 1 М водного раствора этанола радиационно-химические выходы разложения метронидазола (VI) в 3.2 раза превышают таковые для нитропроизводныx гистидина (IV, V). Аналогичные различия в интенсивностях радиолитического разложения этих добавок мы также наблюдали и при радиолизе деаэрированных водных растворов глицеро-1-фосфата.
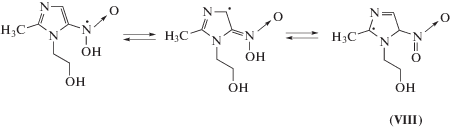
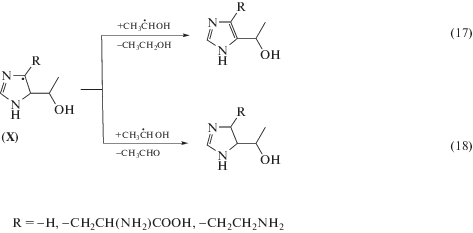
По нашему мнению, более высокие радиационно-химические выходы разложения метронидазола (VI) обусловлены наличием метильной группы при С2 и 2‑гидроксиэтильного фрагмента при N1-атоме в структуре соединения. Образующийся в реакции (11) радикал метронидазола (VI) может перегруппировываться в углеродцентрированный радикал (VIII) по схеме (12) , который в силу наличия заместителя при N1 не способен вступать в реакции диспропорционирования. Радикал (VIII) может превращаться в молекулярный продукт только в результате восстановления или рекомбинации с углеродцентрированными радикалами, в частности, с α-ГЭР по реакции (13). Продукты присоединения α-ГЭР к метронидазолу (VI) в водно-этанольных растворах были идентифицированы нами методом жидкостной хромато-масс-спектрометрии.
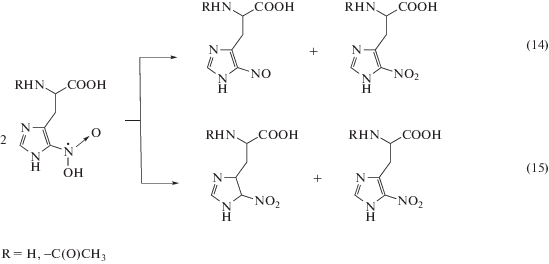
В отличие от метронидазола (VI), нитропроизводные гистидина (IV, V) имеют только один заместитель в положении С4 имидазольного кольца. Поэтому продукты их одноэлектронного восстановления, образующиеся в реакции (11), будут в основном гибнуть в реакциях диспропорционирования, с образованием нитрозосоединений (14) или продуктов восстановления кратной углерод-углеродной связи в имидазольном цикле, например, по реакции (15):
При облучении имидазола (I), гистидина (II), гистамина (III) в деаэрированном 1 М водном растворе этанола радиационно-химический выход бутандиола-2,3 снижается примерно в 10 раз по сравнению с контролем, что указывает на высокую реакционную способность соединений (I–III) по отношению к α-ГЭР. Не обладая функциональными фрагментами с выраженными окислительными свойствами имидазол (I), гистидин (II) и гистамин (III) увеличивают радиационно-химические выходы ацетальдегида до величин, которые не могут быть объяснены только лишь акцептированием гидратированных электронов добавками (I–III) по реакции (5).
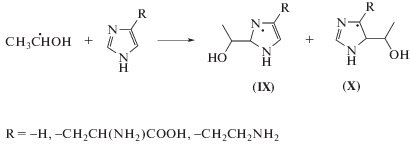
В результате присоединения α-ГЭР по кратным связям имидазола (I) и его производных (II, III) по реакции (16) могут образовываться радикал-аддукты двух типов. Наличие объемного заместителя в положении С4 имидазольного кольца затрудняет присоединение радикалов по –С4=С5–, в результате чего основным продуктом реакции (16) в случае гистидина (II) и гистамина (III) будет азотцентрированный радикал (IX), проявляющий окислительные свойства. В случае имидазола (I) присоединение α-ГЭР будет в основном приводить к образованию более термодинамически стабильного углеродцентрированного радикала (X).
Методом газовой хромато-масс-спектрометрии мы идентифицировали два типа продуктов радиолиза имидазола (I) с массами молекулярного иона m/z = 112 = M(имидазола) + M(α-ГЭР) – 1, а также m/z = 114 = M(имидазола) + M(α-ГЭР) + 1, причем концентрация аддуктов первого типа была значительно выше, чем второго. То есть для углеродцентрированных радикалов (X) имидазола (I) более выгодно окислиться по реакции (17) с восстановлением псевдоароматической системы имидазольного кольца, чем присоединить атом водорода (18):
Разные направления присоединения α-ГЭР по кратным связям в структуре имидазола (I) с одной стороны, а также гистидина (II) и гистамина (III) с другой, являются причиной значительных различий в величинах радиационно-химических выходов ацетальдегида, наблюдаемых при радиолизе этих соединений (I, II, III) в деаэрированном 1 М водном растворе этанола.
Выявленные в работе закономерности радиационно-индуцированных превращений имидазолсодержащих соединений (I–VI) могут иметь важное значение для понимания молекулярных механизмов, ответственных за формирование радиосенсибилизирующих свойств метронидазола (VI). Нитропроизводные гистидина (IV, V) проявили себя эффективными окислителями α-ГУР, способными подавлять свободнорадикальную фрагментацию гидроксилсодержащих органических фосфатов. Поэтому целесообразно продолжить тестирование этих соединений (IV, V) на клеточных культурах и экспериментальных животных в качестве перспективных радиосенсибилизирующих агентов для радиотерапии опухолей.
ВЫВОДЫ
Методом стационарного радиолиза исследовано взаимодействие имидазола, гистамина, гистидина и их нитропроизводных с α-гидроксилсодержащими углеродцентрированными радикалами, образующимися в ходе радиационно-индуцированных превращений глицеро-1-фосфата и этанола в деаэрированных водных растворах при pH 7. Установлено, что в эквимолярных с глицеро-1-фосфатом концентрациях исследуемые вещества ингибируют радиационно-индуцированное дефосфорилирование за счет акцептирования радикальных продуктов радиолиза воды. При радиолизе деаэрированных 0.1 М водных растворов глицеро-1-фосфата, когда соотношениe добавка : : субстрат составляет 1 : 100, нитропроизводные гистидина, а также метронидазол эффективно ингибируют радиационно-индуцированное дефосфорилирование за счет взаимодействия с α-гидроксилсодержащими углеродцентрированными радикалами глицеро-1-фосфата. В тоже время, имидазол, гистамин и гистидин в этих условиях снижают радиационно-химический выход неорганического фосфата лишь на 20%. Рассчитанные с использованием инструментария метода конкурирующих реакций величины констант скорости реакции 5-нитроимидазолов с радикалами глицеро-1-фосфата составляют 5.1 × 109 л моль–1 с–1 для метронидазола и (3.1–3.4) × 109 л моль–1 с–1 для нитропроизводных гистидина. С использованием радиолиза 1 М водного раствора этанола было продемонстрировано, что 5-нитроимидазолы количественно окисляют α-гидроксиэтильные радикалы, что проявляется в отсутствии бутандиола-2,3 среди продуктов радиолиза и ~20-ти кратном увеличении выхода ацетальдегида по сравнению с контролем. Методом хромато-масс-спектрометрии были идентифицированы соединения, образующиеся в ходе радиолиза в результате присоединения α-гидроксиэтильных радикалов по кратным связям имидазола и его производных, для 5‑нитроимидазолов были также зарегистрированы продукты восстановления нитрогруппы. Таким образом, метронидазол и нитропроизводные гистидина способны подавлять радиационно-индуцированное дефосфорилирование глицеро-1-фосфата и, вероятно, глицерофосфолипидов за счет окисления их α-гидроксилсодержащих углеродцентрированных радикалов.
Список литературы
Overgaard J. // J. Clinical Oncology. 2007. V. 25. № 26. P. 4066–4074.
Urtasun R.C., Chapman J.D., Feldstein M.L., Band R.P., Rabin H.R., Wilson A.F., Marynowski B., Starreveld E., Shnitka T. // The British J. Cancer. Supplement. 1978. V. 3. P. 271.
Kapoor K., Chandra, M., Nag D., Paliwal J.K., Gupta R.C., Saxena R.C. // International J. Clinical Pharmacology Research. 1999. V. 19. № 3. P. 83–88.
Cooperman J.M., Lopez R. // Experimental Biology and Medicine. 2002. V. 227. № 11. P. 998–1000.
Wade A.M., Tucker H.N. // The J. Nutritional Biochemistry. 1998. V. 9. № 6. P. 308–315.
Millward D.J. // The J. Nutrition. 1997. V. 127. № 9. P. 1842–1846.
Yurkova I.L., Kisel M.A., Arnhold J., Shadyro O.I. // High Energy Chemistry. 2006. V. 40. № 5. P. 300–303.
Yurkova I.L. // Russian Chemical Reviews. 2012. V. 81. № 2. P. 175.
Wang X., Devaiah S.P., Zhang W., Welti R. // Progress in lipid research. 2006. V. 45. № 3. P. 250–278.
Бринкевич С.Д., Шадыро О.И. // Химия высоких энергий. 2009. Т. 43. № 6. С. 491–495.
Jore D., Champion B., Kaouadji N., Jay-Gerin J.P., Ferradini C. // International J. Radiation Applications and Instrumentation. Part C. Radiation Physics and Chemistry. 1988. V. 32. № 3. P. 443–448.
Бринкевич С.Д., Свердлов Р.Л., Лагутин П.Ю., Шадыро О.И. // Химия высоких энергий. 2011. Т. 45. № 5. С. 414–419.
Бринкевич С.Д., Тугай О.В., Сладкова А.А., Шадыро О.И. // Химия высоких энергий 2020. Т. 54. № 6. С. 474−481.
Бринкевич С.Д., Малиборский А.Я., Капусто И.А., Свердлов Р.Л., Григорьев Ю.В., Ивашкевич О.А., Шадыро О.И. // Химия высоких энергий. 2019. Т. 53. № 2. С. 140–147.
Sverdlov R.L., Brinkevich S.D., Shadyro O.I. // Free radical research. 2014. V. 48. № 10. P. 1200–1205.
Sverdlov R.L., Brinkevich S.D., Shadyro O.I. // Radiation Physics and Chemistry. 2014. V. 98. P. 77–85.
Бринкевич С.Д., Кузьмук Д.А., Свердлов Р.Л., Шадыро О.И. // Химия высоких энергий. 2019. Т. 53. № 6. С. 478–483.
Müller S.N., Batra R., Senn M., Giese B., Kisel M.A., Shadyro O.I. // J. American Chemical Society. 1997. V. 119. № 12. P. 2795–2803.
Jagannadham V., Steenken S. // J. American Chemical Society. 1988. V. 110. № 7. P. 2188–2192.
Бринкевич С.Д., Малиборский А.Я., Капусто И.А., Свердлов Р.Л., Григорьев Ю.В., Шадыро О.И. / Химия высоких энергий 2021. Т. 55. № 1. С. 60.
Ross A.B., Mallard W.G., Helman W.P., Buxton G.V., Huie R.E., Neta. P. NDRL-NIST solution kinetics database. Notre Dame Radiation Laboratory and National Institute of Standards and Technology. Notre Dame, Indiana and Gaithersburg, Maryland. 1998.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий