Химия высоких энергий, 2021, T. 55, № 2, стр. 117-127
Модифицирование полиэтилентерефталата в низкотемпературной плазме для использования в медицине и биологии
А. Б. Гильман a, *, **, М. С. Пискарев a, А. А. Кузнецов a
a Институт синтетических полимерных материалов им. Н.С. Ениколопова РАН
117393 Москва, ул. Профсоюзная, 70, Россия
* E-mail: plasma@ispm.ru
** E-mail: gilmanab@gmail.com
Поступила в редакцию 08.10.2020
После доработки 22.10.2020
Принята к публикации 26.10.2020
Аннотация
Представлен анализ литературных данных по модифицированию полиэтилентерефталата под воздействием низкотемпературной плазмы. Рассмотрено использование современных инструментальных методов для изучения свойств обработанных образцов полимера (измерение контактных углов смачивания и расчеты поверхностной энергии и ее компонентов, рентгенофотоэлектронная спектроскопия и Фурье-ИК-спектроскопия, атомно-силовая и сканирующая электронная микроскопия). Показано изменение контактных свойств, химической структуры и морфологии модифицированной поверхности полиэтилентерефталата. Приведены данные изучения гемосовместимости, антибактериальной устойчивости, адгезии и пролиферации клеток после воздействия плазмы на полиэтилентерефталат.
ВВЕДЕНИЕ
Для использования в медицине и биологии полимерные материалы должны быть биосовместимыми, т.е. не вызывать побочных клинических проявлений и индуцировать клеточный или тканевый ответ, необходимый для достижения терапевтического эффекта [1–9].
В настоящее время полимеры, пригодные для использования в медицине и биологии, могут быть получены как путем синтеза новых материалов, так и путем модифицирования уже существующих с использованием различных химических и физических методов. Одним из наиболее эффективных и технологичных методов модифицирования является воздействие низкотемпературной плазмы [1, 10–13]. Преимущество данного подхода состоит в его эффективности и экологичности, он позволяет исключить жидкостные методы обработки, связанные с использованием химических реагентов. Толщина модифицированного слоя при этом составляет, как правило, до нескольких десятков нанометров [14]. Установки для модифицирования полимерных пленок, ткани, волокон и порошков в плазме находят широкое применение в мировой практике для обработки образцов больших размеров [1, 15–17].
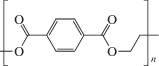
Полиэтилентерефталат (ПЭТФ) – полиэфир терефталевой кислоты и этиленгликоля, структурная формула которого приведена ниже.
Полимер характеризуется химической и гидролитической стойкостью к воздействию водяного пара, пластичностью, обладает высокой механической прочностью, стоек к истиранию, термодеструкция ПЭТФ происходит в температурном диапазоне 290–310°С. Нами было показано, что воздействие разряда постоянного тока приводит к существенной гидрофилизации поверхности полимера, а толщина модифицированного слоя составляет ≤20 нм [18].
В России ПЭТФ используют, в основном, для изготовления емкостей различного вида и назначения (в первую очередь, пластиковых бутылок) и в меньшей степени для переработки в волокна, пленки и другие изделия. В мировой практике большая часть ПЭТФ идет на производство нитей, волокон и пленок, в последнее время полимер все чаще используется в медицине и биологии. В этой связи поверхность ПЭТФ для ряда медицинских применений необходимо модифицировать таким образом, чтобы обеспечить адгезию клеток, отсутствие неблагоприятных реакций и адсорбции белков крови. Кроме того, в зависимости от назначения имплантата желательны такие характеристики как устойчивость к окислению, прочность и гибкость.
МЕТОДИКИ И УСТАНОВКИ ДЛЯ МОДИФИЦИРОВАНИЯ ПОВЕРХНОСТИ ПЭТФ В НИЗКОТЕМПЕРАТУРНОЙ ПЛАЗМЕ
Для модифицирования поверхности ПЭТФ в низкотемпературной плазме применяют различные типы газовых разрядов: разряды пониженного давления – высокочастотный (ВЧ) разряд, микроволновый (СВЧ) разряд, разряд постоянного тока (ПТР) и диэлектрический барьерный разряд (БР), последний, в основном, при атмосферном давлении.
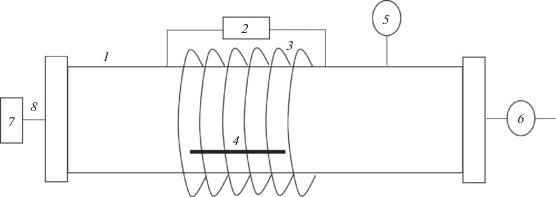
При проведении экспериментов используют лабораторные и промышленные установки ВЧ‑разряда с частотой 13.56 и 27.12 МГц [19–48 ]. На рис. 1 приведена принципиальная схема установки для модифицирования в ВЧ-плазме пониженного давления индукционного разряда. В реакционной камере 1 с помощью ВЧ-источника питания 2 и индукционной катушки 3 создается ВЧ-разряд, в зону горения плазмы помещают модифицируемый образец 4. Вакуумирование установки обеспечивается с помощью системы вакуумирования 6, контроль давления в рабочей камере осуществляется вакуумметром 5. Подачу рабочего газа проводят через систему напуска 8 из емкости 7.
Рис. 1.
Принципиальная схема установки для модифицирования в ВЧ-плазме пониженного давления индукционного разряда: 1 – реакционная камера, 2 – ВЧ-источник питания, 3 – индукционная ВЧ-катушка, 4 – образец, 5 – вакуумметр, 6 – система вакуумирования, 7 – емкость с рабочим газом, 8 – подача рабочего газа.
Использование обработки в плазме пониженного давления с индукционным ВЧ-разрядом (27.12 МГц, мощность 150 Вт) для модифицирования пленки ПЭТФ толщиной 125 мкм в атмосфере рабочих газов O2 и N2 привело к образованию на поверхности новых кислород- и азотсодержащих групп и изменению ее морфологии, что обеспечило существенное увеличение гидрофильности, необходимое для успешного прикрепления и роста эндотелиальных клеток пупочной вены человека [20].
С помощью лабораторной установки, включающей обработку поверхности ПЭТФ в ВЧ-разряде в атмосфере O2 (13.56 МГц, 50 Вт, 1.33 Па, 1–5 мин) и последующее нанесение серебра методом магнетронного распыления мишени с использованием переменного или постоянного тока, была показана возможность получения антибактериальных покрытий [35].
Среди промышленных установок ВЧ-разряда для модифицирования поверхности ПЭТФ используют Edwards E306A (Великобритания) [40], HD-1 (Китай) [43], Technics 800-11 (США) [44], Anatech SP 100 (США) [45], Denton DV-502 A (Швейцария) [46], SurFx AtomfloTM 400L [47] и Atomflo 350 L [48] (США).
Для исследований применяют лабораторные [49, 50] и промышленные установки с разрядом постоянного тока – Balzers SCD 050 и BAL-TEC SCD 050 (Германия) [51–53], а также лабораторные [54] и промышленные установки с микроволновым (СВЧ) разрядом (2.45 ГГц) Plaslan 500 (Германия) [55], ASTEX (Великобритания) [56] и Europlasma NV [57]. В [56] в вакуумную камеру было введено устройство для магнетронного катодного распыления серебра (Angstrom Sciences, США), а модифицированный образец с помощью механического манипулятора перемещали непосредственно в рабочую камеру рентгенофотоэлектронного спектрометра Kratos Axis 165 без вынесения на воздух. Это дало возможность наиболее точного определения вида и числа новых функциональных групп, образующихся на поверхности полимера и приводящих к его гидрофилизации.
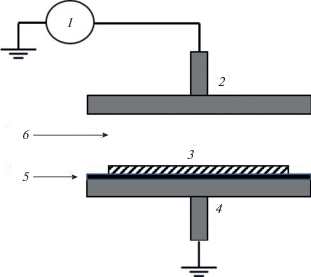
Для модифицирования ПЭТФ используют лабораторные [58–65] и промышленные [66–71] установки диэлектрического барьерного разряда (БР), функционирующие при атмосферном или достаточно высоком давлении рабочего газа. На рис. 2 представлена принципиальная схема установки БР для модифицирования образцов полимера. Питание разряда осуществляется от источника напряжения 1, зона плазмы 6 возникает между верхним 2 и нижним заземленным 4 электродом 5, на котором помещают обрабатываемый образец 3. В качестве газовой фазы часто используют атмосферный воздух, как правило, помещение в этом случае должно быть высокого класса чистоты, так как промышленные установки не всегда имеют реакционной камеры. Такое устройство характерно для установок, позволяющих обрабатывать рулонные материалы большого размера (пленки, ткани, волокна). Модифицирование пленки ПЭТФ толщиной 50 мкм с использованием лабораторной установки БР (верхний электрод подключен к источнику переменного тока частотой 10 кГц, нижний электрод заземлен через сопротивление 100 Ом), рабочий газ – О2 (подается в рабочую камеру) приводило к существенной гид-рофилизации поверхности – величина краевого угла смачивания по воде (θв) уменьшалась от 75 до ~30°, в течение длительного времени нахождения на воздухе при комнатных условиях (2000 ч) поверхность оставалась гидрофильной [63]. Воздействие БР приводило к образованию новых кислородсодержащих групп, что способствовало улучшению контактных свойств полимера.
Рис. 2.
Схема установки для модифицирования в плазме БР: 1 – источник питания, 2 – верхний электрод, 3 – модифицируемый образец, 4 – заземление нижнего электрода, 5 – нижний электрод, 6 – зона плазмы.
Для исследований используют также промышленные установки БР APJet Inc. (США) [66], Coating Star (Германия) [67], APPJ Plasmatreated (Германия) [68–70], а при модифицировании размерных образцов волокон и ткани (рулонных материалов) из ПЭТФ в [71] была с успехом применена промышленная установка БР Coating System (Германия) с рабочей частотой 26 кГц. Было показано, что величина θв уменьшалась от 80° до 42°, что приводило к улучшению антибактериальной активности поверхности обработанной ткани из ПЭТФ.
Известны исследования поверхности ПЭТФ, модифицированной с помощью облучения лазером или вакуумным УФ-излучением [72–75]. Результаты сравнительного исследования воздействия на поверхность пленки ПЭТФ толщиной 50 мкм (Goodfellow, Великобритания) облучения в атмосфере воздуха с помощью ArF-эксимерного лазера (λ = 193 нм, Lambda Physik Compex, Германия) и в высоком вакууме с помощью Nd : YAG лазера (облучение пульсирующим вакуумным ультрафиолетовым излучением), показали, что изменения морфологии поверхности, возникающие в результате воздействия ВУФ-излучения, приводили к существенному улучшению адгезии и пролиферации эмбриональных клеток китайского хомячка, тогда как воздействие эксимерного лазера вызывало заметно меньшие изменения морфологии и давало меньший биологический эффект [72, 73]. Использование CO2-импульсного лазера (λ = 9.25 мкм, Lumonics 103-2, Германия) и эксимерного лазера KrF (λ = 248 нм, Model 1812, Phys-ics Instrumentation Center-RAS, Россия) для модифицирования пленки ПЭТФ толщиной 70 мкм (Dupont) [74] вызывало гидрофилизацию поверхности и изменение ее морфологии, обеспечивающие значительное увеличение адсорбции и роста клеток фибробластов мыши L929.
МЕТОДЫ ИССЛЕДОВАНИЯ СВОЙСТВ И СТРУКТУРЫ ПОВЕРХНОСТИ ПЭТФ, МОДИФИЦИРОВАННОЙ В ПЛАЗМЕ И ПОД ВОЗДЕЙСТВИЕМ ЛАЗЕРНОГО ИЗЛУЧЕНИЯ
Исследования модифицированной поверхности ПЭТФ проводят с помощью ряда современных физико-химических методов. Это изучение гидрофильности или гидрофобности поверхности (смачиваемости) путем измерения краевых углов смачивания по полярной и неполярной жидкостям с расчетом полной поверхностной энергии, ее полярного и дисперсионного компонентов; исследование изменения химического состава и химической структуры методами рентгенофотоэлектронной и Фурье-ИК-спектроскопии; изучение изменения морфологии поверхности методами атомно-силовой микроскопии, профилометрии и сканирующей электронной микроскопии. Изучают также изменение адгезионных свойств и влагопоглощения модифицированного полимера.
Одним из наиболее важных результатов процесса модифицирования поверхности ПЭТФ является существенное увеличение гидрофильности, обеспечивающее рост адгезии и пролиферации клеток на поверхности полимера. Величина краевого угла смачивания по воде (θв) для исходного полимера в зависимости от метода получения изучаемых образцов (пленок, волокон, ткани и т.п.) составляет 72°–87°, а воздействие ВЧ и СВЧ-разрядов, а также ПТР, БР и лазерного излучения приводит к ее существенному уменьшению [19–25, 27–33, 36–42, 44, 47–52, 55, 58–61, 63, 65–67, 70, 71, 74]. В качестве примера в табл. 1 приведены данные по изменению θв, полной поверхностной энергии (γ), ее полярного (γP) и дисперсионного (γd) компонентов для пленок ПЭТФ, модифицированных в ВЧ-разряде [29], ПТР [49] и БР [65]. Видно, что для модифицированных пленок во всех случаях наблюдается существенное уменьшение θв, значительное увеличение γ и многократный рост γP. Проведенные исследования показали, что увеличение гидрофильности поверхности сохраняется в течение длительного времени. Так для пленок ПЭТФ, модифицированных в ВЧ-разряде (27.12 МГц, 200 Вт, 75 Па, исходное θв = 72°) в атмосфере рабочих газов О2 и N2 в течение 3 с, полученные непосредственно после обработки значения θв = 8° (атмосфера О2) и θв = 16° (атмосфера N2) возрастали при хранении в течение 14 сут до 20° и ~50° соответственно [24]. В случае воздействия на пленки ПЭТФ (θв = 74.8°) БР при атмосферном давлении воздуха полученная величина θв = 33.4° возрастала через 200 ч хранения до 58°, а наблюдаемое увеличение в значительной степени зависело от условий хранения – влажности и температуры [63]. В обоих указанных выше случаях поверхность оставалась гидрофильной (θв < 60°).
Таблица 1.
Изменение краевого угла смачивания по воде (θв), полной поверхностной энергии (γ), ее полярного (γP) и дисперсионного (γd) компонентов пленок ПЭТФ в результате воздействия разрядов различных типов
| Обработка | θв, град | Поверхностная энергия, мДж/м2 | Литература | |||
|---|---|---|---|---|---|---|
| γ | γP | γd | ||||
| ВЧ-разряд, 13.56 МГц, 100 мкм, 30 В, Не, 100 Па, 40 с. |
Исходный | 72.4 | 48.4 | 7.0 | 41.4 | [29] |
| Обработанный | 32.3 | 72.6 | 32.0 | 40.6 | ||
| ПТР, 40 мкм, 50 мA, воздух, 20 Пa, 50 с | Исходный | 80 | 26.5 | 12.4 | 14.1 | [49] |
| Обработанный на аноде | 12 | 71.6 | 55.0 | 16.6 | ||
| Обработанный на катоде | 10 | 72.2 | 55.8 | 16.4 | ||
| БР, 150 мкм, Не, атмосферное давление, 5 кГц, 40 Вт, 10 с | Исходный | 76 | 43.27 | 3.91 | 39.36 | [65] |
| Обработанный | 34 | 60.46 | 35.14 | 25.32 | ||
Действие лазерного излучения, например, CO2 пульсирующего лазера с длиной волны 9.25 мкм на пленки ПЭТФ (θв = 70.6° ± 0.6°) приводило к менее выраженной гидрофилизации поверхности (максимум до θв = 62.7° ± 1.9°), наличие которой, с одновременным изменением морфологии, вызывало улучшение адсорбции и роста клеток фибробластов мыши L929 [74].
Следует отметить, что, например, проблема тромбоза при использовании полимерных трансплантатов может быть решена как за счет увеличения гидрофильности, так и за счет увеличения гидрофобности поверхности. Например, в работе [22] поверхность ПЭТФ модифицировали в ВЧ‑разряде в атмосфере CF4, а в [30] – в атмосфере С2F4. В результате величина θв в первом случае увеличивалась от 75° до 110°, а во втором случае получали супергидрофобную поверхность – величина θв возрастала от 78° до 130°–160°. Эксперименты с коронарными эндотелиальными клетками в стентах (покрытие каркаса стента клетками, выстилающими внутренний просвет сосуда) показали перспективность использования таких материалов в сосудистых трансплантатах.
С помощью метода рентгенофотоэлектронной спектроскопии (РФЭС) изучают изменения химического состава и структуры поверхности ПЭТФ, модифицированной в низкотемпературной плазме и под воздействием лазерного излучения [19–27, 29–31, 33, 34, 39, 40, 42–45, 47–51, 53, 55, 56, 58–64, 66, 68, 69, 71–73, 75, 77].
Воздействие плазмы неполимеризующихся газов (воздух, He, Ar, N2, O2 и т.п.) приводит к увеличению на поверхности полимера количества кислород- и азотсодержащих групп. В качестве примера в табл. 2 приведены результаты, полученные при изучении процесса модифицирования образцов пленки ПЭТФ в ВЧ-разряде [26] и БР (ткань) [71]. Видно, что после обработки на поверхности уменьшается количество связей С–С и возрастает количество групп С–О и О=С–О, а также появляются группы С–N и O=C–NH2. С образованием этих групп и ростом их количества связано увеличение гидрофильности поверхности ПЭТФ, приводящее к лучшей адсорбции активных веществ, например, низина, и возрастанию активности в борьбе с патогенными организмами, например, S. aureus ATCC 6538 и его метициллин-устойчивыми штаммами [71].
Таблица 2.
Изменение химической структуры ПЭТФ по данным РФЭС в результате воздействия ВЧ-разряда пониженного давления и БР при атмосферном давлении
| Обработка | C–C 284.8 эВ | С–О С–N 286.4 эВ |
О=С–О 288.8 эВ | O=C–NH2 C=O 287.4 эВ |
Литература | |
|---|---|---|---|---|---|---|
| ВЧ-разряд, 27.12 МГц, пленка 125 мкм, N2, 200 Вт, 75 Па, 3 с |
Исходный | 67.7 | 17.9 | 13.3 | – | [26] |
| Обработанный в плазме | 48.5 | 23.1 | 23.2 | 5.2 | ||
| Обработанный в зоне послесвечения | 62.5 | 18.3 | 14.9 | 4.2 | ||
| БР, ткань, толщина 0.56мм, пористость 63.5%, 1 кВ, 26 кГц, воздух при атмосферном давлении, ‘‘Coating Star” |
Исходный | 73.5 (285.6 эВ) | 15.7 | 10.8 (289.2 эВ) | – | [71] |
| Обработанный | 59 | 20.7 | 18.8 | 1.5 | ||
Воздействие лазерного излучения приводит к уменьшению атомного содержания кислорода на поверхности ПЭТФ и значительным морфологическим изменениям на микро- и наноуровне [72–74]. В работе [73] было показано, что после облучения источником вакуумного ультрафиолетового излучения в атмосфере Kr с длиной волны 9–70 нм количество кислорода уменьшалось с 27.94% до 19.77%, по-видимому, за счет уменьшения количества функциональных O–C=О групп. Однако при этом наблюдалось значительное увеличение шероховатости поверхности, которое обеспечивало адсорбцию и рост клеток яичников китайского хомячка, высеянных на поверхность ПЭТФ, полученную после облучения УФ-лазером.
При изучении изменений химического состава модифицированной в плазме поверхности ПЭТФ используют также методы ИК-спектроскопии, в том числе многократного нарушенного полного внутреннего отражения (МНПВО) – для определения количества кислородсодержащих групп [37, 38, 40, 46, 62, 47, 65, 75 ] и установления осаждения полимерной пленки иной химической природы с помощью полимеризации прекурсоров в плазме [39, 41, 46, 55, 56]. В работах [37, 38] трековые мембраны из ПЭТФ модифицировали в ВЧ-разряде в среде неполимеризующихся газов (13.56 МГц, рабочие газы воздух, N2, O2 и смеси N2 + O2, 70 Вт, 10 мин). Методом ИК-спектроскопии МНПВО было показано, что на поверхности существенно возрастало количество карбоксильных групп – увеличивалась интенсивность полосы поглощения при 1720 см–1, а величина эффекта зависела от давления в газовой фазе. Например, при давлении воздуха в разряде 4 Па количество кислорода возрастало на 19%, а при 10.5 Па – на 28%. С помощью ИК-спектроскопии фиксировали осаждение на поверхности ПЭТФ путем полимеризации в плазме тонких пленок на основе пиррола [39], полиэтиленгликоля [41], аллиламимина [55], акриловой кислоты [56], а также иммобилизацию фибриногена [46].
Воздействие плазмы вызывает значительные изменения морфологии поверхности ПЭТФ, для изучения которых используют методы атомно-силовой (АСМ) [19, 20, 22–24, 27, 28, 30, 42, 45, 49–53, 59–61, 66, 68–71] и сканирующей электронной микроскопии (СЭМ) [20–22, 25, 28, 30–41, 43–46, 49–52, 55, 57–59, 62, 64, 65, 68, 69, 72–74].
В табл. 3 приведены примеры изменения морфологии поверхности пленок ПЭТФ по данным АСМ для модифицирования полимера в ВЧ-разряде [19], ПТР [49] и БР [69]. Видно, что во всех случаях наблюдается увеличение средней (Ra) и среднеквадратичной (Rms) шероховатости поверхности по сравнению с исходными значениями. Увеличение этих параметров наблюдается с ростом времени обработки в плазме, а также в значительной степени зависит от вида разряда, под воздействием которого происходит процесс, и состава газовой фазы. Наибольшие изменения характерны для модифицирования полимера в БР, кроме того в этом случае наблюдается значительная деструкция полимера.
Таблица 3.
Данные АСМ по изменению средней (Ra) и среднеквадратичной (Rms) шероховатости для пленок ПЭТФ, модифицированных в ВЧ-разряде, ПТР и БР
| Процесс | Время обработки, с | Шероховатость, нм | Литература | ||
|---|---|---|---|---|---|
| Ra | Rms | ||||
| ВЧ-разряд, 13.56 МГц, 150 Вт, SO2, 30 Па | – | 1.2 | 2.3 | [19] | |
| 10 | 15.2 | 24.5 | |||
| 80 | 17.6 | 28.0 | |||
| ПТР, 50 мА, воздух, 10 Па | исходный | – | 0.51 | 0.89 | [49] |
| катод | 50 | 1.21 | 1.72 | ||
| анод | 50 | 0.89 | 1.25 | ||
| БР, APP Plasmatreat 19 кГц, 250 В, 5 А, 0.3 МПа, воздух, Ar, N2 |
исходный | – | 0.58 | 0.73 | [69] |
| воздух | 0.25 | 1.23 | 1.53 | ||
| Ar | 1.19 | 1.57 | |||
| N2 | 2.48 | 3.15 | |||
Метод АСМ используют также для определения шероховатости и толщины осажденного на поверхности слоя в процессе полимеризации прекурсоров в плазме. Например, Ra равнялась 2 ± 0.2 нм для фторсодержащего покрытия (толщина 30 нм, θв = 105° ± 3°), осажденного на поверхности пленки ПЭТФ путем полимеризации С2F4 в ВЧ-разряде (13.56 МГц), а толщина осажденного слоя фторсодержащего полимера составляла 282 ± 120 нм (50 с осаждения) и 526 ± 214 нм (90 с осаждения) [30].
Для исследования изменений морфологии поверхности ПЭТФ в виде пленок, волокон и трековых мембран, модифицированных в плазме, широкое применение находит метод СЭМ. С помощью этого метода были показаны морфологические изменения на нано- и микроуровнях, которые наблюдают на поверхности.
Так, на поверхности пленок ПЭТФ толщиной 125 мкм, обработанных в ВЧ-разряде в атмосфере N2 (27.12 МГц, 150 Вт, 60 с), появлялись сферолиты малого размера, тогда как после аналогичного воздействия плазмы O2 наблюдали образование наноразмерных нитевидных структур [20]. Возникновение такого рода структур может быть связано с ионной бомбардировкой и преимущественным травлением аморфной фазы ПЭТФ. Исследования in vitro показали улучшение пролиферации эндотелиальных клеток пупочной вены человека на всех модифицированных в плазме образцах. Для пленок ПЭТФ толщиной 20 мкм, модифицированных в ВЧ-разряде на промышленной установке Edwards E306A (рабочий газ воздух, 12 Па, 10 МГц, 1.2 кВ), наблюдали появление доменных структур со средним размером ~15–17 нм при малых временах обработки, увеличение времени воздействия приводило к образованию подобных структур размером до ~60 нм [40].
При модифицировании волокон из ПЭТФ в ВЧ-разряде (13.56 МГц, 50 Вт, рабочие газы Ar и О2, 13 Па) было найдено уменьшение диаметра волокон за счет травления, при этом пористость практически не изменялась [21]. Однако использование БР (атмосферное давление, рабочие газы воздух, O2, N2, и Ar,15 кВ, 350 Гц, 10 с) практически не влияло на диаметр волокон [64].
Для трековых мембран из ПЭТФ, модифицированных в плазме неполимеризующихся газов, было найдено увеличение эффективного диаметра пор на 15–20% и образование наноструктурированной поверхности [37, 38]. Была показана возможность использования таких мембран в качестве высокоэффективного биосовместимого эксплантодренажа для хирургического лечения рефрактерной глаукомы. Для мембран, на поверхности которых проводили осаждение покрытий иной химической природы методом полимеризации в плазме пиррола [39] или аллиламина [55], было установлено существенное уменьшение эффективного диаметра пор. Эти изменения приводили к появлению асимметрии проводимости [39] и увеличению метаболической активности фибробластов кожи человека [55].
Облучение пленок ПЭТФ с помощью УФ-импульсного лазера (с частотой 10 Гц) и ArF-эксимерного лазера (λ = 193 нм) вызывало образование на поверхности различного типа волнообразных микроструктур (рифленых, конических, типа ворса), обеспечивающих высокую пролиферацию клеток яичника китайского хомячка [72, 73]. Воздействие на поверхность пленок ПЭТФ импульсного CO2 лазера (λ = 9.25 мкм) и KrF эксимерного лазера (λ = 248 нм) приводило к морфологическим изменениям, способствующим значительному росту фибробластных клеток мыши L929 [74].
Как правило, целью модифицирования образцов ПЭТФ в низкотемпературной плазме является улучшение контактных свойств полимера применительно к задачам улучшения его биосовместимости – адгезии и роста на поверхности клеточного материала. Однако, в ряде работ приводятся данные по улучшению адгезии полимера, в том числе к клеям различной природы и в композитных материалах, что может быть важно для его практического применения в различного рода медицинских приборах и устройствах [32, 35, 40, 46, 48, 66, 69, 76]. Адгезионные испытания проводили по стандартам ASTM D4541, ASTM 1876-01 и с помощью липкой ленты 3М (Scotch®810). В качестве адгезивов использовали эпоксидные смолы, уретановые, силиконовые и акриловые клеи. Было показано существенное увеличение адгезии – например, для пленок ПЭТФ, модифицированных в ВЧ-разряде в атмосфере Не, сила отрыва при использовании уретанового клея возрастала от 4 МПа для исходного образца до 11 МПа после обработки [48]. Высокая межфазная адгезия была найдена при испытаниях по Т-тесту для модифицированных в плазме He/O2 и He/N2 и покрытых акрилатным адгезивом пленок ПЭТФ [66]. Значительно возрастала адгезия обработанных в плазме образцов ПЭТФ в контакте с клеями и рядом других полимеров, измеренная методом Т-теста. Так для пары ПЭТФ/ПТФЭ (политетрафторэтилен) воздействие ПТР приводило к увеличению силы отслаивания от 10 ± 1 Н/м до 160 ± 19 (смола ЭД-20) и до 280 ± 24 Н/м (полиуретановый клей) [76].
Испытания композита, полученного на основе обработанных в ВЧ-разряде волокон ПЭТФ и связующего полиметилметакрилата, проведенные на приборе INSTRON 4204 на определение силы растяжения, показали увеличение на 20–30% при времени обработки 5 с и уменьшение при 20–90 с воздействия [32].
Было показано значительное увеличение адгезии слоя серебра, нанесенного на модифицированную в ВЧ-разряде в атмосфере кислорода ткань из ПЭТФ; ткань с покрытием эффективно сохраняла свои антимикробные свойства после 20 циклов стирки [35].
ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ МОДИФИЦИРОВАННОГО ПЭТФ В МЕДИЦИНЕ И БИОЛОГИИ
Модифицирование ПЭТФ под воздействием низкотемпературной плазмы дает новые возможности для использования полимера в медицине и биологии, существенно изменяя его биосовместимость.
Одним из наиболее важных результатов является улучшение гемосовместимости полимера для его применения в качестве сосудистых имплантатов [19, 30, 33, 34, 46, 58, 65, 68, 77]. Так, увеличение адгезии и пролиферации эндотелиальных клеток пупочной вены человека (HUVEC) наблюдали для образцов пленок полимера, модифицированных в ВЧ-разряде в парах SO2 (13.56 МГц, 150 Вт, 30Па, 20–180 с) и связали этот эффект с гидрофилизацией поверхности [19]. Осаждение наноструктурированного слоя фторсодержащего полимера, полученного методом полимеризации C2F4 в ВЧ-разряде (13.56 МГц, 100 Вт, 200 Па, 50 и 90 мин), показало, что модифицированная поверхность характеризуется лучшим прикреплением, увеличением жизнеспоcобности и ростом клеток HUVEC, а такой полимер может служить лучшим материалом для трансплантата сосудов, чем исходный ПЭТФ [30]. Существенное увеличение биосовместимости с клетками HUVEC было найдено также для образцов ПЭТФ, модифицированных в ВЧ-разряде (13.56 МГц, 10 Вт, 67 Па) в атмосфере смесей O2/H2, NH3/H2 и NH3, за счет увеличения количества кислородсодержащих групп или прививки новых азотсодержащих групп [34]. В случае обработки ПЭТФ в ВЧ-плазме в атмосфере азота и водорода наблюдалось уменьшение поверхностной тромбогенности сосудистых трансплантатов малого калибра за счет улучшения адгезии и пролиферации клеток HUVEC [77]. Воздействие микроплазменных струй БР при атмосферном давлении воздуха (9 кГц, 10 Вт, 16 кВ) на размерные образцы ПЭТФ приводило к образованию на поверхности полимера значительного количества кислород- и азотсодержащих групп, обеспечивающих гемосовместимость полимера [58]. Для пленок полимера, модифицированных в БР в атмосфере гелия (13.5 кГц, 40 Вт, 10 с), было установлено, что такое воздействие позволяет избежать деградации структуры белков и предотвращает свертывание крови [65]. В приведенных примерах (кроме обработки в атмосфере C2F4) существенно возрастала гидрофильность модифицированной поверхности полимера.
После воздействия плазмы ПЭТФ приобретает важное качество – антибактериальную устойчивость [35, 36, 45, 62, 64]. Так, обработка ткани из ПЭТФ в ВЧ-разряде в атмосфере O2 (13.56 МГц, 50 Вт, 1.33 Па, 1–5 мин) с последующим осаждением тонкого слоя серебра методом магнетронного распыления в атмосфере аргона приводила к существенному росту устойчивости к бактериям S. aureus и E. coli [35]. Предварительная активация в ВЧ-разряде в смеси воздуха с O2 и N2 (1 : 4) с последующим нанесением тонкого слоя углеродсодержащего покрытия в плазме C6H12 обеспечивала высокую антибактериальную устойчивость трековых мембран из ПЭТФ по отношению к грамположительным (St. aureus ATCC 29213) и грамотрицательным (Е. coli АТСС 54383) штаммам микроорганизмов [36]. Антибактериальные свойства по отношению к E. coli были показаны на образцах ПЭТФ, модифицированных в плазме 4-винилпиридина [45]. Данные по значительному увеличению антибактериальной активности ткани из ПЭТФ (Thai Negoro Co., Таиланд), модифицированной в БР при атмосферном давлении воздуха (12.5 кВ, 325 Гц, 10 с) с последующим нанесением покрытия хитозана из раствора, приведены в [62]. Было установлено, что через 24 ч инкубации КОЕ (колониеобразующая единица) на контрольных образцах и исходном ПЭТФ возрастает на 40–50%, тогда как на образцах ПЭТФ + хитозан уменьшается для E. сoli в ~1000 раз, а для S. aureus более чем в 10000 раз.
Трековую мембрану из ПЭТФ (ПЭТФ ТМ) производства ОИЯИ (Дубна, Россия) модифицировали путем воздействия ВЧ-разряда (13.56 МГц, 100 Вт, 10 Па, 10 мин) с использованием в качестве рабочих газов N2, воздуха и смесей N2 с O2 [37, 38]. Были проведены экспериментальные и клинические исследования ПЭТФ ТМ с наноструктурированной поверхностью в качестве эксплантодренажа для антиглаукоматозных операций. Полученная мембрана позволила избежать зарастания хирургически сформированного пути оттока благодаря образованию нежной капсулы вокруг дренажа, обеспечивающей как фильтрацию через ее стенки, так и свободное течение глазной жидкости. Острота зрения у пациентов контрольной группы повысилась в среднем на 0.1–0.3.
Модифицирование пленок ПЭТФ в ВЧ-разряде (27.12 МГц, 200 Вт, 25 Па, 30 с) в атмосфере O2 или СF4 показало, что происходит гидрофилизация (плазма О2) или гидрофобизация (плазма СF4) поверхности полимера, но в обоих случаях улучшается адсорбция белков и аминокислот [22]. Воздействие плазмы О2 приводит к увеличению адгезии белка, образующего толстый слой на поверхности полимера, тогда как после воздействия плазмы в атмосфере СF4 имеет место специфическое конформационное связывание белков. Однако, в обоих случаях содержание белка на поверхности благотворно влияет на адгезию и на 25% увеличивает пролиферацию эпителиальных клеток молочной железы человека.
Изучение модифицированных в плазме и под действием лазерного излучения образцов ПЭТФ показало значительное улучшение адсорбции и пролиферации различных клеток, в том числе фибробластов – клеток соединительной ткани организма, синтезирующих внеклеточный матрикс, обеспечивающих механическую поддержку клеток и транспорт химических веществ, что особенно важно для заживления ран [21, 44, 50, 51, 55, 72, 74].
Пленки ПЭТФ толщиной 125 мкм активировали в ВЧ-разряде в атмосфере Ar (13.56 МГц, 200 Вт, 3 мин, 3 Па), а затем на поверхность прививали слой полиакриловой кислоты (из раствора под действием УФ-облучения) [44]. На полученной поверхности с иммобилизованным покрытием из хитозана или о-карбоксиметилхитозана изучали адсорбцию и рост клеток гладких мышц, пролиферация которых обеспечивает организацию цитоскелета. Исследования жизнеспособности этих клеток показали, что через 5 сут все модифицированные материалы обладали пролиферацией клеток в ~2 раза превышающей данные для исходного ПЭТФ. Воздействие на пленки ПЭТФ разряда постоянного тока в атмосфере Ar (установка Balzers SCD) c последующей прививкой на модифицированную поверхность цистамина из раствора значительно улучшало цитосовместимость поверхности, повышало адгезию и пролиферацию клеток гладких мышц сосудов человека [51]. Модифицирование образцов ПЭТФ путем полимеризация аллиламина в СВЧ-разряде (2.45 МГц, 400–1200 Вт, 50 Па) в зоне послесвечения плазмы с использованием в качестве газа-носителя Ar (предварительная активация в плазме Ar 30 c) приводило к образованию на поверхности аминогрупп, обеспечивающих in vitro совместимость c фибробластами человека и многократно увеличивающими их метаболическую активность [55]. Изучение воздействия разряда постоянного тока и переменного тока частотой 40 кГц на свойства поверхности пленок ПЭТФ (40 мкм, PETLAIN BT 1010 E, Superfilm, Турция) показало, что обработка в плазме и последующая иммобилизация хитозана существенно увеличивает адгезию и рост мезенхимальных стволовых клеток человека [50].
Для пленок ПЭТФ, модифицированных с помощью облучения УФ-излучением ArF-эксимерного лазера (λ = 193 нм, 30 импульсов с флюенсом 30 мДж/см2), наблюдали заметное увеличение адсорбции клеток яичника китайского хомячка (линия клеток СНО-К1) и их распластывание на поверхности по сравнению с исходной пленкой [72]. Адгезию и пролиферацию клеток фибробластов L929 на поверхности ПЭТФ, облученной импульсным СО2 лазером (λ = 9.25 мкм) и эксимерным KrF лазером (λ = 248 нм), исследовали in vitro [74]. Полученные данные свидетельствуют, что прикрепление и рост клеток существенно возрастают после модифицирования поверхности полимера.
ЗАКЛЮЧЕНИЕ
Таким образом, очевидно, что модифицирование ПЭТФ под воздействием низкотемпературной плазмы и лазерного излучения приводит к существенному улучшению биосовместимости полимера. Новые свойства полимера связаны с изменениями химической структуры и морфологии поверхностного слоя, приводящими к изменению контактных свойств материала. Представленные в литературе данные свидетельствуют о том, что модифицированный в плазме ПЭТФ обладает высокой метаболической активностью по отношению к фибробластам человека, хорошей гемосовместимостью и антибактериальной устойчивостью. В этой связи, модифицированный в низкотемпературной плазме ПЭТФ, безусловно, имеет хорошие перспективы для использования в медицине и биологии.
Список литературы
Weltmann K.-D., Kolb J.F., Holub M., Uhrlandt D., Šimek M., Ostrikov K., Hamaguchi S., Cvelbar U., Černák M., Locke B., Fridman A., Favia P., Becker K. // Plasma Proc. Polym. 2019. V. 16. № 1. 1800118.
Bekeschus S., Favia P., Robert E., von Woedtke T. // Plasma Proc. Polym. 2019. V. 16. № 1. 1800033.
Xaubet M., Baudler J.-S., Gerling T., Giuliani L., Minotti F., Grondona D., Von Woedtke T., Weltmann K.-D. // Plasma Proc. Polym. 2018. V. 15. № 8. 1700211.
Siow K.S. // Plasma Proc. Polym. 2018. V. 15. № 9. 1800059.
Maitz M.F. // Biosurf. Biotribol. 2015. V. 1. P. 161.
E S.F., Shi L., Guo Z.G., Liu W.M. // Biosurf. Biotribol. 2015. V. 1. P. 81.
Kim M.S., Kim J.H., Min B.H., Chun H.J., Han D.K., Lee H.B. // Polym. Rev. 2011. V. 51. № 1. P. 23.
Yoshida S., Hagiwara K., Hasebe T., Hotta A. // Surf. Coat. Techn. 2013. V. 233. P. 99.
Jacobs T., Morent R., De Geyter N. // Plasma Chem. Plasma Proc. 2012. V. 32. № 5. P. 1039.
Non-thermal plasma technology for polymeric materials : applications in composites, nanostructured materials, and biomedical fields / Eds. Thomas S., Mozetič M., Cvelbar U., Špatenka P., Praveen K.M. Amsterdam: Elsevier. 2019. 494 p.
Nguyen D.B., Mok Y.S., Huynh D.L., Jeong D.K., Lee W.G. // Plasma Proc. Polym. 2019. V. 16. № 8. 1800173.
Vesel A., Mozetic M. // J. Phys. D Appl. Phys. 2017. V. 50. 293001.
Modification of Polymer Properties / Eds. by Jasso-Gastinel F., Kenny J.M. / Fabbri P., Messori M. Surface Modification of Polymers: Chemical, Physical and Biological Routes. William Andrew: Cambrige. 2016. P. 109.
Энциклопедия низкотемпературной плазмы. Вводный том IV / Под ред. Фортова В.Е. М.: Наука. 2000. 505 с.
Arpagaus C, Oberbossel G, von Rohr P.R. // Plasma Process. Polym. 2018. V. 15. 1800133.
Plasma Science and Technology – Progress in Physical States and Chemical Reactions. / Ed. by Mieno T. InTech Pbs. 2016. 574 p.
Friedrich J. The plasma chemistry of polymer surfaces: advanced techniques for surface design. Weinheim: Wiley. 2012. 473 p.
Пискарев М.С., Скрылева Е.А., Сенатулин Б.Р., Гильман A.Б., Kузнецов A.A. // Химия высоких энергий. 2020. Т. 54. № 4. С. 325.
Vesel A., Recek N., Motaln H., Mozetic M. // Plasma 2017. V. 1. P. 2.
Cvelbar U., Junkar I., Modic M. // Japan. J. Appl. Phys. 2011. V. 50. P. 08JF02.
Savoji H., Lerouge S., Ajji A., Wertheimer M.R. // Plasma Proc. Polym. 2015. V. 12. № 4. P. 314.
Jaganjac M., Vesel A., Milkovic L., Recek N., Kolar M., Zarkovic N., Latiff A., Kleinschek K-S., Mozetic M. // J. Biomed. Mater. Res. Part A. 2014. V. 102. № 7. P. 2305.
Oteyaka M.O., Chevallier P., Turgeon S., Robitaille L., Laroche G. // Plasma Chem. Plasma Proc. 2012. V. 32. P.17.
Junkar I., Vesel A., Cvelbar U., Mozetic M., Strnad S. // Vacuum. 2010. V. 84. P. 83.
Li F., Wang J., Sun H., Huang N. // Plasma Sci. Techn. 2010. V. 12. № 2. P. 235.
Vesel A., Mozetic M. // J. Phys.: Conf. Ser. 2008. V. 100. P. 012027.
Vesel A., Junkar I., Cvelbar U., Kovac J., Mozetic M. // Surf. Interface Anal. 2008. V. 40. P. 1444.
Katsikogianni M.G., Syndrevelis C.S., Amanatides E.K., Mataras D.S., Missirlis Y.F. // Plasma Proc. Polym. 2007. V. 4. P. S1046.
Papakonstantinou D., Amanatides E., Mataras D., Ioannidis V., Nikolopoulos P. // Plasma Proc. Polym. 2007. V. 4. P. S1057.
Pezzatini S., Morbidelli L., Gristina R., Favia P., Ziche M. // Nanotechnology. 2006. V. 19. P. 275101.
Li F.,Wang J.,Sun H., Huang N. // Key Eng. Mater. 2005. V. 288–289. P. 421.
Cioffi M.O.H., Voorwald H.J.C., Mota R.P. // Mater. Characterization 2003. V. 50. P. 209.
Pu F.R., Williams R.L., Markkula T.K., Hunt J.A. // Biomaterials. 2002. V. 23. P. 2411.
Ramires P. A., Mirenghi L., Romano A. R., Palumbo F., Nicolardi G. // J. Biomed. Mater. Res. Part A. 2000. V. 51. P. 535.
Chen Y.-H., Hsu C.-C., He J.-L. // Surf. Coat. Techn. 2013. V. 232. P. 868.
Elinson V., Lyamin A., Kravets L., Kikot I., Sylnitskaya O. // High Temp. Mater. Proc. 2014. V. 18. № 3. P. 215.
Рязанцева Т.В., Кравец Л.И., Елинсон В.М. // Перспект. матер. 2012. № 3. С. 41.
Ryazantseva T.V., Kravets L.I., Elinson V.M. // Surf. Coat.Techn. 2011. V. 205. P. S562.
Kravets L.I., Gilman A.B., Yablokov M.Yu., Satulu V., Mitu B., Dinescu G. // High Temp. Mater. Proc. 2015. V. 19. № 1. P. 1.
Shcherbina A.A., Chalykh A.E. // Protection Met. Phys. Chem. Surf. 2015. V. 51. № 3. P. 341.
Kumar D.S., Fujioka M., Asano K., Shoji A., Jayakrishnan A., Yoshida Y. // J. Mater. Sci: Mater. Med. 2007. V. 18. P. 1831.
Zhang Y., Ishikawa K., Mozeti M., Tsutsumi T., Kondo H., Sekine M., Hori M. // Plasma Proc. Polym. 2019. V. 16. № 6. 1800175.
Jingrun R., Jin W., Hong S., Nan H. // Appl. Surf. Sci. 2008. V. 255. P. 263.
Zhu A-P., Zhao F., Fang N. // J. Biomed. Mater. Res. Part A. 2008. V. 86A. № 2. P. 467.
Cen L., Neoh K. G., Ying L., Kang E. T. // Surf. Interface Anal. 2004. V. 36. P. 716.
Chandy T., Das G.S., Wilson R.F., Rao G.H.R. // Biomaterials. 2000. V. 21. P. 699.
Donegan M., Milosavljevic V., Dowling D.P. // Plasma Chem. Plasma Proc. 2013. V. 33. P. 941.
Gonzalez E., Barankin M.D., Guschl P.C., Hicks R.F. // Langmuir. 2008. V. 24. № 21. P. 12636.
Пискарев М.С., Гильман А.Б., Гатин А.К., Гайдар А.И., Куркин Т.С., Кузнецов А.А. // Химия высоких энергий. 2019. Т. 57. № 1. С. 64.
Demina T.S., Piskarev M.S., Romanova O.A., Gatin A.K., Senatulin B.R., Skryleva E.A., Zharikova T.M., Gilman A.B., Kuznetsov A.A., Akopova T.A., Timashev P.S. // Materials. 2020. V. 13. № 3. P. 508.
Kolská Z., Reznícková A., Nagyová M., Slepicková-Kasálková N., Sajdl P., Slepicka P., Svorcík V. // Polym. Degrad. Stab. 2014. V. 101. P. 1.
Slepika P., Slepiková-Kasálková N., Stránská E., Baáková L., Svorcík V. // eXPRESS Polym. Lett. 2013. V. 7. № 6. P. 535.
Kotal V., Svorcık V., Slepicka P., Sajdl P., Blahova O., Sutta P., Hnatowicz V. // Plasma Proc. Polym. 2007. V. 4. P. 69.
Zaplotnik R., Vesel A., Mozetič M. // Plasma Proc. Polym. 2018. V. 15. № 9. 1800021.
Hamerli P., Weigel Th., Groth Th., Paul D. // Biomaterials. 2003. V. 24. P. 3989.
Shi M.K., Dunham G., Gross M.E., Graff G.L., Martin P.M. // J. Adhes. Sci.Techn. 2000 V. 14. № 12. P. 1485.
Gouveia I.C., Antunes L.C., Gomes A.P. // J. Tex. Ist. 2011. V. 102. № 3. P. 203.
Ni W., Liu D., Song Y., Ji L., Zhang Q., Niu J. // Eur. Phys. J. Appl. Phys. 2013. V. 61. 10801.
Mui T.S.M., Mota R.P., Quade A., de Oliveira Hein L.R., Kostov K.G. // Surf. Coat. Techn. 2018. V. 352. P. 338.
Homola T., Wu L.Y. L., Černák M. // J. Adhes. 2014. V. 90. № 4. P. 296.
Yun T.K., Kim J.H., Lee D.K. // Molec. Crys. Liq. Crys. 2014. V. 586. № 1. P. 188.
Sophonvachiraporn P., Rujiravanit R., Sreethawong T., Tokura S., Chavadej S. // Plasma Chem. Plasma Proc. 2011. V. 31. P. 233.
De Geyter N., Morent R., Leys C. // Nucl. Instr. Meth. Phys. Res. B. 2008. V. 266. P. 3086.
Onsuratoom S., Rujiravanit R., Sreethawong T., Tokura S., Chavadej S. // Plasma Chem. Plasma Proc. 2010. V. 30. P.191.
Topala I., Dumitrascu N., Pohoata V. // Plasma Chem. Plasma Proc. 2007. V. 27. P. 95.
Rezaei F., Dickey M.D., Bourham M., Hauser P.J. // Surf. Coat. Techn. 2017. V. 309. P. 371.
Leroux F., Perwuelz A., Campagne C., Behary N. // J. Adhes. Sci. Techn. 2006. V. 20. № 9. P. 939.
Williams T.S., Yu H., Hicks R.F. // Rev. Adhes. Adhes. 2013. V. 1. № 1. P. 46.
Gotoh K., Kobayashi Y., Yasukawa A., Ishigami Y. // Colloid. Polym. Sci. 2012. V. 290. P.1005.
Dumitrascu N., Topala I., Popa G. // IEEE Trans. Plasma Sci. 2005. V. 33. № 5. P. 1710.
Kerkeni A., Behary N., Dhulster P., Chihib N.E., Perwuelz A. // J. Appl. Polym. Sci. 2013. V. 129. № 2. P. 866.
Reisinger B., Fahrner M., Frischauf I., Yakunin S., Svorcik V., Fiedorowicz H., Bartnik A., Romanin C., Heitz J. // Appl. Phys. A. Mat. Sci. Proc. 2010. V. 100. P. 511.
Bartnik A., Fiedorowicz H., Jarocki R., Kostecki J., Szczurek M., Bilinski A., Chernyayeva O., Sobczak J.W. // Appl. Phys. A. 2010. V. 99. P. 831.
Dadsetan M., Mirzadeh H., Sharifi-Sanjani N., Daliri M. // J. Biomed. Mater. Res. B: Appl. Biomat. 2001. V. 57. P. 183.
Wu G., Paz M.D., Chiussi S., Serra J., Gonzalez P., Wang Y.J., Leon B. // J. Mater. Sci.: Mater. Med. 2009. V. 20. P. 597.
Piskarev M.S., Zinov’ev A.V., Gilman A.B., Kechek’yan A.S., Kuznetsov A.A. // Polym. Sci. Ser. D. 2019. V. 12. № 2. P. 159.
Mirenghi L., Ramires P.A., Pentassuglia R.E., Rotolo P., Romito A. // J. Mater. Sci.: Mater. Med. 2000. V. 11. P. 327.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий