Химия высоких энергий, 2021, T. 55, № 3, стр. 206-214
О причинах влияния растворителя на фотохимию комплекса ${\mathbf{P}}{{{\mathbf{t}}}^{{{\mathbf{IV}}}}}{\mathbf{Cl}}_{{\mathbf{6}}}^{{{\mathbf{2}} - }}$
Е. М. Глебов a, b, *, В. Ф. Плюснин a, b
a Институт химической кинетики и горения им. В.В. Воеводского Сибирского Отделения Российской академии наук
630090 Новосибирск, ул. Институтская, 3, Российская Федерация
b Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Российская Федерация
* E-mail: glebov@kinetics.nsc.ru
Поступила в редакцию 02.12.2020
После доработки 24.12.2020
Принята к публикации 10.01.2021
Аннотация
Фотохимия комплекса ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ парадоксальным образом зависит от растворителя. В воде, хлороформе и ацетонитриле протекает цепная фотосольватация комплекса. При этом схема фотолиза в воде и хлороформе совершенно идентична, а в ацетонитриле наблюдается особенность на уровне образования переносчика цепи. В простых спиртах фотохимия является нецепной, представляя собой комбинацию фотосольватации и фотовосстановления Pt(IV) до Pt(II). В статье показано, что главными факторами, объясняющими эффект растворителя, являются значения констант скорости некоторых ключевых реакций.
Фотохимия комплекса ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$, о которой известно с 1832 г. [1], таит в себе немало сюрпризов [2, 3], одним из которых является странная зависимость фотохимических свойств от природы растворителя в ряду вода–хлороформ–ацетонитрил–простые спирты. В водных растворах происходит цепная реакция фотоакватации [4–8], в которой переносчиками цепи являются интермедиаты Pt(III) [7, 8]. Аналогичные цепные фотопроцессы протекают в хлороформе [9]. В ацетонитриле также наблюдается цепная фотосольватация, однако, в отличие от воды и хлороформа, главную роль играет процесс переноса электрона с молекулы растворителя на возбужденный светом комплекс [10]. Наконец, в простых спиртах (метанол, этанол, изопропанол) наблюдается комбинация нецепных процессов фотосольватации [11] и фотовосстановления, при этом перенос электрона с молекулы растворителя на возбужденный светом комплекс играет ключевую роль [12–14]. Таким образом, растворители по отношению к фотохимии комплекса ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ классифицируются следующим образом: вода подобна хлороформу, от них несколько отличается по свойствам ацетонитрил, и особняком стоят спирты. Трудно представить, что эта последовательность может коррелировать с какими-то свойствами растворителей.
По нашему мнению, объяснение парадоксальному влиянию растворителя следует искать в энергетике и кинетике первичных (сверхбыстрых) и последующих процессов. Сверхбыстрые процессы для координационных соединений имеют ряд особенностей, связанных с большим количеством возбужденных состояний разной природы. Выделим некоторые из этих особенности, следуя обзору А. Вл-чека [15].
1. Для комплексов переходных металлов существуют различные типы возбужденных состояний, различающихся составом орбиталей, мультиплетностью, энергией, динамикой и реакционной способностью.
2. Плотность возбужденных состояний для комплексов металлов намного выше, чем для органических соединений. В узком диапазоне энергий могут сосуществовать несколько возбужденных состояний. Возбужденные состояния различной природы могут взаимодействовать как в геометрии Франк-Кондоновского (вертикального) возбужденного состояния, так и при движении вдоль специфических координат реакции. Это приводит к возникновению конкурирующих путей (как релаксационных, так и реакционных).
3. Многие комплексы переходных металлов даже в основном состоянии активны по отношению к окислительно-восстановительным процессам. Эта активность сохраняется для возбужденных состояний, что обуславливает особую роль процессов с переносом электрона.
4. Существует возможность изменения свойств возбужденных состояний посредством относительно небольших структурных изменений.
Перечисленные особенности определяют разнообразие возможных фотопроцессов для комплексов переходных металлов. Далее мы попытаемся дать качественное объяснение влиянию растворителя на фотохимию ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$. Для этого нам понадобится более подробно рассмотреть особенности фотофизики и фотохимии этого комплекса в разных растворителях.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
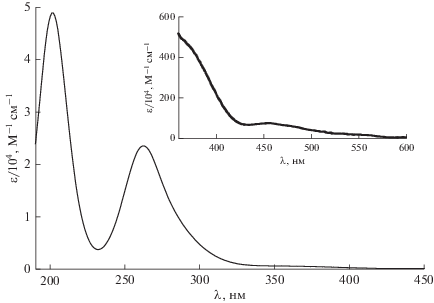
Строение и электронные спектры поглощения (ЭСП) комплекса ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$
Комплекс ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ (электронная конфигурация 5d6) имеет октаэдрическое строение с длиной связи Pt–Cl 2.32 Å [16]. ЭСП в водном растворе показан на рис. 1. Впервые спектр этого комплекса был приведен в работе Йоргенсена [17], детальное исследование спектра в разных растворителях проведено Свихартом и Мэйсоном [18]. Спектр содержит d-d полосы в видимом и ближнем УФ-диапазонах и полосы переноса заряда лиганд–металл (ПЗЛМ) в ультрафиолетовой области спектра. В видимой области d-d полосы имеют достаточно большую интенсивность, что не вполне обычно для октаэдрических комплексов, где эти переходы запрещены по четности. Однако в спектре наблюдается даже d-d переход с дополнительным запретом по спину (465 нм, ε ~ ~ 50 M–1 см–1), что связано с большой константой спин-орбитального взаимодействия, снимающего запрет.
Первичный интермедиат, возникающий при фотовозбуждении ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$
В экспериментах по сверхбыстрой (длительность возбуждающего импульса короче 100 фс) кинетической спектроскопии в воде [19], простых спиртах [19] и ацетонитриле [10] был зарегистрирован один и тот же интермедиат (рис. 2) с характерным временем жизни, лежащем в интервале 200–300 пс. В хлороформе эксперименты не были проведены по техническим причинам. Ранее эта частица была обнаружена в водном растворе в эксперименте по пикосекундному (длительность возбуждающего импульса 20 пс) лазерному импульсному фотолизу [20].
Рис. 2.
ЭСП интермедиата, зарегистрированного в экспериментах по сверхбыстрой кинетической спектроскопии комплекса ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ в H2O (405 нм, 60 фс [19]), CH3CN (400 нм, 60 фс [10]) и CH3OH (405 нм, 60 фс [19]). Амплитуды спектров нормированы на максимальное поглощение в длинноволновой области спектра.
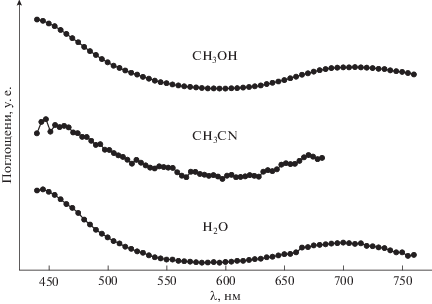
Этот интермедиат (рис. 2) может быть идентифицирован как первичная Адамсоновская радикальная пара $[{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }} \ldots {\text{C}}{{{\text{l}}}^{\centerdot }}]$ [3]. Механизм радикальных пар, предложенный в пятидесятых годах прошлого века для объяснения процессов фотосольватации, включающих окислительно-восстановительные стадии, связан с выходом восстановленной формы лиганда из координационной сферы возбужденного комплекса. Он был предложен Адамсоном для комплексов кобальта(III) с одним галоид-ионом в координационной сфере –Co(NH3)5X2+ (X – атом галогена) [21, 22]. Предполагается, что первичным фотопроцессом является внутрисферный перенос электрона. Термин “Адамсоновская радикальная пара” является традиционным, хотя по сути эти интермедиаты представляют собой ион-радикальные пары. В применении к фотоакватации гексагалогенидного комплекса четырехвалентного иона переходного металла механизм Адамсона выглядит следующим образом:
(1)
${{{\text{M}}}^{{{\text{IV}}}}}{\text{X}}_{6}^{{2 - }} \xrightarrow{{h\nu }} [{{{\text{M}}}^{{{\text{III}}}}}{\text{X}}_{5}^{{2 - }} \ldots {{{\text{X}}}^{\centerdot }}]\,\,\,{\text{первичная радикальная пара,}}$(2)
$[{{{\text{M}}}^{{{\text{III}}}}}{\text{X}}_{5}^{{2 - }}...{{{\text{X}}}^{\centerdot }}] \xrightarrow{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}} [{{{\text{M}}}^{{{\text{III}}}}}{{{\text{X}}}_{{\text{5}}}}{{{\text{(}}{{{\text{H}}}_{{\text{2}}}}{\text{O}})}^{{2 - }}} \ldots {{{\text{X}}}^{\centerdot }}] \,\,{\text{вторичная радикальная пара,}}$(3)
$[{{{\text{M}}}^{{{\text{III}}}}}{{{\text{X}}}_{5}}{{({{{\text{H}}}_{2}}{\text{O}})}^{{2 - }}}...{{{\text{X}}}^{\centerdot }}] \to {{{\text{M}}}^{{{\text{IV}}}}}{{{\text{X}}}_{5}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}^{ - }} + {{{\text{X}}}^{ - }} \,\,{\text{обратный перенос электрона,}}$(4)
$[{{{\text{M}}}^{{{\text{III}}}}}{{{\text{X}}}_{5}}{{({{{\text{H}}}_{2}}{\text{O}})}^{{2 - }}} \ldots {{{\text{X}}}^{\centerdot }}] \to {{{\text{M}}}^{{{\text{III}}}}}{{{\text{X}}}_{5}}{{({{{\text{H}}}_{2}}{\text{O}})}^{{2 - }}} + {{{\text{X}}}^{\centerdot }} \,\,{\text{выход атома галогена в объем}}{\text{.\;}}$Интерпретация интермедиата (рис. 2) как первичной Адамсоновской радикальной пары позволяет объяснить весь массив имеющихся экспериментальных данных [3]. Однако прямых доказательств (например, квантово-химических расчетов) такой интерпретации в настоящее время не существует.
Цепная фотоакватация ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$
Цепная фотоакватация ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ [4–8] описывается механизмом (5)–(11) [8] (сверхбыстрые стадии, описанные выше, опущены). Атом хлора исчезает, не оказывая влияния на цепные процессы [7].
Инициирование цепи
(5)
${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{{\text{6}}}^{{{\text{2}} - }}\xrightarrow{{h\nu }} {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }}~ + ~~{\text{C}}{{{\text{l}}}^{\centerdot }},$(6)
$\begin{gathered} {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{{\text{5}}}^{{{\text{2}} - }}~ + ~~{\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}~~ \to ~ \\ \to \,\,~{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{4}}}}\left( {{\text{OH}}} \right){{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}^{{{\text{2}} - }}}~~ + ~~{\text{C}}{{{\text{l}}}^{ - }}~~ + ~~{{{\text{H}}}^{ + }}, \\ \end{gathered} $(7)
$\begin{gathered} {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{4}}}}\left( {{\text{OH}}} \right){{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}^{{{\text{2}} - }}}~~ \to ~ \\ \to \,\,~{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{3}}}}{{\left( {{\text{OH}}} \right)}^{ - }}~~ + ~~{{{\text{H}}}_{{\text{2}}}}{\text{O}}~~ + ~~{\text{C}}{{{\text{l}}}^{ - }}, \\ \end{gathered} $Продолжение цепи
(8)
$\begin{gathered} {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{3}}}}{{\left( {{\text{OH}}} \right)}^{ - }}~~ + ~~{\text{PtCl}}_{{\text{6}}}^{{{\text{2}} - }} + ~~{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to ~ \\ \to \,\,~{\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{{\text{5}}}}{{\left( {{\text{OH}}} \right)}^{{{\text{2}} - }}}~~ + ~~{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{3}}}}\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)~~ + ~~{\text{C}}{{{\text{l}}}^{ - }}, \\ \end{gathered} $(9)
${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{3}}}}\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)~~ \rightleftarrows ~{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{3}}{{\left( {{\text{OH}}} \right)}^{ - }}~~ + ~~{{{\text{H}}}^{ + }},$(10)
${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{{\text{5}}}}{{\left( {{\text{OH}}} \right)}^{{{\text{2}} - }}}~~ + ~~ {{{\text{H}}}^{ + }}~~ \rightleftarrows ~~{\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{{\text{5}}}}{{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}^{ - }},$Обрыв цепи
(11)
$\begin{gathered} 2{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{3}}{{\left( {{\text{OH}}} \right)}^{ - }}~~ + ~~{\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}~~ \to ~~{\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{{\text{4}}}}\left( {{\text{OH}}} \right){{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}^{ - }}~~ + ~ \\ + \,\,~{\text{P}}{{{\text{t}}}^{{{\text{II}}}}}{\text{C}}{{{\text{l}}}_{{\text{2}}}}\left( {{\text{OH}}} \right){{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}^{ - }}. \\ \end{gathered} $Два интермедиата Pt(III) предполагаемого состава PtIIICl4(OH)(H2O)– и PtIIICl3(OH)– обнаружены в экспериментах по лазерному импульсному фотолизу [7, 19] (следует отметить, что состав лигандов в интермедиатах строго не доказан). Интерпретация интермедиатов Pt(III) основана на квантово-химических расчетах Гурсо с сотр. [20, 23–25], проведенных в 80-е годы прошлого века релятивистским самосогласованным методом MS Xα [26]. Уверенность в адекватности расчетов методом MS Xα подтверждается успешностью его применения для расчетов ЭСП стабильных комплексов тяжелых металлов [27–29]. Однако воспроизведение этих расчетов на базе современных методов квантовой химии является актуальной задачей.
Цепная фотохимия гексахлорплатината(IV) в хлороформе
Хоггард с соавторами [30, 31] на основе стационарных методов исследования предложили цепной процесс фотовосстановления комплексов H2PtIVCl6 и (n‑Bu4N)2[PtCl6] в хлороформе (оба соединения не диссоциируют в данном растворителе), представленный для случая кислоты уравнениями (12)–(17).
(12)
${{{\text{H}}}_{2}}{\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{6}}~~\xrightarrow{{h\nu }} {{{\text{H}}}_{2}}{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{5}}}}~~ + ~~{\text{C}}{{{\text{l}}}^{\centerdot }},$(13)
${\text{C}}{{{\text{l}}}^{\centerdot }} + {\text{CHC}}{{{\text{l}}}_{3}}~~ \to {\text{HCl}}~~ + ~{{~}^{\centerdot }}{\text{CC}}{{{\text{l}}}_{3}},$(14)
${{{\text{H}}}_{2}}{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{5}}}} \to {{{\text{H}}}_{2}}{\text{P}}{{{\text{t}}}^{{{\text{II}}}}}{\text{C}}{{{\text{l}}}_{{\text{4}}}} + {}^{\centerdot }{\text{Cl,}}$(15)
${{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{6}} + {}^{\centerdot }{\text{CC}}{{{\text{l}}}_{3}} \to {{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{5}} + {\text{CC}}{{{\text{l}}}_{4}},$(16)
$2 {}^{\centerdot }{\text{CC}}{{{\text{l}}}_{{\text{3}}}}{\text{ }} \to {{{\text{C}}}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{{\text{6}}}},$(17)
${\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{5}}}}{\text{ }} \to {{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{t}}}^{{{\text{II}}}}}{\text{C}}{{{\text{l}}}_{{\text{4}}}}{\text{ }} + {{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{{\text{6}}}}.$Однако радикал •CCl3, играющий роль переносчика цепи в механизме Хоггарда, реагирует с кислородом с образованием перекисного радикала CCl3OO• (18), причем константа скорости близка к диффузионной [32]
(18)
${}^{\centerdot }{\text{CC}}{{{\text{l}}}_{{\text{3}}}} + {{{\text{O}}}_{{\text{2}}}}{\text{ }} \to {\text{CC}}{{{\text{l}}}_{{\text{3}}}}{\text{O}}{{{\text{O}}}^{\centerdot }}.$Радикал CCl3OO•, обладая окислительными свойствами [33, 34], не может заменить радикал •CCl3 в реакции продолжения цепи (15). Это означает, что квантовый выход фотолиза H2PtIVCl6 и (n‑Bu4N)2[PtCl6] в хлороформе должен был зависеть от концентрации растворенного кислорода, однако экспериментально эта зависимость не проявляется [9]. Этот факт позволил нам предложить другой механизм фотолиза (n‑Bu4N)2[PtCl6] (19)–(22), который объясняет все имеющиеся данные по стационарному и лазерному импульсному фотолизу [9].
Зарождение цепи
(19)
$\begin{gathered} {{{\text{(}}n{\text{ - B}}{{{\text{u}}}_{{\text{4}}}}{\text{N}})}_{2}}{\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{{\text{6}}}}{\text{ }}\xrightarrow{{h\nu }} \\ \to \,\,{{(n{\text{ - B}}{{{\text{u}}}_{{\text{4}}}}{\text{N}})}_{2}}{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{5}}}} + {\text{C}}{{{\text{l}}}^{\centerdot }}, \\ \end{gathered} $(20)
$\begin{gathered} {{(n{\text{ - B}}{{{\text{u}}}_{{\text{4}}}}{\text{N}})}_{2}}{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{5}}}} \to \\ \to \,\,(n{\text{ - B}}{{{\text{u}}}_{{\text{4}}}}{\text{N}}){\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{4}}}} + (n{\text{ - B}}{{{\text{u}}}_{{\text{4}}}}{\text{N}}){\text{Cl,}} \\ \end{gathered} $Продолжение цепи
(21)
$\begin{gathered} (n{\text{ - B}}{{{\text{u}}}_{{\text{4}}}}{\text{N}}){\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{4}}}} + {{(n{\text{ - B}}{{{\text{u}}}_{{\text{4}}}}{\text{N}})}_{2}}{\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{{\text{6}}}}\xrightarrow{{{\text{CHC}}{{{\text{l}}}_{{\text{3}}}}}} \\ \to (n{\text{ - B}}{{{\text{u}}}_{{\text{4}}}}{\text{N}}){\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{{\text{5}}}}{\text{(CHC}}{{{\text{l}}}_{{\text{3}}}}{\text{)}} + {{(n{\text{ - B}}{{{\text{u}}}_{{\text{4}}}}{\text{N)}}}_{{\text{2}}}}{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{5}}}}, \\ \end{gathered} $Обрыв цепи
(22)
$\begin{gathered} 2(n{\text{ - B}}{{{\text{u}}}_{{\text{4}}}}{\text{N}}){\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{{\text{4}}}}\xrightarrow{{{\text{CHC}}{{{\text{l}}}_{{\text{3}}}}}} \\ \to (n{\text{ - B}}{{{\text{u}}}_{{\text{4}}}}{\text{N}}){\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{{\text{5}}}}({\text{CHC}}{{{\text{l}}}_{{\text{3}}}}) + (n{\text{ - B}}{{{\text{u}}}_{{\text{4}}}}{\text{N)P}}{{{\text{t}}}^{{{\text{II}}}}}{\text{C}}{{{\text{l}}}_{{\text{3}}}}. \\ \end{gathered} $В этом случае цепные процессы в воде (5)–(11) и хлороформе (19)–(22) аналогичны и включают восстановительную фотодиссоциацию и последующее развитие цепных процессов с участием интермедиатов Pt(III) (зарегистрированных в экспериментах по лазерному импульсному фотолизу). Атом хлора и/или продукты его реакций (радикал •CCl3) не участвуют в процессе. Растворитель участвует только в роли сольватирующего агента.
Цепная фотосольватация ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ в ацетонитриле
Фотовозбуждение ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ в ацетонитриле приводит к цепной фотосольватации с образованием комплекса PtIVСl5(CH3CN)2– [10, 35 ]. Механизм фотолиза представлен уравнениями (23)–(30), учитывающими как сверхбыстрые стадии, так и цепные процессы.
Сверхбыстрая стадия и зарождение цепи
(23)
${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }} \xrightarrow{{h\nu }} [{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }} \ldots {\text{C}}{{{\text{l}}}^{\centerdot }}],$(24)
$\begin{gathered} \text{[}{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }} \ldots {\text{C}}{{{\text{l}}}^{\centerdot }}] + {\text{C}}{{{\text{H}}}_{3}}{\text{CN}} \to \\ \to \,\,{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{6}^{{3 - }} + {}^{\centerdot }{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{CN}} + {{{\text{H}}}^{ + }}, \\ \end{gathered} $(25)
${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{6}^{{3 - }} \xrightarrow{{t^\circ }} {\text{ P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }} + {\text{C}}{{{\text{l}}}^{ - }},$Продолжение цепи
(26)
${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }} \to {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{4}^{ - } + {\text{C}}{{{\text{l}}}^{ - }},$(27)
$\begin{gathered} {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{4}^{ - } + {\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }} \xrightarrow{{{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CN}}}} {\text{ }} \\ \to {\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{{\text{5}}}}{{{\text{(C}}{{{\text{H}}}_{{\text{3}}}}{\text{CN)}}}^{ - }} + {\text{ P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }}, \\ \end{gathered} $Обрыв цепи
(28)
$\begin{gathered} {\text{2P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{4}^{ - } \xrightarrow{{{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CN}}}} \\ \to \,\,{\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{{\text{5}}}}{{{\text{(C}}{{{\text{H}}}_{{\text{3}}}}{\text{CN)}}}^{ - }} + {\text{Pt(II)}}, \\ \end{gathered} $(29)
$ {}^{\centerdot }{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{CN}} + {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }} \to {\text{P}}{{{\text{t}}}^{{{\text{II}}}}}{\text{Cl}}_{4}^{{2 - }} + {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{ClCN,}}$(30)
${}^{\centerdot }{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{CN}} \to \Pr {\text{oducts}}{\text{.}}$Необходимость введения стадии сверхбыстрого переноса электрона с молекулы растворителя на первичную Адамсоновскую радикальную пару обусловлена тем, что даже при очень больших концентрациях (до 0.01 М) свободных ионов Cl– в растворе нам не удалось (в отличие от случая водных растворов [7]) зафиксировать выход атома хлора в объем растворителя по образованию дигалоидного анион-радикала $~{\text{Cl}}_{2}^{{\centerdot - }}$ (реакция (31)) [10].
(31)
${\text{C}}{{{\text{l}}}^{\centerdot }} + {\text{C}}{{{\text{l}}}^{ - }}~~ \to ~{\text{Cl}}_{2}^{{\centerdot - }}.$Образовавшиеся в результате переноса электрона радикалы •CH2CN вносят вклад в обрыв цепи (реакция (29)) но их влияние на кинетику фотосольватации невелико [10].
Фотохимия комплекса ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ в спиртах
В метаноле и этаноле, в отличие от трех рассмотренных выше растворителей, цепные процессы не развиваются [11]. После первичного процесса – внутрисферного переноса электрона с образованием Адамсоновской радикальной пары (23), протекают параллельные реакции обратного переноса электрона (32), приводящего к фотосольватации исходного комплекса, и переноса электрона с молекулы растворителя на Адамсоновскую радикальную пару (33), что запускает механизм восстановления платины до двухвалентного состояния (34)–(36) [12–14].
(32)
$\begin{gathered} {\text{[P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }} \ldots {\text{C}}{{{\text{l}}}^{\centerdot }}] + {\text{C}}{{{\text{H}}}_{3}}{\text{OH}} \to \\ \to \,\,{\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{5}}{{({\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}})}^{ - }} + {\text{ C}}{{{\text{l}}}^{ - }}, \\ \end{gathered} $(33)
$\begin{gathered} \text{[}{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }} \ldots {\text{C}}{{{\text{l}}}^{\centerdot }}] + {\text{C}}{{{\text{H}}}_{3}}{\text{OH}} \to {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{6}^{{3 - }} + \\ + \,\, {}^{\centerdot }{\text{C}}{{{\text{H}}}_{2}}{\text{OH}} + {{{\text{H}}}^{ + }}, \\ \end{gathered} $(34)
${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{6}^{{3 - }} \to {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }} + {\text{C}}{{{\text{l}}}^{ - }},$(35)
${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{6}^{{5 - }} \to {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{4}^{ - } + {\text{C}}{{{\text{l}}}^{ - }},$(36)
${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{4}^{ - } + {\text{C}}{{{\text{H}}}_{3}}{\text{OH}} \to {\text{P}}{{{\text{t}}}^{{{\text{II}}}}}{\text{Cl}}_{4}^{{2 - }} + {}^{\centerdot }{\text{C}}{{{\text{H}}}_{2}}{\text{OH}} + {{{\text{H}}}^{ + }}.$Далее будут выделены ключевые факторы, которые могут определять влияние растворителей на фотохимию комплекса ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$: энергетика процессов (1), константа скорости реакции атома хлора с растворителем (2) и соотношение скоростей передачи и обрыва цепи (3).
1. ЭНЕРГЕТИКА ПРОЦЕССА ПЕРЕНОСА ЭЛЕКТРОНА С РАСТВОРИТЕЛЯ НА ВОЗБУЖДЕННЫЙ СВЕТОМ КОМПЛЕКС
Прежде всего зададимся вопросом о возможности фотоиндуцированного переноса электрона с растворителя на возбужденный светом комплекс с энергетической точки зрения. Для этого не обязательно рассматривать механизм в деталях, можно ограничиться рассмотрением энергетики реакции (37) – до диссоциации первичного катион-радикала растворителя на радикал растворителя и H+.
(37)
${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }} + {\text{RH}} + h\nu \to {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{6}^{{3 - }} + {\text{R}}{{{\text{H}}}^{{\centerdot + }}}.$Энергию кванта, при которой процесс возможен, можно оценить из неравенства (I)
(I)
$h\nu \geqslant {{E}_{i}} + E_{{red}}^{{Pt}} + \Delta (\Delta {{G}_{{solv}}}) + {{E}_{{Coulomb}}},$(II)
$\Delta G_{{solv}}^{0} = - \frac{{{{z}^{2}}{{e}^{2}}}}{{2a}}\left( {1 - \frac{1}{\varepsilon }} \right)$Проведем оценку для ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ в метаноле. Вертикальная энергия ионизации (VET) в газовой фазе равна 10.94 эВ, в жидкости – на 1 эВ меньше, 9.99 эВ [36]. Комплекс ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ является умеренным окислителем (окислительно-восстановительный потенциал для реакции двухэлектронного восстановления ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ = ${\text{P}}{{{\text{t}}}^{{{\text{II}}}}}{\text{Cl}}_{4}^{{2 - }}$ + 2Cl– равен + 0.734 В [37, с. 217]), так что при восстановлении Pt(IV) до Pt(II) энергия выделяется. Для получения наиболее жесткой оценки будем считать, что окислительно-восстановительный потенциал для реакции одноэлектронного восстановления ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ = ${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{4}^{{2 - }}$ + Cl– равен нулю.
Радиус иона ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ равен 4.1 Å (длина связи Pt–Cl в ионе равна 2.32 Å [16], радиус иона Cl– равен 1.81 Å [38]). Радиус иона ${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{6}^{{3 - }}$ примем равным той же величине. Сольватацию катион-радикала CH3OH•+ учитывать не нужно, т.к. нам известна экспериментальная энергия ионизации в жидкой фазе. В результате получаем за счет сольватации $\Delta (\Delta {{G}_{{solv}}})$ = (–8.4 эВ). Диаметр молекулы метанола примем равным ее кинетическому диаметру (∼4 Å [39]), соответственно, расстояние между анионом ${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{6}^{{3 - }}$ и протоном считаем равным 8.1 Å. Тогда для энергии кулоновского взаимодействия ${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{6}^{{3 - }}$ и CH3OH•+ получаем (–0.17 эВ). Таким образом, минимальная энергия кванта, согласно уравнению (I), получается равной 1.43 эВ, что соответствует длине волны возбуждения 864 нм. То есть, для ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ фотоиндуцированный перенос электрона с молекулы метанола возможен при облучении любым видимым светом.
Энергетические параметры реакции (37) для воды и ацетонитрила оценивали аналогично. Результаты приведены в табл. 1. Видно, что и для этих растворителей процесс переноса электрона с молекулы растворителя на возбужденный светом комплекс при УФ-возбуждении, обычно используемом в экспериментах по фотохимии ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$, не запрещен по энергетическим соображениям. Поскольку этот процесс реализуется в спиртах и ацетонитриле и не реализуется в воде, понятно, что энергетические соображения не играют решающей роли.
Таблица 1.
Энергетические параметры гипотетической реакции переноса электрона с молекулы растворителя на возбужденный светом комплекс ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ (37). Оценка по формулам (I)–(III). $E_{i}^{{gas}}$ и $E_{i}^{{liq}}$ – газофазный и жидкофазный потенциалы ионизации растворителя. Окислительно-восстановительный потенциал одноэлектронного восстановления ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ = ${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{4}^{{2 - }}$ + Cl-принят равным нулю. Радиус ионов ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ и ${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{6}^{{3 - }}$ принят равным 4.1 Å. Расстояние R для оценки энергии кулоновского взаимодействия принято равным 4.1 Å + dsolv, где dsolv– диаметр молекулы растворителя. hν (λ) – граничная энергия кванта (длина волны) излучения, при которых процесс разрешен по энергии
Для хлороформа процесс (37) не актуален, поскольку в отсутствие диссоциации компенсировать энергию, необходимую для ионизации растворителя, нечем.
2. КОНСТАНТА СКОРОСТИ РЕАКЦИИ АТОМА ХЛОРА С РАСТВОРИТЕЛЯМИ
Полагая, что первичный интемедиат, зарегистрированный в воде, спиртах и ацетонитриле, представляет собой Адамсоновскую радикальную пару $[{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{5}}^{{2 - }} \ldots {\text{C}}{{{\text{l}}}^{\centerdot }}]$, можно предположить следующий механизм реакции (37):
(а) в результате внутрисферного фотопереноса электрона образуется Адамсоновская радикальная пара;
(б) электрон переносится с молекулы растворителя на атом хлора радикальной пары;
(с) октаэдрическая структура комплекса платины (теперь уже трехвалентной, а не четырехвалентной) восстанавливается (реакции (24) для ацетонитрила и (33) для метанола).
(37a)
${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }} \xrightarrow{{h\nu }} [{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }} \ldots {\text{C}}{{{\text{l}}}^{\centerdot }}],$(37b)
$\begin{gathered} {\text{[P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }} \ldots {\text{C}}{{{\text{l}}}^{\centerdot }}] + {\text{ RH}} \to \\ \to [{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }} \ldots {\text{C}}{{{\text{l}}}^{ - }}] + {\text{R}}{{{\text{H}}}^{{\centerdot + }}}, \\ \end{gathered} $(37c)
$[{\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }} \ldots {\text{C}}{{{\text{l}}}^{ - }}] \to {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{6}^{{3 - }}.$Поскольку можно полагать, что атом хлора в Адамсоновской радикальной паре слабо связан с комплексным катионом, интересно посмотреть на константы скорости реакции свободного атома хлора с растворителями (реакции (13) (с хлороформом), (38)–(40), табл. 2).
(38)
${\text{C}}{{{\text{l}}}^{\centerdot }} + {\text{C}}{{{\text{H}}}_{3}}{\text{OH}}~ \to {}^{\centerdot }{\text{C}}{{{\text{H}}}_{2}}{\text{OH}} + {{{\text{H}}}^{ + }}~ + {\text{C}}{{{\text{l}}}^{ - }},$(39)
${\text{C}}{{{\text{l}}}^{\centerdot }} + {\text{C}}{{{\text{H}}}_{3}}{\text{CN}}~~ \to {}^{\centerdot }{\text{C}}{{{\text{H}}}_{2}}{\text{CN}} + {{{\text{H}}}^{ + }}~ + {\text{C}}{{{\text{l}}}^{ - }} ,$(40)
${\text{C}}{{{\text{l}}}^{\centerdot }} + {{{\text{H}}}_{2}}{\text{O}}~ \to ~{\text{ClO}}{{{\text{H}}}^{ - }} + {{{\text{H}}}^{ + }}.$Таблица 2.
Константы скорости реакции свободного атома хлора с растворителями
| Реагент | Номер реакции | Растворитель | k | Ссылка |
|---|---|---|---|---|
| CH3OH | 38 | CCl4 | 5.7 × 109 M–1c–1 | [43] |
| 2.7 × 109 M–1c–1 | [44] | |||
| CH3CN | 39 | CH3CN | *5.4 × 107 c–1 | [45] |
| CHCl3 | 13 | CCl4 | 1.2 × 107 M–1c–1 | [46] |
| **(1.2–1.8) × 107 M–1c–1 | [43] | |||
| H2O | 40 | H2O | 2.5 × 105 с–1 | [47] |
| 1.6 × 105 с–1 | [48] |
* Приведенная в [45] бимолекулярная константа скорости 2.8 × 106 M–1 c–1 представляет собой произведение фактически определенной авторами работы мономолекулярной константы и обратного молярного объема ацетонитрила. ** Использованы разные методы, давшие несколько отличающиеся значения константы скорости.
Константа скорости реакции атома хлора с метанолом близка к диффузионной, в то время как в ацетонитриле и хлороформе она на три порядка меньше. Вода ввиду невозможности переноса атома водорода представляет собой особый случай.
Характерное время жизни Адамсоновской радикальной пары в воде, метаноле и ацетонитриле составляет соответственно 220 [19], 350 [19] и 370 пс [10]. При коэффициенте диффузии D = 10–5 см2/c время τ = 300 пс соответствует диффузионному расхождению пары ${\text{[P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{C}}{{{\text{l}}}_{5}}^{{2 - }} \ldots {\text{C}}{{{\text{l}}}^{\centerdot }}]$ на 5 Å (x2 ∼ Dτ). То есть, время жизни Адамсоновской пары близко к диффузионному. Сравним его со временем жизни атома хлора в разных растворителях.
Характерное время жизни атома хлора в воде – несколько микросекунд – на много порядков величины превышает время диффузионного расхождения пары. Никаких специфических взаимодействий между молекулами растворителя и атомом хлора за это время не возникает. Диффузионное расхождение пары дает старт дальнейшим термическим процессам (6)–(11), обеспечивающим в конечном итоге цепную фотосольватацию.
Характерное время жизни атома хлора в ацетонитриле составляет 20 нс. Если бы в эксперименте по лазерному импульсному фотолизу ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ в CH3CN возникали свободные атомы хлора, то при добавлении в раствор 10–2 М свободных хлорид-ионов около половины этих атомов образовали бы дигалоидный анион-радикал ${\text{Cl}}_{2}^{{\centerdot - }}$ по реакции (41), которая является диффузионно-контролируемой [49]. Однако в работе [10] в описанном эксперименте не было обнаружено никаких следов дигалоидного анион-радикала. Отсюда следует справедливость первичного механизма (23)–(25). Электрон переносится с молекулы растворителя на атом хлора Адамсоновской радикальной пары, процесс описывается реакциями (37a)–(37c).
(41)
${\text{C}}{{{\text{l}}}^{\centerdot }} + {\text{ C}}{{{\text{l}}}^{ - }}~~ \to {\text{Cl}}_{2}^{{\centerdot - }} .$Для молекулы метанола константа скорости реакции с атомом хлора, измеренная в CCl4 (табл. 2), близка к диффузионной. Оценив диффузионную константу скорости в CCl4 по формуле ${{k}_{D}} = \frac{{8RT}}{{3000\eta }}$ [50], получим значение 7.4 × 109 М–1 с–1. Из наблюдаемой константы скорости ${{k}_{{obs}}} = \frac{{{{k}_{D}}{{k}_{{kin}}}}}{{{{k}_{D}} + {{k}_{{kin}}}}}$ по литературным данным табл. 2 получим, что бимолекулярная кинетическая константа скорости лежит в интервале (4–25) × 109 М–1 с–1. Мономолекулярная константа скорости переноса электрона в паре •Cl…CH3OH связана с кинетической константой соотношением ${{k}_{{kin}}} = {{k}_{{mono}}}V$ [51], где V = = 4πR2Δ – объем реакционной зоны, R – суммарный радиус реагентов (≈2.8 Å), Δ – ширина реакционной зоны. Полагая Δ ≈ 1 Å, получаем V ≈ 0.06 М–1. В результате даже при минимальном значении кинетической константы 4 × 109 М–1 с–1 характерное время жизни свободного атома хлора в метаноле составляет 15 пс (близкое значение ≈10 пс получается при формальном определении мономолекулярной константы как ${{k}_{{mono}}} = {{{{k}_{{kin}}}} \mathord{\left/ {\vphantom {{{{k}_{{kin}}}} {{{V}_{\mu }}}}} \right. \kern-0em} {{{V}_{\mu }}}}$, где Vμ – молярный объем метанола). Таким образом, время жизни атома хлора в составе Адамсоновской радикальной пары в метаноле более чем на порядок превышает его время жизни в объеме растворителя. Оно определяется параллельными реакциями (32) и (33).
Константа скорости гибели атома хлора в хлороформе (табл. 2) в 300 раз меньше минимальной кинетической константы скорости его гибели в метаноле. Это позволяет оценить время жизни атома хлора в хлороформе величиной 5 нс.
Подводя итоги сказанному в этом разделе, отметим, что атом хлора в составе Адамсоновской радиальной пары играет главную роль в ранних стадиях фотохимических процессов в метаноле и ацетонитриле. В воде и хлороформе диссоциация радикальной пары (или ее аналога в неполярном растворителе) приводит к диффузии атома хлора в объеме растворителя. После этого ни сам атом хлора, ни продукты его реакций с растворителем не оказывают существенного влияния на реакции комплексов платины. В дальнейших цепных процессах (6)–(11) и (19)–(22) растворитель (вода и хлороформ) играет только роль лиганда. Этим и объясняется кажущееся парадоксальным сходство фотохимии гексахлорплатината(IV) в воде и хлороформе.
3. КОНСТАНТА СКОРОСТИ РЕАКЦИИ ПЕРЕДАЧИ ЦЕПИ
Рассмотрим константы скорости реакций, отвечающих за развитие цепи в разных растворителях.
Ацетонитрил (реакция (27)): k27 = (1.2 ± 0.2) × × 105 M–1 c–1 [10].
Хлороформ (реакция (21)): k21 = (2.1± 0.2) × × 105 M–1 c–1 [9].
Вода (реакция (8)): константа не измерена, есть только оценка из работы [7]. Но, судя по тому факту, что константа диспропорционирования 2k11 = (4.6 ± 0.4) × 106 M–1 c–1 [4] имеет тот же порядок величины, что для ацетонитрила [10] и хлороформа [9], константа скорости продолжения цепи тоже должна быть ∼105 M–1 c–1.
Таким образом, в случаях развития цепных реакций время жизни в типичных условиях эксперимента по лазерному импульсному фотолизу ([${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$]0 ∼ 10–4 М) мы всегда имеем для скорости реакции продолжения цепи (константа скорости kс) kс × [${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$]0 ∼ 10 с–1.
В случае метанола диссоциация интермедиата Pt(III) – комплекса ${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }}$ (реакция (35)) протекает с константой скорости (4.9 ± 0.2) × 103 с–1 [12–14]. Константа скорости гибели последнего интермедиата Pt(III) – комплекса ${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{4}^{ - }$ – не измерена. Предположим, что константа скорости (псевдопервого порядка) реакции ${\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{4}^{ - }$ с растворителем (36) лежит в интервале 102–103 с–1. В этом случае гипотетическая реакция продолжения цепи (42) (аналогичная реакции (27)), которая должна иметь константу скорости ∼105 M–1 c–1 (ее значение не должно сильно отличаться от случаев ацетонитрила и хлороформа), не сможет конкурировать с реакцией (36), и цепи не будут развиваться.
(42)
$\begin{gathered} {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{4}^{ - } + {\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }} \xrightarrow{{{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}}} \\ \to {\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{C}}{{{\text{l}}}_{5}}{{({\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}})}^{ - }} + {\text{P}}{{{\text{t}}}^{{{\text{III}}}}}{\text{Cl}}_{5}^{{2 - }}. \\ \end{gathered} $По всей вероятности, именно указанное соотношение констант скоростей реакций (36) и (42) (или, другими словами, наличие специфического канала обрыва цепи в реакции переносчика цепи с растворителем) является причиной отсутствия цепных фотохимических процессов в простых спиртах.
ЗАКЛЮЧЕНИЕ
В работе показано, что влияние растворителя на фотохимию комплекса ${\text{P}}{{{\text{t}}}^{{{\text{IV}}}}}{\text{Cl}}_{6}^{{2 - }}$ определяется величинами констант скорости сверхбыстрых реакций с участием первичного интермедиата Pt(III) и медленных реакций с участием комплексов Pt(III) – потенциальных переносчиков цепи в цепном процессе фотосольватации. Для доказательства механизмов фотолиза требуется проведение квантово-химических расчетов структуры и ЭСП предполагаемого первичного продукта фотолиза – Адамсоновской радикальной пары.
Список литературы
Hershel J. // Phil. Mag. 1832. № 1. P. 58.
Ford P.C., Petersen J.D., Hintze R.E. // Coord. Chem. Rev. 1974. V. 14. № 1. P. 67.
Glebov E.M., Pozdnyakov I.P., Plyusnin V.F., Khmelinskii I. // J. Photochem. Photobiol. C: Photochem. Rev. 2015. V. 24. P. 1.
Wright R.C., Laurence G.S. // J. Chem. Soc. Chem. Commun. 1972. № 3. P. 132.
Балашев К.П., Васильев В.В., Зимняков А.М., Шагисултанова Г.А // Коорд. Хим., 1984, Т. 10. № 7. С. 976.
Балашев К.П., Блинов И.И., Шагисултанова Г.А. // Журн. Неорг. Хим. 1987. Т. 32. № 10. С. 2470.
Znakovskaya I.V., Sosedova Yu.A., Glebov E.M., Grivin V.P., Plyusnin V.F. // Photochem. Photobiol. Sci. 2005. V. 4. № 11. P. 897.
Глебов Е.М., Коломеец А.В., Поздняков И.П., Гривин В.П., Плюснин В.Ф., Ткаченко Н.В., Лемметяйнен Х. // Изв. АН Сер. Хим. 2013. № 7. С. 1540 [Glebov E.M., Kolomeets A.V., IPozdnyakov.P., Grivin V.P., Plyusnin V.F., Tkachenko N.V., Lemmetyinen H. // Rus. Chem. Bull. Int. Edit. 2013. V. 62. № 7. P. 1540 (Engl. Transl.)].
Matveeva S.G., Grivin V.P., Plyusnin V.F., Vasilchenko D.B., Glebov E.M. // J. Photochem. Photobiol. A: Chem. 2018. V. 359. P. 80.
Matveeva S.G., Pozdnyakov I.P., Grivin V.P., Plyusnin V.F., Mereshchenko A.S., Melnikov A.A., Chekalin S.V., Glebov E.M. // J. Photochem. Photobiol. A: Chem. 2016. V. 325. P. 13.
Поздняков И.П., Глебов Е.М., Матвеева С.Г., Плюснин В.Ф., Мельников А.А., Чекалин С.В. // Изв. АН Сер. Хим. 2015. № 8. С. 1784 [Pozdnyakov I.P., Glebov E.M., Matveeva S.G., Plyusnin V.F., Melnikov A.A., Chekalin S.V. // Russ. Chem. Bull. Int. Edit. 2015. V. 64. № 8. P. 1784 (Engl. Transl.)].
Grivin V.P., Khmelinski I.V., Plyusnin V.F., Blinov I.I., Balashev K.P. // J. Photochem. Photobiol. A: Chem. 1990. V. 51. № 1. P. 167.
Grivin V.P., Khmelinski I.V., Plyusnin V.F. // J. Photochem. Photobiol. A: Chem. 1990. V. 51. № 3. P. 379.
Grivin V.P., Khmelinski I.V., Plyusnin V.F. // J. Photochem. Photobiol. A: Chem. 1991. V. 59. № 1. P. 153.
Vlcek Jr. A. // Coord. Chem. Rev. 2000. V. 200–202. P. 933.
Williams R.J., Dillin D.R., Milligan W.O. // Acta Cryst. 1973. V. B29. № 7. P. 1369.
Jorgensen C.K. // Acta Chem. Scand. 1956. V. 10. № 4. P. 518.
Swihart D.L., Mason W.R. // Inorg. Chem. 1970. V. 9. № 7. P. 1749.
Glebov E.M., Kolomeets A.V., Pozdnyakov I.P., Plyusnin V.F., Grivin V.P., Tkachenko N.V., Lemmetyinen H. // RSC Adv. 2012. V. 2. № 13. P. 5768.
Goursot A., Kirk A.D., Waltz W.L., Porter G.B., Sharma D.K. // Inorg. Chem. 1987. V. 26. № 1. P. 14.
Adamson A.W., Sporer A.H. // J. Am. Chem. Soc. 1958. V. 80. № 15. P. 3865.
Endicott J.F., Ferraundi G.J., Barber J.R. // J. Phys. Chem. 1975. P. 79. № 6. P. 630.
Goursot A., Chermette H., Peigault E., Chanon M., Waltz W.L. // Inorg. Chem. 1984. V. 23. № 22. P. 3618.
Goursot A., Chermette H., Waltz W.L., Lillie J. // Inorg. Chem. 1989. V. 28. № 12. P. 2241.
Waltz W.L., Lillie J., Goursot A., Chermette H. // Inorg. Chem. 1989. V. 28, № 12. P. 2247.
Slater J.C., Johnson K.H. // Phys. Rev. B. 1972. V. 5. № 3. P. 844.
Goursot A., Penigault E., Chermette H. // Chem. Phys. Lett. 1983. V. 97. № 2. P. 215.
Goursot A., Chermette H., Daul C. // Inorg. Chem. 1984. V. 23. № 3. P. 305.
Goursot A., Chermette H. // Can. J. Chem., 1985. V. 63. № 7. P. 1407.
Monreal O., Esmaeli T., Hoggard P.E. // Inorg. Chim. Acta. 1997. V. 265. P. 279.
Monreal P.E., Vogler A. // Inorg. Chim. Acta. 2003. V. 348. P. 229.
Monig J, Bahnemann D., Asmus K.-D. // Chem.-Biol. Interact. 1983. V. 47. № 1. P. 15.
Packer J.E., Wilson R.L., Bahnemann D., Asmus K.-D. // J. Chem. Soc. Perkin Trans. II. 1980. P. 296.
Packer J.E., Mahood J.S., Wilson R.L., Wolfenden B.S. // Int. J. Radiat. Biol. 1981. V. 39. № 2. P. 135.
Балашев К.П., Блинов И.И., Шагисултанова Г.А. // Кинетика и катализ. 1987. V. 28. № 4. С. 801 [Balashev K.P., Blinov I.I., Shagisultanova G.A. // Kinet. Catal. 1987. V. 28. № 4. P. 696 (Engl. Transl.)].
Bhattacharyya D., Zhang Y., Elles Ch.D., Bradforth S.E. // J. Phys. Chem. A. 2019. V. 123. № 27. P. 5789.
Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. М.: Химия, 1987. 322 с.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. С. 130.
Shah D., Kissick K., Ghorpade A., Hannah R., Bhattacharyya D. // J. Membr. Sci. 2000. V. 179. № 1–2. P. 185.
NIST Webbook. https://webbook.nist.gov
Computational Chemistry Comparison and Benchmark Database, http://cccbdb.nist.gov
D’Arrigo C. // Am. J. Physiol. 1978. V. 235. № 1. P. 109.
Chateaneuf J.E. // J. Am. Chem. Soc. 1990. V. 112. № 1. P. 442.
Sumiyoshi T., Miura K., Hagiwara H., Katayama M. // Chem. Lett. 1987. № 7. P. 1429.
Foergeteg S., Berces T. // J. Photochem. Photobiol. A: Chem. 1993. V. 73. № 3. P. 187.
Sumiyoshi T., Katayama M. // Bull. Chem. Soc. Jpn. 1990. V. 63. № 5. P. 1293.
McElroy W.J. // J. Phys. Chem. 1990. V. 94. № 6. P. 2435.
Klaning U.K., Wolff T. // Ber. Bunzenges. Phys. Chem. 1985. V. 89. № 1. P. 243.
Neta P., Huie R.E., Ross A.B. // J. Phys. Chem. Ref. Data. 1988. V. 17. № 3. P. 1027.
Энтелис C.Г., Тигер Р.П. Кинетика реакций в растворах. Количественный учет влияния среды. М.: Химия, 1973. 416 с.
Berdnikov V.M., Doktorov A.B. // Chem. Phys. 1982. V. 69. № 1–2. P. 205.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий