Химия высоких энергий, 2021, T. 55, № 3, стр. 237-240
Моделирование кинетики неокислительной конверсии смеси пропан–вода в плазме барьерного разряда
А. Ю. Рябов a, *, С. В. Кудряшов a, А. Н. Очередько a
a Федеральное государственное бюджетное учреждение науки Институт химии нефти Сибирского отделения РАН
634055 Томск-55, просп. Академический, 4, Россия
* E-mail: andrey@ipc.tsc.ru
Поступила в редакцию 18.12.2020
После доработки 11.01.2021
Принята к публикации 13.01.2021
Аннотация
Исследование продолжает цикл работ по изучению превращений газообразных алканов в плазме барьерного разряда в присутствии воды. Предложена модель химической кинетики неокислительной конверсии пропана, результаты расчeтов хорошо согласуется с экспериментальными данными. Проведен сравнительный анализ кинетики и механизма превращения метана и пропана, который подтвердил основные положения о механизме реакций выдвинутые ранее.
ВВЕДЕНИЕ
Ранее [1] предложен способ конверсии углеводородов С1–С4 в плазме барьерного разряда (БР) в присутствии воды с образованием газообразных и жидких продуктов. Применение воды позволяет избежать нежелательного образования депозита на поверхности электродов реактора.
В работах [2, 3] предложен способ моделирования химической кинетики в БР с использованием эффективной константы скорости электронно-молекулярной реакции (keff) и простого выражения для ее оценки, существенно упрощающий кинетические расчеты. Показано, что результаты моделирования кинетики превращения метана в присутствии воды в БР хорошо согласуются с экспериментальными данными.
Настоящая работа является логическим продолжением исследований [1–3]. Далее приведены результаты моделирования кинетики превращения пропана в БР в присутствии воды с использованием методики, опубликованной в работах [2, 3].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Необходимые для расчетов keff значения констант скорости электронно-молекулярных реакций и дрейфовой скорости электронов получены с использованием программного пакета Bolsig+ [4], сечения рассеяния электронов молекулами пропана и воды взяты из базы данных [5]. Расчет keff для основных каналов диссоциации молекулы пропана выполнен с учетом данных работ [6, 7].
Моделирование кинетики химических реакций проведено с применением программного пакета Kintecus [8] без учета растворения жидких продуктов в воде. Модель химической кинетики превращения пропана в БР включает 169 реакции, набор реакций ограничен процессами с участием пентана, значения констант скорости химических реакций взяты из общедоступной базы данных [9].
Набор наиболее значимых реакций и соответствующие константы скорости приведены в табл. 1. Сокращение набора реакций проведено с применением программного пакета Atropos [10] на основании коэффициентов чувствительности реакций, рассчитанных с использованием Kinteсus.
Таблица 1.
Наиболее значимые реакции и соответствующие константы скорости (k) модели химической кинетики
| № | Реакция | k, см3/с | Источник |
|---|---|---|---|
| 1 | C3H8 → C3H6 + H2 | 7.99 × 10–3 c–1 | Расчет |
| 2 | C3H8 → C2H4 + СH4 | 7.05 × 10–3 c–1 | Расчет |
| 3 | C3H8 → C3H7 + H | 5.17 × 10–3 c–1 | Расчет |
| 4 | C3H8 → C3H4 + 2H2 | 1.64 × 10–3 с–1 | Расчет |
| 5 | C3H8 → C2H5 + СH3 | 9.41 × 10–4 с–1 | Расчет |
| 6 | C3H8→C2H6 + СH2 | 7.05 × 10–5с–1 | Расчет |
| 7 | H2О → ОH + H | 1.36 × 10–4 с–1 | Расчет |
| 8 | C3H6 + H → C3H7 | 1.6 × 10–12 | [11] |
| 9 | C2H4 + H → C2H5 | 1.11 × 10–12 | [12] |
| 10 | C3H4 + H → C3H5 | 5.8 × 10–13 | [13] |
| 11 | H + CH2 → CH + Н2 | 2.01 × 10–10 | [14] |
| 12 | C3H7 + C2H4 → C5H11 | 4.25 × 10–18 | [15] |
| 13 | C3H7 + C3H7 → C6H14 | 2.9 × 10–11 | [16] |
| 14 | C3H7 + C3H4 → C6H11 | 2.99 × 10–18 | [15] |
| 15 | C3H7 + C2H5 → C5H12 | 2.6 × 10–11 | [16] |
| 16 | C2H5 + С2H5 → C4H10 | 1.8 × 10–11 | [18] |
| 17 | CH3 + С3H4 → C4H7 | 5.9 × 10–18 | [15] |
| 18 | CH3 + ОH → CH3ОН | 1.45 × 10–10 | [17] |
| 19 | CH2 + С3Н8 → C4H10 | 1.89 × 10–12 | [19] |
| 20 | СН2 + CH2 → C2H2 + Н2 | 5.3 × 10–11 | [14] |
| 21 | OH + C3H8 → C3H7 + H2O | 9.38 × 10–13 | [20] |
| 22 | OH + C3H6 → CH3CHCH2OH | 3.01 × 10–11 | [21] |
| 23 | OH + C2H4 → CH2CH2OH | 9.0 × 10–12 | [21] |
| 24 | H + CH2CH2OH → C2H5OH | 8.3 × 10–11 | [22] |
| 25 | H + CH3CHCH2OH → C3H7OH | 8.3 × 10–11 | По аналогии с [24] |
| 26 | OH + OH → H2O2 | 2.6 × 10–11 | [23] |
| 27 | C3H7 + C3H5 → C6H12 | 4.24 × 10–11 | [11] |
| 28 | C3H7 + C5H11 → C8H18 | 1.59 × 10–11 | По аналогии с [29] |
| 29 | C3H7 + C4H9 → C7H16 | 1.59 × 10–11 | [24] |
| 30 | CH + С3Н8 → C4H9 | 4.25 × 10–10 | [14] |
| 31 | C2H5 + С5Н11 → C7H16 | 3.4 × 10–11 | [24] |
В табл. 2 приведен расчетный и экспериментальный составы продуктов превращения смеси пропана в присутствии воды [1]. Видно, что наблюдается удовлетворительное согласие между расчетными и экспериментальными данными, некоторое расхождение в содержании этана и бутанов в продуктах реакции, вероятно, связано с упрощением модели на стадии разрядного инициирования реакции. Кроме этого, заниженное значение содержания УВ С5+ обусловлено тем, что в кинетической модели не учитывалось растворение жидких продуктов в воде.
Таблица 2.
Расчетный и экспериментальный составы газообразных продуктов превращения смеси пропан–вода. Приведенная напряженность электрического поля (E/n) = 110 Td, [H2O] = 2 об. %, и соответствует равновесной концентрации при 20°С
| Соединение | Содержание, % | |
|---|---|---|
| Расчет | Эксперимент [1] | |
| Н2 | 30.25 | 29.1 |
| CH4 | 18.41 | 20.3 |
| С2Н4 | 13.28 | 15.4 |
| C2H6 | 3.91 | 13.1 |
| C3H6 | 15.6 | – |
| C4H10 | 2.85 | 8.1 |
| С5+ | 4.56 | 14.0 |
| Кислородсодержащие | 0.14 | < 0.01 |
| Конверсия, % | 9.4 | 10.3 |
Из табл. 1 видно, что образование углеводородов С3+ происходит преимущественно за счет реакций рекомбинации с участием этильных и пропильных радикалов. Реакция СН2 радикала с молекулой пропана вносит незначительный вклад в этот процесс (табл. 1, реакция № 19). В то время как в случае превращения смеси метан-вода образование углеводородов С3+ преимущественно связано с реакцией встраивания CH2 радикала в С–С-связь молекулы углеводорода [2, 3].
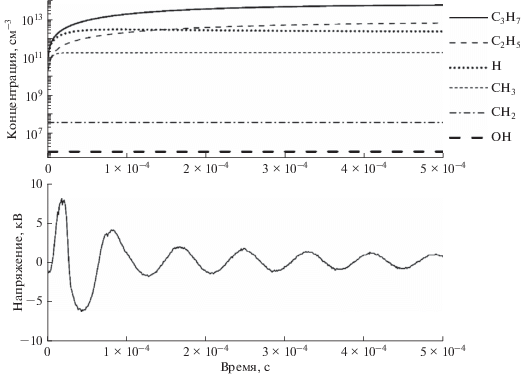
Представленные выше тезисы наглядно проиллюстрированы на рис. 1, на котором приведено изменение концентрации основных радикалов, образующихся при воздействии БР на исходную смесь за один высоковольтный импульс напряжения. Видно, что суммарная концентрация этильных и пропильных радикалов более чем на 3 порядка выше концентрации СН2 радикалов.
Рис. 1.
Изменение концентрации основных радикалов смеси пропан–вода в БР за один импульс напряжения.
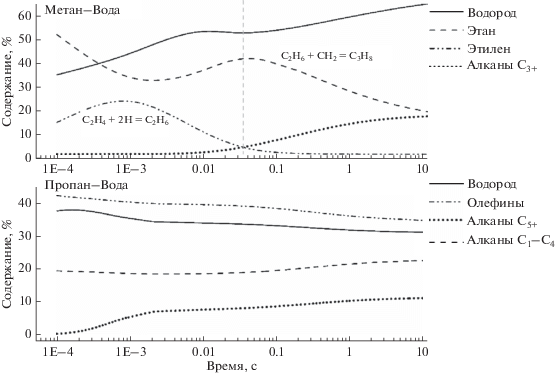
Данная особенность механизма превращения метана и пропана в БР отражается на виде расчeтных кинетических кривых образования продуктов реакции (рис. 2).
В случае превращения метана кинетические кривые образования продуктов реакции имеют преимущественно экстремальный характер, для пропана наблюдается монотонное изменение содержания продуктов реакции от продолжительности воздействия разряда на исходную смесь.
Другой особенностью протекания процессов превращения метана и пропана под действием БР является разнонаправленный ход кинетических кривых образования водорода в продуктах реакции.
На рис. 2 видно, что начальное содержание водорода в обоих случаях сравнимо и составляет около ~35–37%, в дальнейшем содержание водорода в продуктах превращения метана возрастает до ~60%, а при превращении пропана снижается до ~30%.
По-видимому, это связано с тем, что на стадии разрядного инициирования реакции молекулы пропана фрагментируются преимущественно с образованием непредельных соединений (этилена и пропилена). В дальнейшем атомарный водород, образующийся в ходе реакции, расходуется на процессы гидрирования этих соединений.
При превращении как метана, так и пропана в присутствии воды наблюдается образование небольшого количества кислородсодержащих соединений. В обоих случаях основная роль в этих процессах принадлежит реакциям с участием гидроксил радикалов, однако из-за сравнительно низкой скорости диссоциации воды под действием электронов БР этот процесс имеет минорный характер.
ЗАКЛЮЧЕНИЕ
Разработана модель химической кинетики неокислительной конверсии пропана в присутствии воды в БР. Результаты моделирования удовлетворительно согласуются с экспериментальными данными. Установлена 31 наиболее значимая реакция из 169 элементарных процессов механизма превращения, использованных в кинетических расчетах. Проведен сравнительный анализ кинетики и механизма превращения метана и пропана в БР, который подтвердил основные положения о механизме реакций, ранее выдвинутые в работах [1, 3]: 1) конверсия метана и пропана протекает по радикальному механизму; 2) в случае превращения метана образование углеводородов С3+ преимущественно связано с реакцией встраивания CH2 радикала в С–С-связь молекулы углеводорода; 3) образование продуктов реакции из пропана происходит, преимущественно, в результате рекомбинации алкильных радикалов.
Таким образом, предложенный ранее [2, 3] способ моделирования химической кинетики в БР с использованием эффективной константы скорости электронно-молекулярной реакции можно рекомендовать для теоретического исследования кинетики и механизмов плазмохимических реакций в БР с участием органических соединений.
Список литературы
Кудряшов С.В., Рябов А.Ю., Очередько А.Н. // Химия высоких энергий. 2017. Т. 51. № 2. С. 137.
Кудряшов С.В., Рябов А.Ю., Очередько А.Н. // Химия высоких энергий. 2018. Т. 52. № 2. С. 150.
Kudryashov S., Ryabov A., Shchyogoleva G // J. Phys. D: Appl. Phys. 2016. V. 49. P. 025205.
Hagelaar G.J.M., Pitchford L.C. // Plasma Sources Sci. Technol. 2005. V. 14. № 4. P. 722.
Viehland database. http://www.lxcat.net.
Janev R.K., Reiter D. // Phys. Plasmas. 2002. V. 9. № 9. P. 4071.
Janev R.K., Reiter D. // Phys. Plasmas. 2004. V. 11. P. 780.
Ianni J.C. Kintecus V5.5. 2015. http://www.kintecus.com.
NIST Chemical Kinetics Database. http://kinetics.nist.gov.
Ianni J.C. Atropos V1.00, 2003 http://www.kintecus.com/atropos.htm.
Tsang W. // J. Phys. Chem. Ref. Data. 1991. V.2 0. P. 221.
Curran H.J. // Int. J. Chem. Kinet. 2006. V. 38. P. 250.
Warnatz J. // Combustion Chemistry. ed. W.C. Gardiner Jr., pub. Springer-Verlag, NY. 1984.
Baulch D.L., Cobos C.J., Cox, R.A. and et al. // J. Phys. Chem. Ref. Data. 1992. V. 21. P. 411.
Kerr J.A., Parsonage M.J. // Butterworths. London. 1972.
Tsang W. // J. Phys. Chem. Ref. Data. 1988. V. 17. P. 887.
Baulch D.L., Cobos C.J., Cox R.A. et al. // J. Phys. Chem. Ref. Data. 1994. V.23. P. 847.
Tsang W., Hampson R.F. // J. Phys. Chem. Ref. Data. 1986. V. 15. P. 1087.
Halberstadt M.L., Crump J. // J. Photochem. 1973. V. 1.
Walker R.W. // Int. J. Chem. Kinet. 1985. V. 17.
Atkinson R., Baulch D.L., Cox, R.A. and et al. // J. Phys. Chem. Ref. Data. 1997. V. 26. P. 521.
Bartels M., Hoyermann K., Sievert R. // Symp. Int. Combust. Proc. 1982. V. 19.
Atkinson R., Baulch D.L., Cox R.A. et al. // Atmos. Chem. Phys. 2004. V. 4. P. 1461.
Tsang W. // J. Phys. Chem. Ref. Data. 1990. V. 19. P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий