Химия высоких энергий, 2021, T. 55, № 4, стр. 274-280
Промотированный водой фотохимический синтез 12-оксо-6,12-дигидроазепино[2,1-b]хиназолинов при конкурентном образовании 3н-азепин-2(1Н)-онов
А. В. Будруев a, *, Д. А. Давыдов a, М. А. Гиричева a, А. В. Покровская a, Г. К. Фукин b, А. Л. Пронина a
a Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, просп. Гагарина, 23/5, Россия
b Институт металлоорганической химии имени Г.А. Разуваева РАН
603950 Нижний Новгород, ул. Тропинина, 49, Россия
* E-mail: budruev@gmail.com
Поступила в редакцию 03.02.2021
После доработки 06.03.2021
Принята к публикации 12.03.2021
Аннотация
В работе проведена оценка влияния органо-водного растворителя на выходы метилового эфира 12‑оксо-6,12-дигидроазепино[2,1-b]хиназолин-6-карбоновой кислоты и метилового эфира 3Н-азепин-2(1Н)-он-3-карбоновой кислоты. Установлено, что при низких концентрациях вода конкурирует с этиловым эфиром 2-аминобензойной кислоты в реакции нуклеофильного присоединения, уменьшая выходы азепино[2,1-b]хиназолинона и увеличивая выходы 3Н-азепинона. При концентрации воды более 20 мас. % нуклеофильность замещенного анилина увеличивается, способствуя увеличению выходов азепино[2,1-b]хиназолинона и уменьшению выходов 3Н-азепинона.
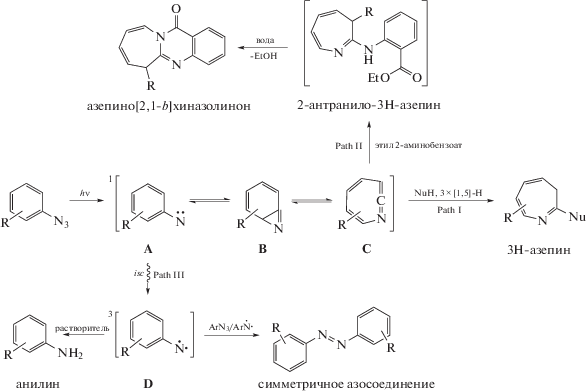
Реакционная способность 1,2-дидегидроазепинов C [1–10], интермедиатов фотолиза арилазидов, во многом определяет направление и селективность фотохимических реакций ароматических азидов (Схема 1 , Path I и II) [11]. Так в нуклеофильных растворителях, таких как вода, эти интермедиаты реагируют с ней с образованием 3H-азепин-2(1Н)-онов [12–17].
На первый взгляд, при проведении реакции в сухих апротонных растворителях, то есть в отсутствии конкуренции нуклеофилов за электрофильный центр, выходы продуктов присоединения нуклеофильных субстратов к 1,2-дидегидроазепинам будут максимальными. Вероятно поэтому, выходы 12-оксо-6,12-дигидроазепино[2,1-b]хиназолинов, полученных при фотолизе арилазидов с 2‑аминобензойной кислотой в смеси ТГФ-вода и 1,4-диоксан-вода, были низкие. [13, 17] (Схема 1 , Path II).
Однако вода не только конкурирует с замещенными анилинами за реакционный центр, но и увеличивает их нуклеофильность [18–22]. В этом случае увеличение ее концентрации в реакционной смеси может привести не к снижению, а к увеличению селективности присоединения анилинов к 1,2-дидегидроазепинам C, то есть к увеличению выходов 2-антранило-3H-азепинов и, следовательно, азепино[2,1-b]хиназолинонов (Схема 1 , Path II).
Хотя наш интерес к разработке новых способов получения этих гетероциклов обусловлен хорошо известной фармакологической активностью хиназолинов [23, 24], оценка влияния растворителей и содержания воды в реакционной смеси на выходы продуктов реакций арилазидов актуальна, так как способствует развитию методологии фотохимического синтеза сложных гетероциклических структур из простых реагентов.
Схема 1 . Основные фотохимические реакции ароматических азидов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
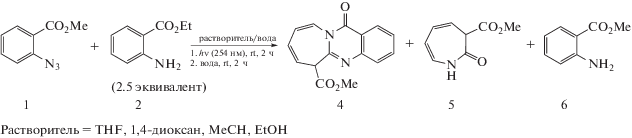
В качестве объектов исследования выбрали метил 2-азидобензоат 1 и этил 2-аминобензоат 2, при облучении образующие метил 12-оксо-6,12-дигидроазепино[2,1-b]хиназолин-6-карбоксилат 4 и метил 3Н-азепин-2(1Н)-он-3-карбоксилат 5 (Схема 2 ).
Схема 2 . Условия фотолиза метилового эфира 2-азидобензойной кислоты с этиловым эфиром 2-аминобензойной кислоты.
Фотолиз проводили в ацетонитриле (марки “О. С. Ч.”, сорт 0), 1,4-диоксане (марки “Х. Ч.”), ТГФ (марки “Х. Ч.”) и этаноле 96%. Все растворители, кроме этанола, сушили и хранили над молекулярными ситами 3 и 4 Å [25].
Спектры ЯМР 1H и 13C регистрировали на спектрометре Varian 400 MR (400 и 100 МГц соответственно) в CDCl3. Масс-спектры записывали на приборе Thermo Electron DSQ II, ионизация ЭУ (70 эВ), прямой ввод. Контроль над степенью конверсии азида и накоплением продуктов реакции осуществляли методом ВЭЖХ на приборе Shimadzu LC-20AD.
Синтез 2-азидобензойной кислоты и метилового эфира 2-азидобензойной кислоты 1 проводили по методикам [17, 26].
Методика фотолиза. Метиловый эфир 2-азидобензойной кислоты 1 (10 мг, 56.5 μмоль) и этиловый эфир 2-аминобензойной кислоты 2 (23.3 мг, 141 μмоль, 2.5 эквив.) растворяли в 10 мл органо-водной смеси и при перемешивании 2 ч облучали ртутно-кварцевыми лампами низкого давления (2 × БУФ-15, 254 нм). Затем к 50 μл фотолитической смеси добавляли 200 μл дист. воды и анализировали на жидкостном хроматографе сразу после смешивания и выдерживания 2 ч.
Метиловый эфир 12-оксо-6,12-дигидроазепино[2,1-b]хиназолин-6-карбоновой кислоты 4. Навеску 35 мг (0.2 ммоль) азида 1 и 82 мг (0.5 ммоль, 2.5 эквив.) амина 2 растворяли в 30 мл сухого 1,4‑диоксана и при перемешивании облучали в кварцевом сосуде 2 ч. Облученный раствор вливали в 150 мл воды и перемешивали 2 ч. Продукт экстрагировали хлороформом (4 × 10 мл), сушили над Na2SO4, сорбировали на 400 мг силикагеля, вносили на колонку с силикагелем, уравновешенную гексаном, и элюировали смесью гексан-этилацетат (8 : 1 v/v). Спектральные данные см. в [17].
Метиловый эфир 3Н-азепин-2(1Н)-он-3-карбоновой кислоты 5. Навеску 35 мг (0.2 ммоль) азида 1 растворяли в 10 мл 1,4-диоксана, добавляли 20 мл воды и при перемешивании облучали 1 ч в кварцевом сосуде. Растворитель удалили, смесь продуктов сорбировали на 400 мг силикагеля, вносили на колонку с силикагелем, уравновешенную гексаном, и элюировали смесью гексан-этилацетат (8 : 1 v/v) и затем гексан-этилацетат (5 : 1 v/v). Выход 23 мг (70%). Бесцветные кристаллы. Т. пл. 110°C. Спектр ЯМР 1Н (СDCl3, δ, м.д., J/Гц): 8.81 (с, 1H Csp2H, азепин), 6.32–6.15 (м, 2H Csp2H, азепин), 5.99–5.82 (м, 2H Csp2H, азепин), 3.83 (с, 3H, OMe), 3.51 (д.д, 1H, J = 5.8, 1.8 Csp3H, азепин). Спектр ЯМР 13C (101 МГц, СDCl3, δ, м.д., J/Гц): 169.0 (O–C=O), 164.7 (N–C=O), 126.8, 125.7, 121.1, 114.8 (Csp2H, азепин), 52.9 (Csp3H, азепин), 52.8 (OMe), согласуется с [15]. Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, %): 167 [M]+ (22), 135 [M‒MeOH]+ (14), 108 [M–MeOC(O)]+ (100), 80 (54), 79 (11), 53 (20), 52 (13).
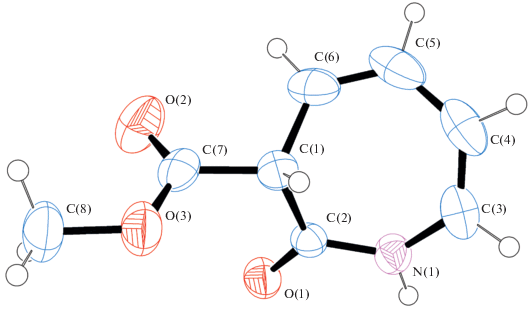
Рентгеноструктурное исследование метилового эфира 3Н-азепин-2(1Н)-он-3-карбоновой кислоты 5 проводили на дифрактометре Bruker Smart Apex (ω-сканирование, излучение МоKα, λ = 0.71073 Å, T = 150 K). Кристаллы (C8H9NO3, молекулярная масса 167.16) моноклинные, пространственная группа P 21/n, a 4.7284(2) Å, b 25.5864(8) Å, c 6.9369(3) Å, α = 90° β = 104.640(4)° γ = 90°, V 812.00(6) Å3, Z 4, dcalc 1.367 мг м–3, μ 0.106 мм–1, F(000) 352.0, 2.80° < Θ < 27.99°; получены при перекристаллизации из гексан–этилацетат (8 : 1, v/v) при температуре 12°С.
Таблица 1.
Выходы 3Н-азепин-2(1Н)-она 5 от содержания воды в органо-водной смеси
| Вода, мас, % | Выходы 3Н-азепин-2(1Н)-она 5, % | ||
|---|---|---|---|
| ацетонитрил | ТГФ | 1,4-диоксан | |
| 0.0 | 0 | 0 | 0 |
| 0.1 | – | – | 32 |
| 1.0 | 38 | 45 | 47 |
| 10.0 | 55 | 60 | 60 |
| 16.0 | 58 | 67 | 69 |
| 20.0 | 61 | 69 | 74 |
| 30.0 | 64 | 73 | 74 |
| 40.0 | 65 | 73 | 69 |
| 50.0 | 67 | 73 | 68 |
| 72.0 | 68 | 71 | 68 |
Интенсивности 14635 отражений (2376 независимых отражений, Rint 0.0278) измерены на дифрактометре Bruker D8 Quest (графитовый монохроматор, λ(Mo-Kα) 0.71073 Å, температура 100 К). Учет поглощения проводили на программе SADABS [27]. Структура решена прямым методом и уточнена методом наименьших квадратов по $F_{{hkl}}^{2}$ с анизотропией тепловых параметров для всех неводородных атомов. Атомы водорода были помещены в геометрически рассчитанные положения и уточнены с использованием модели “наездника”. Финальные факторы расходимости: R1 0.0501 (I > 2σ(I)), wR2 0.1488 (уточнены по $F_{{hkl}}^{2}$ для всех независимых отражений), S(F2) 1.014, ρmax/min 0.277/–0.186 e Å–3. Все вычисления произведены на пакете программного обеспечения SHELXTL [28]. Молекулярная структура соединения 5 построена в программе ORTEP-3 [29]. Полный набор рентгеноструктурных данных для метилового эфира 3Н-азепин-2(1Н)-он-3-карбоновой кислоты 5 депонирован в Кембриджском банке структурных данных (CCDC 1953880).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Структуру метилового эфира 3Н-азепин-2(1Н)-он-3-карбоновой кислоты 5 определили методом рентгеноструктурного анализа (рис. 1) и подтвердили методами масс- и ЯМР спектроскопии, структура азепино[2,1-b]хиназолинона 4 была определена ранее [17].
Рис. 1.
Молекулярное строение соединения 5 в представлении атомов эллипсоидами тепловых колебаний с 50% вероятностью.
Согласно полученным данным (рис. 2–5, кривая 1) фотолиз смеси азида 1 и этилового эфира 2‑аминобензойной кислоты 2 в сухих растворителях приводил к образованию азепино[2,1-b]хиназолинона 4 с выходами 8%. И хотя при облучении в ТГФ и в 1,4-диоксане, содержащих 1 мас. % воды, выходы продукта уменьшались до 2 и 5% соответственно, в целом, выходы азепино[2,1-b]хиназолинона 4 росли с увеличением концентрации воды в фотолитической смеси.
Рис. 2.
Зависимость выходов азепино[2,1-b]хиназолинона 4 (1) и 3Н-азепин-2(1Н)-она 5 (3) от содержания воды в фотолитической смеси и выходы азепино[2,1-b]хиназолинона 4 (2) после добавки воды к облученному раствору.
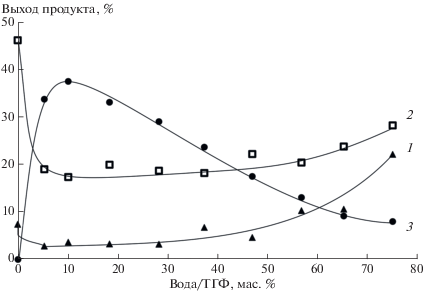
Рис. 3.
Зависимость выходов азепино[2,1-b]хиназолинона 4 (1) и 3Н-азепин-2(1Н)-она 5 (3) от содержания воды в фотолитической смеси и выходы азепино[2,1-b]хиназолинона 4 (2) после добавки воды к облученному раствору.
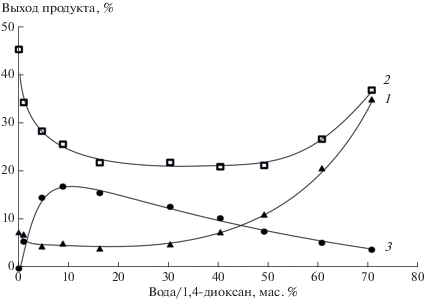
Рис. 4.
Зависимость выходов азепино[2,1-b]хиназолинона 4 (1) и 3Н-азепин-2(1Н)-она 5 (3) от содержания воды в фотолитической смеси и выходы азепино[2,1-b]хиназолинона 4 (2) после добавки воды к облученному раствору.
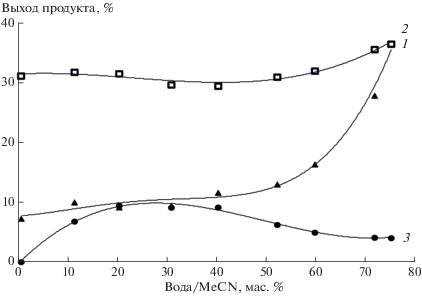
Рис. 5.
Зависимость выходов азепино[2,1-b]хиназолинона 4 (1) и 3Н-азепин-2(1Н)-она 5 (3) от содержания воды в фотолитической смеси и выходы азепино[2,1-b]хиназолинона 4 (2) после добавки воды к облученному раствору.
Невысокие выходы азепино[2,1-b]хиназолинона 4 в этих условиях могли быть обусловлены низкой скоростью внутримолекулярной конденсации 2-антранило-3H-азепинов (Схема 1 , Path II). Как было установлено ранее [17], добавка воды к облученному раствору ускоряла внутримолекулярную конденсацию 2-антранило-3H-азепинов до азепино[2,1-b]хиназолинонов 4. Поэтому после облучения в растворы добавляли воду в 4‑х кратном избытке к объему реакционной смеси. Растворы выдерживали 2 ч при комнатной температуре и повторно определяли содержание гетероцикла 4.
Повторный анализ показал, что выходы азепино[2,1-b]хиназолинона 4 увеличивались во всех случаях, кроме этанола. Причем увеличение выходов было тем существенней, чем меньше воды было в исходной фотолитической смеси (рис. 2–4, кривая 2). Максимальных выходов азепино[2,1-b]хиназолинон 4 достигал при проведении фотолиза в сухом ТГФ (46%). В 1,4-диоксане и ацетонитриле выходы гетероцикла составили 45 и 32% соответственно. В образцах с близким к предельному для растворимости реагентов содержанием воды выходы азепино[2,1-b]хиназолинона 4 составили 28, 32, 37 и 36% в ТГФ, 1,4-диоксане, ацетонитриле и этаноле соответственно.
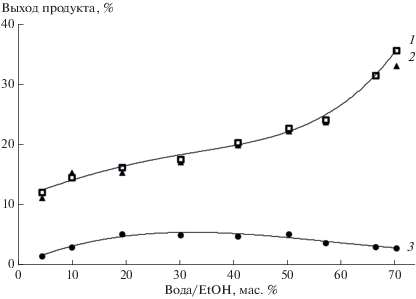
В смесях этанол–вода добавка воды не приводила к изменению выходов азепино[2,1-b]хиназолинона 4 (рис. 5, кривая 2), что, по-видимому, связано с конкурентным присоединением этанола к 1,2-дидегидроазепину С и уменьшением эффективности образования 2-антранило-3H-азепина.
Одновременно с содержанием азепино[2,1-b]хиназолинона 4 в фотолитических смесях определяли выходы метилового эфира 3H-азепин-2(1Н)-он-3-карбоновой кислоты 5 (Схема 2 ), продукта присоединения воды к интермедиату С. Как и предполагалось, в сухих апротонных растворителях 3H-азепин-2(1Н)-он 5 не образовывался. Зависимость его выходов от концентрации воды в реакционных смесях имела экстремальный характер (рис. 2–4, кривая 3). В ТГФ и 1,4‑диоксане, содержащих 10 масс.% воды, выходы 3H‑азепин-2(1Н)-она 5 достигали 38 и 17% соответственно, а в ацетонитриле с 20 масс.% воды его выходы составили 10%. При увеличении концентрации воды в растворах выходы 3H-азепин-2(1Н)-она 5 уменьшались, и в образцах с предельным для растворимости реагентов количеством воды они составили 8, 4 и 4% для ТГФ, 1,4-диоксана и ацетонитрила соответственно. Выходы 3H-азепин-2(1Н)-она 5 в смесях этанол−вода были низкими и не превышали 5% (рис. 5, кривая 3).
Добавка воды в облученные растворы не приводила к изменению выходов соединения 5.
Увеличение выходов 3H-азепин-2(1Н)-она 5 в ряду ацетонитрил, 1,4-диоксан, ТГФ, по-видимому, связано с уменьшением скорости конверсии интермедиата C в триплетный нитрен (через бензазирин B и синглетный нитрен A, Схема 1 , Path III) [8]. В этом случае уменьшение доли органического растворителя в реакционной смеси должно приводить к уменьшению концентрации интермедиата С и, следовательно, к уменьшению выходов гетероциклов 4 и 5.
Таким образом, по-видимому, на выходы 3H‑азепин-2(1Н)-она 5 в органо-водных смесях влияло, с одной стороны, содержание воды в реакционной смеси, а с другой стороны – увеличение нуклеофильности анилина 2 в смесях с высоким содержанием воды.
Для проверки этих предположений были определены выходы метилового эфира 3H-азепин-2(1Н)-он-3-карбоновой кислоты 5, образующегося при фотолизе азида 1, в серии органо-водных смесей без добавления этилового эфира 2-аминобензойной кислоты 2.
Хроматографический анализ облученных растворов показал (табл. 1), что уже незначительное содержание воды в реакционной смеси приводило к образованию 3H-азепин-2(1Н)-она 5. Так в 1,4-диоксане, содержащем 0.1 мас. % воды, выходы гетероцикла 5 составили 32%, а при фотолизе в смеси с 20 мас. % воды достигли 74%. Выходы 3H‑азепин-2(1Н)-она 5 в органо-водных смесях, содержащих около 70 масс.% воды, снижались до 68%.
В качестве побочных продуктов фотолиза арилазида 1 в органо-водной смеси обнаружены: метиловый эфир 2-аминобензойной кислоты 6 – продукт реакций триплетных нитренов (Схема 1 , Path II), и азепино[2,1-b]хиназолинон 4 – продукт реакции амина 6 с интермедиатом С. Их выходы увеличивались с ростом концентрации воды, но не превышали 4 и 2% соответственно.
Таким образом, при фотолизе азида 1 с амином 2 в смесях, содержащих более 20% воды, на выходы 3H-азепин-2(1Н)-она 5 существенное влияние оказывал не столько избыток воды, сколько наличие в реакционной смеси замещенных анилинов.
ЗАКЛЮЧЕНИЕ
Установлено, что при фотолизе метилового эфира 2-азидобензойной кислоты вода промотирует как стадию нуклеофильного присоединения эфира 2-аминобензойной кислоты к образующемуся 1,2-дидегидроазепину С, так и стадию замыкания пиримидинового кольца азепино[2,1-b]хиназолинона 4. В низких концентрациях вода конкурирует с амином в реакции нуклеофильного присоединения, увеличивая выходы 3H-азепин-2(1Н)-она 5. Однако при высоких концентрациях воды нуклеофильность сложного эфира 2-аминобензойной кислоты 2 возрастает, увеличивая выход азепино [2,1-b]хиназолинона 4.
Список литературы
Doering W.v.E., Odum R. // Tetrahedron. 1966. V. 22. № 1. P. 81.
Sundberg R.J., Suter S.R., Brenner M. // J. Am. Chem. Soc. 1972. V. 94. № 2. P. 513.
Schrock A.K., Schuster G.B. // J. Am. Chem. Soc. 1984. V. 106. № 18. P. 5228.
Shields C.J., Chrisope D.R., Schuster G.B. et al. // J. Am. Chem. Soc. 1987. V. 109. № 15. P. 4723.
Scriven E. Current Aspects of the Solution Chemistry of Arylnitrenes // Reactive Intermediates Springer, 1982. C. 1-54.
Scriven E.F., Turnbull K. // Chem. Rev. 1988. V. 88. № 2. P. 297.
Li Y.Z., Kirby J.P., George M.W. et al. // J. Am. Chem. Soc. 1988. V. 110. № 24. P. 8092.
Gritsan N., Platz M.S. // Chem. Rev. 2006. V. 106. № 9. P. 3844.
Azides and nitrenes: reactivity and utility / Scriven E.: Elsevier, 2012.
Inui H., Sawada K., Oishi S. et al. // J. Am. Chem. Soc. 2013. V. 135. № 28. P. 10246.
Xue J., Luk H.L., Eswaran S. et al. // J. Phys. Chem. A. 2012. V. 116. № 22. P. 5325.
Purvis R., Smalley R.K., Suschitzky H. et al. // J. Chem. Soc., Perkin Trans. 1. 1984. P. 249.
Lamara K., Smalley R.K. // Tetrahedron. 1991. V. 47. № 12–13. P. 2277.
Budruev A.V., Karyakina L.N., Oleinik A.V. // High Energ. Chem. 2004. V. 38. № 1. P. 20.
Bou-Hamdan F.R., Lévesque F., O’Brien A.G. et al. // Beilstein J. Org. Chem. 2011. V. 7. № 1. P. 1124.
Sinjagina D.Y., Budruev A.V. // High Energ. Chem. 2013. V. 47. № 4. P. 162.
Budruev A.V., Dzhons D.Y., Faerman V.I. et al. // Chem. Heterocycl. Compd. 2016. V. 52. № 9. P. 694.
Brotzel F., Chu Y.C., Mayr H. // J. Org. Chem. 2007. V. 72. № 10. P. 3679.
De K., Legros J., Crousse B. et al. // J. Org. Chem. 2009. V. 74. № 16. P. 6260.
Phippen C.B., Beattie J.K., McErlean C.S. // Chem. Commun. 2010. V. 46. № 43. P. 8234.
Rulev A.Y. // Russ. Chem. Rev. 2011. V. 80. № 3. P. 197.
Fedotova A., Kondrashov E., Legros J. et al. // C. R. Chim. 2018. V. 21. № 7. P. 639.
Nepali K., Bande M.S., Sapra S. et al. // Med. Chem. Res. 2012. V. 21. № 7. P. 1271.
Rayees S., Satti N.K., Mehra R. et al. // Med. Chem. Res. 2014. V. 23. № 9. P. 4269.
Williams D.B.G., Lawton M. // J. Org. Chem. 2010. V. 75. № 24. P. 8351.
Budruev A.V., Karyakina L.N., Oleinik A.V. // High En. Chem. 2003. V. 37. № 1. P. 29.
Sheldrick G. // SADABS, Bruker/Siemens Area Detector Absorption Correction Program, v. 2014/2; Bruker AXS: Madison, WI.
Sheldrick G. // Inc., Madison (WI, USA). 2000. V. 10.
Farrugia L.J. // J. Appl. Crystallogr. 2012. V. 45. № 4. P. 849.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий