Химия высоких энергий, 2021, T. 55, № 5, стр. 366-373
Гидролитическая стабильность и фотостабильность борных комплексов дибензоилметана с различными заместителями у атома бора
Д. С. Ионов a, *, И. В. Ионова a, Н. А. Лобова a, c, Ю. Н. Кононевич b, А. С. Белова b, Д. А. Бургарт c, d, В. А. Сажников a, c, А. М. Музафаров b, e, М. В. Алфимов a, c
a Центр фотохимии, ФНИЦ “Кристаллография и фотоника”, Российская академия наук
119421 Москва, Россия
b Институт элементоорганических соединений им. А.Н. Несмеянова, Российская академия наук
119991 Москва, Россия
c Московский физико-технический институт (государственный университет)
141707 Долгопрудный, Россия
d Институт радиотехники и электроники им. В.А. Котельникова, Российская Академия наук
125009 Москва, Россия
e Институт синтетических полимерных материалов им. Н.С. Ениколопова, Российская академия наук
117393 Москва, Россия
* E-mail: dmitriy.ionov@gmail.com
Поступила в редакцию 16.04.2021
После доработки 03.05.2021
Принята к публикации 11.05.2021
Аннотация
Исследованы основные фотофизические характеристики и изучены гидролитическая стабильность и фотостабильность борных комплексов дибензоилметана, содержащих различные заместители у атома бора. Установлено, что гидролитическая стабильность исследуемых комплексов увеличивается в ряду DBMBO < DBMBF2 < DBMB(C6F5)2. Из полученных данных рассчитаны константы скорости реакции гидролиза и энергии (${{E}_{A}}$), энтальпии ($\Delta {{H}_{ \ne }}$) и энтропии ($\Delta {{S}_{ \ne }}$) активации. Изучение фотостабильности борных комплексов дибензоилметана показало, что фотодеградация исследуемых соединений в ацетонитриле увеличивается в ряду DBMBF2 < DBMBO < DBMB(C6F5)2 и коррелирует с изменением $\Delta {{H}_{ \ne }}$ гидролиза.
ВВЕДЕНИЕ
В настоящее время наблюдается повышенный интерес к изучению различных органических флуорофоров на основе комплексов бора. Благодаря разнообразным фотофизическим свойствам производные дибензоилметаната дифторида бора (DBMBF2) занимают особое место среди представителей данного класса соединений и находят широкое применение в различных областях, например, для создания биосенсоров, оптоэлектронных устройств, для визуализации биологических объектов и др. [1–4]. Перспективным направлением использования рассматриваемых комплексов является создание химических датчиков. Производные DBMBF2 могут быть успешно использованы для определения кислорода [5], для распознавания ароматических углеводородов в газовой фазе [6–12] и растворах [13, 14], для определения газообразного HCl [15] и т.д. Основным недостатком, ограничивающим широкое использование производных DBMBF2, является их низкая гидролитическая стабильность и фотодеградация. Решение данных проблем позволит существенно расширить область их применения. Несмотря на большую распространенность флуоресцентных комплексов бора, в литературе практически отсутствуют систематические работы по изучению стабильности этих соединений. Ранее была изучена фотостабильность DBMBF2 в различных растворителях [16], однако вопрос о влиянии структуры производного DBMBF2 на фотостабильность до сих пор не исследовался. Таким образом, установление взаимосвязи между структурой и гидролитической стабильностью и фотостабильностью соединений данного класса представляет большой практический интерес. В настоящей работе изучены фотофизические свойства, гидролитическая стабильность и фотостабильность трех борных комплексов дибензоилметана, содержащих заместители разной природы при атоме бора: DBMBF2, DBMBO и DBMB(C6F5)2 (рис. 1).
МЕТОДИКА ЭКСПЕРИМЕНТА
Материалы. Флуорофоры DBMBF2, DBMBO и DBMB(C6F5)2 были получены способами, описанными ранее [17–19].
Измерение спектрально-люминесцентных характеристик флуорофоров. UV/VIS спектры поглощения измеряли с использованием спектрофотометра Shimadzu UV-3101PC. Спектры флуоресценции получали с использованием спектрофлуориметра Аgilent Cary Eclipse. Квантовые выходы флуоресценции измеряли относительно стандарта 9,10-дифенилантрацена в циклогексане, кислород был удален путем продувки азотом. Квантовый выход стандарта считали φ = 0.95 [20]. Времена жизни флуоресценции измеряли с использованием времяразрешенного спектрофлуориметра Picoquant Fluotime 300. Возбуждение осуществлялось импульсным пикосекундным диодным лазером Picoquant LDH-P-C-375B с длиной волны 375 нм. Фитинг полученных данных выполнялся с использованием программы Picoquant EasyTau 2.
Исследование гидролитической стабильности. 1 мг красителя растворяли в 50 мл ацетона. 3 мкл полученного раствора смешивали с 3 мл деионизованной воды с сопротивлением 18 Мом см и переносили в кварцевую кювету с длиной оптического пути 1 см для дальнейшего анализа на спектрофлуориметре Cary Eclipse, оснащенном термостатом на основе элемента Пельтье. Исследуемые растворы термостатировали при заданной температуре в диапазоне от 25 до 60°С с шагом 5°С. Период регистрации спектров выбирался в зависимости от скорости наблюдаемых изменений в диапазоне 2–5 мин, а длительность эксперимента – в диапазоне 40–80 мин.
Исследование фотостабильности. Для изучения фотостабильности DBMBF2, DBMBO и DBMB(C6F5)2 были приготовлены растворы соединений в ацетонитриле с концентрацией ≈10–5 моль/л. Облучение растворов проводили в течение 45 мин с интервалом 5 мин в кварцевой кювете марки КУ-1 с длиной оптического пути 1 см с использованием ртутно-ксеноновой лампы Hamamatsu LC-8 (средняя мощность ~143 Вт/м2) при комнатной температуре. Расстояние от источника света до центра кюветы было равным 15 см. Запись спектров поглощения проводилась на спектрофотометре Shimadsu UV-3101PC. При наблюдении кинетики фотодеградации соединений (в течение 240 мин) временной интервал записи спектров постепенно увеличивался (0–30 мин: запись каждые 5 мин, 30–60 мин: запись каждые 10 мин, 60–240 мин: запись каждые 60 мин).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
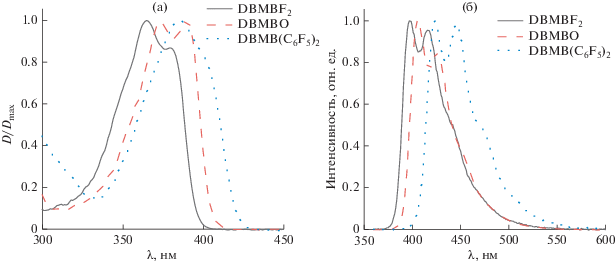
Структуры исследуемых комплексов представлены на рис. 1. На рис. 2 приведены нормированные спектры поглощения и флуоресценции комплексов в дихлорметане (ДХМ). Спектры поглощения и флуоресценции в ацетоне по форме не отличаются от полученных в ДХМ.
В табл. 1 представлены результаты измерений квантовых выходов (φ) и времен жизни флуоресценции (τ), а также рассчитанные из полученных данных значения константы скорости флуоресценции (kr) и константы скорости безызлучательной дезактивации возбужденного состояния (knr) для изученных соединений. При переходе от дихлорметана к ацетону для DBMBF2 и DBMBO наблюдается уменьшение φ и увеличение knr. Ранее для DBMBF2 было показано, что основным каналом безызлучательного распада является внутренняя конверсия, обусловленная вращательными колебаниями фенильных групп [21–23]. По мере увеличения вязкости растворителя (вязкость ацетона η = 0.306 мПа с, дихлорометана η = = 0.413 мПа с) энергия активации вращения фенильных групп увеличивается, что приводит к уменьшению константы скорости внутренней конверсии. Значения knr для DBMBO в ацетоне и ДХМ изменяются также, как и для DBMBF2. Поэтому для DBMBO можно предположить аналогичный механизм безызлучательной дезактивации. Однако, полученные knr в случае DBMBO значительно меньше, а разница между значениями в исследуемых растворителях близка к точности измерений. Уменьшение значения knr для DBMBO свидетельствует о существенном повышении энергии активации вращения фенильных групп, которое происходит, по-видимому, вследствие стабилизации плоской конформации молекулы. Стабилизация происходит, предположительно, в результате увеличения взаимодействия π-систем фенильных колец и хелатного цикла, в котором у атома бора отсутствуют группы, понижающие электронную плотность. Изменения knr для DBMB(C6F5)2 при переходе от ДХМ к ацетону имеет противоположную направленность, следовательно, процесс безылучательного распада данного комплекса не зависит от вязкости и не связан с вращением фенильных колец.
Таблица 1.
Спектрально-люминесцентные характеристики комплексов: $\lambda _{{\max }}^{{abs}}$ – длина волны максимума спектра поглощения, $\lambda _{{\max }}^{{fl}}$ – длина волны максимума спектра флуоресценции, φ – квантовый выход флуоресценции, τ – время жизни флуоресценции, kr – константа скорости флуоресценции, knr – константа скорости безызлучательной дезактивации возбужденного состояния
| Комплекс | Растворитель | $\lambda _{{\max }}^{{abs}}$, нм | $\lambda _{{\max }}^{{fl}}$, нм | φ | τ, нс | kr × 106, c–1 | knr × 106, c–1 |
|---|---|---|---|---|---|---|---|
| DBMBF2 | ДХМ | 365 | 397 | 0.23 ± 0.01 | 0.50 ± 0.01 | 460 ± 30 | 1560 ± 30 |
| Ацетон | 365 | 397 | 0.14 ± 0.01 | 0.34 ± 0.01 | 410 ± 30 | 2560 ± 30 | |
| DBMBO | ДХМ | 390 | 406 | 0.84 ± 0.03 | 1.63 ± 0.01 | 520 ± 30 | 94 ± 30 |
| Ацетон | 390 | 406 | 0.75 ± 0.03 | 1.58 ± 0.01 | 480 ± 30 | 150 ± 30 | |
| DBMB(C6F5)2 | ДХМ | 386 | 423 | 0.37 ± 0.02 | 1.44 ± 0.01 | 250 ± 20 | 440 ± 20 |
| Ацетон | 386 | 423 | 0.54 ± 0.02 | 2.28 ± 0.01 | 240 ± 20 | 200 ± 20 |
Исследование гидролитической стабильности
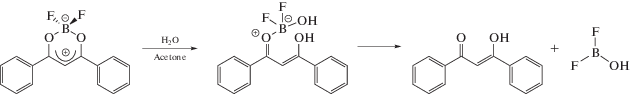
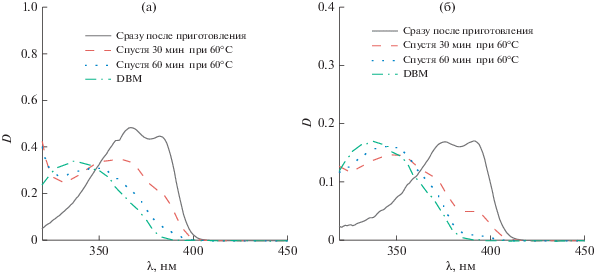
При хранении растворов борных комплексов дибензоилметана в гидрофобных органических растворителях в течение трех месяцев не наблюдается изменений спектров поглощения, что свидетельствует об их стабильности. В случае полярных растворителей, содержащих примеси воды, уже после нескольких часов после приготовления растворов наблюдаются изменения спектров поглощения, проявляющиеся в сдвиге максимума поглощения в область более коротких длин волн. Наблюдаемые изменения можно объяснить разложением комплекса и образованием дибензоилметана (DBM), имеющего более коротковолновый спектр поглощения с максимумом при 340 нм. При 50% воды в ацетоне при 60°С спектр поглощения соответствующего комплекса за час почти полностью переходит в спектр поглощения DBM, как показано на рис. 3.
Рис. 3.
Электронные спектры поглощения растворов DBMBF2 (a) и DBMBO (б) в смеси ацетон/вода 50%/50% v/v, выдержанных в течение различных интервалов времени при 60°С. Спектры поглощения дибензоилметана представлены для сравнения.
Предположительный механизм гидролиза борных комплексов дибензоилметана, на примере DBMBF2, представлен на cхеме 1.
Схема 1 . Предполагаемый механизм гидролиза DBMBF2.
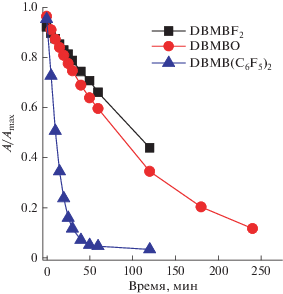
Рассматриваемые комплексы являются эффективными флуорофорами, в отличие от продуктов гидролитического разложения, которые не флуоресцируют. Поэтому гидролитическая деградация комплексов изучалась путем измерения зависимости спектров флуоресценции их растворов от времени. На рис. 4 в качестве примера представлены спектры флуоресценции DBMBF2 при 45°С, полученные в различные моменты времени. По мере деградации комплексов наблюдается падение интенсивности флуоресценции, при этом форма спектра не меняется, что свидетельствует об отсутствии флуоресценции продуктов распада. Как можно видеть из представленных результатов, гидролитическая стабильность изменяется в ряду DBMBO < DBMBF2 < DBMB(C6F5)2. Полученную зависимость можно объяснить совокупным влиянием стерического и гидрофобного факторов объемистых заместителей –C6F5 у атома бора. Стерический фактор пентафторфенильных колец делает атом бора, подвергающийся атаке в процессе гидролиза, менее доступным для взаимодействия. Гидрофобный эффект существенно препятствует сольватации и разделению продуктов гидролиза, что в совокупности определяет максимальную гидролитическую стабильность DBMB(C6F5)2 в ряду перечисленных аналогов.
Рис. 4.
Изменение спектров флуоресценции DBMBF2 (a), DBMBO (б) и DBMB(C6F5)2 (в) со временем при 45°C.
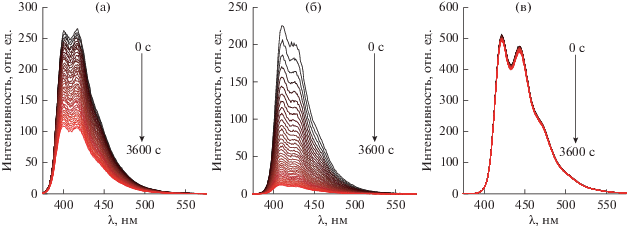
В эксперименте использовались концентрации, соответствующие оптической плотности D ≈ 0.1. При данной оптической плотности доля поглощенного света и интенсивность флуоресценции прямо пропорциональна оптической плотности и, соответственно, концентрации флуорофоров в растворе.
На рис. 5 представлены зависимости от времени логарифма отношения интенсивности флуоресценции I на длине волны максимума спектра флуоресценции (см. табл. 1) к интенсивности флуоресценции в начальный момент времени I0 для молекул DBMBF2, DBMBO и DBMB(C6F5)2 в водно-ацетоновой смеси 50% : 50% v/v при различной температуре. Для рассматриваемых флуорофоров и экспериментальных условий зависимости линейны. Поэтому реакция гидролиза описывается уравнением первого порядка, и для интенсивностей флуоресценции справедливо уравнение:
где $k$ – константа скорости реакции.Рис. 5.
Зависимость $\ln \frac{I}{{{{I}_{0}}}}~$ от времени для DBMBF2 (а), DBMBO (б) и DBMB(C6F5)2 (в) при различной температуре.
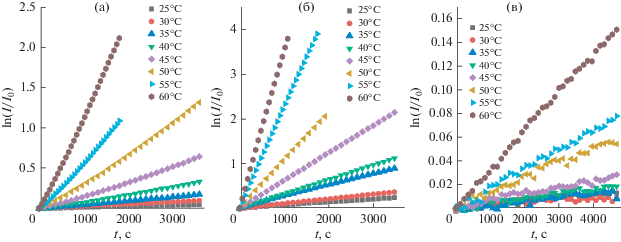
В табл. 2 представлены константы скорости реакции гидролиза для молекул DBMBF2, DBM-BO и DBMB(C6F5)2, полученные при различной температуре.
Таблица 2.
Константы скорости реакции гидролиза DBMBF2, DBMBO и DBMB(C6F5)2 при различной температуре
| T, °С | k × 106, c–1 | ||
|---|---|---|---|
| DBMBF2 | DBMBO | DBMB(C6F5)2 | |
| 25 | 17 ± 1 | 70 ± 1 | 3.1 ± 0.1 |
| 30 | 30 ± 1 | 105 ± 1 | 2.2 ± 0.1 |
| 35 | 58 ± 1 | 262 ± 2 | 3.0 ± 0.1 |
| 40 | 110 ± 2 | 324 ± 1 | 4.3 ± 0.1 |
| 45 | 230 ± 4 | 621 ± 1 | 5.9 ± 0.1 |
| 50 | 470 ± 10 | 1070 ± 2 | 12.7 ± 0.2 |
| 55 | 770 ± 16 | 2270 ± 5 | 16.5 ± 0.2 |
| 60 | 1530 ± 35 | 3560 ± 10 | 32.6 ± 0.1 |
Полученные температурные зависимости констант скоростей линейны в координатах Аррениуса и Эрринга (см. рис. 6):
где B – предэкспоненциальный множитель, EA – энергия активации, R – универсальная газовая постоянная, T – абсолютная температура.Рис. 6.
Зависимость $k~$ от температуры для DBMBF2 – (◼), DBMBO – ( ) и DBMB(C6F5)2 – (
) и DBMB(C6F5)2 – ( ) в координатах Аррениуса (а) и Эйринга (б), линиями показаны результаты линейной
аппроксимации.
) в координатах Аррениуса (а) и Эйринга (б), линиями показаны результаты линейной
аппроксимации.
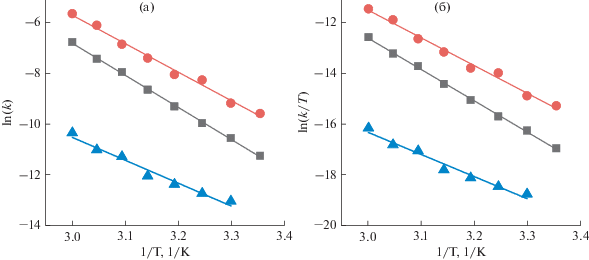
Полученные энергии, представленные в табл. 3, хорошо согласуются с вычисленными ранее для спироборатного комплекса куркумина [24]. Как можно видеть из полученных результатов в ряду DBMBF2, DBMBO, DBMB(C6F5)2 возрастает $\Delta {{H}_{ \ne }}$ с одновременным падением $\Delta {{S}_{ \ne }}$. Гидролитическая стабильность DBMB(C6F5)2 обусловлена, прежде всего, энтропийным фактором. Для DBMB(C6F5)2$\Delta {{S}_{ \ne }}$ почти на 100 Дж/моль·K меньше, чем у DBMBO, что подтверждает предположение о влиянии стерического и гидрофобного факторов объемистых заместителей –C6F5, сделанное выше. При этом энтальпия активации для DBMB(C6F5)2 существенно ниже, чем у DBMBO и DBMBF2. Понижение $\Delta {{H}_{ \ne }}$ в рассматриваемом ряду, по-видимому, связано с уменьшением энергии разрыва связи =O–B. Эта связь в комплексе DBMB(C6F5)2 становится менее устойчивой из-за сильного электроноакцепторного эффекта групп –C6F5.
Таблица 3.
Энергия (EA), энтальпия ($\Delta {{H}_{ \ne }}$), энтропия ($\Delta {{S}_{ \ne }}$) активации реакции гидролиза
| Вещество | ln(B) | EA, кДж/моль | $\Delta {{H}_{ \ne }}$, кДж/моль | $\Delta {{S}_{ \ne }}$, Дж/моль · K |
|---|---|---|---|---|
| DBMBF2 | 31 ± 0.5 | 106 ± 1 | 103 ± 1 | 6 ± 4 |
| DBMBO | 28 ± 1 | 94 ± 3 | 91 ± 3 | –19 ± 12 |
| DBMB(C6F5)2 | 17 ± 2 | 75 ± 5 | 72 ± 5 | –114 ± 17 |
Исследование фотостабильности
На рис. 7 представлены кинетические кривые, которые были построены по нормированным значениям оптической плотности растворов, измеренной на длинноволновом плече поглощения на длинах волн 370, 390 и 390 нм соответственно.
Скорость фотодеградации разбавленных растворов в ацетонитриле увеличивается в ряду DBMBF2 < DBMBO < DBMB(C6F5)2. Полученные результаты коррелируют с изменением энтальпии активации гидролиза $\Delta {{H}_{ \ne }}$ и связаны, предположительно, с уменьшением энергии разрыва связи =O–B, что соответствует гипотезе о механизме фотодеградации DBMBF2, предложенной в работе [16].
ЗАКЛЮЧЕНИЕ
Исследование гидролитической стабильности трех борных комплексов дибензоилметана: DBMBF2, DBMBO и DBMB(C6F5)2, содержащих заместители разной природы при атоме бора, в водно-ацетоновой смеси показало, что гидролитическая стабильность исследуемых комплексов изменяется в ряду DBMBO < DBMBF2 < < DBMB(C6F5)2. Рассчитанные константы скорости реакции гидролиза и энергии активации $\Delta {{H}_{ \ne }}~$и $\Delta {{S}_{ \ne }}$ дают основание полагать, что повышенная гидролитическая стабильность DBMB(C6F5)2 обусловлена энтропийным фактором, связанным, предположительно, со стерическим эффектом и гидрофобностью фрагмента B(C6F5)2. Изучение фотостабильности борных комплексов дибензоилметана показало, что фотодеградация исследуемых соединений в ацетонитриле увеличивается в ряду DBMBF2 < DBMBO < DBMB(C6F5)2, что коррелирует с падением $\Delta {{H}_{ \ne }}$ гидролиза и связано, по-видимому, с понижением стабильности связи =O–B. Таким образом, введение –C6F5 у атома бора значительно повышает гидролитическую стабильность борных комплексов. Для достижения фотостабильности необходимо увеличить энергию разрыва связи =O–B, что, предположительно, можно достичь введением электронодонорных заместителей в DBM.
Список литературы
Chen P.-Z., Niu L.-Y., Chen Y.-Z., et al. // Coord. Chem. Rev. 2017. V. 350. P. 196.
Tanaka K., Chujo Y. // NPG Asia Mater. 2015. V. 7. № 11. P. e223.
Frath D., Massue J., Ulrich G. et al. // Angew. Chemie Int. Ed. 2014. V. 53. № 9. P. 2290.
Li D., Zhang H., Wang Y. // Chem. Soc. Rev. 2013. V. 42. № 21. P. 8416.
Daly M.L., Kerr C., DeRosa C.A., et al. // ACS Appl. Mater. Interfaces. 2017. V. 9. № 37. P. 32008.
Ионов Д.С., Сажников В.А., Юрасик Г.А. и др. // Химия высоких энергий. 2018. Т. 52. № 6. С. 473.
Ионов Д.С., Юрасик Г.А., Кононевич Ю.Н. и др. // Российские нанотехнологии. 2017. Т. 12. № 7–8. С. 13.
Ионов Д.С., Юрасик Г.А., Антонов А.В. и др. // Химия высоких энергий. 2015. Том. 49. № 3. С. 210.
Сажников В.А., Музафаров А., Копысов В.Н. и др. // Российские нанотехнологии. 2012. Т. 7. № 1–2. С. 24.
Ionov D., Yurasik G., Kononevich Y. et al. // Procedia Eng. 2016. V. 168. P. 3415.
Arias Espinoza J.D., Sazhnikov V., Smits E.C.P. et al. // J. Fluoresc. 2014. V. 24. № 6. P. 1735.
Ионов Д.С., Юрасик Г.А., Молчанов С.П. и др. // Российские нанотехнологии. 2016. Т. 11. № 7–8. С. 55.
Kononevich Y.N., Sazhnikov V.A., Belova A.S. и дp. // New J. Chem. 2019.
Chaudhuri T., Salampuria S., Mukhopadhyay C. et al. // J. Photochem. Photobiol. A Chem. Elsevier B.V. 2012. V. 248. P. 55.
Kobayashi H., Ogawa M., Alford R. et al. // Chem. Rev. 2010. V. 110. № 5. P. 2620.
Захарова Г.В., Чибисов А.К., Сажников В.А., и др. // Химия высоких энергий. 2013. Т. 47. № 6. С. 477.
Sakai A., Tanaka M., Ohta E. et al. // Tetrahedron Lett. 2012. V. 53. № 32. P. 4138.
Hartmann H. // J. fur Prakt. Chemie. 1986. V. 328. № 5–6. P. 755.
Nagai A., Kokado K., Nagata Y. et al. // J. Org. Chem. 2008. V. 73. № 21. P. 8605.
Rurack K. // Standardization and Quality Assurance in Fluorescence Measurements I. Berlin, Heidelberg: Springer Berlin Heidelberg. P. 101–145.
Harju T.O., Erostyák J., Chow Y.L. et al. // Chem. Phys. 1994. V. 181. № 1–2. P. 259.
Harju T.O. // J. Mol. Struct. THEOCHEM., 1996. V. 360. № 1–3. P. 135.
Harju T.O., Korppi-Tommola J.E.I., Huizer A.H. et al. // J. Phys. Chem. 1996. V. 100. № 9. P. 3592.
John J., Rugmini S.D., Nair B.S. // Orient. J. Chem. 2017. V. 33. № 2. P. 849.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий