Химия высоких энергий, 2021, T. 55, № 5, стр. 339-346
Взаимодействие наночастиц золота с цианиновыми красителями в холестерических субмикрочастицах ДНК
В. Н. Морозов a, *, М. А. Климович a, b, М. А. Колыванова a, b, О. В. Дементьева c, В. М. Рудой c, В. А. Кузьмин a
a Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, ул. Косыгина, 4, Россия
b Федеральный медицинский биофизический центр им. А.И. Бурназяна ФМБА России
123098 Москва, ул. Живописная, 46, Россия
c Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
* E-mail: morozov.v.n@mail.ru
Поступила в редакцию 21.04.2021
После доработки 03.05.2021
Принята к публикации 11.05.2021
Аннотация
Методом спектроскопии кругового дихроизма исследованы структурные изменения в частицах холестерической жидкокристаллической дисперсии (ХЖКД) ДНК при образовании комплексов цианиновых красителей SYBR Green I (SG) и PicoGreen (PG) с отрицательно заряженными наночастицами золота (НЧЗ). Показано, что в присутствии красителей разрушение холестерической упаковки ДНК под действием НЧЗ усиливается до ≈1.6 (SG) и ≈2.7 (PG) раз. Установлено, что НЧЗ препятствуют формированию “возвратной” холестерической фазы ДНК при “закалке” ХЖКД – ее нагреве до 80°C и охлаждении до 20°C. Предварительная обработка ХЖКД ДНК красителями SG и PG в этом случае способствует восстановлению сигнала кругового дихроизма. Больший эффект отмечен для PG, что может объясняться более сильным электростатическим взаимодействием этого красителя с НЧЗ, поскольку его заряд равен +3, тогда как заряд SG – +2.
ВВЕДЕНИЕ
Жидкие кристаллы (ЖК) представляют собой уникальный пример самоорганизации вещества, и их использование перспективно в целом ряде областей от органической электроники до диагностики онкозаболеваний [1–4]. Поскольку даже небольшие локальные возмущения структуры ЖК могут приводить к сильному изменению их свойств (например, оптических характеристик), одним из наиболее быстроразвивающихся направлений является изучение возможности применения ЖК в качестве рабочих элементов сенсоров. ЖК чувствительны к вариациям pH [5] и температуры [6], воздействию магнитных полей [7] и ионизирующего излучения [8]. Они также могут использоваться для обнаружения разнообразных химических агентов (поллютантов [9], химического оружия [10], наркотических веществ [11] и др.).
К образованию мезофаз способны различные соединения: от малых молекул до биополимеров (белки, нуклеиновые кислоты и др.). Способность биополимеров к упорядочению, обнаруженная, в том числе, в некоторых биологических объектах [12–14], также представляет значительный интерес для решения задач биоаналитики. Например, основой для создания биодатчиков могут выступать частицы жидкокристаллических дисперсий (ЖКД) ДНК, получаемые в результате так называемой psi-конденсации (также Ψ; акроним от polymer and salt-induced [15]). В ходе фазового исключения в присутствии соли и нейтрального полимера (например, полиэтиленгликоля, ПЭГ) низкомолекулярные двухцепочечные ДНК образуют в водно-солевом растворе субмикрометровые глобулы с упорядоченной структурой. Согласно существующим представлениям [16], молекулы ДНК в частицах ЖКД располагаются в параллельных слоях, плотность упаковки которых зависит от осмотического давления раствора полимера. Благодаря своим оптическим свойствам наиболее привлекательной для сенсорных приложений является холестерическая ЖКД (ХЖКД) ДНК. В частицах ХЖКД слои молекул ДНК повернуты друг относительно друга на некоторый угол, формируя спиральную надмолекулярную структуру. ХЖКД ДНК характеризуется выдающимся по амплитуде отрицательным сигналом на спектре кругового дихроизма (КД) в области поглощения азотистых оснований (λ = 270–280 нм). Однако еще более ярко выраженной оптической активностью обладают так называемые “возвратные” холестерические фазы ДНК, получаемые в результате термической “закалки” ХЖКД ДНК [17]. Сигнал КД этих систем является весьма чувствительным маркером как температурного воздействия, так и присутствия биологически активных соединений [18]. Для обнаружения некоторых аналитов может быть также использован индуцированный КД (ИКД), который наблюдается при встраивании хромофоров в холестерическую структуру частиц ЖКД ДНК [19, 20].
ЖКД ДНК представляют собой удобную платформу для инкорпорирования низкомолекулярных лигандов и/или наночастиц (НЧ). Их включение в состав частиц дисперсии может способствовать приобретению жидкокристаллической матрицей новых функциональных возможностей. В частности, плотная упаковка молекул ДНК в частицах ЖКД способствует сближению инкорпорированных элементов, значительно усиливая эффективность их взаимодействия. Ранее нами было показано, что эффективность тушения флуоресценции связанного с ДНК красителя с помощью НЧ золота (НЧЗ) в молекулярно-организованных системах может значительно превосходить регистрируемую в разбавленном водном растворе [21]. При этом увеличение плотности упаковки ДНК способствует возрастанию эффективности тушения. Вкупе со способностью связывать различные ДНК-специфичные флуоресцентные красители, продемонстрированной, в том числе, в работах [22–24], это свидетельствует о возможности использования ХЖКД ДНК в качестве основы для создания высокочувствительных флуоресцентных сенсоров. Однако здесь важно отметить, что взаимодействие различных по строению флуорофоров и НЧЗ в разбавленных водных растворах и в молекулярно-организованных системах ДНК может принципиально различаться [24], а добавление НЧЗ к ХЖКД ДНК может приводить к нарушению пространственной организации молекул в частицах дисперсии [25]. В настоящее время структурные аспекты взаимодействия НЧЗ с флуоресцентными красителями в мезофазах ДНК, а также влияние их комплексов на организацию жидкокристаллической матрицы остаются практически не исследованными. Поэтому цель настоящей работы состояла в изучении методом спектроскопии КД структурных изменений в частицах ХЖКД ДНК и “возвратной” холестерической фазы ДНК при связывании исследованных нами ранее флуоресцентных красителей SYBR Green I (SG) и PicoGreen (PG) с НЧЗ.
МАТЕРИАЛЫ И МЕТОДЫ
Для приготовления ХЖКД ДНК использовали коммерческие препараты ПЭГ молекулярной массы 4000 Да (Biochem Chemopharma, Франция) и деполимеризованной ультразвуком ДНК ((0.25–0.5) × 106 Да; Деринат, Россия). Водно-солевой раствор ДНК (7.5 × 10−5 M) готовили на основе фосфатного (NaH2PO4) буфера (10−2 M), содержащего 0.3 M NaCl (pH ≈ 7.4). Затем, согласно методике [18], равные объемы водно-солевого раствора ДНК и раствора ПЭГ с концентрацией 34 мас. % интенсивно перемешивали в течение 120 с, а полученную смесь 90 мин выдерживали при комнатной температуре. Индикатором образования ХЖКД ДНК являлось появление на спектре КД интенсивной отрицательной полосы в области λ = 270–280 нм.
В качестве “внешних” хромофоров были выбраны коммерческие ДНК-специфичные красители SG и PG (Lumiprobe, США), концентрацию которых определяли спектрофотометрически на приборе UV-3101 PC (Shimadzu, Япония), используя известные значения коэффициентов экстинкции: ${{\varepsilon }_{{494}}} \approx 73\,000{\text{\;л\;}}{{{\text{М}}}^{{ - 1}}}{\text{\;с}}{{{\text{м}}}^{{ - 1}}}$ (SG), ε500 ≈ 70 000 л М–1 см–1 (PG) [26]. Также использовали сферические НЧЗ с исходным (сразу после синтеза) средним размером ≈2.5 нм. Процедура синтеза НЧЗ, а также анализ их характеристик методами просвечивающей электронной микроскопии, динамического рассеяния света и спектрофотометрии описаны в наших предыдущих работах [21, 24]. Перед использованием НЧЗ выдерживали при температуре +4°C не менее 6 месяцев для проявления у частиц металлических свойств [27].
Спектры КД измеряли в диапазоне 230–600 нм с помощью дихрографов СКД-2 и СКД-2М, изготовленных в лаборатории лазерно-спектрального приборостроения Института спектроскопии РАН. Все измерения проводили в кварцевых кюветах с длиной оптического пути 1 см. На установке СКД-2 сигналы регистрировали при комнатной температуре, а измерения спектров КД в различных температурных режимах проводили при помощи СКД‑2М. Температуру в термостатируемом кюветном отделении дихрографа регулировали в диапазоне 20–80°C. Порядок проведения измерений был следующим: к ХЖКД ДНК добавляли исследуемый краситель, затем вносили НЧЗ и подвергали температурной обработке (после внесения каждого препарата систему инкубировали в течение 5–10 мин для достижения равновесия). Перед каждым измерением образцы выдерживали в кюветном отделении в течение 5–10 мин с целью их равномерного нагрева/охлаждения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние “внешнего” хромофора на эффективность разрушения ХЖКД ДНК
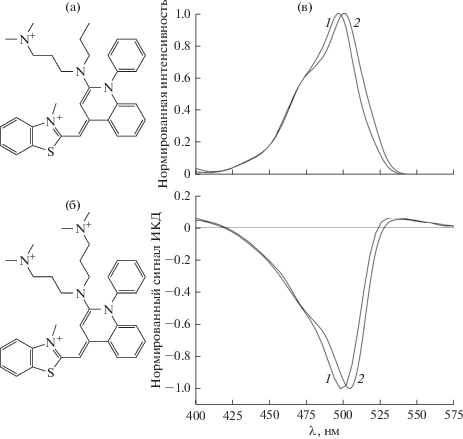
Цианиновые красители SG и PG имеют сходную структуру хромофорных частей молекул (рис. 1а, б), но различаются наличием дополнительной аминогруппы на пропильной цепочке PG и, как следствие, величиной заряда: +2 (SG) и +3 (PG). Они привлекательны благодаря высокому квантовому выходу флуоресценции в комплексе с ДНК и отсутствию сигнала в свободной форме. Их взаимодействие с ДНК реализуется преимущественно по механизму интеркаляции: хромофорные части молекул локализуются между парами оснований, а пропильные “хвосты” – в узкой бороздке двойной спирали [28, 29]. Связывание SG и PG с ДНК в составе частиц ХЖКД приводит к возникновению ИКД – появлению на спектре КД характерных полос в области их поглощения (λSG = 498 нм, λPG = 504 нм). В то время как для ряда узкобороздочных лигандов при связывании в ХЖКД ДНК наблюдались положительные сигналы ИКД [22], интеркаляционным комплексам красителей SG и PG с ДНК в составе частиц ХЖКД соответствует отрицательный знак полосы на спектрах КД. Близость строения молекул красителей и их спектральных свойств обуславливает похожий характер их сигналов ИКД (рис. 1в).
Рис. 1.
Структурные формулы красителей SG (а) и PG (б). (в) Нормированные спектры возбуждения (вверху) SG (1) и PG (2) и нормированные сигналы ИКД при связывании этих красителей в ХЖКД ДНК (внизу).
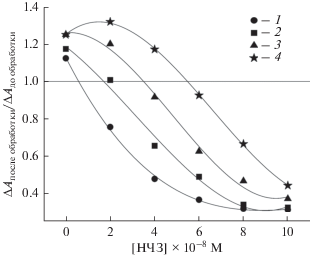
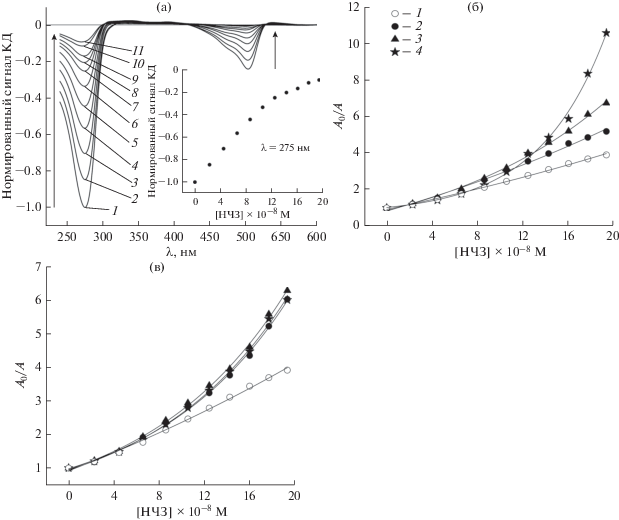
Как было отмечено ранее, НЧ могут нарушать пространственную организацию ДНК в частицах ХЖКД [21, 25]. Такое явление наблюдалось при использовании не только НЧЗ, но и кобальт-ферритных НЧ [30]. В работе [31] нарушение холестерической упаковки ДНК связали с образованием между ee соседними молекулами агрегатов из НЧ. В качестве примера на рис. 2а представлен КД‑спектр ХЖКД ДНК, содержащей 2 × 10–6 М PG, в присутствии НЧЗ в концентрации от 2.27 × × 10–8 до 19.33 × 10–8 М. Добавление НЧЗ приводило к постепенному уменьшению амплитуды как основного сигнала (λ ≈ 275 нм), так и полосы ИКД (λ ≈ 504 нм). Учитывая обнаруженные нами ранее различия в эффективности тушения флуоресценции SG и PG с помощью ультрамалых НЧЗ, обусловленные, вероятно, разной структурой образующихся комплексов [24], можно предположить, что разрушение ХЖКД ДНК, обработанных этими красителями, под действием НЧЗ также будет происходить по-разному. Сравнение эффективности разрушения ХЖКД ДНК в присутствии PG и SG в различной концентрации показано на рис. 2б и 2в. Видно, что увеличение концентрации PG приводило к росту деструктивного эффекта НЧЗ. Если при концентрации красителя 3.25 × × 10–7 М максимальная величина отношения A0/A (A0 и A – интенсивности сигналов КД на длине волны λ = 275 нм в отсутствие и присутствии НЧЗ соответственно) составляла 5.18, то при концентрации PG 7 × × 10–6 М это отношение возрастало в 2 раза (до 10.57). В то же время, в изученных условиях степень разрушения ХЖКД ДНК практически не зависела от концентрации SG. Значение A0/A, достигаемое при максимальной концентрации НЧЗ, в этом случае составляло примерно 6.3. При наименьшей исследованной концентрации красителей эффективность разрушения ХЖКД ДНК в присутствии SG оказалась примерно на 16% выше, чем при предварительной обработке системы красителем PG. Такой результат может быть следствием того, что в этом случае НЧЗ “работают” в ХЖКД ДНК в присутствии SG как самостоятельно, так и в комплексе с красителем, а в присутствии PG – только в комплексе с красителем.
Рис. 2.
(а) КД-спектр ХЖКД ДНК, обработанной 2 × 10–6 М PG, в присутствии НЧЗ в концентрации (×10–8 М): 1 – 0, 2 – 2.27, 3 – 4.46, 4 – 6.57, 5 – 8.59, 6 – 10.55, 7 – 12.43, 8 – 14.25, 9 – 16, 10 – 17.7, 11 – 19.33. Вставка: зависимость амплитуды полосы λ = 275 нм от концентрации НЧЗ. (б, в) Эффективность разрушения холестерической упаковки ДНК в частицах ЖКД при добавлении (0–19.33) × 10–8 М НЧЗ в присутствии PG (б) и SG (в) в концентрации 0 (1), 3.25 × 10–7 (2), 1.75 × 10–6 (3), 7 × 10–6 М (4).
Добавление к ЖКД ДНК золя Au приводит к разбавлению системы, а, следовательно, и к уменьшению осмотического давления раствора ПЭГ, формирующего частицы дисперсии. Таким образом, разрушение упаковки ДНК происходит под влиянием двух факторов: разбавления и непосредственного действия НЧЗ. Поскольку объем золя золота, добавляемого к ХЖКД ДНК, содержащим исследуемые красители, был таким же, можно заключить, что более эффективное разрушение упорядоченной структуры ДНК под действием НЧЗ в этих системах не связано с их дополнительным разбавлением. Полученный результат, очевидно, является следствием взаимодействия НЧЗ с интеркалированными молекулами SG или PG и формирования тройного комплекса ДНК–краситель–НЧЗ.
Образование “возвратной” холестерической фазы ДНК в присутствии НЧЗ и цианиновых красителей
Как уже было отмечено, жидкокристаллические фазы ДНК чувствительны к температурному воздействию [32]. Повышение температуры может влиять как на диффузионную подвижность ПЭГ в ЖКД ДНК, так и на структуру ДНК, что в итоге сказывается на организации частиц дисперсии. Так, например, в работах [33, 34] был продемонстрирован температурно-индуцированный переход гексагональной упаковки ДНК в холестерическую. В свою очередь, нагрев ХЖКД ДНК приводит к уменьшению ее оптической активности: с повышением температуры амплитуда сигнала КД постепенно уменьшается, вплоть до полного его исчезновения. Этот эффект, обычно наблюдаемый в диапазоне температуры 30–80°C и получивший название “КД-плавления”, так же как и действие НЧ, связан с раскручиванием спиральной структуры частиц дисперсии. Температурное воздействие, однако, может сопровождаться не только нарушением упаковки ДНК. Так, нагрев ХЖКД ДНК до 80°C и последующее охлаждение до 20°C приводит к значительному увеличению амплитуды сигнала КД. Данный эффект может быть обусловлен как уменьшением расстояния между соседними молекулами ДНК, так и увеличением угла закрутки холестерических слоев [34].
В качестве примера на рис. 3 представлены КД-спектры ХЖКД ДНК в присутствии 4.46 × × 10–8 М НЧЗ и 3.5 × 10–6 M исследуемых красителей до и после цикла температурной обработки. В отсутствие НЧЗ последовательные нагрев и охлаждение ХЖКД ДНК приводили к небольшому (примерно на 13%) увеличению сигнала КД. Однако при их добавлении амплитуда полосы на КД-спектре ХЖКД ДНК после охлаждения существенно уменьшалась. Без учета влияния НЧЗ на систему (рис. 3б: переход от кривой 0 к кривой 1) снижение амплитуды сигнала составляло примерно 50% (переход от кривой 1 к кривой 3 на том же рисунке). Поскольку с ростом температуры деструктивный эффект НЧЗ возрастает [35], можно предположить, что раздвижение слоев ДНК при повышении температуры ослабляет стерические ограничения и тем самым позволяет НЧЗ и молекулам ДНК перегруппироваться. Так как расстояние между соседними молекулами, при котором наблюдается холестерическая упаковка ДНК, может составлять от ≈3.2 до ≈4.9 нм [36], при раскручивании слоев может появляться дополнительное пространство как для связывания НЧЗ, так и для образования ими более крупных агрегатов.
Рис. 3.
Спектры ХЖКД ДНК при последовательном нагреве до 80°C и охлаждении до 20°C: в отсутствие НЧЗ и красителей (а), а также в присутствии 4.46 × 10–8 М НЧЗ (б), 4.46 × 10–8 М НЧЗ и 3.5 × 10–6 M красителя SG (в) или PG (г). Обозначения кривых: 0 – спектр до обработки НЧЗ (б–г); 1 – спектр сравнения, который использовали для нормировки (а – в отсутствие НЧЗ, б–г – в присутствии НЧЗ); 2 – спектр при температуре 80°C; 3 – спектр после охлаждения системы.
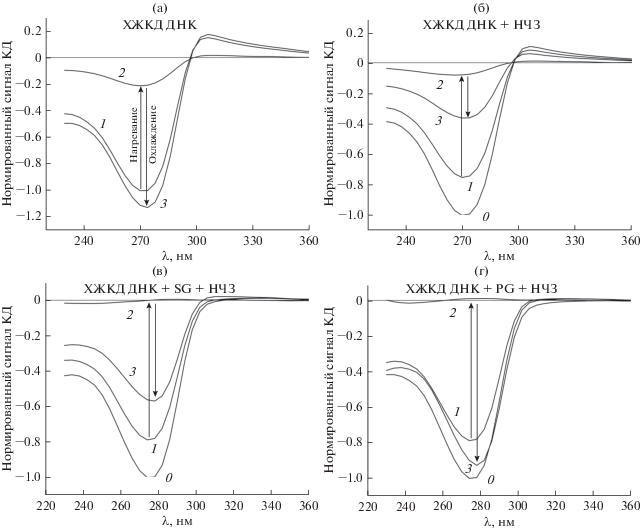
Отметим, что поведение ХЖКД ДНК с предварительно введенными красителем и НЧЗ при нагреве и последующем охлаждении оказалось весьма нетривиальным. Во-первых, при температуре 80°C сигналы КД таких систем соответствовали характерным для разбавленного раствора ДНК (что свидетельствует о полном разрушении упорядоченной структуры), в то время как в отсутствие SG и PG сохранялась наблюдаемая для холестерической организации ДНК оптическая активность (рис. 3а и 3б). Во-вторых, присутствие в системе красителя (SG или PG) способствовало более полному восстановлению амплитуды КД-сигнала ХЖКД ДНК при ее охлаждении (рис. 3в и 3г). Если в отсутствие красителей для системы, содержащей 4.46 × 10–8 М НЧЗ, интенсивность КД-сигнала восстанавливалась лишь на ≈50%, то в присутствии 3.5 × 10–6 M SG – на ≈72% (ср. кривые 1 и 3 на рис. 3в), а при добавлении PG в той же концентрации восстановленная полоса даже превосходила по амплитуде КД-сигнал ХЖКД ДНК, обработанной НЧЗ (ср. кривые 1 и 3 на рис. 3г). Обнаруженный эффект можно объяснить тем, что разрушение ХЖКД ДНК в результате нагревания способствует эффективному связыванию НЧЗ и образованию комплексов ДНК–краситель–НЧЗ и/или краситель–НЧЗ. Такие комплексы могут оказываться исключенными из восстанавливаемой холестерической структуры частиц ХЖКД ДНК.
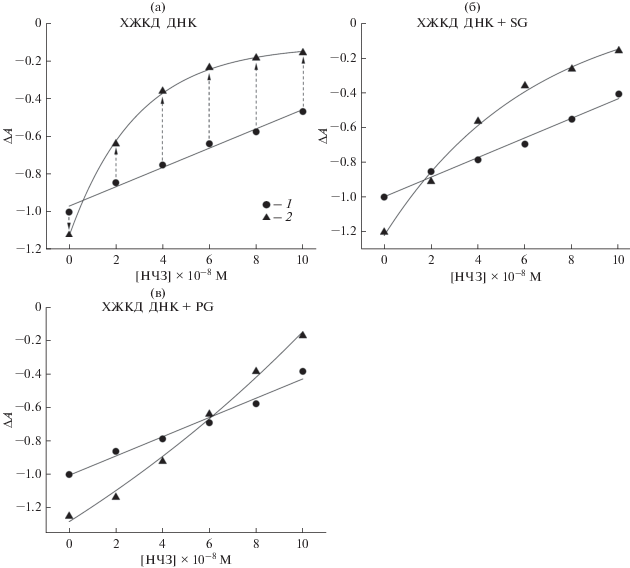
Сравнение интенсивности КД-сигналов для ХЖКД ДНК, обработанных SG и PG, до и после циклирования температуры в присутствии (0–10.55) × 10–8 М НЧЗ проведено на рис. 4. Предварительное добавление к ХЖКД ДНК 3.5 × 10–6 M SG позволило практически полностью восстановить исходную амплитуду сигнала КД при концентрации НЧЗ 2.27 × 10–8 М, в то время как та же концентрация PG способствовала нейтрализации деструктивного эффекта НЧЗ в более широком диапазоне их концентрации. Так, даже в присутствии 6.57 × 10–8 М НЧЗ наблюдалось восстановление сигнала КД системы примерно на 93%. При меньших концентрациях НЧЗ наблюдалось возрастание интенсивности полосы КД как до уровня, предшествовавшего обработке, так и превышающего амплитуду исходного сигнала. Способность PG восстанавливать КД-сигнал ХЖКД ДНК после ее температурной обработки при различной концентрации красителя иллюстрирует рис. 5. При термической обработке ХЖКД ДНК в отсутствие НЧЗ увеличение концентрации PG приводило к незначительному росту сигнала КД “возвратной” холестерической фазы. В то же время в присутствии НЧЗ уменьшение концентрации PG приводило к постепенному снижению эффекта восстановления сигнала КД. Практически полное восстановление амплитуды сигнала после температурной обработки в присутствии 4.46 × 10–8 М НЧЗ наблюдалось при концентрации PG 1.75 × 10–6 M, а при концентрации красителя 7 × 10–7 M – при 2.27 × 10–8 М НЧЗ. Таким образом, можно предположить, что изменение концентрации этого красителя позволяет управлять процессами встраивания НЧЗ в “возвратную” холестерическую фазу ДНК после тепловой обработки.
ЗАКЛЮЧЕНИЕ
В настоящей работе на примере цианиновых красителей SG и PG впервые показано влияние “внешнего” хромофора на эффективность разрушения пространственной организации ДНК в частицах ее ХЖКД под действием НЧЗ. Кроме того, обработка ХЖКД ДНК этими красителями способствовала нейтрализации или уменьшению деструктивного эффекта НЧЗ при формировании “возвратной” холестерической фазы ДНК в результате температурной обработки. В обоих случаях бóльшая величина эффекта достигалась в присутствии PG, молекулы которого характеризуются бóльшим по сравнению с SG положительным зарядом (+3 vs +2). Именно величина заряда PG, по-видимому, обуславливает его более сильное взаимодействие с отрицательно заряженными НЧЗ: возможность связывать большее число частиц и/или участвовать в образовании их кластеров большего размера.
Продемонстрированные в настоящей работе эффекты могут быть положены в основу создания сенсорной системы, основанной на высокой эффективности тушения флуоресценции красителей с помощью НЧЗ в пространственно-организованных системах ДНК. Можно предположить, что добавление в такую систему неспецифичных к ДНК молекул, связывающих НЧЗ, высвобождаемые при нагреве ХЖКД ДНК, будет приводить к уменьшению эффективности тушения флуоресценции. Кроме того, обнаруженное изменение интенсивности сигнала КД “возвратной” холестерической фазы ДНК может лечь в основу способа определения концентрации соединений, не демонстрирующих ИКД при связывании в ХЖКД ДНК.
ИСТОЧНИК ФИНАНСИРОВАНИЯРабота выполнена по теме госзадания 44.7 Кинетика и механизм элементарных стадий сложных фотохимических и фотобиохимических процессов, № 01201253303.
Список литературы
Beeckman J., Neyts K., Vanbrabant P.J.M. // Opt. Eng. 2011. V. 50. P. 081202.
Lagerwall J.P.F., Scalia G. // Curr. Appl. Phys. 2012. V. 12. P. 1387.
Iino H., Hanna J. // Polym. J. 2017. V. 49. P. 23.
Vallamkondu J., Corgiat E.B., Buchaiah G., Kandimalla R., P. Reddy P.H. // Cancers (Basel). 2018. V. 10. P. 462.
Negrini R., Mezzenga R. // Langmuir. 2011. V. 27. P. 5296.
Toriyama K., Tada S., Ichimiya K., Funatani S., Tomita Y. // Int. J. Heat Mass Transfer. 2016. V. 92. P. 483.
Wang M., He L., Zorba S., Yin Y. // Nano Lett. 2014. V. 14. P. 3966.
Debnath A., Goswami D., Singha B.K., Haldar S., Mandal P.K. // Liq. Cryst. 2020. In press.
Niu X., Zhong Y., Chen R., Wang F., Luo D. // Opt. Express. 2017. V. 25. P. 13549.
Cadwell K.D., Lockwood N.A., Nellis B.A., Alf M.A., Willis C.R., Abbott N.L. // Sens. Actuators B. Chem. 2007. V. 128. P. 91.
Wang S., Zhang G., Chen Q., Zhou J., Wu Z. // Microchim. Acta. 2019. V. 186. P. 724.
Leforestier A., Livolant F. // Biophys. J. 1993. V. 65. P. 56.
Bouligand Y. // C. R. Chim. 2008. V. 11. P. 281.
Mitov M. // Soft Matter. 2017. V. 13. P. 4176.
Maniatis T., Venable Jr. J.H., Lerman L.S. // J. Mol. Biol. 1974. V. 84. P. 37.
Скуридин С.Г., Верещагин Ф.В., Салянов В.И., Чулков Д.П., Компанец О.Н., Евдокимов Ю.М. // Молекулярная биология. 2016. Т. 50. С. 887.
Евдокимов Ю.М., Салянов В.И., Компанец О.Н., Кац Е.И., Скуридин С.Г. // Жидкие кристаллы и их практическое использование. 2019. Т. 19. С. 59.
Евдокимов Ю.М., Салянов В.И., Семенов С.В., Скуридин С.Г. Жидкокристаллические дисперсии и наноконструкции ДНК. М.: Радиотехника, 2008.
Скуридин С.Г., Верещагин Ф.В., Салянов В.И., Гусев В.М., Павлов М.А., Компанец О.Н., Евдокимов Ю.М. // Сенсорные системы. 2015. Т. 29. С. 84.
Евдокимов Ю.М., Скуридин С.Г., Салянов В.И., Семенов С.В., Сольев П.Н., Валуев-Эллистон В.Т., Верещагин Ф.В., Чулков Д.П., Компанец О.Н. // Оптика и спектроскопия. 2017. Т. 122. С. 214.
Morozov V.N., Kolyvanova M.A., Dement’eva O.V., Rudoy V.M., Kuzmin V.A. // J. Lumin. 2020. V. 219. P. 116898.
Коваль В.С., Иванов А.А., Салянов В.И., Стомахин А.А., Олейников В.А., Жузе А.Л. // Биоорганическая химия. 2017. Т. 43. С. 167.
Морозов В.Н., Кузьмин В.А. // Химия высоких энергий. 2019. Т. 53. С. 161.
Morozov V.N., Kolyvanova M.A., Dement’eva O.V., Rudoy V.M., Kuzmin V.A. // J. Mol. Liq. 2021. V. 321. P. 114751.
Скуридин С.Г., Дубинская В.А., Рудой В.М., Дементьева О.В., Захидов С.Т., Маршак Т.Л., Кузьмин В.А., Попенко В.И., Евдокимов Ю.М. // Доклады Академии наук. 2010. Т. 432. С. 838.
Zipper H., Brunner H., Bernhagen J., Vitzthum F. // Nucleic Acids Res. 2004. V. 32. P. e103.
Дементьева О.В., Карцева М.Е., Сухов В.М., Рудой В.М. // Коллоидный журнал. 2017. Т. 79. С. 562.
Dragan A.I., Casas-Finet J.R., Bishop E.S., Strouse R.J., Schenerman M.A., Geddes C.D. // Biophys. J. 2010. V. 99. P. 3010.
Dragan A.I., Pavlovic R., McGivney J.B., Casas-Finet J.R., Bishop E.S., Strouse R.J., Schenerman M.A., Geddes C.D. // J. Fluoresc. 2012. V. 22. P. 1189.
Евдокимов Ю.М., Першина А.Г., Салянов В.И., Магаева А.А., Попенко В.И., Штыкова Э.В., Дадинова Л.А., Скуридин С.Г. // Биофизика. 2015. Т. 60. С. 428.
Скуридин С.Г., Дубинская В.А., Штыкова Э.В., Волков В.В., Рудой В.М., Дементьева О.В., Кузьмин В.А., Лисицына Е.С., Захидов С.Т., Зеленина И.А., Евдокимов Ю.М. // Биологические мембраны. 2011. Т. 28. С. 191.
Grasso D., Fasone S., La Rosa C., Salyanov V. // Liq. Cryst. 1991. V. 9. P. 299.
Евдокимов Ю.М., Скуридин С.Г., Салянов В.И., Кац Е.И. // Доклады Академии наук. 2016. Т. 467. С. 556.
Евдокимов Ю.М., Скуридин С.Г., Салянов В.И., Семенов С.В., Штыкова Э.В., Дадинова Л.А., Компанец О.Н., Кац Е.И. // Оптика и спектроскопия. 2017. Т. 123. С. 64.
Евдокимов Ю.М., Скуридин С.Г., Салянов В.И., Попенко В.И., Штыкова Э.В., Дадинова Л.А., Волков В.В., Хлебцов Н.Г., Хлебцов Б.Н., Кац Е.И. // Российские нанотехнологии. 2014. Т. 9. С. 82.
Livolant F., Leforestier A. // Prog. Polym. Sci. 1996. V. 21. P. 1115.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий