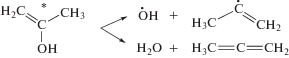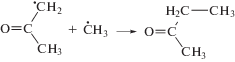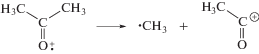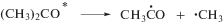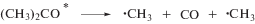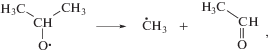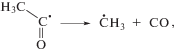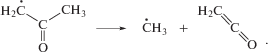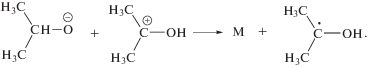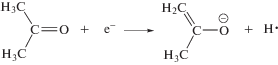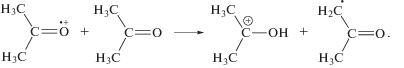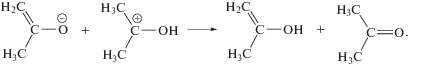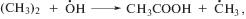Химия высоких энергий, 2021, T. 55, № 5, стр. 393-399
Радиолитические процессы в кипящем ацетоне
С. И. Власов a, Е. М. Холодкова a, А. В. Пономарев a, *
a Институт физической химии и электрохимии им. А.Н. Фрумкина Российской Академии наук
119071 Москва, Ленинский просп., 31, стр. 4, Россия
* E-mail: ponomarev@ipc.rssi.ru
Поступила в редакцию 26.03.2021
После доработки 05.05.2021
Принята к публикации 11.05.2021
Аннотация
По сравнению с комнатной температурой, состав и выходы продуктов радиолиза кипящего ацетона существенно изменяются. Кипение в сочетании с высокой мощностью поглощенной дозы и радиолитическим подкислением приводят к появлению продуктов енольной структуры (изопропенил ацетат, 2-метоксипропен, винилацетат), а также иных продуктов, нехарактерных для гамма-радиолиза при меньших температурах (аллен, трет-бутанол и сложные эфиры). Процессы енолизации проявляются в увеличении выходов водорода, уксусной кислоты, алкокси-производных и полимеров. Рассматривается образование продуктов енольной структуры в первичных ионных процессах, а также во вторичных процессах с участием винилокси и пропен-2-окси радикалов. Отмечается роль процессов термического разложения радикалов в снижении выхода ряда продуктов радикальной рекомбинации.
ВВЕДЕНИЕ
Ацетон приобрел широкое практическое применение в качестве полярного легколетучего растворителя. В частности, он используется в исследованиях, связанных с ионизацией и возбуждением молекул – в химии высоких энергий, радиохимии, масс-спектроскопии, лучевой терапии, химии атмосферы и других [1, 2]. Как следствие, вопросы влияния внешних условий на механизм радиолитических превращений ацетона вызывает закономерных интерес. К числу малоизученных аспектов относятся процессы динамической изомеризации ацетона (2-пропанон ↔ пропен-2-ол) под действием ионизирующего излучения, температуры и кислотных интермедиатов, накапливающихся в процессе радиолиза. При нормальных условиях содержание енольного изомера (пропен-2-ола) в ацетоне не превышает 0.0001%. Однако радиолизу присуще образование возбужденных молекул, ионов и радикалов, чья избыточная энергия выше энергии енолизации (42.5 кДж/моль или 0.44 эВ/молекула). Соответственно, вероятно стимулирующее влияние радиолиза на динамическую изомеризацию ацетона [2]. В настоящей работе роль изомеризации оценивалась из сравнения ассортимента и выходов продуктов радиолиза ацетона в условиях кипения (329.5 К) и при комнатной температуре (293 К).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ацетон (от “Реахим”) осушали над безводным CaSO4 и силикагелем, и трижды перегоняли в атмосфере Ar с использованием средней фракции конденсата в последующих экспериментах. Перед облучением образцы насыщались Ar в течение 40–45 мин. Содержание остаточных примесей в очищенном ацетоне было не более 0.05 мас. %, в том числе, воды не более 0.01 мас. % (по данным ИК спектроскопии и хроматографии).
Для облучения использовали линейный ускоритель электронов УЭВК-10-10Т (энергия 8 МэВ, средний ток пучка ≤500 A; длительность импульса 6 мкс; частота следования импульсов 300 Гц). Использовались установка и методика, описанные в [3]. Максимальная мощность дозы во время импульса составляла 65 кГр/с. Во избежание перегрева образцов, использовался прерывистый режим облучения со средней мощностью дозы 5–7 кГр/мин. Для дозиметрии использовали сополимер с феназиновым красителем СО ПД(Ф)Р-5/50 (ГСО 7865-2000).
Состав образцов анализировался перед облучением и сразу после завершения облучения с использованием хроматомасс-спектрометра (Agilent 5977EMSD/7820AGC; носитель – гелий, колонка – стеклянная капиллярная длиной 60 м с внутренним диаметром 0.25 мкм, библиотека спектров NIST). Экспериментальные данные усреднялись по результатам 5–7 независимых опытов при каждой дозе (отклонения данных не превышали ±7% от средней величины).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Радиолитическая фрагментация молекул ацетона приводит к нескольким легколетучим соединениям – от водорода до ацетальдегида (рис. 1). Образование этих соединений интенсифицируется с ростом температуры. С наибольшим выходом образуются продукты разрыва С–С связей (СН4, СО, С2Н6, С2Н4О). Вместе с тем, обнаруживаются пропен и аллен, образование которых предполагает отщепление атома кислорода. При 293 К, выход аллена незначителен, тогда как в кипящем ацетоне (329.5 К) он превышает выходы пропена и ацетальдегида.
Рис. 1.
Влияние температуры на радиационно-химические выходы продуктов фрагментации и полимеризации ацетона.

Энергия связи С=О в карбонильной группе составляет около 7.8 эВ, что обеспечивает ее устойчивость в радиолитических превращениях. В свою очередь, энергия сильно поляризованной С−О связи в спиртах равна 3.7 эВ. Соответственно резкое увеличение выхода аллена и прирост выхода пропена могут указывать на появление менее прочной связи С–ОН, характерной для енольной формы ацетона
Энтальпия кипения ацетона ΔHкип составляет 29.1 кДж/моль (0.3 эВ/молекула), что немного меньше энергии енолизации (0.44 эВ/молекула). Однако в условиях кипения, эта разница может легко восполняться избыточной энергией, привносимой излучением. Соответственно, для возбужденной молекулы енола, имеющей гидроксильную группу и подвижный α-Н атом, становится возможным распад с разрывом С–О связи
Оба направления реакции (2) приводят к образованию воды. Радикал ОН преобразуется в воду путем отщепления Н атома от соседней молекулы растворителя. В спиртах С1–С4 при 293 К выход разрыва С–О связи и, соответственно, выход образования воды, составляет 0.04–0.08 мкмоль/Дж, увеличиваясь с ростом температуры [4]. Рисунок 1 указывает, что в ацетоне при 293 К преобладает образование пропена, тогда как при 329.5 К основным продуктом реакции (2) становится аллен (в равновесии с пропином). Наряду с реакцией (2), расщепление С–О связи также вероятно при распаде возбужденных катион-радикалов, имеющих енольную форму.
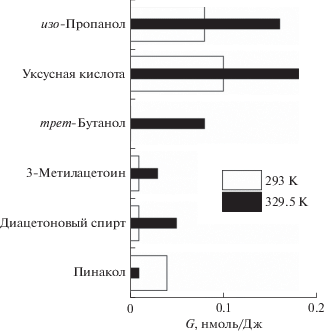
Среди более тяжелых продуктов радиолиза доминируют 2-бутанон (рис. 1) и гидроксил-содержащие соединения (рис. 2). Кипение стимулирует рост выходов изо-пропанола, уксусной кислоты и 2-бутанона более чем в 1.5 раза. Источником образования 2-бутанона может служить рекомбинация 2-оксопропильных и метильных радикалов
Рис. 2.
Влияние температуры на радиационно-химические выходы гидроксил-содержащих продуктов радиолиза ацетона.
На стадии радикальных процессов, образование 2-оксопропильных радикалов обусловлено преимущественно реакциями отрыва Н атома от метильных групп ацетона малыми радикалами типа Н, ОН, СН3, а также алкокси радикалами. В свою очередь, метильные радикалы возникают вследствие распада возбужденных молекул или катион-радикалов ацетона или его енольной формы. В газовой фазе диссоциация материнского иона (4)
наблюдается при поглощении энергии 10.45 эВ и выше [5, 6]. Такая диссоциация является преобладающим процессом на стадии ионных процессов. В свою очередь, распад возбужденных молекул с элиминированием метильного радикала происходит при избыточной энергии 4.5 эВ (5) и 6.5 эВ (6), т.е. из низших возбужденных состояний:
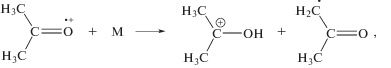
Температура практически не влияет на выход ионизации и возбуждения молекул [7]. В свою очередь, ацетон обладает низкой вязкостью (0.36 и 0.28 мПа при 293 и 329.5 К соответственно), что обусловливает малое значение эффекта клетки в нем. Таким образом, рост выходов метильных радикалов с температурой обусловлен не повышением вероятности процессов (4)–(6) или ослаблением эффекта клетки, а низкой термической стойкостью некоторых радиационно-индуцируемых радикалов [2]. Наиболее существенными источниками дополнительных метильных радикалов являются термостимулируемые процессы [8, 9]:
Наиболее быстрыми из них являются реакции (7) и (8). Вследствие процессов (4)–(9) наблюдается высокий выход образования метильного радикала и, соответственно, метана (рис. 1). Поскольку 2‑оксопропильный и метильный радикалы являются преобладающими радиолитическими интермедиатами, то вероятность реакции (3) представляется весьма высокой. Вместе с тем, в присутствие енола возможно образование 2-бутанона по ионному механизму. Для катион-радикалов и катионов характерны процессы кластеризации с молекулами ацетона [10]. В таком кластере, который содержит карбокатион и молекулу енола, весьма вероятно присоединение карбокатиона к С=С связи енола с образованием новой С–С связи. Однако избыточная энергия, имеющаяся у карбокатиона и у енола, провоцирует расщепление комбинированного интермедиата в β-положении относительно неспаренного электрона:
Возникающий катион при последующей нейтрализации превращается в 2-бутанон. В частности, этой реакцией может быть обусловлено доминирование 2-бутанона среди тяжелых продуктов радиолиза кипящего ацетона (рис. 1).
Предшественниками изо-пропанола могут служить 2-гидроксипропильные и 2-пропокси радикалы. В первом случае, изо-пропанол является продуктом диспропорционирования, а во втором – продуктом отщепления Н атома от окружающих молекул. Можно рассматривать два основных источника 2-гидроксипропильных и 2-пропокси радикалов. Реакция (11) первичного катион-радикала с молекулой ацетона приводит к катиону
который при последующей нейтрализации (12) превращается в 2-гидроксипропильный или 2‑пропокси радикал (в зависимости от избыточной энергии реагентов)
Другой путь образования 2-гидроксипропильных или 2-пропокси радикалов состоит в присоединении Н радикалов к С=О (в кето-форме) или к С=С (в енольной форме) связи. Одновременный рост выхода изо-пропанола и снижение выхода пинакола (рис. 2) указывают, что в кипящем ацетоне происходит существенное изменение механизма гибели 2-гидроксипропильных или 2-пропокси радикалов по сравнению с радиолизом при комнатной температуре. Пинакол является продуктом димеризации 2-гидроксипропильных радикалов. Стерические затруднения при димеризации должны быть минимальными именно в кипящем ацетоне. И структурная релаксация димера также должна упрощаться в кипящем ацетоне. Однако выход пинакола при 329.5 К оказывается намного меньше, чем при 293 К. Следовательно образование пинакола снижается из-за недостатка 2-гидроксипропильных радикалов. С одной стороны, кипение может способствовать образованию 2-пропокси радикалов в ущерб образованию 2-гидроксипропильных радикалов. Как следствие, возрастает вероятность образования изо-пропанола. С другой стороны, кипение может облегчать альтернативные реакции с участием 2-гидроксипропильных радикалов. Одной из таких конкурирующих реакций является образование трет-бутанола в результате рекомбинации 2-гидроксипропильных и метильных радикалов. При 293 К такой процесс малозначим (рис. 2), вероятно, из-за стерических затруднений. Однако при 329.5 К трет-бутанол становится одним из главных радиолитических продуктов.
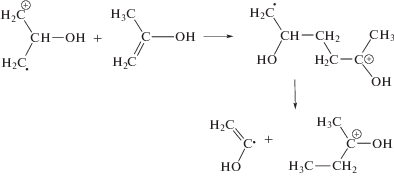
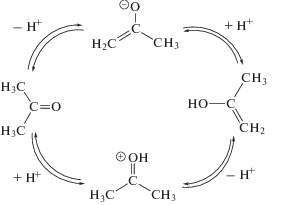
Образование енольных интермедиатов имеет место на самых первых стадиях радиолитических превращений [6, 11], вчастности, при изомеризации возбужденных катион-радикалов. Общепринятая схема каталитического преобразования кетона в енол предполагает отрыв протона с образованием енолят-аниона, либо протонирование карбонильной группы (рис. 3). Аналогичные ионные интермедиаты образуются в числе первичных продуктов радиолиза ацетона – в результате диссоциативного присоединения электрона недовозбуждения
и при взаимодействии первичного катион-радикала с растворителем
Последующая нейтрализация ионов приводит к образованию двух молекул, по крайней мере, одна из которых обладает избыточной энергией и, соответственно, может находиться в енольной форме
Одним из главных катализаторов дополнительной енолизации может служить уксусная кислота (рис. 2), выход которой лишь немногим уступает выходу 2-бутанона.
Выход ионизации ацетона составляет около 0.51 мкмоль/Дж (4.9 молекул/100 эВ) [12]. Свободные электроны быстро захватываются молекулами ацетона (k = 6.6 × 109 дм3/(моль с)) и, в отличие от анион-радикалов, принимают незначительное участие в последующих радиолитических превращениях. Около 70% первичных ионов погибают во внутритрековых процессах и лишь 30% (0.15 мкмоль/Дж) участвуют в объемных превращениях [12]. С точки зрения радиационной стойкости, пропен-2-ол и 2-пропанон существенно различаются. Потенциал ионизации енола (8.6 эВ) существенно ниже, чем у кето-формы (9.7 эВ). В то же время, молекулярный катион-радикал енола более устойчив к фрагментации по С–С связи, чем катион-радикал кето-формы [11].
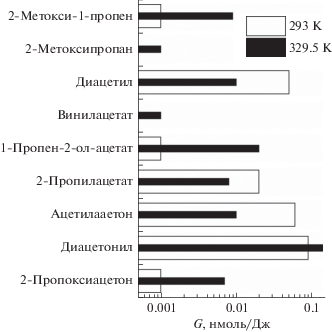
Рисунок 4 показывает наличие енольных производных среди продуктов рекомбинации радикалов в облучаемом ацетоне. К таким соединениям относятся 2-метокси-1-пропен, 1-пропен-2-ол-ацетат (изопропенил ацетат) и винилацетат. Очевидно, предшественниками первых двух может служить пропен-2-окси радикал, а третьего – винилокси радикал. Как видно из рис. 4, роль этих енольных интермедиатов возрастает в кипящем ацетоне. Пропен-2-окси радикал можно рассматривать как енольный изомер 2-оксопропильного радикала. В свою очередь, винилокси радикал является изомером ацетильного радикала. Однако самопроизвольная изомеризация 2-оксопропильного и ацетильного радикала при 329.5 К является очень медленной [13, 14]. Поэтому вероятнее, что енольные радикалы образуются при распаде возбужденных молекул или катион-радикалов ацетона. В обоих енольных интермедиатах радикальный центр позиционирован на атоме кислорода. Для таких алкокси радикалов характерны быстрые (диффузионно-контролируемые) реакции отрыва Н атомов от алкильных групп соседних молекул или присоединения к двойной связи [3, 4]. Соответственно, вероятность участия пропен-2-окси и винилокси радикалов в реакциях радикальной рекомбинации мала и для наблюдения продуктов рекомбинации требуется высокая мощность дозы, характерная для облучения электронным пучком.
Рис. 4.
Влияние температуры на радиационно-химические выходы простых эфиров, сложных эфиров и дикетонов в ацетоне.
Разрыв О–Н связи в еноле, в частности, реакция (13), может служить основной причиной увеличения выхода молекулярного водорода в кипящем ацетоне. При комнатной температуре, когда содержание енола незначительно, образование Н и Н2 происходит вследствие разрыва С–Н связей. Однако такой разрыв в катион-радикале и в возбужденной молекуле ацетона является более энергоемким по сравнению с разрывом С–С связи [15] и, соответственно, выход Н2 относительно мал (до 0.09 мкмоль/Дж). Причем этот выход практически не зависит от температуры в диапазоне 293–323 К [16]. В кипящем ацетоне выход возрастает почти на треть, что может быть обусловлено именно разрывом О–Н связи в енольной форме. Расщепление О–Н связи в возбужденных спиртах и енолах весьма вероятно [7, 11]. Например, в спиртах С1–С3, выход алкокси радикалов составляет 0.10–0.26 мкмоль/Дж [2, 4].
Образование высокомолекулярных соединений в кипящем ацетоне вдвое интенсивнее, чем при 293 К. Очевидно, основной причиной формирования полимеров являются реакции присоединения радикалов к ненасыщенным соединениям и последующей рекомбинации макрорадикалов. Повышение содержания енола и, соответственно, С=С связей в кипящем ацетоне может способствовать процессу конденсации. Дополнительным источником высокомолекулярных соединений могут служить процессы альдольно-кротоновой конденсации ацетона и других карбонильный продуктов радиолиза, где енолы принимают ключевое участие [17]. Под влиянием индукционного эффекта карбонильной группы, α-С атомы в молекулах кетона или альдегида имеют пониженную электронную плотность, что приводит к поляризации связи Сα–Н. Поэтому оказываются возможными реакции в которых одна молекула карбонильного соединения (в форме карбаниона) присоединяется к С=О группе другого карбонильного соединения. Возникающие альдоли и кетолы при нагревании легко дегидратируются. Легкое отщепление воды объясняется подвижностью Н атома в α-звене, на которое действуют индукционные эффекты групп ОН и С=О. Кислотный катализ в конденсации альдегидов и кетонов приводит к ускорению реакций дегидратации альдолей и кетолов и образованию ненасыщенных соединений. В конденсацию вовлекаются различные карбонильные соединения, образуемые в процессе радиолиза. Как следствие, возникающие полимеры имеют нерегулярное строение.
В свою очередь, радикалы ОН и вода служат наиболее очевидными предшественниками уксусной кислоты:
Кетен образуется в результате распада возбужденных молекул и в процессах диспропорционирования радикалов ацетона [9, 13, 18]. Он регистрируется на хроматограмме, но его количество не воспроизводится, вероятно, из-за термостимулируемых процессов в хроматографической колонке. Как видно из рис. 4, высокая мощность дозы электронного излучения приводит к образованию дополнительных продуктов радикальной рекомбинации (2-метоксипропана, 2-пропилацетата и 2‑пропоксиацетона), которые ранее [16] не регистрировались при гамма-радиолизе ацетона.
ЗАКЛЮЧЕНИЕ
Радиолиз кипящего ацетона приводит к существенному изменению ассортимента и выходов конечных продуктов по сравнению с радиолизом при комнатной температуре. Кипение способствует радиолитическому образованию аллена, трет-бутанола, винил-ацетата, 2-метоксипропана, 2-метокси-1-пропена, 1-пропен-2-ол-ацетата, 2-пропилацетата и 2-пропоксиацетона, которые ранее не обнаруживались при комнатной температуре в условиях гамма-облучения. Одной из причин наблюдаемых изменений может являться динамическая изомеризация молекул и ионов ацетона в молекулы и ионы пропен-2-ола. Короткоживущая енольная форма привносит в ацетон химические изменения, свойственные спиртам, включая возможность локального образования водородных связей и возможность разрыва С–О и О–Н связей. Вместе с тем, енолизация интенсифицирует процессы пост-радиационной химической конденсации. Выходы большинства продуктов радиолиза возрастают при кипении, однако выходы пинакола, диацетила, 2-пропилацетата и ацетилацетона уменьшаются, вероятно, из-за термического разложения их предшественников.
Список литературы
Shokrekhodaei M., Quinones S. // Sensors (Basel). 2020. V. 20(5). P. 1251. https://doi.org/10.3390/s20051251
Ponomarev A.V., Vlasov S.I., Kholodkova E.M., Chul-kov V.N., Bludenko A.V. // Radiat. Phys. Chem. 2019. V. 165. P. 108405. https://doi.org/10.1016/j.radphyschem.2019.108405
Vlasov S.I., Kholodkova E.M., Ponomarev A.V. // High Energy Chem. 2018. V. 52(4). P. 312. https://doi.org/10.1134/S0018143918040173
Ponomarev A.V., Vlasov S.I., Kholodkova E.M. // High Energy Chem. 2019. V. 53(4). P. 314. https://doi.org/10.1134/S0018143919040106
Anand S., Schlegel H.B. // Phys. Chem. Chem. Phys. 2004. V. 6. P. 5166. https://doi.org/10.1039/B411229F
Mishima K., Hayashi M., Lin S.H. // Int. J. Mass Spectrometry. 2004. V. 238. P. 1. https://doi.org/10.1016/j.ijms.2004.08.003
Woods R., Pikaev A. // Applied Radiation Chemistry. Radiation Processing. Wiley, NY. 1994.
Curran H.J. // Int. J. Chem. Kinet. 2006. V. 38(4). P. 250. https://doi.org/10.1002/kin.20153
Huynh L.K., Violi A. // J. Org. Chem. 2008. V. 73(1). P. 94. https://doi.org/10.1021/jo701824n
Apicella B., Li X., Passaro M., Russo C. // J. Am. Soc. Mass Spectrom. 2016. V. 27. P. 1835. https://doi.org/10.1007/s13361-016-1464-3
Grajales-González E., Monge-Palacios M., Sarathy S.M. // J. Phys. Chem. A. 2018. V. 122. P. 3547. https://doi.org/10.1021/acs.jpca.8b00836
Ponomarev A.V., Ratner A.M., Pikaev A.K. // High Energy Chem. 1995. V. 29(2). P. 91.
Wang H., Bozzelli J.W. // Chem. Phys. Chem. 2016. V. 17. P. 1983. https://doi.org/10.1002/cphc.201600152
Wakamatsu H., Hidaka Y. // Int. J. Chem. Kinet. 2008, V. 40(6). P. 320. https://doi.org/10.1002/kin.20313
Nobre M., Fernandes A., Ferreira da Silva F., Antunes R., Almeida D., Kokhan V., Hoffmann S.V., Mason N.J., Eden S., Limão-Vieira P. // Phys. Chem. Chem. Phys. 2008. V. 10. P. 550. https://doi.org/10.1039/b708580j
Larin V.A., Veselovskaya N.V., Bach N.A. // High Energy Chem. 1967. V .1. P. 447.
Perrin C.L., Chang K.L. // J. Org. Chem. 2016. V. 81(13). P. 5631. https://doi.org/10.1021/acs.joc.6b00959
Semenikhin A.S., Shubina E.G., Savchenkova A.S., Chechet I.V., Matveev S.G., Konnov A.A., Mebel A.M. // Int. J. Chem. Kinet. 2018. V. 50. P. 273. https://doi.org/10.1002/kin.21156
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий