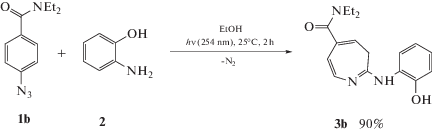Химия высоких энергий, 2021, T. 55, № 6, стр. 502-504
Влияние растворителей на эффективность фотоинициируемого образования 2,3- и 2,7-замещенных 3Н-азепинов
М. А. Гиричева a, А. В. Покровская a, Д. А. Давыдов a, А. В. Будруев a, *
a Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, пр. Гагарина, 23/5, Россия
* E-mail: budruev@gmail.com
Поступила в редакцию 29.05.2021
После доработки 01.07.2021
Принята к публикации 06.07.2021
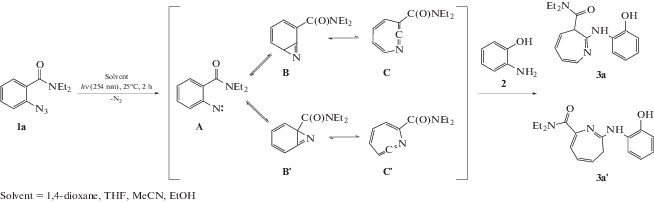
Азепины – ключевые структурные элементы широкого спектра фармацевтически активных субстанций [1]. Одним из методов синтеза аминозамещенных 3Н-азепинов является реакция нуклеофильного присоединения аминов к 1,2-дидегидроазепинам С – промежуточным продуктам фотохимических превращений ароматических азидов (Cхема 1).
При фотолизе орто-арилазидов возможно образование 2,3- и 2,7-замещенных-3H-азепинов [2]. Соотношение выходов этих азепинов зависит как от стерических [3], так и от энергетических [4] факторов, которые могут являться следствием специфического взаимодействия интермедиатов фотолиза азида с растворителем. В большинстве случаев фотолиз азидов ведет к образованию 2,3-замещенных-3H-азепинов [5] как основных продуктов реакции, в то же время, 2,7-замещенные-3H-азепины не образуются или имеют низкие выходы. Таким образом, целью данной работы стало изучение влияния условий проведения реакции на эффективности образования 2,3- и 2,7-замещенных 3Н-азепинов.
В качестве объектов исследования были выбраны диэтиловые амиды орто- (1a) и пара-азидобензойных кислот (1b) и орто-аминофенол в качестве нуклеофильного субстрата. Синтез азидов осуществлен согласно обобщенной методике [6].
Для синтеза 3Н-азепинов 0.5 ммоль арилазида 1 и 0.75 ммоль (1.5 экв) орто-аминофенола 2 растворяли в 40 мл одного из исследованных растворителей. Реакционную смесь облучали при комнатной температуре сдвоенной ртутно-кварцевой лампой низкого давления БУФ-15 (254 нм) в кварцевом реакторе при перемешивании до полного распада азида (2 ч). Контроль степени конверсии азида вели методом ВЭЖХ на хроматографе Shimadzu LC-20 с детектором SPD-M20A.
Схема 1 . Фотоинициируемое образования 2,3- и 2,7-замещенных 3Н-азепинов.
Продукты N,N-диэтил-2-((2-гидроксифенил)амино)-3H-азепин-3-карбоксиамид 3a и N,N-диэтил-2-((2-гидроксифенил)амино)-3H-азепин-7-карбоксиамид 3a' (вязкие оранжево-красные жидкости) выделяли методом колоночной хроматографии на силикагеле. Разделение проводили с использованием в качестве элюентов смеси петролейного эфира с этилацетатом (5 : 1, v/v) – выделение 2,3-3Н-азепина 3а; хлористого метилена с этилацетатом (5 : 2, v/v) – выделение 2,7-3Н-азепина 3a'.
3а Спектр ЯМР 1Н (СDCl3, δ, м.д., J/Гц): 7.11 – 6.96 (м, 3H Ar), 6.93 (д.д., J = 7.9, 1.3, 1H, Ar), 6.83 – 6.73 (м, 1H, 6-H азепин), 6.45 (д.д., J = 8.4, 6.0, 1H, 5-H азепин), 5.96 (д.д., J = 8.2, 5.6, 1H, 4-H азепин), 5.25 – 5.17 (м, 1H, 7-H азепин), 3.51-3.23 (м, 4H CH2СН3); 2.85 (с, 1H 3-H азепин); 1.2 (м, 6H CH2СН3).
3а' Спектр ЯМР 1Н (СDCl3, δ, м.д., J/Гц): 7.04 (д, J = 7.8, 2H, Ar), 6.95 (c, 1H), 6.79 – 6.71 (м, 1H, Ar), 6.23 (д.д., J = 9.1, 5.7, 1H, 6-H азепин), 6.06 (д, J = 5.7, 1H, 5-H азепин), 5.44 (д.д., J = 15.8, 6.8, 1H, 4-H азепин), 3.48 (кв, J = 7.1, 4H, CH2СН3), 3.02 (д, J = 6.7, 2H, 3-H азепин), 1.20 (т, J = 6.2, 6H, CH2СН3).
Характеристическими сигналами для соединений 3a и 3a' в спектре ЯМР 1Н являются синглеты протонов фрагмента СН(sp3) в области 2.85 и 3.02 м. д.
N,N-диэтил-2-((2-гидроксифенил)амино)-3H-азепин-5-карбоксиамид 3b (мелкокристаллический темно-красный порошок) получен по описанной выше методике (Схема 2 ) и выделен методом колоночной хроматографии на силикагеле с использованием в качестве элюента смеси петролейного эфира и этилацетата (1:1, v/v).
Схема 2 . Синтез 2,5-замещенных 3Н-азепинов.
3b Спектр ЯМР 1Н (СDCl3, δ, м.д., J/Гц): 7.07 (т.д., J = 8.4, 1.4, 1H, Ar); 6.99-6.93 (м, 3H, Ar); 6.78-6.70 (м, 1H, 6-H азепин); 5.90 (д, J = 8.4, 1H, 7-H азепин); 5.37 (т, J = 6.9, 1H, 4-H азепин); 3.4-3.0 (м, 4H CH2СН3); 2.88 (д, J = 6.6, 2H, 3-H азепин); 1.2-1.0 (м, 6H, CH2СН3).
В отличие от азепина 3b, выходы соединений 3a и 3a' существенно менялись при замене растворителя. Использование 1,4-диоксана приводило к преимущественному образованию одного продукта – азепина 3а, тогда как использование этанола – к увеличению выхода 2,7-3Н-азепина 3а' с одновременным уменьшением выхода 2,3-замещенного-3Н-азепина 3а, и в то же время к снижению суммарного выхода реакции (табл. 1).
Таблица 1.
Выходы азепинов 3a и 3a' в различных растворителях
| Растворитель | Выходы, % | kŋ(3a)/ŋ(3a') | |
|---|---|---|---|
| 3а | 3a' | ||
| 1,4-диоксан | 46 | 8 | 5.8 |
| ТГФ | 36 | 9 | 4.0 |
| MeCN | 41 | 17 | 2.4 |
| EtOH (азеотроп) | 28 | 16 | 1.8 |
Это может быть связано с изменением нуклеофильности орто-аминофенола в растворителях [7], что приводит к более вероятному его присоединению к менее стабильному интермедиату В', находящемуся в динамическом равновесии с интермедиатом В через арилнитрен А.
Суммарные выходы азепинов 3а и 3а' уменьшаются из-за роста вероятности реакции арилнитрена А (например, реакция образования 2-амино-N,N-диэтилбензамида – продукта отрыва атомов водорода арилнитреном А от растворителя).
Список литературы
Sharif S.A., Calder E.D., Delolo F.G., Sutherland A. // J. Org. Chem. 2016. V. 81. № 15. P. 6697.
Gritsan N.P., Tigelaar D., Platz M.S. // J. Phys. Chem. A. 1999. V. 103. № 23. P. 4465.
Ulfa S.M., Okamoto H., Satake K. // Heterocycles. 2011. V. 83. № 6. P. 1259.
Karney W.L., Borden W.T. // J. Am. Chem. Soc. 1997. V. 119. № 14. P. 3347.
Lamara K., Smalley R.K. // Tetrahedron. 1991. V. 47. № 12–13. P. 2277.
Budruev A.V., Dzhons D.Y., Faerman V.I., Fukin G.K., Shavyrin A.S. // Chem. Heterocycl. Compd. 2016. V. 52. № 9. P. 694. [Будруев А.В., Джонс Д.Ю., Фаерман В.И., Фукин Г.К., Шавырин А.С. // Химия гетероциклических соединений 2016, Т. 52. № 9. С. 694.]
Brotzel F., Chu Y. C., Mayr H. // J. Org. Chem. 2007. V. 72. №. 10. P. 3679.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий