Химия высоких энергий, 2021, T. 55, № 6, стр. 475-486
Одномерное моделирование СВЧ разряда в газовом пузыре в воде
Ю. А. Лебедев a, *, А. В. Татаринов a, И. Л. Эпштейн a, А. Ю. Титов a
a ФГБУН “Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук”
119991 Москва, Ленинский просп., 29, Россия
* E-mail: lebedev@ips.ac.ru
Поступила в редакцию 15.04.2021
После доработки 01.07.2021
Принята к публикации 06.07.2021
Аннотация
Настоящая работа посвящена моделированию СВЧ разряда в воде и изучению кинетических процессов в газовой смеси продуктов разложения воды. Расчеты проводились для атмосферного и пониженного давления при постоянной температуре газа. Одномерная модель основана на совместном решении уравнения баланса для нейтральных и заряженных компонент плазмы, уравнения Больцмана, уравнения для стационарного распределения СВЧ поля в объеме заполненного плазмой и уравнения Пуассона. С помощью нульмерной модели получена сокращенная кинетическая схема реакций для плазмы водяного пара, которая использовалась в одномерной модели. Проведены расчеты для заданных значений СВЧ поля. Показано, что полученные с помощью нульмерной модели режимы перехода от электроотрицательной к электроположительной плазме при значениях E/N выше 350 Тд не наблюдаются в рамках одномерной модели СВЧ разряда. В широком диапазоне значений СВЧ поля, заданных на антенне, СВЧ плазма в воды электроотрицательна. Концентрация электронов невелика по сравнению с концентрацией положительных ионов H3O+, ${{{\text{H}}}_{{\text{5}}}}{\text{O}}_{2}^{ + },$ H3O+(H2O)3, квазинейтральность поддерживается отрицательным ионом OH-, а степень диссоциация воды не превышает 20–25%.
ВВЕДЕНИЕ
Разряды в жидкостях и в контакте с ними привлекают большое внимание исследователей из-за возможностей решения различных прикладных задач, таких как получение водорода, ацетилена, наночастиц углерода, наночастиц оксидов и нитридов различных металлов и др. Достоинством таких систем является их высокая химическая активность [1–8]. Большое место в таких исследованиях занимают разряды в воде, которые позволяют решить многие экологические проблемы, связанные с ее детоксикацией [9–12]. В этих задачах используются различные типы электрических разрядов, но наименее исследованы микроволновые разряды. Известно, что СВЧ разряды обладают рядом особенностей. В частности, они обеспечивают более мягкие условия для плазменных процессов и не требуют экстремально высоких электрических полей для создания плазмы, дают возможность получать плотную плазму, в ряде случаев процесс очистки воды идет более интенсивно, чем при использовании дуговой и ВЧ плазмы. Ряд сведений о таких разрядах представлен в [14–21]. В [22] проведено сравнение характеристик ВЧ и микроволнового разряда в воде, а в [23] проведено сравнение микроволнового разряда в воде и углеводородах. Нужно отметить, что микроволновые разряды всегда создаются в газовых пузырях (диаметр пузырей достигает нескольких миллиметров), которые возникают при испарении жидкости у микроволновой антенны, или создаются искусственно. Этот факт наглядно проиллюстрирован в [24] при измерении пробойной напряженности микроволнового поля. Показано, что пробивная напряженность на несколько порядков меньше пробивной напряженности жидкости и практически не отличается от пробивной напряженности в газе. Однако данных о достоинствах такого разряда недостаточно и требуются дальнейшие исследования. В настоящей работе предпринята попытка получить новую информацию о микроволновых разрядах в воде. Разряды в воде представляют интерес как для задач получения водорода и ее очистки от примесей, так и из-за того, что вода используется в качестве компонента плазменно-растворных систем.
Набор имеющихся экспериментальных данных о микроволновом разряде в воде весьма ограничен. Суммируя известные экспериментальные сведения о параметрах микроволновых разрядов в воде можно отметить, что, хотя и есть результаты по получению разряда при атмосферном давлении над поверхностью жидкости, многие работы проводятся при пониженном давлении 30–70 Торр (при 30°С давление насыщенных паров воды 30 Торр). Это позволяет облегчить процесс зажигания разряда. Разряд создается при микроволновых мощностях 150 Вт–1 кВт. Определенная по излучению радикала ОН вращательная температура в разряде достигает 3–4 кК и слабо зависит от давления. Концентрация электронов достигает 7 × 1014 см–3. Температура электронов порядка 5 кК. При возбуждении разряда с помощью коаксиальной линии, напряженность микроволнового поля на центральном электроде порядка 10 кВ/см при мощности 150–200 Вт.
Проводились расчеты кинетических процессов в разрядах в воде. Среди расчетных работ, связанных с плазмой в пузырях, можно отметить [25–27].
Целью настоящей работы является построение одномерной модели процессов в микроволновой плазме в паровом пузыре в воде при атмосферном и пониженном давлениях и проведение сравнения полученных в расчетах характеристик плазмы при разных давлениях, температурах газа и приведенных напряженностях электрического поля. Первая часть работы, связанная с нульмерным моделированием, носит методический характер и направлена на разработку укороченной кинетической схемы процессов, которую можно применять при одномерном и двумерном моделировании.
ПОСТАНОВКА ЗАДАЧИ
Из экспериментов известно, что СВЧ разряд горит на торце антенны, помещенной в воду. Вода кипит, на поверхности антенны образуются пузырьки с плазмой водяного пара, которые со временем растут в диаметре, отрываются и всплывают к поверхности.
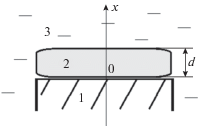
В настоящей работе рассматриваются только процессы в газовом пузыре без учета гидродинамических свойств самого плазменного образования. Процессы, инициированные разрядом в воде, не рассматриваются. Считается, что размер плазменного образования в направлении оси антенны много меньше длины волны СВЧ волны и что плазма однородна в поперечном направлении. При таком подходе рассматривается нестационарная одномерная задача внутри слоя плазмы 2 заданной толщины d с граничными условиями на поверхности антенны 1 (рис. 1). В работе считалось, что d = 2 мм, что соответствует данным экспериментов.
УРАВНЕНИЕ ДЛЯ СВЧ ПОЛЯ
В данной постановке задачи для СВЧ поля используется упрощенная формула, описывающая распределение стационарного поля вблизи антенны в плазменной среде:
Тогда выражение для СВЧ поля, используемое в одномерной модели, следующее:
(1)
${{\bar {E}}_{{{\text{MW}}}}}\left( x \right) = {{E}_{0}}{{\left\{ {{{{\left( {1~ - ~\frac{{{{n}_{e}}\left( x \right)}}{{{{n}_{{{\text{norm}}}}}}}} \right)}}^{2}} + {{{\left( {\frac{\nu }{\omega }\frac{{{{n}_{e}}\left( x \right)}}{{{{n}_{{{\text{norm}}}}}}}} \right)}}^{2}}} \right\}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}.$Отметим, что при параметрах плазмы, реализуемых в наших условиях, размер скин-слоя существенно превышает d.
УРАВНЕНИЯ БАЛАНСА ДЛЯ ЧАСТИЦ ПЛАЗМЫ
Из многочисленных работ, посвященных моделированию разрядов в водяном паре, мы отметим здесь работу [28], и несколько сокращенную схему процессов [29], происходящих в воде, соответственно, в импульсном и барьерных разрядах. В работе [29] была использована кинетическая модель для диссоциации паров воды в нетермической плазме при атмосферном давлении и анализируются возможные каналы диссоциации воды, характерные времена реакций и ключевые процессы формирования H2. При выборе процессов диссоциации молекулы воды под действием электронного удара авторы работы [29] выбрали 12 элементарных процессов из 18 процессов, представленных в работе [28]. Они исключили реакции с образованием отрицательных ионов O–, OH– и возбужденного атома кислорода O*(3P). Для описания процесса отлипания электронов при столкновениях иона с тяжелыми частицами учитывался только процесс ассоциативного отлипания, поскольку прямое отлипание электронов в столкновениях неэффективно при описываемых температурах тяжелых частиц.
Одной из задач работы было построение на базе модели, используемой при нуль-мерном моделировании, сокращенной схемы кинетических процессов, которая позволяла бы одно и двумерное моделирование разряда. В данной работе в качестве исходной использовалась кинетическая схема из работы [29] с добавлением электронных процессов с образованием отрицательных ионов O–, OH–. Полная схема содержит 176 реакций для 35 компонент. Были проведены расчеты в нульмерном приближении с использованием полной кинетической схемы для постоянного СВЧ поля (см. ниже). Известно, что в разряде в парах воды могут образовываться тяжелые положительные ионы, в том числе и кластерные ионы [29–32]. Известно, также, что концентрация таких ионов зависит от газовой температуры и с повышением последней, концентрация таких ионов уменьшается [30, 31]. В рассматриваемых в настоящей работе условиях температура газа достаточно велика, поэтому мы в рамках упрощенной модели ограничивались присутствием ионов H3O+(H2O)n c n не превышающем 3. Для кластерных ионов учитывалась только электрон-ионная рекомбинация, т.к. в предварительных расчетах было установлено, что влиянием ион-ионной рекомбинации можно пренебречь.
Анализ схемы позволил уменьшить число учитываемых компонент до 19, а кинетическую схему сократить до 56 реакций (табл. 1).
Таблица 1.
Сокращенная кинетическая схема плазмохимических процессов в водяном паре
| № | Реакция | Константы скоростей реакций [см3/моль сек; см6/мол2 сек]; T [K], Te [эВ], если не отмечено в формуле отдельно; f = 6.02 × 1023 |
Литература |
|---|---|---|---|
| Диссоциация под электронным ударом | |||
| (1) | e + H2O → H + OH + e | k(E/N) | [28] |
| Ионизация под электронным ударом | |||
| (2) | e + H2O → 2e + H2O+ | k(E/N) | [28] |
| Диссоциативное прилипание | |||
| (3) | e + H2O → H– + OH | k(E/N) | [28] |
| (4) | e + H2O → O– + H2 | k(E/N) | [28] |
| (5) | e + H2O → OH- + H | k(E/N) | [28] |
| Реакции нейтральных частиц | |||
| (6) | OH + OH → H2O2 | 1.020 × 1013 | [33] |
| (7) | OH + HO2 → H2O + O2 | f 4.8 × 10–11⋅e2.08[kJ/mole]/RT | [33] |
| (8) | OH + H2O2 → HO2 + H2O | f 2.9 × 10–12⋅e–1.33 [kJ/mole]/RT | [33] |
| (9) | H + HO2 → H2O + O | f 5.0 × 10–11⋅e–7.20 [kJ/mole]/RT | [33] |
| (10) | H + HO2 → OH + OH | f 2.81 × 10–10⋅e–3.66 [kJ/mole]/RT | [33] |
| (11) | H + HO2 → O2 + H2 | f 7.11 × 10–11⋅e –5.90 [kJ/mole]/RT | [33] |
| (12) | H + OH → O + H2 | f 6.86 × 10–14(T/298)2.80e–16.21 [kJ/mole]/RT | [33] |
| (13) | H + O2 → HO2 | 1.084 × 1012 | [33] |
| (14) | OH + OH → H2O + O | f 7.89 × 10–14 (T/298)2.60e7.86 [ kJ/mole]/RT | [33] |
| (15) | OH + O → O2 + H | f 4.55 × 10–12(T/298)0.40e3.09 [kJ/mole]/RT | [30] |
| (16) | OH + H2 → H2O + H | f 2.97 × 10–12(T/298)1.21e–19.71 [kJ/mole]/RT | [33] |
| (17) | O + OH → HO2 | f 2.69 × 10–10e –0.26 [kJ/mole]/RT | [33] |
| (18) | O + H2 → OH + H | f 3.44 × 10–13(T/298)2.67e–26.27 [kJ/mole]/RT | [33] |
| (19) | O + H2O → OH + OH | f 6.68 × 10–13(T/298)2.60e–63.52 [kJ/mole]/RT | [33] |
| (20) | H2O2 + H → OH + H2O | f 4.0 × 10–11e–16.63 [kJ/mole]/RT | [33] |
| (21) | H2O2 + H → HO2 + H2 | f 8.0 × 10–11e–33.26 [kJ/mole]/RT | [33] |
| (22) | H2O2 + O2 → 2HO2 | f 9.0 × 10–11e–166 [kJ/mole]/RT | [33] |
| (23) | H2O2 + M → 2 OH + M | 9.000 × 10–3 | [33] |
| (24) | HO2 + H2 → H2O2 + H | f 5.0 × 10–11e –109 [kJ/mole]/RT | [33] |
| (25) | HO2 + HO2 → H2O2 + O2 | f 2.2 × 10–13e 4.99 [kJ/mole]/RT | [33] |
| (26) | HO2 + M → H + O2 + M | f 2.41 × 10–8(T/298)–1.18e–203 [kJ/mole]/RT | [33] |
| (27) | H2O + H → H2 + OH | f 1.58 × 10–11 (T/298)1.20e–79.90 [kJ/mole]/RT | [33] |
| (28) | OH + OH + M → H2O2 + M | f 6.89 × 10–31(T/298)–0.80 | [33] |
| (29) | H + O2 + H2O → HO2 + H2O | 2.321 × 1017 | [33] |
| (30) | H + OH + H2O → H2O + H2 | 1.101 × 1018 | [33] |
| Перенос заряда | |||
| (31) | H2O++ H2O → H3O+ + OH | 3.010 × 1014 | [28] |
| (32) | H2O+ + H2 → H3O+ + H | 8.431 × 1014 | [28] |
| (33) | H2O+ + O2 → ${\text{O}}_{{\text{2}}}^{{\text{ + }}}$ + H2O | 9.033 × 1013 | [28] |
| (34) | H– + H2O→ OH– + H2 | 2.288 × 1015 | [28] |
| (35) | ${\text{O}}_{{\text{2}}}^{{\text{ + }}}$ + 3H2O → ${{{\text{H}}}_{{\text{5}}}}{\text{O}}_{{\text{2}}}^{{\text{ + }}}$ + O2 + OH | 1.144 × 1015 (*) | [28] |
| Ион-электронное отлипание | |||
| (36) | H– + e → 2e + H | 6.020 × 1017 | [29] |
| (37) | O– + e → 2e + O | 2.400 × 1016 | [29] |
| Реакции нейтрализации | |||
| (38) | O– + H2O+ → O + H2O | 6.203 × 1016 | [28] |
| (39) | OH– + H2O+ → OH + H2O | 6.323 × 1016 | [28] |
| (40) | H– + H2O+ → H + H2O | 1.855 × 1017 | [28] |
| Ион-молекулярные реакции | |||
| (41) | H3O+ + 2H2O → H3O+H2O + H2O | 6.530 × 1020 | [29] |
| (42) | H3O+H2O + 2H2O → H3O+(H2O)2 + H2O | 8.340 × 1020 | [29] |
| (43) | H3O+(H2O)2 + 2H2O → H3O+(H2O)3 + H2O | 8.710 × 1020 | [29] |
| Электрон-ионная рекомбинация | |||
| (44) | e + H3O+ + H2O → H + 2H2O | 9.790 × 1024 | [29] |
| (45) | e + H3O+H2O + H2O → H + 3H2O | 9.790 × 1024 | [29] |
| (46) | e + H3O+(H2O)2 + H2O → H + 4H2O | 9.790 × 1024 | [29] |
| (47) | e + H3O+(H2O)3 + H2O → H + 5H2O | 9.790 × 1024 | [29] |
| (48) | e + H3O+(H2O)2 → H + 3H2O | f 4.5 × 10−6 (300/Te[K])0.5 | [29] |
| (49) | e + ${{{\text{H}}}_{{\text{5}}}}{\text{O}}_{{\text{2}}}^{{\text{ + }}}$ → H + 2H2O | f 106 × 2.4 × 10−12(0.026/Te)0.08 | [28] |
| (50) | e + ${\text{O}}_{{\text{2}}}^{{\text{ + }}}$ → 2O | f 106 × 2 × 10−14(0.026/Te)1/2 | [28] |
| Прилипание | |||
| (51) | e + O2 → O– + O | f 1.07 × 10−9${\text{T}}_{{\text{e}}}^{{ - 1.391}}{{e}^{{{{ - 6.26} \mathord{\left/ {\vphantom {{ - 6.26} {{{{\text{T}}}_{{\text{e}}}}}}} \right. \kern-0em} {{{{\text{T}}}_{{\text{e}}}}}}}}}$ | [13] |
| Ассоциативное отлипание | |||
| (52) | H– + O2 → HO2 + e | 7.260 × 1014 | [28] |
| (53) | O– + O → O2 + e | 9.030 × 1013 | [28] |
| (54) | OH– + H → H2O + e | f 106 × 1.0 × 10−15 | [28] |
| (55) | OH– + HO2 → H2O + O2 + e | 6.023 × 1014 | [13] |
| (56) | H2 + O– → H2O + e | 3.614 × 1014 | [28] |
Сокращенная модель включает положительно и отрицательно заряженные ионы: H2O+, H3O+, ${{{\text{H}}}_{{\text{5}}}}{\text{O}}_{{\text{2}}}^{ + },$ H3O+H2O, H3O+(H2O)2, H3O+(H2O)3, ${\text{O}}_{{\text{2}}}^{ + },$ H–, O–, OH–, электроны и нейтральные молекулы H2O, H2, O2, OН, Н, О, H2O2, HO2.
Для каждой компоненты плазмы записывается балансное уравнение в следующем виде:
(2)
${{\partial {{n}_{i}}} \mathord{\left/ {\vphantom {{\partial {{n}_{i}}} {\partial {\text{t}}}}} \right. \kern-0em} {\partial {\text{t}}}} - \nabla \cdot \left( {{{D}_{i}}\nabla {{n}_{I}}~ + ~z{{\mu }_{i}}{{n}_{i}}\nabla \varphi } \right) = {{R}_{I}}.$Здесь ni – концентрация i-ой компоненты плазмы, Di – коэффициенты диффузии для нейтральных и заряженных компонент плазмы, ${{\mu }_{i}}$ – коэффициенты подвижности для электронов и ионов, $\varphi $ – электрический потенциал, z = ±1 в зависимости от заряда иона, Ri – скорости реакций компонент плазмы.
Для нейтральных газовых компонент под Di понимается коэффициент бинарной диффузии молекулы воды и нейтральной молекулы i. Он определяется с помощью параметров потенциала Леннарда-Джонса [34].
Для подвижности ионов были использованы выражения, полученные в рамках задачи о дрейфе ионов в несильных полях [35]. Движение иона определяется его поляризационным взаимодействием с нейтральной молекулой и определяется по формуле ${{\mu }_{i}} = {e \mathord{\left/ {\vphantom {e {\left( {M{\kern 1pt} '{{\nu }_{m}}} \right)}}} \right. \kern-0em} {\left( {M{\kern 1pt} '{{\nu }_{m}}} \right)}} = {e \mathord{\left/ {\vphantom {e {\left( {M{\kern 1pt} 'N{v}{\kern 1pt} {\kern 1pt} '\sigma _{{tr}}^{'}} \right)}}} \right. \kern-0em} {\left( {M{\kern 1pt} 'N{v}{\kern 1pt} {\kern 1pt} '\sigma _{{tr}}^{'}} \right)}}.$ Здесь е – заряд электрона, $M{\kern 1pt} '$ – приведенная масса налетающего иона, ${{\nu }_{m}}$ – частота столкновений иона с нейтральной молекулой, N – суммарное число молекул,${v}{\kern 1pt} '$ – средняя скорость относительного движения иона, $\sigma _{{{\text{tr}}}}^{'}$ – транспортное сечение взаимодействия иона с молекулой. Молекула воды обладает собственным большим дипольным моментом d0 и наведенной поляризацией можно пренебречь в случае ионов с энергиями εi < 2.3 эВ [35]. В нашем случае это условие выполняется. Транспортное сечение взаимодействия иона с молекулой с собственным дипольным моментом d0 в отсутствии резонансной перезарядки задается формулой: $~\sigma _{{{\text{tr}}}}^{'}~\sim 2\pi a_{0}^{2}\left( {{{{{d}_{0}}} \mathord{\left/ {\vphantom {{{{d}_{0}}} {e{{a}_{0}}}}} \right. \kern-0em} {e{{a}_{0}}}}} \right){{{{I}_{H}}} \mathord{\left/ {\vphantom {{{{I}_{H}}} {\varepsilon {\kern 1pt} '}}} \right. \kern-0em} {\varepsilon {\kern 1pt} '}}$ [35]. Здесь ${{a}_{0}}{\text{\; = \;0}}{\text{.53}} \times {\text{1}}{{{\text{0}}}^{{ - {\text{11}}}}}$ м – Боровский радиус атома водорода, ${{I}_{H}} = {\text{13}}.6$ эВ – его потенциал ионизации. Для иона ${{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}^{{\text{ + }}}}$ транспортное сечение определяется резонансной перезарядкой
(3)
$\sigma _{{{\text{tr}}}}^{'}{\text{\; = \;}}\pi a_{0}^{2}~\frac{{{{I}_{H}}}}{I}~{\text{l}}{{{\text{n}}}^{2}}\left( {\frac{{{\text{100}}{{\upsilon }_{0}}}}{\upsilon }\sqrt {\frac{I}{{{{I}_{H}}}}} } \right).$Коэффициенты диффузии ионов связаны с подвижностью соотношением Эйнштейна: Di/μi = = kT/e.
УРАВНЕНИЕ БОЛЬЦМАНА ДЛЯ ЭЛЕКТРОНОВ ПЛАЗМЫ
Для определения функции распределения электронов по энергиям (ФРЭЭ) используется уравнение Больцмана, записанное в двучленном приближении разложения ФРЭЭ по сферическим гармоникам [27]. Константы скорости реакций электронных процессов (1)–(5) в табл. 1 рассчитываются с помощью набора соответствующих сечений реакций и ФРЭЭ и являются функциями значений приведенного поля E/N. Коэффициенты диффузии и подвижности для электронов также вычисляются из ФРЭЭ для полученных значений E/N. В данной работе ФРЭЭ была рассчитана с помощью программы BOLSIG+ [36] и набору сечений столкновений электронов с молекулами воды, взятыми из [28, 37].
УРАВНЕНИЕ ПУАССОНА
При решении системы балансных уравнений для определения электрического потенциала $\varphi ,$ возникающего вследствие разделения зарядов, на каждом шаге по времени решается уравнение Пуассона
(4)
$ - \nabla \cdot \nabla \varphi = \frac{e}{{{{\varepsilon }_{0}}}}\left( {\sum\limits_p {{{n}_{p}}} - \sum\limits_n {{{n}_{n}} - {{n}_{e}}} } \right),$ГРАНИЧНЫЕ И НАЧАЛЬНЫЕ УСЛОВИЯ
Температура газа считалась варьируемым параметром и не зависела от состава плазмы. В одномерной модели она принималась равной 500 и 2000 К. Расчеты проводились при пониженном (30 Тор) и атмосферном давлениях.
Значения концентрации водяного пара на границах x = 0 и x = d соответствовали заданным температуре и давлению. Граничные значения для концентраций остальных компонент плазмы и потенциала $\varphi $ полагались равными нулю. Граничные значения СВЧ поля равны соответственно E(0) = E0. Расчеты проводились для нескольких заданных значений амплитуды СВЧ поля E0 в диапазоне 0.5–10 кВ/см, частота СВЧ поля 2.45 ГГц.
Начальное распределение концентрации водяного пара постоянно по оси x и соответствовало значению на границах разряда.
Начальные значения концентраций заряженных частиц не известны. В расчетах мы взяли постоянные однородные начальные распределения электронов и ионов H2O+ равные 10–6 моль/м3, что соответствует примерно концентрации 1011 см–3 при атмосферном давлении. В предварительных расчетах нульмерной модели мы варьировали начальные концентрации в интервале от 1010 до 1013 см–3. Значение начальной концентрации заряженных частиц и выбор сорта положительного иона оказывало влияние на решение на временах, не превышающих 10–7–10–5 с. Так как в этой работе нас интересовало в основном стационарное решение, то начальные значения электронов и выбранного положительного иона не важны.
Начальные распределения для концентраций остальных нейтральных и заряженных компонент плазмы полагались равными нулю.
Система уравнений (1)–(3) с заданными граничными и начальными условиями решалась при помощи пакета Comsol 3.5a [35] до получения стационарных решений.
ПРЕДВАРИТЕЛЬНЫЕ РАСЧЕТЫ В РАМКАХ НУЛЬМЕРНОЙ МОДЕЛИ
На первом шаге были проведены расчеты в нульмерном приближении с использованием полной кинетической схемы для СВЧ поля, задаваемого внутри плазмы с целью разработки укороченной схемы процессов. Для реактора использовалась модель реактора идеального перемешивания [38]. Рассматривались давления 1 атмосфера и 30 Торр и газовые температуры 500 и 2000 К. Значения E/N менялась от 150 до 500 Тд. Полученные расчеты показали, что при увеличении E/N происходит переход от электроотрицательного режима, в котором отрицательный заряд плазмы определяется ионами, к электроположительному в котором концентрация электронов больше концентрации отрицательных ионов. Величина переходного значения E/N зависит как от давления, так и от газовой температуры, она меняется от 200 до 450 Тд. Как показали наши дальнейшие одномерные расчеты режим разряда для всех рассмотренных нами условий является электроотрицательным. Величина E/N внутри плазмы 200–350 Тд.
Проведенный нами анализ показал, что на временах меньших 10–8 с, диссоциация воды происходит под действием электронного удара
В последующем на больших временах наряду с этой реакцией при больших температурах основной становится реакция
При малых температурах реакция
уже не влияет, а имеют значение реакции
Для реакций образования воды самые существенные реакции – это реакции электрон-ионной рекомбинации
и на больших временах реакция
Скорость реакции OH + H2 → H2O + H растет с ростом температуры. Это приводит к увеличению степени конверсии воды с уменьшением температуры. Уменьшение давления приводит к увеличению степени разложения воды т.к. реакции
являются реакциями второго порядка и их скорость падает с давлением (суммарной концентрацией частиц).
Анализ показал, что основной реакцией образования электронов является реакция ионизации
Другой важной реакцией является реакция отлипания
Реакция отлипания
становится существенной только при пониженном давлении и небольшой температуре. Гибель электронов происходит в реакциях прилипания
Ионы ОН– являются основными отрицательными ионами. Они образуются в реакции
а гибнут в реакциях отлипания
Основной положительный ион в рассмотренных условиях ион H3O+(H2O)3. При давлении в 1 атм и температуре Т = 500 К концентрация иона ${{{\text{H}}}_{{\text{5}}}}{\text{O}}_{2}^{ + }$ становится сравнимой с концентрацией иона H3O+(H2O)3. ${{{\text{H}}}_{{\text{5}}}}{\text{O}}_{2}^{ + }$ получается в результате цепочки реакций:
(5)
${\text{O}}_{2}^{ + }~\xrightarrow{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}~{{{\text{H}}}_{{\text{2}}}}{\text{O}}_{3}^{ + }\xrightarrow{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}{{{\text{H}}}_{{\text{4}}}}{\text{O}}_{2}^{ + }~\xrightarrow{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}~{{{\text{H}}}_{{\text{5}}}}{\text{O}}_{2}^{ + }.$Анализ показал, что первый шаг в этой цепочке является самым медленным. Поэтому для уменьшения числа переменных в одномерных расчетах мы записали образование иона через реакцию
c константой второго порядка, соответствующей первому шагу цепочки (5). Возможность такого упрощения была проверена расчетным путем и замена цепочки реакций суммарной реакцией не привела к изменению результатов расчетов.
Анализ показал, что основными реакциями образования водорода являются реакция
приводящая также к образованию иона ОН–, а также реакции
Основная реакция, приводящая к гибели молекулы водорода, это реакция
Кроме того, влияют ионные реакции
Основные процессы образования OH это диссоциация молекул воды под электронным ударом и процессы между нейтральными молекулами
Основной канал гибели OH при 2000 К – реакция
а при 500 К реакции
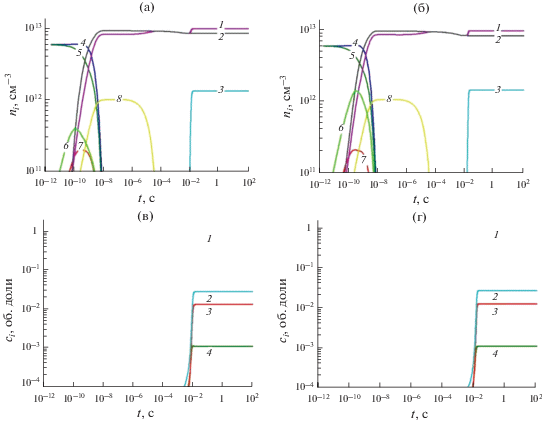
Как уже отмечалось, для расчетов в рамках одномерной модели кинетическая схема была упрощена (табл. 1). На рис. 2 приведены примеры некоторые результаты при расчете по полной и укороченной схеме. Видно, что результаты расчетов по полной и упрощенной схемам основных параметров удовлетворительно согласуются и упрощенную схему можно использовать в расчетах по одномерной модели.
РАСЧЕТЫ ПО ОДНОМЕРНОЙ МОДЕЛИ. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Для расчета поля по формуле (1) в одномерных расчетах необходимо задать значение Е0. Предварительно были проведены 2D расчеты электродинамики в пустой разрядной камере, используемой нами ранее [39]. Величина поля на торце электрода составляет примерно 10–30 кВ/см в зависимости от падающей мощности. Этот диапазон мы использовали в 1D расчете для величины Е0 при давлении равном 1 атм и газовой температуре 2000 К. Для случая p = 30 Торр и Т = = 500 К задавались такие значения Е0, которые дают такие же значения величины E0/N на торце электрода, что и при p = 1 атм и T = 2000 К.
Ниже мы приводим полученные в расчете стационарные распределения разных переменных. На рис. 3 показаны аксиальные распределения СВЧ-поля для разных значений Е0, посчитанные по формуле (1). При р = 30 Торр наблюдается резонанс поля вблизи границы разряда. Важно отметить, что внутри разряда величина поля очень слабо зависит от поля на торце антенны.
Рис. 3.
Стационарные аксиальные распределения СВЧ поля. (a) p = 30 Torr, T = 500 K; 1 – E0 = 0.8 кВ/см; 2 – E0 = = 1.6 кВ/см; 3 – E0 = 4.0 кВ/см; (б) p = 760 Торр, T = 2000 K; 1' – E0 = 10 кВ/см; 2' – E0 = 15 кВ/см; 3' – E0 = 25 кВ/см.
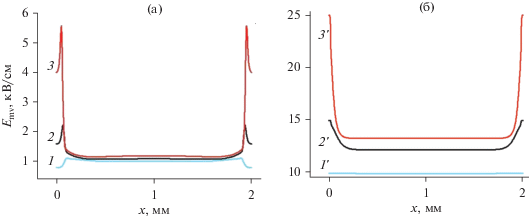
На рис. 4 показаны рассчитанные аксиальные распределения величины E/N для разных значений величины поля на электроде Е0. Для давления 30 Торр E/N внутри разряда имеет значение порядка 200 Тд. Для 1 атмосферы E/N внутри разряда меняется примерно от 300 до 400 Тд. Эти значения соответствуют электроотрицательному режиму разряда, т.е. электронов всегда много меньше, чем отрицательных ионов.
Рис. 4.
Стационарные аксиальные распределения параметра E/N. (a) p = 30 Торр, T = 500 K 1 – E0 = 1.6 кВ/см; 2 – E0 = = 2.4 кВ/см; 3 – E0 = 3.2 кВ/см; 4 – E0 = 4.0 кВ/см; 5 – E0 = 5.6 кВ/см; (б) p = 760 Торр, T = 2000 K; 1' – E0 = 10 kV/cm; 2' – E0 = 15 кВ/см; 3' – E0 = 20 кВ/см; 4' – E0 = 25 кВ/см; 5' – E0 = 35 кВ/см. Отметим, что граничные значения E/N соответствующие кривым 1 и 1', 2 и 2', 3 и 3', 4 и 4', 5 и 5' одинаковы для случаев (a) и (б). Однако масштабы, выбранные здесь для удобства рассмотрения профилей E/N внутри плазмы, не позволяют это увидеть.
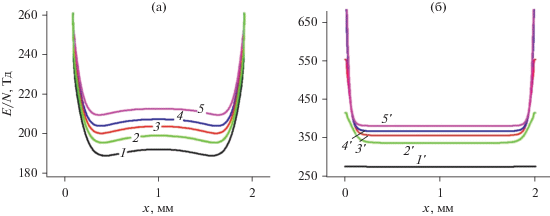
Рис. 5.
Стационарные аксиальные распределения концентрации электронов. (a) p = 30 Торр, T = 500 К; (б) p = 760 Торр, T = 2000 К. Кривые 1–5 и 1'–5' соответствуют тем же граничным значениям E0/N, что и на рис. 4.
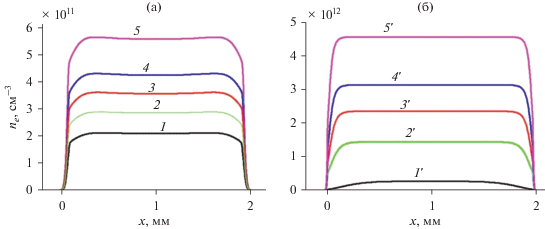
Рис. 6.
Стационарные аксиальные распределения концентрации основного отрицательного иона ОН–. (а) p = 30 Торр, T = 500 К; (б) p = 760 Торр, T = 2000 К. Кривые 1–5 и 1'–5' соответствуют тем же граничным значениям E0/N, что и на рис. 4.
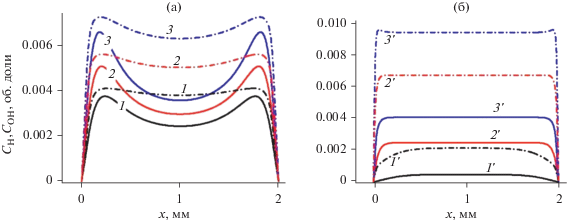
На рис. 5 и 6 показаны стационарные концентрации электронов и основного отрицательного иона ОН–. Их концентрации при атмосфере примерно на порядок больше, чем при давлении 30 Торр. Это связано с тем, что полученные значения E/N в объеме реактора при атмосферном давлении больше чем для 30 Торр при одинаковых значениях E/N на электроде. Аксиальное распределение концентрации иона ОН– гораздо более плоское при атмосферном давлении, чем при 30 Торр из-за меньшего влияния диффузии. Основным положительным ионом при всех режимах является ион H3O+(H2O)3.
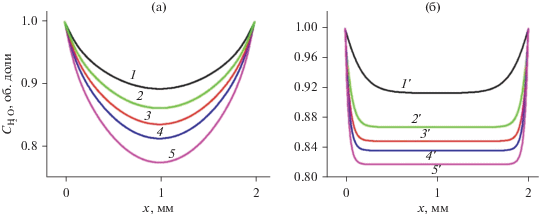
На рис. 7 показаны рассчитанные стационарные концентрации водяного пара. Разница в профилях H2O для двух давлений обусловлена влиянием диффузии, хотя средняя по объему реактора объемная доля H2O примерно одинакова и меняется примерно от 0.93 до 0.83 в зависимости от величины Е0. Это различие связано с большой диссоциацией водяного пара вблизи электрода. Важно отметить, что средняя по объему степень диссоциации в СВЧ разряде не превышает 20%, что связано с уменьшением величины приведенного СВЧ поля в объеме плазмы из-за его самосогласованной связи с концентрацией электронов (уравнение (1)).
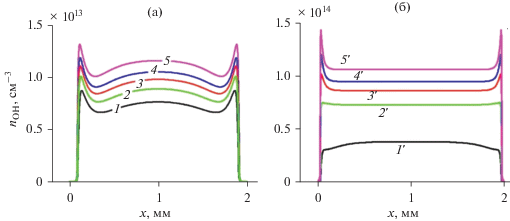
Рис. 8.
Стационарные концентрации молекулы водорода (сплошные линии) и пероксида водорода (пунктирные л-инии).
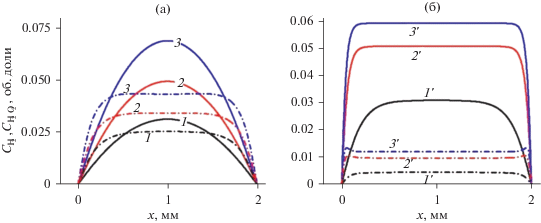
Рис. 9.
Стационарные концентрации атома водорода (сплошные линии) и гидроксильного радикала (пунктирные л-инии).
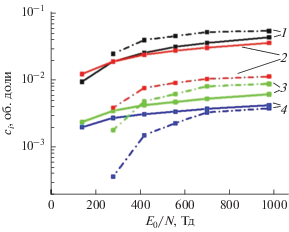
На рис. 8 и 9 показаны стационарные профили продуктов разложения водяного пара. На рис. 10 показаны эти концентрации осредненные по объему реактора. Видно, что при атмосфере в водород идет больше молекул, чем при 30 Торр, а в пероксид водорода меньше. Концентрация радикала OH превосходит концентрацию атома Н при всех рассмотренных условиях.
ВЫВОДЫ
В одномерном приближении проведено моделирование СВЧ разряда (2.45 ГГц) в парах воды в геометрии, моделирующей паровой пузырь у антенны СВЧ разряда в воде при давлениях 30 Торр и атмосферном давлении при использовании температуры газа в качестве параметра. Расчеты проводились по укороченной схеме кинетических процессов, полученной в результате анализа известных моделей. Основные результаты могут быть сформулированы следующим образом.
• Учет связи СВЧ поля с концентрацией электронов приводит к уменьшению напряженности СВЧ поля в объеме плазмы (параметр E/N составляет 200–300 Тд) по сравнению с напряженностью поля на антенне. Это приводит к тому, что переход плазмы в режим с преобладанием концентрации электронов над концентрацией отрицательных ионов (электроположительная плазма), наблюдаемый без учета влияния плазмы на поле при больших Е/N, не происходит.
• Средняя по объему степень диссоциации в СВЧ разряде не превышает 20%, что связано с уменьшением величины приведенного СВЧ поля в объеме плазмы из-за его самосогласованной связи с концентрацией электронов
• Расчеты показывают, что основным положительным ионом является ион H3O+(H2O)3, а основной отрицательный ион – ион ОН–.
• Во всех исследованных режимах концентрация электронов всегда много меньше, чем ионов ОН–.
• При р = 30 Торр наблюдается резонансное увеличение СВЧ поля вблизи границы разряда.
Список литературы
Bruggeman P.J., Leys C. // J. Phys. D: Appl. Phys. 2009. V. 42. P. 053001.
Samukawa S., Hori M., Rauf S. et al. // J. Phys. D: Appl. Phys. 2012. V. 45. P. 253001.
Bruggeman P.J., Kushner M.J., Locke B.R. et al. // Plasma Sources Sci. and Technol. 2016. V. 25. P. 053002.
Horikoshi S., Serpone N. // RSC Adv. 2017. V. 7. P. 47196.
Adamovich I., Baalrud S.D., Bogaerts A. et al. // J. Phys. D: Appl. Phys. 2017. V 50. P. 323001.
Lebedev Yu.A. // Plasma Phys. Rep. 2017. V. 43. P. 676.
Vanraes P.A., Bogaerts A. // Appl. Phys. Rev .2018. V. 5. P. 031103.
Lebedev Yu.A. // High Temp. 2018. V. 56. P. 811.
Malik M.A., Ghaffar A., Malik S.A. // Plasma Sources Sci. Technol. 2001. V. 10. P. 82.
Rybkin V.V., Shutov D.A. // Plasma Phys. Reports. 2017. V. 43. P. 1089
Foster J. // Phys. Plasmas. 2017. V. 24. P. 055501.
Rezaei F., Vanraes P., Nikiforov A. et al. // Materials. 2019. V. 12. P. 2751.
Aoki H., Kitano K., Hamaguchi S. // Plasma Sources Sci. Technol. 2008. V. 17. P. 025006.
Hattori Y., Mukasa S., Nomura S. et al. // J. Appl. Phys. 2010. V. 107. P. 063305.
Hattori Y., Mukasa S., Toyota H. et al. // Surface & Coatings Technology. 2012. V. 206. P. 2140.
Horikoshi S., Sawada S., S. Sato S. et al. // Plasma Chemistry and Plasma Processing. 2019. V. 39. P. 51.
Ishijima T., Hotta H., Sugai H. et al. // Appl. Phys. Lett. 2007. V. 91. P. 121501.
Ishijima T., Sugiura H., Saito1 R. et al. // Plasma Sources Sci. Technol. 2010. V. 19. P. 015010.
Maehara T., Honda S., Inokuchi C. et al. // Plasma Sources Sci. Technol. 2011. V. 20. P. 034016.
Sato S., Mori K., Ariyada O et al. // Surface & Coatings Technology. 2011. V. 206. P. 955–958.
Xiao-Tong Zhao, Xiao-Mei Zhu, Zhi-Yu Yan et al. // IEEE Trans Plasma Sci. 2016. V. 44. № 8.
Nomura S., Toyota H., Mukasa S et al. // Applied Physics Express. 2008. V. 1. P. 046002.
Helena Oi Lun LI, Jun KANG, Kuniko URASHIMA et al. // J. Inst. Electrostat. Jpn. 2013. V. 37. P. 22.
Hattori Y., Mukasa S., Toyota H. et al. // Current Applied Physics. 2013. V. 13. P. 1050e1054.
Wei Tian, Kunhide Tachibana, Mark J Kushner // J. Phys. D: Appl. Phys. 2014 V. 47. P. 055202.
Takeuchi N., Ishii Y., Yasuoka K. // Plasma Sources Sci. Technol. 2012. V. 21. P. 015006 .
Tong L. Simulation of the Plasma Generated in a Gas Bubble. Excerpt from the Proceedings of the 2013 COMSOL Conference in Boston. https://www.comsol.ru/paper/simulation-of-the-plasma-generated-in-a-gas-bubble-15649
Avtaeva S., General A., Kel’man V. // J. Phys. D: Applied Physics 2010. V. 43. P. 315201.
Rehman F., Lozano-Parada J.H., Zimmerman W.B. // Int. J. Hydr. Energy. 2012. V. 37. P. 17678.
Sieck L.W., Heron J.T., Green D.S. // Plasma Chemistry and Plasma Processing. 2000. V. 20. P. 235.
Van Gaens W., Bogaerts A. // J. Phys. D. Appl. Phys. 2013. V. 46.
Смирнов Б.М. Комплексные ионы. М.: Наука, 1983. 150 с.
https://www.kinetics.nist.gov
Hirschfelder J.O., Curtiss Ch.F., Bird R.B. Molecular theory of gases and liquids. Wiley. N.Y., 1954.
Райзер Ю.П. Физика газового разряда. М.: Наука, 1987. 591 с.
Hagelaar G., Pitchford L. // Plasma Sources Sci. Technol. 2005. V. 14. P. 722.
Itikawa Y., Mason N. // J. Phys. and Chem. Ref. Data. 2005. V. 34. № 1. P. 1.
COMSOL Multiphysics. https://comsol.com/chemical-reactionengineering
Lebedev Yu.A., Tatarinov A.V., Epstein I.L., Averin K.A. // Plasma Chemistry and Plasma Processing. 2016. V. 36. P. 535.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий