Химия высоких энергий, 2022, T. 56, № 2, стр. 120-129
Радиолиз водных растворов аммиака: математическое моделирование
В. А. Грачев a, *, А. Б. Сазонов a
a НИЦ “Курчатовский институт”
123182 Москва, пл. Академика Курчатова, д. 1, Россия
* E-mail: Grachev_VA@nrcki.ru
Поступила в редакцию 01.12.2020
После доработки 28.06.2021
Принята к публикации 06.07.2021
- EDN: ZDJDQM
- DOI: 10.31857/S0023119321060073
Аннотация
Разработана математическая модель радиолиза водного раствора, содержащего компоненты теплоносителя первого контура ВВЭР: аммиак и борную кислоту. Результаты тестирования показывают, что среднее значение отклонения результатов расчета по модели от экспериментальных данных не превышает 35% при обработке около 250 экспериментальных точек. Разработанная модель корректно предсказывает временную эволюцию показателей качества теплоносителя ВВЭР (концентраций H2, O2 и NH3) и может использоваться для анализа их поведения при различных параметрах активной зоны ВВЭР (температура, мощность, содержание бора и др.).
Радиолиз теплоносителя первого контура ВВЭР под действием излучения активной зоны – совокупность огромного множества химических реакций, что обусловлено, помимо прочего, изначальным присутствием растворенных в воде борной кислоты, щелочей и аммиака. По той же причине молекулярными продуктами радиолиза теплоносителя ВВЭР будут не только водород, пероксид водорода и кислород, но и азот, его оксиды, азотная и азотистая кислоты и некоторые другие соединения.
Математическое моделирование радиолиза теплоносителя ядерного реактора необходимо, в первую очередь, для правильного выбора и обоснования параметров водно-химического режима (ВХР), а также для анализа ситуаций, связанных с его нарушениями. Для ВВЭР-1000 отдельной проблемой становится прогнозирование поведения топливных оболочек при работе реактора на мощности выше номинальной, когда в режиме кипения происходит обеднение теплоносителя водородом. Последнее потенциально способно вызвать интенсивное окисление поверхности твэлов [1]. Оценка влияния подъема мощности на локальные параметры ВХР в активной зоне невозможна без привлечения результатов моделирования радиолиза теплоносителя.
Радиолиз чистой воды сегодня изучен настолько подробно, что его математическое моделирование при самых разных внешних условиях не встречает принципиальных трудностей [2]. Что касается аммиака и его водных растворов, то их радиолиз изучался как экспериментально, так и теоретически, начиная с середины XX столетия, однако полной картины взаимных превращений азотсодержащих молекул в воде при действии облучения получить так и не удалось. Во многом это связано с тем, что публикации на данную тему нередко содержат видимые фактические ошибки и неточности.
При небольших концентрациях аммиака в водном растворе (на уровне нескольких мг/кг, характерном для ВХР теплоносителя первого контура ВВЭР) его радиолиз инициируется гидроксильными радикалами и атомами водорода, образующимися при действии излучения на воду. Получающиеся амильные радикалы (NH2) могут рекомбинировать друг с другом с образованием гидразина. Последний, также под действием свободных радикалов (ОН, NH2), окисляется до молекулярного азота. Такая схема превращений характерна, прежде всего, для растворов, насыщенных водородом, когда образование окислительных продуктов радиолиза воды (O2 и H2O2) подавлено [3].
Как показывают исследования, разложение аммиака в рассматриваемой системе обратимо [4]. Обратный процесс восстановления N2 до NH3 подразумевает, прежде всего, активацию молекул азота, которая оказывается, тем не менее, практически невозможной, если приписать всем частицам системы основное электронное состояние. В работе [5] впервые была выдвинута гипотеза о том, что активация N2 происходит при взаимодействии последнего с гидроксильным радикалом в возбужденном состоянии (ОН*). Etoh и др. [6] предложили считать основным механизмом активации прямое действие излучения на молекулы азота. В качестве доказательства авторы приводят экспериментальные данные о том, что выход связанного азота PN при облучении водных растворов смеси N2 и H2 при постоянном соотношении их концентраций пропорционален начальному содержанию азота [N2]. Однако приведенные в работе рассуждения на эту тему некорректны, т.к. пропорциональность между PN и [N2] может иметь место и в других случаях, в том числе и при активации азота гидроксилом в возбужденном состоянии.
При недостатке восстановителя (водорода) в растворах аммиака все большую роль при облучении начинают играть процессы окисления. На первой стадии наиболее вероятной, по-видимому, оказывается реакция NH2 с молекулярным кислородом с образованием оксида азота NO, способного окисляться далее до нитрит- и нитрат-ионов. Окислению подвергаются и образующиеся в качестве промежуточных продуктов гидразин и гидроксиламин [3, 7].
Механизм превращений гидразина в водных растворах подробно изучали Buxton и его коллеги [8–10]. Ими же создана математическая модель, хорошо описывающая полученные экспериментальные результаты [11]. Однако общей модели, описывающей превращения аммиака в водных растворах под действием излучения, включая активацию азота, образование нитритов и нитратов, разработано не было, хотя предпосылкой для ее создания можно считать обзор работ, сделанный в [12]. В программе МОРАВА-H2, одним из блоков которой является модель радиолиза водного теплоносителя H2O-rad [13], механизм превращений соединений азота [14] содержит сомнительные допущения и в ряде случаев дает результаты, плохо согласующиеся с экспериментальными.
В завершение остановимся на вопросе о влиянии борной кислоты на радиолиз воды и водных растворов. Принято считать, что химическая активность борной кислоты по отношению к продуктам радиолиза воды незначительна. Важно лишь помнить, что при использовании реакторного излучения в ходе ядерной реакции 10B(n,α)7Li образуются тяжелые заряженные частицы с высокой ЛПЭ. Это ведет к тому, что относительный выход радикальных продуктов радиолиза воды уменьшается, а молекулярных – увеличивается [2].
Тем не менее, реакции борной кислоты с гидратированным электроном (eaq–) и гидроксильным радикалом возможны, и в литературе имеются оценки констант скорости этих процессов [15]. Наибольшего внимания заслуживают результаты работы [16], в которой экспериментально продемонстрировано влияние добавок борной кислоты на равновесие между аммиаком и азотом при облучении растворов NH3 только γ-квантами 60Co, когда реакции 10B(n,α)7Li нет. Согласно этим данным, борная кислота даже в малых, по сравнению с аммиаком, количествах защищает его от разложения. Какого-либо теоретического объяснения этому пока не существует.
Исходя из вышесказанного, целью настоящей работы стало создание математической модели для описания радиолитических процессов в водных растворах, содержащих компоненты, характерные для теплоносителя первого контура ВВЭР (прежде всего, аммиак и борную кислоту). При этом область моделируемых условий облучения (мощность дозы, ЛПЭ излучения, температура и pH среды) также должна содержать диапазон рабочих значений, характерных для активной зоны ВВЭР.
ОПИСАНИЕ МОДЕЛИ
Модель радиационно-химических превращений на гомогенной стадии радиолиза представляет собой систему обыкновенных дифференциальных уравнений 1-го порядка, записанных для N концентраций исходных компонентов теплоносителя и продуктов его радиолиза (включая промежуточные частицы) как функций времени:
(1)
$\begin{gathered} \frac{{d{{C}_{i}}}}{{dt}} = \frac{{D{\kern 1pt} '\rho {{G}_{{0i}}}}}{{100e{{N}_{a}}}} - {{C}_{i}}\sum\limits_{j = 1}^N {{{k}_{{ij}}}{{C}_{j}}} + \\ + \,\,\sum\limits_{m = 1}^N {\sum\limits_{n = 1}^N {{{k}_{{mn}}}{{C}_{m}}{{C}_{n}}{{\delta }_{i}}\left( {m,n} \right)} } , \\ \end{gathered} $Решение жесткой нелинейной системы (1) относительно Сi осуществляется методом матричной экспоненты, описание которого можно найти в [17].
Радиационно-химические выходы первичных продуктов радиолиза жидкой воды определяются средней ЛПЭ излучения. Для расчета значений G0i при 25°С использовали экспериментальные результаты, суммированные в [14]: их объем, по сравнению с информацией из других источников, максимален, а достоверность неоднократно подтверждена. Зависимость выходов от температуры (до 300°С) определяли путем аппроксимации экспериментальных данных [18, 19].
Согласно [2], для корректного описания радиолиза жидкой воды достаточно учитывать следующие частицы: H2, O2, H2O2, ${\text{HO}}_{{\text{2}}}^{ - },$ H+, OH–, $e_{{aq}}^{ - },$ H, OH, HO2 и ${\text{O}}_{2}^{ - }.$ Набор основных реакций этих частиц друг с другом приведен в монографии [20]. Кинетические характеристики реакций были взяты из базы данных [21]. Пересчет значений констант скоростей при 25°С (k25) на другую температуру проводили по уравнению Аррениуса. Если для реакции не было найдено значение энергии активации Ea, его принимали равным энергии активации самодиффузии воды Ew = 12.6 кДж/моль. Данное допущение основано на том, что энергии активации большинства быстрых реакций в воде меньше или соизмеримы с энергией активации диффузии ее молекул. Кроме этого, в рамках модели было введено диффузионное ограничение на константы скорости большинства реакций, за исключением т.н. “сверхбыстрых” [22].
Список включенных в модель реакций, описывающих радиолиз аммиака и борной кислоты в водном растворе, представлен в табл. 1.
Таблица 1.
Перечень элементарных реакций, протекающих при радиолизе водных растворов аммиака, гидразина и борной кислоты
| № | Уравнение реакции | k25, л · моль–1 · с–1 | Ea, кДж/моль |
|---|---|---|---|
| 1 | ${\rm N}{{{\rm H}}_{3}} + {\rm O}{\rm H} \to {\rm N}{{{\rm H}}_{2}} + {{{\rm H}}_{2}}{\rm O}$ | 9.7 × 107 [23] | 11.4 [24] |
| 2 | ${\rm N}{{{\rm H}}_{2}} + {\rm H} \to {\rm N}{{{\rm H}}_{3}}$ | 1010 [14] | Ew |
| 3 | ${\rm N}{{{\rm H}}_{2}} + e_{{aq}}^{ - } \to {\rm N}{{{\rm H}}_{3}} + {\rm O}{{{\rm H}}^{ - }}$ | 1010 [14] | Ew |
| 4 | ${\rm N}{{{\rm H}}_{2}} + {\rm H}{{{\rm O}}_{2}} \to {\rm N}{{{\rm H}}_{3}} + {{{\rm O}}_{2}}$ | 1010 [25] | Ew |
| 5 | ${\rm N}{{{\rm H}}_{2}} + {\rm O}{\rm H} \to {\rm N}{{{\rm H}}_{2}}{\rm O}{\rm H}$ | 9.5 × 109 [26] | Ew |
| 6 | ${\rm N}{{{\rm H}}_{2}} + {{{\rm H}}_{2}}{{{\rm O}}_{2}} \to {\rm N}{\rm H}{\rm O}{\rm H} + {{{\rm H}}_{2}}{\rm O}$ | 9.0 × 107 [26] | Ew |
| 7 | ${\rm N}{{{\rm H}}_{2}} + {\rm N}{\rm O} \to {{{\rm N}}_{2}} + {{{\rm H}}_{2}}{\rm O}$ | 108* | Ew |
| 8 | ${\rm N}{\rm H}{\rm O}{\rm H} + {\rm H} \to {\rm N}{{{\rm H}}_{2}}{\rm O}{\rm H}$ | 108* | Ew |
| 9 | ${\rm N}{\rm H}{\rm O}{\rm H} + e_{{aq}}^{ - } \to {\rm N}{{{\rm H}}_{2}}{\rm O}{\rm H} + {\rm O}{{{\rm H}}^{ - }}$ | 109* | Ew |
| 10 | $2{\rm N}{\rm H}{\rm O}{\rm H} \to {{{\rm N}}_{2}} + 2{{{\rm H}}_{2}}{\rm O}$ | 106** [14] | Ew |
| 11 | ${\rm N}{\rm H}{\rm O}{\rm H} + {\rm H}{{{\rm O}}_{2}} \to {\rm N}{{{\rm H}}_{2}}{\rm O}{\rm H} + {{{\rm O}}_{2}}$ | 108* | Ew |
| 12 | ${\rm N}{\rm O} + {\rm O}{\rm H} \to {\rm H}{\rm N}{{{\rm O}}_{2}}$ | 2.0 × 1010 [27] | Ew |
| 13 | ${\rm N}{{{\rm H}}_{2}}{\rm O}{\rm H} + {\rm O}{\rm H} \to {\rm N}{\rm H}{\rm O}{\rm H} + {{{\rm H}}_{2}}{\rm O}$ | 9.5 × 109 [28] | Ew |
| 14 | ${\rm N}{{{\rm H}}_{2}}{\rm O}{\rm H} + e_{{aq}}^{ - } \to {\rm N}{{{\rm H}}_{2}} + {\rm O}{{{\rm H}}^{ - }} + {{{\rm H}}_{2}}{\rm O}$ | 9.2 × 108 [28] | Ew |
| 15 | ${\rm H}{\rm N}{{{\rm O}}_{2}} + {\rm H} \to {\rm N}{\rm O} + {{{\rm H}}_{2}}{\rm O}$ | 4.5 × 108 [29] | Ew |
| 16 | ${\rm H}{\rm N}{{{\rm O}}_{2}} + {\rm N}{{{\rm H}}_{2}}{\rm O}{\rm H} \to {{{\rm N}}_{2}}{\rm O} + 2{{{\rm H}}_{2}}{\rm O}$ | 108* | Ew |
| 17 | ${{{\rm N}}_{2}}{\rm O} + {\rm H} \to {{{\rm N}}_{2}} + {\rm O}{\rm H}$ | 2.1 × 106 [30] | Ew |
| 18 | ${{{\rm N}}_{2}}{\rm O} + e_{{aq}}^{ - } \to {{{\rm N}}_{2}} + {\rm O}{\rm H} + {\rm O}{{{\rm H}}^{ - }}$ | 9.6 × 109 [31] | 19.0 [31] |
| 19 | $2{\rm N}{{{\rm H}}_{2}} \to {{{\rm N}}_{2}}{{{\rm H}}_{4}}$ | 2.2 × 109 [26] | 0 [24] |
| 20 | ${\rm N}{{{\rm H}}_{3}} + {\rm H} \to {\rm N}{\rm H}_{4}^{ + } + e_{{aq}}^{ - }$ | 6.7 × 105 [32] | Ew |
| 21 | ${\rm N}{\rm H}_{4}^{ + } + e_{{aq}}^{ - } \to {\rm N}{{{\rm H}}_{3}} + {\rm H}$ | 1.5 × 106 [33] | 20.0 [33] |
| 22 | ${\rm N}{\rm H}_{4}^{ + } + {\rm O}{{{\rm H}}^{ - }} \to {\rm N}{{{\rm H}}_{3}} + {{{\rm H}}_{2}}{\rm O}$ | 3.3 × 1010 [14] | 20.0* [34] |
| 23 | ${\rm N}{{{\rm H}}_{3}} + {{{\rm H}}_{2}}{\rm O} \to {\rm N}{\rm H}_{4}^{ + } + {\rm O}{{{\rm H}}^{ - }}$ | 9.7 × 103* (см. [34]) | 0.0 [34] |
| 24 | ${\rm N}{{{\rm H}}_{2}} + {{{\rm O}}_{2}} \to {\rm N}{\rm O} + {{{\rm H}}_{2}}{\rm O}$ | 1.2 × 108 [35] | Ew |
| 25 | ${\rm N}{\rm H}_{4}^{ + } + {\rm H}{\rm O}_{2}^{ - } \to {\rm N}{{{\rm H}}_{3}} + {{{\rm H}}_{2}}{{{\rm O}}_{2}}$ | 1010* | Ew |
| 26 | ${{{\rm H}}^{ + }} + {\rm N}{{{\rm H}}_{3}} \to {\rm N}{\rm H}_{4}^{ + } + {{{\rm H}}_{2}}{\rm O}$ | 4.3 × 1010 [22] | 0* |
| 27 | ${\rm N}{\rm H}_{4}^{ + } + {{{\rm H}}_{2}}{\rm O} \to {{{\rm H}}^{ + }} + {\rm N}{{{\rm H}}_{3}}$ | 0.45* | 72.0* |
| 28 | ${{{\rm N}}_{2}}{{{\rm H}}_{4}} + {\rm O}{\rm H} \to {{{\rm N}}_{2}}{{{\rm H}}_{3}} + {{{\rm H}}_{2}}{\rm O}$ | 4.5 × 109 [8] | 12.0 [8] |
| 29 | ${{{\rm N}}_{2}}{{{\rm H}}_{4}} + {\rm N}{{{\rm H}}_{2}} \to {{{\rm N}}_{2}}{{{\rm H}}_{3}} + {\rm N}{{{\rm H}}_{3}}$ | 1.2 × 107 [10] | 8.2 [10] |
| 30 | $2{{{\rm N}}_{2}}{{{\rm H}}_{3}} \to {{{\rm N}}_{2}} + 2{\rm N}{{{\rm H}}_{3}}$ | 109 [8] | 0 [8] |
| 31 | ${{{\rm N}}_{2}}{{{\rm H}}_{3}} + {{{\rm O}}_{2}} \to {{{\rm N}}_{2}}{{{\rm H}}_{2}} + {\rm H}{{{\rm O}}_{2}}$ | 3.8 × 108 [9] | 5.6 [9] |
| 32 | ${{{\rm N}}_{2}}{{{\rm H}}_{4}} + {\rm H}{{{\rm O}}_{2}} \to {{{\rm N}}_{2}}{{{\rm H}}_{3}} + {{{\rm H}}_{2}}{{{\rm O}}_{2}}$ | 7.0 × 106 ** [10] | Ew |
| 33 | ${{{\rm N}}_{2}}{{{\rm H}}_{2}} + {{{\rm H}}_{2}}{{{\rm O}}_{2}} \to {{{\rm N}}_{2}} + 2{{{\rm H}}_{2}}{\rm O}$ | 6.0 × 17 ** [10] | Ew |
| 34 | $2{{{\rm N}}_{2}}{{{\rm H}}_{2}} \to {{{\rm N}}_{2}}{{{\rm H}}_{4}} + {{{\rm N}}_{2}}$ | 2.0 × 104 [10] | Ew |
| 35 | ${{{\rm N}}_{2}}{{{\rm H}}_{4}} + {\rm H} \to {{{\rm H}}_{2}} + {{{\rm N}}_{2}}{{{\rm H}}_{3}}$ | 3.0 × 14 ** [36] | 8.36 [36] |
| 36 | ${{{\rm N}}_{2}}{{{\rm H}}_{4}} + {{{\rm H}}_{2}}{\rm O} \to 2{\rm N}{{{\rm H}}_{2}} + {{{\rm H}}_{2}}{\rm O}$ | 1.8 × 10–6* [37] | 58.5* [38] |
| 37 | ${\rm O}{\rm H}{\kern 1pt} * + {{{\rm H}}_{2}}{\rm O} \to {\rm O}{\rm H} + {{{\rm H}}_{2}}{\rm O}$ | 105* | Ew |
| 38 | ${\rm O}{\rm H}{\kern 1pt} * + {{{\rm N}}_{2}} \to {\rm N}{\rm H} + {\rm N}{\rm O}$ | 1010* | Ew |
| 39 | ${\rm N}{\rm H} + {{{\rm H}}_{2}} \to {\rm N}{{{\rm H}}_{3}}$ | 1010* | Ew |
| 40 | ${{{\rm H}}_{3}}{\rm B}{{{\rm O}}_{3}} + e_{{aq}}^{ - } \to {{{\rm H}}_{2}}{\rm B}{\rm O}_{3}^{ - } + {\rm H}$ | 5.0 × 103 [15] | Ew |
| 41 | ${{{\rm H}}_{2}}{\rm B}{\rm O}_{3}^{ - } + {{{\rm H}}^{ + }} \to {{{\rm H}}_{3}}{\rm B}{{{\rm O}}_{3}} + {{{\rm H}}_{2}}{\rm O}$ | 7.25 × 1010 [34] | 12.6 [34] |
| 42 | ${{{\rm H}}_{3}}{\rm B}{{{\rm O}}_{3}} + {\rm O}{\rm H} \to {{{\rm H}}_{2}}{\rm B}{{{\rm O}}_{3}} + {{{\rm H}}_{2}}{\rm O}$ | 2.0 × 106** [15] | Ew |
| 43 | ${{{\rm H}}_{3}}{\rm B}{{{\rm O}}_{3}} + {\rm N}{{{\rm H}}_{2}} \to {{{\rm H}}_{2}}{\rm B}{{{\rm O}}_{3}} + {\rm N}{{{\rm H}}_{3}}$ | 2.0 × 106* | Ew |
| 44 | ${{{\rm H}}_{2}}{\rm B}{{{\rm O}}_{3}} + {\rm H} \to {{{\rm H}}_{3}}{\rm B}{{{\rm O}}_{3}}$ | 1010* | Ew |
| 45 | ${{{\rm H}}_{2}}{\rm B}{{{\rm O}}_{3}} + {\rm H}{{{\rm O}}_{2}} \to {{{\rm H}}_{3}}{\rm B}{{{\rm O}}_{3}} + {{{\rm O}}_{2}}$ | 108* | Ew |
При описании радиационно-индуцированных превращений соединений азота частично был использован подход, изложенный в [14, 25]. Если значение k25 для реакции из табл. 1 отсутствовало в литературе, его выбирали по аналогии с другими реакциями того же класса (ион-молекула, ион-радикал и т.п.) и затем уточняли по мере необходимости. Температурные зависимости констант скорости рассчитывались так, как это уже было описано выше.
В ходе тестовых расчетов было найдено, что прямое действие излучения на азот не воспроизводит экспериментальные результаты при разумных значениях первичного выхода разложения N2, порядка 7.3 молекул/100 эВ [39]. Поэтому химическая активация молекул N2 представлена только реакцией № 38 [5]. Первичный трековый выход возбужденных гидроксильных радикалов при любых условиях принимался равным половине полного выхода ОН.
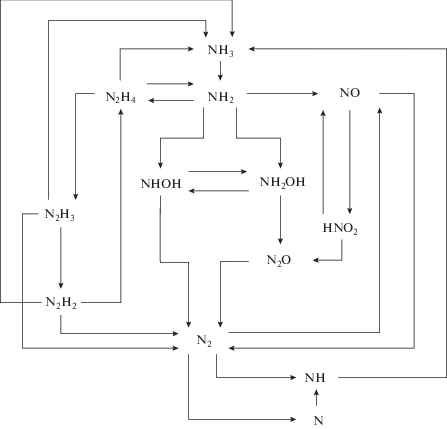
Реакции, приводящие к образованию нитрата, в модель не включали, поскольку ее основное назначение – описание радиолиза в теплоносителе первого контура ВВЭР, когда концентрация растворенного кислорода заведомо мала. Таким образом, для описания механизма радиолиза аммиака использовали схему превращений, представленную на рис. 1.
Реакции образования радикалов H2BO3 при взаимодействии борной кислоты с NH2, а также их гибели постулированы. Основанием в данном случае следует считать не только аналогию с реакциями № 1, 2 и № 42, но и близость энергий связи атома водорода с остатками молекул воды, аммиака и борной кислоты [40].
В целом модель включает в себя 79 химических реакций между N = 29 частицами. Изменяемыми входными параметрами являются начальные концентрации веществ, температура, мощность поглощенной дозы и средняя ЛПЭ излучения. Помимо ячейки с фиксированной температурой и полем излучения в модели рассматривается циркуляционная петля с постоянным объемом жидкой фазы. В этом случае, помимо вышеперечисленных величин, задаваемых для каждого участка петли, дополнительными параметрами являются объемный расход жидкости и объемы участков.
При моделировании излучения активной зоны реактора с легкой водой под давлением и борным регулированием составляющие мощности дозы быстрых нейтронов, γ-излучения и продуктов реакции 10B(n,α)7Li могут быть заданы произвольно и независимо или рассчитаны в зависимости от текущих значений тепловой мощности реактора и содержания 10B в теплоносителе. Использованные при создании модели методы расчета изложены в [41].
ВЕРИФИКАЦИЯ МОДЕЛИ
Для верификации использовали данные, полученные разными авторами в экспериментах по облучению воды и водных растворов, содержащих водород, кислород, перекись водорода, аммиак, гидразин и борную кислоту.
На рис. 2 в качестве примера представлены результаты моделирования радиолиза растворов H2O2 и соответствующие экспериментальные данные [42]. В табл. 2 приведены значения стандартных отклонений σ расчетных концентраций веществ от измеренных в тех экспериментах, что были взяты для верификации модели. Как было указано в примечаниях к табл. 1, кинетические характеристики нескольких реакций (главным образом, с участием гидразина) были изменены для лучшего согласия теорииy с экспериментом. Результаты, представленные ниже, получены с учетом этих изменений.
Рис. 2.
Накопление H2O2 в облучаемой воде, содержащей H2 и O2. Точки – эксперимент [42], линии – расчет. 1, ▲ – 490 мкмоль/л Н2 + 551 мкмоль/л О2; 2, ◆ – 1254 мкмоль/л О2; 3, ◼ – 780 мкмоль/л Н2.
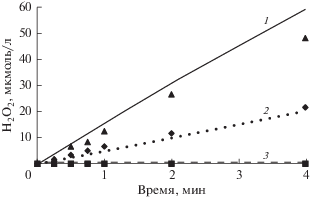
Таблица 2.
Различия между результатами моделирования и экспериментальными данными по радиолизу водных растворов
| Состав раствора | Анализируемый компонент | Ссылка | Число экспери-ментов | Число точек |
σ в экспе-рименте, % | |
|---|---|---|---|---|---|---|
| min | max | |||||
| H2O | Н2О2 | [43] | 1 | 6 | 4 | 4 |
| H2O + Н2О2 | Н2О2 | [44] | 5 | 39 | 17 | 28 |
| (H2O + Н2О2) + Н2* | Н2О2 | [42] | 17 | 85 | 12 | 125 |
| H2O + Н3ВО3 | Н2О2, Н2, О2 | [45] | 4 | 12 | 2 | 49 |
| H2O + N2H4 + О2 | N2H4 | [10] | 3 | 8 | 5 | 40 |
| H2O + N2H4 + Н2О2 | Н2 | [46] | 4 | 15 | 3 | 47 |
| (H2O + NH3) + N2* | Н2О2, HNO2 | [7] | 2 | 34 | 50 | 62 |
| (H2O + NH3) + H3BO3 | NH3 | [16] | 3** 6*** | 3 33 |
1 14 |
12 67 |
На основании полученных результатов можно заключить, что рассчитанные значения концентраций компонентов водных растворов в целом достаточно хорошо описывают экспериментальные данные. Следует учесть, что вещества, анализируемые в экспериментах, в большинстве своем являются летучими или неустойчивыми к примесям (как H2O2). Эти свойства способны увеличивать погрешность анализа и, таким образом, снижать точность экспериментальных данных. Важно отметить и то, что для большинства реакций, идущих при радиолизе воды, в литературе имеется в среднем по 3–4 различных значения для k25 и Ea. Как показали тестовые расчеты, вариации этих параметров в пределах, рекомендуемых литературой, влияют на частные результаты, но не на среднее значение σ, составляющее около 35%.
В табл. 3 и на рис. 3 более детально представлена верификация модели по экспериментам с облучением растворов аммиака, в том числе – со-держащих борную кислоту [16]. δ представляет абсолютную величину разницы между экспериментальным (Сэксп) и расчетным (Срасч) значением конечной концентрации аммиака, отнесенную к Сэксп. Для сравнения в таблице приведены значения δ, полученные с использованием программы H2O-rad при моделировании радиолиза растворов в стационарных условиях [13].
Таблица 3.
Сравнение результатов расчета с экспериментальными данными о радиолизе растворов аммиака и борной кислоты [16]
| Условия облучения | Начальная концентрация NH3, ммоль/л | Концентрация H3BO3, ммоль/л | Конечная концентрация NH3, ммоль/л | δ, % * | Число точек | σ, % | |
|---|---|---|---|---|---|---|---|
| Сэксп | Срасч | ||||||
| γ 60Co, | 6.0 | 0 | 3.60 | 3.55 | 1.4 (26) | 1 | – |
| 160 кГр, | 6.0 ** | 0 | 4.20 | 3.71 | 11.6 (14) | 1 | – |
| 0.53 Гр/с, 25°C | 6.0 | 0.1 | 5.34 | 5.42 | 1.4 (18) | 1 | – |
| n + γ реактора, | 5.25 | 0 | 1.0 | 1.52 | 51.1 | 9 | 30 |
| 100 кГр, | |||||||
| 3.44 Гр/с, | 5.5 | 70 | 4.0 | 0.32 | 91.9 | 7 | 67 |
| 30°C | |||||||
| n + γ реактора, | 4.0 *** | 85 | 2.20 | 2.76 | 26.6 | 1 | – |
| 105 кГр, | 3.3 | 42 | 1.39 | 2.06 | 48.6 | 1 | – |
| 3.44 Гр/с, | 4.8 | 106 | 1.70 | 2.73 | 62.3 | 1 | – |
| 180°C | 5.3 | 168 | 2.15 | 2.87 | 30.1 | 11 | 14 |
* Числа в скобках – результаты расчета по программе H2O-rad [13]. ** + 0.77 ммоль/л H2. *** Доза 100 кГр, температура 200°C.
Рис. 3.
Разложение аммиака в теплоносителе исследовательского реактора. Точки – эксперимент [16], линии – расчет. 1, ◆ – 5.3 ммоль/л NH3 + 168 ммоль/л H3BO3; 2, ▲ – 5.25 ммоль/л NH3.
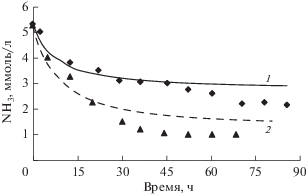
Как видно из результатов, представленных в табл. 3, предложенная схема реакций радиационного окисления и синтеза аммиака (табл. 1) удовлетворительно описывает экспериментальные данные работы [16]. Стандартное отклонение не превышает 67%, а его среднее значение для данной серии экспериментов равно 36%, что фактически совпадает со средним по всем системам, перечисленным в табл. 2.
Сравнивая результаты, полученные для облучения в статических условиях, с данными расчетов по программе H2O-rad [13], можно отметить худшее согласие последних с экспериментом. И дело не только в большей величине отклонения δ. Согласно настоящей модели, с увеличением времени облучения концентрация аммиака в растворе падает до некоторого стационарного значения, когда скорость его разложения сравнивается со скоростью синтеза. В модели H2O-rad аммиак разлагается полностью. Иными словами, H2O-rad пренебрегает процессом образования аммиака из азота под действием облучения, что, как известно, не всегда справедливо [4]. Необходимо добавить, что представленная в настоящей работе модель качественно воспроизводит и экспериментальные данные [5], послужившие базой для установления механизма радиационного синтеза аммиака. Однако разумное количественное согласие здесь было получено не для всех экспериментов.
В процессе работы было найдено, что варьирование значений k25 и/или Ea для реакций № 27, 42, 43 и 45 (табл. 1) в разумных пределах не влияло существенным образом на результаты воспроизведения данных одних экспериментов (или не меняло их вовсе) и в значительной мере влияло на результаты моделирования других. В общей сложности было протестировано порядка 20 различных наборов k25 и Ea. В табл. 1 приведен один из тех, которые удовлетворительно описывают данные работы [16]. Однако утверждать, что именно он является оптимальным, пока не представляется возможным ввиду малого объема экспериментальных данных, представленных только двумя публикациями [7, 16].
Таким образом, принимая во внимание как большой размер массива экспериментальных данных, по которым проводилась верификация, так и ряд неопределенностей, связанных с их трактовкой, полученные разумные значения σ позволяют считать изложенную модель достаточно адекватной, чтобы делать на ее основании достоверные предсказания о поведении системы при изменении внешних параметров.
ОПИСАНИЕ РАДИОЛИЗА ТЕПЛОНОСИТЕЛЯ ВВЭР
Работоспособность модели тестировали также при решении задачи о накоплении радиолитического водорода в первом контуре реактора ВВЭР за счет разложения аммиака. Согласно опыту эксплуатации АЭС с ВВЭР, для получения концентрации Н2 около 3 мг/дм3 (нормируемый диапазон концентраций при работе в штатном режиме на 100% мощности составляет от 2.2 до 4.5 мг/дм3 [47]) требуется создать начальную концентрацию аммиака в контуре от 20 до 30 мг/дм3 (при 25°С). Указанное количество водорода способно эффективно подавить образование кислорода и других окислительных продуктов радиолиза воды по принципу Ле-Шаталье–Брауна. Согласно измерениям [48], минимальная концентрация водорода, необходимая для этого (т.н. “критическая концентрация H2”), лежит в диапазоне от 20 до 200 мкмоль/л. Следует учесть, что эта величина зависит от мощности дозы, ЛПЭ, температуры и присутствия других веществ. Концентрация растворенного в теплоносителе кислорода, согласно [47], не должна превышать 5 мкг/дм3.
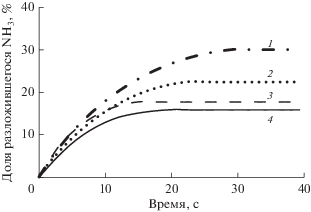
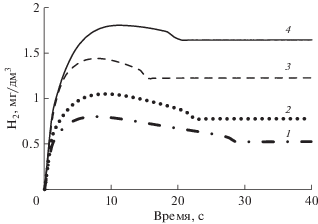
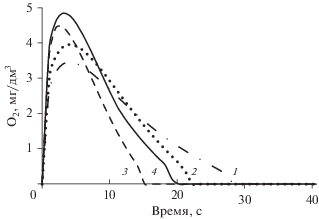
Параметры реакторной установки (тепловая мощность, объем активной зоны объем теплоносителя в контуре, его расход и температура, а также содержание борной кислоты в начале цикла работы на мощности) соответствовали ВВЭР-1200. Рассчитанные значения мощности дозы от нейтронов, γ-квантов и α-частиц составили 2.6, 1.7 и 1.1 кГр/с соответственно. На рис. 4–6 представлены зависимости доли разложившегося аммиака, концентрации водорода и кислорода соответственно для первых 40 с, начиная с момента “включения облучения” при варьировании начальной концентрации аммиака C0 от 5 до 30 мг/дм3. В табл. 4 приведены соответствующие значения через 2 ч.
Таблица 4.
Содержание ключевых компонентов в теплоносителе через 2 ч с момента “включения облучения”
| C0, мг/дм3 | Доля разложившегося NH3, % | Концентрация Н2, мг/дм3 | Концентрация О2, мкг/дм3 |
|---|---|---|---|
| 5 | 56 | 1.00 | 11.3 |
| 10 | 35 | 1.25 | 5.36 |
| 20 | 25 | 1.80 | 5.04 |
| 30 | 20 | 2.13 | 3.16 |
Как следует из рис. 4–6, динамическое равновесие между компонентами для всех значений C0 устанавливается быстро, примерно за 20–30 с. На протяжении остального времени аммиак уже очень медленно разлагается под действием излучения. Концентрация водорода после 30 с монотонно растет, достигая через 2 ч значений порядка 1–2 мг/дм3 (и продолжая далее расти). Концентрация кислорода, пройдя через максимум порядка 3–5 мг/дм3 (рис. 6), далее очень быстро падает до нескольких мкг/дм3 также во всех случаях. Тем не менее, в рассматриваемом диапазоне C0, по всей видимости, существует два различных режима разложения аммиака на начальной стадии радиолиза. Смена режимов происходит при C0 ≈ 15 мг/дм3 и находит свое отражение в смене направления смещения “особых” точек на кривых накопления и расходования с ростом C0.
Проведенное здесь моделирование не рассматривает работу деаэратора и ионообменного фильтра, который в период накопления водорода активно насыщается ионами аммония, приходя в равновесие с теплоносителем. Поэтому в результате работы указанного оборудования наработка водорода до ~2.5 мг/дм3, осуществляется на протяжении суток, а не двух-трех часов. Тем не менее, результаты расчетов однозначно показывают, что при C0 ≤ 20 мг/дм3 концентрация кислорода в начальный период будет превышать установленную в [47] норму. Таким образом, адекватность модели радиолиза подкрепляется и опытом эксплуатации реакторных установок с ВВЭР. Отметим также, что понятие “критической концентрации H2” как некоторого фиксированного значения в условиях аммиачно-калиевого ВХР приобретает еще большую неопределенность вследствие большего числа реакций, протекающих в облучаемой системе.
ВЫВОДЫ
Разработана математическая модель радиолиза водных растворов аммиака (в том числе в присутствии борной кислоты), включающая обратный процесс образования аммиака из растворенного азота. Проведена верификация модели по опубликованным в литературе экспериментальным данным. Результаты тестовых расчетов демонстрируют адекватность модели. Стандартное отклонение расчетных концентраций от соответствующих экспериментальных значений составляет в среднем 35%. Тем не менее, однозначно утверждать, что представленный набор параметров для расчета скоростей химических реакций, заложенных в модель, является оптимальным, невозможно. Причиной являются ограниченность объема непротиворечивых литературных данных, а также множество связанных с ними неопределенностей в представлении результатов эксперимента. Для уточнения параметров модели требуются дополнительные исследования кинетики отдельных элементарных химических реакций в водных растворах, а также расширение экспериментальной базы по радиолизу водных растворов аммиака и борной кислоты, в том числе в условиях, приближенных к условиям теплоносителя первого контура в активной зоне ВВЭР.
Получены удовлетворительные результаты при моделировании накопления радиолитического водорода растворе, содержащем компоненты теплоносителя первого контура ВВЭР. Представленные данные однозначно показывают, что разработанная модель позволяет достоверно предсказывать временную эволюцию продуктов радиолиза такого водного раствора при различных начальных условиях. Перспективой дальнейшей работы является создание пространственно-распределенной модели теплоносителя в активной зоне, с учетом теплогидравлических и нейтронно-физических характеристик последнего, а также присутствия паровой фазы и перераспределения компонентов между фазами. Необходимость этого продиктована отсутствием однозначного объяснения побеления твэлов в области газосборника при повышении мощности ВВЭР-1000 до 104% (от номинальной). Планируемое дальнейшее повышение мощности (до 107% и выше) в обязательном порядке требует обоснования безопасности эксплуатации, в том числе – путем демонстрации влияния подъема мощности на локальные параметры ВХР. С этой точки зрения настоящую работу по моделированию растворов аммиака следует рассматривать как первый этап на пути расчетного обоснования безопасности подъема мощности ВВЭР.
Список литературы
Алиев Т.Н., Евдокимов И.А., Лиханский В.В., Махин В.М. // Вопросы атомной науки и техники. 2009. Серия: “Обеспечение безопасности АЭС”. Вып. 25. С. 96.
Пикаев А.К., Кабакчи С.А., Макаров И.Е. Высокотемпературный радиолиз воды и водных растворов. М.: Энергоатомиздат, 1988. 136 с.
Пикаев А.К. // Успехи химии. 1960. Т. XXIX. Вып. 4. С. 508.
Буланов А.В., Колесов Б.И., Лукашенко М.Л. и др. // Атомная Энергия. 2000. Т. 88. Вып. 5. С. 353.
Дмитриев М.Т. // Журнал прикладной химии. 1963. Т. 36. С. 1123.
Etoh Y., Karasawa H., Ibe E. et al. // J. Nuclear Science and Technology. 1987. V. 24. № 8. P. 672.
Dwibedy P., Kishore K., Dey G.R., Moorthy P.N. // Radiat. Phys. Chem. 1996. V. 48. № 6. P. 743.
Buxton G.V., Steuart C.R. // J. Chem. Soc., Faraday Trans. 1996. V. 92. № 9. P. 1519.
Buxton G.V., Steuart C.R. // J. Chem. Soc., Faraday Trans. 1997. V. 93. № 8. P. 1535.
Buxton G.V., Lynch D.A. // Phys. Chem. Chem. Phys. 1999. V. 1. P. 3293.
Buxton G.V., Sims H.E. // Phys. Chem. Chem. Phys. 2000. V. 2. P. 4941.
Dey G.R. // Radiat. Phys. Chem. 2011. V. 80. № 3. P. 394.
https://www.researchgate.net/publication/332875887 Дата обращения: 31.08.2020 г.
Кабакчи С.А. Математическое моделирование радиационного воздействия на водные теплоносители ядерных энергетических установок. Учебное пособие. М.: НИЦ “Курчатовский институт”, 2018. 111 с.
Buxton G.V., Sellers R.M. // Radiat. Phys. Chem. 1987. V. 29. № 2. P. 137.
Habersbergerova A., Bartonicek B. // Nukleonika. 1981. V. 26. № 7-8. P.783
Галанин М.П., Конев С.А. Об одном численном методе решения обыкновенных дифференциальных уравнений // Препринты ИПМ им. М.В. Келдыша. 2017. № 18. 28 с. https://doi.org/10.20948/prepr-2017-18
Elliot. A.J., Chenier M.P., Ouellette D.C. // J. Chem. Soc., Faraday Trans. 1993. V. 89. № 8. P. 1193.
Sunaryo G.R., Katsumura Y., Hiroishi D., Ishigure K. // Radiat. Phys. Chem. 1995. V45. № 1. P. 131.
Бяков В.М., Ничипоров Ф.Г. Радиолиз воды в ядерных реакторах. М.: Энергоатомиздат, 1990. 176 с.
База данных по химической кинетике NIST http:// kinetics.nist.gov/solution Дата обращения: 31.08.2020 г.
Романовский Б.В. Основы химической кинетики. М.: Экзамен, 2006. 416 с.
Hickel B., Sehested K. // Radiat. Phys. Chem. 1992. V. 39. № 4. P. 355.
Buxton G.V., Lynch D.A. // J. Chem. Soc., Faraday Trans. Faraday Trans. 1998. V. 94. P. 3271.
Кабакчи С.А., Булгакова Г.П. Радиационная химия в ядерном топливном цикле. М.: РХТУ им. Д.И. Менделеева, 1996. 104 с.
Pagsberg P.B. // Aspects of Research at Risø.1972. P. 209–222.
Strehlow H., Wagner I. // Z. Phys. Chem. 1982. V. 132. № 2. P. 151.
Simic M., Hayon E. // J. Am. Chem. Soc. 1971. V. 93. № 23. P. 5982.
Halpern J., Rabani J. // J. Am. Chem. Soc. 1966. V. 88. № 4. P. 699.
Czapski G., Peled E. // Isr. J. Chem. 1968. V. 6. № 4. P. 421.
Elliot A.J. // Radiat. Phys. Chem. 1989. V. 34. № 5. P. 753.
Schwarz H.A. // J. Phys. Chem. 1991. V. 95 № 17. P. 6697.
Chen R., Avotinsh Y., Freeman G.R. // Can. J. Chem. 1994. V. 72. № 4. P. 1083.
Гордеев А.В. Автореф. дис. … канд. хим. наук. М.: ИФХ РАН, 1994.
Менькин В.Б., Макаров И.Е., Пикаев А.К. // Химия высоких энергий. 1991. Т. 25. № 1. С. 60.
Stief L.J., Payne W.A. // J. Chem. Phys. 1976. V. 64. № 12. P. 4892.
Wellman C.R., Ward. J.R., Kuhn L.P. // J. Am. Chem. Soc. 1976. V. 98 № 7. P. 1683.
Ishida K., Wada Y., Tachibana M. et al. // J. Nuclear Science and Technology. 2006. V. 43. № 1. P. 65.
Macdonald R.G., Miller O.A. // Radiat. Phys. Chem. 1985. V. 26. № 1. P. 63.
Гурвич Л.Г., Карачевцев Г.В., Кондратьев В.Н. и др. Энергии разрыва химических связей, потенциалы ионизации и сродство к электрону. М.: Наука, 1974. 351 с.
Егоров Ю.А. Основы радиационной безопасности атомных электростанций. М.: Энергоиздат, 1982. 272 с.
Hochanadel C.J. // J. Phys. Chem. 1952. V. 56. № 5. P. 587.
Schwarz H.A. // J. Phys. Chem. 1962. V. 66. № 2. P. 255.
Hayon E. // Trans. Faraday Soc. 1967. V. 60. P. 1059.
Hart E.J., McDonell W.R., Gordon S. // Proceedings of International Conference on the Peaceful Uses of Atomic Energy, Geneva: United Nations, 1955. № 7. P. 597.
Belloni J., Haissinsky M. // Int. J. Rad. Phys. Chem. 1959. V. 1. P. 519.
СТО 1.1.1.03.004.0980-2014 Водно-химический режим первого контура при вводе энергоблока атомной электростанции проекта АЭС-2006 в эксплуатацию. Нормы качества теплоносителя и средства их обеспечения – ОАО “Концерн Росэнергоатом”, 2014.
Christensen H., Molander A., Lassing A. et al. // Water chemistry of nuclear reactor systems 7. 1996. V. 1. P. 138.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий