Химия высоких энергий, 2022, T. 56, № 3, стр. 171-180
Комплексы включения стриловых красителей с кукурбитурилами: сверхбыстрая релаксация электронно-возбужденных состояний
Д. А. Иванов a, *, А. Д. Свирида a, Н. Х. Петров a
a Центр фотохимии РАН Федерального научно-исследовательского центра “Кристаллография и фотоника” РАН
119421 Москва, ул. Новаторов, 7А-1, Россия
* E-mail: ivanovd@photonics.ru
Поступила в редакцию 24.09.2021
После доработки 17.12.2021
Принята к публикации 14.01.2022
- EDN: PVEHHC
- DOI: 10.31857/S0023119322030056
Аннотация
Рассмотрены литературные данные по сверхбыстрой (в пикосекундном диапазоне) релаксации электронно-возбужденных комплексов включения между состоящими из n гликольурильных звеньев (n = 5–8) макроциклическими кавитандами, кукурбит[n]урилами (CB[n]) и стириловыми красителями. Процесс релаксации сопровождается трансляционным перемещением катиона красителя вглубь полости кукурбитурилов. В комплексах состава 1 : 1 с СВ[6] это движение происходит вдоль центральной оси кавитанда с характерным временем 1–2 пикосекунды при комнатной температуре. По определению, такие супрамолекулярные системы называются молекулярными машинами. В супрамолекулярных комплексах состава 2 : 1 с СВ[8] возможна реакция [2 + 2] фотоциклоприсоединения стириловых красителей. Рассмотрена физически ясная модель перемещения элетронно-возбужденных катионов красителя в полости кукурбитрурилов, которая дает хорошо согласующуюся с экспериментом оценку характерного времени работы молекулярной машины.
ВВЕДЕНИЕ
С начала этого века наблюдается значительный рост интереса к физико-химическим свойствам сравнительно нового типа кавитандов, семейству кукурбитурилов (структурная формула показана на рис. 1). Так, согласно Web of Science, число публикаций, связанных с кукурбитурилами, в 90-е годы прошлого века составляло единицы статей в год, в нулевые годы – это уже десятки публикаций, а в последние десятилетие каждый год появляется почти полторы сотни статей. Такой интерес во многом связан со склонностью кукурбитурилов к образованию комплексов включения с органическими (особенно положительно заряженными) частицами подходящего размера.
Разнообразное поведение молекул-гостей в комплексах включения вызвало многочисленные исследования, например, процессов окисления–восстановления “гостя”, стабилизации переноса заряда внутри полости “хозяина”, инкапсуляции лекарственных молекул и т.д. Гомологи и производные кукурбитурила дают новые возможности во многих областях супрамолекулярной химии, включая распознавание, катализ, разделение, транспортировку и многое другое, что было отражено в многочисленных обзорах (см. напрмер, [1, 2]) и монографии [3].
Недавно выяснилось, что в комплексах включения кукурбитурилов и стириловых красителей после фотовозбужения возможны структурные изменения с характерными временами, лежащими в пикосекундном диапазоне, свойство, которое позволяет отнести эти супрамолекулрные системы к фотоуправляемым молекулярным машинам [4].
Данный обзор охватывает результаты исследования процессов пикосекундного временного диапазона, проходящих в полости кукурбитурила при фотовозбуждении ряда инкапсулированных стириловых красителей. В частности, особое внимание уделяется построению и анализу мгновенных спектров флуоресценции супрамолекулрных комплексов. Следует отметить, что эксперименты с пикосекундным временным разрешением были выполнены в основном в Центре фотохимии РАН, которому в 2021 г. исполнилось 25 лет со дня его образования.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
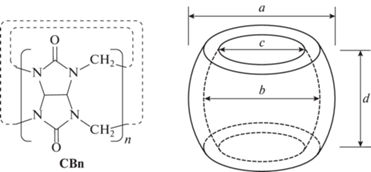
Физико-химические свойства кукурбитурилов. Кукурбит[n]урилы (CB[n]) являются полыми макроциклическими кавитандами, состоящими из n гликольурильных звеньев (n = 5–8, 10), связанных парами метиленовых групп [5]. Благодаря своей форме, тривиальное название эти молекулы получили от латинского слова “cucurbitus”, что в переводе означает “тыква” (см. рис. 1 и табл. 1).
Впервые кукрбитурилы были синтезированы в 1905 г. немецким химиком Робертом Берендом [6]. Однако их структура оставалась неизвестна вплоть до 1981 г., пока Мок и Фримен не повторили оригинальный синтез [7].
Тогда же Мок начал исследовать комплексы гость−хозяин с кукурбит[6]урилом, химические реакции, способные протекать в полости кукурбит-урила (азид-алкиновое циклоприсоединение), и даже представил вариант молекулярного переключателя на основе CB[6] [8–10]. Затем, в 90-е годы ХХ в. группа Бушмана сделала значительный вклад в химию кукурбит[6]урилов, исследовав инкапсулирование красителей кукурбитурилами [11, 12], связывание кукурбитурилов с катионами [13], и определив константы связывания с различными гостевыми молекулами [14]. Группа Кима создала линейные, двумерные и трехмерные полиротаксаны на основе CB[6] [15, 16], в том числе, так называемое, “молекулярное ожерелье” – двумерный замкнутый полиротаксан [17].
В торцах молекул кукурбитурильного ряда, обрамляя входы (порталы) в полость, находятся атомы кислорода карбонильных групп, несущие частичный отрицательный заряд. Это свойство способствует связыванию между кукурбитурилами и относительно небольшими органическими катионами с образованием комплексов включения типа “гость–хозяин”, как, например, комплекс метилвиологена с кукурбит[7]урилом [18, 19]. Жесткая структура, а также возможность образования комплексов включения делает кукурбитурилы привлекательными соединениями для построения новых супрамолекулярных систем [1].
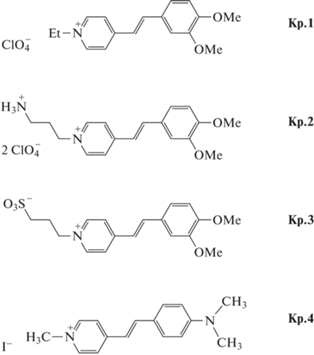
Фотофизические свойства инкапсулированных стириловых красителей. Инкапсулирование органического красителя в полость кукурбитурила приводит, как правило, к значительным изменениям фотофизических свойств красителя [2], в частности, к увеличению интенсивности флуоресценции по сравнению со свободным красителем. Например, было обнаружено, что добавление CB[7] в водные растворы иодидов 3,3'-диэтилтиакарбоцианинов вызывает существенное изменение спектров поглощения красителей и значительное увеличение квантового выхода флуоресценции [20, 21]. Полученные результаты были приписаны образованию комплекса состава 1 : 1 с константой связывания K ≈ 3 × 104 л/моль. Образование псевдоротаксанового комплекса стирилового красителя Кр.1 (см. рис. 2) состава 1 : 1 в присутствии CB[7] (константа связывания K = 106 л/моль) также приводит к тому, что интенсивность флуоресценции существенно увеличивается [22].
В работе [23] было показано, что добавление CB[6] в водные растворы стирилового красителя Кр.4 приводит к очень большому (в 270 раз) увеличению флуоресценции. Квантово-химические расчеты, результаты которых согласуются с данными ЯМР, показывают, что минимальная энергия комплекса включения достигается, когда полость кукурбитурила накрывает пиридиниевый фрагмент молекулы красителя. Константа связывания комплексов состава 1 : 1, определенная методом флуоресцентного титрования, равна 1.02 × 105 л/моль. Увеличение флуоресценции приписывается затруднению внутримолекулярных вращений катиона красителя при образовании комплекса и отчасти его ион-дипольным взаимодействиям с карбонильными группами CB[6].
Особенностью катионов стириловых красителей является то, что они представляют собой внутримолекулярные донорно-акцепторные системы A+–π–D, где пиридиниевое звено A+ является акцептором электронов, а диметиламинофенил D – донором, связанным π-электронно-сопряженным мостиком [24]. Положительный заряд, который в основном состоянии локализован на акцепторной пиридиниевой группе, при возбуждении перемещается в сторону донорной диметиланилино группы [25]. В случае Кр.4 полуэмпирическими расчетами показано, что при возбуждении положительный заряд метилпиридиниевой группы уменьшается с +0.968e до +0.631e, тогда как на фрагменте N, N-диметиланилина он увеличивается с +0.192e до +0.686e. Вычисления Черниковой с соавторами [26] показали, что для азакраун-содержащего стририлового красителя (близкого аналога Кр.4) величина переноса заряда с бензольной на придиниевую группу составляет 0.33e.
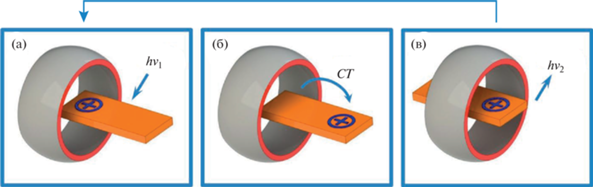
Сверхбыстрое перемещение электронно-возбужденной молекулы красителя в полости кукурбит-урила. В работе [22] на основе квантово-химических расчетов было показано, что в основном состоянии заряженный пиридиниевый фрагмент красителя Кр.1 находится внутри полости вблизи заряженного портала СВ[7], а другая его часть – вне полости. При возбуждении молекулы гостя происходит внутримолекулярный перенос заряда (CT) и молекула-гость изменяет свое положение относительно молекулы-хозяина. Процесс схематически проиллюстрирован на рис. 3.
Рис. 3.
Движение катиона красителя в полости кукурбитурила при фотовозбуждении: (а) поглощение кванта света, (б) внутримолекулярный перенос заряда, (в) поступательное движение возбужденного катиона в полости кавитанда и последующая релаксация. Красным обозначен отрицательный заряд на порталах кукурбитурила.
В работе [4] в рамках такой электростатической модели была сделана оценка времени, которое требуется для перемещения гостей-катионов внутри полости кавитанда:
Здесь ԑ – диэлектрическая проницаемость среды, а – радиус портала с отрицательным зарядом q; m – масса катиона красителя и e – его подвижный положительный заряд. Формула (1) для параметров, соответствующих типичным свойствам комплексов включения [27]: a ≈ 2Å, ԑ ≈ 10, m = 200 a.e., и в предположении, что q ≈ e (причем последний заряд – порядка элементарного заряда электрона) дает T ≈ 500 фс. Фактически это оценка снизу так как вязкость при выводе формулы (1) не учитывалась. Тем не менее, процессы, связанные со структурными изменениями комплексов включения между кукурбитурилами и стириловыми красителями, должны происходить в пикосекундном масштабе времени.
Известно, что для изучения релаксации электронно-возбужденных состояний в пикосекундном диапазоне удобно использовать времяразрешенную методику флуоресцентной спектроскопии, метод апконверсии [28]. Эффективность такого подхода была продемонстрирована на примере экспериментальной установки, построенной на основе лазера на кристалле Cr: Forsterite, который генерирует импульсы длительностью 90 фс с частотой следования 96 МГц (энергия импульса 7 нДж) на основной длине волны около 1250 нм (подробнее см. [29]).
Сверхбыстрая релаксация электронно-возбужденных супрамолекулряных комплексов стириловых красителей с кукурбитурилами состава 1 : 1. Разрешенная во времени релаксация электронно-возбужденных состояний растворов стириловых красителей изучена достаточно подробно [30–33] и, как правило, рассматривается в рамках модели, представленной на рис. 4.
Рис. 4.
Схема зависимости потенциальной энергии стирилового красителя от координаты реакции (см. текст).
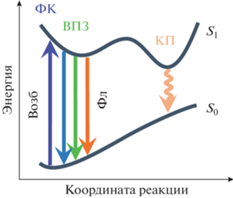
Франк-Кондоновское (ФК) состояние первого синглетного электронно-возбужденного уровня (S1) возникает, когда транс-форма основного состояния S0 стирилового красителя поглощает квант света. Последующую релаксацию можно рассматривать как движение репрезентативной точки вниз по одномерной кривой потенциальной энергии системы. Начальная стадия, связанная с колебательным охлаждением и внутримолекулярным переносом заряда (ВПЗ), происходит в течение нескольких сотен фемтосекунд, что сопровождается значительным изменением в распределении электронной плотности катиона красителя.
Перенос заряда, в свою очередь, приводит к реорганизации сольватной оболочки, которая происходит в пикосекундном масштабе времени, а также к значительному уменьшению потенциальной энергии системы. На этой стадии релаксации краситель имеет практически планарную структуру, а длина волны флуоресценции увеличивается за счет уменьшения потенциальной энергии S1 [34].
Внутримолекулярные вращательные движения стирилового красителя определяют более медленную стадию релаксации, изомеризацию по двойной связи и вращения вокруг одинарных связей фрагмента C–C=C–C молекулы. Вращение около одинарной связи в стириловой части катиона приводит к, так называемому, скрученному состоянию внутримолекулярного переноса заряда, которое соответствует минимуму энергии S1 и является коническим пересечением (КП) на рис. 4. Последнее играет важную роль как эффективный канал безызлучательной релаксации. Характерное время внутренней конверсии, идущей через КП, составляет около 100 фс [35]. Система может попасть в область КП из флуоресцентного состояния ВПЗ, перевалив через, как правило, низкий энергетический барьер, что приводит к сильному тушению флуоресценции. Таким образом, можно выделить три характерных времени релаксации: первое – несколько сотен фемтосекунд, второе – порядка 1 пс и третье – десятки пс.
В работах [36–38] показано, что эта схема применима и для описания фотофизики комплексов включения стириловых красителей с кукурбитурилами. Образование 1 : 1 комплексов включения с CB[n] (n = 6.7) изменяет максимальное время затухания τ3 от 50 пс для свободного Кр.1 до 100–200 пс для связанного Кр.1 в соответствии с наблюдаемым усилением стационарной флуоресценции. Гласбек с сотрудниками в важной работе [39] экспериментально показали, что флуоресценция стириловго красителя увеличивается только при значительном подавлении всех внутримолекулярных вращений красителя в возбужденном состоянии. Таким образом, перемещение стирилового красителя при фотовозбуждении внутрь полости кукурбитурила увеличивает потенциальный барьер между ВПЗ и КП состояниями.
Данные исследований ЯМР [40], полученные группой Ли, подтверждают структурную реорганизацию в подобных комплексах включения с CB [6]: было показано, что при протонировании основного состояния Кр.4, анилиновое кольцо смещается в полость CB [6]. При протонировании Кр.4 аминогруппа становится положительно заряженной, что в некоторой степени играет роль, аналогичную фотоиндуцированному переносу заряда.
Как уже отмечалось, комплекс включения Кр.4 с CB[6] можно рассматривать как молекулярную машину [4, 41], молекулярный переключатель, за счет взаимного движения его частей друг относительно друга под действием света. Аналогичные рассуждения приводят Черникова и соавторы, исследуя комплексы включения CB 7] и стириловых красителей, близких по строению к Кр.4 [26].
Компоненты сигнала флуоресценции τ1, характеризующиеся более короткими временами порядка 100 фс, соответствуют так называемому колебательному охлаждению и присутствуют в кинетике затухания флуоресценции Кр.4 как свободного, так и связанного с CB[6]. Эти времена преобладают в синей области полосы флуоресценции и отражают быструю релаксацию высоких колебательных подуровней возбужденного состояния, которые заселяются в первый момент после фотовозбудения. Соответственно, такие же времена проявляются в красном крыле спектра флуоресценции в виде увеличения заселенности более низких колебательных подуровней.
Характерное время гидратации возбужденного состояния составляет около 2 пс, что определяется переориентацией молекул воды в гидратной оболочке красителя [43]. В комплексе включения это время должно изменяться, поскольку кавитанд влияет на характер взаимодействия красителя с гидратной оболочкой.
Для количественной оценки такого механизма супрамолекулярной сольватации, был исследован времяразрешенный стоксов сдвиг флуоресценции в пикосекундном масштабе времени [43]. Мгновенные спектры испускания были получены из набора кривых затухания флуоресценции, снятых на различных длинах волн по методу Флеминга [44].
На рис. 5 и 6 представлены реконструированные мгновенные спектры флуоресценции водного раствора Кр.4 и его комплексов с CB [6] в диапазоне 5 пс. Черными кружками отмечены максимумы флуоресценции для каждого момента времени. Перестройка гидратной оболочки красителя проявляется в непрерывном батохромном сдвиге мгновенного спектра флуоресценции, что хорошо видно на рисунках. Сольватация (гидратация) включает в себя либрационное движение молекул воды, а также смещение CB[6] относительно красителя, когда в растворе присутствуют комплексы. Зависимость стоксова сдвига от времени обычно описывается функцией корреляции времени сольватации [45]:
(2)
$S\left( t \right) = \frac{{\nu \left( t \right) - \nu \left( \infty \right)}}{{\nu \left( 0 \right) - \nu \left( \infty \right)}}.$Рис. 5.
Двумерная диаграмма затухания флуоресценции водного раствора Кр.4. Черными кружками отмечены максимумы флуоресценции мгновенных спектров.
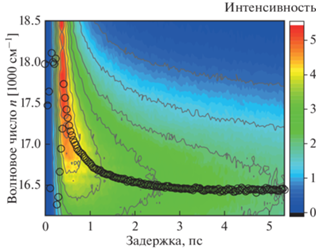
Рис. 6.
Двумерная диаграмма затухания флуоресценции водного раствора комплексов Кр.4 с CB[6]. Черными кружками отмечены максимумы флуоресценции мгновенных спектров.
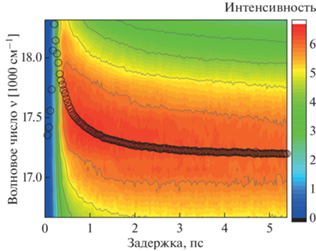
Здесь $\nu \left( 0 \right),$ $\nu \left( \infty \right)$ и $\nu \left( t \right)$ – волновые числа максимумов спектров излучения при t = 0, t → ∞, когда система находится в равновесии, и в промежуточный момент времени t.
Изменение положения максимумов спектров флуоресценции (черные кружки на рис. 5 и 6) соответствует уравнению (3), которое следует из уравнения (2):
(3)
$\nu \left( t \right) = {{\alpha }_{1}}{{e}^{{{{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{1}}}}} \right. \kern-0em} {{{\tau }_{1}}}}}}} + {{\alpha }_{2}}{{e}^{{{{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{2}}}}} \right. \kern-0em} {{{\tau }_{2}}}}}}} + \nu \left( \infty \right).$В табл. 2 представлены результаты аппроксимации положения максимума флуоресценции мгновенных спектров для Кр.4 и его комплексов с CB[6] уравнением (3). Следует отметить, что значение ν(∞) хорошо согласуются с волновым числом максимума стационарных спектров флуоресценции. Более короткие времена сольватации можно отнести к колебательному охлаждению, а более длинные – к вращению молекул воды в первой гидратной оболочке Кр.4. Добавление CB[6] к раствору красителя приводит к изменению τ2 от 0.81 пс для несвязанного Кр.4 до 1.15 пс для комплекса, что связано с вращательным движением молекул воды в сольватной оболочке. Значение τ1, которое можно отнести к колебательному охлаждению, изменилось с 118 до 224 фс при добавлении CB[6].
Таблица 2.
Результаты аппроксимации положения максимума флуоресценции мгновенных спектров для Кр.4 и его комплексов с CB[6] суммой двух экспонент
| Растворитель | Образец | ${{\alpha }_{1}}$ | τ1, фс | ${{\alpha }_{2}}$ | τ2, фс | ν(∞), см–1 |
|---|---|---|---|---|---|---|
| Н2О | Кр.4 | 64 ± 3 | 121 ± 7 | 769 ± 82 | 799 ± 20 | 16 415 ± 2 |
| Кр.4 + CB[6] | 1523 ± 47 | 223 ± 7 | 424 ± 12 | 1149 ± 28 | 17 198 ± 3 | |
| D2O | Кр.4 | 1537 ± 144 | 288 ± 31 | 731 ± 65 | 1211 ± 80 | 16 425 ± 4 |
| Кр.4 + CB[6] | 2279 ± 119 | 301 ± 21 | 455 ± 20 | 1630 ± 148 | 17 230 ± 4 |
Жесткая гидрофобная полость кукурбитурила имеет низкую поляризуемость [27], поэтому, в отличие от полярных молекул воды в первой гидратной оболочке, она не может существенно изменить энергию сольватации красителя. Полость кукурбитурила, по-видимому, играет роль второй гидрофобной сольватной оболочки, влияющей на первую гидрофильную. Однако присутствие CB[6] может нарушить сеть водородных связей вокруг красителя. Наблюдаемое увеличение более короткого времени сольватации может быть связано с тем, что плотная сеть водородных связей вокруг возбужденной молекулы ускоряет колебательное охлаждение [46]. Стоит отметить, что величина гипсохромного сдвига стационарного спектра флуоресценции при комплексообразовании хорошо согласуется со свободной энергией диссоциации водородных связей [45, 47]. Иными словами, при образовании комплекса CB[6] разрушается сеть водородных связей вокруг красителя, что увеличивает энергию системы.
Аналогичные эксперименты были выполнены в тяжелой воде [48]. При замене H2O на D2O максимум стационарного спектра флуоресценции свободного Кр.4 смещается с 603 до 610 нм, при этом максимум флуоресценции комплекса не изменяет своего положения (580 нм). Квантовый выход флуоресценции увеличивается незначительно: на 6% для свободного красителя и на 15% для его комплекса с кукурбитурилом, т.е. наблюдается слабый нормальный изотопный эффект [49]. Отсюда следует, что скорость безызлучательных процессов, конкурирующих с флуоресценцией, в данном случае, практически не зависит от типа растворителя. В тяжелой воде колебательное охлаждение происходит медленнее [50], что объясняет увеличение характерного времени τ1 в тяжелой воде для свободного красителя (см. табл. 2).
Присутствие CB[6] в растворе существенно увеличивает τ2 (табл. 2). Это увеличение объясняется также как и в случае Н2О растворов, с учетом того, что переносимая сольватная масса для D2O больше.
Следует отметить, что в рамках концепции молекулярной машины время τ2 можно рассматривать как время срабатывания молекулярного переключателя. Другими словами, время, необходимое для движения электронно-возбужденного стирилового красителя Кр.4 внутри кавитанда CB6, составляет примерно 1.1 пс в воде и 1.6 пс в тяжелой воде.
Результаты по анизотропии флуоресценции комплексов включения стириловых красителей с кукурбитурилом, полученные в работе [51], позволяют прояснить характер движения стириловых красителей в комплексах с кукурбитурилами.
По определению, анизотропия флуоресценции определяется следующим выражением [52]:
Здесь ${{I}_{\parallel }}$ и ${{I}_{ \bot }}$ – интенсивность флуоресценции, измеренная в параллельном и перпендикулярном положении анализатора относительно линейно поляризованного возбуждающего импульса.
Анизотропия флуоресценции Кр.4 в комплексах с CB[6] как функция времени r = r (t) достигает значение r ≈ 0.38 за 500 фс после возбуждения флуоресценции, оставаясь потом постоянной в диапазоне до 2.5 пс. Максимально возможное значение анизотропии составляет 0.4, если поглощающий и излучающий осцилляторы параллельны [53], что вполне выполняется в случае веретенообразных стириловых красителей. При этом значение анизотропии превышает 0.38, если угол между поглощающим и излучающим осцилляторами не выходит за пределы 10°. Таким образом, в комплексах гость–хозяин после возбуждения лазерным импульсом происходит быстрое трансляционное перемещение катиона стирилового красителя.
Сверхбыстрая динамика релаксации электронно-возбужденных супрамолекулряных комплексов стириловых красителей с кукурбит[8]урилами состава 2 : 1. В отличие от CB[6] и CB[7], полость кавитанда CB[8] может разместить две молекулы красителя одновременно. Для таких тройных комплексов следует учитывать взаимодействие гостевых молекул между собой, которые под воздействием света могут образовывать новые химические связи.
В работах [54, 55] методами ЯМР и спектрофотометрии в водных растворах были обнаружены комплексы включения между Кр.1 и CB[8] состава 2 : 1. Было показано, что в результате фотолиза этих растворов образуется изомер циклобутана, что демонстрирует способность кавитанда CB[8] выступать в роли супрамолекулярного катализатора реакций [2 + 2] фотоциклоприсоединения. В литературе встречается достаточно много примеров таких реакций, эффективно протекающей в полости кукурбит[8]урила (см. например [56–59]).
Такие фотохимические процессы должны приводить к появлению дополнительного канала релаксации электронно-возбужденных состояний красителя, концентрационному тушению. В работе [60] экспериментально было показано, что такое тушение действительно существует в пикосекундном диапазоне. В той же работе при помощи квантово-химических расчетов было показано, что в невозбужденном состоянии два красителя в полости CB[8] имеют плоскую форму и расположены параллельно друг другу “голова к хвосту” на расстоянии между плоскостями приблизительно 3.6 Å. Расстояние между C атомами двойных связей красителей составляет около 4.1 Å. Это означает, что несмотря на то, что молекулы красителей параллельны, их C=C связи не находятся одна над другой. Таким образом, для осуществления элементарного акта реакции циклоприсоединения – другими словами, чтобы пара красителей удовлетворяла топохимическому принципу – один из красителей должен сместиться примерно на 2.2 Å вдоль оси симметрии CB[8] по направлению к другому. Кроме того, должно еще произойти сближение красителей в вертикальной плоскости, так как образующиеся C–C связи циклобутана (1.585 Å) почти на 2 Å короче расстояния между красителями.
Таким образом, после поглощения кванта света комплекс включения состава 2 : 1 испытывает значительные структурные изменения, связанные с относительным движением катионов красителя, по-видимому, диффузионного характера.
В рамках диффузионного приближения, характерное время концентрационного тушения электронно-возбужденной частицы $\sim {\kern 1pt} \frac{1}{{{{k}_{q}}c}}$ = 14 пс. Здесь с ≈ 7 моль/л – эффективная концентрация двух катионов красителя в полости CB[8], объем которой ≈480 Å3 (см. табл. 1); kq ≈ 1010 л моль–1 с–1 – диффузионная константа скорости в воде [61]. Такая оценка хорошо согласуется с экспериментом.
В работе [62] было продолжено изучение сверхбыстрой кинетики затухания флуоресценции 2 : 1 комплексов для красителей Кр.1, Кр.2 и Кр.3 с CB[8]. На рис. 7 представлены типичные кривые затухания флуоресценции в диапазоне до 10 пс для водных растворов свободного красителя Кр.1 и красителя Кр.1 в присутствии CB[8] при максимальном содержании комплексов 2 : 1, т.е. 0.5 эквив. CB[8]. Аналогичные кривые затухания флуоресценции были получены и в случае красителей Кр.2, Кр.3.
Рис. 7.
Кривые затухания флуоресценции водных растворов красителя Кр.1 (красный) и красителя Кр.1 в комплексе 2 : 1 с СВ[8] (синий) – возбуждение 417 нм, регистрация 530 нм.
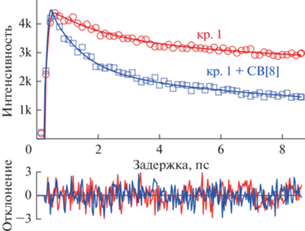
Исследованные водные растворы стириловых красителей имеют типичный набор характерных времен затухания (табл. 3). Присутствующую во всех образцах экспоненту со временем порядка 1–2 пс можно приписать реакции сольватной оболочки на перераспределение заряда красителя в возбужденном состоянии. На длине волны 530 нм, правом крыле спектра флуоресценции, где проводились измерения имеется растущая экспонента с временем порядка 300 фс, которую можно приписать процессу колебательного охлаждения. Третья экспонента, присутствующая во всех исследованных красителях, характеризуется затуханием 20–75 пс в зависимости от образца. Добавление CB[8] в систему приводит к уменьшению величины характерного третьего времени.
Таблица 3.
Характерные времена затухания флуоресценции на 530 нм водных растворов красителей Кр.1, Кр.2 и Кр.3 и их комплексов с CB[8]
Квантовые выходы фотохимической реакции циклоприсоединения были определены на основе данных фотолиза растворов комплексов стриловых красителей методом, описанным в работе [35]. Они равны 0.06, 0.02, 0.04 для Кр.1, Кр.2 и Кр.3 соответственно. Квантовый выход фотохимической реакции для образца Кр.1 является наибольшим среди рассмотренных красителей, и для него наблюдается наибольшее изменение второй положительной экспоненты в кинетике затухания флуоресценции. Соответствующее изменение наблюдается и для остальных красителей. Такая корреляция доказывает, что фотохимическая реакция красителей в полости СВ[8] является дополнительным каналом релаксации электронно-возбужденных состояний 2 : 1 комплексов включения.
ЗАКЛЮЧЕНИЕ
На примере супрамолекулярных комплексов стириловых красителей с кукурбитурилами в обзоре рассмотрены результаты исследований сверхбыстрой релаксации электронно-возбужденных комплексов, которая сопровождается существенными структурными изменениями, связанными с перераспределением электронной плотности при фотовозбуждении системы. Внутримолекулярный перенос электрона в молекулярном катионе красителя изменяет его взаимодействие с отрицательно заряженным порталом кавитанда, что вызывает механическое перемещение красителя вглубь полости кукурбитурилов. По определению, такие системы являются молекулярными машинами. В комплексах состава 1 : 1 с СВ[6] это движение происходит вдоль центральной оси кавитанда с характерным временем 1–2 пс. В супрамолекулярных комплексах состава 2 : 1 появляется дополнительный канал релаксации, реакция [2 + 2] фотоциклоприсоединения стириловых красителей, которая также может изучаться сверхбыстрыми методами лазерной флуоресцентной спектроскопии.
Список литературы
Masson E., Ling X., Joseph R., Kyeremeh–Mensaha L., Lua X. // RSC Advances. 2012. V. 2. P. 1213.
Dsouza R.N., Pischel U., Nau W.M. // Chem. Rev. 2011. 111. P. 7941.
Kim K., Murray J., Selvapalam N., Ho Ko Y., Hwang J. Cucurbiturils: chemistry, supramolecular chemistry and applications. New Jersey, World Scientific, 2018.
Petrov N.Kh., Ivanov D.A., Alfimov M.V. // ACS OME-GA. 2019. V. 4. № 7. P. 11500. https://doi.org/10.1021/acsomega.9b01158
Lee J.W., Samal S., Selvapalam N., Kim H.-J., Kim K. // Acc. Chem. Res. 2003. V. 36. № 8. P. 621. https://doi.org/10.1021/ar020254k
Behrend R., Meyer E., Rusche F. // Liebigs Ann. Chem. 1905. V. 339. P. 1. https://doi.org/10.1002/jlac.19053390102
Freeman W.A., Mock W.L., Shih N.-Y. // J. Am. Chem. Soc. 1981. V. 103. P. 7367. https://doi.org/10.1021/ja00414a070
Mock W.L., Shih N.Y. // The J. Organic Chemistry. 1983. V. 48. № 20. P. 3618–3619. https://doi.org/10.1021/jo00168a069
Mock W.L., Irra T.A., Wepsiec J.P., Adhya M. // The J. Organic Chemistry. 1989. V. 54. № 22. P. 5302. https://doi.org/10.1021/jo00283a024
Mock W.L., Pierpont J.A. // J. Chem. Soc., Chem. Commun. 1990. 21. P. 1509. https://doi.org/10.1039/C39900001509
Buschmann H.-J., Schollmeyer E. // J. inclusion phenomena and molecular recognition in chemistry. 1997. Oct. V. 29. №. 2. P. 167. https://doi.org/10.1023/A:1007981816611
Buschmann H.-J., Wolff T. // J. Photochemistry and Photo-biology A: Chemistry. 1999. V. 121. № 2. P. 99. https://doi.org/10.1016/S1010-6030(98)00459-6
Buschmann H.-J., Cleve E., Schollmeyer E. // Inorganica Chimica Acta. 1992. V. 193. № 1. P. 93. https://doi.org/10.1016/S0020-1693(00)83800-1
Buschmann H.-J., Jansen K., Schollmeyer E. // Thermochimica Acta. 1998. V. 317. № 1. P. 95. https://doi.org/10.1016/S0040-6031(98)00377-3
Jeon Y.-M., Kim J., Whang D., Kim K. // J. American Chemical Society. 1996. V. 118. № 40. P. 9790. https://doi.org/10.1021/ja962071x
Kim K. // Chem. Soc. Rev. 2002. V. 31. № 2. P. 96. https://doi.org/10.1039/A900939F
Whang D., Park K.M., Heo J., Ashton P., Kim K. // J. Am. Chem. Soc. 1998. V. 120. № 19. P. 4899. https://doi.org/10.1021/ja980029r
Xing X., Zhou Y., Sun J., Tang D., Li T., Wu K. // Analytical Letters. 2013. V. 46. № 4. P. 694.
Zhang X., Xu X., Li S., Li L., Zhang J., Wang R. // Theranostics. 2019. V. 9. P. 633.
Petrov N.Kh., Ivanov D.A., Golubkov D.V., Gromov S.P., Alfimov M.V. // Chemical Physics Letters. 2009. V. 480. № 1. P. 96.
Zakharova G.V., Zhizhimov D.A., Sazonov S.K., Avakyan V.G., Gromov S.P., Görner H., Chibisov A.K. // J. Photochemistry and Photobiology A: Chemistry. 2015. V. 302. P. 69.
Ivanov D.A., Petrov N.Kh., Nikitina E.A., Basilevsky M.V., Vedernikov A.I., Gromov S.P., Alfimov M.V. // The J. Physical Chemistry A. 2011. May. V. 115. № 17. P. 4505.
Li Z., Sun S., Liu F., Pang Y., Fan J., Song F., Peng X. // Dyes and Pigments. 2012. V. 93. № 1–3. P. 1401.
Carlotti B., Consiglio G., Elisei F., Fortuna C.G., Mazzucato U., Spalletti A. // The J. Physical Chemistry A. 2014. V. 118. № 36. P. 7782.
Abdel-Halim S.T., Awad M. K. // J. Mol. Struct. 2009. V. 920. P. 332.
Chernikova E.Y., Berdnikova D.V., Fedorov Y.V., Fedorova O.A., Maurel F., Jonusauskas G. // Phys. Chem. Chem. Phys. 2017. V. 19. P. 25834.
Assaf K.I., Nau W.M. // Chem. Soc. Rev. 2015. V. 44. P. 394.
Lemmetyinen H., Tkachenko N.V., Valeur B., Hotta J.-I., Ameloot M., Ernsting N.P., Gustavsson T., Boens N. // Pure Appl. Chem. 2014. V. 86. P. 1969.
Шандаров Ю.А., Крюков И.В., Иванов Д.А., Иванов А.А., Петров Н.Х., Алфимов М.В. // Приборы и техника эксперимента. 2018. № 4. С. 90.
Glasbeek M., Zhang H. // Chem. Rev. 2004. V. 104. P. 1929.
Huang Y., Cheng T., Li F., Huang C.-H., Wang S., Huang W., Gong Q. // J. Phys. Chem. B 2002. V. 106. P. 10041.
Jee A.-Y., Bae E., Lee M. // J. Chem. Phys. 2010. V. 133. P. 014507.
Kim J., Lee M. // J. Phys. Chem. A. 1999. V. 103. P. 3378.
Huang Y., Cheng T., Li F., Huang C.-H., Wang S., Huang W., Gong Q. // J. Phys. Chem. B 2002. V. 106. P. 10041.
Levine B.G., Martínez T.J. // Annu. Rev. Phys. Chem. 2007. V. 58. P. 613.
Ivanov D.A., Petrov N.K., Ivanov A.A., Alfimov M.V., Vedernikov A.I., Gromov S.P. // Chem. Phys. Lett. 2014. V. 610–611. P. 91.
Петров Н.Х., Иванов Д.А., Шандаров Ю.А., Крюков И.В., Авакян В.Г., Алфимов М.В., Сазонов С.К., Громов С.П. // Российские нанотехнологии. 2015. Т. 10. № 11–12. С. 33.
Petrov N.K., Ivanov D.A., Shandarov Y.A., Kryukov I.V., Ivanov A.A., Alfimov M.V., Lobova N.A., Gromov S.P. // Chem. Phys. Lett. 2016. V. 647. P. 157.
Glasbeek M., Zhang H. // Chem. Rev. 2004. V. 104. P. 1929.
Li Z., Sun S., Liu F., Pang Y., Fan J., Song F., Peng X. // Dyes Pigm. 2012. V. 93. P. 1401.
Erbas-Cakmak S., Leigh D.A., McTernan C.T., Nussbaumer A.L. // Chem. Rev. 2015. V. 115. P. 10081.
van der Post S.T., Tielrooij K.-J., Hunger J., Backus E.H.G., Bakker H.J. // Faraday Discuss. 2013. V. 160. P. 171.
Petrov N.K., Ivanov D.A., Kryukov I.V., Svirida A.D., Shandarov Y.A., Alfimov M.V. // J. Fluoresc. 2018. № 28. P. 883.
Maroncelli M., Fleming G.R. // J. Chem. Phys. 1987. № 86. P. 6221.
Bagchi B., Jana B. // Chem. Soc. Rev. 2010. № 39. P. 1936.
Middleton C.T., Cohen B., Kohler B. // J. Phys. Chem. A 2007. V. 111. P. 10460.
Гордон А., Форд Р. Спутник химика. Физико-химические свойства, методики, библиография (справочник). М.: Мир, 1976.
Свирида А.Д., Иванов Д.А., Шандаров Ю.А., Крюков И.В., Петров Н.Х., Алфимов М.В. // Химия высоких энергий. 2018. Т. 52. № 3. С. 245.
Ermolaev V.L. // Opt. Spectrosc. 2016. № 121. P. 567.
Gustavsson T., Banyasz A., Sarkar N., Markovitsi D., Improta R. // Chem. Phys. 2008. V. 350. P. 186.
Петров Н.Х., Иванов Д.А., Крюков И.В., Шандаров Ю.А., Свирида А.Д., Алфимов М.В. // Химия высоких энергий. 2017. Т. 51. № 1. С. 77.
Лакович Дж. Основы флуоресцентной спектроскопии. М.: Мир, 1986.
Ramadass R., Bereiter-Hahn J. // J. Phys. Chem. B 2007. № 111. P. 7681.
Gromov S.P., Vedernikov A.I., Kuz’mina L.G., Kondratuk D.V., Sazonov S.K., Strelenko Y.A., Alfimov M.V., Howard J.A.K. // European J. Organic Chemistry. 2010. V. 2010. № 13. P. 2587.
Иванов Д.А., Петров Н.Х., Алфимов М.В., Ведерников А.И., Громов С.П. // Химия высоких энергий. 2014. Т. 48. № 4. С. 295.
Jon S.Y., Ko Y.H., Park S.H., Kim H.-J., Kim K. // Chem. Commun. 2001. № 19. P. 1938.
Pattabiraman M., Kaanumalle L.S., Natarajan A., Ramamurthy V. // Langmuir. 2006. V. 22. № 18. P. 7605.
Nakamura A., Irie H., Hara S., Sugawara M., Yamadab Y. // Photochem. Photobiol. Sci. 2011. V. 10. Iss. 9. P. 1496.
Li F., Zhuang J., Jiang G., Tang H., Xia A., Jiang L., Song Y., Li Y., Zhu D. // Chemistry of Materials. 2008. Feb. V. 20. № 4. P. 1194.
Petrov N.Kh., Ivanov D.A., Shandarov Yu.A., Kryukov I.V., Svirida A.D., Avakyan V.G., Alfimov M.V., Lobova N.A., Gromov S.P. // Chemical Physics Letters. 2017. V. 673. P. 99.
Гаммет Л. Основы физической химии. М.: Мир, 1972.
Свирида А.Д., Иванов Д.А., Крюков И.В., Шандаров Ю.А., Петров Н.Х., Алфимов М.В., Александрова Н.А., Сазонов С.К., Ведерников А.И., Громов С.П. // Химия высоких энергий. 2019. Т. 53. № 3. С. 199.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий