Химия высоких энергий, 2022, T. 56, № 3, стр. 181-185
Спектрально-люминесцентное и спектрофотометрическое исследование молекулярных и анионных форм N-метилпроизводных 5-фторурацила в водных растворах
С. С. Остахов a, *, Г. С. Абдрахимова a, Р. Р. Каюмова a, С. П. Иванов a, С. Л. Хурсан a
a Уфимский институт химии УФИЦ РАН
450054 Уфа, просп. Октября, 71, Россия
* E-mail: chemlum@anrb.ru
Поступила в редакцию 23.12.2021
После доработки 10.01.2022
Принята к публикации 14.01.2022
- EDN: VLXRCS
- DOI: 10.31857/S0023119322030081
Аннотация
Спектрофотометрическим и флюоресцентным (ФЛ) методами исследованы растворы N-метилпроизводных 5-фторурацила (FU): 1-метил-5-фторурацил (1M-FU), 3-метил-5-фторурацил (3M-FU) и 1,3-диметил-5-фторурацил (1,3DM-FU) в нейтральной (pH 6.8) и щелочной (pH 11) водных средах. Впервые зарегистрированы параметры флуоресценции (ФЛ): спектры и квантовые выходы (φ) ФЛ 1M-FU, 3M-FU и 1,3DM-FU, а также их анионных форм. Обнаружены батофлорные сдвиги максимумов ФЛ и увеличение квантовых выходов ФЛ данных соединений по сравнению с незамещенным FU при рН 6.8 и рН 11. Приводится интерпретация установленных закономерностей.
С середины XX века известно, что природные урацилы являются компонентами нуклеиновых кислот [1]. В это же время были открыты медико-биологические свойства некоторых замещенных пиримидинов. В частности, были синтезированы 5-галоурацилы (F–, Cl–, Br–, J–), обладающие ярко выраженными противоопухолевыми, антибактериальными и противовирусными свойствами [2, 3]. В настоящее время 5-фторурацил (фармацевтические препараты: “Фторурацил-ЛЭНС”, “5-Фторурацил-Эбеве”) широко используется в онкологии при лечении опухолей толстого кишечника, желудка, поджелудочной железы, легких и метастазах в эти органы [4]. Метилированные производные урацила, в частности, 6-метил-урацил (лекарственный препарат “Метилурацил”) эффективно применяется как иммуностимулятор, улучшающий трофику и регенерацию тканей [5], проявляет выраженные гепатопротекторные и антиоксидантные свойства [6], а его 5‑гидрокси-производное демонстрирует выраженный антигипоксический эффект [6].
В 1953 г. Уотсоном и Криком было высказано предположение, что редкие таутомерные формы нуклеиновых кислот способны вызывать нарушения в репликации ДНК [1]. Позже в работе [7] подобное поведение было обнаружено и у их анионных форм. В 60-е годы прошлого века, в работах [8, 9] спектрофотометрическим методом исследованы водные растворы всего ряда 5- и 6-галоген-урацилов, а также их метилзамещенных производных. Определены константы первой и второй ступеней диссоциации, установлено процентное содержание моноанионных форм 5-фторурацила [8–10].
Известно, что урацил и его производные обладают флюоресценцией [11, 12]. Спектрально-люминесцентный метод, позволяет не только зарегистрировать низкие концентрации пиримидиновых оснований в растворах [11, 12], и кристаллическом состоянии [13, 14], но также исследовать их кето-енольные [14–17] и анионные формы [12].
В то же время, несмотря на большой объем проведенных исследований с использованием различных физико-химических методов, ФЛ изучение анионных форм урацилов носило эпизодический характер. В этой связи целью настоящей работы являлось определение и сравнительный анализ спектрально-люминесцентных параметров метилпроизводных 5-фторурацила (FU): 1-метил-FU (1M-FU), 3-метил-FU (3M-FU) и 1,3-диметил-FU (1,3DM-FU) и их анионных форм в нейтральных (рН 6.8) и щелочных (рН 11.0) водных растворах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры поглощения регистрировали на спектрофотометре “Shimadzu UV-1800”, скорректированные спектры ФЛ на спектрофлюориметре “СМ-2203” в кварцевой кювете (l = 1 см). Фотовозбуждение образцов проводили на длине волны возбуждающего света λex = 250 нм. Спектры ФЛ записаны в интервале длин волн эмиссии λem = = 300–500 нм с разрешением ±2 нм.
Квантовые выходы ФЛ определяли по известной методике [18] с использованием внешнего стандарта L-триптофана (Trp) по уравнению (1):
(1)
$\varphi = {{\varphi }_{{{\text{Trp}}}}}{{(S{{A}_{{{\text{Trp}}}}})} \mathord{\left/ {\vphantom {{(S{{A}_{{{\text{Trp}}}}})} {({{S}_{{{\text{Trp}}}}}A)}}} \right. \kern-0em} {({{S}_{{{\text{Trp}}}}}A)}},$1M-FU, 3M-FU и 1,3DM-FU синтезированы по методике [20]. FU (“Sigma-Aldrich”, ≥99.0%), Trp (“Sigma-Aldrich”, 99.5%) и KOH квалификации “х. ч.” использовали без предварительной очистки. Растворы FU и его метилпроизводных (с = 1.0 × 10–5 моль/л) готовили в дважды перегнанной воде при рН 6.8 и 11.0.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Введение СН3-заместителей в N1, N3-положение FU позволяет провести достоверное отнесение УФ- и ФЛ-спектров молекулярных (рН 6.8) и анионных (рН 11.0) форм метилпроизводных FU (рис. 1), а также определить их спектрально-люминесцентные параметры.
Известно, что при введении алкильных заместителей в пиримидиновые основания в УФ- и ФЛ-спектрах регистрируются: батохромные и батофлорные сдвиги, гиперхромные эффекты, а также увеличение φ ФЛ в нейтральных водных растворах [8, 11].
На рис. 2 приведены спектры поглощения нейтральных (рН 6.8) водных растворов FU и его метилпроизводных (рис. 1).
Рис. 2.
Спектры поглощения: 1 – FU, 2 – 1M-FU, 3 – 3M-FU, 4 – 1,3DM-FU (с = 1.0 × 10–5 моль/л, H2O, рН 6.8, 298 К).
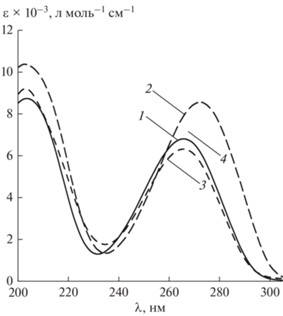
При сопоставлении максимумов поглощения (λabs) и молярных десятичных коэффициентов поглощения (ε) исследованных соединений обнаружено, что введение СН3- заместителя в N1 положение FU приводит к батохромному сдвигу на ≈8 нм и гиперхромному эффекту (рис. 2, спектр 2, табл. 1). Спектральные характеристики 3M-FU идентичны 5-фторурацилу (рис. 2, спектр 3, табл. 1). В то же время, параметры поглощения 1,3DM-FU (рис. 2, спектр 4, табл. 1) близки к таковым для 1M-FU. Аналогичные тенденции наблюдались в работе [8] при введении СН3-заместителей в N1 и N3 положения 5-бромурацила (1М-BrU, 3М-BrU и 1,3DМ-BrU), а также в ряду метилпроизводных урацила [11].
Таблица 1.
Спектральные характеристики молекулярных и анионных форм водных растворов FU и его метилпроизводных (с = 1.0 × 10–5 моль/л, λex = 250 нм, H2O, 298 К)
| Соединение | Поглощение | Люминесценция | ||
|---|---|---|---|---|
| λabs, нм | ε × 10–3, л моль–1 см–1 |
λem, нм | φ × 104 | |
| pH 6.8 | ||||
| FU | 266 | 6.8 | 340 | 2.2 |
| 1M-FU | 274 | 8.6 | 367 | 11.5 |
| 3M-FU | 266 | 6.3 | 363 | 6.7 |
| 1,3DM-FU | 273 | 7.6 | 340 | 2.0 |
| pH 11.0 | ||||
| N1‑FU | 3001 | ─ | 3721 | 351 |
| N3‑FU | 2691 | ─ | 3581 | 111 |
| N3‑1M-FU | 272 | 3.6 | 367 | 12.0 |
| N1‑3M-FU | 293 | 9.1 | 375 | 41.5 |
Примечание. 1 − данные работы [12]. Погрешность измерений ±5%.
Из вышеприведенных результатов следует, что кардинальное влияние на энергию S0–S1 перехода оказывает наличие СН3 группы именно в N1, а не N3 положении 5-фторурацила. Теоретическая трактовка данного экспериментального факта дана в работе [11]. Квантово-химические расчеты проводились с помощью метода PCM-TD-PBEO для тетрагидратной модели первой сольватной оболочки FU. Показано, что вклад N3 атома урацила в граничные орбитали очень мал, поэтому заместитель в третьем положении не приводит к значительному сдвигу электронного S0–S1 перехода. Напротив, CH3-группа в положении N1 и атом фтора в С5 положении пиримидинового цикла дают антисвязывающий вклад в HOMO орбиталь, тем самым увеличивая ее энергию. Эти заместители оказывают антисвязывающий эффект и на LUMO орбиталь, но значительно меньший, чем в HOMO. Энергетический зазор между HOMO и LUMO при введении заместителей уменьшается, что приводит к батохромному сдвигу S0–S1 перехода по отношению к таковому в незамещенном урациле [11].
Остается невыясненным вопрос о влиянии метилирования на S1–S0 излучательные переходы FU в электронно-возбужденном состоянии. В спектре ФЛ в результате присоединения CH3-группы в N1 положение FU в нейтральных (рН 6.8) водных растворах регистрируются батофлорный сдвиг (≈27 нм) и увеличение квантового выхода ФЛ 1M-FU в 5 раз (рис. 3, спектр 2, табл. 1).
Рис. 3.
Спектры ФЛ: 1 – FU, 2 – 1М-FU, 3 – 3М-FU, 4 – 1,3DМ-FU (с = 1.0 × 10–5 моль/л, λex = 250 нм, H2O, рН 6.8, 298 К).
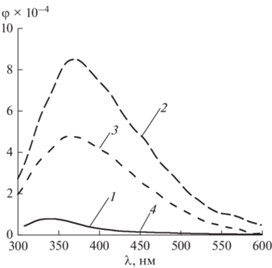
Батохромный сдвиг и гиперхромный эффект в УФ-спектрах 1M-FU, как было показано выше, не столь значителен. Введение метильного заместителя в N3 положение пиримидинового основания, в отличие от УФ-спектров, также приводит к длинноволновому смещению ФЛ 3M-FU (≈23 нм) (рис. 3, спектр 3) и повышению его квантового выхода ФЛ в 3 раза (табл. 1). Очевидно влияние электронного возбуждения на спектрально-люминесцентные параметры FU вследствие присоединения CH3-группы как в N1, так и в N3 положении пиримидинового основания. Таким образом, с одной стороны, спектральные сдвиги и рост φ ФЛ при метилировании N1 и N3 положения FU более значительны для S1–S0 чем для S0–S1 переходов, с другой, – доминирующее влияние СН3 группы в N1 положении FU не столь существенно в его электронно-возбужденном состоянии (табл. 1). Для 1,3DM-FU, переход S0–S1 в поглощении соответствует таковому для 1M-FU, а в электронно-возбужденном состоянии спектрально-люминесцентным параметрам 5-фтор-урацила (табл. 1).
Выше было приведено сравнительное исследование влияния метилирования FU на его УФ- и ФЛ-спектральные параметры в нейтральных (рН 6.8) водных растворах. Представляет интерес изучение депротонирования метилпроизводных FU в щелочных (pH 11) водных растворах. На рис. 4 приведены УФ-спектры анионных форм FU и его метилпроизводных: N3–FU, N1–FU, N1–3M-FU, N3–1M-FU (рис. 1).
Рис. 4.
Спектры поглощения: 1 – FU, 2 – 1M-FU, 3 – 3M-FU (с = 1.0 × 10–5 моль/л, H2O, рН 11.0, 298 К).
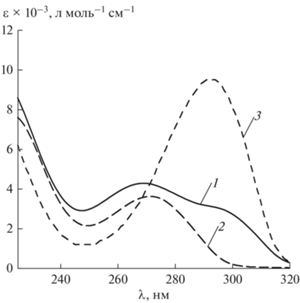
Ранее [12] спектр поглощения FU в водных растворах при рН 11 (рис. 4, спектр 1) с максимумом λabs = 269 нм и перегибом в области 300 нм был отнесен к анионам N3–FU и N1–FU соответственно (рис. 1, табл. 1). Из сравнения спектральных параметров, приведенных на рис. 4 и в табл. 1, очевидно совпадение, в пределах погрешности измерений, максимумов поглощения N1–FU с N1–3M-FU и N3–FU с N3–1M-FU. Депротонирование N1 положения FU, также как и метилирование, оказывает наибольшее влияние на УФ-спектры 5-фторурацила (табл. 1). Однако, в спектре поглощения N1–3M-FU (рис. 4, спектр 3), в отличие от его молекулярной формы (рис. 2, спектр 3), фиксируется существенный батохромный сдвиг на ≈27 нм и гиперхромный эффект (табл. 1). В то же время значения максимумов поглощения молекулярной и анионной форм 1М-FU (табл. 1) значительно не изменяются, а молярный десятичный коэффициент поглощения при образовании аниона N3–1M-FU, напротив, уменьшается в ≈2 раза. Следует отметить, что аналогичная тенденция в изменениях спектральных параметров при переходе из молекулярной формы в анионную прослеживается при исследовании щелочных (рН 10–14) водных растворов 1М-BrU, 3М-BrU и 1,3DМ-BrU [8].
Таким образом, аналогично метилированию FU в нейтральных водных растворах (рН 6.8), его депротонирование по N1 положению (рН 11.0), также оказывает наибольшее влияние на его спектрофотометрические параметры.
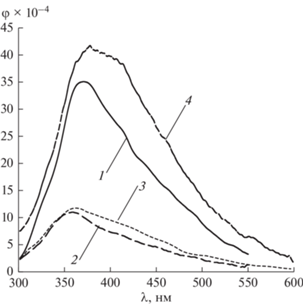
На рис. 5 представлены спектры ФЛ щелочных (рН 11.0) водных растворов FU и его метилзамещенных производных.
В спектре ФЛ (рис. 5, спектр 2) в результате присоединения CH3-группы в N1 положение FU регистрируются существенный батофлорный сдвиг (27 нм) и увеличение квантового выхода ФЛ 1M-FU в 5 раз (табл. 1). Наличие метильного заместителя в N3 положение пиримидинового основания, также как в нейтральных водных растворах, приводит к длинноволновому смещению в спектре ФЛ 3M-FU (23 нм) (рис. 5, спектр 3) и повышению φ ФЛ в 3 раза (табл. 1).
Как в спектральных параметрах поглощения, так и ФЛ анионов незамещенного [12] и метилзамещенных производных FU при pH 11 можно отметить их совпадение в пределах погрешности измерений (табл. 1). Максимумы УФ-поглощения: N1–FU и N1–3MFU – λabs = 300 и 293 нм; N3–FU и N3–1MFU – λabs = 269 и 272 нм. Максимумы ФЛ: N1–FU и N1–3MFU – λem= 372 и 275нм; N3–FU и N3–1MFU – λem = 358 и 367 нм. Величины φ ФЛ: N1–FU и N1–3МFU – φ = 35.0 и 41.5 × 104; N3–FU и N3–1МFU – φ = 11.0 и 12.0 × × 10–4 соответственно (табл. 1).
ЗАКЛЮЧЕНИЕ
Из анализа полученных результатов следует, что изменение рН существенного влияния на УФ и ФЛ спектры, а также φ люминесценции 1M-FU не оказывает. Однако введение CH3-группы в N1 положение и депротонирование N1 положения 3M-FU приводит к значительному длинноволновому сдвигу в УФ и ФЛ спектрах, гиперхромному эффекту и увеличению φ люминесценции (табл. 1).
В работе [12] показано, что в ряду FU, N3–FU, N1–FU длинноволновый сдвиг в УФ и ФЛ спектрах коррелируется с увеличением расчетной величины – константой магнитного экранирования (σ), полученной в рамках метода ядерно-независимых химических сдвигов [21, 22]. Константа магнитного экранирования является одним из критериев увеличения степени сопряжения в пиримидиновом цикле, а значит и ароматичности [23]. Такая достаточно стабильная структура способна сохранять индуцированный кольцевой ток в цикле при воздействии магнитного поля извне, что приводит к уменьшению безызлучательных потерь энергии [24] и, соответственно, увеличению φ ФЛ.
Таким образом, полученные результаты могут быть непротиворечиво интерпретированы с точки зрения увеличения степени сопряжения и, как следствие, повышение стабильности в пиримидиновом цикле при метилировании и депротонировании FU и его производных, а квантовый выход ФЛ можно рассматривать как количественную оценку ароматичности.
БЛАГОДАРНОСТИ
Спектрально-люминесцентные измерения выполнены на оборудовании ЦКП “Химия” УфИХ УФИЦ РАН и РЦКП “Агидель” УФИЦ РАН.
ИСТОЧНИК ФИНАНСИРОВАНИЯРабота выполнена в рамках Государственного задания по темам НИР УфИХ УФИЦ РАН: “Механизм и кинетические закономерности окислительных трансформаций с участием высокоактивных интермедиатов в химических и биохимических процессах”, “Установление структуры, состава и физико-химических свойств органических, биоорганических, полимерных молекул и комплексных соединений методами хроматографии, масс-спектрометрии, ИК, УФ, ЭПР и ЯМР-спектроскопии”.
Список литературы
Watson J.D., Crick F.H.C. // Nature. 1953. V. 171. № 4361. P. 964.
Blackburn G.M., Gait M.J. (Eds.) Nucleic Acids in Chemistry and Biology. N.Y.: Oxford University Press, 1996. 470 p.
Morris S.M. // Mutat. Res. 1993. V. 297. P. 39.
Машковский М.Д. Лекарственные средства. М.: Новая волна, 2002. Т. 2. 608 с.
Большая Медицинская Энциклопедия / Под ред. Петровского Б.В.: М.: “Советская энциклопедия”, 3-е издание. 1981. Т. 15. 576 с.
Gimadieva A.R., Myshkin V.A., Mustafin A.G., Chernyshenko Y.N., Borisova N.S., Zimin Y.S., Abdrakhmanov I.B. // Pharm. Chem. J. 2014. V. 48. P. 93.
Sowers L.C., Shaw B.R, Veigl M.L., Sedwick W.D. // Mutation Research. 1987. V. 177. P. 201.
Berens K., Shugar D. // Acta Biochimica Polonica. 1963. V. 10. № 1. P. 25.
Wempen I., Fox J.J. // J. Am. Chem. Soc. 1964. V. 86. № 12. P. 2474.
Abdrakhimova G.S., Ovchinnikov M.Yu., Lobov A.N., Spirikhin L.V., Ivanov S.P., Khursan S.L. // Journal of Physical Organic Chemistry. 2014. V. 27. P. 876.
Gustavsson T., Bányász Á., Lazzarotto E., Markovitsi D., Scalmani G., Frisch M.J., Barone V., Improta R. // J. Am. Chem. Soc. 2006. V. 128. № 2. P. 607.
Остахов С.С., Султанбаев М.В., Овчинников М.Ю., Каюмова Р.Р., Хурсан С.Л. // Химия высоких энергий. 2017. Т. 51. № 2. С. 116.
Остахов С.С., Султанбаев М.В., Хурсан С.Л., Шишлов Н.М., Лебедев Ю.А., Кинзябулатов Р.Р. // Химия высоких энергий. 2014. Т. 48. № 5. С. 379.
Ostakhov S.S., Sultanbaev M.V. // Mendeleev Communication. 2012. V. 22. № 1. P. 23.
Suwaiyan A., Morsy M.A., Odah K.A. // Chemical Physics Letters. 1995. V. 237. P. 349.
Султанбаев М.В., Остахов С.С., Ганцев Ш.Х., Халиуллин Ф.А., Казаков В.П. // Химия высоких энергий. 2010. Т. 44. № 5. С. 415.
Ostakhov S.S., Ovchinnikov M.Y., Masyagutova G.A., Khursan S.L. // J. Physical Chemistry A. 2019. V. 123(37). P. 7956.
Паркер С. Фотолюминесценция растворов. М.: Мир, 1972. 510 с.
Tatischeff I., Klein R. // Photochem. photobiol. 1975. V. 22. № 6. P. 221.
Буранбаева Р.С., Лобов А.Н., Грабовский С.П., Иванов С.П. // Вестник Башкирского университета. 2017. Т. 22. № 1. С. 48.
Jiménez-Halla J.O.C., Matito E., Robles J., Sola M. // J. Organometallic Chemistry. 2006. V. 691. № 21. P. 4359.
Stanger A. // The J. Org. Chem. 2005. V. 71. № 3. P. 883.
Schleyer P.R., Jiao H. // Pure Appl. Chem. 1996. V. 68. № 2. P. 209.
Красовицкий Б.М., Болотин Б.М. Органические люминофоры. М.: Химия, 1984. 336 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий