Химия высоких энергий, 2022, T. 56, № 3, стр. 193-198
Радиационно-индуцированная дегидратация и деструкция пропандиола-1,2 и бутандиолов-1,2; -2,3 в деаэрированных водных растворах
О. В. Урбанович a, b, *, А. И. Давыденко a, Е. А. Пантелеева a, Р. Л. Свердлов a, О. И. Шадыро a, b
a Белорусский государственный университет
220030 Минск, пр. Независимости, 4, Республика Беларусь
b Научно-исследовательский институт физико-химических проблем Белорусского государственного университета
220006 Минск, ул. Ленинградская, 14, Республика Беларусь
* E-mail: olga.urbanovich@gmail.com
Поступила в редакцию 05.11.2021
После доработки 10.01.2022
Принята к публикации 14.01.2022
- EDN: BILPSY
- DOI: 10.31857/S0023119322030123
Аннотация
С‒С-связи исходного диола. Были даны объяснения наблюдаемых эффектов и важности учета полученных результатов для изучения механизмов протекания свободнорадикальных реакций фрагментации гидроксилсодержащих биомолекул, индуцируемых ионизирующим излучением.
ВВЕДЕНИЕ
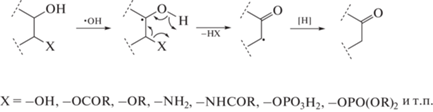
Многолетние исследования радиационно-индуцированных превращений гидроксилсодержащих органических веществ, проводимые на кафедре радиационной химии и химико-фармацевтических технологий химического факультета БГУ и в Лаборатории химии свободнорадикальных процессов НИИ ФХП БГУ, позволили установить, что отличительной особенностью свободнорадикальных превращений таких веществ является возможность реализации свободнорадикальной фрагментации по схеме (1) :
Свободнорадикальная фрагментация приводит к повреждению бифункциональных органических соединений [1], гидроксилсодержащих глицерофосфолипидов [2–4], сфинголипидов [3, 5], гликолипидов [6, 7], а также углеводов [8, 9], аминокислот и их производных [10, 11]. В результате происходит не только превращение исходных биомолекул, но и образование токсичных и физиологически активных продуктов [3, 4, 6, 7, 9, 12]. Реакции типа (1) могут быть источником продуктов, негативно влияющих на функционирование организма при его облучении или воздействии других стресс-факторов. Вышесказанное предопределяет значительный интерес к изучению деталей реакций типа (1).
В последние годы появились факты, указывающие на влияние мощности дозы действующего излучения на радиационно-химические выходы продуктов радиолиза α-диолов в водных растворах. В работах [13, 14] была показана возможность протекания цепной фрагментации пропандиола-1,2 в деаэрированных водных растворах, хотя в более ранних работах [1, 15, 16] для аналогичной исходной концентрации вещества при более высокой (приблизительно в 10 раз) мощности поглощенной дозы ионизирующего излучения, используемого для инициирования свободнорадикальных реакций, цепные процессы не наблюдались.
Целью настоящей работы является установление взаимосвязи между структурой α-диолов и возможностью реализации цепного процесса их фрагментации. Предметами исследования были пропандиол-1,2 (ПД-1,2), бутандиол-1,2 (БД-1,2) и бутандиол-2,3 (БД-2,3), которые отличаются терминальным (ПД-1,2 и БД-1,2) и медиальным (БД-2,3) расположением гидроксильных групп.
МЕТОДИКА ЭКСПЕРИМЕНТА
В работе без предварительной очистки использовали пропандиол-1,2 (99.5%, Aldrich), бутандиол-1,2 (98%, Aldrich) и бутандиол-2,3 (98%, Aldrich), ацетон (99.9%, AppliChem), метилэтилкетон (95%, Sigma-Aldrich), пропаналь (98%, Fluka), водный раствор формальдегида ω = 37% (содержащий 10–15% метанола в качестве стабилизатора) фирмы Sigma-Aldrich, ацетальдегид и бутаналь (99.5%, Sigma-Aldrich), дигидрофосфат калия (99%, Sigma Life Sciences) и гидрофосфат натрия (99%, Sigma-Aldrich), 2,4-динитрофенилгидразин (ДНФГ) фирмы Sigma-Aldrich перед использованием подвергали перекристаллизации из ацетонитрила [17]. Для приготовления водных растворов исследуемых соединений и используемых реактивов применялась свежеприготовленная деионизованная вода (Heal Force Smart Mini Water purification system, Shanghai, China) (электропроводность воды 0.055 мкСм/см). Водные растворы исследуемых веществ, а также стандартные растворы готовились весовым методом и методом последовательного разбавления.
Для приготовления исследуемых растворов ПД‑1,2, БД-1,2 и БД-2,3 с концентрацией 1 моль/л и 0.1 моль/л вещества растворяли в 50 мМ фосфатном буфере (рН 7.0 ± 0.1). Величину рН контролировали на рН-метре HannaHI 9321.
Далее растворы помещали в стеклянные ампулы. Деаэрирование проводили барботированием аргоном (объемная доля Ar не менее 99.993%) в течение 60 мин, после чего ампулы запаивали.
Приготовленные растворы облучали на установке MPX-γ-25М (γ-излучением изотопа 60Cо). Мощность поглощенной дозы составляла 0.086 ± ± 0.007 Гр/с, интервал поглощенных доз 0.10‒0.62 кГр. Для определения мощности поглощенной дозы использовался дозиметр Фрикке (G(Fe3+) = 15.5 ионов/100эВ) [18].
Для анализа карбонильных продуктов радиационно-химических превращений ПД-1,2 использовали дериватизирующий раствор ДНФГ (0.03 г ДНФГ, 6.2 мл 36% HCl, доведенный до 100 мл метанолом). Растворы исследуемых веществ после облучения и стандартные растворы смешивали с раствором ДНФГ в соотношении 1 : 1 в виалах, далее их оставляли для протекания реакции на 15 мин в защищенном от света месте, после чего проводили хроматографический анализ.
Качественный и количественный анализ образующихся ацетона, пропионового альдегида, ацетальдегида и формальдегида проводили методом высокоэффективной жидкостной хроматографии на хроматографе “Shimadzu” (Япония) с использованием детектора на диодной матрице SPD-M20A при длине волны 365 нм. Условия хроматографирования: колонка Shim-pack VP-ODS (длина – 150 мм, внутренний диаметр – 4.6 мм, размер зерен – 4.6 мкм); элюент – ацетонитрил:вода (1 : 1 об./об.); скорость потока элюента 0.8 мл/мин; температура термостата колонки 40°С; объем вводимой пробы 1 мкл.
Продукты радиационно-химических превращений БД-1,2 (метилэтилкетон, бутаналь, пропаналь) и БД-2,3 (метилэтилкетон, ацетальдегид) определяли на газовом хроматографе GC-2010 (Shimadzu, Япония), оснащенном пламенно-ионизационным детектором, колонкой RT Q-BOND (30 м, 0.32 мм внутренний диаметр, 10 мкм толщина пленки неподвижной фазы). Качественный и количественный анализ проводили с использованием внешних стандартов.
Для проведения анализа продуктов превращений БД-1,2 на хроматографе GC-2010 использовали следующие параметры: начальная температура 100°С, скорость подъема до 180°С – 5°С/мин, до 250°С – 10°С/мин, температура инжектора 250°С; температура детектора 250°С; газ-носитель – гелий; детектор – пламенно-ионизационный; объем задаваемой пробы – 1 мкл.
Для проведения анализа продуктов превращений БД-2,3 на хроматографе GC-2010 использовали следующие параметры: начальная температура 60°С, скорость подъема до 250°С – 10°С/мин, температура инжектора 250°С; температура детектора 250°С; газ-носитель – гелий; детектор – пламенно-ионизационный; объем задаваемой пробы – 1 мкл.
Радиационно-химические (G, молекула/100эВ) выходы образования продуктов реакций рассчитывали на линейных участках зависимости концентраций веществ от поглощенной дозы. Статистическую обработку результатов эксперимента и расчет значения ошибки определения радиационно-химических выходов проводили в программе Origin 8.1 Pro методом наименьших квадратов с использованием коэффициента доверительной вероятности 0.95. Для расчета величин радиационно-химических выходов использовали результаты не менее трех независимых экспериментов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученные в работе значения радиационно-химических выходов продуктов радиолиза изученных α-диолов в деаэрированных водных растворах с концентрацией 1 и 0.1 моль/л приведены в табл. 1. Из данных следует, что основным типом радиолитических превращений изучаемых веществ является их дегидратация. Кроме этого происходит образование продуктов деструкции исходных веществ по С‒С-связи между двумя гидроксильными группами.
Таблица 1.
Выходы продуктов радиационно-индуцированных превращений пропандиола-1,2, бутандиола-1,2 и бутандиола-2,3 в деаэрированных водных растворах при рН 7
| Тестируемое соединение | Продукты радиолиза | G (продукта), молекула/100 эВ | |
|---|---|---|---|
| Концентрация α-диолов | |||
| 1 моль/л | 0.1 моль/л | ||
| Пропандиол-1,2 | Ацетон Пропионовый альдегид Ацетальдегид Формальдегид |
14.43 ± 1.31 1.26 ± 0.09 0.64 ± 0.06 0.37 ± 0.02 |
7.87 ± 0.21 0.77 ± 0.02 0.47 ± 0.04 0.33 ± 0.04 |
| Бутандиол-1,2 | Метилэтилкетон Масляный альдегид Пропионовый альдегид Формальдегид |
9.07 ± 0.35 0.99 ± 0.09 0.45 ± 0.07 0.29 ± 0.03 |
3.52 ± 0.20 0.92 ± 0.06 0.34 ± 0.08 0.16 ± 0.03 |
| Бутандиол-2,3 | Метилэтилкетон Ацетальдегид |
1.77 ± 0.13 1.95 ± 0.31 |
1.07 ± 0.06 0.80 ± 0.21 |
Величины радиационно-химических выходов ацетона и метилэтилкетона (табл. 1), рассчитанные для экспериментов с ПД-1,2 и БД-1,2 в 1 М растворах соответственно, указывают на короткоцепной механизм их образования, так как их выходы значительно превосходят суммарный радиационно-химический выход ОН- и Н-радикалов (~3.25 частиц/100 эВ [19]), которые являются инициаторами свободнорадикальных реакций органических соединений в условиях эксперимента. В отличие от ПД-1,2 и БД-1,2 при радиолизе 1 М раствора БД-2,3 радиационно-химический выход продукта дегидратации оказался почти в 2 раза ниже суммарного выхода ОН- и Н-радикалов (табл. 1). Это указывает на отличия в процессах радиационно-химической дегидратации ПД‑1,2, БД-1,2 и БД-2,3. Учитывая структуру молекул α-диолов, можно предположить, что наблюдаемые различия обусловлены положением вицинальных гидроксильных групп в их структуре. При терминальном положении вицинальных гидроксильных групп в структуре ПД-1,2 и БД-1,2 цепной процесс дегидратации реализуется, но при их смещении в медиальное положение, как в структуре БД-2,3, этого не происходит.
Снижение выходов продуктов дегидратации при переходе от ПД-1,2 к БД-1,2 (табл. 1) может быть связано с появлением дополнительного метиленового звена в структуре БД-1,2 по сравнению с ПД-1,2, что создает конкуренцию основному процессу образования α-гидроксилсодержащих углерод-центрированных радикалов из исходных соединений.
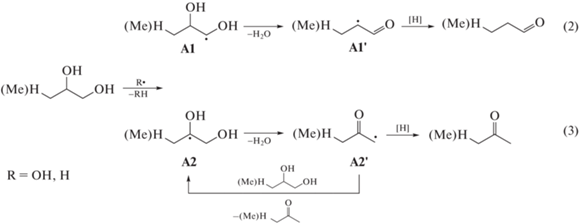
При облучении водных растворов α-диолов с терминальным расположением гидроксильных групп происходит образование двух различных продуктов дегидратации: ацетона и пропионового альдегида для ПД-1,2, метилэтилкетона (МЭК) и масляного альдегида для БД-1,2, радиационно-химические выходы которых существенно отличаются (табл. 1). Такие отличия в выходах продуктов дегидратации обусловлены строением и реакционной способностью исходных молекул и промежуточных радикальных частиц. При радиолизе ПД-1,2 и БД-1,2 образуются два α-гидроксилсодержащих углерод-центрированных радикала А1 и А2 по схемам (2) и (3) соответственно, дальнейшие превращения которых дают продукты дегидратации исходных соединений. Из образующихся радикалов А1' и А2' последние более реакционноспособны и с большей вероятностью вступают в реакции продолжения цепи, обеспечивая преимущественное образование ацетона и МЭК.
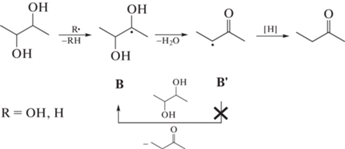
Для БД-2,3, который имеет симметричную структуру, характерно образование только одного продукта дегидратации – МЭК из радикала B по схеме (4) . Радиационно-химический выход продукта дегидратации не превышает суммарного выхода инициаторов свободнорадикальных реакций (табл. 1), что, по-видимому, обусловлено медиальным расположением гидроксильных групп в молекуле. В результате дегидратации радикала В образуется вторичный радикал B', который, в отличие от радикалов А2', менее склонен к отрыву атома водорода от исходной молекулы с образованием радикала В, и цепной процесс фрагментации не реализуется.
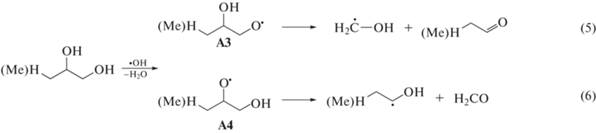
Кроме дегидратации при радиолизе α-диолов происходит деструкция исходных веществ по С‒С-связи, которая протекает через стадию образования О-центрированных радикалов [1] (табл. 1). По схемам (5) и (6) радикалы А3 и А4 подвергаются деструкции с образованием ацетальдегида и формальдегида при радиолизе пропандиола-1,2, пропионового альдегида и формальдегида при радиолизе бутандиола-1,2.
Относительно невысокие радиационно-химические выходы продуктов деструкции α-диолов (табл. 1) связаны с меньшей вероятностью образования неустойчивых кислород-центрированных радикалов при взаимодействии исходных молекул с ОН-радикалами.
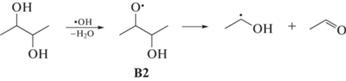
При радиолизе бутандиола-2,3 превращение кислород-центрированного радикала В2 по схеме (7) приводит к образованию ацетальдегида и α‑гидроксиэтильных радикалов:
Для растворов, содержащих БД-2,3, характерно образование продукта деструкции С‒С-связи с большим радиационно-химическим выходом, чем для растворов ПД-1,2 и БД-1,2 (табл. 1). Наблюдаемое различие может быть обусловлено дополнительным образованием ацетальдегида за счет диспропорционирования α-гидроксиэтильных радикалов.
Исходя из данных табл. 1, можно заключить, что при переходе к 0.1 моль/л растворам исследуемых α-диолов наблюдаются схожие описанным для 1 моль/л растворов закономерности образования продуктов радиационно-химических превращений. Для ПД-1,2 и БД-1,2 наблюдаются выходы основных продуктов дегидратации, указывающие на короткоцепной механизм их образования. Снижение выхода ацетона и метилэтилкетона более чем в 2 раза в сравнении с наблюдаемым для 1 моль/л растворов диолов обусловлено снижением скорости реакции передачи цепи радикалами А1' и A2' за счет 10-кратного уменьшения концентрации ПД-1,2 и БД-1,2.
Для 0.1 М растворов БД-2,3 также наблюдается уменьшение радиационно-химических выходов продуктов радиолиза по сравнению с 1 моль/л раствором. Величины радиационно-химических выходов метилэтилкетона и ацетальдегида, как и в случае 1 моль/л растворов, указывают на отсутствие цепных процессов их образования.
ЗАКЛЮЧЕНИЕ
В рамках работы были исследованы закономерности протекания радиационно-индуцированных превращений α-диолов в деаэрированных водных растворах при рН 7, определены состав и радиационно-химические выходы продуктов их превращений.
Было установлено, что в ходе радиационно-химических превращений пропандиола-1,2, бутандиола-1,2 и бутандиола-2,3 образуются основные продукты дегидратации (ацетон и метилэтилкетон), минорные продукты дегидратации (пропионовый и масляный альдегиды) и продукты деструкции С‒С-связей (формальдегид, ацетальдегид и пропионовый альдегид), были рассчитаны их радиационно-химические выходы.
Полученные значения радиационно-химических выходов продуктов превращений изучаемых соединений позволяют заключить, что α-диолы с терминальным расположением гидроксильных групп (пропандиол-1,2 и бутандиол-1,2) подвергаются свободнорадикальной фрагментации по цепному механизму. Ключевую роль в продолжении цепи выполняют реакционноспособные терминальные углерод-центрированные радикалы. В случае бутандиола-2,3 аналогичный механизм дегидратации не протекает из-за образования более устойчивого вторичного углерод-центрированного радикала.
Полученные результаты важны для изучения механизмов протекания свободнорадикальных превращений гидроксилсодержащих биомолекул, индуцируемых как ионизирующим излучением, так и другими инициаторами гомолитических процессов.
Список литературы
Петряев Е.П., Шадыро О.И. Радиационная химия бифункциональных органических соединений. Минск: Университетское, 1986. 166 с.
Yurkova I.L., Shadyro O.I., Kisel M.A. et al. // Chem. Phys. Lipids. 2004. V. 132. № 2. P. 235.
Shadyro O., Lisovskaya A. // Chem. Phys. Lipids. 2019. V. 221. P. 176.
Shadyro O., Samovich S., Edimecheva I. // Free Radic. Biol. Med. 2019. V. 144. P. 6.
Yurkova I.L. // Russian Chemical Reviews. 2012. V. 81. P. 175.
Shadyro O.I., Yurkova I.L., Kisel M.A. et al. // Free Rad. Biol. Med. 2004. V. 36. № 12. P. 1612.
Yurkova I., Kisel M., Arnhold J. et al. // Chem. Phys. Lipids. 2005. V. 134. № 1. P. 41.
Shadyro O.I., Kisel R.M. // High Energ. Chem. 2007. V. 41. № 5. P. 318.
Edimecheva I.P., Kisel R.M., Shadyro O.I. et al. // J. Radiat. Res. 2005. V. 46. P. 319.
Sladkova A.A., Sosnovskaya A.A., Edimecheva I.P. et al. // Radiat. Phys. Chem. 2012. V. 81. № 12. P. 1896.
Sladkova A.A., Lisovskaya A.G., Sosnovskaya A.A. et al. // Radiat. Phys. Chem. 2014. V. 96. P. 229.
Yurkova I., Kisel M., Arnhold J. et al. // Chem. Phys. Lipids. 2005. V. 137. № 1–2. P. 29.
Nepachalovich P.S., Shadyro O.I., Bekish A.V. et al. // Free Radic. Res. 2020. V. 54. № 10. P. 732.
Jiang D., Barata-Vallejo S., Golding B.T. et al. // Org. Biomol. Chem. 2012. V. 10. P. 1102.
Петряев Е.П., Шадыро О.И., Кулинкович О.Г. // Журн. орган. химии. 1978. Т. 14. № 5. С. 920.
Петряев Е.П., Ветров B.C., Грушевич Л.E. и др. // Вестн. БГУ. Сер. 2. 1971. № 2. С. 6.
Armarego W.L.F., Chai. C. Purification of Laboratory Chemicals (Sixth Edition). USA: Butterworth-Heinemann, 2009. P. 752.
Fricke H., Hart E.J. Chemical dosimetry. N.Y.: Academic press, 1966. P. 167.
Пикаев А.К. Современная радиационная химия. Радиолиз газов и жидкостей / А.К. Пикаев; под ред. Спицына В.И. М.: Наука, 1986. 439 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий