Химия высоких энергий, 2022, T. 56, № 3, стр. 186-192
(Мет)акрилатсодержащие фотоинициаторы свободно-радикальной полимеризации на основе пространственно-экранированных О-бензохинонов
Э. Р. Жиганшина a, *, В. С. Лысенков a, Т. И. Лопатина a, М. В. Арсеньев a, С. А. Чесноков a
a Федеральное государственное бюджетное учреждение науки Институт металлоорганической химии
им. Г.А. Разуваева Российской академии наук
603950 Нижний Новгород, ул. Тропинина, 49, Россия
* E-mail: zhiganshinae@mail.ru
Поступила в редакцию 28.12.2021
После доработки 10.01.2022
Принята к публикации 14.01.2022
- EDN: QRRTKB
- DOI: 10.31857/S0023119322030135
Аннотация
Синтезированы новые мономеры-инициаторы, производные 3,5-ди-трет-бутил-о-бензохинона, содержащие фрагменты 2-гидроксиэтилметакрилата (МЭГ) и пентаэритритол триакрилата (ПЭТА). Исследована активность новых о-хинонов (соинициатор N,N-диметилциклогексиламин) в реакции фотоинициирования полимеризации олигокарбонатдиметакрилата ОКМ-2 под действием видимого излучения. Изучена термическая стабильность полученных полимеров. Сополимеризацией синтезированных о-хинонов с МЭГ и ПЭТА (инициатор динитрил азоизомасляной кислоты, 80°С) получены полимеры и оценена миграция из них о-хинонов.
ВВЕДЕНИЕ
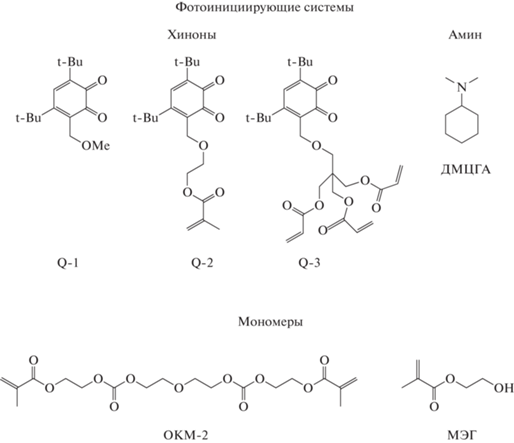
Реакция радикальной фотополимеризации широко используется в современной промышленности при фотоотверждении красок [1], покрытий и адгезивов [2, 3], в медицине [4, 5], стереолитографическом синтезе 3D-объектов [6–8], оптоэлектронике [9], создании матриц для тканевой инженерии [10, 11] и др. В основе этих процессов лежит использование инициирующих систем, генерирующих под действием излучения свободные радикалы. Помимо них, в результате фотопревращения инициатора образуются продукты, способные мигрировать из сшитых полимерных матриц, вызывая пожелтение и специфический запах полимера. Вариант решения проблемы – создание полимеризационноспособных фотоинициаторов, которые могут не только генерировать инициирующие свободные радикалы, но также сополимеризоваться с мономерами в составе фотополимеризующейся композиции (ФПК). Известны полимеризационноспособные карбонилсодержащие фотоинициаторы II типа на основе тиоксантона [12, 13] и бензофенона [14, 15]. Однако они чувствительны в УФ (тиоксантон и бензофенон), что ограничивает применение разнообразных источников инициирующего излучения. В то же время такие фотоинициаторы II типа, как о-бензохиноны, инициируют полимеризацию под действием видимого света от 400 до 650 нм, что открывает возможность фотоотверждения “толстых” слоев композиции [16]. Наиболее изучены 3,5- и 3,6-ди-трет-бутил-о-бензохиноны. Ранее из 3,6-ди-трет-бутил-о-бензохинона и 2-гидроксиэтилметакрилата (МЭГ) был получен метакрилатсодержащий о-бензохинон [17]. Однако он не эффективен как инициатор фотополимеризации [18]. Другой вариант триалкилзамещенных о-бензохинонов – это производные 3,5-ди-трет-бутил-6-(метоксиметил)-о-бензо-хинона [19–21]. Такие о-бензохиноны совместно с третичными аминами эффективно инициируют фотополимеризацию диметакрилата триэтиленгликоля [16]. В настоящей работе синтезированы новые (мет)акрилсодержащие о-бензохиноны, содержащие фрагменты пентаэритритол триакрилата (ПЭТА) и МЭГ. Исследована их реакционная способность в реакции фотовосстановления и в фотоинициировании полимеризации олигокарбонатадиметакрилата ОКМ-2. Определены температуры разложения синтезированных полимеров. Проведены сравнительные исследования миграции новых (мет)акрилатсодержащих о-бензохинонов и 3,5-ди-трет-бутил-6-(метоксиметил)-о-бензохинона из полимерных матриц. Структурные формулы используемых в работе соединений и их обозначения приведены на схеме 1 .
Схема 1
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты: 3,5-ди-трет-бутил-6-(метоксиметил)пирокатехин (1) и 3,5-ди-трет-бутил-6-(метоксиметил)-о-бензохинон (Q-1) синтезированы по описанной в [19] методике. N,N-диметилциклогексиламин (ДМЦГА) (“Aldrich”) и изопропиловый спирт использовали без дополнительной очистки. Диметакрилат α,α-бис-(метакрилоксиэтиленкарбонат)-диэтиленгликоль – OКМ-2 (ООО “Корунд”, Россия) и 2-гидроксиэтилметакрилат (МЭГ) (“Aldrich”) использовали без дополнительной очистки. Динитрил азоизомасляной кислоты (ДАК) (“Реахим”) и толуол очищали по стандартным методикам [22].
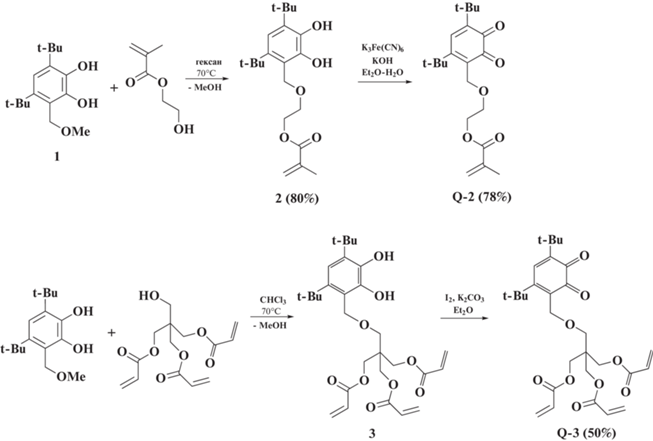
2-((4,6-ди-трет-бутил-2,3-дигидроксибензил)-этил метакрилат (2). МЭГ (0.50 г, 3.9 ммоль) и 3,5-ди-трет-бутил-6-метоксиметилпирокатехин 1 (1.06 г, 3.9 ммоль) растворяли в н-гексане (15 мл) и кипятили с обратным холодильником в течение 24 ч с постепенным упариванием смеси до 5 мл. Затем реакционную смесь охлаждали и полностью удаляли растворитель. Неочищенный продукт перекристаллизовывали из н-гексана и выделяли в виде белого кристаллического порошка. Выход: 1.16 г (80%). Тпл = 135–137°С. Рассчитано для С21H32O5: С, 69.20; Н, 8.85. Найдено: С, 69.15; Н, 8.87. 1Н (300 MГц, DMSO, δ, м.д.): 1.29 (c, 9H, t-Bu), 1.32 (c, 9H, t-Bu), 1.84 (c, 3H, ‒CH3), 3.74 (т, 2H, –CH2–, J = 8.8 Гц), 4.22 (т, 2H, –CH2–, J = 8.8 Гц), 4.68 (с, 2Н, CH2O), 5.65 (c, 1H, CH2=), 6.00 (c, 1H, CH2=), 6.71 (c, 1H, Car-H), 7.79 (c, 1H, OH), 7.95 (c, 1H, OH). 13C (75 MГц, DMSO, δ, м.д.): 18.41, 29.91, 32.77, 35.02, 35.66, 64.27, 66.00, 68.36, 115.08, 122.08, 126.27, 134.90, 136.24, 138.74, 143.15, 146.14, 173.00. ИК-спектр (вазелиновое масло), ν/см-1: 1020,1096, 1295 (С–O), 1621, 1640, 3393, 3497 (OH).
2-((2,4-ди-трет-бутил-5,6-диоксоциклогекса-1,3-диен-1-ил)метокси)этил метакрилат (Q-2). К раствору пирокатехина 2 (1.16 г, 3.2 ммоль) в Et2O (40 мл) при интенсивном перемешивании добавляли раствор K3Fe(CN)6 (5.26 г, 16 ммоль) и KOH (0.36 г, 6.4 ммоль) в воде (80 мл). Реакционную смесь активно перемешивали в течение 45 мин при комнатной температуре. После этого смесь промывали водой (3×80 мл) и экстракт сушили над безводным сульфатом натрия. Растворитель упаривали и остаток о-бензохинона перекристаллизовали из н-гексана (20 мл). Выход 1.10 г (78%). Тпл = 118–120°С. Рассчитано для С21H30O5: С, 69.59; Н, 8.34. Найдено: С, 69.61; Н, 8.31. 1Н (400 MГц, СDCl3, δ, м.д.): 1.24 (c, 9H, t-Bu), 1.38 (c, 9H, t-Bu), 1.93 (c, 3H, –CH3), 3.73 (т, 2H, –CH2–, J = 8.8 Гц), 4.29 (т, 2H, –CH2–, J = 8.8 Гц), 4.48 (с, 2Н, CH2O), 5.65 (c, 1H, CH2=), 6.12 (c, 1H, CH2=), 7.08 (c, 1H, Car–H). 13C (100 MГц, СDCl3, δ, м.д.): 18.30, 29.09, 30.00, 35.43, 38.71, 62.55, 63.78, 68.72, 125.75, 132.17, 136.13, 137.08, 148.75, 159.96, 167.28, 179.42, 182.26. ИК-спектр (вазелиновое масло), ν/см–1: 1098, 1231, 1617, 1657, 1746 (С=О и С=С).
2-(((4,6-ди-трет-бутил-2,3-дигидроксибензил)окси)метил)пропан-1,2,3-триил триакрилат (3). ПЕТА (1.18 г, 3.9 ммоль) и соединение 1 (1.06 г, 3.9 ммоль) растворяли в хлороформе (15 мл) и кипятили с обратным холодильником в течение 24 ч с постепенным упариванием смеси до 5 мл. Затем реакционную смесь охлаждали и полностью удаляли растворитель. Неочищенный продукт 3 без выделения использовали для дальнейшей реакции окисления.
2-(((2,4-ди-трет-бутил-5,6-диоксоциклогекса-1,3-диен-1-ил)метокси)метил)пропан-1,2,3-триил триакрилат (Q-3). К раствору 3 (1.16 г, 2.2 ммоль) в Et2O (40 мл) при интенсивном перемешивании добавляли K2CO3 (1.52 г, 11 ммоль), а затем гранулы I2 (0.55 г, 2.2 ммоль). Реакционную смесь активно перемешивали в течение 12 ч при комнатной температуре. Выпавший белый осадок минеральных солей отфильтровывали. Эфирный раствор образовавшегося продукта упаривали. Хинон Q-3 выделяли колоночной хроматографией (элюент толуол : ацетон = 30 : 1) в виде темно-красного масла. Выход: 0.58 г (50%). Рассчитано для С28H36O9: С, 65.10; Н, 7.02. Найдено: С, 65.08; Н, 7.10. 1Н (400 MГц, СDCl3, δ, м.д.): 1.21 (c, 9H, t-Bu), 1.37 (c, 9H, t-Bu), 3.32 (c, 2H, –OCH2), 4.15 (c, 6H, ‒CH2–), 4.38 (c, 2H, –CH2O–), 5.84 (м, 6Н, CH2=, J = 6.5 Гц), 6.09 (м, 3H, CH=, J = 6.5 Гц), 7.06 (c, 1H, Car−H). 13C (100 MГц, СDCl3, δ, м.д.): 29.06, 29.99, 36.36, 40.89, 42.19, 62.63, 64.12, 66.29, 127.95, 131.27, 137.21, 148.45, 159.53, 165.48, 179.49, 182.34.
Спектрофотометрические исследования проводили на спектрофотометре СФ-56 (“ЛОМО”, Россия). Кинетику фотовосстановления о-бензохинонов в присутствии ДМЦГА исследовали по методике, описанной в [16]. Кинетику фотополимеризации ОКМ-2 исследовали термографическим методом, как описано в [16]. Источник света лампа КГМ-24-250 с фокусирующим устройством. Освещенность в области измерительной ячейки установки 40 кЛк.
Для исследования миграционных свойств о‑бензохинонов, готовили композиции растворением 0.1 М о-бензохинона, 30 мМ ДАК в смеси ОКМ-2 с МЭГ в массовом соотношении 1 : 1. Композицию помещали в полость формы, образованной двумя силикатными стеклами с демпферирующей прокладкой между ними толщиной 1 мм и грели при 80°С в течение 6 ч. Затем из формы извлекали образец, размельчали его на частицы размером менее 300 мкм и экстрагировали 1 г полимера 20 мл изопропилового спирта при комнатной температуре. В заданный момент времени регистрировали спектр поглощения раствора и по значению максимума оптической плотности (~400 нм) определяли содержание фотоинициатора в экстракте.
Термогравиметрический анализ (ТГА) выполняли на установке синхронного термического анализа TGA/DSC3+METTLER TOLEDO; скорость нагрева 5°C/мин от 30 до 500°C; азот, скорость потока 50 мл/мин.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По реакции трансэтерификации 3,5-ди-трет-бутил-6-метоксиметилпирокатехина 1 с гидроксилсодержащими мономерами ПЭТА и МЭГ синтезированы новые катехол(мет)акрилаты 2 и 3, соответственно. Окислением пирокатехинов 2 и 3 получены о-хиноны Q-2 и Q-3 (Схема 2 ). Строение полученных соединений подтверждено данными ЯМР, ИК, УФ-спектроскопий.
Схема 2
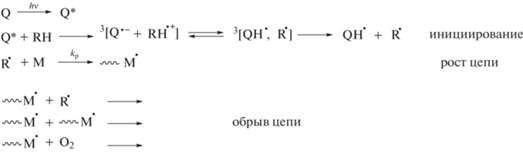
В электронных спектрах поглощения о-хинонов Q-1–Q-3 в видимой области наблюдаются две полосы, соответствующие S (π → π*) и S (n → →π*) электронным переходам карбонильных групп. Спектральные характеристики о-бензохинонов Q-2 и Q-3 мало отличаются от Q-1 (табл. 1). Облучение толуольных растворов Q-1−Q-3 светом λ > > 475 нм в присутствии ДМЦГА приводит к их обесцвечиванию, что говорит о протекании реакции фотовосстановления хинонов (Схема 3 ) [23]. Реакция фотовосстановления о-хинонов заключается в фотопереносе атома водорода с молекулы амина на фотовозбужденную молекулу хинона и значительно замедляется в присутствии кислорода. Из данных табл. 1 видно, что и в аргоне, и на воздухе пара Q-3–ДМЦГА является более реакционноспособной. Сопоставление величин эффективной константы скорости фотовосстановления хинонов (kН) в атмосфере аргона и на воздухе показывает, что увеличение объема заместителей при хиноновом фрагменте приводит к уменьшению влияния кислорода на скорость реакции.
Таблица 1.
Спектральные характеристики о-хинонов Q-1–Q-3а и величины kН о-хинонов Q-1–Q-3 в присутствии ДМЦГА в инертной атмосфере и на воздухеб [Q] = 0.42 мМ, [ДМЦГА] = 2.1 мМ, Лампа КГМ-24-150, I = = 13 кЛк
| Хинон | λmax, нм (ε, моль–1 л см–1) π → π* |
λmax, нм n → π* |
Q–DMCHA | kН ×103, с–1 | kH(Ar)/kH(возд) | |
|---|---|---|---|---|---|---|
| Ar | воздух | |||||
| Q-1 | 403 (2150) | 581 | Q-1 | 0.76 | 0.58 | 1.30 |
| Q-2 | 404 (2180) | 584 | Q-2 | 0.45 | 0.34 | 1.18 |
| Q-3 | 404 (1900) | 582 | Q-3 | 0.94 | 0.78 | 1.20 |
Схема 3
В результате реакции фотовосстановления образуются радикальные продукты, способные инициировать фотополимеризацию (радикал R·, Схема 3 ). В табл. 2 представлены величины кинетических параметров полимеризации ОКМ-2 в присутствии системы о-бензохинон (Q-1–Q-3)–ДМЦГА. Видно, что введение (мет)акрилатных фрагментов в структуру 3,5-ди-трет-бутил-о-бензохинона существенно уменьшает влияние кислорода на кинетику протекания полимеризации (значения W0 и W/[M]max).
Таблица 2.
Значения начальной (W0) и максимальной приведенной (W/[M]max) скоростей, периода индукции (Тинд) и конверсии за 30 мин (Р) при фотополимеризации ОКМ-2 в присутствии о-бензохинонов Q-1–Q-3 паре с ДМЦГА [Q] = 3.78 мМ, [ДМЦГА] = 0.1 М. Лампа КГМ-24-150, I = 40 кЛк
| Обозначение ФПК | Q–ДМЦГА-ОКМ-2 | Условия | Тинд, с | W0, с–1 | W/[M]max×103, с–1 | P, % |
|---|---|---|---|---|---|---|
| П1 | Q-1 | Вакуум Воздух |
28 43 |
0.042 0.019 |
1.96 1.71 |
80 73 |
| П2 | Q-2 | Вакуум Воздух |
26 45 |
0.040 0.037 |
1.77 1.75 |
82 79 |
| П3 | Q-3 | Вакуум Воздух |
26 43 |
0.040 0.031 |
1.81 1.80 |
76 71 |
Термическая стабильность полимерных образцов П1−П3 оценивали методом ТГА в атмосфере азота. На рис. 1 представлены термограммы для исследуемых полимеров.
Рис. 1.
Термогравиметрические кривые разложения фотополимеров: 1 – без хинона, 2 – П1, 3 – П2, 4 – П3.
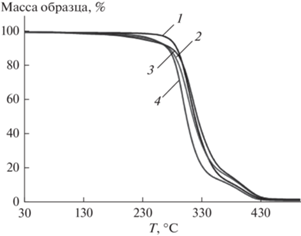
Для образцов П1–П3 на основе ОКМ-2 наблюдается двухступенчатое термическое разложение в интервале температур 30–500°C. Начальная температура разложения может быть связана с разрушением C–C-связей боковых цепей в сетчатом полимере. Вторая ступень является результатом деградации жестких сегментов основных цепей, формирующих сетчатую структуру полимера [24]. Введение в состав ФПК о-хинонов Q-1–Q-3, в целом, не оказывает влияния на ход термогравиметрических кривых (рис. 1) и, соответственно, на параметры ТГА, представленные в табл. 3. Однако, Т5% для П1–П3 ниже на 25–30°C, чем для безхинонового полиОКМ-2. Это может быть связано с наличием олигомерных цепей, температура разложения С–С-связей которых ниже по сравнению с их высокомолекулярными аналогами. Такие цепи образуются в результате реакции обрыва растущих макрорадикалов феноксильными радикалами в ходе процесса фотополимеризации. Наличие (мет)акрилатных групп у о-хинонов Q-2 и Q-3 не повлияло на величину Тн образцов П2 и П3 из-за низкой концентрации фотоинициатора.
Таблица 3.
Параметры термогравиметрических кривых для исследуемых полимерных образцов Тн и Тк – температуры начала и окончания разложения полимера, Т5% и Т50% – температуры при потере массы полимера на 5 и 50% соответственно
| Обозначение | Тн, °С | Тк, °С | Т5%, °С | Т50%, °С |
|---|---|---|---|---|
| полиОКМ-2 | 280 | 430 | 277 | 315 |
| П1 | 282 | 425 | 248 | 315 |
| П2 | 287 | 427 | 239 | 320 |
| П3 | 277 | 421 | 250 | 303 |
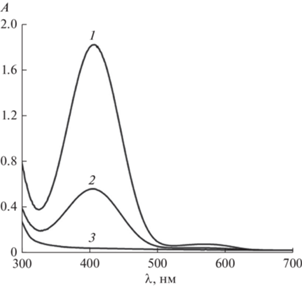
Введение в структуру молекулы фотоинициатора одного или трeх (мет)акрилатных фрагментов приводит к возможности его встраивания в полимерную цепь и уменьшению вымывания из конечного полимера. Это было подтверждено в эксперименте по оценке вымывания хиноновых фрагментов из полимера, полученного термической полимеризацией смеси ОКМ-2 : МЭГ в соотношении 1 : 1 в течение 20 дней (добавка монометакрилата МЭГ приводит к уменьшению числа сшивок и облегчает миграцию невстроившихся хиноновых фрагментов) (табл. 4). На рис. 2 показаны спектры поглощения экстрактов после выдерживания в них образцов в течение 20 дней. Видно, что концентрация Q-1 в экстракте из полимера (рис. 2, спектр 1) в 6 и 4.7 раза выше, чем в экстрактах из образцов на основе Q-2 и Q-3 (рис. 2, спектры 2 и 3) соответственно. Вымывание Q-2 составляет 9% за 20 дней вымачивания, в то время как вымывание фотоинициатора Q-3 не наблюдается совсем. Эти данные подтверждают сохранение реакционной способности (мет)акрилатных фрагментов в хинонах в реакции сополимеризации с другими мономерами. При этом, строение и число мономерных блоков в составе инициатора влияет на его способность встраиваться в матрицу получаемого полимера.
ЗАКЛЮЧЕНИЕ
Синтезированы новые (мет)акрилсодержащие фотоинициаторы, включающие в себя фрагменты 2-гидроксиэтилметакрилата (Q-2) и пента-эритритол триакрилата (Q-3) и чувствительные в видимом спектральном диапазоне. Показано, что введение (мет)акрилатных фрагментов в структуру 3,5-ди-трет-бутил-о-бензохинона не оказывает влияния на эффективность фотоиницирования полимеризации диметакрилата ОКМ-2, снижая при этом влияние кислорода на кинетику протекания процесса. Термическая стабильность полученных в ходе фотополимеризации полимеров не уступает стабильности полиОКМ-2, синтезированного без участия о-бензохинонов. Наличие (мет)акрилатных групп в Q-2 и Q-3 обеспечивает низкую миграцию о-бензохинонов из сополимеров МЭГ с ОКМ-2.
Список литературы
Wang D. Aqueous colored photocurable paint and preparation method thereof. A.c. CN 2021-10066000 Chinese // 2021. P. 11.
Hou H., Gan Ya., Yin J., Jiang X. // Langmuir. 2017. V. 33. № 8. P. 2027.
Shah A.H., Kartheek P., Gandhi P., Jonnalagadda K., Steele T.W.J. // Macromol. Mater. Eng. 2019. № 1900230.
Ao-Ieong W.-S., Chien S.-T., Jiang W.-C., Yet S.-F., Wang J. // Polymers. 2021. V. 13. № 1960.
Seror J., Stern M., Zarka R., Orr N. // Plast. Reconstr. Surg. 2021. V. 148. № 6S. P. 32S.
Bagheri A., Jin J. // ACS Appl. Polym. Mater. 2019. V. 1. № 4.
van Bochove B., Hannink G., Buma P., Grijpma D. W. // Macromol. Biosci. 2016. V. 16. № 12. P. 1853.
Sutton J., Rajan K., Harper D.P., Chmely S.C. // ACS Appl. Mater. Interfaces. 2018. V. 10. № 42. P. 36456.
Chen Yu., Sun C., Zhou H., Li J., Xin W., Xu H., Zhu H. // J. Phys. Chem. Lett. 2021. V. 12. № 40. P. 9989.
Levett P.A., Melchels F.P.W., Schrobback K., Hutmacher D.W., Malda J., Klein T.J. // Acta Biomater. 2013. V. 10. № 1. P. 214.
Ferracci G., Zhu M., Ibrahim M. S., Ma G., Fan T. F., Lee B. H., Cho N.-J. // ACS Appl. Bio Mater. 2020. V. 3. № 2. P. 920.
Wu Q., Mo Y., Zhang Y., Li F., Deng M. // Macromol. Chem. Phys. 2021. V. 222. № 20. P. 2100221.
Eren T. N., Okte N., Morlet-Savary F., Fouassier J.P., Lalevee J., Avci D. // J. Polym. Sci. A: Polym. Chem. 2016. V. 54. № 20. P. 3370.
Zhang T., Jiang B., Huang Yu. // Compos. B. Eng. 2018. V. 140. P. 214.
Tang Y., Zhang Y., Yang J., Nie J. // J. Polym. Sci. A: Polym. Chem. 2017. V. 55. P. 313.
Shurygina M.P., Zakharina M. Yu., Baten’kin M.A., Konev A.N., Shavyrin A.S., Chelnokov E.A., Shushunova N.Yu., Arsenyev M.V., Chesnokov S.A., Abakumov G.A. // Eur. Polym. J. 2020. V. 127. № 109573.
Arsenyev M.V., Shurygina M.P., Poddel’sky A.I., Druzhkov N.O., Chesnokov S.A., Fukin G.K., Cherkasov V.K., Abakumov G.A. // J. Polym. Res. 2013. V. 20. P. 98.
Шушунова Н.Ю., Арсеньев М.В., Глухова Т.А., Зайцев С.Д., Чесноков С.А. // Высокомолекулярные Соединения Серия Б. 2015. Т. 57. № 3. С. 198.
Arsenyev M.V., Baranov E.V., Shurygina M.P., Chesnokov S.A., Abakumov G.A. // Mendeleev Commun. 2016. V. 26. № 6. P. 552.
Poddel’sky A.I., Arsenyev M.V., Astaf’eva T.V., Chesnokov S.A., Fukin G.K., Abakumov G.A. // J. Organomet. Chem. 2017. V. 835. P. 17.
Zhiganshina E.R., Arsenyev M.V., Shavyrin A.S., Baranov E.V., Chesnokov S.A. // Mendeleev Commun. 2019. V. 29. P. 91.
Armarego W.L.F., Chai C.L.L. Purification of laboratory chemicals. Amsterdam: Elsevier Inc. Butterworth-Heinemann, 2003.
Shurygina M.P., Kurskii Yu.A., Druzhkov N.O., Chesnokov S.A., Abakumov G.A. // High Energ. Chem. 2010. V. 44. P. 234.
Si Q.F., Wang X., Fan X.D., Wang S.J. // J. Polym. Sci. A: Polym. Chem. 2005. V. 43. P. 1883.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий