Химия высоких энергий, 2022, T. 56, № 4, стр. 300-304
Прямое окисление бензола в фенол в реакторе с барьерным разрядом
А. Н. Очередько a, С. В. Кудряшов a, А. Ю. Рябов a, А. В. Лещик a
a Федеральное государственное бюджетное учреждение науки Институт химии нефти Сибирского отделения РАН
634055 Томск-55, проспект Академический, 4, Россия
Поступила в редакцию 11.03.2022
После доработки 11.03.2022
Принята к публикации 13.03.2022
- EDN: KDLZUG
- DOI: 10.31857/S002311932204012X
Аннотация
Показана принципиальная возможность прямого окисления бензола в фенол кислородом и воздухом в барьерном разряде в условиях эффективного удаления продуктов реакции из зоны его действия. Установлено, что контроль температуры реактора в процессе окисления бензола в плазме барьерного разряда целесообразен для управления как величиной конверсии бензола, так и составом продуктов реакции. Предложен возможный механизм процесса.
ВВЕДЕНИЕ
Фенол является одним из крупнотоннажных продуктов органического синтеза, в настоящее время ~95% мирового объема фенола производят по кумольному методу [1]. К преимуществу этого метода относят то, что наряду с фенолом образуется ацетон. Однако высокие экономические затраты на проведение процесса заставляют исследователей искать новые пути получения фенола. Перспективным направлением считается прямое окисление бензола в фенол. Наряду с каталитическими способами, активно разрабатываются плазмохимические методы [2, 3].
В работе [2] показана принципиальная возможность получения фенола из бензола с использованием барьерного разряда (БР). Однако исследователи отмечают, что окисление бензола всегда сопровождается образованием отложений на поверхности электродов реактора, что существенно снижает селективность процесса и делает энергозатраты на получение фенола неоправданно высокими. Это способствовало тому, что основной фокус исследований сместился на разработку процессов очистки промышленных газов от примеси бензола [4]. Причиной низкой селективности плазмохимических процессов, в первую очередь, является отсутствие эффективного канала вывода продуктов реакции из зоны действия разряда, а также недостаточность данных по кинетике и механизмам превращений органических соединений в электрических разрядах.
Авторами предложен способ увеличения селективности плазмохимических реакций с участием органических соединений в БР, заключающийся в подавлении процесса их полимеризации на поверхности электродов реактора [5, 6]. БР возбуждается между электродами, покрытыми стекающей по ним пленкой из жидкого углеводорода (УВ) или воды. Образующиеся под действием БР продукты реакции растворяются в пленке и эффективно удаляются из разрядной зоны реактора, не подвергаясь дальнейшим превращениям.
В данной работе представлены результаты экспериментов по прямому окислению бензола в фенол кислородом и воздухом в БР. Использование воздуха в качестве окислителя представляло интерес как с практической точки зрения, поскольку он дешевле кислорода, так и для выявления особенностей механизма окисления бензола.
Эксперименты проведены на установке, которая подробно описана в работах [5, 6]. Анализ состава продуктов реакции проводился с использованием хроматографа HP 6890 и хромато-масс-спектрометра Termo Scientific DFS.
Качественный анализ продуктов реакции с высокой молекулярной массой и твердых продуктов выполнен на ЯМР-Фурье спектрометре Bruker AVANCE AV300, ИК-Фурье спектрометре Nicolet 5700.
Поверхность и размеры твердых образцов исследованы с применением сканирующего электронного микроскопа Quanta 200 3D, вес измерен с помощью лабораторных электронных весов Sartorius RC 210P.
Конверсия бензола (Х, мас.%) рассчитана по формуле:
где Мпрод – масса продуктов реакции, мг;М – масса исходного углеводорода, мг.
Содержание продуктов реакции в послереакционной смеси (S, мас. %) определено по выражению:
где Mi – масса i-го продукта реакции, мг;Мпрод – масса продуктов реакции, мг.
Энергетические затраты на превращение исходного углеводорода (P, кВтч/кг) рассчитаны по формуле:
где W – активная мощность разряда, Вт;t – продолжительность эксперимента, с.
Методики регистрации электрических параметров разряда и расчета активной мощности подробно описаны в работах [5, 6].
Во всех экспериментах объемный расход бензола составлял 0.26 см3/мин, кислорода (воздуха) – 60 см3/мин, время контакта парогазовой смеси с разрядной зоной реактора – 10.5 с. Температура стенок реактора – 20°С, давление – атмосферное. Амплитуда высоковольтных импульсов напряжения не превышала 10 кВ, частота их повторения равнялась 400 Гц, активная мощность БР достигала 1.8 Вт.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Окисление бензола в БР как кислородом, так и воздухом сопровождается образованием фенолов различного строения. Состав смеси продуктов окисления бензола представлен в табл. 1.
Таблица 1.
Состав смеси продуктов окисления бензола воздухом и кислородом
| Продукты | Содержание, мас. % | |
|---|---|---|
| кислород | воздух | |
| Фенол | 74.4 | 77.3 |
| Двухатомные фенолы | 9.1 | 3.4 |
| из них пирокатехин | 2.3 | 0.9 |
| гидрохинон | 6.8 | 2.5 |
| Другие | 16.5 | 19.3 |
Основным продуктом окисления является фенол (до 77.3 мас. %). В незначительном количестве обнаружены двухатомные фенолы (преимущественно гидрохинон). Также обнаружены пирокатехин, о-гидроксибифенил, бифенил и другие соединения. Конверсия бензола за один проход парогазовой смеси через реактор составила в кислороде – 0.7 мас. %, воздухе – 0.4 мас. %, что соответствует энергозатратам на его превращение ~20 и 30.4 кВтч/кг.
Окисление бензола воздухом сопровождается образованием осадка (в случае кислорода осадок не обнаружен), количество которого не превышает 13 мас. % относительно продуктов, собираемых в виде раствора в бензоле. На рис. 1 приведены изображения осадка, полученные на электронном микроскопе. Осадок представляет собой агрегаты из сферических частиц диаметром 1–5 мкм.
Образцы осадка также были исследованы методами ИК-, ЯМР 1Н и 13С-спектроскопии. Было установлено, что осадок имеет сложное строение, а в его молекулярной структуре содержатся фенольные и карбонильные группы.
Несмотря на меньшее содержание кислорода в воздухе и снижение конверсии бензола при его окислении воздухом в БР (см. табл. 1) содержание фенола в составе продуктов окисления бензола незначительно возрастает. Этот факт невозможно объяснить только с точки зрения более низкой концентрации кислорода в воздухе, поскольку из данных о плазмохимическом синтезе озона из воздуха известно и о влиянии на процесс содержащегося в воздухе азота [7].
В связи с этим для более детального исследования процесса окисления бензола в БР в экспериментах по окислению бензола смесями кислорода и азота было изучено влияние азота на конверсию бензола, состав продуктов его окисления и другие параметры эксперимента. Результаты представлены на рис. 2 и 3.
Рис. 2.
Зависимость конверсии бензола и энергозатрат на его окисление в БР от содержания азота в смеси с кислородом.
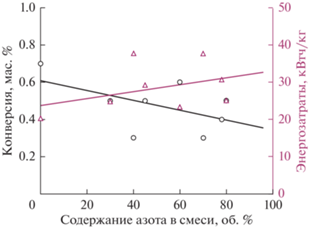
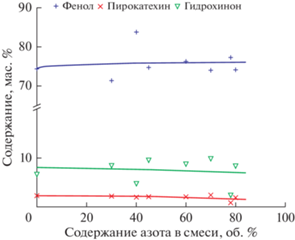
Рис. 3.
Зависимость содержания фенола, пирокатехина и гидрохинона в смеси продуктов окисления бензола в БР от содержания азота в смеси с кислородом.
Из рис. 2 следует, что с ростом содержания азота в смеси с кислородом конверсия бензола снижается, при этом энергозатраты на его превращение закономерно растут. Конверсия бензола находится в диапазоне 0.3–0.7 мас. %, энергозатраты не превышают 40 кВтч/кг.
Наличие азота в смеси с кислородом не приводит к образованию новых продуктов окисления (рис. 3), основными продуктами окисления бензола смесями азота и кислорода остаются фенол и двухатомные фенолы пирокатехин и гидрохинон. Их содержание в смеси продуктов окисления практически не зависит от состава окисляющей смеси и в среднем составляет 85 мас. % в сумме.
Полученные результаты исследования процесса окисления бензола в плазме БР позволяют предположить вероятный механизм образования фенола.
Из данных о реакциях в низкотемпературной плазме известно, что на начальной стадии плазмохимических процессов электроны разряда, взаимодействуя с молекулами исходной смеси, инициируют образование активных частиц (радикалы, возбужденные молекулы) [4, 7], которые затем участвуют в дальнейших химических превращениях с образованием стабильных продуктов.
Анализ потерь энергии электронов БР при столкновении с молекулами исходной парогазовой смеси позволяет оценить состав частиц, образовавшихся на стадии разрядного инициирования реакции, и дальнейшее направление ее протекания.
В табл. 2 представлен баланс потерь энергии электронов в парогазовой смеси кислород–бензол.
Таблица 2.
Потери энергии электронов БР на возбуждение различных состояний молекул в смеси паров бензола с кислородом
| Потери, % | O2 | C6H6 |
|---|---|---|
| Колебательные состояния | 7.3 | 19.2 |
| Электронные состояния | 69.8 | |
| Ионизация | 0.3 | 1.1 |
Расчеты выполнены с использованием программы Bolsig+ [8], сечения рассеяния электронов молекулами исходной смеси взяты из [9–11]. Приведенная напряженность электрического поля (E/n) составила 110 Td.
Как видно из приведенных в табл. 2 данных, основные потери энергии электронов БР приходятся на возбуждение колебательных и электронных состояний кислорода – 69.8% и бензола – 19.2%. Незначительные потери энергии электронов БР на ионизацию позволяют пренебречь участием ионов при рассмотрении механизма окисления бензола в БР. Таким образом, основным каналом образования частиц на стадии разрядного инициирования реакции будет диссоциация молекул кислорода и бензола из электронно-возбужденных состояний.
Под действием БР молекулы кислорода диссоциируют преимущественно с образованием атомарного кислорода в основном состоянии O(3P) [3]:
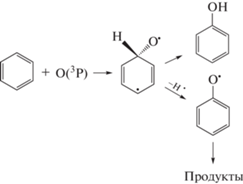
Присоединение образовавшегося атомарного кислорода к углеродному атому двойной связи молекулы бензола приводит к образованию аддукта, который затем перегруппировывается в фенол либо в фенокси радикал [12–14]:
Как следует из данных работы [3], нельзя исключать образование фенола и по радикально-цепному механизму:
(3)
${{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{6}} + {\text{O}}\left( {^{{\text{3}}}{\text{P}}} \right) \to {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}}\centerdot \, + {\text{H}} \bullet ,$(4)
${{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{5}} + {{{\text{O}}}_{2}} \to {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{OO}} \bullet \to {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}}{\kern 1pt} \bullet + {\text{ O}},$(5)
${{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}}{\kern 1pt} \bullet + {\text{ H}} \bullet \to {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{OH}},$(6)
${{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}}{\kern 1pt} \bullet + {\text{ HOO}} \bullet \to {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{OH}} + {{{\text{O}}}_{{\text{2}}}}.$Кроме того, согласно данным работы [12], молекула бензола из электронно-возбужденного состояния может диссоциировать с преимущественным образованием фенильного радикала и атомарного водорода:
(7)
${{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{6}} + {\text{e}} \to {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{5}}{\kern 1pt} \bullet + \,{\text{H}}{\kern 1pt} \bullet + \,{\text{e}},$который при взаимодействии с кислородом также может давать фенол по реакциям (3)–(5) или другие обнаруженные продукты [12–14].
Образование осадка при окислении бензола воздухом, вероятно, можно связать с дополнительным каналом превращения аддукта атомарного кислорода и бензола, приводящим к его деструкции. При этом, исходя из ранее сделанного авторами предположения о механизме окисления пропилена [5], где показано, что возбужденные молекулы азота влияют на содержание продуктов его окисления, в том числе на направление изомеризации аддукта пропилена и атомарного кислорода, можно предположить, что реакция возбужденных молекул азота с аддуктом атомарного кислорода и бензола и есть тот дополнительный канал его превращений, который приводит к образованию отличных от фенола продуктов и осадка.
В целом, эффект образования осадка при окислении бензола воздухом представляет интерес для выяснения особенностей механизма окисления ароматических углеводородов и получения новых данных о процессах самоорганизации в БР, но негативно влияет на возможные практические применения в будущем. Таким образом, для прямого получения фенола из бензола в БР предпочтительнее использование кислорода, чем воздуха.
ЗАКЛЮЧЕНИЕ
Показана принципиальная возможность прямого окисления бензола в фенол кислородом и воздухом в БР в условиях эффективного удаления продуктов реакции из зоны его действия. В условиях эксперимента при использовании воздуха основным продуктом является фенол (77.3 мас. %), в незначительном количестве образуются двухатомные фенолы, преимущественно гидрохинон. Окисление бензола воздухом сопровождается образованием незначительного количества осадка. Осадок представляет собой агрегаты из сферических частиц диаметром 1–5 мкм, содержит фенольные и карбонильные группы и обладает сложной структурой. Предложен возможный механизм прямого окисления бензола в БР, согласно которому образование фенола происходит преимущественно в результате присоединения атомарного кислорода, образовавшегося под действием электронов БР, к двойной связи бензола. В рамках предложенного механизма обосновано возможное влияние молекул азота на процесс образования осадка при окислении бензола.
Полученные экспериментальные данные показывают принципиальную возможность разработки новых экологически чистых методов получения фенола из бензола с использованием низкотемпературной неравновесной плазмы электрических разрядов, например БР.
Список литературы
Schmidt R.J. // Appl. Catal. A–Gen. 2005. V. 280. № 1. P. 89.
Ascenzi D., Franceschi P., Guella G., et al. // J. Phys. Chem. A. 2006. V. 110. № 25. P. 7841.
Dey G.R., Sharma A., Pushpa K.K., et al. // J. Hazard. Mater. 2010. V. 178. № 1–3. P. 693.
Franceschi P., Guella G., Scarduelli G., et al. // Plasma Process. Polym. 2007. V. 4. № 5. P. 548.
Kudryashov S.V., Ochered’ko A.N., Ryabov A.Yu., et al. // Plasma Chem. Plasma Process. 2011. V. 31. P. 649.
Kudryashov S.V., Ryabov A.Yu, Shchyogoleva G.S. // J. Phys. D. Appl. Phys. 2016. V. 49. P. 025205.
Kogelschatz U. // Plasma Chem. Plasma Process. 2003. V. 23. № 1. P. 1.
Hagelaar G.J.M., Pitchford L.C. // Plasma Sources Sci. T. 2005. V. 14. № 4. P. 722.
Viehland database. Электронный ресурс. Режим доступа: URL: http://www.lxcat.net.
Sanches I.P., Sugohara R.T., Rosani L. et al. // J. Phys. B–At. Mol. Opt. 2008. V. 41. № 18. P. 185202.
Bettega M., Winstead C., McKoy V. // J. Chem. Phys. 2000. V. 112. № 20. P. 8806.
Cvetanovic R.J. // J. Phys. Chem. Ref. Data. 1987. V. 16. P. 261.
Taatjes C.A., Osborn D.L., Selby T.M. et al. // J. Phys. Chem. A. 2010. V. 114. № 9. P. 3355.
Nguyen T.L., Peeters J., Vereecken L. // J. Phys. Chem. A. 2007. V. 111. № 19. P. 3836.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий