Химия высоких энергий, 2022, T. 56, № 5, стр. 317-325
Конкурентные процессы переноса энергии и раскрытия четырехчленного цикла в циклобутанах, образующихся в реакции [2+2]-фотоциклоприсоединения бис-стирилбензохинолиновых диад
М. Ф. Будыка a, *, Т. Н. Гавришова a, В. М. Ли a, Н. И. Поташова a, Ю. А. Федулова a, b
a Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка, просп. Академика Семенова, 1, Россия
b Факультет фундаментальной физико-химической инженерии МГУ им. Ломоносова
Москва, Россия
* E-mail: budyka@icp.ac.ru
Поступила в редакцию 25.04.2022
После доработки 10.05.2022
Принята к публикации 15.05.2022
- EDN: GSWPZA
- DOI: 10.31857/S0023119322050023
Аннотация
Циклобутаны, содержащие два вицинальных бензо[f]хинолиновых (BQ) заместителя, являются продуктами реакции [2 + 2]-(кросс-)фотоциклоприсоединения (ФЦП) ковалентно-связанных бифотохромных диад, в которых стирилбензохинолиновые фотохромы связаны с 2,3-нафтиленовым (NA) каркасом метиленовыми мостиками разной длины. Исследованы спектрально-люминесцентные свойства циклобутана CB44N в сравнении с аналогами. Предположено, что в циклобутанах с BQ заместителями фотохимическое раскрытие четырехчленного цикла (реакция ретро-ФЦП) после возбуждения BQ происходит в результате переноса (перераспределения) энергии (ПЭ) от BQ* на циклобутан с образованием интермедиата Х, в котором возможен как возврат в исходный циклобутан, так и раскрытие цикла с образованием соответствующей диады. С процессом ПЭ от BQ* на циклобутан конкурирует индуктивно-резонансный (Фёрстеровский) ПЭ от BQ* на удаленную NA группу, что объясняет зависимость спектрально-люминесцентных и фотохимических свойств серии родственных циклобутанов от длины метиленовых мостиков.
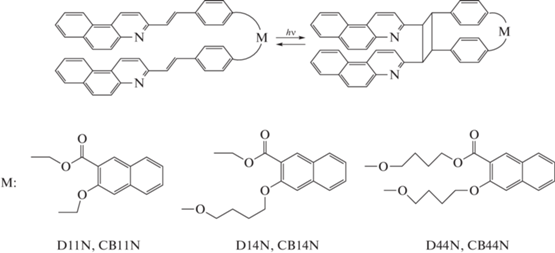
Реакция [2+2]-фотоциклоприсоединения (ФЦП) ненасыщенных соединений – это одна из фундаментальных фотохимических реакций, которая активно используется в синтетической органической химии [1–3]. Когда субстратом реакции ФЦП является этилен или его производные, в качестве продукта образуются соответствующие циклобутаны. Образование производных циклобутана было нами обнаружено при исследовании фотохимических свойств серии родственных бис-стирилбензохинолиновых диад, в которых два 3‑стирилбензо[f]хинолиновых (SBQ) фотохрома связаны разными мостиковыми группами [4–8]. Было найдено, что в диадах под действием света протекают две конкурентные реакции – транс-цис фотоизомеризация фотохромов и межфотохромная реакция ФЦП (или кросс-ФЦП, если реагируют разные SBQ-фотохромы), причем квантовый выход реакции ФЦП (φPCA), а также обратной реакции ретро-ФЦП – раскрытия циклобутанового кольца (φrPCA) –зависел от длины мостиковых групп. Так, для схожих по структуре диад D11N, D14N, D44N, схема 1, где SBQ фотохромы связаны с фрагментом 3-окси-2-нафтойной кислоты (NA) метиленовыми мостиками разной длины, получены значения φPCA 0.26, 0.081, 0.18 и значения φrPCA 0, 0.0079, 0.11 соответственно [5, 7, 8]. В этом ряду диад в реакции (кросс-)ФЦП образуются соответствующие тетразамещенные циклобутаны CB11N, CB14N и CB44N, схема 1, в которых у одной из сторон циклобутанового кольца имеются два одинаковых вицинальных бензо[f]хинолиновых (BQ) заместителя, а у противоположной стороны циклобутана – две фениленовые группы с разными заместителями в пара-положении и удаленный нафтиленовый каркас NA, связанный с фениленовыми группами метиленовыми “мостиками” разной длины.
Схема 1. Реакция [2+2]-фотоциклоприсоединения в стирилбензохинолиновых диадах D11N, D14N и D44N с образованием соответствующих циклобутанов CB11N, CB14N и CB44N.
Эффективность реакции ФЦП, кроме прочих факторов, зависит от взаимного расположения двух SBQ фотохромов относительно друг друга, что объясняет влияние длины связывающего мостика на значение φPCA для разных диад. Ранее зависимость квантового выхода внутримолекулярной реакции ФЦП от длины метиленового мостика, связывающего два алкена, наблюдалась для α,ω-бис(п-винилфенил)алканов [9]. Однако в результате ФЦП бис-стирилбензохинолиновых диад образуются циклобутаны, которые имеют одинаковые заместители у четырехчленного ядра, две вицинальные BQ группы и две вицинальные пара-фениленовые группы, схема 1. Поэтому можно было ожидать, что реакция раскрытия цикла для этих циклобутанов будет происходить с равной эффективностью, т.е. значения φrPCA для всех циклобутанов будут совпадать. Однако измеренные значения φrPCA в ряду CB11N, CB14N и CB44N существенно различаются.
В рассматриваемых производных циклобутана реакция ретро-ФЦП при облучении светом в области длинноволновой полосы поглощения (ДВПП), где поглощают BQ заместители, начинается с локального возбуждения BQ. После этого происходит перенос (перераспределение) энергии (ПЭ) от BQ* на циклобутановое ядро с дальнейшим его раскрытием. Можно предположить, что ПЭ происходит “через связи” (through-bond) по суперобменному механизму [10]. Очевидно, что с ПЭ от BQ* на циклобутановое ядро конкурирует другой фотофизический процесс (кроме флуоресценции BQ* с квантовым выходом φfl), поскольку квантовый выход реакции ретро-ФЦП φrPCA < (1 – φfl), а никаких других фотохимических реакций в циклобутанах после возбуждения BQ не наблюдается.
Таким конкурирующим процессом может быть образование эксимера между двумя вицинальными BQ заместителями [5] и/или ПЭ на NA группу [7]. Для циклобутана CB14N была определена эффективность (квантовый выход) тушения BQ φQ = 0.96 (параметр φQ был обозначен как φET, поскольку тушение было приписано процессу ПЭ BQ → NA без учета ПЭ на циклобутан) [7]. При переходе от циклобутана CB14N к CB44N один из метиленовых мостиков удлиняется до четырех звеньев, поэтому можно предположить, что увеличение φrPCA для CB44N обусловлено уменьшением эффективности конкурентного ПЭ BQ → NA вследствие увеличения расстояния между донором и акцептором энергии.
Для проверки этого предположения в данной работе более детально исследованы спектрально-люминесцентные свойства циклобутана CB44N. Найдено, что, по сравнению со свободным состоянием, в циклобутане CB44N флуоресценция BQ* потушена в результате двух процессов переноса энергии: ПЭ на NA группу с квантовым выходом φET = 0.36 и ПЭ на циклобутановое ядро с квантовым выходом φR = 0.52; суммарный квантовый выход тушения φQ = 0.88. Квантовохимические DFT расчеты показали, что при переходе от CB14N к CB44N расстояние между центрами донорно-акцепторных пар BQ-NA увеличивается от 1.44 до 1.74 нм для одного BQ заместителя и 1.89 нм для другого BQ заместителя. Увеличение расстояния между BQ и NA коррелирует с уменьшением φET в CB44N по сравнению с CB14N и подтверждает вывод, что ПЭ BQ → NA является процессом, конкурирующим с реакцией ретро-ФЦП и уменьшающим квантовый выход раскрытия циклобутана.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Циклобутан CB44N получали in situ путем облучения раствора диады D44N светом с длиной волны 372 нм (светодиод LED-372), синтез диады D44N описан ранее [8].
Электронные спектры поглощения записаны на спектрофотометре “Specord M-400”. Флуоресцентные исследования проведены в Аналитическом центре коллективного пользования ИПХФ РАН: спектры эмиссии сняты на спектрофлуориметре “LS-55” фирмы PerkinElmer.
Все исследования выполнены при комнатной температуре, при красном свете, в воздушно-насыщенных растворах в этаноле с добавлением хлористого метилена в кварцевых кюветах с длиной оптического пути l = 1 см. Квантовые выходы флуоресценции измеряли, используя в качестве эталона разбавленный спиртовой раствор антрацена, квантовый выход флуоресценции которого составляет 0.3 [11], точность измерения 15%.
Квантово-химические расчеты соединений в основном (S0) состоянии проводили методом функционала плотности с использованием гибридного функционала M06-2X, учитывающего дисперсионные взаимодействия, с базисом 6-31G*, пакет программ GAUSSIAN-09 [12]. Структуры соединений рассчитаны с полной оптимизацией геометрии. Оптимизированные структуры соответствовали минимуму на поверхности потенциальной энергии, поскольку в колебательных спектрах отсутствовали мнимые частоты.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
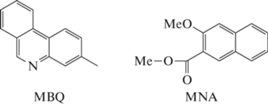
Спектральные свойства циклобутана CB44N были исследованы в сравнении со свойствами модельных соединений – 3-метилбензо[f]хинолина (MBQ) и метилового эфира 3-метокси-2 нафтойной кислоты (MNA), схема 2.
Схема 2. Структура модельных соединений, 3-метилбензо[f]хинолина MBQ и метилового эфира 3-метокси-2 нафтойной кислоты MNA.
На рис. 1 показан спектр поглощения CB44N (спектр 1), а также спектры модельных хромофоров – MBQ (спектр 2) и MNA (спектр 3). Оба модельных соединения имеют ДВПП в области 310–380 нм. Поглощение циклобутанового ядра с простыми С–С σ-связями ограничено вакуумным ультрафиолетом [13], спектр поглощения оксифениленовых заместителей также ограничен коротковолновой областью < 300 нм, как можно оценить исходя из спектра поглощения анизола (максимум ДВПП 269 нм) [14]. Из этого следует, что спектр поглощения CB44N в УФ области 300–380 нм является суммой поглощения только BQ заместителей и удаленной NA группы. Из сравнения со спектрами модельных соединений видно, что структурированная ДВПП CB44N с максимумами 319, 333 и 349 нм определяется поглощением BQ заместителей (для удобства сравнения спектр MBQ на рис. 1 сдвинут батохромно на 3 нм). Спектры поглощения MBQ и NA перекрываются, причем NA вносит сравнительно небольшой вклад в ДВПП в области 300–350 нм, а на длинноволновом спаде ДВПП в области 360–380 нм поглощает только NA, что позволяет селективно возбуждать этот хромофор, см. ниже спектры флуоресценции. Однако селективное возбуждение NA группы не приводит к раскрытию циклобутанового ядра, поэтому при облучении диады D44N светом с длиной волны 372 нм циклобутан CB44N образуется, практически, количественно [8]. В то же время, реакция ретро-ФЦП происходит при облучении циклобутана CB44N коротковолновым светом 316 нм в области поглощения BQ заместителей [8].
Рис. 1.
Спектры поглощения: (1) – циклобутан CB44N, (2) – MBQ (удвоен и сдвинут батохромно на 3 нм), (3) – MNA; спектры флуоресценции: (4) – MBQ (возбуждение на 330 нм, сдвинут батофлорно на 4 нм), (5) – MNA (возбуждение на 339 нм).
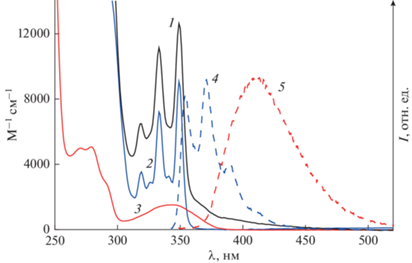
Оба модельных хромофора являются одновременно флуорофорами с квантовыми выходами флуоресценции φfl = 0.43 для MBQ и φfl = 0.38 для MNA [7]. Как видно на рис. 1, спектр излучения MBQ (спектр 4) перекрывается со спектром поглощения NA (спектр 3), что создает предпосылки для индуктивно-резонансного (Фёрстеровского) переноса энергии (ПЭ), существенно влияющего на фотофизические и фотохимические свойства CB44N.
Циклобутан CB44N люминесцирует с квантовым выходом φfl = 0.22. Как и следовало ожидать при наличии нескольких флуорофоров, спектры люминесценции CB44N зависят от длины волны возбуждения, а спектры возбуждения люминесценции – от длины волны наблюдения. Поскольку на длинноволновом спаде ДВПП CB44N поглощает только NA группа, при возбуждении светом 360 нм люминесценция циклобутана (рис. 2, спектр 1) определяется излучением только этой группы и совпадает со спектром излучения модельного MNA с максимумом 411 нм (рис. 1, спектр 5).
Рис. 2.
Нормированные спектры люминесценции циклобутана CB44N при возбуждении светом с длиной волны (1) 360 нм и (2) 330 нм; спектры возбуждения люминесценции циклобутана CB44N при наблюдении на длине волны (3) 408 нм и (4) 371 нм; разложение спектра (2) на спектры (5) BQ и (6) NA (см. текст).
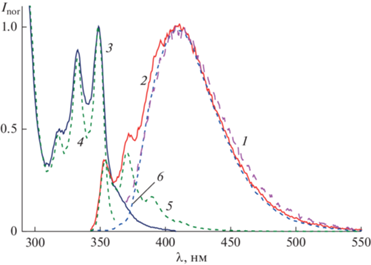
При возбуждении светом 330 нм, в области поглощения обоих хромофоров, NA и BQ, в спектре люминесценции циклобутана CB44N появляются дополнительные резко выраженные коротковолновые максимумы 354 и 372 нм, рис. 2, спектр 2, которые совпадают по положению с максимумами в спектре излучения MBQ, сдвинутом батофлорно на 4 нм (рис. 1, спектр 4). При наблюдении на длине волны 408 нм, в области излучения NA флуорофора, спектр возбуждения люминесценции (рис. 2, спектр 3) совпадает со спектром поглощения CB44N в целом, а при наблюдении в области коротковолнового пика 372 нм, где NA не излучает, в спектре возбуждения исчезает длинноволновое плечо 360–390 нм (рис. 2, спектр 4), принадлежащее NA, и спектр становится похожим на спектр поглощения модельного MBQ (рис. 1).
Очевидно, что максимумы 319, 333 и 349 нм в спектрах возбуждения флуоресценции CB44N (рис. 2, спектры 3, 4), и коротковолновые максимумы 354 и 372 нм в “полном” спектре излучения циклобутана (рис. 2, спектр 2) относятся к BQ заместителям. Наблюдаемые эффекты свидетельствуют о наличии ПЭ BQ → NA. В соответствии с этим, при наблюдении за излучением донора энергии (BQ), в спектре возбуждения циклобутана CB44N видны полосы только донора, а при наблюдении за излучением акцептора энергии (NA), в спектре возбуждения видны полосы и донора, и акцептора.
Полный спектр излучения циклобутана при возбуждении светом с длиной волны 330 нм (рис. 2, спектр 2) раскладывается на два спектра – 5 и 6 на рис. 2, причем спектр 6 совпадает со спектром 1, т.е. принадлежит NA, а спектр 5 принадлежит BQ заместителям и совпадает со спектром излучения модельного MBQ, батофлорно сдвинутым на 4 нм. Из соотношения площадей (в шкале волновых чисел) спектров 5 и 6 на рис. 2, можно рассчитать, что BQ заместители вносят 20% в спектр излучения циклобутана CB44N. С учетом того, что на долю BQ заместителей приходится 84% поглощенного света (на длине волны 330 нм), квантовый выход флуоресценции BQ в CB44N $\varphi _{{{\text{fl}}}}^{'}$(BQ) = = 0.052. Это в 8.3 раз меньше, чем в модельном MBQ, т.е. флуоресценция BQ в CB44N существенно потушена.
Аналогично, исходя из того, что NA группа вносит 80% в спектр излучения циклобутана CB44N и на ее долю приходится 16% поглощенного света, можно рассчитать, что квантовый выход флуоресценции NA в CB44N $\varphi _{{{\text{fl}}}}^{'}$(NA) = 1.1. Это в 2.9 раза больше, чем φfl для модельного MNA, т.е. сенсибилизированная флуоресценция вносит основной вклад в излучение NA в CB44N.
Структура циклобутана CB44N была оптимизирована методом DFT на уровне M06-2X/6-31G*. На рис. 3 показан конформер CB44N, который образуется в реакции ФЦП EE изомера диады D44N. В этом конформере NA фрагмент максимально удален от циклобутанового кольца. Расчет показывает, что один BQ заместитель находится на расстоянии 1.74 нм от NA фрагмента, другой – на расстоянии 1.89 нм.
Ранее при расчете тем же методом было найдено, что в циклобутане CB14N, содержащем более короткую цепочку из одной метиленовой группы (схема 1), расстояние между центрами донорно-акцепторной пары меньше и составляет 1.44 нм [7]. Таким образом, уменьшение эффективности ПЭ при переходе от CB14N к CB44N согласуется с увеличением расстояния между донором и акцептором энергии в этих циклобутанах.
На рис. 4 показан экспериментальный и теоретический спектр поглощения CB44N, рассчитанный на уровне TD-M06-2X/6-31G*, а также структура молекулярных орбиталей (МО), переходы между которыми дают основной вклад в соответствующие возбужденные состояния. Для удобства сравнения с экспериментальным спектром, расчетный спектр сдвинут батохромно на 0.8 эВ. В табл. 1 приведены параметры рассчитанного спектра: максимум полосы поглощения, вертикальная энергия возбуждения, сила осциллятора и состав перехода.
Рис. 4.
Спектры поглощения циклобутана CB44N, экспериментальный (правая ось) и теоретический (левая ось, расчет методом TD-M06-2X/6-31G*, спектр сдвинут батохромно на 0.8 эВ); показана структура молекулярных орбиталей, участвующих в указанных переходах, обозначения МО: H (highest occupied) – высшая занятая, L (lowest unoccupied) – низшая вакантная.
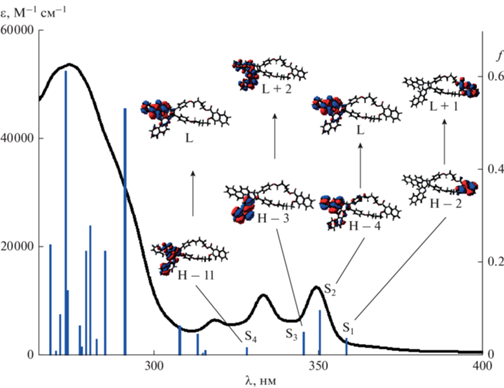
Таблица 1.
Теоретический спектр поглощения циклобутана CB44N: максимум полосы (λmax) и соответствующая вертикальная энергия возбуждения (Ev), сила осциллятора (f) и состав перехода, расчет методом TD-M06-2X/6-31G*, спектр сдвинут в сторону низких энергий на 0.8 эВ
| Состояниеа | λmax, нм | Ev, эВ | f | Составб | % |
|---|---|---|---|---|---|
| S1 | 358 | 3.46 | 0.0365 | H-2 → L + 1 | 81 |
| S2 | 350 | 3.54 | 0.0966 | H-4 → L | 43 |
| S3 | 345 | 3.59 | 0.0498 | H-3 → L + 2 H-3 → L + 4 |
30 17 |
| S4 | 328 | 3.78 | 0.0169 | H-11 → L | 47 |
| S5 | 316 | 3.93 | 0.0101 | H-6 → L H-10 → L + 2 |
20 18 |
| S6 | 315 | 3.94 | 0.0041 | H-10 → L + 2 | 28 |
| S7 | 313 | 3.96 | 0.0454 | H-3 → L + 2 H-3 → L + 4 H-5 → L + 2 |
29 25 17 |
| S8 | 308 | 4.03 | 0.0629 | H-7 → L + 1 H-2 → L + 5 |
57 26 |
Следует отметить, что высшая занятая МО (highest occupied, далее – H), и соседняя (H-1) орбиталь локализованы на оксифениленовых заместителях у циклобутанового ядра, а низшая вакантная МО (lowest unoccupied, далее – L) – на одном из BQ заместителей. Ближайшие к граничным орбитали, локализованные на NA фрагменте – это (H-2) и (L + 1), но переход электрона именно между этими орбиталями определяет длинноволновую полосу S0 → S1 (табл. 1). Это соответствует экспериментальным данным, согласно которым длинноволновый спад ДВПП циклобутана обусловлен поглощением NA фрагмента (рис. 1).
Следующие по энергии возбужденные состояния S2 и S3 обусловлены переходами электрона между МО, локализованными на BQ заместителях, рис. 4, что также соответствует экспериментальным данным. Далее идут nπ* переходы в состояния S4–S6 (табл. 1) с участием МО (H-10) и (H-11), в которые существенные вклады вносят несвязывающие атомные орбитали атомов азота BQ заместителей, рис. 4. Обычно малоинтенсивные nπ* переходы маскируются соседними более интенсивными ππ* переходами.
Высоковозбужденные состояния S12 и S13 связаны с переходами электрона между занятыми орбиталями (H-1), (H) и вакантными орбиталями (L + 7), (L + 9), локализованными на оксифениленовых заместителях; эти состояния лежат по энергии выше S1 состояния на 0.96 и 0.98 эВ, соответственно, что согласуется с положением ДВПП анизола, см. выше.
Согласно экспериментальным данным, CB44N не раскрывается при облучении светом 372 нм в полосе поглощения NA группы, т.е. возбуждение NA группы не приводит к реакции ретро-ФЦП. Отсюда следует вывод, что отсутствует ПЭ с NA* на циклобутан.
Очевидно, что ПЭ с BQ* на циклобутан происходит в S2 (и S3) ππ*-возбужденном состоянии, локализованном на BQ группе, поскольку облучение CB44N в области поглощения BQ групп приводит к реакции ретро-ФЦП.
Кроме BQ заместителей, CB44N имеет оксифениленовые заместители у циклобутанового ядра. Заселение высоколежащих ππ* возбужденных состояний, локализованных на этих заместителях, также может приводить к реакции ретро-ФЦП. Этот вывод сложно подтвердить экспериментально, поскольку невозможно селективно возбудить оксифениленовые группы. Малоинтенсивные полосы поглощения этих групп в коротковолновой области спектра перекрываются интенсивными полосами поглощения BQ заместителей и NA группы, рис. 1. Из соотношения молярных показателей поглощения модельных соединений MBQ, MNA и анизола можно оценить, что, например, на длине волны 260 нм BQ, NA и оксифениленовые группы поглощают 83, 11 и 6% света, соответственно, поэтому доля циклобутана, который может раскрыться в результате возбуждения оксифениленовых групп светом 260 нм, лежит в пределах ошибки измерения φrPCA.
На рис. 5 показана диаграмма термов, на которой суммированы полученные экспериментальные и расчетные данные.
Рис. 5.
Диаграмма термов для MBQ и CB44N, указаны энергии 0–0 переходов, рассчитанные по пересечению спектров поглощения и излучения, показаны излучательные и безызлучательные переходы; ЕТ (energy transfer) – перенос энергии, Х – интермедиат реакции ретро-ФЦП; обозначения параметров даны в тексте.
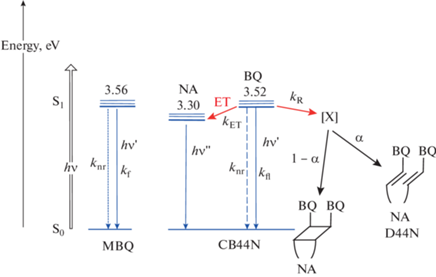
Для возбужденного MBQ* существует два канала дезактивации – излучательный с константой скорости kfl и безызлучательный с константой скорости knr, рис. 5. Поскольку время жизни MBQ* τ = 6.61 нс и φfl = 0.43 [7], получаем kfl = = φfl/τ = 6.54 × 107 с–1 и knr = 8.66 × 107 с–1.
Для возбужденного флуорофора BQ* в составе CB44N к этим двум процессам дезактивации, для которых, предположительно, сохраняются константы kfl и knr, добавляются два дополнительных процесса, приводящие к тушению BQ* – это ПЭ на NA группу с константой скорости kET (и квантовым выходом φET) и ПЭ на циклобутановое ядро с константой скорости kR (и квантовым выходом φR), который инициирует реакцию ретро-ФЦП, рис. 5. Суммарную эффективность тушения BQ* по этим двум каналам можно определить как φQ = = (φET + φR) = 1 – $\varphi _{{{\text{fl}}}}^{'}$/φfl, где φfl и $\varphi _{{{\text{fl}}}}^{'}$ – квантовые выходы излучения флуорофора в свободном состоянии и при наличии тушения. Используя MBQ в качестве модели свободного флуорофора с φfl = 0.43 и рассчитанное выше для BQ в CB44N значение $\varphi _{{{\text{fl}}}}^{'}$(BQ) = 0.052, получаем φQ = 0.88.
Из тушения BQ* можно найти только суммарную эффективность тушения φQ, но не ее составляющие φET и φR. Раздельно эти параметры можно оценить из других данных. Поскольку следствием ПЭ является как тушение донора, так и сенсибилизация акцептора, эффективность ПЭ φET можно рассчитать исходя из увеличения квантового выхода флуоресценции акцептора (в данном случае – NA):
По теории Фёрстера [15], константа скорости ПЭ kET определяется временем жизни донора (τD), радиусом Фёрстера (R0) и расстоянием между донором и акцептором (R):
Ранее для донорно-акцепторной пары BQ–NA был рассчитан интеграл перекрывания по модели Фёрстера J = 8.9 × 1012 М–1 см–1 нм4 [7]. С использованием этого параметра и среднего значения ориентационного фактора κ2 = 2/3, получаем для пары BQ–NA радиус Фёрстера R0 = 2.01 нм. С учетом рассчитанного значения kET, получаем среднее расстояние между BQ и NA в CB44N R = = 1.67 нм, что согласуется с результатами квантовохимических расчетов, согласно которым в максимально развернутом конформере циклобутана расстояние BQ–NA равно 1.74 и 1.89 нм для разных BQ заместителей, см. выше.
Квантовый выход реакции ретро-ФЦП, измеренный по кинетике спектральных изменений, φrPCA = 0.11, что меньше рассчитанного квантового выхода φR = 0.52, т.е. основная часть энергии возбуждения диссипирует, не приводя к раскрытию циклобутана. По-видимому, в результате ПЭ на циклобутановое ядро сначала образуется интермедиат Х, и квантовый выход φR характеризует именно этот первичный процесс, рис. 5. Далее некоторая часть Х, определяемая фактором распределения α, превращается в диаду, остальная часть (1–α) возвращается в исходный циклобутан, рис. 5. Из соотношения φrPCA/φR получаем значение α = 0.21.
Известно, что циклобутаны с вицинальными ароматическими заместителями, например, производными карбазола, проявляют эксимерную флуоресценцию при наличии дополнительного мостика, обеспечивающего более близкое расположение заместителей друг к другу (карбазолофаны) [16]. Для исследуемого ряда циклобутанов также нельзя полностью исключить возможность образования эксимера между двумя BQ заместителями, поскольку экспериментально наблюдаются основные характеристики эксимера – батофлорно сдвинутый спектр флуоресценции (который в данном случае приписывается излучению NA) при сохранении спектра возбуждения флуоресценции BQ.
В любом случае, и образование эксимера, и ПЭ от BQ к NA, являются конкурентными процессами по отношению к реакции ретро-ФЦП. Для выяснения детального механизма реакции ретро-ФЦП и возможных конкурентных процессов необходимы дополнительные экспериментальные и теоретические исследования.
Ранее тушение BQ в циклобутане CB14N было приписано ПЭ BQ → NA, без учета вклада ПЭ на циклобутановое ядро [7]. Учет этого канала тушения по приведенному выше алгоритму дает следующие параметры для CB14N: φQ = 0.95, φET = 0.5, φR = 0.45. Для CB14N φrPCA = 0.079, поэтому фактор распределения в интермедиате Х для этого циклобутана α = 0.18, что близко к значению для CB44N.
Таким образом, при переходе от CB14N к CB44N эффективность ПЭ φET уменьшается от 0.5 до 0.36, при этом увеличиваются как φR, от 0.45 до 0.52, так и φrPCA, от 0.079 до 0.11. Это согласуется с выводом, что в рассматриваемом ряду родственных циклобутанов процесс ПЭ BQ → NA конкурирует с реакцией ретро-ФЦП и приводит к снижению ее эффективности.
ЗАКЛЮЧЕНИЕ
Исследованы спектрально-люминесцентные свойства тетразамещенного циклобутана CB44N, имеющего у одной из сторон четырехчленного цикла два одинаковых вицинальных бензо[f]хинолиновых (BQ) заместителя, а у противоположной стороны цикла – две вицинальные фениленовые группы с окси-заместителями в пара-положении, которые связаны с удаленным нафтиленовым (NA) каркасом тетраметиленовыми “мостиками”.
В циклобутане CB44N под действием света, приводящего к возбуждению BQ заместителей, наблюдается индуктивно-резонансный (Фёрстеровский, FRET) перенос энергии (ПЭ) от BQ* к NA, приводящий к тушению BQ* и сенсибилизации NA, а также реакция раскрытия четырехчленного цикла (ретро-ФЦП). Предположено, что ретро-ФЦП инициируется процессом ПЭ от BQ* на циклобутановое ядро, в результате которого образуется интермедиат Х. Далее некоторая часть Х превращается в диаду, остальная часть возвращается в исходный циклобутан. Соотношение между двумя каналами превращения Х характеризуется фактором распределения α.
Квантовохимические DFT расчеты показали, что расстояние между центрами донорно-акцепторных пар BQ-NA в CB44N увеличивается по сравнению с циклобутаном CB14N, имеющим более короткий метиленовый мостик. Увеличение расстояния между BQ и NA коррелирует с уменьшением эффективности переноса энергии BQ → NA и увеличением квантового выхода реакции ретро-ФЦП. Полученные данные, а также сравнение свойств серии родственных циклобутанов показывают, что ПЭ BQ → NA является процессом, конкурирующим с реакцией ретро-ФЦП, поэтому спектрально-люминесцентные и фотохимические свойства циклобутанов зависят от длины метиленовых мостиков в этих соединениях.
Список литературы
Poplata S., Troster A., Zou Y.Q., Bach T. // Chem. Rev. 2016. V. 116. P. 9748.
Hoffmann N. // Chem. Rev. 2008. V. 108. P. 1052.
Ramamurthy V., Sivaguru J. // Chem. Rev. 2016. V. 116. P. 9914.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Ли В.М. // Химия высоких энергий. 2017. Т. 51. С. 216.
Budyka M.F., Gavrishova T.N., Potashova N.I., Li V.M. // ChemistrySelect. 2018. V. 3. P. 10651.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Федулова Ю.А. // Химия высоких энергий. 2019. Т. 53. С. 206.
Budyka M.F., Gavrishova T.N., Li V.M., Potashova N.I., Ushakov E.N. // ChemistrySelect. 2021. V. 6. P. 3218.
Budyka M.F., Gavrishova T.N., Li V.M., Potashova N.I., Fedulova J.A. // Spectrochim. Acta Part A. 2022. V. 267. P. 120565.
Nishimura J., Nakamura Y., Hayashida Y., Kudo T. // Acc. Chem. Res. 2000. V. 33. P. 679.
Russo V., Curutchet C., Mennucci B. // J. Phys. Chem. B. 2007. V. 111. P. 853.
Becker H.D. // Chem. Rev. 1993. V. 93. P. 145.
Gaussian 09, Revision B.01 // M.J. Frisch, G.W. Trucks, H.B. Schlegel, et al. Gaussian, Inc., Wallingford CT, 2010.
Buenker R.J., Peyerimho S.D. // Chem. Phys. 1975. V. 8. P. 56.
Dearden J.C., Forbes W.F. // Can. J. Chem. 1950. V. 37. P. 1305.
Braslavsky S.E., Fron E., Rodriguez H.B., Roman E.S., Scholes G.D., Schweitzer G., Valeur B., Wirz J. // Photochem. Photobiol. Sci. 2008. V. 7. P. 1444.
Nakamura Y., Kaneko M., Tani K., Shinmyozu T., Nishimura J. // J. Org. Chem. 2002. V. 67. P. 8706.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий