Химия высоких энергий, 2022, T. 56, № 6, стр. 456-469
Нульмерное моделирование СВЧ разряда в водном растворе этанола
Ю. А. Лебедев a, *, А. В. Татаринов a, И. Л. Эпштейн a, А. Ю. Титов a
a ФГБУН “Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук”
119991 Москва, Ленинский просп., 29, Россия
* E-mail: lebedev@ips.ac.ru
Поступила в редакцию 11.05.2022
После доработки 11.07.2022
Принята к публикации 12.07.2022
- EDN: NIIEAO
- DOI: 10.31857/S0023119322060110
Аннотация
В нульмерном приближении проведено моделирование СВЧ разряда внутри пузыря, заполненного СВЧ плазмой в парах воды и этилового спирта при давлении одной десятой атмосферы. В качестве параметра использовалась удельная мощность, поглощаемая разрядом. Для описания процессов в разряде в набор реакций, разработанный для описания термических процессов горения и детонации, были добавлены реакции с заряженными частицами для воды, спирта и продуктов их разложения. Расчетные концентрации основных продуктов разложения водного раствора спирта хорошо согласуются с имеющимися в литературе экспериментальными данными в широком диапазоне начального состава смеси и вложенной в разряд мощности.
ВВЕДЕНИЕ
В последнее время растет интерес к получению водорода и водородсодержащих газов. Предполагается, что водород станет безопасным и доступным источником энергии для устойчивого развития с точки зрения загрязнения воздуха, энергетической безопасности и изменения климата. Ответ на вопрос о том, может ли водород обеспечить мировые потребности в качестве энергоносителя не столь очевиден. Эта проблема детально рассматривается в [1]. Обосновывается вывод о том, что на начальном этапе развития водородной энергетики наиболее реальный путь преодоления сложных проблем транспортировки и хранения водорода – его рассредоточенное малотоннажное производство непосредственно в местах потребления.
В настоящее время проводятся широкие исследования по использованию водорода в качестве замены традиционных источников энергии. Водород удовлетворяет основному условию экологичности и в то же время имеет самую высокую теплотворную способность по сравнению с другими видами топлива (теплота, выделяющаяся при сгорании водорода, составляет 142 кДж/г по сравнению с 47 кДж/г для бензина, 29/7 кДж/г для этанола, 15 кДж/г для древесины, 27 кДж/г для угля и 54 кДж/г для природного газа [2]). Основными методами получения водорода из углеводородов (чаще других используется метан) являются паровая конверсия, углекислотная конверсия, парциальное окисление и пиролиз [3–5]. В последнее время большое внимание уделяется проблеме получения водорода с использованием низкотемпературной плазмы [6–9]. В задачах получения водорода используются разные типы электрических разрядов: барьерный, ВЧ, СВЧ, дуговые разряды.
Перспективным сырьем для получения водорода в плазме электрических разрядов являются спирты. В обзоре [10] рассмотрены физико-химические основы и механизмы плазменного риформинга этанола, получения водорода в условиях нетермической дуги, получение водорода в плазменно-каталитических системах, получение водорода в малогабаритных плазменных устройствах и др.
Интерес к спиртам в качестве исходного вещества для получения водорода вызвал появление публикаций по моделированию процессов в таких средах [11–14].
Одним из новых типов разряда, исследуемых с целью получения водорода, является СВЧ разряд в растворах спиртов.
В настоящей работе описаны результаты нульмерного моделирования процесса получения водорода в СВЧ разряде в водном растворе этанола. Результаты экспериментов описаны в [15, 16]. Разряд нестационарный и плазмохимические процессы протекают в газовом пузыре, находящемся внутри жидкости на конце СВЧ антенны. По истечению определенного времени, необходимого для увеличения размеров пузыря, обеспечивающего равенство нулю равнодействующей сил тяжести, архимедовой и поверхностного натяжения, пузырь отрывается от антенны и плазма в нем исчезает. В [16] представлена модель, описывающая процессы в остывающем после отрыва от антенны газовом пузыре. В настоящей работе описана модель процессов в газовом пузыре при возникновении плазмы до его отрыва от антенны.
ФОРМУЛИРОВКА ЗАДАЧИ
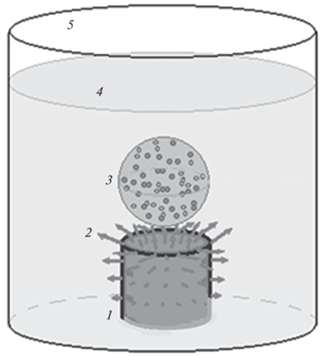
Рассчитывается покомпонентный состав и газовая температура внутри пузыря, заполненного СВЧ плазмой смеси паров воды и этилового спирта и их продуктов разложения (рис. 1). Пузырь окружен кипящей жидкостью, Т0 = 320 К. Давление p (Па) внутри пузыря постоянное, равное одной десятой атмосферы (соответствует условиям проведения экспериментов). Пузырь расположен на торце цилиндрической СВЧ антенны. Удельная мощность, поглощаемая разрядом от СВЧ источника (f = 2.45 ГГц) является заданным параметром. Начальные массовые доли паров воды и спирта задаются. Начальная температура газовой смеси внутри пузыря 320 К.
Рис. 1.
Схема плазменного реактора. 1 – СВЧ антенна, 2 – линии напряженности СВЧ поля, 3 – пузырь с плазмой в парах жидкости, 4 – жидкая смесь воды и этилового спирта, 5 – стеклянный стакан.
Для описания термических процессов используется набор реакций San Diego Mechanism (SDM) [17]. Кроме того, добавлены реакции с заряженными частицами (табл. 1).
Таблица 1.
Схема плазмо-химических процессов в смеси паров воды и этилового спирта
| № | Реакция | Тип реакции | Константы скоростей реакций (см3 ⋅ моль–1 ⋅ с–1; см6 ⋅ моль–2 ⋅ с–1); T (K), Te (эВ), если не отмечено в формуле отдельно | Лите-ратура |
|---|---|---|---|---|
| Вода | ||||
| (1) | e + H2O → H + OH + e | Диссоциация электронным ударом | k(E/N) | [25] |
| (2) | e + H2O → 2e + H2O+ | Ионизация электронным ударом | k(E/N) | [25] |
| (3) | e + H2O → H– + OH | Прилипание | k(E/N) | [25] |
| (4) | e + H2O → O– + H2 | k(E/N) | [25] | |
| (5) | e + H2O → OH– + H | k(E/N) | [25] | |
| (6) | e + O2 → O– + O | 6.44 × 1014$T_{{\text{e}}}^{{ - {\text{1}}{\text{.391}}}}{{{\text{e}}}^{{ - {\text{6}}{\text{.26/}}{{T}_{{\text{e}}}}}}}$ | [26] | |
| (7) | H2O++ H2O → H3O+ + OH | Перенос заряда | 3.01 × 1014 | [25] |
| (8) | H2O+ + H2 → H3O+ + H | 8.43 × 1014 | [25] | |
| (9) | H2O+ + O2 → ${\text{O}}_{2}^{ + }$ + H2O | 9.03 × 1013 | [25] | |
| (10) | H– + H2O→ OH– + H2 | 2.29 × 1015 | [25] | |
| (11) | ${\text{O}}_{2}^{ + }$ + 3H2O → H5${\text{O}}_{2}^{ + }$ + O2 + OH | 1.14 × 1015 | [25]a | |
| (12) | H– + e → 2e + H | Отлипание | 6.02 × 1017 | [27] |
| (13) | O– + e → 2e + O | 2.40 × 1016 | [27] | |
| (14) | O– + H2O+ → O + H2O | Ион-ионная рекомбинация | 6.20 × 1016 | [25] |
| (15) | OH– + H2O+ → OH + H2O | 6.32 × 1016 | [25] | |
| (16) | H– + H2O+ → H + H2O | 1.86 × 1017 | [25] | |
| (17) | e + H3O+ + H2O → H + 2H2O | Электронионная рекомбинация | 9.79 × 1024 | [27] |
| (18) | e + H5${\text{O}}_{2}^{ + }$ → H + 2H2O | 1.44 × 1018(0.026/Te)0.08 | [25] | |
| (19) | e + ${\text{O}}_{2}^{ + }$ → 2O | 1.20 × 1016(0.026/Te)1/2 | [25] | |
| (20) | H– + O2 → HO2 + e | Ассоциативное отлипание | 7.26 × 1014 | [25] |
| (21) | O– + O → O2 + e | 9.03 × 1013 | [25] | |
| (22) | OH– + H → H2O + e | 6.02 × 1014 | [25] | |
| (23) | OH– + HO2 → H2O + O2 + e | 6.02 × 1014 | [26] | |
| (24) | H2 + O– → H2O + e | 3.61 × 1014 | [25] | |
| Этиловый спирт | ||||
| (25) | C2H5OH + e → CH3O+ + 2e + CH3 | Ионизация электронным ударом | k(E/N) | [21] |
| (26) | C2H5OH + e → C2H5O+ + 2e + H | k(E/N) | [21] | |
| (27) | C2H5OH + e → C2H5OH+ + 2e | k(E/N) | [21] | |
| (28) | CO + e → CO+ + 2e | k(E/N) | [28] | |
| (29) | H2 + e → ${\text{H}}_{2}^{ + }$ + 2e | k(E/N) | [28] | |
| (30) | e + H → H+ + 2e | k(E/N) | [28] | |
| (31) | e + C → C+ + 2e | k(E/N) | [28] | |
| (32) | e + O → O+ + 2e | k(E/N) | [28] | |
| (33) | C2H5OH + e → CH3CHO + H2 + e | Диссоциация электронным ударом | k(E/N) | [22] |
| (34) | C2H5OH + e → CH4 + CH2O + e | k(E/N) | [22] | |
| (35) | C2H4 + e → C2H3 + H + e | k(E/N) | [28] | |
| (36) | C2H4 + e → C2H2 + H2 + e | k(E/N) | [28] | |
| (37) | C2H2 + e → C2H + H + e | k(E/N) | [28] | |
| (38) | CH4 + e → CH3 + H + e | k(E/N) | [28] | |
| (39) | C2H5OH + e → H– + CH3CH2O | Прилипание | k(E/N) | [23] |
| (40) | C2H5OH + e → C2H4O– + H2 | k(E/N) | [23] | |
| (41) | C2H5OH + e → C2H5O– + H | k(E/N) | [23] | |
| (42) | e + CO2 → O– + CO | k(E/N) | [28] | |
| (43) | CO + e → O– + C | k(E/N) | [28] | |
| (44) | C2H5O– + H3O+ → C2H5OH + H2O | Ионионная рекомбинация | 6.02 × 1016 (по аналогии) | |
| (45) | C2H4O– + H2O+ → CH3CHO + H2O | 6.02 × 1016 (по аналогии) | ||
| (46) | ${\text{H}}_{3}^{ + }$ + H– → 2H2 | 1.38 × 1017 | [29] | |
| (47) | ${\text{H}}_{2}^{ + }$ + H– → H2 + H | 1.38 × 1017 | [29] | |
| (48) | ${\text{H}}_{2}^{ + }$ + O– → H2 + O | 6.02 × 1016 | [29] | |
| (49) | ${\text{H}}_{2}^{ + }$ + OH– → H2 + OH | 1.16 × 1017 | [29] | |
| (50) | ${\text{H}}_{2}^{ + }$ + OH– → 2H + OH | 6.02 × 1016 | [29] | |
| (51) | ${\text{H}}_{2}^{ + }$ + OH– → H + O + H2 | 6.02 × 1016 | [29] | |
| (52) | ${\text{H}}_{2}^{ + }$ + OH– → 3H + O | 6.02 × 1016 | [29] | |
| (53) | CO+ + OH– → CO + OH | 1.16 × 1017 | [29] | |
| (54) | CO+ + OH– → O + CO + H | Ионионная рекомбинация | 6.02 × 1016 | [29] |
| (55) | ${\text{H}}_{3}^{ + }$ + OH– → OH + H + H2 | 6.02 × 1016 | [29] | |
| (56) | ${\text{H}}_{3}^{ + }$ + OH– → O + 2H + H2 | 6.02 × 1016 | [29] | |
| (57) | C2H4O– + H3O+ → C2H4O + H2O + H | 6.02 × 1016 (по аналогии) | ||
| (58) | H+ + H– → 2H | 1.385 × 1017 | [29] | |
| (59) | H– + O+ → H + O | 1.385 × 1017 | [29] | |
| (60) | O+ + O– → 2O | 2.40 × 1016 | [29] | |
| (61) | ${\text{O}}_{2}^{ + }$ + O– → O + O2 | 1.60 × 1016 | [29] | |
| (62) | ${\text{O}}_{2}^{ + }$ + O– → 3O | 1.60 × 1016 | [29] | |
| (63) | ${\text{O}}_{2}^{ + }$ + O– + O2 → O3 + O2 | 7.25 × 1016 | [29] | |
| (64) | ${\text{O}}_{2}^{ + }$ + ${\text{O}}_{2}^{ - }$ → 2O2 | 1.20 × 1017 | [29] | |
| (65) | ${\text{O}}_{2}^{ + }$ + ${\text{O}}_{2}^{ - }$ → O2 + 2O | 6.02 × 1016 | [29] | |
| (66) | ${\text{O}}_{2}^{ + }$ + ${\text{O}}_{3}^{ - }$ → O2 + O3 | 1.20 × 1017 | [29] | |
| (67) | ${\text{O}}_{2}^{ + }$ + ${\text{O}}_{3}^{ - }$ → 3O + O2 | 6.02 × 1016 | [29] | |
| (68) | H– + ${\text{O}}_{2}^{ + }$ → H + O2 | 1.20 × 1017 | [29] | |
| (69) | H– + ${\text{O}}_{2}^{ + }$ → H + 2O | 6.02 × 1016 | [29] | |
| (70) | OH– + ${\text{O}}_{2}^{ + }$ → OH + O2 | 1.20 × 1017 | [29] | |
| (71) | OH– + ${\text{O}}_{2}^{ + }$ → H + O2 + O | 6.02 × 1016 | [29] | |
| (72) | OH– + ${\text{O}}_{2}^{ + }$ → H + 3O | 6.02 × 1016 | [29] | |
| (73) | OH– + ${\text{O}}_{2}^{ + }$ → 2O + OH | 6.02 × 1016 | [29] | |
| (74) | CH3O+ + e → HCO + H2 | Электронионная рекомбинация | 6.02 × 1016 (по аналогии) | |
| (75) | C2H5O+ + e → CH3 + CH2O | 6.02 × 1016 (по аналогии) | ||
| (76) | C2H5OH+ + e → CH3CHOH + H | 6.02 × 1016 (по аналогии) | ||
| (77) | C2H5OH+ + e → CH2OH + CH3 | 6.02 × 1016 (по аналогии) | ||
| (78) | C2H5OH+ + e → CH4 + CH2O | 6.02 × 1016 (по аналогии) | ||
| (79) | C2H5OH+ + e → CH3CHO + H2 | 6.02 × 1016 (по аналогии) | ||
| (80) | ${\text{H}}_{2}^{ + }$ + e → H + H | 6.02 × 1016 | [29] | |
| (81) | ${\text{H}}_{3}^{ + }$ + e → H2 + H | 6.02 × 1016 | [29] | |
| (82) | CO+ + e → C + O | Электронионная рекомбинация | 3.81 × 1018(1/Te)0.55 | [29] |
| (83) | H+ + 2e → e + H | 3.20 × 10–3$T_{{\text{e}}}^{{ - 4.5}}$ | [29] | |
| (84) | O+ + 2e → e + O | 2.60 × 104(Te [K]/300)–4.5 | [29] | |
| (85) | e + O+ + M → M + O | 2.20 × 109(Te [K]/300)–1.5 | [29] | |
| (86) | e + H3O+ → OH + H2 | 8.43 × 103$T_{{\text{e}}}^{{ - 0.7}}$ | [29] | |
| (87) | e + H3O+ → OH + 2H | 3.60 × 104$T_{{\text{e}}}^{{ - 0.7}}$ | [29] | |
| (88) | e + H3O+ → H2O + H | 1.5 × 104$T_{{\text{e}}}^{{ - 0.7}}$ | [29] | |
| (89) | CO+ + O2 → CO + ${\text{O}}_{2}^{ + }$ | Перенос заряда | 7.2 × 1013 | [29] |
| (90) | ${\text{H}}_{2}^{ + }$ + H2→ ${\text{H}}_{3}^{ + }$ + H | 1.20 × 1015 | [29] | |
| (91) | ${\text{H}}_{2}^{ + }$ + CO → CO+ + H2 | 3.88 × 1014 | [29] | |
| (92) | O– + H2 → OH– + H | 1.80 × 1013 | [29] | |
| (93) | O– + O2 → ${\text{O}}_{2}^{ - }$ + O | 6.02 × 1013 | [29] | |
| (94) | ${\text{O}}_{2}^{ - }$ + O → O– + O2 | 9.00 × 1013(T/300)0.5 | [29] | |
| (95) | O– + O2 + M → ${\text{O}}_{3}^{ - }$ + M | 4.00 × 1013(300/T) | [29] | |
| (96) | O– + O3 → O + ${\text{O}}_{3}^{ - }$ | 3.18 × 1014 | [29] | |
| (97) | ${\text{O}}_{2}^{ - }$ + O3 → O2 + ${\text{O}}_{3}^{ - }$ | 2.40 × 1014 | [29] | |
| (98) | ${\text{O}}_{3}^{ - }$ + O → O2 + ${\text{O}}_{2}^{ - }$ | 1.92 × 1014 | [29] | |
| (99) | C+ + O2 → O+ + CO | 3.73 × 1014 | [29] | |
| (100) | C+ + O2 → CO+ + O | 2.29 × 1014 | [29] | |
| (101) | C+ + OH → CO+ + H | 4.64 × 1014 | [29] | |
| (102) | C+ + CO2 → CO+ + CO | 6.62 × 1014 | [29] | |
| (103) | H+ + O2 → H + ${\text{O}}_{2}^{ + }$ | 1.20 × 1015 | [29] | |
| (104) | H+ + O → H + O+ | 2.10 × 1014 | [29] | |
| (105) | H+ + H2O → H2O+ + H | 4.15 × 1015 | [29] | |
| (106) | O+ + H → H+ + O | 3.50 × 1014 | [29] | |
| (107) | O+ + O2 → ${\text{O}}_{2}^{ + }$ + O | 1.20 × 1013 | [29] | |
| (108) | O+ + OH → ${\text{O}}_{2}^{ + }$ + H | 2.20 × 1014 | [29] | |
| (109) | O+ + H2O → H2O+ + O | 1.90 × 1015 | [29] | |
| (110) | ${\text{O}}_{2}^{ + }$ + C → CO+ + O | Перенос заряда | 3.10 × 1013 | [29] |
| (111) | ${\text{O}}_{2}^{ + }$ + C → C+ + O2 | 3.10 × 1013 | [29] | |
| (112) | ${\text{O}}_{2}^{ + }$ + C2 → CO+ + CO | 2.50 × 1014 | [29] | |
| (113) | O– + H → OH + e | Ассоциативное отлипание | 3.00 × 1014 | [29] |
| (114) | O– + CO → CO2 + e | 3.90 × 1014 | [29] | |
| (115) | ${\text{O}}_{3}^{ - }$ + O → 2O2 + e | 1.80 × 1014 | [29] | |
| (116) | O + O– → O2 + e | 9.00 × 1013 | [29] | |
| (117) | C2H4O– + H2 → C2H5OH + e | 6.02 × 1013 | [29] | |
| (118) | C2H5O– + H → C2H5OH + e | 6.02 × 1013 | [29] | |
| (119) | C2H + OH ↔ C2 + H2O | Дополнит. реакции с нейтралами | 3.00 × 1013 | [30] |
| (120) | C + OH ↔ CO + H | 5.00 × 1013 | [30] | |
| (121) | C + O2 ↔ CO + O | 1.20 × 1014exp(–2014/T) | [30] | |
| (122) | C + T-CH2 ↔ C2H + H | 5.00 × 1013 | [30] | |
| (123) | C2 + H2 ↔ C2H + H | 6.62 × 1013exp(–4002/T) | [30] | |
| (124) | C2 + O ↔ C + CO | 3.60 × 1014 | [30] | |
| (125) | C2 + O2 ↔ 2CO | 8.97 × 1012exp(–493/T) | [30] | |
| (126) | C2 + OH ↔ C2O + H | 5.00 × 1013 | [30] | |
| (127) | H2O + C ↔ CH + OH | 7.83×1011T0.67exp(–19785/T) | [30] | |
| (110) | 2CH ↔ C2 + H2 | 5.00 × 1011 | [30] | |
| (128) | T-CH2 + M ↔ C + H2 + M | 9.64 × 1025exp(–32220/T) | [30] | |
| (129) | CH + O ↔ C + OH | 1.52 × 1013exp(–2381/T) | [30] | |
| (130) | CH + H ↔ C + H2 | 7.89 × 1013exp(–81/T) | [30] | |
| (131) | C + CH3 ↔ C2H2 + H | 5.00 × 107 | [30] | |
| (132) | 2C + M ↔ C2 + M | 3.00 × 102exp(503/T) | [30] | |
| (133) | C + CH ↔ C2 + H | 5.00 × 1013 | [30] | |
a Ион H5${\text{O}}_{2}^{ + }$ образуется в результате последовательности реакций: ${\text{O}}_{2}^{ + }\xrightarrow{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}_{3}^{ + }\xrightarrow{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}{{{\text{H}}}_{{\text{4}}}}{\text{O}}_{2}^{ + }\xrightarrow{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}}_{2}^{ + }$. Анализ показал, что первый шаг в этой последовательности является самым медленным. Мы записали образование иона в результате реакции с константой скорости второго порядка, соответствующей первому шагу приведенной выше последовательности [31].
Расчеты проводились для смеси воды со спиртом для 4 значений поглощенной удельной мощности: 0.5, 1, 1.5, 2 кВт/см3 и для 4 составов начальной смеси: 100, 80, 50 и 10 об. % спирта.
Моделирование проводилось при помощи программы Comsol 3.5a [18], использующей метод конечных элементов.
Проведено сравнение продуктов распада с экспериментальными данными из работы [16].
Уравнение баланса для массовой доли газообразных продуктов
В рамках нульмерной модели при постоянном давлении уравнения баланса для газообразных частиц записываются в виде
Здесь ${{w}_{i}}$ – безразмерная массовая доля i-й компоненты газовой смеси; $\rho $ – плотность газовой смеси (кг/м3), ${{M}_{i}}$ – масса моля i-й компоненты (кг/моль); а ${{R}_{i}}$ описывает скорости реакций механизмов образования и потерь частиц газовой смеси (моль⋅м–3 ⋅ c–1). Связь между величинами ${{w}_{i}}$ и $\rho $ определяется выражением:
где R = 8.31 (Дж ⋅ моль–1 · К–1) – универсальная газовая постоянная. Связь между мольной концентрацией i-го компонента газовой смеси ${{c}_{i}}$ (моль/м3) и его массовой долей ${{w}_{i}}$ определяется выражением:
Источниковый член в (1) записывается в виде:
где первая группа слагаемых в скобках относится к реакциям первого порядка, вторая группа – к реакциям второго порядка, а третья – к реакциям третьего порядка, а ${{k}_{j}}$ – коэффициенты скоростей реакций j-го порядка ((м3/моль)j–1 ⋅ c–1).
Уравнение баланса энергии газовой смеси
Для идеальной газовой смеси энергетический баланс реактора равен
(2)
$\begin{gathered} {{V}_{r}}\rho \mathop \sum \limits_{i = 1}^N \left( {\frac{{{{w}_{i}}}}{{{{M}_{i}}}}{{C}_{{p,i}}}} \right)\frac{{dT}}{{dt}} = Q + \\ + \,\,\alpha {{V}_{r}}\left( {P - \mathop \sum \limits_l {{Q}_{{ek}}}{{r}_{k}}} \right) - \frac{{8{{V}_{r}}}}{{{{R}^{2}}}}\lambda \left( T \right)\left( {T - {{T}_{0}}} \right). \\ \end{gathered} $Здесь T – газовая температура (К), а ${{V}_{r}}$ – объем плазменного пузыря. Теплоемкость каждой компоненты ${{C}_{{p,i}}}$ (Дж ⋅ моль–1 · К–1) вычисляется на основе термодинамических полиномов:
где ${{a}_{{1i}}}$ – ${{a}_{{5i}}}$ известные полиномиальные коэффициенты i-й компоненты, $Q$ – тепло, выделяемое или поглощаемое химическими реакциями (Дж/c):
Здесь ${{r}_{k}}$ – скорость k-й химической реакции (моль ⋅ м–3 ⋅ c–1)). ${{H}_{k}} = - \sum\nolimits_{l = 1}^L {{{\nu }_{{lk}}}{{h}_{l}}} $ – энтальпия k-й реакции (Дж/моль), где ${{\nu }_{{lk}}}$ – стехиометрический коэффициент l-й компоненты в к-й реакции, определяемый как положительный для реагентов и отрицательный для продуктов. Второй член в правой части уравнения (2) описывает энергию, идущую на нагрев газа от СВЧ-поля, α – доля СВЧ-энергии, уходящая в тепло без учета энергии уходящей на диссоциацию, ионизацию и прилипание. В расчетах величина α варьировалась от 0.7 до 0.9. Величина ${{Q}_{{ek}}}$ учитывается для реакций, идущих под электронным ударом. Мы предполагали, что на эти процессы уходит энергия, требуемая для преодоления порога этих реакций. Для ${{Q}_{{ek}}}$ использовалось выражение ${{u}_{k}}{\text{e}}{{N}_{{\text{A}}}}$ [18], где e – заряд электрона, ${\text{e\; = \;1}}{\text{.60}} \times {\text{1}}{{{\text{0}}}^{{ - {\text{19}}}}}$ (Кл) , ${{u}_{k}} - $ порог k-й реакции под электронным ударом (eV) , ${{N}_{{\text{A}}}}$ = = $~{\text{6}}{\text{.02}} \times {\text{1}}{{{\text{0}}}^{{23}}}$ (моль–1) – число Авогадро.
Энтальпия i-й компоненты газовой смеси ${{h}_{i}}$ (Дж/моль) связана с температурой термодинамическим полиномом (К):
В нашем случае удельная мощность $P$ (Вт/м3), поглощаемая в плазме, является заданным параметром.
В задаче учитывалась потеря тепла за счет теплопроводности с помощью приближенного выражения $\frac{{8{{V}_{r}}}}{{{{R}^{2}}}}\lambda \left( T \right)\left( {T - {{T}_{0}}} \right)$, где R – радиус пузыря (м). Для простоты считалось, что коэффициенты теплопроводности всех компонент газовой смеси одинаковы и равны коэффициенту теплопроводности $\lambda \left( T \right)$ (Дж ⋅ c–1 · м–1 · К–1) для молекулярного водорода. Такое допущение соответствует максимальному отводу тепла.
Вычисление среднего поля в плазме
Будем считать, что величина P постоянна во времени
где $\sigma $ – электронная проводимость плазмы (Ом–1 ⋅ ⋅ c–1), а Е – некоторое однородное по пространству пузыря поле внутри плазмы (В ⋅ м–1). Проводимость плазмы [19]
определяется электронной плотностью ${{n}_{e}} = {{c}_{e}}{{N}_{{\text{A}}}}$ (м–3), частотой СВЧ поля $\omega $ (Гц) и частотой столкновений электронов с тяжелыми нейтральными частицами плазмы
$\nu $ (Гц). Здесь 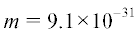 (кг) масса электрона.
(кг) масса электрона.
СВЧ поле в плазме вычисляется из (3): $E = \sqrt {P{{\sigma }^{{ - 1}}}} $ (В/м) и используется для вычисления приведенного поля E/N, которое необходимо для вычисления констант скоростей реакций под электронным ударом.
Уравнение Больцмана
Для определения функции распределения электронов по энергиям (ФРЭЭ) используется уравнение Больцмана, записанное в двучленном приближении разложения ФРЭЭ по сферическим гармоникам. Константы скорости реакций электронных процессов рассчитываются с помощью набора соответствующих сечений реакций и ФРЭЭ и являются функциями значений приведенного поля E/N. Для упрощения расчетов ФРЭЭ рассчитывалась для состава смеси Н2 – 66 об. %, СО – 34 об. %, приведенного в работе [16]. В данной работе ФРЭЭ была рассчитана с помощью программы BOLSIG+ [20] и набора сечений столкновений электронов с молекулами смеси.
Процессы в плазме
Список нейтральных компонент, учитываемый при моделировании процессов в плазме следующий: H, O2, OH, O, H2, H2O, HO2, H2O2, CO, CO2, HCO, CH3, CH4, CH2O, T–CH2, S–CH2, C2H4, CH3O, C2H5, C2H6, CH, C2H2, CHCHO, C2H4OOH, OC2H3OOH, C2H3, CH2CHO, C2H4O, HCCO, CH2CO, C2H, CH2OH, CH3OH, CH3CHO, CH3CO, C2H5OH, CH2CH2OH, CH3CHOH, CH3CH2O, C3H4, C3H3, C3H5, C3H6, C3H8, I–C3H7, N–C3H7, C3H6OOH, OC3H5OOH, C4H10, P–C4H9, S-C4H9, C4H8, S–C4H9O2 [CH3CH2CH(CH3)OO], C4H8OOH– 1-3 [CH2CH2CH(CH3)OOH], N–C4KET–1-3 [CHOCH2CH(CH3)OOH], O3, C, C2, C2O.
Список учитываемых заряженных частиц: H2O+, H3O+, ${{{\text{H}}}_{{\text{5}}}}{\text{O}}_{2}^{ + }$, CO+, C2H5OH+, C2H5O+, CH3O+, H+, ${\text{H}}_{2}^{ + }$, ${\text{H}}_{3}^{ + }$, O+, ${\text{O}}_{2}^{ + }$, C+, e, H–, O–, ${\text{O}}_{2}^{ - }$, ${\text{O}}_{3}^{ - }$, OH–, C2H5O–, C2H4O–, CH3O–.
Схема кинетических процессов, добавленных нами к набору реакций SDM представлена в табл. 1. В набор нейтральных продуктов разложения были добавлены С и С2.
В качестве электронных процессов нами рассматривались: прямая ионизация, диссоциация, прилипание, отлипание и электрон-ионная рекомбинация. Если для воды сечения всех электронных процессов известны, то для этилового спирта данных мало. В частности, есть данные для парциальных и полного сечения ионизации [21]. Для сечения диссоциации этанола нами использовались данные, полученные в работе [22] для возбуждения нижних электронных состояний этанола. В работе [23] при исследовании диссоциативного прилипания электрона в метиловом и этиловом спиртах было показано, что зависимости выхода иона Н– от энергии электронов имеют одинаковую резонансную структуру с максимумами 6.3 и 7.9 эВ. Аналогичная структура наблюдается и в воде при диссоциативном прилипании электрона с отрывом атома Н от гидроксильной группы. Поэтому для сечения реакции диссоциативного прилипания этилового спирта использовали сечение реакции
Значение константы отлипания для отрицательных ионов спирта нам не известны, в расчете константа отлипания взята типичной для подобных процессов равная 6 × 1013 см3/моль c.
В схему процессов добавлен набор ион-молекулярных реакций, позволяющий точнее определить ионный состав плазмы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
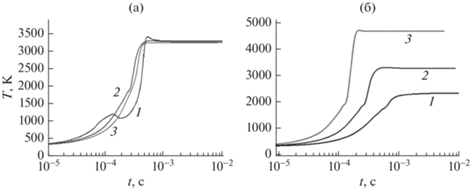
На рис. 2 приведены зависимости температуры газа от времени при различном начальном составе смеси и при различном энерговкладе. Температура начинает расти на временах 10–5–10–4 с. С увеличением удельной мощности рост температуры начинается на меньших временах, ее рост более резкий и ее установившееся значение выше. Влияние начального состава смеси незначительно. Оно, очевидно, обусловлено тепловыми эффектами различных химических процессов.
Рис. 2.
Зависимости температуры газа от времени: (a) при постоянной удельной мощности Руд = 1 кВт/см3: 1 – 10 об. % спирта; 2 – 50 об. %; 3 – 80 об. %; (б) при постоянном составе 50 об. % спирта: 1 – Руд = 0.5 кВт/см3; 2 – Руд = = 1 кВт/см3; 3 – Руд = 2 кВт/см3.
Основными продуктами разложения смеси воды и спирта являются (рис. 3a) водород и СО. При таких удельных мощностях вода и спирт полностью разлагаются на временах порядка 10–3 с.
Рис. 3.
Изменение концентраций по времени: (а) газовых продуктов разложения, где 1 – C2H5OH; 2 – H2O; 3 – H2; 4 – H; 5 – CO; 6 – CH4; 7 – C2H4; 8 – C2H2; (б) заряженных частиц, где 1 – электроны, 2 – H+, 3 – OH–, 4 – C2H5O+, 5 – ${\text{H}}_{3}^{ + }$, 6 – C+. Начальная концентрация этилового спирта – 50 об. %, Руд = 1 кВт/см3.
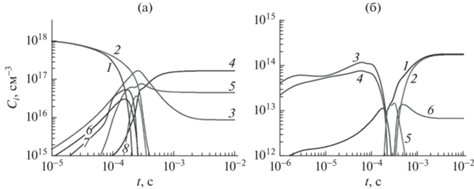
На рис. 3б показана эволюция ионного состава. На временах менее 10–4 с основными заряженными частицами являются ионы ОН– и С2Н5О+. При больших временах отрицательный заряд сформирован электронами, а положительный ионами Н+. При удельной мощности менее 1 кВт/см3 на временах больших 10–3 с электроны компенсируются ионом Н3О+.
Описанная эволюция ионного состава характерна для любого начального состава смеси. Концентрация электронов растет с увеличением вложенной мощности в интервале 2 × 1013–1015 см–3.
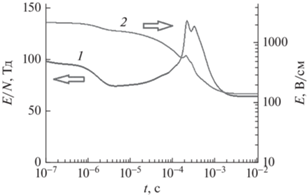
СВЧ поле отслеживает поведение электронов. Так как концентрация электронов растет, то значение поля падает от 2000 до 150 В/см. Приведенное поле E/N пропорционально Е и Т, поэтому оно имеет максимум. Последний находится на временах порядка 3–5 × 10–4 с. В этом интервале будет находиться и максимум процессов под электронным ударом. Интервал изменения E/N – в пределах 50–150 Тд (рис. 4).
Рис. 4.
Изменение: 1 – приведенного поля E/N и 2 – СВЧ поля E по времени. Руд = 1 кВт/см3, начальная концентрация этилового спирта – 50 об. %.
Влияние электронных процессов на характеристики разряда
На рис. 5 и 6 представлены результаты расчетов полной схемы с учетом кинетических процессов с заряженными частицами и схемы, включающей чисто термические процессы, без электронных и ионных процессов.
Рис. 5.
Основные радикалы в продуктах разложения смеси воды и спирта: (а) – полная схема, включающая процессы под электронным ударом, (б) – схема пиролиза той же смеси, не включающая процессы под электронным ударом. 1 – H, 2 – СH2O, 3 – СH3, 4 – OH, 5 – HCO. Начальное значение – 50 об. % этилового спирта при значении поглощенной удельной мощности 1 кВт/см3.
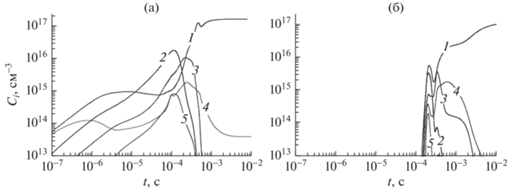
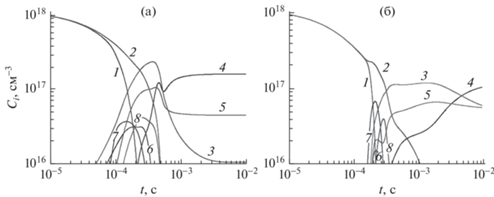
Рис. 6.
Основные газовые продукты разложения смеси воды. Слева – полная схема, включающая процессы под электронным ударом, справа – схема пиролиза той же смеси, не включающая процессы под электронным ударом. 1 – C2H5OH, 2 – H2O, 3 – H2, 4 – H, 5 – CO, 6 – CH4, 7 – C2H4, 8 – C2H2. Начальное значение – 50 об. % этилового спирта при значении поглощенной удельной мощности 1 кВт/см3.
Наличие СВЧ разряда в пузырьке газа на начальных временах приводит к двум эффектам: к росту газовой температуры и к протеканию химических процессов с заряженными частицами. На временах до 10–7 с температура газа практически не меняется. На этих временах происходит небольшое разложение воды за счет процессов с заряженными частицами. Основные из них это процессы диссоциации под электронным ударом и ион-молекулярной реакции
и ион-молекулярная реакция
Эти процессы приводят к появлению радикалов Н, ОН, СН3 (рис. 5), которые вызывают протекание различных процессов с нейтральными молекулами наряду с электронными процессами. Основная диссоциация начинается на временах, превышающих 10–4 с. Для разложения спирта на этих временах имеют значения как реакции с электронами, так и реакции с нейтральными частицами, причем наличие электронных процессов увеличивает степень разложения спирта. Аналогичный эффект мы видим и для диссоциации паров воды (рис. 6).
Основные процессы образования водорода и окиси углерода
Рассмотрим теперь основные каналы получения водорода и окиси углерода. Проведенный анализ показал, что на временах до 10−4 с основными процессами образования водорода являются реакции диссоциации спирта
и реакция переноса заряда
На временах порядка 10–4 с, наряду с приведенными выше реакциями с заряженными частицами, важными являются реакции взаимодействия атома Н с продуктами распада спирта и воды: C2H4, C2H6, CH2O, C2H3 и т.д. Основной реакцией гибели молекулярного водорода являются реакция
и реакции
Таким образом на временах, превышающих 10–4 с, на концентрацию водорода влияют как процессы с заряженными частицами, так и процессы с нейтральными молекулами. Основными процессами, приводящими к образованию окиси углерода, являются реакции
Причем первые две реакции являются основными реакциями образования CO на временах меньших 10–4 с. Все эти процессы протекают при наличии радикалов Н, HCO, СН3. Так как учет электронных процессов приводит к появлению этих радикалов на малых временах, то образование СО начинается на более ранних временах при учете процессов с заряженными частицами. Гибель CO происходит в основном в реакциях
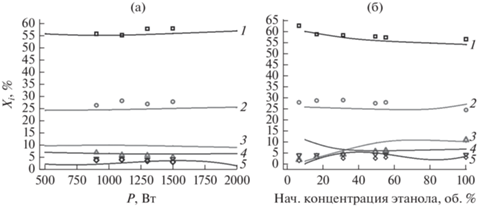
В работе [16] проведены результаты хроматографических измерений продуктов распада в СВЧ (f = 2.45 ГГц) плазме смеси воды и этилового спирта при пониженном давлении 0.1 атм. Диапазон вкладываемой в разряд мощности составлял 900–1500 Вт. Измерения продуктов распада проводились для различного начального состава газовой смеси. Ниже на рис. 8 результаты измерений показаны отдельными символами.
Сравнение результатов нульмерного расчета с данными эксперимента достаточно сложная задача. Сразу нужно отметить, что сравнение с результатами экспериментов показывает, что стационарный состав продуктов, полученный при кинетических расчетах, и результаты термодинамических расчетов не согласуются с данными экспериментов. Это может означать, что пузырь отрывается от антенны на временах, меньших времени достижения стационара. Предположим, что экспериментальные данные о компонентном составе соответствуют составу продуктов разложения в пузыре в момент его отрыва от антенны. Для определения момента отрыва мы использовали данные работы [16], в которой отмечено, что максимальный диаметр плазменного образования порядка 1 см.
Предположим, также, что зажигание плазмы соответствует моменту, когда диаметр расширяющегося кипящего пузыря становится порядка диаметра цилиндрического торца антенны (рис. 7а). Обоснованием такого предположения являются наши расчеты структуры СВЧ поля у торца цилиндрической антенны [24]. В этом случае максимальное поле, сконцентрированное вблизи кромки антенны и именно там происходит пробой газа. В настоящей работе диаметр антенны соответствовал эксперименту и был равен 4 мм [15]. Поэтому начальный объем пузыря в нашем расчете определяется размером антенны. Из условия сохранения массы смеси, зная начальный и конечный диаметр пузыря, мы находили момент времени отрыва пузыря. Именно в этот момент производится сравнение с экспериментальными данными (рис. 7б). По результатам расчетов время отрыва пузыря от антенны для всех режимов находится в интервале 0.1–0.6 мс.
Рис. 7.
Схематическое изображение кипящего пузыря: (а) в момент зажигания разряда; (б) в момент отрыва от антенны.
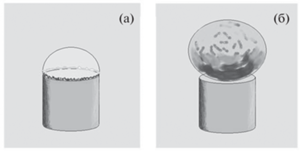
Рис. 8.
(а) Зависимости содержания газовых продуктов разложения в экспериментах (символы) и расчетах (линии) от поглощенной мощности. ◻, 1 – водород; ⚪, 2 – СО; △, 3 – С2Н2, ▽, 4 – СН4, ◇, 5 – С2Н4. Начальная концентрация этилового спирта 50 об. %. (б) Зависимости содержания газовых продуктов разложения в экспериментах (символы) и расчетах (линии) от начальной концентрации этанола. ◻, 1 – водород, ⚪, 2 – СО, △, 3 – С2Н2, ▽, 4 – СН4, ◇, 5 – С2Н4. Поглощенная мощность Р = 1500 Вт.
Мы понимаем, что используемый нами алгоритм связи результатов расчетов с данными экспериментов не вполне корректен и основан на ряде предположений. Для более точного соотнесения расчетных и экспериментальных результатов требуется по меньшей мере одномерная модель.
Поскольку при хроматографическом анализе пары воды не учитывались, то приводимые на графиках объемные проценты всех компонент рассчитывались без учета воды. Концентрации каждого из основных получаемых нами углеводородов (ацетилена, метана и этилена) не превышают 10 об. %. Концентрации указанных углеводородов не изменяются при повышении мощности. Концентрация ацетилена растет с увеличением начальной доли этилового спирта, что подтверждается экспериментом.
Основными продуктами для всех режимов являются водород и СО в примерном отношении 2 : 1. Их концентрации слабо зависят от вложенной мощности и начального состава смеси (рис. 8).
ЗАКЛЮЧЕНИЕ
В нульмерном приближении проведено моделирование СВЧ разряда внутри пузыря, заполненного СВЧ плазмой в парах воды и этилового спирта при давлении одной десятой атмосферы. Пузырь окружен кипящей жидкостью, Т0 = 320 К. В качестве параметра использовалась удельная мощность, поглощаемая разрядом. Для описания процессов в разряде в набор реакций, разработанный для описания термических процессов горения и детонации [17], были добавлены реакции с заряженными частицами для воды, спирта и продуктов их разложения (табл. 1).
Основные результаты могут быть сформулированы следующим образом.
1. Влияние на нагрев газа тепловых эффектов различных химических процессов намного меньше влияния СВЧ поля.
2. Сравнение с данными экспериментов показывает, что стационарный состав продуктов, полученный при кинетических расчетах, и результаты термодинамических расчетов не согласуются с данными экспериментов. Это объясняется тем, что из экспериментов известно, что разряд является нестационарным (разряд отрывается от антенны) и полученные в экспериментах результаты соответствуют меньшим временам, чем время выхода на стационар. Нами был предложен способ определения времени отрыва от антенны пузыря, позволивший провести сравнение нашего расчета с экспериментальными данными [16].
3. Основными продуктами разложения водного раствора спирта являются водород и окись углерода. Их расчетные концентрации хорошо согласуются с экспериментальными данными [16] и слабо зависят от вложенной мощности и начального состава смеси.
4. Электронные и ионные процессы особенно важны на начальных временах, когда температура газа близка к температуре кипения начальной смеси и термические процессы не проходят. На этих временах за счет процессов с заряженными частицами образуются радикалы, наличие которых обеспечивает протекание термических процессов. На временах больших 10–4–10–3 с процессы с заряженными частицами также влияют, так как на этих временах наблюдается максимум приведенного поля (рис. 5) и скорости их по величине сравнимы со скоростями термических процессов.
5. Рассчитанная концентрация электронов находится в диапазоне от 2 × 1013 до 1015 см–3. Основным отрицательным ионом был ион OH–, а основными положительными ионами были ионы С2Н5О+, Н3О+ и H+.
Список литературы
Арутюнов В.С. // Горение и плазмохимия. 2021. Т. 19. С. 245.
Holladay J.D., Hu J., King D.L., Wang Y. // Catal. Today. 2009. V. 139. P. 244.
Abbas H.F., Wan Daud W.M.A. // Int. J. Hydrogen Energy. 2010. V. 35. P. 1160.
Dincer I., Acar C. // Int. J. Hydrogen Energy. 2015. V. 40. P. 11094.
Nikolaidis P., Poullikkas A. // Renew. Sustain Energy Rev. 2017. V. 67. P. 597.
Словецкий Д.И. // Химия высоких энергий. 2006. Т. 40. № 2. С. 112.
Burlica R., Shih K.Y., Hnatiuc B., Locke B.R. // Ind. Eng. Chem. Res. 2011. V. 50. P. 9466.
Mizeraczyk J., Urashima K., Jasinski M., Dors M. // Int. J. of Plasma Envir. Sci. & Technol. 2014. V. 8. № 2.
Mizeraczyk J., Jasinski M. // Eur. Phys. J. Appl. Phys. 2016. V. 75. P. 24702.
Yan Y. and Du C. Hydrogen Generation from Ethanol using Plasma Reforming Technology. Zhejiang University Press, Hangzhou and Springer Nature Singapore Pte Ltd. 2017.
Bundaleska N., Tsyganov D., Tatarova E., Dias F.M., Ferreira C.M. // International Energy of Hydrogen Energy. 2014. V. 39. P. 5663.
Levko D.S., Tsymbalyuk A.N., Shchedrin A.I. // Physics Reports. 2012, V. 38. № 11. P. 913.
Щедрин А.И., Левко Д.С., Черняк В.Я., Юхименко В.В., Наумов В.В. // Письма в ЖЭТФ. 2008. Т. 88. С. 107.
Wenju Wang, Chunying Zhu, Yingyu Cao // International Journal of hydrogen energy. 2010. V. 35. P. 1951.
Sun Bin, Zhao Xiaotong, Xin Yanbin, Zhu, Xiaomei // Int. J. Hydr. Energy. 2017. V. 42. P. 24047.
Liu Jing-Lin, Zhu Tong Hui, Sun Bing. // Int. J. Hydr. Energy. 2022. V. 47. P. 12841.
https://web.eng.ucsd.edu/mae/groups/combustion/mechanism.html – UC San Diego Combustion Research Group, San Diego Mechanism
https://www.comsol.ru/model/thermal-plasma-8658
Райзер Ю.П. Физика газового разряда М.: Наука, 1987. 591 с.
Hagelaar G., Pitchford L. // Plasma Sources Sci. Technol. 2005. V. 14. P. 722.
Nixon K.L., Pires W.A.D., Neves R.F.C., Duque H.V., Jones D.B., Brunger M.J., Lopes M.C.A. // International Journal of Mass Spectrometry. 2016. V. 404. P. 48.
Hargreaves L.R., Khakoo M.A., Winstead C. // Journal of Physics B: Atomic, Molecular and Optical Physics. 2016. V. 49. P. 18.
Prabhudesai V.S., Kelkar A.H., Nandi D., Krishnakumar E. // Physical Review Letters. 2005. V. 95. P. 143202.
Lebedev Yu.A., Tatarinov A.V., Epshtein I.L. // High Temperature. 2011. V. 49. № 6. P. 775.
Avtaeva S., General A., Kel’man V. // J. Phys. D: Appl. Phys. 2010. V. 43. P. 315201.
Aoki H., Kitano K., Hamaguchi S. // Plasma Sources Sci. Technol. 2008. V. 17. P. 025006.
Rehman F., Lozano-Parada J.H., Zimmerman W.B. // Int. J. Hydrogen Energy. 2012. V. 37. P. 17678.
Pancheshnyi S., Biagi S., Bordage M., Hagelaar G., Morgan W., Phelps A., Pitchford L. // Chem. Phys. 2012. V. 398. P. 148.
Wang W., Snoeckx R., Zhang X., Cha M., Bogaerts A. // J. Phys. Chem. C. 2018. V. 122. P. 8704.
Tsyganov D., Bundaleska N., Tatarova E. et al. // Plasma Sources Sci. Technol. 2016. V. 25. P. 015013.
Lebedev Yu.A., Tatarinov A.V., Epshtein I.L., Titov A.Yu. // High Energy Chemistry, 2021. V. 55. № 6. P. 490.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


