Химия высоких энергий, 2023, T. 57, № 1, стр. 28-38
Оценка возможности применения внешнего рентгеновского излучения для моделирования процессов авторадиолиза терапевтических радиофармпрепаратов (на примере соединений [153Sm]Sm-PSMA-617 и [177Lu]Lu-PSMA-617)
Ю. А. Митрофанов a, В. Б. Бубенщиков a, А. В. Белоусов a, А. С. Лунёв a, А. А. Ларенков a, *
a Федеральное государственное бюджетное учреждение “Государственный научный центр
Российской Федерации – Федеральный медицинский биофизический центр имени А.И. Бурназяна”
123098 Москва, Живописная ул., д. 46, Россия
* E-mail: anton.larenkov@gmail.com
Поступила в редакцию 16.08.2022
После доработки 03.09.2022
Принята к публикации 04.09.2022
- EDN: DCWVPG
- DOI: 10.31857/S0023119323010096
Аннотация
В работе представлены результаты исследования радиолитической деградации векторных молекул радиофармацевтических препаратов, обусловленной ионизирующим излучением используемого в составе радионуклида, в сравнении с той же дозой внешнего рентгеновского облучения. Выполнена оценка дозовых коэффициентов для медицинских терапевтических радионуклидов самария-153 и лютеция-177 в водных растворах в геометрии, моделирующей готовую лекарственную форму радиофармацевтических препаратов (медицинский флакон) как математическими методами (in silico), так и с помощью химической дозиметрической системы. Облучение внешним рентгеновским излучением в дозах, формируемых в объемах терапевтических радиофармпрепаратов с характерной удельной активностью, выполнено на рентгеновской установке ЛНК-268. На примере радиофармпрепаратов [153Sm]Sm‑PSMA‑617 и [177Lu]Lu‑PSMA‑617 проведено сравнение степени радиолитической деградации и профилей радиолитических примесей, образующихся как в результате внешнего облучения рентгеновским излучением, так и в результате авторадиолиза. Отмечено качественное совпадение профилей примесей, образующихся в обоих случаях. Показано, что внешнее рентгеновское излучение может быть использовано для моделирования процессов авторадиолиза радиофармацевтических препаратов в случае внесения дополнительных поправок на вид излучения и мощность дозы.
ВВЕДЕНИЕ
Ядерная медицина — это быстро развивающаяся междисциплинарная область исследований, интенсивно изучаемая в последние десятилетия. Термин ядерная медицина зачастую все еще ассоциируется только с высокоточными диагностическими процедурами, такими как однофотонная эмиссионная компьютерная томография (ОФЭКТ), позитронно-эмиссионная томография (ПЭТ) и методами гибридной визуализации (ОФЭКТ/компьютерная томография (КТ) или ПЭТ/КТ). Тем не менее, терапевтическая радиофармацевтика делает быстрый прогресс в удовлетворении клинической потребности по поиску лекарств от очень трудно поддающихся консервативному лечению заболеваний (главным образом онкологических). При таргетной радионуклидной терапии (РНТ) мощное ионизирующее излучение избирательно доставляется к раковым клеткам с использованием радиофармацевтических препаратов, содержащих радионуклиды (РН), испускающие α-частицы, β‑частицы или электроны Оже.
Внушительный потенциал таргетной РНТ, установленный в ходе клинических испытаний в мире при лечении первичного рака, а также отдаленных метастазов, в настоящее время признается эффективным, безопасным, экономически и логистически конкурентоспособным методом лечения, привлекающим внимание как малых, так и крупных фармацевтических компаний [1]. Большинство применяемых и разрабатываемых сегодня радиофармпрепаратов для РНТ содержат β−‑излучающие радионуклиды, среди которых лютеций-177 обладает наиболее привлекательными ядерно-физическими свойствами. В мировой клинической практике уже активно применяют два одобренных и зарегистрированных РФП на основе 177Lu: [177Lu]Lu‑DOTA‑TATE (оксодотреотид, Lutathera® [2]; РНТ нейроэндокринных опухолей) и [177Lu]Lu‑PSMA‑617 (випивотида тетраксетан, Pluvicto™ [3]; РНТ метастатического кастратрезистентного рака предстательной железы). В настоящее время рынок радиотерапии оценивается примерно в одну треть рынка ядерной медицины/радиофармацевтических препаратов. Однако ожидается, что в ближайшие годы этот сегмент рынка будет расти с двузначным годовым темпом роста из-за увеличения применения терапевтических радионуклидов для различных патологических состояний. Разработка новых терапевтических РФП с 177Lu и другими радионуклидами активно продолжается.
Для успешного клинического применения терапевтический РФП должен соответствовать ряду показателей качества, среди которых одним из основных является устойчивость в течение срока годности к действию излучения, создаваемого радионуклидом, входящим в состав готовой лекарственной формы (ГЛФ). Инициируемые излучением радионуклида процессы радиолиза в объеме препарата приводят к быстрой деградации векторной молекулы РФП, и, как следствие, потере им специфичности и терапевтической эффективности. Для предотвращения подобной ситуации на стадии фармацевтической разработки ГЛФ РФП производится оптимизация состава: введение специальных антиоксидантов-радиопротекторов, подбор концентрации основных и вспомогательных веществ, изменение объема ГЛФ и т.д.
На практике для оценки устойчивости ГЛФ терапевтических РФП к авторадиолизу проводится серийные наработки и анализ во времени препаратов с использованием высоких (клинических) активностей радионуклидов (например, для РФП с лютецием‑177 – порядка 7.4 ГБк). В случае неудовлетворительного результата исследования необходимо введение корректировок в состав препарата в отношении радиопротектора [4]. Учитывая рыночную стоимость самих радионуклидов, а также нерадиоактивных прекурсоров и собственно наработку контрольных партий РФП, процедура подбора необходимого радиопротектора и его концентрации приводят к существенному росту стоимости фармацевтической разработки РФП (помимо дополнительной дозовой нагрузки на исследовательский персонал). Кроме того, образующиеся со временем радиолитические примеси (профиль радиохимических примесей) в РФП в соответствии с современными подходами к обеспечению качества лекарственных средств следует охарактеризовать для квалификации их влияния на фармакокинетику РФП и установления допустимых пределов содержания в ГЛФ [5, 6].
В данном аспекте моделирование процессов радиолиза, происходящих в ГЛФ терапевтических РФП с помощью внешнего облучения, представляется весьма привлекательной альтернативой, способной существенно снизить затраты на стадии фармацевтической разработки.
Первоначально для оценки формируемых доз было решено использовать химическую дозиметрию. Разработанные и успешно применяемые в области радиационной химии химические дозиметрические системы характеризуются различными параметрами, в первую очередь — рабочим диапазоном доз, в котором сохраняется линейность зависимости измеряемого параметра системы (зачастую спектрометрически) от величины поглощенной дозы [7–13]. С целью выбора подходящего химического дозиметра первичный поиск рабочего диапазона доз проводили с помощью широко распространенных программ моделирования OLINDA/EXM 1.0, IDAC Dose 2.1 и Geant4. Применимость метода внешнего облучения оценивали исходя из анализа результатов высокоэффективной жидкостной хроматографии (ВЭЖХ-анализа) модельных препаратов самария-153 и лютеция-177 на основе упомянутого ранее лиганда простат-специфического мембранного антигена — PSMA-617. Выбор данной модели ГЛФ РФП обусловлен высокой актуальностью исследований различных аспектов разработки РФП данного класса [14, 15].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все реактивы и растворители были высокочистого или фармацевтического качества и были приобретены у Sigma-Aldrich или PanReac. [177Lu]LuCl3 в 0.04 M растворе HCl с объемной активностью 49.3 ГБк/мл и удельной активностью не менее 1850 ГБк/мг приобретен у ГП “РАДИОПРЕПАРАТ” (ИЯФ АН Республики Узбекистан, Ташкент, пос. Улугбек). [153Sm]SmCl3 в 0.1 М растворе HCl с объемной активностью 4 ГБк/мл и удельной активностью 5.6 ГБк/мг предоставлен АО “НИФХИ им. Л.Я. Карпова” (Российская Федерация, Обнинск). Прекурсор PSMA-617 приобретен у ABX advanced biochemical compounds GmbH (Германия, Радеберг), а также любезно предоставлен ООО “ЦМИ”.
Компьютерное моделирование. Для оценки поглощенных доз, создаваемых в объемах терапевтического РФП использовали программный код Geant4 [16], реализующий метод Монте-Карло. Программный код Geant4 разработан в ЦЕРН для моделирования прохождения частиц через вещество. При моделировании поглощенных доз моделировался распад исходного радионуклида и все процессы взаимодействия испускаемых фотонов и электронов с веществом в предположении равномерного распределения радионуклидов в цилиндрическом объеме. Для достижения требуемой статистической точности для каждого варианта моделировали 108 историй (распадов). Использовали набор физических процессов (physics list) PENELOPE, поскольку он более точно описывает взаимодействие низкоэнергетичных фотонов и электронов [17].
Химическая дозиметрия. Для моделирования доз, создаваемых радионуклидами 153Sm и 177Lu в растворе, готовили образцы медно-ферросульфатного дозиметра Фрикке [18] с добавлением раствора радионуклида в медицинских флаконах с внутренним диаметром 1 см (ISO 8362). Для этого навески FeSO4 · 7H2O и CuSO4 · 5H2O растворяли в деионизованной воде и добавляли концентрированную серную кислоту. Полученный раствор предварительно барботировали аргоном в течение 30 мин для снижения чувствительности к мощности (дозиметр линеен до 5 Гр/мкс [10]). Затем добавляли аликвоту раствора радионуклида. При этом конечные концентрации компонентов составляли: c(FeSO4) = 10−3 моль/л; с(CuSO4) = = 10−2 моль/л; с(H2SO4) = 5 × 10−3 моль/л; с(HCl) = = (2.5–50) × 10−3 моль/л. Объемную активность препаратов измеряли сразу после приготовления с помощью дозкалибратора ISOMED 2010 (“MED Nuklear-Medizintechnik Dresden GmbH”, Германия). Образец сравнения готовили по той же методике, но без добавления растворов радионуклидов (с(HCl) = 0). Все образцы готовили в трех параллелях. Растворы, не содержащие РН, были так же использованы для определения мощности дозы от установки ЛНК 258.
Концентрацию Fe(III) в образцах определяли на спектрофотометре Cary 60 (Agilent, США) при 304 нм (при комнатной температуре, 22°С) относительно необлученного дозиметрического раствора в кювете с длиной оптического пути 5 мм. Для спектрофотометрии отбирали по три аликвоты каждого образца. В случае радиоактивных растворов после измерения оптической плотности аликвоту возвращали обратно к общей массе раствора для минимизации влияния отбора активности на формируемую дозу.
Приготовление и ВЭЖХ-анализ препаратов. Для приготовления препаратов [153Sm]Sm‑PSMA‑617 и [177Lu]Lu‑PSMA‑617 к навескам PSMA-617 добавляли 0.06 M раствор натрия ацетата, деионизованную воду и аликвоту раствора радионуклида (250–450 МБк 153Sm или 177Lu). Препараты выдерживали в термошейкере при 95°С в течение 30 мин. Конечная концентрация прекурсора c(PSMA-617) = 240 и 10 мкмоль/л (для препаратов 153Sm и 177Lu соответственно), натрия ацетата с(AcONa) = = 0.03 моль/л, pH 4.50 ± 0.05.
Для ВЭЖХ-анализа препаратов использовали хроматограф Knauer Smartline (Германия), оснащенный радиометрическим детектором fLumo (Berthold, Германия). Анализ проводили в градиентном режиме 0–13–13.5–21 мин = 85–28–85–85%A (A — водный раствор трифторуксусной кислоты, 0.1 об. %; B — MeOH) на колонке Phenomenex® Jupiter C18 250 × 4.6 мм (5 мкм, 300 Å) при 55°С и скорости потока 0.85 мл/мин. Время удерживания соединений [153Sm]Sm‑PSMA‑617 и [177Lu]Lu‑PSMA‑617 в данном методе составляет 11.35–11.40 мин.
Внешнее облучение. Для внешнего облучения рентгеновскими лучами использовали установку ЛНК-268, включающую: односекционную рентгенозащитную камеру, закрепленную на технологической подставке; рентгеновский аппарат РАП 100-10; видеокамеру; персональный компьютер. Аппарат РАП 100-10 размещается в верхней части камеры, там же крепятся оптические элементы лазерного центратора. В нижней части камеры установлен подвижный рабочий стол для размещения облучаемых объектов на различном фокусном расстоянии. В технологической подставке установлен пульт электроснабжения установки и блок питания рентгеновского аппарата. Рентгеновский аппарат РАП 100-10 оснащен рентгеновской трубкой 1БПВ23-100 с молибденовым анодом и выходным бериллиевым окном, имеет водяное охлаждение, работает при анодном напряжении на рентгеновской трубке в регулируемом диапазоне 30–100 кВ. Максимальный анодный ток составляет 10 мА. Необходимую продолжительность облучения устанавливали с помощью дозиметра Фрикке. Ввиду низкой проникающей способности генерируемых рентгеновских лучей облучение образов препаратов и растворов химического дозиметра проводили в тонком слое в геометрии чашки Петри (∅35 × 10 мм, TC-treated, Eppendorf). Во всех случаях объем облучаемых растворов составлял 1 мл.
Оценка дозового коэффициента in silico
Оценка поглощенной дозы D (Гр) расчетным методом основана на уравнении, связывающем основные ядерно-физические характеристики радионуклида, массу раствора и степень поглощения ионизирующего излучения:
(1)
$D = \frac{{\Delta A}}{{\lambda \rho V}}\mathop \sum \limits_i {{E}_{i}}{{y}_{i}}{{{{\varphi }}}_{i}},$Из размерного анализа следует, что дозовый коэффициент ψ представляет собой поглощенную дозу, которая создается в единичном объеме раствора с плотностью ρ (кг/мл) при распаде 1 МБк радионуклида. Или, несколько иначе, ψ – поглощенная доза, которая создается энергией распада, соответствующей единичной объемной убыли активности.
Для первичной оценки доз (и дозовых коэффициентов) растворов, содержащих 153Sm и 177Lu, были проведены расчеты по уравнению (1) с использованием литературных значений φi [19] и ядерно-физических характеристик радионуклидов [20]. Также для сравнения проведено математическое моделирование с использованием ПО OLINDA/EXM (Organ Level Internal Dose Asessment Code) версии 1.0 и IDAC Dose версии 2.1 [21] и Geant4. При использовании IDAC Dose 2.1 значения φi находятся с помощью MCNP 6.0 [22]. В результате расчетных исследований были получены значения поглощенных доз и дозовых коэффициентов для различной геометрии и объема раствора (табл. 1, рис. 1). Представленный ниже выбор методов расчета основан на переходе от чисто теоретической сферической геометрии к некоторому приближению к реальной геометрии флакона с препаратом.
Таблица 1.
In silico оценки дозовых коэффициентов для различной геометрии растворов в приближении равномерного распределения активности по объему раствора с плотностью 1 кг/м3
| Метод расчета | Объем жидкости, геометрия | ψ, Гр мл/МБк | |
|---|---|---|---|
| 153Sm | 177Lu | ||
| Уравнение (1) | 1 мл, сфера (r = 6.2 мм) | 8.21 | 17.35 |
| OLINDA/EXM 1.0 | 10.12 | 19.30 | |
| IDAC Dose 2.1a | 9.91 | 19.11 | |
| Geant4 | 1 мл, цилиндр (r = 4.4 мм, h = 16 мм)a | 11.45 | 18.59 |
| 1 мл, цилиндр 1 мл (r = 10 мм, h = 3.183 мм)b | 12.18 | 18.43 | |
| 1–20 мл, цилиндр (r = 10 мм, h = 3.2–63.7 мм)c | 9.25–9.97 | 18.2–19.0 | |
Рис. 1.
Влияние разбавления на величину поглощенной дозы в растворе 177Lu (a) и дозовые коэффициенты 153Sm и 177Lu (б). Приближение к пенициллиновому флакону (табл. 1), начальная активность радионуклида оставляет 7.4 ГБк.
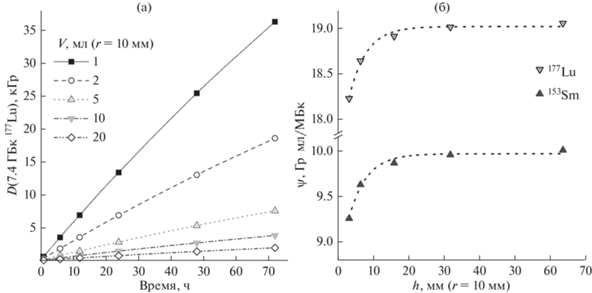
Полученные значения ψ для 177Lu согласуются с ранее опубликованными литературными данными: из результатов моделирования поглощенных доз в растворах в сферической геометрии следует значение дозового коэффициента 18.8–19.09 Гр мл/МБк [23–25] (S [мГр МБк−1 с−1] = = 1000ψλ/V).
Результаты моделирований поглощенных доз при различных объемах раствора показаны на рис. 1а. Обнаружена зависимость дозового коэффициента ψ от объема раствора (рис. 1б), что так же показано в исследовании in silico [26].
Как сказано выше, выражение для этого коэффициента представляет собой дозу, приведенную к единице изменения объемной активности, и в явном виде не содержит геометрических параметров (например, высоты цилиндра h и его радиуса r), но является их сложной функцией ψ = f(ρ,φi(ρ,Ei,r,h…)). Это теоретически позволяет находить дозу для любой объемной активности при нахождении параметров зависимости ψ от геометрических факторов.
В первом приближении можно показать, что в диапазоне 1–20 мл (наиболее часто используемые на практике объемы растворов) в геометрии цилиндра с радиусом 1 см (приближение к пенициллиновому флакону) рассчитываемая по методу Монте-Карло поглощенная доза выражается следующим уравнением:
(3)
$D = {{\psi }}\left( h \right)\frac{{{{\Delta }}A}}{V} = ({{\Psi }_{{h \to \infty }}} - b{{c}^{h}})\frac{{{{\Delta }}A}}{V}.$Здесь b и c – коэффициенты асимптотического уравнения, $\Psi $h→∞ – предельное для данной геометрии значение дозового коэффициента. Следует отметить, что с практической точки зрения введение поправки вида ψ – bch не является необходимым (исходя из приведенных выше оценок in silico), так как максимальная разница в значениях дозовых коэффициентов 177Lu и 153Sm для 1 и 20 мл составляет всего 5–7%.
В работе [24] как расчет дозовых коэффициентов и формируемых поглощенных доз, так и эксперименты с препаратами лютеция-177 проведены в очень небольших объемах растворов (10–500 мкл) с низкой объемной активностью (115 МБк/мл). Для этих условий приведены многообещающие результаты оценки эффективности ряда радиопротекторов и их комбинации. Однако проведенные нами расчеты указывают на то, что прямое масштабирование результатов модельных исследований на реальные объемы и активности ГЛФ РФП может быть некорректным. Указанное выше влияние объема раствора на величину дозового коэффициента может меняться при переходе от одного радионуклида к другому (например, при существенном изменении энергии β−-частиц) и изменение ψ может вырасти настолько, что им нельзя будет пренебречь.
Полученные результаты показывают, что в объеме таких РФП как Lutathera® (370 МБк/мл, 20–25 мл, срок годности 72 ч) [27] и Pluvicto™ (1000 МБк/мл, 7.5–12.5 мл, срок годности 120 ч) [28] к концу срока годности теоретически формируется поглощенная доза порядка 3.5 и 7.3 кГр соответственно, что определило выбор химической дозиметрической системы.
Модифицированный дозиметр Фрикке
Согласно предварительным данным, полученным с помощью компьютерного моделирования, требовалась стабильная дозиметрическая система, линейная в диапазоне до 10 кГр, исключающая химическое взаимодействие радионуклидов с компонентами системы.
Наиболее широкое применение в радиационной химии находит ферросульфатная система, обычно называемая дозиметром Фрикке. Данную систему использует в качестве эталонной при калибровке других систем и источников излучения. Основным недостатком ферросульфатного дозиметра является достаточно ограниченный диапазон доз (40–400 Гр) [7]. Модификация дозиметра Фрикке добавлением сульфата меди (II) позволила существенно снизить радиационно-химический выход (G(Fe3+) = 0.66 ионов/100 эВ = 6.5407 × × 10−8 моль/Дж) и повысить верхний предел примерно до ~10 кГр [8, 9]. Еще одна популярная дозиметрическая система, используемая для измерения доз в диапазоне 1–50 кГр – дихроматная [11–13] – в данном случае является не подходящей из-за ионов серебра, которые образуют малорастворимые соединения с большинством анионов. Поэтому для дозиметрии был выбран медно-ферросульфатный дозиметр [18].
Изменение оптической плотности дозиметрического раствора ΔOD связано к поглощенной этим раствором дозы ионизирующего излучения (ИИ) соотношением (4):
Здесь ε – молярный коэффициент экстинкции (216 м2/моль, 304 нм); ρ – плотность дозиметрического раствора (1000.2 кг/м3, измерена при 22°С); d – длина оптического пути в спектрофотометрической кювете (0.005 м); G – радиационно-химический выход (6.5407 × 10−8 моль/Дж).
Очевидно, что мощность дозы (а соответственно и скорость изменения оптической плотности раствора) с течением времени будет падать в строгом соответствии с законом радиоактивного распада (рис. 2а, в). Постоянство произведения ερdGψ/V11 обуславливает линейный вид зависимости ΔOD от ΔA (рис. 2б, г). Представление в линейном виде было выбрано из соображений удобства объединения результатов экспериментов с растворами, содержащими различную начальную активность радионуклида, в одну регрессионную модель. Правомерность данного действия обоснована результатом теста Чоу: значения наблюдаемых F-статистик ниже соответствующих критических значений в 1.4 и 214 раз (153Sm и 177Lu соответственно).
Рис. 2.
Изменение оптической плотности растворов, содержащих 250 ± 5 и 495 ± 5 МБк 153Sm и 177Lu с течением времени (а, в) и линеаризованная форма данных зависимостей (б, г). Планки погрешностей опущены для ясности (≤5%).
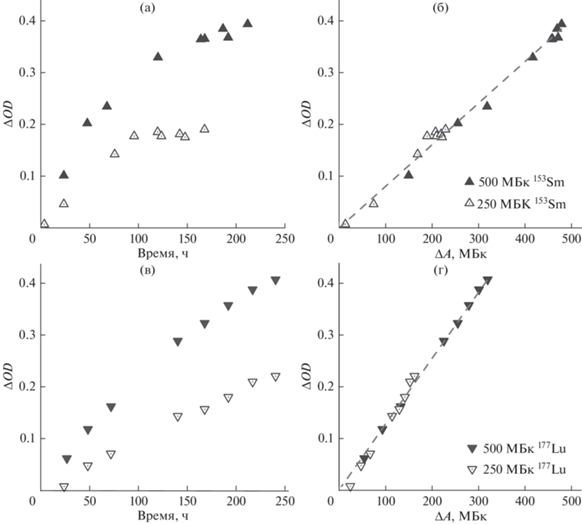
Экспериментальные параметры регрессионных моделей и значения ψэксп (полученные делением значений угловых коэффициентов на произведение ερdG/V), приведены в табл. 2.
Таблица 2.
Результаты обработки экспериментальных значений изменения оптической плотности дозиметрических растворов
| Параметр | 153Sm | 177Lu |
|---|---|---|
| Угловой коэффициент b, МБк−1 | 8.033 × 10−4 | 1.2729 × 10−3 |
| SD(b), МБк−1 | 0.086 × 10−4 | 0.0013 × 10−3 |
| Коэффициент детерминации, R2 | 0.9978 | 0.9981 |
| Среднеквадратичное отклонение, S0 | 0.01149 | 0.00976 |
| Число степеней свободы, df | 19 | 18 |
| ψэксп, Гр мл/МБк | 11.37 | 18.01 |
| SD(ψэксп), Гр мл/МБк | 0.12 | 0.19 |
Видно, что значение дозового коэффициента для 177Lu, полученного экспериментально (при использовании литературного значения радиационно-химического выхода G), лежит между рассчитанным по уравнению (1) и вычисленными с помощью ПО (табл. 1). В случае 153Sm удовлетворительное совпадение величины ψ, рассчитанной по уравнению (1) (в геометрии сферы объемом 1 мл) и с помощью ПО, достигается только случае учета энергетических вкладов электронов конверсии, Оже и, более того, в приближении полного (!) поглощения β−-частиц в объеме раствора – согласно данным Национальной лаборатории Анри Беккереля о ядерно-физических характеристиках 153Sm [29], расчет ψ по уравнению (1) приводит к значению 10.24 Гр мл/МБк (по сравнению с 8.21 Гр мл/МБк, табл. 1), что все же несколько ниже экспериментального значения.
На рис. 3 представлены прогнозируемые значения поглощенных доз (пунктирные линии и заштрихованные области), создаваемых 500 МБк 153Sm и 177Lu в 1 мл раствора в сравнении с экспериментальными значениями доз, рассчитанными по уравнению (4) (треугольники, 495 ± 5 МБк 153Sm и 177Lu).
Рис. 3.
Сравнение поглощенных доз, создаваемых 500 МБк 153Sm и 177Lu. Линии (штрих и штрих-пунктир) – моделирование с помощью Geant4 (ψ = 12.18 и 18.43 Гр МБк/мл для 153Sm и 177Lu соответственно); треугольники – экспериментальные значения (уравнение (4)).
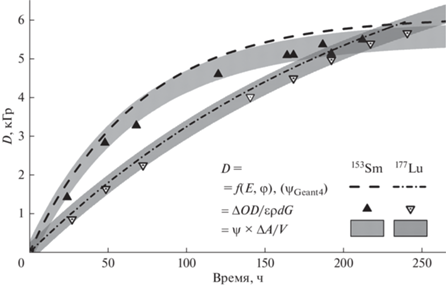
Закрашенные области соответствуют 95%-м доверительным интервалам прогнозируемых значений доз, рассчитанным по экспериментальным значениям дозовых коэффициентов. На данном графике наглядно показано совпадение различных данных для как для лютеция-177, так и для самария-153. Согласие результатов моделирования с помощью специализированных программ и эксперимента с дозиметром Фрикке, позволяет с достаточной точностью предсказать дозы, формируемые во флаконах с радиофармпрепаратом.
Влияние поглощенной дозы на РХЧ препаратов 153Sm и 177Lu
Возможность использования метода внешнего облучения определяется сходством степени деградации векторной молекул и профиля радиохимических примесей (качественный критерий), возникающих под действием внешнего излучения при равенстве величин поглощенных препаратами доз. В роли количественного критерия выступает величина изменения радиохимической чистоты препарата.
Процесс авторадиолиза препаратов [153Sm]Sm-PSMA-617 и [177Lu]Lu-PSMA-617 был изучен при начальных объемных активностях радионуклидов 460 ± 10 МБк/мл 153Sm и 177Lu в соответствующих препаратах. На рис. 4 показано, что в отсутствие радиопротектора радиохимическая чистота препаратов очень быстро падает и спустя 24 ч сохраняется всего около 24% [153Sm]Sm‑PSMA‑617 и около 50% [177Lu]Lu‑PSMA‑617. Различие в скоростях падения величин РХЧ обусловлено соответствующей разницей между значениями мощности формируемых доз от излучения этих радионуклидов: в период времени до 170–250 ч при равных активностях самарий-153 оказывает большую дозовую нагрузку по сравнению с лютецием-177 (рис. 3).
Рис. 4.
Зависимость радиохимической чистоты препаратов [153Sm]Sm/[177Lu]Lu‑PSMA‑617 от поглощенной дозы (A0 = 450–470 МБк, V = 1 мл). Поглощенные дозы рассчитаны исходя из экспериментальных значений дозовых коэффициентов ψэксп. Пунктиром показано 95%-ое совпадение экспериментальных значений РХЧ с экспоненциальным приближением (РХЧD = РХЧ0e−D⁄1210, R2 = 0.992).
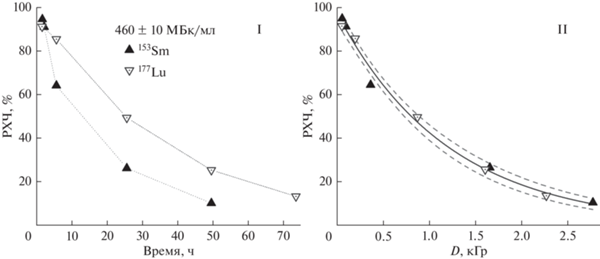
Подобные зависимости приведены в исследовании эффективности радиопротекторов в препаратах 177Lu и 111In [24]. В данной работе авторы наблюдали еще более резкое изменение РХЧ в зависимости от поглощенной дозы: около 50% радиоконъюгата подвергается разложению уже при 200 Гр, а при D ≈ 420 Гр сохраняется всего около 25% радиоконьюгата [30], при этом были использованы более низкие объемные активности (до 250 МБк/мл). Авторы особо отмечают, что зависимость радиохимической чистоты от дозы является линейной, что несколько не согласуется с результатами данной работы: при относительно высоких значениях D (более 1 кГр) РХЧ становится менее чувствительна к величине поглощенной дозы, однако в упомянутых работах не обсуждается результат воздействия высокой дозовой нагрузки.
На рис. 5 представлены результаты ВЭЖХ-анализа препаратов [177Lu]Lu‑PSMA‑617, в которых одинаковая поглощенная доза (0.8 и 1.5 кГр) сформирована различными путями. Мощность дозы установки ЛНК 258, вычисленная по результатам экспериментов по облучению серии образцов медно-ферросульфатного дозиметра через различные интервалы времени, составила 288 ± 2 Гр/мин (в диапазоне 0.8–4.6 кГр величина R2 = 0.99932 при n = 18).
Рис. 5.
Внешнее облучение (288 Гр/мин, пунктирная) и авторадиолиз (430 МБк/мл 177Lu, сплошная линия); I – хроматограмма препарата на момент приготовления; II – 0.8 кГр; III – 1.5 кГр.
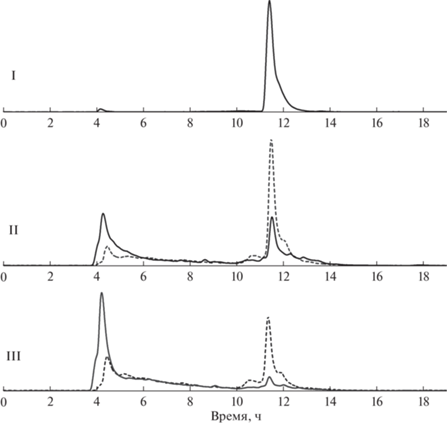
Из представленных данных видно, что степень радиолитической деградации радиоконьюгата в случае внешнего облучения несколько ниже по сравнению с облучением из-за распада входящего в состав препарата радионуклида. При дозе 1.5 кГр в следствие авторадиолиза около 80–90% активности 177Lu представлено в форме радиохимических примесей, в то время как при внешнем облучении разложению подвергается около 60% радиоконьюгата [177Lu]Lu‑PSMA‑617. При этом высокое сходство профилей радиолитических примесей позволяет с уверенностью предположить, что их совпадения можно добиться при формировании более высокой дозы от внешнего облучения (по сравнению с дозой от излучения РН, входящего в состав РФП). Таким образом, при внесении определенной поправки (повышающего коэффициента) на величину дозы, формируемой внешним рентгеновским излучениeм, будет возможно создать хроматографичечкий профиль продуктов радиолиза, аналогичный процессам авторадиолиза терапевтических РФП.
Следует подчеркнуть, что мощность дозы, создаваемой установкой ЛНК-268 примерно в 600 раз выше начальной (максимальной) мощности дозы, создаваемой 430 МБк 177Lu в 1 мл препарата (около 0.56 Гр/мин в течение первых суток). Использование теста Чоу, упомянутое выше, может показать сохраняется ли значение углового коэффициента при изменении начальной активности данного радионуклида в образце, что косвенно может говорить о влиянии мощности дозы. Возможным объяснением наблюдаемого явления может быть некоторое “запаздывание” химических реакций, приводящих к образованию продуктов радиолиза радиоконьюгата, и притоком ионизирующих частиц (или скоростью возникновения активных частиц). Следует отметить, что моделируемая с помощью дозиметра Фрикке поглощенная доза относится к взаимодействию быстрых частиц с относительно простыми молекулами (вода, ионы неорганических кислот т.п.), в то время как молекулярный вектор в модели ГЛФ РФП является сложной многоатомной, частично π-сопряженной системой, электронные и колебательные возбуждения в которой могут приводить к иному перераспределению вносимой в систему энергии (более эффективному ее поглощению с возможным протеканием вторичных эффектов деградации). Наблюдаемое различие может быть обусловлено влиянием дополнительных ядерных процессов в реальных препаратах, эффект которых не учитывается при математическом моделировании, достаточно мал для регистрации химическим дозиметром, но достаточен для разрыва химических связей векторной молекулы РФП. Например, вкладом действия ядер отдачи в деструкцию молекулы. Однако, расчеты показывают, что для лютеция-177 влиянием эффекта отдачи в случае такого тяжелого ядра как 177Hf (${}_{{{\text{71}}}}^{{{\text{177}}}}{\text{Lu}}\xrightarrow{{{\text{6}}{\text{.647\;сут}}}}{}_{{{\text{72}}}}^{{{\text{177}}}}{\text{Hf + }}{}_{{ - 1}}^{{\text{0}}}{{{\text{e}}}^{ - }}{\text{ + }}{}_{{\text{0}}}^{{\text{0}}}{{{{\tilde {\nu }}}}_{{{{{\text{e}}}^{ - }}}}}$) наблюдаемое явление объяснить нельзя, так как даже в предельном случае кинетической энергии ядра отдачи (2.3 эВ) недостаточно для разрыва химической связи С–С (EC–C ≈ 3–4 эВ, EC—COOH ≈ 2.7 эВ).
Определение необходимой величины повышающего коэффицинета для поглощенной дозы, формируемой внешним рентгеновским излучением является вопросом дальнейших исследований.
ЗАКЛЮЧЕНИЕ
Показана применимость медно-ферросульфатного дозиметра Фрикке для оценки дозовых коэффициентов таких терапевтических радионуклидов как 153Sm и 177Lu. Значения дозовых коэффициентов, полученныx при анализе экспериментальных данных, с достаточной точностью совпадают с моделируемыми математически, а также, в случае 177Lu согласуются с опубликованными ранее литературными данными. Анализ образцов препарата [177Lu]Lu‑PSMA‑617 с одинаковой поглощенной дозой, инициированной в одном случае внешним рентгеновский излучением и собственным распадом радионуклида в другом показал схожие качественно, но различные количественно результаты радиолитической деградации векторной молекулы. При этом качественное совпадение профилей радиолитических примесей позволяет предположить, что, несмотря на различную природу ионизирующего излучения, в обоих случаях протекают химические реакции, приводящие к одинаковому качественному составу примесей. Данный факт свидетельствует в пользу использования метода внешнего облучения для моделирования дозовой нагрузки на радиофармпрепарат, при внесении в выражение для дозового коэффициента некоторой поправки на вид излучения и/или мощность дозы. Также метод внешнего облучения подходит для качественной оценки эффективности различных радиопротекторов на этапе первичного подбора состава радиофармпрепарата.
Упомянутые выше зависимости величины дозового коэффициента от геометрии и объема раствора, типа излучения и мощности дозы являются темой дальнейших исследований.
Список литературы
Dolgin E. // Nat. Biotechnol. 2018. V. 36. № 12. P. 1125–1127. https://doi.org/10.1038/nbt1218-1125
Hennrich U., Kopka K. // Pharmaceuticals. 2019. V. 12. № 3. P. 114. https://doi.org/10.3390/ph12030114
Novartis PluvictoTM approved by FDA as first targeted radioligand therapy for treatment of progressive, PSMA positive metastatic castration-resistant prostate cancer | Novartis [Electronic resource]. URL: https://www.novartis.com/news/media-releases/novartis-pluvictotm-approved-fda-first-targeted-radioligand-therapy-treatment-progressive-psma-positive-metastatic-castration-resistant-prostate-cancer (accessed: 01.08.2022).
Baudhuin H., Cousaert J., Vanwolleghem P., Raes G., Caveliers V., Keyaerts M., Lahoutte T., Xavier C. // Pharmaceuticals. 2021. V. 14. № 5. P. 448 https://doi.org/10.3390/ph14050448
Mu L., Hesselmann R., Oezdemir U., Bertschi L., Blanc A., Dragic M., Löffler D., Smuda C., Johayem A., Schibli R. // Appl. Radiat. Isot. 2013. V. 76. P. 63–69 https://doi.org/10.1016/j.apradiso.2012.07.022
Martin S., Tönnesmann R., Hierlmeier I., Maus S., Rosar F., Ruf J., Holland J.P., Ezziddin S., Bartholomä M.D. // J. Med. Chem. 2021. V. 64. № 8. P. 4960–4971 https://doi.org/10.1021/acs.jmedchem.1c00045
Rothschild W.G., Allen A.O. // Radiat. Res. 1958. V. 8. № 2. P. 101. https://doi.org/10.2307/3570600
Hart E.J., Walsh P.D. // Radiat. Res. 1954. V. 1. № 4. P. 342–346.
Hart E.J. // Radiat. Res. 1955. V. 2. № 1. P. 33–46.
Bjergbakke E., Sehested K. // Radiation Chemistry / ed. Hart E.J. 1968. P. 579–584. https://doi.org/10.1021/ba-1968-0081.ch040
Sharpe P.H.G., Barrett J.H., Berkley A.M. // Int. J. Appl. Radiat. Isot. 1985. V. 36. № 8. P. 647–652. https://doi.org/10.1016/0020-708X(85)90006-7
Sharpe P.H.G., Sehested K. // Int. J. Radiat. Appl. Instrumentation. Part C. Radiat. Phys. Chem. 1989. V. 34. № 5. P. 763–768. https://doi.org/10.1016/1359-0197(89)90281-6
Sharpe P., Miller A., Bjergbakke E. // Int. J. Radiat. Appl. Instrumentation. Part C. Radiat. Phys. Chem. 1990. V. 35. № 4–6. P. 757–761. https://doi.org/10.1016/1359-0197(90)90311-5
Wang F., Li Z., Feng X., Yang D., Lin M. // Prostate Cancer Prostatic Dis. Springer US, 2022. V. 25. № 1. P. 11–26. https://doi.org/10.1038/s41391-021-00394-5
Kopka K., Benešová M., Bařinka C., Haberkorn U., Babich J. // J. Nucl. Med. 2017. V. 58. № Supplement 2. P. 17S–26S. https://doi.org/10.2967/jnumed.116.186775
Allison J., Amako K., Apostolakis J., Arce P., Asai M., Aso T., Bagli E., Bagulya A., Banerjee S., Barrand G., Beck B.R., Bogdanov A.G., Brandt D., Brown J.M.C., Burkhardt H., Canal P., Cano-Ott D., Chauvie S., Cho K., et al. // Nucl. Instruments Methods Phys. Res. Sect. A Accel. Spectrometers, Detect. Assoc. Equip. 2016. V. 835. P. 186–225. https://doi.org/10.1016/j.nima.2016.06.125
Taschereau R., Chow P.L., Cho J.S., Chatziioannou A.F. // Nucl. Instruments Methods Phys. Res. Sect. A Accel. Spectrometers, Detect. Assoc. Equip. 2006. V. 569. № 2 SPEC. ISS. P. 373–377. https://doi.org/10.1016/j.nima.2006.08.038
Khusnulina A. // IOP Conf. Ser. Mater. Sci. Eng. 2014. V. 66. № 1. P. 012032. https://doi.org/10.1088/1757-899X/66/1/012032
Stabin M.G., Konijnenberg M.W. // J. Nucl. Med. 2000. V. 41. № 1. P. 149–160.
Radionuclide Decay Data [Electronic resource]. URL: http://hps.org/publicinformation/radardecaydata.cfm (accessed: 15.05.2022).
Andersson M., Johansson L., Eckerman K., Mattsson S. // EJNMMI Res. EJNMMI Research, 2017. V. 7. № 1. P. 88. https://doi.org/10.1186/s13550-017-0339-3
Goorley T., James M., Booth T., Brown F., Bull J., Cox L.J., Durkee J., Elson J., Fensin M., Forster R.A., Hendricks J., Hughes H.G., Johns R., Kiedrowski B., Martz R., Mashnik S., McKinney G., Pelowitz D., Prael R., et al. // Nucl. Technol. 2012. V. 180. № 3. P. 298–315. https://doi.org/10.13182/NT11-135
de Blois E., Chan H.S., de Zanger R., Konijnenberg M., Breeman W.A.P. // Appl. Radiat. Isot. Elsevier, 2014. V. 85. P. 28–33. https://doi.org/10.1016/j.apradiso.2013.10.023
de Blois E., Sze Chan H., Konijnenberg M., de Zanger R., A.P. Breeman W. // Curr. Top. Med. Chem. 2013. V. 12. № 23. P. 2677–2685. https://doi.org/10.2174/1568026611212230005
Ruigrok E.A.M., Tamborino G., de Blois E., Roobol S.J., Verkaik N., De Saint-Hubert M., Konijnenberg M.W., van Weerden W.M., de Jong M., Nonnekens J. // Eur. J. Nucl. Med. Mol. Imaging. Springer Berlin Heidelberg, 2022. № 0123456789. P. https://doi.org/10.1007/s00259-022-05821-w
Traino A.C., Marcatili S., Avigo C., Sollini M., Erba P.A., Mariani G. // Med. Phys. 2013. V. 40. № 4. P. 042505. https://doi.org/10.1118/1.4794473
PRODUCT MONOGRAPH LUTATHERA ® [Electronic resource] // Toxicology. 2010. P. 1–55. URL: https://www.samnordic.se/wp-content/uploads/ 2018/05/LUTATHERA-MONOGRAPH-120218.pdf.
Dosing & Administration I PLUVICTO [Electronic resource]. URL: https://www.hcp.novartis.com/products/pluvicto/psma-positive-mcrpc/dosing-and-administration/ (accessed: 01.08.2022).
LnHB. Nuclear data – Laboratoire National Henri Becquerel [Electronic resource]. URL: http://www.lnhb.fr/nuclear-data/nuclear-data-table/ (accessed: 14.08.2022).
de Zanger R.M.S., Chan H.S., Breeman W.A.P., de Blois E. // J. Radioanal. Nucl. Chem. Springer International Publishing, 2019. V. 321. № 1. P. 285–291. https://doi.org/10.1007/s10967-019-06573-y
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


