Физикохимия поверхности и защита материалов, 2019, T. 55, № 6, стр. 610-619
Формирование и свойства привитых к активному углероду электрон- и ионпроводящих слоев N-замещенных производных ПВХ
А. Ю. Цивадзе 1, А. Я. Фридман 1, А. А. Аверин 1, М. П. Шабанов 1, Е. М. Морозова 1, Г. А. Петухова 1, А. К. Новиков 1, И. И. Бардышев 1, *, И. Я. Полякова 1, А. М. Горбунов 1, В. Н. Титова 1, А. А. Явич 1
1 Федеральное государственное бюджетное учреждение науки, Институт физической химии и электрохимии
им. А. Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, корп. 4, Россия
* E-mail: bardyshev@phyche.ac.ru
Поступила в редакцию 14.02.2019
После доработки 13.04.2019
Принята к публикации 15.04.2019
Аннотация
Проведена систематизация исследований в области функционализации углеродных сорбентов, основанной на химическом модифицировании поверхности активного углерода, путем ковалентной прививки макромолекулярных N-замещенных циклических аминов. В результате получены пористые электронопроводящие и люминесцирующие слои, пришитые к подложкам. Слои способны сорбировать органические соединения. При сорбции кислот, гидроксидов и солей металлов слои становятся электрон- и ионпроводящими. В них как в катодно-поляризованных электрохимических мостиках образуется водород, а как в анодно-поляризованных электрохимических мостиках – кислород. Рассмотрены принципы формирования слоев на поверхности материала из волокон целлюлозной нити и асбестовой ткани, а также из никелевых нитей. Показаны особенности таких функционализированных сорбентов.
ВВЕДЕНИЕ
Функционализация углеродных сорбентов, основанная на химическом модифицировании активного углерода (АУ) путем ковалентной прививки к его поверхности различных групп, направлена на повышение их сорбционных характеристик или придания новых свойств. Прививкой радикалов с амино-, окси- и карбоксильными группами синтезированы люминесцирующие нанотрубки. Прививка аминных, карбоксильных, эпоксидных, арильных, алкильных, алкоксильных и фторалкильных групп обеспечивает распределение нанотрубок в полиэтилене, полипропилене и во фторопласте, совместимость нанотрубок с эпоксидными смолами и образование сшивок типа “матрица–наполнитель” в процессе отверждения [1–8]. Прививку ПВХ и его аналогов к АУ используют с целью создания блочных сорбентов, ионопроводящих мембран и сорбционно активных электродов [1–15].
В [16–23] описаны материалы с пористыми люминесцирующими, электронопроводящими слоями из привитых к АУ макромолекулярных N‑замещенных циклических аминов (далее “слои”). Слои синтезируют на подложках путем превращения привитого ПВХ в аминные производные. Слои способны сорбировать органические соединения. При сорбции кислот, гидроксидов и солей металлов слои проводят одновременно электроны и ионы. В слоях как катодно-поляризованных электрохимических мостиках образуется водород, а как в анодно-поляризованных электрохимических мостиках – кислород или хлор. В настоящей работе рассмотрены принципы формирования слоев на поверхности ПВХ-материала, волокон нити целлюлозной и асбестовой ткани и нитей из никеля, а также показаны их особенности как функционализированных сорбентов.
ФОРМИРОВАНИЕ И СТРОЕНИЕ СЛОЕВ
Синтез слоя включает приготовление суспензии из измельченных частиц АУ с сорбированным бензиловым спиртом (БС) и макромолекул ПВХ в тетрагидрофуране (ТГФ) с добавкой триэтаноламина (ТЭА), нанесение на подложку геля, состоящего из ПВХ, сольватированного БС и нековалентно связанного с частицами АУ, прививку ПВХ к АУ с последующим превращением геля в пористый слой.
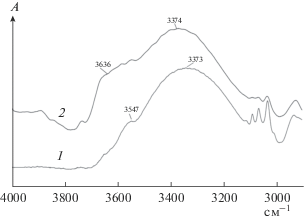
Для приготовления суспензии используют раствор ПВХ в БС, в котором на каждую ClCH< группу ПВХ приходится около трех молекул БС [24]. ИК-спектр раствора приведен на рис. 1. В нем присутствует полоса 3373 см–1, относящаяся к O–H колебанию в БС, в котором атом водорода связан с атомом кислорода из других молекулы БС, и полоса 3636 см–1, относящаяся к O–H колебанию, когда атом водорода связан атомом с меньшей способностью к образованию водородной связи [25]. В данном случае – с атомом хлора из Cl–CH<– группы ПВХ. АУ размалывают в этом растворе, разбавленном ТГФ, с помощью устройства типа блендера до состояния, при котором измельченные частицы равномерно распределены в объеме. Плотность раствора ПВХ почти в 2 раза больше плотности АУ. Поэтому при отсутствии взаимодействия между ПВХ и АУ, углерод всплывал бы независимо от размера частиц. Предельное отношение массовых долей ПВХ и угля в суспензии с равномерным распределением частиц около 1 : 3.2.
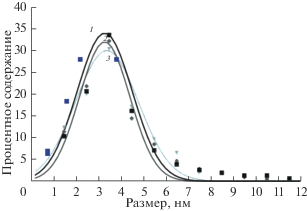
Микрофотографии частиц, в которых ПВХ, сольватированный БС, привит к АУ и зависимости их распределения от размера приведены на рис. 2 и 3. Видны отдельные частицы шарообразной формы и агрегаты из визуально различимых двух, трех или четырех таких частиц. Минимальный размер отдельной частицы около 0.5 мкм, а максимальный – 7 мкм. Преобладают частицы размером от 3 до 5 мкм.
Рис. 2.
Микрофотографии частиц АУ в геле из ПВХ, АУ, БС и ТЭА, полученного из суспензии, разбавленной ТГФ в 8 (а), 4 (б) и 2 (в) раза.
Рис. 3.
Распределения частиц АУ от размера в геле из ПВХ, АУ, БС и ТЭА, полученного из суспензии, разбавленной ТГФ в 8 (а), 4 (б) и 2 (в) раза.
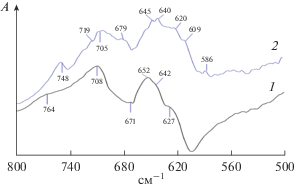
Образование такой суспензии можно объяснить следующий образом. В АУ имеются ароматические гидроксигруппы. Их способность к образованию водородных связей больше, чем у групп в БС. При размоле становятся доступными гидроксигруппы, ранее находящиеся внутри частицы. Они, замещая часть БС, связываются с Cl–CH<– группами ПВХ, и вокруг измельчаемых частиц формируется оболочка из макромолекул ПВХ. На рис. 4 приведены ИК-спектры исходного ПВХ и ПВХ в геле. В спектре ПВХ полосы 709 и 679 см–1, 640 , 620 и 586 см–1 относятся к C–Cl колебаниям в аморфных и кристаллических участках, в участках с неплоской конфигурацией и с разупорядоченными цепями [26]. В спектре ПВХ в геле имеется интенсивная сложная полоса 652 см–1, которая проявляется в спектре растворенного ПВХ [25]. Следовательно, макромолекулы вокруг частиц АУ, вследствие их сольватации БС, не связаны в какие-либо упорядоченные надмолекулярные структуры. По-видимому, частицы размером от 0.5 до 7 мкм полностью окружены макромолекулами, оболочка из которых препятствует дальнейшему измельчению угля. Одни и те же макромолекулы могут участвовать в формировании оболочек нескольких частиц, что приводит к равномерному их распределению.
Для прививки ПВХ к углю используют реакцию –>COH + ClCH< + ТЭА → –>C–O–CH< + + ТЭА ⋅ HCl. В группировках –>C–OH ⋅ Cl–CH< такая реакция выгодна стерически и термодинамически. Было установлено, что частицы в геле из ПВХ, привитого к АУ, по форме и по размерам практически такие же, как и до прививки.
Формирование капсулирующих слоев проводится одновременно с прививкой ПВХ к углю. Суспензию наносят на материал, в поверхностных слоях которого имеются группы, способные взаимодействовать с Cl–CH< группами ПВХ. Для волокон целлюлозной ткани используют >СН–ОН группы из целлобиозных группировок на поверхности фибрилл, а для асбестовой ткани – группировки –>Si–OH на поверхности рулонов волокнистого гидросиликата магния. Пришивку геля ПВХ, прививаемого к углю, проводят путем образования эфирных групп.
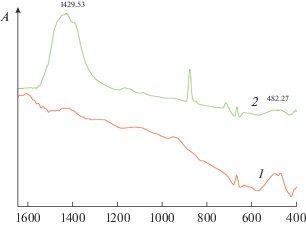
Для прививки геля к поверхности нитей проводят ее подготовку, исходя из следующего. Электронная плотность у атомов в областях изломов, находящихся на поверхности продольных пор, наслоений и раковин, меньше, чем у атомов в объеме материала. Такие атомы способны координировать анионы, с которыми образуют малорастворимые соединения. Поэтому для отмывки нитей используют композиции на основе комплексонов, включающих ${\text{СО}}_{{\text{3}}}^{{{\text{2}} - }}.$ На рис. 5 приведены ИК-спектры поверхности никелевой проволоки и проволоки, подготовленной к капсулированию. В спектре последней имеются полосы 1430 и 860 см–1, относящиеся к колебаниям в ${\text{СО}}_{{\text{3}}}^{{{\text{2}} - }}$ [29]. При их взаимодействии с Cl–CH< группами ПВХ образуются группировки типа моноэфиров угольной кислоты, через которые гель пришивается к нити.
Рис. 5.
ИК-спектры поверхности никелевой проволоки (1) и проволоки, подготовленной к капсулированию (2).
Образование слоя привитых к углю макромолекулярных N-замещенных производных ПВХ основано на взаимодействия групп ПВХ, привитых к АУ, с первичной производной первичного амина согласно реакции 2ClCH< + NH2CH2R + + 2ТЭА → RCH2–N(–CH<)2 + 2ТЭА ⋅ HCl, где R – CH2OH, –COONa, –COOK. Стерически одна группа NH2CH2R может взаимодействовать с ClCH<– группами из разных макромолекул. Цепи ПВХ превращаются в макромолекулярные сетки из сочлененных N-замещенных циклических аминов c транслируемым звеном (–CH2CH–)NR. В зоне их прививки к АУ образуются люминесцирующие циклические группировки из указанных звеньев и углеродных радикалов. Превращения линейных макромолекул, сольватированных БС, в сетки сопровождается принудительным вытеснением БС из полостей циклов. Макромолекулы связаны как с АУ, так и с подложкой, поэтому БС выделяется из слоя через его поверхность. Согласно [27], под давлением вытесняемой жидкости формируются “hard–elastic” структуры в виде шарообразных или эллипсообразных полостей, соединенных каналами, которые становятся порами со стенками из сочлененных циклов.
В табл. 1 приведены значения массовой доли АУ и показателя γ – содержания транслируемых звеньев в циклах слоев из привитых к АУ этаноламиновых, натрий глицинатных и калий глицинатных производных ПВХ, полученных из гелей с отношением АУ : ПВХ, равным 1 : 1, 1 : 2 и 1 : 3. Они обозначены как МЭ-1, МЭ-2 и МЭ-3, как ГН-1, ГН-2 и ГН-3, и ГН-1, ГН-2 и ГН-3, и как ГК-1, ГК-2 и ГК-3, соответственно.
Таблица 1.
Состав слоев
| Слой | Уголь, % | γ, ммоль/г | Слой | Уголь, % | γ, ммоль/г | Слой | Уголь, % | γ, ммоль/г |
|---|---|---|---|---|---|---|---|---|
| МЭ-1 МЭ-2 МЭ-3 |
51.5 68.6 76.8 |
4.29 2.77 2.05 |
ГН-1 ГН-2 ГН-3 |
47.7 64.6 73.2 |
3.51 2.37 1.79 |
ГК-1 ГК-2 ГК-3 |
43.7 60.8 69.9 |
3.4 2.37 1.82 |
Было установлено, что форма частиц в слоях, их размер и вид распределения частиц от размера практически такие же, как после прививки ПВХ.
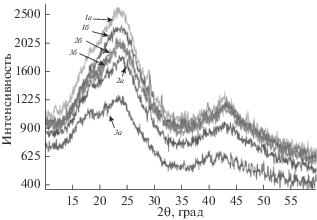
На рис. 6 приведены рентгеновские дифрактограммы МЭ-2, ГН-2, ГК-2, МЭ-3, ГН-3 и ГК-3. На них имеются по две полосы с максимумами при 22.8 и 42.4 ТЭА. Интенсивность сигналов возрастает с увеличением содержания АУ. Согласно [28], эти полосы характеризуют строение углеродных структур в частицах АУ. Природа привитого производного ПВХ мало влияет на внутреннее строение частиц АУ.
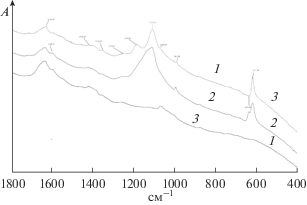
На рис. 7 приведены ИК-спектры МЭ-1, ГН-1, ГК-1. В области 850–600 см–1 практически отсутствуют полосы C–Cl колебаний в ПВХ [29]. Это означает, что практически все C–Cl группы были использованы в процессах прививки и образования циклических аминов. В спектрах имеется широкая полоса 1721 см–1 и полоса 1071 см–1, относящиеся к C=C и C–O колебаниям группировках, типа C=C–C–C–OR [27]. Они входят в структуру циклов в зоне прививки. В спектрах ГН-3 и ГК-3 имеются полосы около 1594 и 1478 см–1 антисимметричного и симметричного колебаний в –COO– в анионах аминокислот [29].
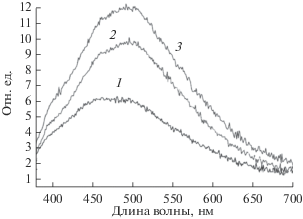
На рис. 8 приведены спектры люминесценции МЭ-1 ГН-1 и ГК-1. Полосы люминесценции находится в области 350–680 нм, той же области, что и спектры модифицированных углеродных нанотрубок с привитыми радикалами с амино-, гидрокси- или карбоксильной группами, близки им по форме и относятся к π* → π переходам в сопряженных углеродных группировках [5–7]. Полосы имеют сложную структуру. Для образца МЭ-3 максимум находится около 475 нм, для образцов ГН-3 и ГК-3 – около 489 нм. Следовательно, замена –ОН группы на –СОО группу привела к сдвигу максимума в длинноволновую область. Интенсивность люминесценции увеличивается в ряду – –ОН < –СООK<–.
В табл. 2 приведены значения электронной проводимости слоев σ. Видно, что σ зависит от содержания АУ и коррелирует со значениями γ. При уменьшении γ соответственно уменьшается общее количество циклов, приходящихся на одну частицу угля. При этом, чем меньше γ, тем больше доля циклов с углеродными радикалами, и тем меньше расстояния между частицами. При одном и тем же значении γ проводимость слоев возрастает в ряду –CH2CH2OH < CH2COONa < –CH2COOK, причем значение σ у слоев с этаноламиновыми производными в два и более раз меньше, чем в случае натрий глицинатных производных. Это можно объяснить тем, что с увеличением размера заместителя уменьшатся расстояние между частицами угля.
Таблица 2.
Электронная проводимость слоев
| Слой | σ × 103, см | Слой | σ × 103, см | Слой | σ × 103, см |
|---|---|---|---|---|---|
| МЭ-1 МЭ-2 МЭ-3 |
0.35 1.69 2.08 |
ГН-1 ГН-2 ГН-3 |
0.75 3.45 5.55 |
ГК-1 ГК-2 ГК-3 |
0.85 4.67 5.88 |
При превращении ПВХ в соответствующие производные в геле, который пришит к подложке, слой становится пришитым к волокнам и нитям. В зоне пришивки частицы АУ с привитыми сетками заполняют пустоты и поры подложки. При этом, происходит формирование пор со стенками из группировок поверхностных слоев и из транслируемых групп, связанных через эфирные группы. В случае нитей между металлом и АУ происходит электронный обмен. Было установлено, что спектры люминесценции слоев на волокнах целлюлозы и асбеста близки к спектрам слоев на пленке ПВХ. Это означает, что строение слоев не зависит от природы подложки.
ОСОБЕННОСТИ СЛОЕВ КАК ФУНКЦИОАНАЛИЗИРОВАННЫХ СОРБЕНТОВ
Микрофотография поверхности МЭ-1 показала, что на ней имеются продольные щели, имеются выпуклости с кратерами и бугристые участки. В табл. 3 приведены значения парциального объема Vпарц АУ в слоях. Видно, что в зависимости от массовой доли АУ и природы заместителя Vпарц больше 66%. На долю производных ПВХ приходится менее 34%. Вместе с тем, согласно условиям синтеза слоя, частицы Vпарц, примыкающие к поверхности и находящиеся в объеме, окружены сетками производных ПВХ. Поэтому вещества попадают в слой путем сорбции в поры со стенками из циклических аминов или со стенками из звеньев с аминогруппами и участков из углерода.
Рис. 9.
Изотермы адсорбции паров бензола (а) и воды (б) в МЭ-1 на целлюлозной ткани. 1 – ветвь адсорбции, 2 – ветвь десорбции.
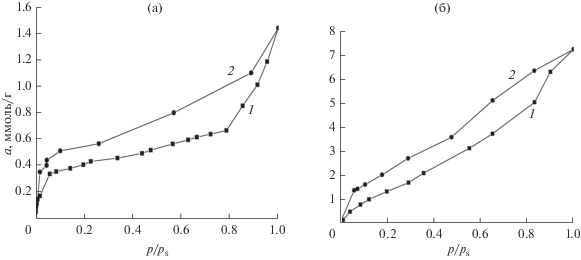
Таблица 3.
Парциальный объем угля в слоях
| Cлой | Vпарц угля, % | Cлой | Vпарц угля, % | Cлой | Vпарц угля, % |
|---|---|---|---|---|---|
| МЭ-1 МЭ-2 МЭ-3 |
70.5 72.8 87.9 |
ГН-1 ГН-2 ГН-3 |
68.6 81.4 86.7 |
ГК-1 ГК-2 ГК-3 |
66.1 79.6 85.4 |
Циклы являются базой для образования молекулярных комплексов “хозяин–гость” [30, 31], наличие аминогрупп обуславливает сорбцию кислот [31]. Циклы как макроциклические лигандные группировки могут координировать ионы металлов [32, 33], что предопределяет поглощение гидроксидов и солей щелочных металлов.
В табл. 4 приведены величины сорбционной емкости слоев на пленке ПВХ при поглощении насыщенных паров и жидкого бензола или гексана. Видно, что G (п) и G (ж) при поглощении бензола уменьшаются, а G (п) и G (ж) при поглощении гексана возрастают с увеличением содержания угля. Это означает, что основная часть гексана дислоцирована в угле, а бензола – в порах угля и в порах со стенками из циклов.
Таблица 4.
Сорбционная емкость слоев при поглощении бензола и гексана
| Слой | Бензол, ммоль/г | Гексан, ммоль/г | ||
|---|---|---|---|---|
| пар | жидкость | пар | жидкость | |
| МЭ-1 ГН-1 ГК-1 МЭ-2 ГН-2 ГК- 2 МЭ- 3 ГН-3 ГК-3 |
13.4 10.4 9.1 11.5 12.0 10.4 9.8 12.7 11.3 |
17.1 14.3 15.0 12.6 12.5 12.0 13.2 13.2 12.7 |
3.7 4.1 2.3 5.4 5.1 3.2 7.6 6.6 5.8 |
5.3 4.9 3.3 6.2 5.3 4.7 8.6 7.0 5.9 |
Изотермы адсорбции паров бензола и воды в МЭ-1 приведены на рис. 9. Ветвь адсорбции паров бензола и воды состоит двух ступеней. Первая находится в области p/ps < 0.3, а вторая в области p/ps > 0.32. Константы сорбции бензола K1a = 2.79 × × 103 и K2a = 6.6, а воды – K1a = 1.03 × 101 и K2a = = 3.4. Объем пор, заполненных на первой ступени бензолом, равен 0.3 см3/г, а водой – 0.31 см3/г, что составляет около 24% сорбционного объема МЭ-1. Ветвь десорбции находится выше ветви адсорбции. Она также состоит из двух ступеней. В области p/ps от 1 до 0.32 по мере уменьшения p/ps степень заполнения объема пор уменьшилась примерно на 75–77%. Константа десорбции бензола K1d ≈ 2.6, а воды K1d ≈ 1.4. Они на три порядка меньше констант сорбции. Это позволяет предположить, что сорбция является термодинамически выгодным процессом, а десорбция – невыгодным.
Рис. 10.
Спектры люминесценции МЭ-1, пропитанного растворителем (а), и с недесорбируемым растворителем (б): 1 – декан, 2 – бензол, 3 – толуол, 4 – безальдегид, 5 – диоксан, 6 – циклогексан.
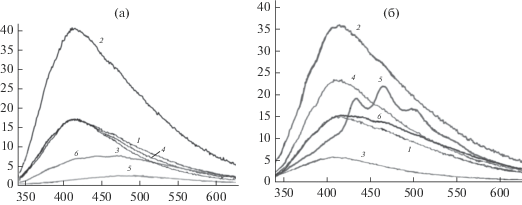
На рис. 10 приведены спектры люминесценции МЭ-1, пропитанные деканом, бензолом, толуолом, бензальдегидом, диоксаном и циклогексаном. В спектрах слоев с деканом, толуолом и диметилсульфоксидом наблюдается частичное тушение люминесценции, в спектрах слоев с бензальдегидом, диоксаном и диметилформамидом наряду с тушением наблюдается изменение положения максимумов, а в случае бензола – в спектрах наблюдается увеличение интенсивности люминесценции. Это указывает на нековалентные хемосорбционные взаимодействия в предельно сольватированных структурах. В спектрах слоев с растворителем, оставшимся после десорбции, интенсивность люминесценции меньше, чем для исходного слоя. В случае бензальдегида, БС и диметилсульфоксида интенсивность в спектре больше, а в случае бензола, декана, диоксана, толуола и диметилформамида – меньше, чем у слоев, насыщенных жидким растворителем. Это означает, что состав комплексов с недесорбированным растворителем отличается от состава с предельно сольватированными циклами. В этих слоях, вероятно, все молекулы растворителя связаны в комплексы, то есть нековалентно связаны со структурными элементами стенок пор. На люминесценцию могут влиять молекулы, связанные с гидроксо – и аминогруппой или с группами из углерода в зоне прививки. В слое, насыщенном растворителем, к молекулам из комплексов ассоциируют молекулы, из которых формируется сольватные оболочки.
Рис. 11.
Спектры люминесценции МЭ-1 с Na2SO4 (1), МЭ-1 с K2SO4 (2), ГН-1 с Na2SO4 (3), и ГК-1 с K2SO4 (4).
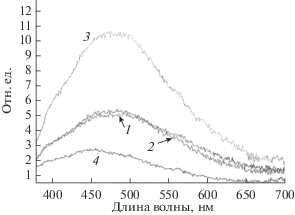
В табл. 4 и 5 приведены величины содержания хлоридов и сульфатов натрия и калия, сорбируемых в слои из водных растворов, и показателя $\dot {n}$ – среднего числа звеньев с аминогруппами, приходящимися на один ион. Связывание солей щелочных металлов основано на координации иона металла в полости циклического лиганда. На рис 11 приведены спектры люминесценции МЭ-1, ГН-1 и ГК-1 с Na2SO4 и K2SO4. Видно, что полоса люминесценции слоев с Na2SO4 и K2SO4 сдвигается в коротковолновую область 25–35 нм. Такой сдвиг возможен при связывании ионов с атомами азота с эфирными атомами кислорода в циклах с группами из углерода. В этих сферах в координации должно участвовать не менее двух атомов азота из транслируемых элементов. Из таблиц видно, что для МЭ-1, МЭ-2, ГН-1, ГК-1 и ГК-2 $\dot {n}$ > 2. Это означает, что Na+ и K+ дислоцированы в стенках пор, а анионы – в порах вблизи стенок. С уменьшением доли производных ПВХ уменьшается содержание макроциклических лигандных групп. Для МЭ-3, ГН-3, ГК-3 $\dot {n}$ < 2. Это указывает на образование многоядерных комплексов с мостиковыми анионами. При этом один Na+ или K+ находится в полости макроцикла в стенках пор, а другие – в порах.
Таблица 5.
Содержание солей в слое и число звеньев, приходящихся на один ион
| Слой | Соль | с | $\dot {n}$ | Слой | Соль | с | $\dot {n}$ |
|---|---|---|---|---|---|---|---|
| МЭ-1 МЭ-1 МЭ-1 МЭ-1 МЭ-2 МЭ-2 МЭ-2 МЭ-2 МЭ-3 МЭ-3 МЭ-3 МЭ-3 |
NaCl KCl Na2SO4 K2SO4 NaCl KCl Na2SO4 K2SO4 NaCl KCl Na2SO4 K2SO4 |
1.35 1.25 0.46 0.28 3.22 1.03 0.42 0.3 3.63 3.12 0.88 0.63 |
3.22 3.6 5.0 7.1 2.75 2.9 3.47 4.9 0.55 0.70 1.2 3.2 |
ГН-1 ГК-1 ГН-1 ГК-1 ГН-2 ГК-2 ГН-2 ГК-2 ГН-3 ГК-3 ГН-3 ГК-4 |
NaCl KCl Na2SO4 K2SO4 NaCl KCl Na2SO4 K2SO4 NaCl KCl Na2SO4 K2SO4 |
1.55 0.53 0.45 0.38 1.18 0.91 0.58 0.29 1.23 1.09 0.59 0.47 |
2.6 6.1 7.8 4.5 2.8 2.6 4.1 4.2 1.4 1.7 1.8 1.8 |
Рис. 12.
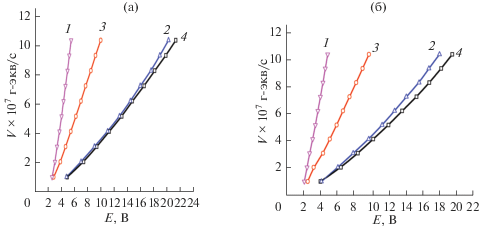
Зависимость скорости движения H+ в МЭ-1 с H2SO4 на асбестовой ткани (1) и на целлюлозной ткани (2) и движения ОН– в МЭ-1 с NaOH на асбестовой ткани (3) и на целлюлозной ткани (4) от напряжения.
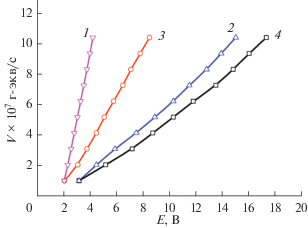
В табл. 6 приведены значения кислотной и щелочной емкости слоев. Они зависят от содержания АУ и от природы кислоты или гидроксида щелочного металла. Молекулы сорбированных кислот и гидроксидов с участием молекул воды в слоях через водородные связи объединены в ассоциаты. В электрохимических мостиках из материалов с такими слоями по системе водородных связей происходит движение H+ или OH–. Примеры зависимостей скорости движения ионов от напряжения проведены на рис. 12. При катодной поляризации таких мостиков на частицах угля образуется водород, а при анодной – кислород. Примеры зависимостей скорости образования H2 и O2 от напряжения приведены на рис. 13. Скорость движения ионов и образования H2 и O2 в слое на волокнах асбестовой ткани больше, чем на целлюлозной. Это связано с тем, что удельная поверхность волокон гидросиликата магния больше, чем фибрилл целлюлозы. Вследствие этого сорбционный объем зоны пришивки к асбесту больше, чем к целлюлозе.
Таблица 6.
Кислотная и щелочная емкость слоев
| Слой | Н+, ммоль/г | Слой | ОН+, ммоль/г | Слой | ОН+, ммоль/г | Слой | ОН+, ммоль/г | ||
|---|---|---|---|---|---|---|---|---|---|
| HCl | H2SO4 | NaOH | KOH | NaOH | KOH | ||||
| МЭ-1 МЭ-2 МЭ-3 |
2.2 1.7 2.44 |
1.47 1.13 2.5 |
МЭ-1 МЭ-2 МЭ-3 |
2.27 2.06 3.2 |
1.46 1.37 2.46 |
ГН-1 ГН-2 ГН-3 |
1.62 2.15 2.18 |
ГК-1 ГК-2 ГК-3 |
1.5 1.23 1.49 |
Рис. 13.
Зависимость от напряжения скорости образования Н2 (а) и O2 (б) в МЭ-1 с H2SO4 на асбестовой (1) и целлюлозной (2) ткани и в МЭ-1 с NaOH на асбестовой (3) и целлюлозной ткани в ЦУЭЦ * H2SO4 (4).
Связывание донорных атомов азота и кислорода в комплексы Na+ и K+ не препятствует сорбции органических соединений. В табл. 5 и 6 приведены данные содержания гексана и бензола виде пара и жидкости в слоях, содержащих кислоты, гидроксиды и соли щелочных металлов. Видно, сорбционная емкость слоев с соединениями металлов при поглощении паров во всех случаях меньше, чем слоев без соединений. По-видимому, при координации Na+ и K+ снижается способность циклов к образованию комплексов “хозяин–гость”. В случае хлоридов и сульфатов, вероятно, большая часть бензола и гексана сосредоточена в угле. Содержание жидких бензола и гексана в слоях с хлоридами и сульфатами больше, а в слоях с гироксидами – меньше, чем в слоях без соединений металлов. Было установлено, что сорбция растворителей в слои с кислотами, гидроксидами и солями мало сказывается на H+ или OH– проводимость слоев на образование в них H2 и O2.
Таблица 7.
Поглощение бензола и гексана слоями, содержащими кислоту или гидроксид щелочного металла
| Слой | Кислота | Бензол, ммоль/г | Гексан, ммоль/г | Гидро- окись |
Бензол, ммоль/г | Гексан, ммоль/г | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| пар | жидк. | пар | жидк. | пар | жидк. | пар | жидк. | |||
| МЭ-1 МЭ-1 МЭ-2 МЭ-2 МЭ-3 МЭ-3 |
HCl H2SO4 HCl H2SO4 HCl H2SO4 |
9.3 9.5 12.5 12.0 12.6 11.5 |
15.9 15.3 13.3 12.8 12.7 14.3 |
3.0 3.6 3.3 4.5 6.0 5.8 |
6.0 3.9 5.8 5.9 7.7 6.56 |
NaOH KOH NaOH KOH NaOH KOH |
10.6 8.1 11.5 10.8 10.4 12.0 |
15.7 16.3 11.8 11.7 15.5 13.8 |
2.6 4.0 3.0 3.6 6.8 5.6 |
3.1 6.0 4.8 5.6 6.6 6.8 |
Таблица 8.
Поглощение бензола и гексана слоями, содержащими соль щелочного металла
| Слой | Соль | Бензол, ммоль/г | Гексан, ммоль/г | Слой | Соль | Бензол, ммоль/г | Гексан, ммоль/г | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| пар | жидк. | пар | жидк. | пар | жидк. | пар | жидк. | ||||
| ГН-1 ГН-1 ГН-2 ГН-2 ГН-3 ГН-3 |
NaCl Na2SO4 NaCl Na2SO4 NaCl Na2SO4 |
10.5 11.1 13.8 12.4 11.1 11.3 |
16.7 13.7 13.9 15.4 13.1 14.6 |
3.2 3.9 3.7 4.6 6.3 5.4 |
5.9 4.8 4.5 6.6 9.3 8.0 |
ГК-1 ГК-1 ГК-2 ГК-2 ГК-3 ГК-3 |
КCl К2SO4 КCl К2SO4 КCl К2SO4 |
12.7 10.7 11.3 11.7 11.7 11.5 |
14.0 14.1 12.2 13.6 14.2 12.6 |
4.0 4.3 5.3 7.3 6.7 6.8 |
5.0 12.7 6.8 7.8 7.5 7.3 |
ЗАКЛЮЧЕНИЕ
Химическое модифицирование поверхности АУ путем ковалентной прививки макромолекулярных N-замещенных циклических аминов для получения пористых электронопроводящих, люминесцируюших слоев, пришитых к подложкам, является новым перспективным направлением в области функциоанализации углеродных сорбентов.
Список литературы
Chun YangYin, Mohd Kheireddine Aroua, Wan Mohd Ashri Wan Daud. // Separation and Purification Technology. 2007. V. 52. № 3. P. 403–415.
Mohammad Saleh Shafeeyan, Wan Mohd Ashri Wan Daud, Amirhossein Houshmand, Ahmad Shamiri. // J. Analytical and Applied Pyrolysis. 2010. 89. P. 143–151.
Bhatnagar A., Hogland W., Marques M., Sillanpää M. Chemical Engineering // J. 2013. V. 219. P. 499–511.
Rachel R.V.A. Rios, Dênio E. Alves et al. // Materials Research. 2003. V. 6. № 2. P. 129–135.
Lefebvre J., Fraser J.M., Finnie P., Homma Y. // Phys. Rev. B. 2004. V. 69. 075403.
Ray S.C., Saha A., Jana N.R., Sarkar R. J. // Phys. Chem. C. 2009. V. 113. P. 18546–18551.
Woosung Kwon, Sungan Do, Ji-Hee Kim et al. // Scientific Reports. 2015. 5. Article number: 12604.
Дьячкова Т.П., Ткачев А.Г. Методы функционализации и модифицирования углеродных нанотрубок. М.: Издательский дом “Спектр”, 2013, 152 c.
Marcia Anson, José Marchese, Eduardo Garis et al. // J. Membrane Science. 2004. Nos. 1–2. P. 19–28.
Asquith B.M., Meier-Haack J., Ladewig B.P. // Chemical Engineering Research and Design. 2015. V. 104. P. 81–91.
Чуднова Т.А., Вайнштейн Э.Ф. // Конструкции из композиционных материалов. 2009. № 4. С. 55–63.
Qi Zhang, Houbin Li, Pan Zhang, Liangliang Liu, Yuhang He, Yali Wang. // Nanoscale Res. Lett. 2014. 9(1). P. 283.
Asquith B.M., Meier-Haack J., Ladewig B.P. // J. Materials Science. 2014. 49(3).
Asquith B.M., Meier-Haack J., Ladewig B.P. // Chemical Engineering Research and Design. 2015. V. 104. P. 81–91.
Mariana Altenhofen da Silva, Melissa Gurgel Adeodato Vieira. // Polymer Testing. 2011. V. 30. № 5. P. 478–484.
Цивадзе А.Ю., Фридман А.Я., Шабанов М.П. и др. Материалы XVI Всероссийского симпозиума с международным участием “Актуальные проблемы теории адсорбции, пористости и адсорбционной селективности”, ФГБУН ИФХЭ РАН, 2018, М. С. 75.
Цивадзе А.Ю., Фридман А.Я., Шабанов М.П., Морозова Е.М., и др. Сборник Физико-химические проблемы адсорбции в нанопористых материалах: Материалы Всероссийского симпозиума с международным участием, 21–25 мая 2018 г. ИФХЭ РАН М. С. 118.
Морозова Е.М., Цивадзе А.Ю., Фридман А.Я. и др. Материалы Всероссийского симпозиума с международным участием, 2018. ИФХЭ РАН. М. С. 120.
Цивадзе А.Ю., Фридман А.Я., Шабанов М.П. и др. Материалы Всероссийского симпозиума с международным участием, 21–25 мая 2018 г. ИФХЭ РАН. М. С. 119.
Shabanov Maxim P., Tsivadze Aslan Yu., Fridman Alexander Ya. et al. // International J. Current Advanced Research. V. 7. P. 11031–11033.
Shabanov M.P., Tsivadze A.Yu., Fridman A.Ya. et al. Chemical Science Review and Letters. 2018. V. 6(21). P. 88–93.
Tsivadze A.Yu., Fridman A.Ya, Morozova E.M. et al. // Russian J. Physical Chemistry A. 2018. V. 92. № 2. P. 368–372.
Tsivadze A.Yu., Fridman A.Ya., Voloshchuk A.M. et al. // Russian J. Electrochemistry. 2017. V. 53. № 1. P. 39–48.
Tsivadze A.Yu., Fridman A.Ya., Voloshchuk A.M. et al. // Protection of Metals and Physical Chemistry of Surfaces. 2009. V. 45. № 6. P. 693–698.
Тарасевич Б.Н. ИК-спектры основных классов органических соединений, 2012. М. изд. МГУ. 54 с.
Пейнтер П., Коулмен М., Кениг Дж. Теория колебательной спектроскопии. Приложение к полимерным материалам. М.: Мир. 1986. 580 с.
Волынский А.Л., Бакеев Н.Ф. Структурная самоорганизация аморфных полимеров, М.: Физматлит. 2005. 232 с.
Girgis S., Temerk Y.M., Gadelrab M.M., Ibrahim D. // Carbon Science. 2007. V. 8. № 2. P. 95–100.
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds: Part A: Theory and Applications in Inorganic Chemistry, Sixth Edition 2009 John Wiley & Sons.
Tsivadse A.Yu., Fridman A.Ya., Morozova E.M. et al. // Russian J. Physical Chemistry A. 2012. V. 86. № 3. P. 452–456.
Fridman A.Ya., Tsivadse A.Yu., Tsivadse A.Yu. et al. // Protection of Metals and Physical Chemistry of Surfaces. 2015. V. 51. № 6. P. 990–1009.
Melson G.A. Ed. Coordination Chemistry of Macrocyclic Compounds. N.Y.: Plenum Press, 197. 664 p.
Скопенко В.В., Цивадзе А.Ю., Савранский Л., Гарновский А.Д. // Координационная химия. М., 2007. 487 с.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов