Физикохимия поверхности и защита материалов, 2020, T. 56, № 2, стр. 115-121
Адсорбция газов на полимерном адсорбенте МN-270 в области сверхкритических температур и давлений
А. А. Прибылов 1, *, К. О. Мурдмаа 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, стр. 4, Россия
* E-mail: pribylov_34@mail.ru
Поступила в редакцию 17.06.2019
После доработки 14.11.2019
Принята к публикации 21.11.2019
Аннотация
Проведено исследование адсорбции азота, аргона и метана в полимерном адсорбенте MN-270 в интервале давлений 0.1–40 МПа при температурах 303, 323, 343, 363 К. Для этих адсорбционных систем измерены изотермы избыточной адсорбции, определены адсорбционные объемы, рассчитаны изотермы адсорбции полного содержания, характеристические энергии адсорбции, дифференциальные, интегральные, средние изостерические и рассчитанные через характеристические энергии теплоты адсорбции.
ВВЕДЕНИЕ
Пористые полимерные адсорбенты различаются по химической природе, величине удельной поверхности, адсорбционному объему, эффективной ширине пор и распределению пор по размерам, что приводит к различию адсорбционных свойств этих адсорбентов. Полимерные адсорбенты нового класса – сверхсшитые полистиролы – обладают высокой адсорбционной активностью по отношению к парам органических веществ [1]. Целью настоящей работы является изучение адсорбции различных газов в таком адсорбенте в широком интервале изменения параметров адсорбционного равновесия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Измерения проводили на объемно-весовой установке высокого давления, подробно описанной ранее [2], на которой определяли вес ампулы с сорбентом при заданном давлении и температуре газов. Измерения проводили в диапазоне давлений 0.1–40 МПа при температурах 303, 323, 343 и 363 К.
В качестве адсорбента использовали сверхсшитый полимерный адсорбент МN-270, являющийся лабораторным аналогом образца МN-200, выпускаемого фирмой Putolite International Lid. (Великобритания). В качестве адсорбтивов – СН4 – [3], N2 – [4] и Ar – [5], все с чистотой не хуже 99.9%.
По экспериментальным данным были рассчитаны изотермы избыточной адсорбции по уравнению:
(1)
$\Gamma \left( {P,T} \right) = {\text{ }}[m{\text{ }}--{{\rho }_{g}}({{V}_{{amp}}}--{{{{{{m}_{{ads}}}} \mathord{\left/ {\vphantom {{{{m}_{{ads}}}} {{{\rho }_{{ads}}}}}} \right. \kern-0em} {{{\rho }_{{ads}}}}})]} \mathord{\left/ {\vphantom {{{{{{m}_{{ads}}}} \mathord{\left/ {\vphantom {{{{m}_{{ads}}}} {{{\rho }_{{ads}}}}}} \right. \kern-0em} {{{\rho }_{{ads}}}}})]} {{{m}_{{ads}}}}}} \right. \kern-0em} {{{m}_{{ads}}}}},$ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Энергетические параметры адсорбции определяются по изотермам адсорбции полного содержания а(Р, Т). Связь избыточной изотермы адсорбции с изотермой адсорбции полного содержания выражается уравнением:
(2)
$\begin{gathered} \Gamma \left( {Р,Т} \right) = а(Р,T) - {{\rho }_{g}}\left( {Р,Т} \right)W = \\ = {{\rho }_{а}}\left( {Р,Т} \right)W - {{\rho }_{g}}\left( {Р,Т} \right)W, \\ \end{gathered} $Чтобы пересчитать изотермы избыточной адсорбции Г(P, T) в изотермы адсорбции полного содержания а(Р, Т), необходимо определить адсорбционный объем W.
Адсорбционные объемы для изучаемых трех систем MN-270–CН4, MN-270–N2 и MN-270–Ar определяли по избыточным изотермам адсорбции для температур 303, 323, 343 и 363 К методом [7], основанном на универсальной связи (2), т.е. на различии изотерм Г(Р, Т) и а(Р, Т) в широком диапазоне давлений. Избыточная изотерма адсорбции, измеренная в широком диапазоне давлений, качественно отличается от изотермы полного содержания. Избыточная изотерма адсорбции с увеличением давления растет, проходит через максимум и далее уменьшается (см. рис. 1), а изотерма адсорбции полного содержания с увеличением давления растет и стремится к предельному значению а0(Р, Т). В этой области давлений производная (∂а/∂Р)т стремится к нулю при этом не меняя знак, как в случае с избыточной изотермой адсорбции [8]. В качестве изотермы адсорбции полного содержания использовали уравнение Бакаева [9], полученное методом статистической термодинамики, которое для адсорбции веществ на адсорбентах с нерегулярной структурой имеет вид:
(3)
$a = {{K}_{0}}\frac{{P{{K}_{1}} + 2{{P}^{2}}{{K}_{2}} + \ldots n{{P}^{n}}{{K}_{n}}}}{{1 + P{{K}_{1}} + {{P}^{2}}{{K}_{2}} + \ldots {{P}^{n}}{{K}_{n}}}},$(4)
$\begin{gathered} \Gamma (Р,Т) = \frac{{{{K}_{0}}({{K}_{1}}P + 2{{K}_{2}}{{P}^{2}} + 3{{K}_{3}}{{P}^{3}})}}{{1 + {{K}_{1}}P + {{K}_{2}}{{P}^{2}} + {{K}_{3}}{{P}^{3}}}} - \\ - \,\,W\frac{{K_{0}^{g}(K_{1}^{g}P + 2K_{2}^{g}{{P}^{2}} + 3K_{3}^{g}{{P}^{3}})}}{{1 + K_{g}^{1}P + K_{g}^{2}{{P}^{2}} + K_{g}^{3}{{P}^{3}}}}. \\ \end{gathered} $Рис. 1.
Изотермы избыточной адсорбции СН4 на MN-270 при Т, К: 303 (1), 323 (2), 343 (3), 363 (4), значки рассчитаны по уравнению (1), сплошные линии по уравнению (4).

Значения Ki и W определяли методом Ньютона так, чтобы достигалось наилучшее соответствие избыточной изотермы адсорбции, рассчитанной из экспериментальных данных (значки) по уравнению (1) и изотермы Γ(Р), рассчитываемой по уравнению (4) (сплошные линии). Для примера на рис. 1 показана изотерма избыточной адсорбции системы MN-270–Ar. Для систем MN-270–СН4 и MN-270–N2 эти зависимости аналогичны. Среднее значение адсорбционного объема для всех систем, определенное при четырех температурах, составило 〈W〉 = 0.64 см3/г.
Как известно, адсорбция это процесс поглощения вещества (адсорбтива) твердым телом (адсорбентом), при котором плотность адсорбированного вещества (адсорбата) значимо отличается от плотности адсорбтива и который происходит с выделением теплоты (см., например, [10]). При адсорбции паров поглощение адсорбтива происходит в интервале давлений от нуля до Р = Рs и при этом выделяется теплота адсорбции, как за счет взаимодействия молекул адсорбата с адсорбентом, так и за счет взаимодействия молекул адсорбата между собой. Нет разумных причин считать, что при адсорбции газов процесс будет протекать принципиально по-иному, но в газовой области отсутствует понятие давления насыщенного пара Р = Рs. Ранее [11] мы предложили давление в точке, где согласно уравнению (2) ρа = = а(Р, Т)/W = ρg(Р, Т), считать аналогом давления насыщенного пара Р = “Рs”, при котором процесс адсорбции завершается. Чтобы найти “Рs(Т)”, нужно для каждой системы адсорбент – адсорбат построить графики зависимостей ρа(Р, Т) и ρg(Р, Т). Точка пересечения этих зависимостей и определяет искомое значение аналога давления “Рs(Т)”. В качестве примера на рис. 2 приведены зависимости ρа и ρg для системы Ar–MN-270 при четырех температурах. Для систем СН4–MN-270 и N2–MN-270 “Рs(Т)” находили таким же образом. Определенные по этой схеме для всех систем и температур значения “Рs(Т)” приведены в табл. 1.
Рис. 2.
Изотермы адсорбции полного содержания CH4 на MN-270 при температурах, К: 303 (1), 323 (2), 343 (3) и 363 (4); а0(Т) – величины а(Р, Т) при Р = “Рs”; b0(Т) величины а(Р,Т) при qst(V(a2)) = 0.

Таблица 1.
Средний коэффициент термического расширения, аналог давления насыщенного пара газов, значения прелельной адсорбции, плотности адсорбатов при разных температурах и плотности адсорбтивов при температуре кипения, критические температуры
| Система | 〈α〉, К–1 | Т, К | “Рs”, МПа | а0, ммоль/г | ρа, г/см3 | $\rho _{0}^{0}$, г/см3 | Тс, К |
|---|---|---|---|---|---|---|---|
| СН4–MN-270 | 0.0015 | 303 | 141.0 | 14.80 | 0.372 | 0.428 | 190.77 |
| 323 | 138.7 | 14.30 | 0.360 | ||||
| 343 | 135.0 | 13.78 | 0.347 | ||||
| 363 | 127.9 | 13.22 | 0.331 | ||||
| N2–MN-270 | 0.0010 | 303 | 145.6 | 14.87 | 0.652 | 0.808 | 126.25 |
| 323 | 142.0 | 14.86 | 0.635 | ||||
| 343 | 137.0 | 13.95 | 0.615 | ||||
| 363 | 134.4 | 13.51 | 0.600 | ||||
| Ar–MN-270 | 0.0016 | 303 | 160.9 | 18.35 | 1.137 | 1.393 | 150.86 |
| 323 | 157.9 | 17.58 | 1.095 | ||||
| 343 | 153.0 | 16.94 | 1.049 | ||||
| 363 | 148.2 | 16.23 | 1.004 |
Изотермы адсорбции полного содержания а(Р, Т) в ммоль/г рассчитывали по уравнению:
(5)
$\begin{gathered} а\left( {Р,Т} \right) = {\text{ }}[m--{\text{ }}{{\rho }_{g}}({{V}_{{amp}}}--{{{{m}_{{ads}}}} \mathord{\left/ {\vphantom {{{{m}_{{ads}}}} {{{\rho }_{{ads}}}}}} \right. \kern-0em} {{{\rho }_{{ads}}}}}-- \\ - \,\,W{{m}_{{ads}}})] \times {{{{1000} \mathord{\left/ {\vphantom {{1000} {\text{М}}}} \right. \kern-0em} {\text{М}}}} \mathord{\left/ {\vphantom {{{{1000} \mathord{\left/ {\vphantom {{1000} {\text{М}}}} \right. \kern-0em} {\text{М}}}} {{{m}_{{ads}}}}}} \right. \kern-0em} {{{m}_{{ads}}}}}. \\ \end{gathered} $Здесь все обозначения такие же, как в уравнении (1), М – значение моля адсорбтива. Изотермы адсорбции полного содержания а(Р, Т) при температурах 303, 323, 343 и 363 К приведены на рис. 3–5 для всех адсорбционных систем. Все рассчитанные изотермы адсорбции полного содержания были аппроксимированы и экстраполированы уравнением (3) до “Рs(Т)” и определены значения а(Р, Т) = а0(“Рs”,Т), являющиеся величинами “предельной” адсорбции, обозначенные на рисунках “темными” значками – а0(Т). Значения а0(“Рs”, Т) необходимы для расчета характеристической энергии адсорбции Е по Дубинину [12].
Рис. 3.
Изотермы адсорбции полного содержания Ar на MN-270 при температурах, К: 303 (1), 323 (2), 343 (3) и 363 (4); а0(Т) – величины а(Р,Т) при Р = “Рs”; b0(Т) величины а(Р,Т) при qst(V(a2)) = 0.

Рис. 4.
Изотермы адсорбции полного содержания N2 на MN-270 при температурах, К: 303 (1), 323 (2), 343 (3) и 363 (4); а0(Т) – величины а(Р, Т) при Р = “Рs”; b0(Т) величины а(Р,Т) при qst(V(a2)) = 0.

Чтобы определить энергетические характеристики адсорбционной системы, необходимо рассчитать теплоты адсорбции, в частности, дифференциальные изостерические теплоты, для расчета которых по изотермам адсорбции полного содержания были построены изостеры адсорбции. Эти изостеры адсорбции хорошо аппроксимируются прямыми линиями во всех изученных интервалах давлений и температур. Для расчета изостерической теплоты адсорбции существуют разные подходы. Этот вопрос обсужден, например, в монографии [13], где приведено наиболее часто используемое уравнение для расчета этой теплоты:
(6)
${{q}_{{st}}} = --RZ{{[{{\partial {\text{ln}}P} \mathord{\left/ {\vphantom {{\partial {\text{ln}}P} {\partial ({1 \mathord{\left/ {\vphantom {1 Т}} \right. \kern-0em} Т})}}} \right. \kern-0em} {\partial ({1 \mathord{\left/ {\vphantom {1 Т}} \right. \kern-0em} Т})}}]}_{a}}~.$Более подробно этот вопрос рассмотрен в работе Бакаева [14], где получено следующее выражение:
(7)
$\begin{gathered} {{q}_{{st}}} = - RZ{{\left( {\frac{{\partial \ln P}}{{\partial ({1 \mathord{\left/ {\vphantom {1 T}} \right. \kern-0em} T})}}} \right)}_{a}} \times \\ \times \,\,\left[ {1 - {{{{{\left( {\frac{{\partial V(a)}}{{\partial a}}} \right)}}_{Т}}} \mathord{\left/ {\vphantom {{{{{\left( {\frac{{\partial V(a)}}{{\partial a}}} \right)}}_{Т}}} {{{V}_{g}}}}} \right. \kern-0em} {{{V}_{g}}}}} \right] - {{\left( {\frac{{\partial P}}{{\partial a}}} \right)}_{T}}\left[ {V(a) - T{{{\left( {\frac{{\partial V(a)}}{{\partial T}}} \right)}}_{a}}} \right]. \\ \end{gathered} $Здесь R – универсальная газовая постоянная, Z – сжимаемость газовой фазы, V(a) – объем адсорбционной системы, Vg – мольный объем равновесной газовой фазы. Это уравнение наиболее полно отражает изменение теплоты адсорбции, поскольку в нем учитывается изменение объема адсорбционной системы от величины адсорбции [∂V(a)/∂а]Т/Vg и изменение этого объема от температуры Т[∂V(a)/∂Т]а. Член (∂Р/∂а)ТV(a), в уравнении (7) – учитывающий влияние на теплоту адсорбции формы изотермы адсорбции, для адсорбции газов при высоких давлениях имеет существенное значение. Так как изменение объема адсорбционной системы от величины адсорбции и температуры незначительно, то производными (∂V(a)/∂а)Т и (∂V(a)/∂Т)а можно пренебречь. С учетом этих допущений уравнение (7) для расчета изостерической теплоты адсорбции имеет вид:
(8)
${{q}_{{st}}}\left( a \right) = --RZ{{[{{\partial {\text{ln}}P} \mathord{\left/ {\vphantom {{\partial {\text{ln}}P} {\partial ({1 \mathord{\left/ {\vphantom {1 Т}} \right. \kern-0em} Т})}}} \right. \kern-0em} {\partial ({1 \mathord{\left/ {\vphantom {1 Т}} \right. \kern-0em} Т})}}]}_{a}}--{{({{\partial Р} \mathord{\left/ {\vphantom {{\partial Р} {\partial а}}} \right. \kern-0em} {\partial а}})}_{Т}}V\left( a \right)~.$В работе [14] рассматриваются два варианта расчета изостерической теплоты. В первом варианте расчет ведется с учетом объема адсорбционной системы V(a) = V(a1) = W. Во втором варианте – с учетом объема адсорбционной системы V(a) = = V(a2) = Vads/mads + W, т.е. с учетом объема каркаса адсорбента. Возникает вопрос, результат какого варианта расчета адекватно отражает процесс адсорбции газов в закритической области изменения параметров адсорбционного равновесия.
Зависимости дифференциальной изостерической теплоты адсорбции qst(a, Т), рассчитанные по уравнению (8), показаны на рис. 6–8 – с учетом V(a1) = 0.64 см3/г (кривые 1–4) и V(a2) = = 1/1.15 + 0.64 = 1.549 см3/г (кривые 1 '–4 '). На этих рисунках показаны также начальные теплоты адсорбции.
Рис. 6.
Зависимость qst(a,Т) СН4 на MN-270 от а(Р,Т) [ммоль/г] и температуры Т, К: 303 (1), 323 (2), 343 (3) и 363 (4); расчет по уравнению (8): кривые 1, 2, 3, 4 – $q_{{st}}^{*}$(V(a1)) и кривые 1 ', 2 ', 3 ', 4 '– $q_{{st}}^{*}$(V(a2)); $q_{{st}}^{*}$(V(a2)) = = 0 в точках b0(Т).
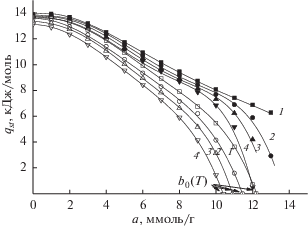
Рис. 7.
Зависимость qst(a, Т) Ar на MN-270 от а(Р, Т) [ммоль/г] и температуры Т, К: 303 (1), 323 (2), 343 (3) и 363 (4); расчет по уравнению (8): кривые 1, 2, 3, 4 – $q_{{st}}^{*}$(V(a1)) и кривые 1 ', 2 ', 3 ', 4 ' – $q_{{st}}^{*}$(V(a2)); $q_{{st}}^{*}$(V(a2)) = = 0 в точках b0 (Т).

Рис. 8.
Зависимость qst(a, Т) N2 на MN-270 от а(Р, Т) [ммоль/г] и температуры Т, К: 303 (1), 323 (2), 343 (3) и 363 (4); расчет по уравнению (8): кривые 1, 2, 3, 4 – $q_{{st}}^{*}$(V(a1)) и кривые 1 ', 2 ', 3 ', 4 ' – $q_{{st}}^{*}$(V(a2)); $q_{{st}}^{*}$(V(a2)) = = 0 в точках b0(Т).

Для расчета начальной теплоты адсорбции часто используют выражение:
(9)
$q\left( 0 \right) = R[\partial {\text{ln}}{{K}_{{\text{H}}}}{{{{\left( Т \right)} \mathord{\left/ {\vphantom {{\left( Т \right)} {\partial 1}}} \right. \kern-0em} {\partial 1}}} \mathord{\left/ {\vphantom {{{{\left( Т \right)} \mathord{\left/ {\vphantom {{\left( Т \right)} {\partial 1}}} \right. \kern-0em} {\partial 1}}} Т}} \right. \kern-0em} Т}],$Для построения изостер значения lnP находят по изотермам адсорбции полного содержания при различных температурах при постоянной величине адсорбции. Этот вопрос в области Генри, где а = KНР, и, следовательно, lna = lnKН+ lnP, можно решить по другому, используя изотермы адсорбции полного содержания при а(Т) = const. Так, например, для двух температур T1> T2 получим: lnа(Т1) = lnа(Т2) = lnKН(Т1) + ln(Р1) = = lnKН(Т2) + ln(Р2) и тогда lnKН(Т1) – lnKН(Т2) = ln(Р2) – ln(Р1). Интегрируя уравнения (6) и (9) и подставляя полученные выше соотношения для изотерм при двух температурах, получим два эквивалентных уравнения для расчета начальной теплоты адсорбции q(0):
(10)
$\begin{gathered} q\left( 0 \right) = [R{{{{Т}_{1}}{{Т}_{2}}} \mathord{\left/ {\vphantom {{{{Т}_{1}}{{Т}_{2}}} {\left( {{{Т}_{2}}--{{Т}_{1}}} \right)}}} \right. \kern-0em} {\left( {{{Т}_{2}}--{{Т}_{1}}} \right)}}] \times \\ \times \,\,[(\ln {{K}_{{\text{Н}}}}\left( {{{Т}_{1}}} \right)--\ln {{K}_{{\text{Н}}}}\left( {{{Т}_{2}}} \right)] = \\ = [{{R{{Т}_{1}}{{Т}_{2}}} \mathord{\left/ {\vphantom {{R{{Т}_{1}}{{Т}_{2}}} {\left( {{{Т}_{2}}--{{Т}_{1}}} \right)}}} \right. \kern-0em} {\left( {{{Т}_{2}}--{{Т}_{1}}} \right)}}] \times {{({\text{ln}}{{P}_{2}}--{\text{ln}}{{P}_{1}})}_{{a~}}}. \\ \end{gathered} $Уравнение (8) отличается от уравнения (6) только членом (∂Р/∂а)ТV(a). Поэтому, учитывая эквивалентность уравнений (6) и (9), а также то, что член (∂Р/∂а) = 1/(∂а/∂Р)Т, Р → 0= 1/KН(Т), уравнение для расчета начальной теплоты адсорбции q(0), зависящее от температуры, будет иметь вид:
(11)
$q\left( 0 \right) = R\,[\partial {\text{ln}}{{{{{{K}_{{\text{Н}}}}(Т)} \mathord{\left/ {\vphantom {{{{K}_{{\text{Н}}}}(Т)} {\partial 1}}} \right. \kern-0em} {\partial 1}}} \mathord{\left/ {\vphantom {{{{{{K}_{{\text{Н}}}}(Т)} \mathord{\left/ {\vphantom {{{{K}_{{\text{Н}}}}(Т)} {\partial 1}}} \right. \kern-0em} {\partial 1}}} Т}} \right. \kern-0em} Т}] - [{1 \mathord{\left/ {\vphantom {1 {{{K}_{{\text{Н}}}}}}} \right. \kern-0em} {{{K}_{{\text{Н}}}}}}\left( T \right)]\,V\left( a \right)~{\text{.}}$Начальные теплоты адсорбции для всех систем и температур, рассчитанные по уравнению (11), исходя из двух вариантов объема адсорбционной системы: V(a1) и V(a2), приведены на рис. 6–8. Согласно нашим расчетам начальные теплоты адсорбции, так же как и изостерические теплоты адсорбции, уменьшаются с повышением температуры.
Рис. 6–8 показывают, что для всех адсорбционных систем выделение теплоты адсорбции, рассчитанной по уравнению (8) по первому варианту расчета через V(a1) (рис. 2–4, кривые 1–4), происходит во всем интервале изменения адсорбции от а(Т) = 0 до а(Т) ≈ a0(Т). Теплоты адсорбции, рассчитанные через V(a2) (кривые 1 '–4 '), достигают нулевых значений при величинах адсорбции примерно в середине измеренных изотерм адсорбции (точки b0(Т) на рисунках), т.е. до завершения процесса адсорбции, чему нет разумного объяснения.
Для практических целей интерес представляют интегральные теплоты адсорбции qint, которые также рассчитали в двух вариантах значения объема адсорбционных систем. Для определения интегральной теплоты с V(a1) зависимость qst(a, Т) аппроксимировали полиномом или сплайном, затем интегрировали в пределах изменения от а(Р, Т) = 0 до а ≈ а0(P, Т) для каждой адсорбционной системы при всех температурах. Для определения интегральной теплоты, рассчитанной с V(a2), зависимость qst(a, Т) определяли в интервале а(Р, Т) = 0 до значения а(Р, Т), где qst(a, Т) = 0. Рассчитанные интегральные теплоты адсорбции представлены в табл. 2. Как видно из таблицы, интегральные теплоты адсорбции, рассчитанные с учетом V(a1) значительно больше таковых, рассчитанных с учетом объема V(a2).
Таблица 2.
Интегральные, средние теплоты адсорбции, характеристические энергии и соответствующие энергии, полученные через Е
| T, K | qint (V(a1)) | qint (V(a2)) | qint (Е) | $q_{{st}}^{*}$(V (a1)) | $q_{{st}}^{*}$(V(a2)) | q*(Е) | Е |
|---|---|---|---|---|---|---|---|
| кДж/кгads | кДж/моль | ||||||
| СН4–MN-270 | |||||||
| 303 | 142.88 | 112.39 | 143.91 | 10.21 | 9.36 | 11.07 | 7.58 |
| 323 | 132.59 | 103.79 | 142.22 | 9.82 | 9.03 | 10.94 | 7.30 |
| 343 | 125.46 | 97.57 | 129.24 | 9.65 | 8.87 | 10.77 | 7.05 |
| 363 | 118.43 | 90.28 | 125.88 | 9.87 | 8.63 | 10.49 | 6.72 |
| N2–MN-270 | |||||||
| 303 | 84.78 | 51.33 | 86.19 | 6.52 | 5.35 | 6.63 | 4.73 |
| 323 | 79.76 | 45.76 | 79.68 | 6.38 | 5.21 | 6.62 | 4.66 |
| 343 | 75.52 | 40.27 | 78.72 | 6.29 | 4.91 | 6.56 | 4.51 |
| 363 | 70.64 | 35.13 | 75.44 | 6.14 | 4.77 | 6.56 | 4.44 |
| Ar–MN-270 | |||||||
| 303 | 115.03 | 74.58 | 126.88 | 6.38 | 6.21 | 7.93 | 5.26 |
| 323 | 106.38 | 67.50 | 125.76 | 6.27 | 6.12 | 7.86 | 5.11 |
| 343 | 96.0.5 | 61.40 | 116.55 | 6.19 | 5.85 | 7.77 | 4.95 |
| 363 | 94.80 | 55.64 | 108.22 | 6.77 | 5.58 | 7.73 | 4.83 |
Средние значения изостерической теплоты адсорбции легко получить, поделив интегральную теплоту адсорбции на интервал интегрирования и наоборот, зная среднюю теплоту адсорбции, можно определить интегральную. Значения средней изостерической теплоты адсорбции $q_{{st}}^{*}$(V(a1)) и $q_{{st}}^{*}$(V(a2)) для всех сиcтем и температур также приведены табл. 2. Естественно, значения средней изостерической теплоты адсорбции $q_{{st}}^{*}$(V(a1)), так же как и qint(V(a1)), больше значений, рассчитанных через V(a2).
Интересно сопоставить полученные средние изостерические теплоты адсорбции со средними значениями теплот адсорбции, рассчитанными другим способом. В работе [11] показано, что среднюю теплоту адсорбции можно рассчитать из минимальных экспериментальных данных (одной изотермы адсорбции полного содержания) через характеристическую энергию адсорбции E по уравнению:
(12)
$q{\text{*}}\left( Е \right) = R{{(T{{T}_{c}})}^{{1/2}}} + ({{\surd {\kern 1pt} \pi } \mathord{\left/ {\vphantom {{\surd {\kern 1pt} \pi } 2}} \right. \kern-0em} 2})\{ E[1{\text{ }} + \alpha {{(T{{T}_{c}})}^{{1/2}}}]\} ,$Характеристическая энергия адсорбции E при адсорбции паров определяется решением уравнения, описывающего изотерму адсорбции, представленную в координатах а/а0 как функция RTln(Рs/P) = Е в характеристической точке а/а0 = = 1/е = 0.368 [12]. Для адсорбции газов, следуя этой же схеме, характеристическую энергию находили по зависимости а/а0 от E = R(TТс)1/2ln(“Ps”/Р) [11]. Результаты расчета E и q*(Е) приведены в табл. 2.
Термический коэффициент адсорбции, входящий в уравнение (12), определяли по экспериментальным данным, как предложено в работе [15]:
(13)
$\alpha = - \frac{1}{{\rho _{0}^{0}}}\left( {\frac{{\Delta {{\rho }_{а}}(Т)}}{{\Delta T}}} \right).$Для нахождения этого коэффициента были определены предельные значения ρа(“Ps”, Т) = а0(“Ps”, Т)/W при всех “Ps” и Т, а ∆ρа(Т) определяли для каждой из двух температур 303–323, 323–343 и 343–363 К. Результаты расчета ρа(“Ps”, Т) приведены в табл. 1, где даны также значения плотности газов при нормальной температуре кипения $\rho _{0}^{0}$ и средние значения 〈α〉 по температурам для всех адсорбционных систем.
Из значения средней теплоты адсорбции q*(Е), легко получить интегральные теплоты qint(Е) умножением на соответствующий интервал интегрирования. Данные, приведенные в табл. 2, показывают, что средние теплоты qst*(V(a1)), полученные из интегральных теплот адсорбции qint(V(a1)), рассчитанных через V(a1), для всех изученных систем и температур хорошо согласуются со средними теплотами q*(Е), так же как и qint(V(a1)) с qint(Е). Теплоты, рассчитанные через V(a2), т.е. и qint(V(a2)) и $q_{{st}}^{*}$(V(a2)), существенно меньше теплот, рассчитанных через V(a1) и теплот, рассчитанных через характеристическую энергию Е.
ВЫВОДЫ
1. Предложено уравнение для расчета начальной теплоты адсорбции, учитывающее зависимость этой теплоты от температуры.
2. Для оценки тепловых эффектов при адсорбции газов (метана, азота и аргона) на полимерном адсорбенте MN-270, так же как на адсорбенте MN-200 [16], расчет изостерической теплоты адсорбции qst(a, Т) по уравнению (8) следует проводить с учетом адсорбционного объема V(a) = W, т.е. объема, где действуют адсорбционные силы и происходит адсорбция. В этом случае увеличение величины адсорбции от нуля до максимального значения а0(P, Т) сопровождается выделением теплоты адсорбции qst(a, Т) в течение всего процесса адсорбции. Расчет изостерической теплоты адсорбции с учетом объема V(a2) приводит к заниженным значениям, которые стремятся к нулю при величинах адсорбции существенно ниже измеренных экспериментально, что нелогично и с нашей точки зрения является ошибочным. Заниженные значения теплоты адсорбции приводят к заниженным значениям повышения температуры, вызванного этой теплотой и, в свою очередь, к ошибкам в практических расчетах энергетики при использовании адсорбционных явлений.
Работа выполнена по государственному заданию № 1201353185.
Список литературы
Davankov V.A., Tsyurupa M.P. // Pure Appl. Chem. 1989. V. 61. P.1881.
Прибылов А.А., Калашников С.М., Серпинский В.В. // Известия АН СССР. Серия химическая. 1990. № 6. С. 1238.
Сычев В.В., Вассерман А.А., Загорученко В.А. и др. Термодинамические свойства метана. М.: Изд-во стандартов. 1979. 348 с.
Сычев В.В., Вассерман А.А., Козлов А.Д. и др. Термодинамические свойства азота. М.: Изд-во стандартов, 1977. 352 с.
Рабинович В.А., Вассерман А.А., Недоступ В.И. и др. Термодинамические свойства неона, аргона, криптона и ксенона. М.: Изд-во стандартов, 1976. 636 с.
Прибылов А.А., Ларионов О.Г., Шеховцова Л.Г. и др. // Известия АН. Серия химическая, 2009. № 4. С. 707.
Якубов Т.С., Шеховцова Л.Г., Прибылов А.А. // Известия АН СССР. Серия химическая. 1995. № 12. С. 2381.
Pribylov A.A., Serpinskii V.V., Kalashnikov S.M. // Zeolites. 1991. V. 11. P. 846.
Бакаев В.А. // Докл. АН СССР. 1966. Т. 167. С. 369.
Синг С., Грег К. Адсорбция. Удельная поверхность. Пористость. М.: Мир, 1984. 310 с.
Прибылов А.А., Мурдмаа К.О. // Известия АН. Серия химическая. 2017. № 5. С. 849.
Дубинин М.М. Адсорбция и пористость. М.: Изд-во ВАХЗ, 1972. 127 с.
Лопаткин А.А. Теоретические основы физической адсорбции. М.: Изд-во Московского университета, 1983. 344 с.
Бакаев В.А. Дис. … д-ра физ.-мат. наук. МГУ им. М.В. Ломоносова. Химический факультет. 1989. 304 с.
Прибылов А.А., Мурдмаа К.О., Соловцова О.В. и др. // Известия АН. Серия химическая. 2018. № 10. С. 1807.
Прибылов А.А., Мурдмаа К.О. // Известия АН. Серия химическая (в печати).
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов



