Физикохимия поверхности и защита материалов, 2021, T. 57, № 3, стр. 277-283
Cинтез и электрохимические свойства композитных покрытий на основе полианилина и соединений марганца на активированной графитовой фольге
В. В. Абаляева 1, *, О. Н. Ефимов 1, Н. Н. Дремова 1, Е. Н. Кабачков 1, 2
1 Учреждение Российской академии наук Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка, просп. Академика Н.Н. Семенова, 1, Россия
2 Научный центр РАН в Черноголовке
142432 Московская обл., Черноголовка, ул. Лесная, 9, Россия
* E-mail: avva@icp.ac.ru
Поступила в редакцию 04.03.2020
После доработки 28.12.2020
Принята к публикации 12.01.2021
Аннотация
Композитные электроактивные покрытия (КЭАП) на основе полианилина (ПАни) и соединений марганца (MnOx) на активированной графитовой фольге были получены путем потенциодинамического осаждения из растворов сульфата анилина в 1 М H2SO4 с введением в состав КЭАП ионов марганца несколькими способами. Электрохимическое поведение полученных КЭАП в основном сходно с поведением чистого ПАни в кислых водных растворах. Однако, введение оксидных соединений марганца приводит к увеличению электрохимической емкости почти вдвое при высоких токовых нагрузках до 2.0 мА см–2 и повышенной стабильности при длительном циклировании. Характеристика оксидных соединений марганца в КЭАП методом РФЭС показала их аморфную природу и присутствие атомов марганца в нескольких степенях окисления.
1. ВВЕДЕНИЕ
Композитные материалы на основе наноразмерных форм углерода (нанотрубки, оксид и восстановленный оксид графена, графитовая фольга) и полисопряженных полимеров, среди которых наиболее часто используют ПАни, последнее время привлекают внимание в качестве перспективных электродных материалов для электрохимических суперконденсаторов [1–3]. Оба компонента композита вносят аддитивный вклад в электрохимическую емкость. Наноуглеродный компонент за счет высокой пористости и электропроводности обладает большой двойнослойной емкостью. Проводящий полимер также имеет двойнослойную емкость в сочетании с Фарадеевской псевдоемкостью за счет обратимых редокс-переходов. Но вдобавок к этому он выполняет роль связующего, которое скрепляет наноуглеродный каркас.
Целью настоящей работы было исследование электрохимических характеристик электродных материалов при введении в состав КЭАП оксидных соединений марганца – доступного и эффективного модификатора, который помимо увеличения Фарадеевской псевдоемкости, может инициировать электрополимеризацию анилина [4–6]. Достоинствами MnO2 также являются его низкая стоимость и высокая теоретическая емкость (около 1370 Ф г–1) [7, 8]. Также MnO2 обладает более высоким окислительным потенциалом по сравнению с другими оксидами переходных металлов (NiO и Co3O4). Тем не менее, существенными недостатками MnO2 являются низкая электропроводность (10–5–10–6 См см–1) и не очень высокая стабильность в протонных средах, что значительно может ограничить его практическое применение [9, 10]. Для решения этой проблемы можно, например, включить MnO2 в электрически проводящие системы, такие как графитовая фольга, проводящие полимерные углеводороды [11]. Существуют несколько способов введения MnOx в углеродистые материалы. Одним из них является электрохимическое осаждение MnOx из раствора MnSO4 [12]. В другом способе в результате медленного окислительно-восстановительного взаимодействия между KMnO4 и С образуются оксиды марганца, которые адсорбируются на графитовой поверхности [6]. Нами было показано, что такие композитные материалы можно наносить в виде покрытия на пористую активированную графитовую фольгу, что значительно упрощало конструкцию электрода и технологию его изготовления [13, 14]. Графитовую фольгу формуют из терморасширенного графита, частицы которого имеют структуру, сходную с восстановленным оксидом графита. Анодная активация поверхности фольги приводит к ее разрыхлению, появлению кислородсодержащих групп и улучшению смачиваемости электролитом.
В данной работе рассматриваются преимущества и недостатки первого из указанных способов конструирования электроактивного покрытия с точки зрения дальнейшего использования в качестве компонента анодного материала в суперконденсаторах.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Графитовая фольга для электрода
Анодирование графитовой фольги (ГФ) толщиной 0.6 мм проводили в 0.1% (NH4)2SO4 при 3 В в течение 3 мин. Рабочим анодом является исходная пластина ГФ, катодом служит пластина из нержавеющей стали. Подробности получения активированной графитовой фольги (АГФ) приведены в [13, 14].
2.2. Электрохимический синтез (ЭС) и электрохимические исследования ПАни с MnOx на АГФ-электроде
ЭС и электрохимические исследования проводили в потенциодинамическом или в гальваностатическом режиме в интервале потенциалов –0.2 …+ 0.75 В (относительно Ag/AgCl) в трехкамерной стеклянной электрохимической ячейке (используемый объем электролита 20 мл) при комнатной температуре в 0.5–1 М H2SO4 на потенциостате PS-7 (фирма Элинс, Россия) с программным обеспечением. Все потенциалы приведены относительно указанного электрода сравнения. Пространства рабочего и вспомогательного электродов были разделены пористой стеклянной перегородкой. Рабочим электродом служила пластина АГФ размером 1 × 5 см, вспомогательным электродом служила чистая стеклоуглеродная (СУ) пластина размером 1 × 5 см. Все композитные пленки выращивались в течение 50 циклов потенциодинамического циклирования в интервале потенциалов –0.2 + 0.75 В со скоростью 20 мВс–1. Электроактивность пленок изучалась циклически вольтамперометрическим сканированием при 20 и 50 мВс−1 в 1 М H2SO4 и гальваностатическим разрядом-зарядом при i = 2 мАсм–2.
Удельную электрохимическую емкость (мФ/см2) рассчитывали по формуле CS = it/ΔV, где i – удельная плотность тока (мА/см2), рассчитанная из площади композитной пленки на электроде; t – время разряда (с); ΔV – область потенциалов (В), в которой происходит разряд.
2.3. ЭС и классификация полученных КЭАП
Для ЭС и электрохимических исследований были использованы четыре электролита:
Э1 – 10 мл 0.2 М АС в 1 М H2SO4 + 10 мл дистиллированной воды.
Э2 – 10 мл 0.2 М АС в 1 М H2SO4 + 10 мл 0.2 М MnSO4 в дистиллированной воде.
Э3 – 1 М H2SO4
Э4 – 0.2 М MnSO4 в дистиллированной воде.
Были получены и изучены 4 варианта КЭАП (К).
1. КЭАП1 (К1) представляет чистый ПАни, выращенный на 1 см2 АГФ в потенциодинамическом режиме в интервале потенциалов –0.2 …+0.75 В из Э1.
Композитные покрытия c ПАни и MnОх получали тремя способами в интервале потенциалов –0.2 …+0.75 В.
2. КЭАП2 (К2) был электроосажден в течение 50 циклов потенциодинамического ЭС из Э1 на 1 см2 АГФ, на которую предварительно осаждали MnOx в течение 50 циклов (20 мВ/с) потенциодинамического ЭС из Э4.
3. КЭАП3 (К3) был электроосажден в течение 50 циклов потенциодинамического ЭС на 1 см2 чистой АГФ из Э2.
4. КЭАП4 (К4) был электроосажден в течение 50 циклов потенциодинамического ЭС из Э2 на 1 см2 АГФ, которую предварительно вымочили в течение суток в Э4.
2.4. Физико-химические исследования КЭАП
Электронномикроскопические исследования осуществляли на растровом электронном автоэмиссионном микроскопе Supra 25 производства Zeiss с рентгеноспектральной энергодисперсионной приставкой INCA Energy производства Oxford Instruments. Разрешение на получаемых изображениях составляет величину 1–2 нм.
Рентгенофотоэлектронные спектры (РФЭС) высокого разрешения С1s, O1s и N1s регистрировали на электронном спектрометре для химического анализа Specs PHOIBOS 150 MCD, рентгеновская трубка с магниевым анодом (MgKα-излучение 1253.6 эВ). При съемке спектров вакуум в камере спектрометра не превышал 3 × 10–9 мбар. Мощность источника составляла 225 Вт. Спектры регистрировались в режиме постоянной энергии пропускания (10 эВ для отдельных линий, спектры отдельных линий записывались – с шагом 0.05 эВ).
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3.1. Ход ЭС
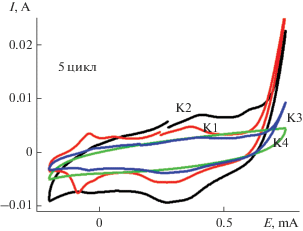
На рис. 1 показаны пятые циклы ЭС четырех описанных образцов ПАни на 1 см2 АГФ. О начале ЭС говорит пик окисления анилина (Ан) при +0.75 В для трех образующихся КЭАП: К1, К2 и К3. Причем, максимальные токи окисления Ан показывает образец К2, где ЭС ПАни проходит на АГФ, на которую предварительно электрохимически был осажден MnOx. Практически не видны токи окисления Ан в К4, в котором поверхность АГФ фактически закрыта адсорбированным MnSO4. ЭС К4 начнется позже, после того, как определенная часть MnSO4 в результате циклирования (и окисления в анодной области) превратится в MnOx. Такое начало ЭС предполагало значительные расхождения в скоростях образования КЭАП и в их свойствах. ЭС проводился для всех случаев в течение 50 циклов со скоростью 20 мВ/с.
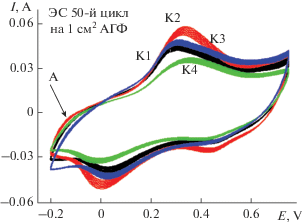
Количества КЭАП, полученных в ЭС за 50 циклов окончательно приведены на рис. 2. Максимальное количество КЭАП, исходя из площади ЦВА, получено для К3, а минимальное – для К4. Оба эти ПАни были электроосаждены на АГФ, предварительно обработанную MnSO4. Для К3 поверхность АГФ циклировалась в течение 50 циклов в растворе MnSO4, и, исходя из литературных данных [15], это привело к образованию на поверхности АГФ набора окислов MnOx. В частности, один из них (MnO2) во время ЭС ПАни являлся по наблюдением авторов [10] дополнительным окислителем для Ан и, следовательно, инициатором ЭС ПАни. В случае К4 для адсорбированного MnSO4 на поверхности АГФ необходимо было время, как уже отмечалось, для превращения соли в соответствующие окислы и начала ЭС ПАни. Поэтому в данном случае количество образованного ПАни оказалось минимальным из всех вариантов ЭС. Роль MnSO4 в составе электролита (К2), возможно, заключается в образовании новой морфологии, отличной от обычного ПАни (К1). Исходя из результатов ЭС, композит К2, показав на старте наивысшую скорость ЭС, за 50 циклов образовался в максимальном количестве, композиты К3 и К1 по количеству образованного ПАни (исходя из площади ЦВА) разделили второе и третье места.
3.2 СЭМ изображение композитных электродов
На рис. 3а показана морфология ПАни (К1), полученного классическим способом в потенциодинамическом режиме из АС в 1 М H2SO4. Материал представляет гранулы, напоминающие короткие трубки диаметром более 200 нм. На рис. 3б приведен композитный электрод, ЭС которого проходил на модифицированной приcутствием MnOx поверхности АГФ.
Рис. 3.
СЭМ изображения композитных электроактивных покрытий и элементный анализ на Mn (а) К1, (б) К2, (в) К3, (г) К4.
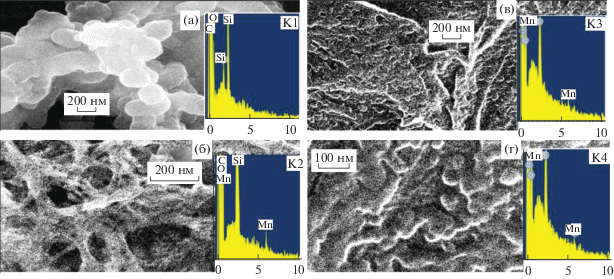
Морфология этого образца отличается от К1, хотя трубчатая структура сохранилась. Отдельные трубки имеют меньший диаметр порядка 100–150 нм, а внутри материала из отдельных трубок сплетена сетка, Этот материал кажется более жестким, чем ПАни. В нем отдельные элементы связаны друг с другом, представляя единый каркас. Количество Mn в образце К2 максимально и составляет 2 вес. %. На двух других фото изображена морфология двух композитных материалов К3 и К4, описанных в разделе 2.2. Последние два образца (K3 и К4) представлены на фото в виде достаточно плотной пленочной структуры. Несмотря на разные скорости образования композитов К3 и К4 (как это уже отмечалось выше), морфология их поверхности оказалась практически одинаковой. К3 начал образовываться сразу на поверхности АГФ, покрытой MnOx, а образованию композита К4 предшествовал индукционный период, необходимый для превращения адсорбированного MnSO4 в MnOx (в процессе циклирования). Но оба эти композита начинали свой ЭС на поверхности АГФ-MnOx, и, вероятно, образование этого первого слоя c участием MnOx давало толчок новой морфологии, которую мы видим для К3 и К4. Количество Mn в составе К3 и К4 приблизительно одинаково и составляет соответственно 1 и 1.1 вес. %. Возможно, происходит взаимодействие полимерных цепочек с размещенными на поверхности АГФ центрами MnOx, что и определяет такую достаточно плотную “укладку” этих полимеров.
3.3. Зарядно-разрядные характеристики
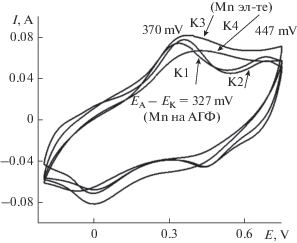
Зарядно-разрядные характеристики снимались в 1 М H2SO4. После извлечения каждого электрода с синтезированным на его поверхности КЭАП из рабочего электролита, электрод промывался в дистиллированной воде и сразу с ним начинали работать в 1 М H2SO4. Перед зарядно-разрядными испытаниями была снята ЦВА каждого электрода в 1 М H2SO4. Обнаружена интересная особенность поведения разных электродов после их извлечения из рабочих электролитов и помещения в 1 М H2SO4.
На рис. 4 приведены ЦВА всех исследуемых электродов в 1 М H2SO4. ЦВА разбиты на две группы: ЦВА электродов К1 и К2 имеют по две пары окислительно-восстановительных переходов, ЦВА электродов К3 и К4 имеют по одному щирокому анодному и катодному переходам с достаточно большой разницей окислительно-восстановительных потенциалов порядка 430 мВ. Первые два композита К1 и К2 получены из Э1 на исходной АГФ (К1) и из Э1 на АГФ с внедренным в ее состав MnOx (К2). В этих двух ЭС в электролите отсутствовали ионы Mn. При ЭС двух других композитов (К3 и К4) в электролите, кроме АС присутствовали ионы Mn. У всех четырех композитных электродов подобраны практически одинаковые исходные реактивы, но для каждого композитного материала условия ЭС оказались отличными друг от друга. В первом случае (для К1 и К2) окисление Ан начинается с момента соприкосновения с поверхностью АГФ, где в качестве окислителя для мономера выступают либо активные кислородные группы поверхности АГФ (в случае К1), либо активный окислитель Mn+4, образованный на поверхности АГФ в процессе длительного циклирования MnSO4 (для К2). В результате идет образование ПАни с характерными двумя центрами окисления-восстановления, которые показывают ΔЕА–К 327 и 235 мВ соответственно для переходов лейкоэмеральдин-эмеральдин и эмеральдин-пернигранилин и обратно. Электроды К3 и К4 на ЦВА показывают один широкий окислительно-восстановительный переход лейкоэмеральдин-эмеральдин и обратно с ΔЕА–К 370 мВ (для К3) и 447 мВ (для К4).
Возможно, в присутствии ионов Mn в составе электролита образуются координационные связи между молекулой Ан и ионами Mn . На поверхности АГФ (для К3) и АГФ-Mn (для К4) образование ПАни проходит с включенными в состав полимерной цепочки отдельных фрагментов Ан-Mn звеньев, что является причиной замедленных окислительно-восстановительных процессов в образовавшемся полимере.
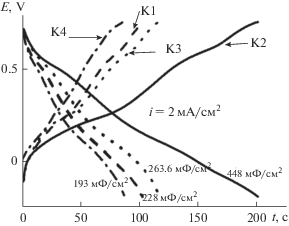
Можно сделать вывод, что все условия ЭС в данном случае влияли на скорость, количество образованного продукта, его морфологию и в конечном счете – на его свойства. После ЦВА в 1 М H2SO4 были проведены зарядно-разрядные испытания и рассчитаны СУД для исследуемых материалов.
Расчеты, проведенные из данных разрядных времен показали, что в полученном ряду материалов максимальную Суд 448 мФ/см2 показал К2, который на первых циклах ЭС не был в лидерах по скорости ЭС (рис. 1), но к 50 циклу, постепенно увеличивая скорость и образуя свою особую морфологию, догнал лидеров и показал при разрядных расчетах максимальное значение Суд. Остальные исследованные композитные материалы составили группу с меньшими значениями СУД. Среди них К3, который показал с первых циклов хорошие скорости ЭС (рис. 1), но, возможно, высокому значению СУД мешает плотная морфология образца, что может служить значительной помехой для доступа электролита при редокс – процессах.
3.4. РФЭ спектры
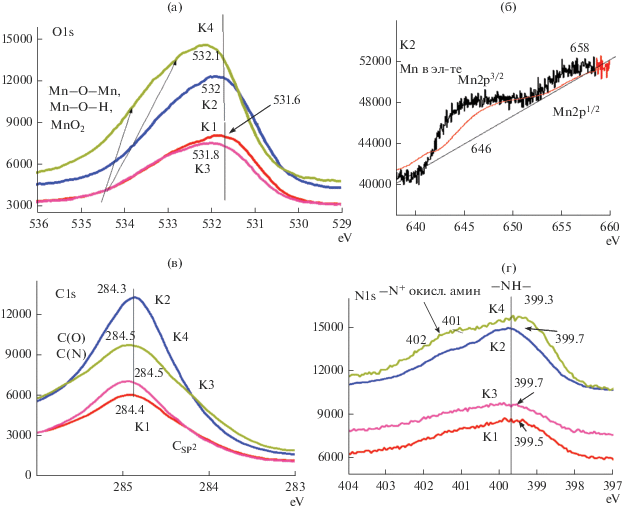
Согласно рис. 6 (спектр О1s) для К1 (ПАни на АГФ) основной пик О1s показывает энергию связи 531.6 эВ. Для трех других композитных материалов (К2, К3 и К4) кислородные связи сдвигаются в сторону более высоких энергий. Эти спектры могут быть разложены на три составляющие: 531.7, 532.1 и 532.3 эВ. Согласно данным [12] они характеризуют наличие Mn(II), Mn(III), Mn(IV).
Это является следствием окисления Mn(II) в MnOx при электрохимическом циклировании АГФ в среде MnSO4 и осаждении этих окислов на поверхности АГФ. Считается, что средняя степень окисления Mn существенно не зависит от разных режимов [15] нанесения. Область Mn 2p (рис. 6б – Mn 2p) состоит из спин-орбитального дублета с Mn 2p1/2, имеющего энергию связи 653.8 эВ и Mn 2p3/2 с энергией связи 642.1 эВ, которые характерны для смешанной валентности (Mn4+ и Mn3+) [16]. Спектры N 1s приведены на рис. 6 (N1s). Широкие пики в спектрах указывают на то, что в пленках сосуществуют несколько структур, что явно является результатом более чем одного типа N. Каждый из этих спектров может быть разложен на четыре гауссовых пика с энергией связи 398.4; 399.5; 401.0 и 402.5 эВ. Пик около 399.5 эВ относится к аминному азоту полимера, в то время как два других пика при 401 и 402 эВ соответствуют положительно заряженному азоту. Пики на склонах спектров К3 и К4 могут быть приписаны иминоподобной структуре [N–], аминоподобным атомам азота [–NH–], протонированному имину [N+–] и протонированному амину [–NH+–] соответственно [18]. Сообщалось, что в результате сшивания полимерных цепей возникают циклические виды азота, которые имеют энергию связи, близкую к протонированному имину (401.3 эВ [18]), поэтому пик при 401.0 эВ (рис. 6 N1s) должен перекрываться с сигналом протонированного имина и циклического азота. Взаимодействие цепочек с происходит преимущественно в хиноидных фрагментах c помощью MnOx и может приводить к сшивке [12, 17]. Соответственно, больше протонирования происходит на иминном азоте полимерной цепи в гибридной пленке, чем в ПАни, что сравнимо с разным протонированием уровня аминного азота. Пик около 399.4 эВ относится к аминному азоту полимера, тогда как два других пика при 400.5 и 402.5 эВ соответствуют положительно заряженному азоту. Эти две различные среды при >400 эВ могут быть интерпретированы как поляронное и биполяронное состояния соответственно. Уровень допирования часто определяется как отношение площадей пиков >400 эВ по отношению к общему азоту [17, 18]. Разделение ЦВА (рис. 4) на две группы также связано с уровнем взаимодействия Mn с ПАни, в которых атомы N по-разному координируются с MnOx. Спектры С1s для всех композитных материалов очень близки (рис. 6 C1s). Из этого следует, что образование координационных связей ПАни с поверхностью электрода (АГФ-MnOx) происходит в основном за счет взаимодействия атомов N (ПАни) и атомов О (MnOx), атомы С в какой-либо координации ПАни с поверхностью электрода практически не задействованы.
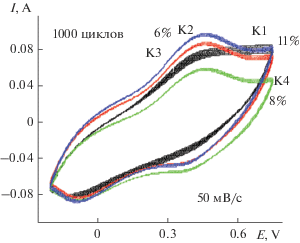
Исследование сохранения электрохимической активности композитных материалов было проведено циклированием в количестве 1000 циклов в 1 М H2SO4 и последующим сравнением начального и конечного значений площади ЦВА и данных зарядно-разрядных времен. Полученные выводы приведены на рис. 7. Наиболее устойчивыми показали себя К2 и К3, потеряв по 6% первоначальной емкости. Наименее устойчив оказался композит К1, потеряв 11%.
4. ВЫВОДЫ
Было обнаружено, что наноструктура ПАни MnOx, четко наблюдаемая с помощью сканирующего электронного микроскопа, сильно зависит от вида осаждения и преобразования в ходе циклирования сульфата марганца. Оксиды марганца, приготовленные в разных режимах, определяют скорость ЭС ПАни и в дальнейшем морфологию образующегося продукта. В результате максимальное значение СУД показал композитный материал К2, который был получен в ЭС на поверхности АГФ, модифицированной оксидами Mn. Он же показал практически максимальную устойчивость при длительном циклировании.
Композитные материалы, исследованные в данной работе, могут быть перспективными материалами для будущих электроактивных покрытий и в качестве анодных компонентов для электрохимических суперконденсаторов.
Работа выполнена в соответствии с Госзаданием 0089-2019-0010.
Работа (частично) выполнена по теме Государственного задания, № государственной регистрации АААА-А19-119061890019-5.
Работа (частично) выполнена с использованием оборудования Аналитического центра коллективного пользования ИПХФ РАН и НЦЧ РАН.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Prasad K.R., Munichandraiah N. // J. Electrochem. Soc. 2002. V. 149. P. A1393.
Prasad K.R., Munichandraiah N. // J. Power Sources. 2002. V. 112. P. 443.
Fusalba F., Gouerec P., Villers D., Belanger D. // J. Electrochem. Soc. 2001. V. 148. P. A1.
Prasad K.R., Miura N., Polyaniline-MnO2 // Electrochem. and Solid-State Letters. 2004. V. 7(11). P. A425.
Dai Y., Chen L., Babayan V., Cheng Q., Saha P., Jiang H., Li C. // J. Mater. Chem. A. 2015. V. 3. P. 21337. https://doi.org/10.1039/c5ta06958k
Xiea Yi., Yanga Ch., Chena P., Yuana D., Guoa K. // J. Power Sources. 2019. V. 425. P. 1.
Dai Yi., Chen L., Babayan V., Cheng Q., Saha P., Jiang H., Li Ch. // J. Mater. Chem. A. 2015. V. 3. P. 21337.
Feng X., Li Y., Chen G., Liu Z., Ning X., Hu A., Tang Q., Chen X. Shen F., Pankratov D., Chi Q. // Current Opinion in Electrochemistry. 2017. V. 4. P. 133.
Radhamani A.V., Surendra M.K., Ramachandra Rao M.S. // Appl. Surf. Sci. 2018. V. 450. P. 209. https://doi.org/10.1016/j.apsusc.2018.04.081
Jaidev Jafri R.I., Kumar M.A., Ramaprabhu S. // J. Mater. Chem. 2011. V. 21. P. 17601.
Hou D., Tao H., Zhu X., Li M. // Appl. Surf. Sci. 2017. V. 419. P. 580. https://doi.org/10.1016/j.apsusc.2017.05.080
Sun L.-J., Liu X.-X., Lau Kim K.-T., Chen L., Gu W.-M. // Electrochimica Acta. 2008. V. 53. P. 3036.
Абаляева В.В., Николаева Г.В., Дремова Н.Н., Кнерельман Е.И., Давыдова Г.И., Ефимов О.Н., Ионов С.Г. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 2. С. 195–203. [Abalyaeva V.V., Nikolaeva G.V., Dremova N.N., Knerel’man E.I., Davydova G.I., Efimov O.N., Ionov S.G. // Protection of Metals and Physical Chemistry of Surfaces. 2019. V. 55. № 2. P. 321–329.]https://doi.org/10.1134/S2070205119020023
Абаляева В.В., Николаева Г.В., Кабачков Е.Н., Ефимов О.Н. // Электрохимия. 2019. Т. 55. № 8. С. 948. [Abalyaeva V.V., Nikolaeva G.V., Kabachkov E.N., Efimov O.N. // Russian J. Electrochemistry. 2019. V. 55. № 8. P. 745.]https://doi.org/10.1134/S1023193519080020
Hu Ch.-Ch., Wang Ch.-Ch. // J. Electrochem. Soc. 2003. V. 150 (8). P. A1079.
Chigane M., Ishikawa M. // J. Electrochem. Soc. 2000. V. 47. P. 2246.
Goswami S., Maitia U.N., Maitia S., Nandy, S., Mit-rab M.K., Chattopadhyay K.K., Zhang X., Ji L., Zhang S., Yang W. // J. Power Sources. 2007. V. 173. P. 1017.
Cruz-Silv R., Romero-García J., Angulo-Sánchez J.L., Flores-Loyola E., Díaz J.A. // Polymer. 2004. V. 45. P. 4711.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов