Зоологический журнал, 2019, T. 98, № 10, стр. 1100-1111
Изменчивость и морфологические особенности черепа шерстистого носорога (Coelodonta antiquitatis (blumenbach 1799)) в позднем плейстоцене на северо-востоке Азии
А. Ю. Пузаченко a, *, И. В. Кириллова b, **, Ф. К. Шидловский b, В. А. Левченко c, ***
a Институт географии РАН
119017 Москва, Россия
b ООО “НАШ Ледниковый Период”
129223 Москва, Россия
c Australia’s Nuclear Science and Technology Organisation (ANSTO)
NSW 2234 Sydney, Sydney Lucas Heights, Australia
* E-mail: puzak@igras.ru
** E-mail: ikirillova@yandex.ru
*** E-mail: lwally_@hotmail.com
Поступила в редакцию 20.02.2019
После доработки 15.03.2019
Принята к публикации 20.03.2019
Аннотация
Изучено 63 черепа шерстистого носорога с северо-востока России (северо-западная Чукотка, северо-восточная Якутия) из коллекции Музея-театра “Ледниковый период” (Москва). Впервые методами одномерной и многомерной статистики исследованы половой диморфизм и изменчивость размеров и формы черепа. Описаны особенности изменчивости, вероятно связанные с полом. Эти особенности выражаются в разном для самцов и самок наборе измерений, изменчивость которых не зависит от варьирования общих размеров черепа, и в различиях аллометрических паттернов самцов и самок. Обнаружена статистически значимая морфологическая неоднородность выборок как самцов, так и самок. Неоднородность обусловлена тем, что в каждой из этих выборок присутствуют особи двух размерных групп, и различия в размерах не связаны с возрастной изменчивостью. Анализ опубликованных радиоуглеродных датировок позволил предположить уменьшение общих размеров черепа данного вида носорогов в конце мегаинтерстадиала МИС 3 – начале стадиала МИС 2 на северо-востоке Азии. Для проверки гипотезы необходимы дополнительные данные о геологическом возрасте исследованных образцов.
Шерстистый носорог (Coelodonta antiquitatis (Blumenbach 1799)) – один из уникальных представителей “Mammuthus–Coelodonta” фаунистического комплекса позднего плейстоцена Евразии (Kahlke, 2014), представители которого были хорошо приспособлены к суровым экологическим условиям вюрмского (=вислинского= валдайского=ермаковского=сартанского) оледенения северной Евразии, соответствующего морским кислородным изотопным стадиям MIS 5d–MIS 2 (~110–12 тыс. лет назад). Вероятной областью происхождения рода шерстистых носорогов считается территория, расположенная на западе современного Тибетского плато (Deng et al., 2011). В среднем плиоцене около 3.7 миллионов лет назад ранний представитель рода – C. thibetana Deng et al. 2011 – обитал здесь в условиях горного остепененного ландшафта. Свидетельства последующей экспансии шерстистых носорогов в Азии сохранились в Китае, Монголии, Забайкалье и на юге Западной Сибири (Teilhard de Chardin, Piveteau, 1930; Chow, Chow, 1959; Kahlke, 1969; Li, 1984; Zheng, Cai, 1991; Foronova, 1999; Deng et al., 2011). В начале среднего плейстоцена, около 460 тыс. лет назад (MIS 12), носороги, близкие к C. tologoijensis Beliajeva 1966, появились в Западной Европе (Kahlke, Lacombat, 2008).
На территории Якутии шерстистые носороги, вероятно, отсутствовали вплоть до среднего неоплейстоцена (Шер, 1971; Лазарев, 2005; Kahlke, Lacombat, 2008). В позднем плейстоцене этот вид был широко распространен в Евразии от Пиренейского по-ва и Британских о-вов до Чукотки и Камчатского по-ва (Маркова и др., 2011; Stuart, Lister, 2012). Наиболее поздние, раннеголоценовые остатки шерстистого носорога обнаружены на Урале, в пещере Лобвинская, 9500 ± 250, IERZ-92 (Косинцев, 1995).
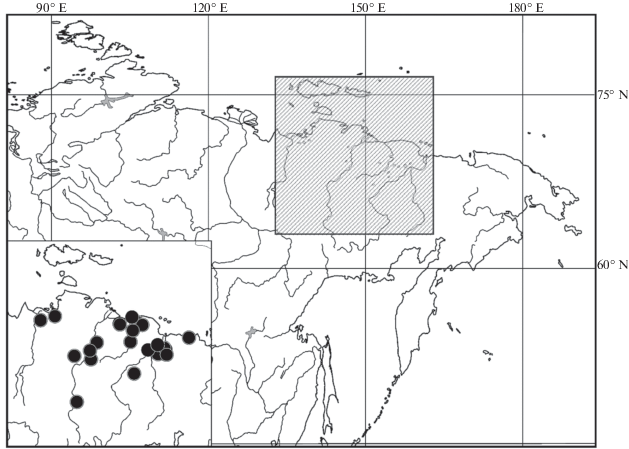
В Музее ”Ледниковый период” (Москва) собрана значительная коллекция черепов шерстистого носорога с территории северо-востока Республики Саха (Якутия) и северо-запада Чукотского АО (рис. 1). Объем материала позволил провести комплексное исследование морфологической изменчивости этой региональной “хроно-популяции” носорогов, обитавшей в позднем плейстоцене в западной части Берингии.
МАТЕРИАЛЫ И МЕТОДЫ
Исследовано 63 черепа взрослых шерстистых носорогов, хранящихся в коллекции музея Ледникового периода и собранных на территории северо-восточной Якутии и на северо-западе Чукотки (рис. 1) в бассейнах рек Яна, Индигирка, Алазея, Колыма и др.
Имеющиеся немногочисленные датировки черепов, включенных в исследованную выборку, позволяют предположить, что возраст находок в основном находится в пределах мегаинтерстадиала МИС 3 (57–29 тыс. лет назад) и начала максимума оледенения МИС 2 (29–20 тыс. лет назад) (Lorenzen et al., 2011): 50 097 ± 1047 (OxA-15 915), 49 940 ± 1160 (OxA-15 731), 49 310 ± 500 (OxA-15 914), 48 020 ± 740 (OxA-16 324), 36290 ± 270 (OxA-16 323), 28 700 ± 130 (OxA-15 911) (здесь и далее приводятся конечные радиоуглеродные даты калиброванные в программе OxCal 4.3, калибровочная кривая – IntCal13 (Ramsey, Lee, 2013).
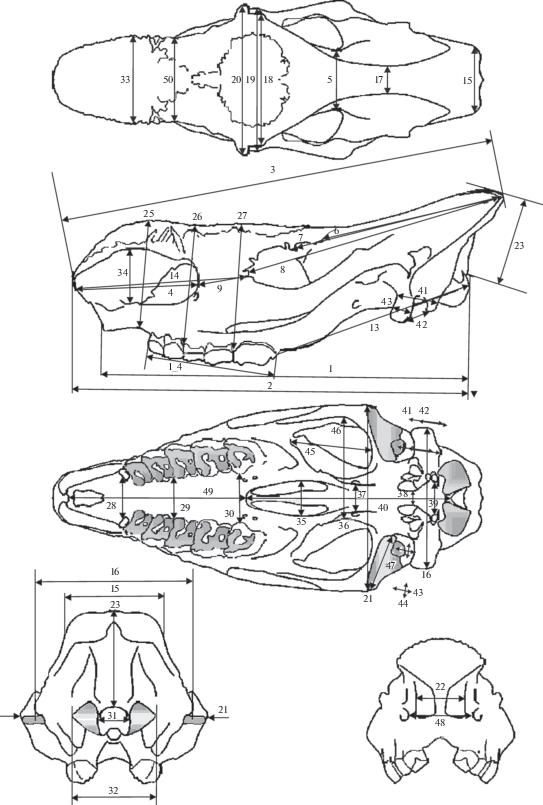
Промеры черепов проведены трижды при помощи стола-измерителя и двух электронных штангенциркулей, ШЦЦ-1-300 и ШЦЦ-1-500, с точностью до 1 мм. Использована методика промеров черепа носорогов, предложенная в (Guérin, 1980; van der Made, 2010) с дополнениями (рис. 2).
Рис. 2.
Схема промеров черепов шерстистого носорога по (van der Made, 2010). В нашей работе использованы следующие промеры: 2 – расстояние от переднего края носовых костей до задней поверхности затылочных мыщелков, 3 – расстояние переднего края носовых костей до затылка, 4 – длина носовой вырезки, 5 – минимальная ширина заглазничного отдела, 6 – расстояние от заглазничного отростка до затылка, 7 – расстояние от надглазничного отростка до затылка, 8 – расстояние от предглазничного отростка до затылка, 9 – расстояние от вырезки между носовой и межчелюстной костями (nasoincisive notch) до переднего края орбиты, 13 – расстояние от заднего края М3 до заднего края затылочного мыщелка, 14 – расстояние от переднего края носовых костей до переднего края орбиты, 15 – ширина затылка, 16 – ширина черепа в сосцевидных отростках, 17 – минимальное расстояние между лобно-теменными гребнями, 18 – ширина между заглазничными отростками, 19 – ширина между надглазничными отростками, 20 – ширина между предглазничными отростками, 21 – максимальная скуловая ширина, 22 – ширина входа в носовую полость, 23 – расстояние от затылочного отверстия до затылочного гребня, 28 – ширина нёба, измеренная перед Р2, 29 – ширина нёба между P4 и M1, 30 – ширина неба, измеренная перед M3, 31 – ширина затылочного отверстия, 32 – ширина между внешними краями затылочных мыщелков, 33 – ширина носовых костей, 34 – высота носового отверстия, 35 – ширина между хоанами, 37 – расстояние между каудальными крыловыми отверстиями (foramen alare caudale), 38 – расстояние между рваными отверстиями (foramen lacerum), 39 - расстояние между подъязычными отверстиями (foramen nervi hypoglossi), 45 – длина пространства внутри скуловой арки, 46 – ширина пространства внутри скуловой арки, 47 – ширина суставной фасетки, 48 – расстояние между подглазничными отверстиями, 50 – минимальная ширина носовых костей позади области происхождения носового рога, I_4 –длина зубного ряда.
Возраст животных оценивали по качественным признакам черепа: зарастанию швов, развитию мест крепления мышц и степени прорезанности и стертости зубов, “зрелости” компактной ткани; для исследования отобраны только черепа, принадлежавшие взрослым (ad), средневозрастным (ad-mat), матерым (mat) и сенильным (mat-sen) особям. Для оценки потенциального влияния возраста на результаты анализа использовали метод анализ соответствий (correspondence analysis (Шафир, 2009; Beh, Lombardo, 2014)) и непараметрический тест Краскела-Уоллиса (Sokal, Rohlf, 1981).
Определение половой принадлежности черепа проведено визуально, на основе внешних признаков: массивность (соотношение длина – ширина) черепа, степень развития мест крепления мышц, в том числе на затылочном гребне, степень развития ругозистости на поверхности черепа, ширина в скуловых дугах. Для некоторых экземпляров пол был определен, переопределен или подтвержден по результатам морфометрического анализа. Для этого использовали часть выборки черепов, в которой половая принадлежность была определена с большой долей уверенности. Эта подвыборка рассматривалась в качестве “обучающей” в пошаговом дискриминантном анализе. Принадлежность остальных экземпляров оценивалась по величине апостериорных вероятностей. Величину проявления полового диморфизма отдельных промеров оценивали по величине индекса полового диморфизма (Россолимо, Павлинов, 1974), отражающего относительное превышение размеров самцов над самками.
Метод исследования морфометрической изменчивости черепа шерстистого носорога ранее апробирован на многих объектах (Пузаченко, 2001; Куприянова и др., 2003; Пузаченко, Загребельный, 2008; Abramov, Puzachenko, 2005; Abramov et al., 2009; 2016; Baryshnikov, Puzachenko, 2011, 2017; Puzachenko et al., 2017 и др.). В общем случае последовательность анализа данных включает: подготовку морфометрических данных (промеров), построение многомерной модели, описывающей основные закономерности изменчивости, анализ полученных результатов. Основная цель подготовки данных – исключение влияния ошибок измерений и заполнение пропущенных данных. Для поиска “экстремальных значений” и выбросов использовали визуальный метод – анализ скаттер-диаграмм и тест Граббса (Stefansky, 1972). Значения, пропущенные вследствие естественных повреждений черепа, заполнялись с помощью EM-алгоритма (Dempster et al., 1977) и метода регрессии. Для приведения исходных промеров к одному масштабу применяли ранжирование в соответствии с формулой: ${{x}_{{i,{\text{rang}}}}} = {{({{x}_{i}} - {{x}_{{\min }}})} \mathord{\left/ {\vphantom {{({{x}_{i}} - {{x}_{{\min }}})} {({{x}_{{\max }}} - {{x}_{{\min }}})}}} \right. \kern-0em} {({{x}_{{\max }}} - {{x}_{{\min }}})}}$. Построение многомерной модели преследует цель компактного описания изменчивости и выявления основных компонент изменчивости на фоне случайных вариаций (“шума”). Модель морфологического пространства представляет собой евклидово пространство, небольшое число координат которого (виртуальные переменные) содержит основную информацию о варьировании многих исходных переменных. Каждый объект (череп) представлен в модельном пространстве точкой с координатами, определяющими ее геометрическое положение относительно всех других объектов. Для построения морфологического пространства использован метод неметрического многомерного шкалирования (NMDS) (Davison, Jones, 1983). В качестве исходных данных для этого метода рассчитывались две матрицы “морфологических дистанций” между всеми черепами выборки. Первая матрица попарных стандартизированных евклидовых дистанций отражала преимущественно различия по общим размерам черепа. Соответствующая модель морфопространства описывает размерную изменчивость и обозначается как “морфопространство размеров” (модель МР, обозначения координат – E1, E2, … и т.д.). Второй вариант оценки морфологических дистанций получен с использованием ранговой корреляции tau-b Кендалла (Kendall, 1975). Метрика в обобщенной виде отражает различия по форме/пропорциям черепов. Соответствующая этой метрике модель обозначена как “морфопространство формы” черепа (модель МФ. обозначение координат K1, K2, … и т.д.) (Пузаченко, 2016). Оптимальная размерность морфопространства (число координат) оценивалась по варьированию показателя “стресса Крускала” (Kruskal, 1964; Куприянова и др., 2003). Анализ МР и МФ моделей включал: корреляционный анализ координат морфопространства и исходных измерений черепа, с целью оценки качества и биологической интерпретации модели; анализа смесей гауссовских распределений (Gridgeman, 1970) с целью проверки однородности распределений значений координат со статистической оценкой по критерию d Колмогорова-Смирнова; классификацию выборки с использованием координат в качестве переменных методом k-средних.
МР и МФ модели были рассчитаны как для выборок предполагаемых самцов и самок, так и для всей выборки в целом. Соответствующие координата моделей (GE1 и GK1) воспроизводят варьирование обобщенных размеров и формы черепа носорогов обоих полов.
Для статистической обработки данных использовали программные продукты STATISTICA v. 8.0 (StatSoft, Tulsa, OK, USA), PAST v. 3.12 (Hammer et al., 2001) и NCSS 12 Statistical Software (ncss.com/software/ncss).
РЕЗУЛЬТАТЫ
Половой диморфизм черепа. У большинства промеров черепа шерстистого носорога предполагаемый половой диморфизм выражен незначительно и проявляется на частях черепа, прямо или косвенно связанных с креплением переднего и заднего рогов и с шириной затылка (табл. 1). Вероятно, рога самцов имели более мощные и широкие основания. Наибольшая разница (12–11%) между самцами и самками определена для ширины входа в полость носа и ширины носовых костей (промеры 22 и 33).
Таблица 1.
Промеры черепа шерстистого носорога с индексом полового диморфизма от 7 до 12%
| Промер | Название промера | Среднее между значениями промера у самцов и самок, мм | Статистическая значимость по тесту Манна–Уитни: Z. p | Индекс полового диморфизма, % |
|---|---|---|---|---|
| 22 | Ширина входа в полость носа | 8.4 | 4.52, < 0.0001 | 12.1 |
| 33 | Ширина носовых костей | 18.9 | 5.32, < 0.0001 | 11.2 |
| 50 | Минимальная ширина носовых костей позади области крепления рога | 14.1 | 5.48, < 0.0001 | 9.3 |
| 19 | Ширина в надглазничных отростках | 22.7 | 5,01, < 0.0001 | 8.6 |
| 15 | Ширина затылка | 16.4 | 3.27, 0.001 | 7.4 |
| 20 | Ширина в предглазничных отростках | 23.4 | 5.16, < 0.0001 | 7.8 |
Половой диморфизм слабо выражен по общим размерам черепа, таким как кондилобазальная длина или максимальная ширина в скуловых дугах.
Несмотря на полученные свидетельства низкого вклада полового диморфизма, этот фактор может влиять на результаты морфометрического анализа. Поэтому в дальнейшем выборки самцов (38 черепов) и самок (25 черепов) анализировали раздельно.
Структура изменчивости черепа. Морфологические пространства самцов имели размерность четыре, а самок – три (МР) и пять (МФ), соответственно. Тест Краскела-Уоллиса и анализ соответствий не выявили влияние принадлежности индивидуального возраста на значения координат моделей.
У самцов максимальные значения коэффициента корреляции Пирсона с первой координатой E1 получены для кондилобазальной длины (r = = 0.80), максимальной ширины в скуловых дугах (r = 0.79), ширины в предглазничных отростках (r = 0.78) и ряда других (табл. 2). Координата E2 коррелирует с шириной между хоанами (r = 0.55), расстоянием от надглазничного и предглазничного отростков до затылка (r = –0.59, –0.57). Специфическими промерами, коррелирующими с координатой E3, являются расстояние между каудальными крыловыми отверстиями (промер 37) и расстояние между лобно-теменными гребнями (промер 17), а с E4 – ширина большого затылочного отверстия.
Таблица 2.
Максимальные значения коэффициентов корреляции Пирсона для координат морфопространств МР (E1–E4) и МФ (K1–K4) с промерами черепа самцов
| Промер | E1 | E2 | E3 | E4 | Промер | K1 | K2 | K3 | K4 |
|---|---|---|---|---|---|---|---|---|---|
| 2 | 0.80 | –0.40 | 0.21 | –0.11 | 3 | 0.65 | 0.31 | 0.42 | –0.04 |
| 21 | 0.79 | 0.27 | –0.22 | –0.17 | 8 | 0.64 | 0.19 | 0.48 | 0.08 |
| 20 | 0.78 | 0.42 | 0.13 | 0.20 | 7 | 0.62 | 0.21 | 0.52 | 0.20 |
| 50 | 0.75 | 0.24 | –0.15 | 0.07 | 17 | –0.51 | –0.29 | 0.23 | 0.08 |
| 16 | 0.73 | 0.16 | 0.05 | –0.25 | 35 | –0.52 | –0.06 | 0.06 | –0.08 |
| 45 | 0.72 | –0.37 | 0.03 | –0.14 | 20 | –0.32 | 0.69 | 0.30 | 0.15 |
| 33 | 0.70 | 0.04 | 0.01 | 0.10 | 18 | –0.42 | 0.66 | 0.17 | 0.15 |
| 3 | 0.75 | –0.54 | –0.18 | 0.07 | 22 | 0.14 | 0.63 | –0.08 | –0.04 |
| 8 | 0.66 | –0.59 | –0.28 | 0.07 | 28 | –0.07 | 0.54 | –0.05 | 0.04 |
| 7 | 0.64 | –0.57 | –0.31 | 0.14 | 48 | –0.07 | 0.58 | –0.09 | 0.12 |
| 35 | 0.31 | 0.55 | –0.25 | –0.23 | 38 | –0.19 | 0.01 | 0.67 | 0.18 |
| 48 | –0.07 | 0.58 | –0.09 | 0.12 | 6 | 0.48 | 0.08 | 0.61 | 0.17 |
| 37 | 0.48 | 0.32 | –0.57 | –0.23 | 37 | –0.22 | –0.10 | 0.54 | –0.06 |
| 17 | 0.17 | 0.47 | –0.52 | –0.16 | 31 | 0.08 | –0.25 | –0.28 | –0.51 |
| 38 | –0.19 | 0.01 | 0.67 | 0.18 | I_4 | 0.40 | 0.04 | 0.08 | 0.52 |
| 31 | 0.11 | –0.08 | –0.01 | –0.70 | 4 | 0.45 | 0.17 | –0.22 | –0.51 |
Промеры, коррелирующие преимущественно или только с одной из координат модели, формируют “ортогональный” базис изменчивости черепа. Именно эти промеры и определяют размерность морфопространства.
Корреляция промеров с координатами МФ ниже по величине (табл. 2). Так как координаты в этом случае воспроизводят изменчивость пропорций черепа, то для промеров, коррелирующих прежде всего с координатой K1, вероятна аллометрическая изменчивость (промеры длины черепа, связанные с затылком, минимальное расстояние между лобно-теменными гребнями, ширина между хоанами). Кроме перечисленных промеров в базис изменчивости пропорций черепа самцов входят: длина зубного ряда, ширина черепа между предглазничными и заглазничными отростками, ширина входа в полость носа и другие (табл. 2).
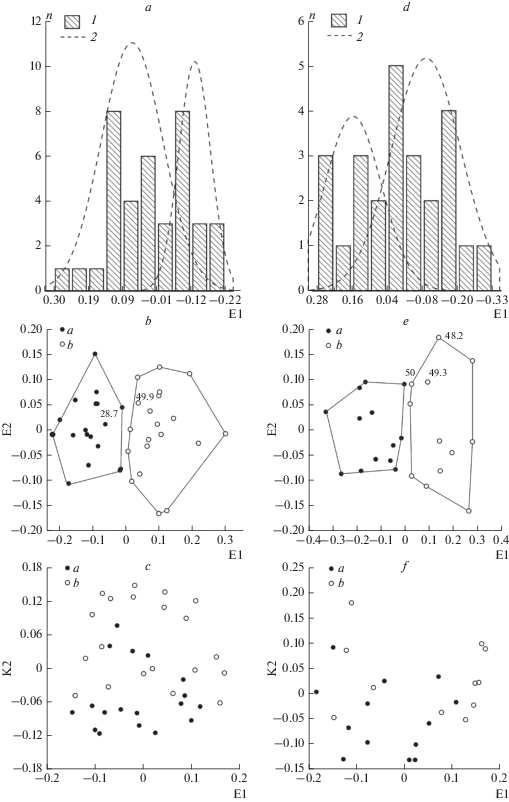
Анализ координат МР и МФ моделей самцов показал, что выборка неоднородна и распределение значений координаты E1 вероятно бимодально (критерий d Колмогорова-Смирнова = 0.084, p = 0.93, рис. 3a). Другими словами, выборка может содержать две группы черепов с разным средним размером черепа. Последующая дихотомическая классификация по значениям координат МР модели разбила выборку на две группы черепов (рис. 3b). По пропорциям черепа представители разных размерных групп практически не различались (рис. 3c). По тесту Манна-Уитни наибольшие значимые различия (p < 0.001) между группами демонстрируют: расстояние от кончика носовых костей до затылка, расстояние от кончика носа до передней границы орбиты максимальная ширина в скуловых дугах, ширина черепа в сосцевидных отростках, ширина носовых костей и другие. Различий между размерными группами не обнаружено по промерам: минимальное расстояние между лобно-теменными гребнями, ширина большого затылочного отверстия, длина зубного ряда и ряду других измерений, не коррелирующих c координатой E1. С помощью анализа соответствий не удалось обнаружить влияние индивидуального возраста животных на состав размерных групп.
Рис. 3.
Размерные группы черепов шерстистого носорога в МР и МФ моделях. a –, d – эмпирическое (1) распределение частот (n) значений первой координаты МР моделей (E1), коррелирующей с общими размерами черепа шерстистого носорога, и модели “смеси” двух гауссовских распределений (2) для выборок самцов (A) и самок (D); b – f – распределения экземпляров черепов самцов (b, c) и самок (e, f) относительно первых двух координат МР (b, e) и МФ (c, f) моделей, 1 – группа с мелкими черепами, 2 – группа с крупными черепами, цифры на диаграммах b, e – геологический возраст экземпляра в тыс. лет.
Изменчивость размеров черепа предполагаемых самок шерстистого носорога выглядит более упорядоченной, что выражается в меньшей размерности МР модели и более высоких величинах коэффициентов корреляции координат с промерами (табл. 3). Первая координата (E1) здесь также описывает варьирование общих размеров черепа (преимущественного его длины): расстояния от переднего края носовых костей до затылка и кондилобазальной длины, длины пространства внутри скуловой арки и других. Координата E2 коррелирует с шириной между хоанами и расстоянием от заднего края М3 до края затылочного мыщелка. Расстояние между подъязычными отверстиями является индикаторным промером координаты E3.
Таблица 3.
Максимальные значения коэффициентов корреляции Пирсона для координат морфопространств МР (E1–E3) и МФ (K1–K5) с промерами черепа самок
| Промер | E1 | E2 | E3 | Промер | K1 | K2 | K3 | K4 | K5 |
|---|---|---|---|---|---|---|---|---|---|
| 3 | 0.91 | –0.15 | 0.25 | I_4 | 0.78 | 0.01 | 0.28 | 0.14 | –0.12 |
| 8 | 0.89 | –0.16 | 0.18 | 7 | 0.70 | 0.39 | –0.03 | –0.04 | –0.23 |
| 2 | 0.85 | 0.03 | 0.30 | 8 | 0.69 | 0.41 | –0.13 | –0.06 | –0.19 |
| 6 | 0.84 | –0.10 | 0.23 | 3 | 0.62 | 0.36 | –0.16 | –0.03 | –0.14 |
| 45 | 0.83 | –0.01 | 0.05 | 18 | –0.25 | 0.77 | 0.03 | –0.02 | 0.06 |
| 7 | 0.82 | –0.26 | 0.12 | 19 | –0.29 | 0.74 | 0.19 | –0.15 | –0.30 |
| 50 | 0.78 | –0.15 | –0.18 | 20 | –0.04 | 0.66 | 0.25 | 0.13 | –0.09 |
| 14 | 0.78 | –0.03 | –0.03 | 39 | –0.12 | –0.03 | –0.62 | 0.08 | 0.02 |
| 23 | 0.74 | –0.22 | –0.11 | 29 | 0.32 | 0.13 | 0.53 | 0.19 | 0.16 |
| 5 | 0.73 | 0.27 | 0.26 | 37 | 0.14 | 0.26 | –0.27 | 0.67 | –0.09 |
| 17 | 0.70 | 0.11 | 0.10 | 38 | 0.10 | 0.31 | –0.03 | 0.52 | –0.31 |
| 4 | 0.67 | 0.05 | 0.08 | 31 | –0.43 | –0.06 | –0.02 | –0.25 | –0.60 |
| I_4 | 0.70 | –0.58 | –0.05 | ||||||
| 33 | 0.66 | –0.20 | –0.43 | ||||||
| 35 | 0.05 | 0.86 | 0.01 | ||||||
| 13 | 0.25 | 0.69 | 0.02 | ||||||
| 18 | 0.33 | 0.64 | –0.16 | ||||||
| 19 | 0.39 | 0.62 | –0.37 | ||||||
| 39 | 0.19 | 0.06 | 0.59 | ||||||
Размерность МФ модели у самок выше, чем у самцов (табл. 3). Так же как и у самцов, координата К1 коррелирует с измерениями, связанными с затылочной областью черепа, но к ним в этом случае добавляется длина зубного ряда. Как и у самцов, у самок пропорции ширины черепа в области орбит воспроизводятся координатой K2. Уникальная для самок координата K3 коррелирует с расстоянием между подъязычными отверстиями и шириной нёба на уровне P4–M1 (промер 29). Координата K4 коррелирует со специфическим промером – шириной между foramen alare caudale. Наконец, координата K5 воспроизводит варьирование относительной ширины большого затылочного отверстия.
Распределение значений координаты E1 у самок также оказалось бимодальным (d Колмогорова-Смирнова = 0.073, p = 0.99, рис. 3d). Скаттердиаграммы в координатах E1–E2 и K1–K2 (рис. 3e, 3f) демонстрируют, что две группы различаются между собой только по общим размерам черепа. В наибольшей степени они различаются по: расстоянию от надглазничного отростка до затылка, расстоянию от заглазничного отростка до затылка, расстоянию от переднего края носовых костей до затылка, расстоянию от предглазничного отростка до затылка, минимальной ширине носовых костей позади области крепления носового рога и минимальному расстоянию между лобно-теменными гребнями. Применение метода анализ соответствий не выявило влияния предполагаемого индивидуального возраста на величину измерений черепа самок носорогов из разных размерных групп.
На рис. 4a приведены линии регрессии координат МР моделей E1 относительно координаты GE1 (E1 = a + b*GE1) для самцов и самок из разных размерных групп. Формально различия между самцами и самками выражены в разном наклоне линий регрессии E1 относительно оси абсцисс GE1. В данном случае аллометрическая изменчивость предполагает, что в группе, включающей крупные черепа, половой диморфизм по общим размерам должен быть более выражен, чем в группе с мелкими черепами.
Рис. 4.
Аллометрическая изменчивость в двух размерных группах черепов шерстистого носорога. a, b – аллометрические паттерны общих размеров (a) и пропорций (b) черепа самок (F) и самцов (M) шерстистых носорогов, относящихся к двум размерным группам, в координатах МР (E1) и МФ (K1) моделей и аналогичных моделей для обоих полов (GE1, GK1) (1 – группа с мелкими черепами,; 2 – группа с крупными черепами); c, d – диаграммы, иллюстрирующие связь между изменениями первой координаты МФ модели для самцов и самок (GK1) с относительным расстоянием от надглазничного отростка до затылка (“7/3”) и относительной длиной зубного ряда (“I_4/3”).
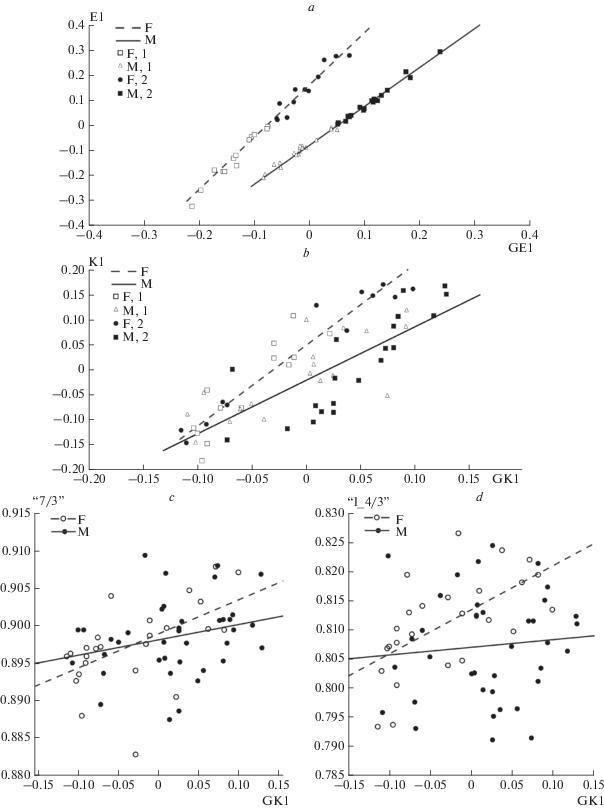
В изменчивости пропорций черепа самцов и самок (координаты K1 и GK1, рис. 4b) различия между полами также присутствуют, но выражены гораздо слабее. Координаты K1 обоих полов коррелируют с измерениями, связанными с длиной черепа и с относительной длиной его церебрального отдела (табл. 2, 3). GK1 координата МФ модели, включающей оба пола, также коррелирует с расстоянием от надглазничного отростка до затылка, нормированным на расстояние от переднего края носовых костей до затылка (рис. 4c). У самок эта зависимость выражена более определенно (коэффициент корреляции Пирсона r = 0.54, p = 0.005). Кроме этого (см. табл. 3), у самок по сравнению с самцами ограничена изменчивость относительной длины зубного ряда (рис. 4d). У самок GK1 коррелирует с длиной зубного ряда, нормированной на расстояние от переднего края носовых костей до затылка, с коэффициентом корреляции 0.61 (p = 0.001), в то время как у самцов подобная корреляция отсутствует. Принадлежность к одной из двух размерных групп, по-видимому, не влияет на пропорции черепа (рис. 4b).
ОБСУЖДЕНИЕ
Половой диморфизм. Половой диморфизм известен как у современных, так и у ископаемых носорогов (Mihlbachler, 2005; Chen et al., 2010), хотя бывает менее выражен, чем у других млекопитающих. Морфологически взрослые самцы и самки различаются по нескольким признакам. Например, самцы индийского носорога (Rhinoceros unicornis L. 1758) имеют более длинные нижнечелюстные резцы (но не рога), более мощную мускулатуру шеи и плеч, а также обширные складки шеи и плеча, что важно при ведении борьбы за самок в период размножения (Dinerstein, 1991). Диморфизм сильнее выражен у животных, выросших в условиях неволи. Самцы значительно выше в холке и больше по массе тела (до 1000 кг), чем в природе, что объясняется отсутствием конкуренции между самцами в зоопарках. В природе сильный стресс и плохое питание в длительный неинбридный интервал, когда молодых самцов прогоняют с продуктивных пастбищ доминирующие самцы, обусловливают выравнивание размеров (Dinerstein, 1991).
Для миоценового Chilotherium wimani Ringström 1924 признаками самца считаются большая длина второго резца, большая длина моляров, большая высота и длина затылочной части черепа (Chen et al., 2010). Указанный автор сделал обзор гендерных различий современных носорогов по литературным данным и указал на их вариабельность для разных видов: у яванского и суматранского носорогов половой диморфизм проявляется скорее в резцах, чем в размерах тела и рогов, тогда как черный носорог мономорфен; половой диморфизм у белого носорога (Ceratotherium simum (Burchell 1817)) выражен в размерах рога, массе тела и шеи; взрослые самцы белого носорога тяжелее самок на 25–43%.
Гендерные различия у взрослых особей шерстистого носорога являются “неполными” и выражены довольно слабо (Borsuk-Bialynicka, 1973). По мнению этого автора, половой диморфизм в выборке из одной популяции проявляется только в крайних значениях распределений признаков. Несмотря на значительное перекрытие распределений признаков самцов и самок, самцов отличают бóльшая длина черепа, бóльшая скуловая и орбитальная ширина черепа. Расстояние от затылочного гребня до орбиты, ширина затылка и носовых костей не проявляют четкой бимодальности рваспределений, что может быть связано с индивидуальной изменчивостью (Borsuk-Bialynicka, 1973).
В нашем исследовании показано, что предполагаемый половой диморфизм разных измерений черепа шерстистого носорога варьирует в пределах 0–12.1%. В целом отмечено, что различия между полами невелики. Эти различия наиболее четко проявляются в ростральной и надглазничной областях черепа, и наиболее вероятно связаны с диморфизмом размеров переднего и заднего рогов. Ругозистость отдельных костных структур также сильно варьирует: от слабой до чрезвычайно выраженной, обычно у самцов. Во втором случае ее развитие можно связать с высоким гормональным статусом.
Половой диморфизм проявлялся не только в средних значениях промеров, но в гораздо большей степени в структуре изменчивости размеров и пропорций черепа. Приведенные данные демонстрируют как сходство базиса изменчивости обоих полов, так и их заметные различия. Последние проявляются в разной размерности морфопространств и наборах промеров, формирующих базис изменчивости. У самцов в состав группы промеров, значения которых зависят от общих размеров черепа (коррелируют с координатой E1), входят в основном измерения общей длины и ширины черепа. У самок аналогичная группа промеров включает также измерения, характеризующие затылочный отдел черепа. У самцов эти промеры одновременно коррелируют и с первой и со второй координатами МР модели (табл. 2), т.е. их конечные величины зависят от двух независимых онтогенетических факторов. Вариации в развитии затылочного отдела черепа существенно влияют на общие пропорции черепа у обоих полов, что отражено в структуре МФ моделей.
Гипотеза об изменении размеров черепа шерстистых носорогов в конце позднего плейстоцена (вторая половина МИС 3 – МИС 2). В данном исследовании черепов шерстистого носорога на фоне относительно слабого полового диморфизма по общим размерам статистическими методами были обнаружены две размерные группы. Различия между “крупными” и “мелкими” экземплярами проявляются в основном по общим размерам. Сопоставление принадлежности к размерной группе с геологическим возрастом черепов (рис. 3b, 3e), позволяет высказать осторожное предположение, что крупные черепа в исследованной выборке чаще имеют более древний возраст, возможно больше 40 тыс. радиоуглеродных лет (МИС 3, МИС 4 или старше). Речь в данном случае может идти только о тенденции (“тренде”), а не о резком изменении размеров животных в конце мегаинтерстадиала МИС 3 – начале стадиала МИС 2. Эта хронологическая гипотеза требует проверки, для которой необходимо получить дополнительное количество радиоуглеродных дат. Необходимо также проверить, насколько генетически подобны “крупные” и “мелкие” экземпляры. На данном этапе исследований предполагается, что обе морфологические группы принадлежать к одному гаплотипу или гаплогруппе мтДНК. В этом случае, при подтверждении “хронологической” гипотезы, уменьшение размеров черепа можно будет связать с изменениями экологических условий жизни носорогов одной и той же хроно-популяции, обитавшей в этой части северо-востока Азии. Для характеристики изменения спектра питания носорогов целесообразно параллельно оценить и изотопный состав (δ13C, δ15N) костей черепа из разных размерных групп. Согласно альтернативной гипотезе смена населения носорогов на рассматриваемой территории произошла во второй половине МИС 3.
Список литературы
Косинцев П.А., 1995. Остатки крупных млекопитающих из Лобвинской пещеры // Материалы по истории современной биоты Среднего Урала. Отв. ред. Быкова Г.В. Институт экологии УрО РАН. Екатеринбург: Екатеринбург. С. 58–102.
Куприянова И.Ф., Пузаченко А.Ю., Агаджанян А.К., 2003. Временны́е и пространственные компоненты изменчивости черепа обыкновенной бурозубки, Sorex araneus (Insectivora) // Зоологический журнал. Т. 82. № 7. С. 839–851.
Лазарев П.А., 2005. Крупные млекопитающие антропогена Якутии (филогенез, систематика, палеоэкология, фаунистические комплексы, тафономия, останки). Автореф. дис. … докт. биол. наук. Якутск: Институт прикладной экологии Севера Академии наук Республики Саха (Якутия). 46 с.
Маркова А.К., Пузаченко А.Ю., Кольфсхотен ван Т., дер Плихт ван И., Пономарев Д.В., 2011. Новейшие данные о динамике ареалов мамонта и шерстистого носорога в Европе во второй половине позднего плейстоцена–голоцене // Известия Российской академии наук. Серия Географическая. № 4. С. 54–65.
Пузаченко А.Ю., 2001. Внутрипопуляционная изменчивость черепа обыкновенного слепыша Spalax microphthalmus (Spalacidae, Rodentia). 1. Методика анализа данных, невозрастная изменчивость самцов // Зоологический журнал. Т. 80. Вып. 3. С. 1–15.
Пузаченко А.Ю., 2016. Количественные закономерности морфологического разнообразия черепа млекопитающих // Ред. Павлинов И.Я., Калякин М.В., Сысоев А.В. Сборник трудов Зоологического музея МГУ. Т. 54. С. 229–268.
Пузаченко А.Ю., Загребельный С.В., 2008. Изменчивость черепа песцов Alopex lagopus lagopus (Carnivora, Canidae) Евразии // Зоологический журнал. Т. 87. № 9. С. 1106–1123.
Россолимо О.Л., Павлинов И.Я., 1974. Половые различия в развитии, размерах и пропорциях черепа лесной куницы (Martes martes L.: Mammalia, Mustelidae) // Бюллетень Московского общества испытателей природы. Т. 79. Вып. 6. С. 23–35.
Шафир М.А., 2009. Анализ соответствий: представление метода // Социология. № 28. С. 20–44
Шер А.В., 1971. Млекопитающие и стратиграфия плейстоцена северо-востока СССР и Северной Америки. М.: Наука. 310 с.
Abramov A.V., Puzachenko A.Y., 2005. Sexual dimorphism of craniological characters in Eurasian badgers, Meles spp. (Carnivora, Mustelidae) // Zoologischer Anzeiger – A Journal of Comparative Zoology. V. 244. P. 11–29.
Abramov A.V., Puzachenko A.Y., Tumanov I.L., 2016. Morphological differentiation of skull in two closely-related mustelid species (Carnivora, Mustelidae) // Zoological Studies. V. 55. № 1. P. 1–23.
Abramov A.V., Puzachenko A.Y., Wiig O., 2009. Cranial variation in the European badger Meles meles (Carnivora, Mustelidae) in Scandinavia // Zoological Journal of the Linnean Society. V. 157. P. 433–450.
Baryshnikov G.F., Puzachenko A., 2011. Craniometrical variability of cave bears (Carnivora, Ursidae): multivariate comparative analysis // Quaternary International. V. 245. P. 350–368.
Baryshnikov G.F., Puzachenko A.Y., 2017. Morphometric analysis of metacarpal and metatarsal bones of cave bears (Carnivora, Ursidae) // Fossil Imprint. V. 73. P. 7–47.
Beh E.J., Lombardo R., 2014. Correspondence Analysis: Theory, Practice and New Strategies, Chichester: Wiley. 592 p.
Borsuk-Bialynicka M., 1973. Studies on the Pleistocene rhinoceros Coelodonta antiquitatis (Blumenbach) // Palaeontologia Polonica. № 29. 149 p.
Chen S., Deng T., Hou S., Shi Q., Pang L., 2010. Sexual Dimorphism in Perissodactyl Rhinocerotid Chilotherium wimani from the Late Miocene of the Linxia Basin (Gansu, China) // Acta Palaeontologica Polonica. V. 55. № 4. P. 587–597.
Chow M., Chow B.S., 1959. Villafranchian Mammals from Lingyi, S.W. Shansi // Acta Palaeontologia Sinica. V. 7. P. 89–97.
Davison M.L. Jones L.E., 1983. Special issue: multidimensional scaling and its applications // Applied Psychological Measurement. V. 7. P. 373–514.
Dempster A., Laird N., Rubin D., 1977. Maximum likelihood from incomplete data via the EM algorithm // Journal of the Royal Statistical Societyю Series B. V. 39. № 1. 138 p.
Deng T., Wang X., Fortelius M., Li Q., Wang Y., Tseng Z.J., Takeuchi G.T., Saylor J.E., Säilä L.K., Xie G., 2011. Out of Tibet: Pliocene woolly rhino suggests high plateau origin of ice age megaherbivores // Science. V. 333. № 6047. P. 1285–1288.
Dinerstein E., 1991. Sexual Dimorphism in the Greater One-Horned Rhinoceros (Rhinoceros unicornis) // Journal of Mammalogy. V. 72. P. 450–457.
Foronova I.V., 1999. Quaternary mammals and stratigraphy of the Kuznetsk Basin (south-western Siberia) // Anthropozoikum. V. 23. P. 71–97.
Gridgeman N.T., 1970. A comparison of two methods of analysis of mixtures of normal distributions // Technometrics. V. 12. № 4. P. 823–833.
Guérin C., 1980. Les rhinocéros (Mammalia, Perissodactyla) du Miocène terminal au Pléistocène supérieur en Europe occidentale; comparaison avec les espèces actuelles. Doc. Laboratoires de Géologie Lyon. V. 79. № 1–3. P. 1–1185.
Hammer Ø., Harper D.A.T., Ryan P.D., 2001. PAST: paleontological statistics software package for education and data analysis // Palaeontologia Electronica. V. 4. P. 1–9.
Kahlke H.-D., 1969. Die Rhinocerotiden-Reste aus den Kiesen von Süßenborn bei Weimar. Paläontologische Abhandlungen. V. A3 № 3/4. P. 667–709.
Kahlke R.-K., 2014. The origin of Eurasian Mammoth Faunas (Mammuthus-Coelodonta Faunal Complex) // Quaternary Science Reviews. V. 96. P. 32–49.
Kahlke R.D., Lacombat F., 2008. The earliest immigration of woolly rhinoceros (Coelodonta tologoijensis, Rhinocerotidae, Mammalia) into Europe and its adaptive evolution in Palaearctic cold stage mammal faunas // Quaternary Science Reviews. V. 27. № 21–22. P. 1951–1961.
Kendall M.G., 1975. Rank Correlation Methods. London: Charles Griffin and Co. 202 p.
Kruskal B., 1964. Multidimensional scaling by optimizing goodness of fit to nonmetric hypothesis // Psychometrika. V. 29. P. 1–27.
Li Y., 1984. Fossil mammals and their stratigraphic age from Danangou, Yuxian Co., Hebei Province // Vertebrata Palasiatica. V. 22. P. 60–68.
Lorenzen E.D., Nogués-Bravo D., Orlando L., Weinstoc, J., Binladen J., Marske K.A. Ugan A. Borregaard M.K., Gilbert M.T.P., Nielsen R., Simon Y.W.H., Goebel T., Graf K.E., Byers D., Stenderup J.T., Rasmussen M., Campos P.F., Leonard J.A., Koepfli K.-P., Froese D., Zazula G., Stafford T.W., Aaris-Sørensen K., Batra P., Haywood A.M., Singarayer J.S., Valdes P.J., Boeskorov G., Burns J.A., Davydov S.P., Haile J., Jenkins D.L., Kosintsev P., Kuznetsova T., Lai X., Martin L.D., McDonald H.G., Mol D., Meldgaard M., Munch K., Stephan E., Sablin M., Sommer R.S., Sipko T., Scott E., Suchard M.A., Tikhonov A., Willerslev R.,Wayne R.K., Cooper A., Hofreiter M., Sher A., Shapiro B., Rahbek C., Willerslev E., 2011. Species-specific responses of Late Quaternary megafauna to climate and humans // Nature. V. 479. P. 359–478.
Mihlbachler M.C., 2005. Linking sexual dimorphism and sociality in rhinoceroses: insights from Teleoceras proterum and Aphelops malacorhinus from the late Miocene of Florida // Bulletin of the Florida Museum of Natural History. V. 45. № 4. P. 495–520.
Ramsey B.C., Lee Sh., 2013. Recent and planned developments of the program OxCal // Radiocarbon. V. 55. P. 720–730.
Puzachenko A.Y., Abramov A.V., Rozhnov V.V., 2017. Cranial variation and taxonomic content of the marbled polecat Vormela peregusna (Mustelidae, Carnivora) // Mammalian Biology. V. 83. P. 10–20.
Sokal R.R., Rohlf F.J., 1981. Biometry. 2d cd. NY: W.H. Freeman and Company. 859 p.
Stefansky W., 1972. Rejecting Outliers in Factorial Designs // Technometrics. V. 14. № 2. P. 469–479.
Stuart A.J., Lister A.M., 2012. Extinction chronology of the woolly rhinoceros Coelodonta antiquitatis in the context of late Quaternary megafaunal extinctions in northern Eurasia // Quaternary Science Reviews. V. 51. P. 1–17.
Teilhard de Chardin P., Piveteau J., 1930. Les mammiferes fossiles de Nihowan (Chine) // Annales de Paléontologie. V. 19. P. 1–134.
van der Made J., 2010. The rhinos from the Middle Pleistocene of Neumark-Nord (Saxony-Anhalt) // Veröffentlichungendes Landesamtes für Denkmalpflegeund Archäologie. V. 62. P. 433–500.
Zheng S., Cai B., 1991. Micromammalian Fossils from Danangou of Yuxian, Hebei // Contribution to INQUA XIII. Beijing: Beijing Scientific and Technological Publishing House. P. 100–131.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал