Зоологический журнал, 2019, T. 98, № 12, стр. 1392-1407
Размер яйца как основной стимул к дискриминационному поведению пеночки-зарнички (Phylloscopus inornatus, Phylloscopidae) при гнездовом паразитизме глухой кукушки (Cuculus optatus, Cuculidae)
С. Г. Мещерягина a, *, Г. Н. Бачурин b, **, О. В. Бурский c, ***, М. Г. Головатин a, ****
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, Россия
b Научно-практический центр биоразнообразия
623850 Ирбит, Россия
c Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Россия
* E-mail: meshcheryagina_sg@ipae.uran.ru
** E-mail: ur.bagenik@mail.ru
*** E-mail: obourski@gmail.com
**** E-mail: golovatin@ipae.uran.ru
Поступила в редакцию 14.03.2019
После доработки 25.03.2019
Принята к публикации 10.04.2019
Аннотация
В трех географических популяциях пеночки-зарнички с различным уровнем гнездового паразитизма глухой кукушки проведены экспериментальные исследования дискриминационного поведения хозяина. Показано, что отсутствие пятнистого рисунка на скорлупе инородных яиц не является стимулом к распознаванию. Принятие или отвержение инородного яйца определяется соотношением диаметров яйца паразита и хозяина, причем средний размер яиц в индивидуальной кладке хозяина также важен. Это дает основание полагать, что распознавание паразитного яйца возникает на основе тактильного контакта самки с неровной поверхностью кладки. Средний диаметр яиц глухих кукушек, использующих гнезда зарничек, существенно меньше величины, при которой вероятность отвержения яйца равна вероятности принятия. Этот показатель также меньше, чем у других рас, что свидетельствует об адаптации гнездового паразита к данному хозяину. Принятие подложенного яйца, удаление его из гнезда и отказ от насиживания кладки представляют собой три ступени одной и той же реакции в ответ на количественное изменение стимула.
Дискриминационное поведение вида-хозяина включает распознавание и отвержение инородного яйца (Honza, Cherry, 2017). Оно возникло в ответ на гнездовой паразитизм и представляет собой самую распространенную защитную адаптацию хозяев (Davies, 2011). Одновременно такое поведение служит селективным механизмом, ответственным за мимикрию яиц гнездового паразита (Davies, Brooke, 1989; Нумеров, 2003; Stokke et al., 2017). Стимулы, пригодные для распознавания чужого яйца, имеют различный приоритет. Показано, что открытогнездящиеся виды зрительно оценивают различие яиц по окраске, а закрытогнездящиеся виды осязают неровность поверхности кладки (Нумеров, 2003). Осязательные стимулы слабо изучены, а результаты их исследования противоречивы (Honza, Cherry, 2017). На выбор того или иного способа отвержения инородного яйца влияют размерно-весовые характеристики последнего (Guigueno et al., 2014; Ruiz-Raya et al., 2015; Roncalli et al., 2017), размер, форма и твердость клюва хозяина (Davies, Brooke, 1989; Moksnes et al., 1991; 1991a; Martín-Vivaldi et al., 2002), а также особенности устройства гнезда и глубина лотка (Mason, Rothstein, 1986; Guigueno et al., 2014).
Глухая кукушка (Cuculus optatus (Gould 1845)) – облигатный гнездовой паразит пеночек рода Phylloscopus (Нумеров, 2003; Payne, 2005; Мещерягина и др., 2017), среди которых пеночка-зарничка (Phylloscopus inornatus (Blyth 1842)) – один из наиболее мелких представителей. Пеночки строят закрытые гнезда с узким входным отверстием сбоку (Cramp, Brooks, 1992). Следовательно, у хозяев глухой кукушки ведущую роль при распознавании могут играть осязательные стимулы, связанные с размером яиц. Экспериментально показано, что распознавание яйца у близкородственного вида – тусклой зарнички (Phylloscopus humei (W.E. Brooks 1878)) – основано на его отличии по размеру от других яиц в кладке (Marchetti, 1992, 2000). При этом хозяева не изучали размер яиц как таковой и принимали как крупные, так и мелкие искусственные яйца, пока все яйца в кладке были сходного размера. В естественных условиях яйцо паразита обычно крупнее яиц хозяина. Возникает вопрос, какие размерные параметры инородного яйца наиболее важны для его распознавания и как это отражается на морфологии яиц глухой кукушки. Ранее нами было установлено пороговое значение разности диаметров яиц при паразитировании кладки, определяющее ответное поведение зарнички (Meshcheryagina et al., 2016). В этой работе мы рассмотрели, как по мере роста размерных различий изменяются вероятность дискриминации и способ отвержения инородного яйца.
МАТЕРИАЛЫ И МЕТОДЫ
Районы исследований и частота эксплуатации гнезд кукушкой
Исследования проводили в трех гнездовых группировках зарнички, различных по положению в ареале и частоте гнездового паразитизма. Сроки наблюдений (июнь–июль) полностью перекрывали сезон гнездования вида-хозяина.
В Юго-восточной Сибири, на западном макросклоне Баргузинского хребта (Бурятия, 54°21′ с.ш., 109°47′ в.д.), в 2012–2013 гг. мы провели 22 эксперимента в 20 гнездах. На этой территории глухие кукушки регулярно используют зарничек в качестве хозяев (рис. 1): первые находки яиц гнездового паразита зарегистрированы А.В. Фёдоровым в 1980–1984 гг. (n = 7, архив Баргузинского заповедника). В 1986–1987 гг. было найдено 5 яиц кукушки в 4 гнездах и 1 кукушонок (Ананин, 2006). За период наших исследований 2005–2007 и 2012–2013 гг. выявлено 29 случаев гнездового паразитизма в 26 из 194 гнезд (Мещерягина и др., 2015, 2017а).
Рис. 1.
Яйцо (слева) и птенец (справа) глухой кукушки в гнезде зарнички: кладка найдена в истоках р. Давше 28 км, 08.07.2012 (фото С.Г. Мещерягиной); кукушонок (pull) – левый приток в верховьях р. Давше 26.5 км, 12.07.2005 (фото Г.Н. Бачурина).

В Центральной Сибири, в среднем течении р. Енисей (Енисейская экологическая станция Института проблем экологии и эволюции им. А.Н. Северцова РАН, Красноярский край, 62°17′ с.ш., 89°01′ в.д.), в 2016–2017 гг. провели 22 эксперимента. Здесь паразитизм в гнездах зарнички наблюдали крайне редко: яйца обнаружены лишь в 6 из 390 гнезд, найденных в течение 27 репродуктивных сезонов (О.В. Бурский, устное сообщение; Мещерягина и др., 2017).
На Северном Урале, в верховьях р. Вишера (Пермский край, 61°01′ с.ш., 58°58′ в.д.), в 2014 г. выполнили 16 экспериментов в 14 гнездах. У западных границ репродуктивного ареала зарничка – немногочисленный вид. За период наших исследований в 2010–2011 и 2014 гг. найдено 22 гнезда, случаев гнездового паразитизма не выявлено (Мещерягина и др., 2015а).
Поиск гнезд и определение даты откладки первого яйца
Зарничка имеет один репродуктивный цикл, повторная откладка возможна в начале сезона после потери яиц. Гнезда устраивают на земле, насиживает только самка (Cramp, Brooks, 1992; Мещерягина и др., 2015а). При поиске гнезд мы совмещали 3 способа: (1) визуальный осмотр подходящих мест на участке токовой активности самца, (2) выпугивание самки из гнезда палкой, которой проводили по наземной растительности, и (3) выслеживание момента, когда самка залетает в гнездо или самец спускается в нижний ярус и смотрит в направлении гнезда. Помимо наблюдений за гнездами с инородным яйцом, еще 105 гнезд зарнички использовали для контроля: отмечали реакцию самки на регулярные проверки и манипуляции с кладкой (измерение, фотографирование и овоскопирование). Повторным считали гнездо, которое было отстроено на участке пары спустя 2–4 суток после потери гнезда и которое содержало яйца, сходные с предыдущей кладкой по размеру и окраске. Дату откладки первого яйца либо фиксировали при непосредственном наблюдении, либо рассчитывали исходя из характерной для зарнички схемы насиживания. В Пермском и Красноярском крае насиживание начиналось с 5-го яйца, в Бурятии и при повторных кладках – с 4-го яйца и продолжалось 12 суток (Мещерягина и др., 2015; 2015а). Начало непрерывного насиживания определяли по степени развития эмбрионов, просвечивая яйца в овоскопе и сравнивая их с фотографиями яиц с точно известным сроком инкубации. Достоверность контролировали по дате вылупления птенцов.
Проведение экспериментов
В качестве модельных использовали неинкубированные яйца других видов птиц, чтобы исключить влияние фактора “искусственного яйца” (Martín-Vivaldi et al., 2002; Antonov et al., 2009; Roncalli et al., 2017). Модельное яйцо подкладывали в обмен на одно яйцо хозяина, однотипно размещая его в гнезде: в горизонтальном положении у порожка с внутренней стороны, перпендикулярно оси входа (рис. 2). Имитируя стратегию кукушки (Нумеров, 2003), яйца подкладывали во второй половине дня, преимущественно в начале инкубации кладки хозяина (0–3 суток, n = 41; 4‒7 суток, n = 15; 9–11 суток n = 4). Перед подкладкой яйцо согревали в руках, чтобы исключить фактор разницы температур c яйцами хозяина. Яйцо подкладывали либо однократно (n = 51), либо двукратно, заменяя на более крупное (n = 4), а в одном случае – после дискриминации яйца глухой кукушки. При имитации паразитизма инородное яйцо часто отвергается в течение 24 ч (Moksnes et al., 1991a; Marchetti, 1992; 2000), поэтому мы оценивали результат эксперимента через 1–2 суток (за некоторыми исключениями); через 2–5 суток (в зависимости от срока инкубации яиц хозяина) модельное яйцо изымали. Размещение яиц в лотке фотографировали при каждом повторном посещении гнезда. Экспериментальные процедуры не нарушали правил проведения научных исследований с использованием животных, утвержденных распоряжением Президиума АН СССР от 2.04.1980 № 12 000–496 и приказом Минвуза СССР от 13.09.1984 № 22. Для экспериментальных подкладок использовали яйца от птиц, содержащихся в неволе, или из брошенных кладок.
Рис. 2.
Способ размещения модельного яйца в гнездах зарнички при экспериментальной имитации гнездового паразитизма: Lsd – японская амадина, Pm – большая синица, Mu – волнистый попугайчик.

Эксперимент 1: контроль. Подкладывали яйца японской амадины (Lonchura striata var. domestica (Linnaeus 1766)), сходные с яйцами зарнички по размеру (рис. 3), но с чисто-белой скорлупой без пятен. Эксперименты (n = 15) были проведены в гнездовом поселении, редко эксплуатируемом глухой кукушкой (Красноярский край, 2016 г.). Их результаты позволили определить, была ли дискриминация модельных яиц ответом на особенность, не связанную с размером, а именно на отсутствие пятнистой окраски.
Рис. 3.
Сравнительный ряд яиц хозяина (Pi – зарничка), гнездового паразита (Co – глухая кукушка расы inornatus) и модельных яиц (Lsd – японская амадина, Pct – сибирская теньковка, Pm – большая синица, Mu – волнистый попугайчик, Ar – розовощекий неразлучник, Nh – корелла).

Эксперимент 2: подкладывание крупных чисто-белых яиц. Использовали яйца мелких попугаев: волнистого попугайчика (Melopsittacus undulatus (Shaw 1805), n = 31), розовощекого неразлучника (Agapornis roseicollis (Vieillot 1818), n = 1) и кореллы (Nymphicus hollandicus (Kerr 1792), n = 1), которые существенно крупнее яиц зарнички (объем яиц больше в 2, 3 и 4 раза соответственно; рис. 3). Выбор модельных яиц был обусловлен крупным размером, превышающим яйцо глухой кукушки расы inornatus по объему в 1.5–2.5 раза, и отсутствием фоновой окраски скорлупы. Такие эксперименты провели во всех исследованных поселениях зарнички с целью установить верхний предел толерантности к размеру инородного яйца и оценить влияние распространенности гнездового паразитизма на дискриминационное поведение хозяина.
Эксперимент 3: подкладывание крупных пятнистых яиц. В качестве модельных применяли яйца большой синицы (Parus major (Linnaeus 1758), n = = 10) и сибирской теньковки (Phylloscopus collybita tristis (Vieillot 1817), n = 2), которые крупнее яиц зарнички в 2 и 1.5 раза по объему (рис. 3) и имеют пятнистый рисунок на чисто-белом фоне. При этом яйца большой синицы сходны с яйцами глухой кукушки расы inornatus по цвету пятен скорлупы и равны им или немного крупнее (до 30%) по объему. Эксперименты с подкладкой яиц большой синицы проведены в поселении, где гнездовой паразитизм не отмечался, что позволило считать любое проявление дискриминации яйца врожденным. Яйца сибирской теньковки в сравнении с глухой кукушкой расы inornatus были на 15–27% меньше по объему, но имели иной цвет пятен (темно-бурые, а не красные). Это позволило тестировать влияние их окраски на распознавание в популяции с регулярным гнездовым паразитизмом.
Естественный гнездовой паразитизм
Кроме экспериментальных данных, в анализ включены результаты естественного гнездового паразитизма глухой кукушки расы inornatus с доступной информацией по оометрии (Бурятия, n = 2, материалы А.В. Фёдорова, 1980 и 1983 гг. и n = 14 яиц в 12 гнездах, собственные материалы, 2005, 2007 и 2012 гг.). Отдельно рассмотрены случаи использования гнезд зарнички несоответствующей расой кукушки: proregulus (Приморский край, n = 1, материалы Н.Н. Балацкого, 1996 г.; о-в Сахалин, n = 1, материалы В.Н. Сотникова, 2009 г.; Бурятия, n = 1, собственные материалы, 2013 г.) и borealis (Красноярский край, n = 2, собственные материалы, 2011 и 2016 гг.). Результаты позволили определить особенности реакции зарнички на яйца различных рас. Таким образом, модельные яйца вместе с яйцами кукушки образовали непрерывный размерный ряд из инородных яиц (табл. 1), а обобщенные результаты показали, какие способы отвержения могут использоваться зарничками в ответ на яйца различного размера.
Таблица 1.
Видовая принадлежность и размерные характеристики яиц, включенных в анализ
| Вид | n | Длина, мм | Диаметр, мм | ||
|---|---|---|---|---|---|
| среднее ± SD | min, max | среднее ± SD | min, max | ||
| Phylloscopus inornatus* | 71 | 13.83 ± 0.51 | 12.79, 15.16 | 10.95 ± 0.28 | 10.13, 11.75 |
| Lonchura striata var. domestica | 14 | 15.83 ± 0.84 | 14.95, 17.45 | 10.91 ± 0.55 | 10.45, 11.77 |
| Phylloscopus collybita tristis | 1 | 16.27 | – | 12.56 | – |
| Parus major | 10 | 17.73 ± 0.26 | 17.43, 18.08 | 13.70 ± 0.18 | 13.43, 13.94 |
| Cuculus optatus gens inornatus | 15 | 18.85 ± 0.82 | 17.30, 20.20 | 13.04 ± 0.39 | 12.60, 13.90 |
| Cuculus optatus gens proregulus | 3 | 20.71 ± 0.38 | 20.30, 21.04 | 13.49 ± 0.32 | 13.17, 13.80 |
| Cuculus optatus gens borealis | 2 | 19.99 ± 0.13 | 19.90, 20.09 | 14.21 ± 0.56 | 13.81, 14.60 |
| Melopsittacus undulatus | 30 | 18.78 ± 0.70 | 17.53, 20.10 | 14.83 ± 0.34 | 14.00, 15.59 |
| Agapornis roseicollis | 1 | 19.70 | – | 16.53 | – |
| Nymphicus hollandicus | 1 | 23.36 | – | 17.60 | – |
Интерпретация результатов подкладки инородных яиц
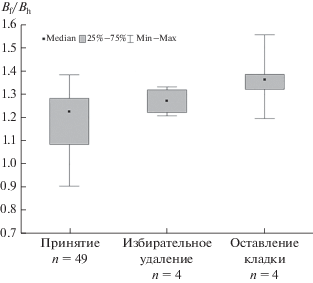
Инородное яйцо считали принятым, если при продолжении дальнейшей откладки яиц и насиживания сохранялась его целостность. О продолжении насиживания свидетельствовало как непосредственное присутствие самки в гнезде, так и изменение размещения яиц в лотке после предыдущего посещения, при котором они были теплыми и сухими. Яйцо считали отвергнутым, если наблюдали удаление инородного яйца или отказ от насиживания всей кладки. При избирательном удалении чужого яйца самка выбрасывала его, захватив клювом за край проклеванного отверстия в скорлупе, либо выкатывала, так что неповрежденное яйцо оказывалось за пределами гнезда и упиралось в неровность наземной поверхности. Гнездо считали оставленным, если кладка была холодной, мокрой, положение инородного яйца в лотке изменилось незначительно или оставалось неизменным, а пара исчезала с гнездового участка. В ряде случаев при этом находили очередное яйцо, отложенное вне лотка. При полном исчезновении яиц, включая инородное, и видимых повреждениях гнезда его считали разоренным и не включали в анализ (n = 3, по одному разорению с яйцом японской амадины, сибирской теньковки и волнистого попугайчика). В кладках с двумя яйцами кукушек (множественный паразитизм) в случае их отвержения хозяином (n = 1) учитывали только размер наиболее крупного яйца, в случае принятия (n = 1) – размер каждого яйца.
В итоге в анализ были включены результаты 77 случаев присутствия инородного яйца в 71 гнезде зарнички (табл. 1). Хозяев гнезда на основе ответного поведения классифицировали как принявших (acceptors) или отвергших (rejecters). Последних подразделяли на две группы: отвергшие путем удаления (ejection) или путем отказа от насиживания всей кладки (desertion).
Оометрические переменные
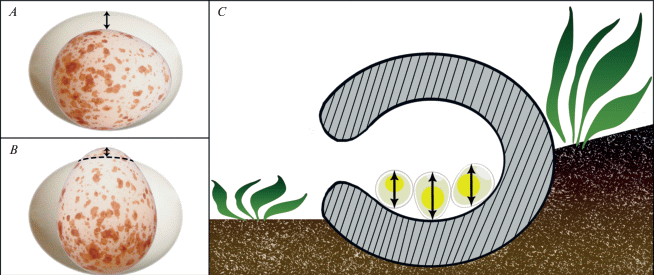
Длину (L) и диаметр (B) яиц измеряли цифровым штангенциркулем с разрешением 0.01 мм. Симметричные удлиненные яйца кукушки редко принимают вертикальное положение (Пукинский, 1978): в наших наблюдениях (n = 114) таких случаев не отмечено. Однако асимметричные яйца мелких птиц иногда разворачиваются вертикально (рис. 4), хотя такое положение неустойчиво и кратковременно. Поэтому мы сопоставляли диаметр подложенных яиц (Bf) как со средним диаметром (Bh), так и со средней длиной (Lh) яиц в кладке хозяина. Мы применяли разнообразные сравнительные функции, в том числе сравнение объемов, вычисленных по формуле V = π/6 × B 2 × L (Муравьев и др., 2008).
Рис. 4.
Показатели размерных различий яиц хозяина и инородных (модельных и гнездового паразита), применяемые в исследовании: A – различия между диаметром инородного яйца и диаметром яйца в кладке хозяина; B – различия между диаметром инородного яйца и длиной яйца в кладке хозяина. C – варианты размещения яиц в лотке (схема в разрезе), от летка слева направо: при горизонтальном положении ощущается наименьший размер (B), при вертикальном – наибольший (L), при диагональном – средний (B < x < L).
Статистические анализы
В малых выборках мы использовали непараметрические тесты: для парных сравнений подложенного яйца со средним размером яиц в кладке хозяина – тест Вилкоксона, для двух независимых выборок – U-критерий Манна-Уитни, а при сравнении трех групп – критерий Краскела-Уоллиса. Частотное взаимодействие двух альтернативных признаков оценивали точным критерием Фишера. Результаты повторной имитации паразитирования в гнезде некоторых хозяев оценивали гамма-коэффициентом ранговой корреляции.
Объединив все собранные данные по принятию или отвержению чужеродного яйца зарничками, мы построили логистическую модель вероятности его дискриминации в зависимости от размеров ln[p/(1 – p)] = a + bx, где x – относительный размер чужеродного яйца, a и b – коэффициенты, значимость которых определяли тестом Вальда. В качестве аргумента x мы подставляли различные выражения из переменных, содержащих размеры яиц паразита и хозяина. Полученные модели сравнивали по AIC (Burnham, Anderson, 2002) и обнаружили, что простое отношение их диаметров соответствует цели наилучшим образом; его использовали для частных сравнений.
Расчеты выполнены в пакете программ Statistica 8.0 (StatSoft Inc., 1984–2007).
РЕЗУЛЬТАТЫ
Общие условия проведения экспериментов не вносили значимого влияния, поэтому мы объединили результаты по целевым задачам, а побочные воздействия рассмотрели в конце раздела.
Реакция на чисто-белые яйца сходного размера
Все самки приняли чисто-белые яйца амадины, которые значимо не отличались от яиц зарнички по диаметру (парный тест Вилкоксона, n = 14, Z = 0.19, p = 0.85), но были немного длиннее (Z = 3.30, p < 0.001). Это дает основание полагать, что в распознавании инородного яйца изучаемый вид не использует визуальные сигналы, такие как отсутствие пятнистой окраски скорлупы, и терпимо относится к избыточной длине яйца.
Реакция на чисто-белые яйца крупного размера
Модельные яйца волнистого попугайчика превосходили яйца зарнички как по диаметру, так и по длине (парный тест Вилкоксона, n = 30, Z > 5.29, p < 0.001 для каждого параметра), и были больше яиц кукушки расы inornatus по диаметру. В результате 11 яиц были приняты, 2 – удалены и 17 – отвергнуты путем отказа от насиживания кладки. Собственные яйца зарничек, принявших модельное яйцо, были крупнее по диаметру, чем яйца самок, отвергших подложенное яйцо (табл. 2), вследствие чего соотношение диаметров инородного и хозяйских яиц между группами также различалось. Еще более крупные чисто-белые яйца розовощекого неразлучника и кореллы были отвергнуты путем оставления гнезда. Эти яйца были использованы однократно и больше не применялись из-за очевидности последствий. Результаты этой серии экспериментов демонстрируют, что главный стимул к дискриминационному поведению зарнички – относительный размер инородного яйца, определенный соотношением диаметров яиц в гнезде.
Таблица 2.
Сравнение оометрических показателей в кладках зарничек, принявших (A) и отвергших (R) инородное яйцо
| Показатель | Melopsittacus undulatus | Parus major | Cuculus optatus gens inornatus | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| медиана | M-U test | медиана | M-U test | медиана | M-U test | |||||||
| A n1 = 11 |
Rn2 = 19 | Z | p | A n1 = 8 |
Rn2 = 2 | Z | p | A n1 = 13 |
Rn2 = 2 | Z | p | |
| Bf, мм | 14.77 | 14.81 | –0.28 | 0.78 | 13.69 | 13.57 | 0.78 | 0.43 | 12.94 | 13.00 | –0.25 | 0.80 |
| Lf, мм | 18.92 | 18.90 | 0.60 | 0.55 | 17.70 | 17.89 | –0.78 | 0.43 | 18.72 | 18.65 | 0.34 | 0.73 |
| Bh, мм | 11.24 | 10.80 | 2.50 | 0.01 | 10.98 | 11.05 | –1.04 | 0.30 | 10.82 | 10.38 | 1.19 | 0.23 |
| Lh, мм | 14.01 | 13.90 | 0.26 | 0.80 | 13.99 | 14.05 | 0.00 | 1.00 | 13.74 | 13.35 | 1.36 | 0.17 |
| (Bf – Bh), мм | 3.68 | 4.05 | –2.17 | 0.03 | 2.74 | 2.53 | 1.31 | 0.19 | 2.20 | 2.63 | –0.76 | 0.44 |
| (Bf – Lh), мм | 0.75 | 1.03 | –0.45 | 0.65 | –0.22 | –0.47 | 0.52 | 0.60 | –0.70 | –0.35 | –0.93 | 0.35 |
| Bf/Bh | 1.33 | 1.37 | –2.35 | 0.02 | 1.25 | 1.23 | 1.04 | 0.30 | 1.21 | 1.25 | –0.85 | 0.40 |
| Bf/Lh | 1.05 | 1.07 | –0.45 | 0.65 | 0.98 | 0.97 | 0.52 | 0.60 | 0.95 | 0.97 | –0.85 | 0.40 |
Реакция на пятнистые яйца крупного размера
Пятнистые модельные яйца большой синицы существенно крупнее хозяйских по диаметру и длине (парный тест Вилкоксона, n = 10, Z > 2.80, p < 0.005 для каждого параметра). В сравнении с яйцами глухой кукушки расы inornatus они больше по диаметру (U-критерий Манна-Уитни, n1 = 10, n2 = 16, Z = 3.58, p < 0.001), но меньше по длине (Z = –3.53, p < 0.001). В результате 8 яиц были приняты и 2 – отвергнуты: одно путем выкатывания, другое – путем отказа от насиживания кладки. Малая выборка не позволила обнаружить различия между двумя группами по избранным оометрическим характеристикам (табл. 2). Однако эти эксперименты показали, что в популяции, не испытывающей гнездового паразитизма, особи обладают врожденной способностью к распознаванию инородного яйца. В одно из гнезд мы подложили яйцо сибирской теньковки диаметром на 1.75 мм больше, чем в кладке хозяев; оно также было принято зарничкой, несмотря на другой оттенок пятен. Полученные результаты внесли вклад в общий анализ размерных различий.
Реакция на яйца глухой кукушки
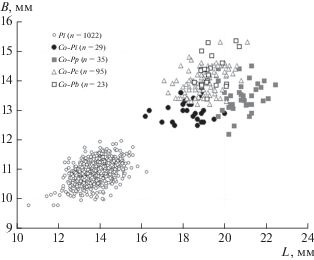
Расы глухой кукушки различаются по оометрическим характеристикам (Meshcheryagina et al., 2018), при этом раса inornatus имеет наименьший диаметр и длину яиц по сравнению с расами proregulus, collybita и borealis (рис. 5).
Рис. 5.
Соотношение длины (L) и диаметра (B) яиц зарнички (Pi), рас глухой кукушки: inornatus (Co-Pi), proregulus (Co-Pp), collybita (Co-Pc) и borealis (Co-Pb) (по материалам Meshcheryagina et al., 2018).
Яйца расы inornatus крупнее яиц хозяев как по диаметру, так и по длине (парный тест Вилкоксона, n = 15, Z = 3.41, p < 0.001 для каждого параметра). В 12 гнездах зарнички приняли 13 яиц и в 2 гнездах отвергли 3 яйца методом отказа от насиживания кладки. Отвержение в первом случае наблюдали в кладке с двумя яйцами кукушки. Диаметр меньшего яйца превосходил хозяйские на 16%, но его не включили в анализ, так как реакция могла быть вызвана более крупным яйцом. Во втором случае оставление гнезда могло быть спровоцировано агрессивным поведением кукушки, покровные перья которой обнаружены у гнезда. Подкладывая собственное яйцо в кладку, насиженную уже 8 суток, она изъяла 3 из 6 яиц хозяина. В целом яйца в кладках зарничек, принявших и отвергших яйцо гнездового паразита, различались слабо (табл. 2).
В случаях паразитирования других рас глухой кукушки на зарничке принятые яйца были на 20 и 27% крупнее хозяйских по диаметру, выброшенное яйцо – на 21% больше (раса proregulus), а в оставленных гнездах – на 20 и 34% больше (раса borealis). Используя доступные нам дополнительные сведения по гнездовому паразитизму различных рас в гнездах зарнички (Мещерягина и др., 2017), мы выявили, что яйца расы inornatus были отвергнуты в двух случаях из 28, расы proregulus – в одном случае из семи, а расы borealis – во всех трех известных случаях. Следовательно, зарнички проявляют дискриминационное поведение к яйцам различных рас глухой кукушки, но яйца расы inornatus отвергаются ими реже, чем других рас (односторонний точный критерий Фишера, n1 = 28, n2 = 10, p = 0.03).
Реакция на повторную имитацию паразитирования
При последовательной замене в одном гнезде инородного яйца на более крупное или при подкладке более мелкого яйца в другую кладку той же самки ответное поведение изменялось соответственно отличию его диаметра от диаметра других яиц в гнезде (табл. 3). Мы ранжировали силу ответной реакции самки на появление инородного яйца тремя баллами: 1 – принятие яйца, 2 – удаление яйца, 3 – отказ от насиживания кладки (оставление гнезда). При усилении отличия подложенного яйца от яиц кладки хозяина балл повторной реакции самки повышался (гамма-коэффициент ранговой корреляции r = 0.74, n = 8, p < 0.01). Интересен результат двукратной подкладки яиц большой синицы (№ 8 в табл. 3): повторное распознавание подложенного яйца сходного размера произошло быстрее, без попытки избирательного удаления.
Таблица 3.
Ответное поведение самок зарничек на искусственный двукратный гнездовой паразитизм
| Описание | Опыт | Яйцо | Вид | Bf/Bh × 100% (Bf – Bh, мм) |
Результат |
|---|---|---|---|---|---|
| Замена на более крупное в одном гнезде | 1 | 1 | Melopsittacus undulatus | 130 (3.39) | Яйцо принято |
| 2 | Nymphicus hollandicus | 156 (6.29) | Отказ от насиживания | ||
| 2 | 1 | Parus major | 122 (2.44) | Яйцо принято | |
| 2 | Melopsittacus undulatus | 127 (3.02) | Отказ от насиживания | ||
| 3 | 1 | Parus major | 124 (2.71) | Яйцо принято | |
| 2 | Melopsittacus undulatus | 134 (3.79) | Яйцо принято | ||
| 4 | 1 | Cuculus optatus gens proregulus | 121 (2.32) | Яйцо выброшено | |
| 2 | Melopsittacus undulatus | 131 (3.50) | Отказ от насиживания | ||
| 5 | 1 | Lonchura striata var. domestica | 91 (–1.08) | Яйцо принято | |
| 2 | Cuculus optatus gens borealis | 120 (2.27) | Отказ от насиживания | ||
| Подкладка более мелкого в другую кладку той же самки | 6 | 1 | Melopsittacus undulatus | 131 (3.48) | Яйцо принято |
| 2 | Parus major | 124 (2.66) | Яйцо принято | ||
| 7 | 1 | Melopsittacus undulatus | 141 (4.33) | Отказ от насиживания | |
| 2 | Parus major | 126 (2.85) | Яйцо принято | ||
| 8 | 1 | Parus major | 124 (2.64) | Яйцо выкачено + + отказ от насиживания |
|
| 2 | Parus major | 122 (2.42) | Отказ от насиживания |
Зависимость вероятности дискриминации от размера инородного яйца
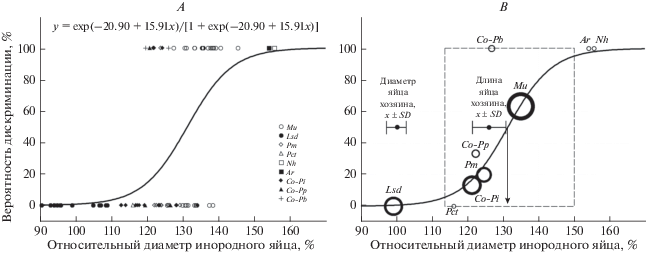
Логистическая регрессия, включающая все 77 случаев реакции на инородное яйцо, показала (рис. 6A), что, по мере роста различий по диаметру (Bf/Bh), вероятность дискриминации монотонно возрастает (Wald’s Chi-square, χ2 = 14.79, p < < 0.001). Положение групповых средних вероятностей по каждому эксперименту близко соответствовало линии регрессии (рис. 6B). В диапазоне аргумента от 113 до 150% вероятность дискриминации возрастала от 5 до 95%. Яйца, сходные с яйцом зарнички по диаметру (100%), в этот интервал не попадали. Яйца, диаметр которых сходен с длиной яйца хозяина (126%), имели хорошие шансы быть принятыми (70%). Только яйца, которые превосходили нормальную изменчивость этого параметра и создавали существенную неустранимую неровность поверхности кладки, дискриминировались с большей вероятностью. Значение Bf/Bh, при котором принятие и отвержение инородного яйца равновероятны, составило 131% (превышение диаметра на 31%).
Рис. 6.
Вероятность дискриминации чужого яйца в зависимости от его относительного диаметра (Bf/Bh × 100%). A – построение кривой логистической регрессии по 77 исходам подкладывания яиц. B – обобщенные результаты дискриминации яиц каждого вида (расы) в сравнении с размерами яиц зарнички и предсказанием модели; пунктирной границей выделена область, где вероятность дискриминации составляет от 5 до 95%. Стрелка указывает на значение, при котором принятие и отвержение инородного яйца равновероятны.
В качестве предикторов распознавания пригодны и другие размерные соотношения яиц паразита и хозяина (табл. 4), но их эффективность не одинакова. Наиболее точное предсказание давало сравнение диаметров, причем отношение – несколько лучше, чем логарифм отношения или разность диаметров. Соотношение объемов, диаметра подброшенного яйца и длины яйца хозяина или обеих длин также давали достоверные предсказания, но модель была существенно менее эффективной (ΔAIC > 2).
Таблица 4.
Оценка моделей дискриминационного поведения ln[p/(1 – p)] = a + bx при различных способах задания аргумента x
| Аргумент x | Критерий Вальда для b | AIC | |
|---|---|---|---|
| χ2 | p | ||
| Bf/Bh | 14.8 | 0.0001 | 72.9 |
| ln(Bf/Bh) | 14.2 | 0.0002 | 73.1 |
| Bf – Bh | 14.6 | 0.0001 | 73.3 |
| ln(Vf/Vh) | 12.9 | 0.0003 | 75.6 |
| (Vf/Vh)1/3 | 13.3 | 0.0003 | 75.7 |
| Vf/Vh | 14.1 | 0.0002 | 76.1 |
| ln(Lf/Bh) | 13.6 | 0.0002 | 78.8 |
| Lf – Bh | 14.0 | 0.0002 | 79.0 |
| Lf/Bh | 13.9 | 0.0002 | 79.4 |
| Lf – Lh | 8.2 | 0.0042 | 94.6 |
| ln(Lf/Lh) | 8.2 | 0.0041 | 94.7 |
| Lf/Lh | 8.1 | 0.0045 | 95.1 |
Зависимость способа отвержения от относительного размера инородного яйца
В отличие от других исследователей, мы обращали особое внимание на следы деятельности самки через 24 ч после подкладывания яйца. В брошенных кладках (n = 20) действия самки, вероятно, отчасти определялись размерами яйца. Чужое яйцо оставалось в исходном положении в 5 случаях, включая максимальные размеры (135–156% диаметра собственных яиц). В 14 случаях, включающих минимальные размеры яйца (122–146%), оно переместилось к боковой (n = 9) или задней стенке (n = 2) или было прокручено на месте (n = 2). При этом все яйца остались неповрежденными. Наконец, в 1 случае модельное яйцо промежуточного размера (139%) было смещено к центру лотка, собственные яйца забросаны подстилкой, причем два из них имели проколы, а снаружи от гнезда найдено новое отложенное яйцо. Таким образом, в большинстве случаев самки пытались удалить яйцо, но после неудачи оставляли кладку почти сразу. Задержку могла вызывать готовность самки снести очередное яйцо. Действительно, в 7 случаях из 20 самка откладывала еще одно яйцо (в 1 случае – рядом с гнездом) и затем оставляла гнездо.
Успешное избирательное удаление чужого яйца зарегистрировано в 4 случаях. Яйцо большой синицы (124%) сначала было перемещено к боковой стенке, затем без повреждений выкачено из гнезда на расстояние 1 м от летка; при этом отложено еще одно яйцо, а другое исчезло. Яйцо глухой кукушки расы proregulus (121%) было проклевано и выброшено в 12 м от гнезда вниз по склону в направлении вылета, при этом яйца хозяина были без повреждений. В двух других случаях яйца волнистого попугайчика (131–133%) не были обнаружены, несмотря на тщательные поиски в радиусе 3–4 м вокруг гнезда.
В полной выборке гнезд с инородным яйцом (n = 77) соотношение размеров инородного и хозяйских яиц Bf/Bh закономерно увеличивалось в группах, принявших яйцо, удаливших его и оставивших гнездо (гамма-корреляция 0.70, p < 0.001; рис. 7). Это позволяет считать удаление яйца, неудачные попытки его удалить и отказ от насиживания паразитированной кладки последовательными стадиями единого процесса отвержения.
Вклад индивидуальных особенностей в результаты экспериментов
Большинство исследователей (Antonov et al., 2009; Guigueno et al., 2014; Roncalli et al., 2017) рассматривали вероятность исхода дискриминационного поведения как функцию видовой принадлежности хозяина и паразита (или типа имитационных яиц) в серии экспериментов, не придавая значения особенностям индивидуальных экспериментов. Насколько велик индивидуальный вклад в распознавание инородных яиц?
Чтобы оценить вклад индивидуальных особенностей яиц хозяина и паразита, мы разложили аргумент модели x = ln(Bf/Bh) = ln(Bfm/Bhm) + + ln(Bfi) – ln(Bhj), где Bfm и Bhm– средние диаметры яиц вида (или расы), а Bfi = Bf/Bfm и Bhj = Bh/Bhm– индивидуальные относительные размеры яиц паразита i и хозяина j. Среди моделей, содержащих эти аддитивные предикторы, ведущее место заняла модель {ln(Bfm/Bhm) – ln(Bhj)} с соотношением средних диаметров и индивидуальным отклонением хозяина. Насыщенная модель {ln(Bfm/Bhm) + + ln(Bfi) – ln(Bhj)} и общая модель {ln(Bfm/Bhm)} – обе уступали по полноте объяснения дискриминации (ΔAIC = +1.9 и ΔAIC = +2.3 соответственно). Таким образом, для всей совокупности данных с измерениями (n = 77) справедливо утверждение, что распознавание чужих яиц зарничками тем более вероятно, чем мельче яйца их собственной кладки.
Можно предположить, что удлиненное яйцо, развернутое вертикально, создает дополнительную неровность поверхности кладки и увеличивает толерантность самки к более крупным инородным яйцам. Однако соотношение длины и диаметра яиц Lh/Bh в кладках хозяев, принявших яйцо, удаливших его и оставивших гнездо, не различалось (гамма-корреляция 0.01, p > 0.90). Следовательно, неровность поверхности собственной кладки у всех самок была сходной и не влияла на вероятность распознавания подложенных яиц.
Влияние других факторов на дискриминационное поведение
Место проведения исследований (Бурятия, Красноярский и Пермский край) не оказывало влияния на параметры яиц зарнички (критерий Краскела-Уоллиса, n = 179, H = 0.45, p = 0.80 для L; H = 0.29, p = 0.86 для B). Кладки с инородными яйцами на этих территориях также не различались (n = 75, H = 1.76, p = 0.41 для L; H = 0.22, p = = 0.89 для B). Не найдено региональных различий и по соотношению диаметров яиц ни в группе принявших чужое яйцо, ни в группе отвергших его (критерий Краскела-Уоллиса, H = 0.00, p = = 1.00 и H = 0.54, p = 0.76 соответственно). При объединении результатов всех экспериментов и гнездового паразитизма изменчивость размеров яиц в кладке хозяев в группах, выделенных по реакции, не различалась (U-критерий Манна-Уитни, n1 = 49, n2 = 28, Z = -0.41, p = 0.68 для CVL; Z = –0.62, p = 0.53 для CVB). Следовательно, ответная реакция не зависела от распространенности паразитизма в местах проведения исследований.
Кладки зарнички, найденные в разные годы на территории Бурятии, не различались по средним значениям длины и диаметра яиц (критерий Краскела-Уоллиса, df = 3, n = 97, H = 4.15, p = 0.25 для L; H = 2.95, p = 0.40 для B). Гнезда, подвергшиеся искусственному или естественному паразитизму на этой территории, также не различались по годам (U-критерий Манна-Уитни, n1 = 12, n2 = 14, Z = 1.29, p = 0.20 для L; Z = 1.08, p = 0.28 для B). Частота отвержения крупных чисто-белых яиц также не зависела от года проведения эксперимента (односторонний точный критерий Фишера, n1 = 5, n2 = 12, p = 0.31).
Ответное поведение самок значимо не изменялось в зависимости от даты откладки 1-го яйца, стадии инкубации и количества яиц хозяина в момент подкладки инородного яйца (табл. 5).
Таблица 5.
Влияние даты откладки 1-го яйца, стадии инкубации в период подкладки и числа яиц хозяина, находившихся в гнезде с инородным яйцом, на ответное поведение самок (“принято” или “отвергнуто”)
| Вид | Число случаев (n) | Факторы | ||||||
|---|---|---|---|---|---|---|---|---|
| принято | отвергнуто | дата | инкубация | число яиц | ||||
| Z | p | Z | p | Z | p | |||
| Melopsittacus undulatus | 11 | 19 | 0.04 | 0.97 | 0.58 | 0.56 | –0.39 | 0.70 |
| Parus major | 8 | 2 | –0.91 | 0.36 | 1.57 | 0.12 | 1.83 | 0.07 |
| Cuculus optatus gens inornatus | 13 | 2 | –0.59 | 0.55 | –0.59 | 0.55 | 0.93 | 0.35 |
| Все инородные яйца | 49 | 28 | –0.18 | 0.86 | –0.44 | 0.66 | –0.49 | 0.62 |
В течение экспериментов хозяева избирательно удалили инородные яйца в 4 гнездах из 76. В контрольных гнездах на тех же этапах гнездования отдельные яйца зарничек исчезли в 5 гнездах из 105, что незначительно меньше (χ2 = 0.02, p = = 0.88). В тех же выборках были брошены 24 паразитированные кладки и только 4 контрольные, т.е. причиной гибели большинства кладок было дискриминационное поведение в эксперименте (χ2 = 26.0, p < 0.001). Следовательно, посещение гнезд наблюдателем не влияло на поведение птиц по отношению к инородным яйцам.
ОБСУЖДЕНИЕ
Значение визуального сигнала при распознавании инородного яйца
Распознавание инородных яиц у большинства видов-хозяев обыкновенной кукушки (Cuculus canorus (Linnaeus 1758)) основано на особенностях окраски скорлупы (Davies, Brooke, 1989; Moksnes et al., 1991; 1991a). У зарнички – расообразующего вида-хозяина глухой кукушки в понимании Мещерягиной с соавторами (2017), – самки не использовали визуальные сигналы в распознавании непохожего по окраске яйца и всегда принимали чисто-белые яйца сходного размера. У близкородственного вида – тусклой зарнички (в цитируемой статье Ph. inornatus) – было показано, что размер служит более сильным сигналом для дискриминации яйца, чем цвет фона или пятнистость рисунка (Marchetti, 1992). Возможно, красно-коричневые пятна, пигментированные протопорфирином, выполняют иную функцию – улучшают прочность скорлупы. Такое значение пятнистости яиц доказано для большой синицы (Gosler et al., 2011), гнездящейся при ограниченном освещении в дуплах. В гнезда зарничек также проникает мало света, и дополнительная защита от повреждения яиц кажется вполне логичным объяснением наличия пятен.
Значение осязательного сигнала при распознавании инородного яйца
Окраска менее заметна в темных средах, поэтому некоторые дуплогнездники или птицы со сферическими гнездами для распознавания используют осязательные сигналы (Mason, Rothstein, 1986), такие как размер яйца. Большинство исследователей в качестве показателя размера использовали объем яйца (Moksnes et al., 1991a; Marchetti, 1992; 2000; Alvarez, 2000; Stokke et al., 2010). Однако один и тот же объем может быть достигнут разным соотношением длины и диаметра яиц, как показано для трех рас глухой кукушки: borealis, collybita и proregulus (Meshcheryagina et al., 2018). К тому же объем яйца, так же как длина и диаметр, не может быть определен птицей посредством тактильных ощущений наседного пятна из-за одновременного нахождения в гнезде нескольких яиц.
Кладка, расположенная в чашеобразном лотке, формирует ровную вогнутую наседную поверхность, прилегающую к выпуклому брюху наседки. У всех насиживающих птиц развит поведенческий комплекс перемещения и переворачивания яиц клювом для лучшей инкубации и нормального развития эмбриона (Болотников и др., 1985). При переворачивании яиц или при резком вылете птицы из гнезда отдельные яйца могут принимать неправильное вертикальное положение, нарушая ровную поверхность кладки. Насиживающая птица, ощущая неудобство, должна дополнительно укладывать выступающие яйца. Доказательством этого предположения могут служить результаты видеорегистраций поведения светлобрюхой пеночки (Phylloscopus bonelli (Vieillot 1819)) в ответ на модельные яйца разного размера (Roncalli et al., 2017). По ним видно, что прикосновения самок, направленные на крупные яйца, были более многочисленными, чем направленные на яйца среднего или малого размера. Желтые древесницы (Setophaga petechia (Linnaeus 1766)) в большей степени перетасовывали и исследовали яйца, когда их кладки содержали модель размером с яйцо буроголового коровьего трупиала (Molothrus ater (Boddaert 1783)), чем в кладках без инородных яиц (Guigueno, Sealy, 2012). Эксперименты с моделями яиц обыкновенной кукушки в кладках бледной бормотушки (Iduna pallida (Hemprich et Ehrenberg 1833)) выявили, что манипуляции с крупным яйцом приводили к сокращению времени инкубации на 11% (Antonov et al., 2009). Вероятно, при вертикальном повороте собственного яйца птица ощущает разность между линейными размерами – длиной выступающего яйца и диаметром соседних яиц в кладке. По нашему мнению, именно врожденный рефлекс выравнивания поверхности кладки лежит в основе распознавания инородных яиц у закрытогнездящихся птиц, к которым можно отнести всех представителей рода Phylloscopus. Благодаря этому дискриминационные способности развиты даже у светлобрюхой пеночки – случайного хозяина обыкновенной кукушки, не имеющего эволюционной истории с гнездовым паразитом (Martín-Vivaldi et al., 2002, 2013; Roncalli et al., 2017).
С одной стороны, разница в размерах яиц, распознаваемая насиживающей птицей, должна иметь нижнюю вероятностную границу чувствительности. В противном случае естественная изменчивость диаметра яиц в пределах кладки будет способствовать дискриминации собственных яиц, тем самым снижая репродуктивный успех. С другой стороны, должна быть верхняя граница толерантности (“предел терпения”) допустимых для вида значений разности размеров яиц, после которой самка принимает однозначное (p = 0.95) решение избавиться от инородного яйца. Наши результаты показывают, что у зарнички нижняя вероятностная граница чувствительности (p = 0.05) соответствует минимальным различиям между длиной и диаметром ее собственных яиц на 12% (см. рис. 6B).
Размерный показатель, определяющий вероятность дискриминации
Вероятность дискриминации возрастает при увеличении относительного диаметра инородного яйца. В отличие от других авторов, мы использовали не средние размеры яиц каждого типа, а индивидуальные для каждого описанного случая. Мы установили, что диаметр яиц хозяйской кладки является существенным фактором дискриминации: чем он меньше, тем успешнее распознавание. Следовательно, решение самки основано на относительном превышении чужого яйца над поверхностью своей кладки, а не на видовых признаках.
Другие размерные показатели меньше влияли на результаты, несмотря на очень высокую морфологическую корреляцию с диаметром. Следовательно, ни длина яйца, ни его масса не являются решающими факторами для распознавания, хотя могут влиять на способ устранения инородного яйца. Порог между решениями “принять” и “отвергнуть” у зарнички в среднем проходит на уровне различия диаметров на 31%, что соответствует максимальному значению неровности, вызванной вертикальным разворотом одного яйца собственной кладки (в среднем 26 ± 5%). Мы не склонны преувеличивать значение того, что самка может спутать собственное вертикально стоящее яйцо с чужим, поскольку она легко может уложить его горизонтально, и оно перестанет мешать, в отличие от яйца кукушки. По-видимому, естественный отбор устанавливает этот порог на компромиссном уровне в отношении других параметров приспособленности, определяющих возможность оставить плодовитое потомство в течение жизни.
Характеристики яиц, определяющие способы отвержения хозяином
Принятое инородное яйцо, как правило, рассматривается исследователями как нераспознанное. Если инородное яйцо распознано, то включается другой поведенческий акт – отвержение. Считалось, что разные виды птиц предпочитают тот или иной способ отвержения в зависимости от размера клюва и индекса захвата – показателей способности удерживать яйцо (Davies, Brooke, 1989; Moksnes et al., 1991; 1991a; Martín-Vivaldi et al., 2002): птицам с маленьким клювом труднее выбросить крупное яйцо, поэтому они чаще оставляют кладку. Позднее экспериментально было показано, что один и тот же вид может использовать разные способы отвержения в зависимости от размера инородного яйца (Guigueno et al., 2014; Roncalli et al., 2017) или связанных с ним характеристик – прочности скорлупы (Stokke et al., 2010) и массы яйца (Ruiz-Raya et al., 2015) по отношению к размеру тела хозяина. Наши результаты также подтверждают эту гипотезу. Самки не могут захватить яйцо крупнее своего из-за малой длины клюва (10.1–11.7 мм по: Cramp, Brooks, 1992). Поэтому они либо выкатывали яйцо за бортик гнезда, либо проклевывали отверстие и, захватывая за край скорлупы, выбрасывали его. Более крупные яйца птицы не могли ни проклевать из-за толстой скорлупы, ни выкатить из-за большой массы, хотя, судя по следам, такие попытки были. В результате самки прекращали насиживание всей кладки, оставляя гнездо с подложенным яйцом. Эксперименты с моделями яиц обыкновенной кукушки в кладках более крупных видов пеночек – веснички (Phylloscopus trochilus (Linnaeus 1758)), теньковки (Phylloscopus collybita (Vieillot 1817)) и светлобрюхой пеночки – также показали высокий уровень оставления гнезд, объясненный неспособностью выбросить столь крупное яйцо (Moksnes et al., 1991; Martín-Vivaldi et al., 2013).
По другой гипотезе, на способ отвержения яйца различными видами влияет главенствующий стимул при распознавании: те, кто выбрасывает, реагируют на окраску, а для тех, кто захоранивает чужое яйцо в подстилке или оставляет гнездо, важнее тактильные сигналы (Guigueno et al., 2014). Для выбрасывания необходимо визуально определить яйцо для удаления, а для иных способов достаточно осязания. Однако наши результаты и эксперименты с другими видами пеночек (Marchetti, 1992; 2000; Roncalli et al., 2017) не поддерживают это предположение: они и выбрасывали, и оставляли кладки, распознавая крупное яйцо тактильно. Не поддерживает гипотезу и показательный случай, выявленный у рыжего печника (Furnarius rufus (Gmelin 1788)) – хозяина блестящего коровьего трупиала (Molothrus bonariensis (Gmelin 1789)). В затемненном шарообразном гнезде насиживающая птица тактильно определяла и выбрасывала отклоняющееся по размеру яйцо – меньшее по диаметру, чем ее собственные яйца (Mason, Rothstein, 1986).
Методы, искажающие результат эксперимента и его интерпретацию
Считается, что даже слабое клевание яиц является надежным показателем распознавания (Marchetti, 1992; 2000; Antonov et al., 2009; Roncalli et al., 2017). Некоторые исследователи (Marchetti, 1992; 2000; Martín-Vivaldi et al., 2013) принимали повреждение скорлупы хозяйских яиц (вмятины и пробоины) за признак клевания чужого яйца. Следуя этому предположению, в наших исследованиях можно было бы заключить, что зарнички не предпринимали попыток клевания подложенного яйца перед оставлением гнезд, так как в 96% случаев отсутствовали повреждения яиц хозяев. Однако такая интерпретация кажется сомнительной, поскольку в единственном случае, когда яйцо глухой кукушки было выброшено за проклеванное отверстие, следов повреждения других яиц не было. Вместе с тем, в кладке с двумя принятыми яйцами гнездового паразита к концу срока насиживания появились вмятины на трех яйцах хозяина: очевидно, их скорлупа истончилась и не выдержала нагрузки при переворачивании крупных яиц. При попытках выкатывания крупного яйца за бортик гнезда в одном случае исчезло яйцо зарнички, а в другом – два яйца имели пробоины в скорлупе. В экспериментах с моделью яйца малой кукушки (Cuculus poliocephalus (Latham 1790)), превышающей яйца тусклой зарнички в 2.5 раза по объему, было показано, что при манипуляциях самки разбили несколько собственных яиц в 4 случаях из 8 (Marchetti, 1992). Следовательно, травматизм яиц хозяина может быть обусловлен не клеванием, а перемещением крупного яйца по лотку.
В предшествующих экспериментальных исследованиях было подвергнуто критике использование искусственных яиц из твердого материала (Martín-Vivaldi et al., 2002; Antonov et al., 2009) или из мягкого пластилина (Roncalli et al., 2017). При излишней твердости моделей недооценивается возможность удаления проклеванных яиц и тем самым завышается уровень принятия. Мягкий материал облегчает клевание, схватывание и выбрасывание, снижая долю оставленных гнезд. Видимо, по этой причине очень крупные пластилиновые модели, подложенные сестринскому виду – тусклой зарничке, – были успешно выброшены из гнезда (Marchetti, 1992; 2000). Мы использовали для экспериментов только натуральные яйца и доказали для зарнички как возможность проклевывания не слишком толстой скорлупы, так и неспособность удалить яйца, более мелкие, чем описанные пластилиновые модели, что заканчивалось отказом от насиживания кладки.
Интересно отметить обнаруженный другими исследователями факт высокой вероятности принятия крупных твердых моделей, превышающих по объему хозяйские яйца в 1.6–3.7 раз. Такое поведение у тугайного соловья (Cercotrichas galactotes (Temminck 1820)) – хозяина обыкновенной кукушки в Испании, связывают с эффектом привлекательности (Alvarez, 2000). В противоположность этому мнению, принятие у бледной бормотушки – маленького вида-хозяина обыкновенной кукушки в Болгарии – объясняют трудностями при выбрасывании после проклевывания яйца (Antonov et al., 2009). При этом наблюдали распознавание модели (87% проклевано), после которого не обязательно следовало избирательное удаление (43.5% не выброшены).
Влияние других факторов на дискриминацию инородного яйца
Для видов, распознающих инородное яйцо по визуальным сигналам, выдвигались различные причины внутривидовой изменчивости реакции: полиморфизм за счет дрейфа генов, влияние возраста или опыта (Moksnes et al., 1991; Lotem et al., 1992; Stokke et al., 2010). В то же время у видов, использующих тактильные стимулы и размерные признаки, все самки были способны к распознаванию яиц независимо от возраста или предшествующего опыта (Mason, Rothstein, 1986; Marchetti, 1992; 2000). Наши эксперименты с повторным подкладыванием яиц той же самке также показали, что исход не связан с индивидуальным опытом, а полностью зависит от размера яйца. Если допустить, что дата начала кладки косвенно отражает возраст самки (Lotem et al., 1992), то наши данные не подтверждают влияние возраста на дискриминационное поведение зарнички. Аналогичный результат известен для светлобрюхой пеночки (Roncalli et al., 2017). У видов, распознающих инородное яйцо по окраске, выявлены различия в уровне реакции между популяциями, подверженными и не подверженными паразитизму (например, Davies, Brooke, 1989; Stokke et al., 2010). В исследованных нами популяциях зарнички способность к дискриминации проявлялась независимо от реальной угрозы паразитизма.
Известно, что относительный размер яйца может определять не только способ отвержения, но также скорость принятия решения (Stokke et al., 2010), затраченное время и расстояние, на которое выброшено яйцо (Roncalli et al., 2017). У видов, распознающих яйца по окраске, реакция дискриминации задерживалась до начала непрерывного насиживания; например, хозяева обыкновенной кукушки иногда откладывали решение на 5–6 суток (Davies, Brooke, 1989; Lotem et al., 1992). У видов, использующих для распознавания тактильные стимулы, решение об отвержении может приходить и раньше. Зарнички принимали решение о дискриминации яйца в течение первых суток после подкладки. Судя по следам, они оставляли гнездо сразу после нескольких попыток переворачивания крупного яйца. Для других видов пеночек было также показано, что для отвержения яйца им требуется не более 24 ч (Marchetti, 1992; 2000; Roncalli et al., 2017). В наших экспериментах с ненасиженными кладками после начала опыта самки нередко откладывали еще одно яйцо, а затем оставляли гнездо. При этом ни стадия инкубации, ни количество яиц в кладке не влияли на ответное поведение зарничек. Подобные выводы были сделаны и для других видов (Moksnes et al., 1991; Stokke et al., 2010; Roncalli et al., 2017).
Влияние дискриминации на морфометрию яиц гнездового паразита
Избирательная дискриминация зарничками яиц с большим диаметром отразилась на ооморфологии рас глухой кукушки. Яйца зарнички мельче, чем у других эксплуатируемых хозяев (Meshcheryagina et al., 2018), но этот вид весьма многочислен на значительной части ареала глухой кукушки, что делает его привлекательным для паразитизма. Эволюция этого гнездового паразита привела к обособлению расы с минимальным диаметром яиц, специализированной на использовании зарнички в качестве хозяина. Эффективность этой адаптации подтверждается тем, что зарнички отвергают яйца “своей” расы менее уверенно, чем других рас глухой кукушки.
Список литературы
Ананин А.А., 2006. Птицы Баргузинского заповедника. Улан-Удэ: Изд-во Бурят. гос. ун-та. 276 с.
Болотников А.М., Шураков А.И., Каменский Ю.Н., Добринский Л.Н., 1985. Экология раннего онтогенеза птиц. Свердловск: УНЦ АН СССР. 228 с.
Мещерягина С.Г., Бачурин Г.Н., Ананин А.А., 2015. Пространственно-временная структура гнездовых поселений пеночки-зарнички на западном макросклоне Баргузинского хребта // Вестник Бурятского государственного университета. № 4. С. 157–168.
Мещерягина С.Г., Вурдова И.Ф., Поляков В.Е., Головатин М.Г., 2015а. К гнездованию пеночки-зарнички в северных районах Свердловской области и Пермского края // Фауна Урала и Сибири. № 2. С. 125–135.
Мещерягина С.Г., Бачурин Г.Н., Бурский О.В., 2017. Распространение рас глухой кукушки на территории России: обзор регистраций гнездового паразитизма по видам-хозяевам // Фауна Урала и Сибири. Вып. 2. С. 139–163.
Мещерягина С.Г., Бачурин Г.Н., Вурдова И.Ф., Ананин А.А., 2017а. Итоги 5-летних исследований Cuculus optatus на территории Баргузинского заповедника // Природные резерваты — гарант будущего: материалы Всероссийской научно-практической конференции с международным участием, посвященной 100-летию заповедной системы России и Баргузинского государственного природного биосферного заповедника, Году ООПТ и Году экологии. Улан-Удэ. С. 155–160.
Муравьев И.В., Сухова О.В., Юдин К.И., 2008. Принцип “золотого сечения” при расчете геометрических показателей в оологических исследованиях // Известия Пензенского государственного педагогического университета им. В.Г. Белинского. Т. 6. № 10. С. 194–199.
Нумеров А.Д., 2003. Межвидовой и внутривидовой гнездовой паразитизм у птиц. Воронеж: ФГУП ИПФ Воронеж. 517 с.
Пукинский Ю.Б., 1978. О редких и малоизученных птицах бассейна Бикин // Природа. № 1. С. 56–76.
Alvarez F., 2000. Response to Common Cuckoo Cuculus canorus model egg size by a parasitized population of Rufous Bush Chat Cercotrichas galactotes // Ibis. V. 142. № 4. P. 683–686. https://doi.org/10.1111/j.1474-919X.2000.tb04470.x
Antonov A., Stokke B.G., Moksnes A., Røskaft E., 2009. Evidence for egg discrimination preceding failed rejection attempts in a small cuckoo host // Biology Letters. V. 5. № 2. P. 169–171. https://doi.org/10.1098/rsbl.2008.0645
Burnham K., Anderson D., 2002. Model Selection and Multi-Model Inference (2nd Edition). Spring-Verlag. 496 p.
Cramp S., Brooks D.J. (eds.), 1992. Handbook or the Birds of Europe, the Middle East and North Africa: the Birds of the Western Palearctic. V. 6: Warblers. Oxford – New York. 760 p.
Davies N.B., 2011. Cuckoo adaptations: trickery and tuning // Journal of Zoology. V. 284. № 1. P. 1–14. https://doi.org/10.1111/j.1469-7998.2011.00810.x
Davies N.B., Brooke M. de L., 1989. An experimental study of co-evolution between the cuckoo, Cuculus canorus, and its hosts. I. Host egg recognition // Journal of Animal Ecology. V. 58. № 1. P. 207–224. https://doi.org/10.2307/4995
Gosler A.G., Connor O.R., Bonser R.H., 2011. Protoporphyrin and eggshell strength: preliminary findings from a passerine bird // Avian Biology Research. V. 4. № 4. P. 214–223. https://doi.org/10.3184/175815511X13207833399666
Guigueno M.F., Sealy S.G., 2012. Increased investigation of manipulated clutches suggests egg recognition without rejection in a Brown-headed Cowbird (Molothrus ater) host, the Yellow Warbler (Setophaga petechia) // The Auk. V. 129. № 1. P. 17–25. https://doi.org/10.1525/auk.2011.11138
Guigueno M.F., Sealy S.G., Westphal A.M., 2014. Rejection of parasitic eggs in passerine hosts: Size matters more for a non-ejecter // The Auk. V. 131. № 4. P. 583–594. https://doi.org/10.1642/AUK-14-36.1
Honza M., Cherry M.I., 2017. Egg characteristics affecting egg rejection // Avian brood parasitism: behaviour, ecology, evolution and coevolution. Springer, Cham. P. 401–419. https://doi.org/10.1007/978-3-319-73138-4_22
Lotem A., Nakamura H., Zahavi A., 1992. Rejection of cuckoo eggs in relation to host age: a possible evolutionary equilibrium // Behavioral Ecology. V. 3. № 2. P. 128–132. https://doi.org/10.1093/beheco/3.2.128
Marchetti K., 1992. Costs to host defence and the persistence of parasitic cuckoos // Proceedings of the Royal Society B – Biological Sciences. V. 248. № 1321. P. 41–45. https://doi.org/10.1098/rspb.1992.0040
Marchetti K., 2000. Egg rejection in a passerine bird: size does matter // Animal Behaviour. V. 59. № 4. P. 877–883. https://doi.org/10.1006/anbe.1999.1388
Martín-Vivaldi M., Soler M., Møller A.P., 2002. Unrealistically high costs of rejecting artificial model eggs in cuckoo Cuculus canorus hosts // Journal of Avian Biology. V. 33. № 3. P. 295–301. https://doi.org/10.1034/j.1600-048X.2002.330311.x
Martín-Vivaldi M., Soler J.J., Møller A.P., Pérez-Contreras T., Soler M., 2013. The importance of nest-site and habitat in egg recognition ability of potential hosts of the Common Cuckoo Cuculus canorus // Ibis. V. 155. № 1. P. 140–155. https://doi.org/10.1111/ibi.12000
Mason P., Rothstein S.I., 1986. Coevolution and avian brood parasitism: Cowbird eggs show evolutionary response to host discrimination // Evolution. V. 40. № 6. P. 1207–1214. https://doi.org/10.2307/2408948
Meshcheryagina S.G., Golovatin M.G., Bachurin G.N., 2016. Experimental study of discrimination behavior in the yellow-browed warbler (Phylloscopus inornatus) brood-parasitized by the Oriental cuckoo (Cuculus (saturatus) optatus) // Russian Journal of Ecology. V. 47. № 1. P. 104–106. https://doi.org/10.1134/s1067413616010082
Meshcheryagina S.G., Mashanova A., Bachurin G.N., Mitiay I.S., Golovatin M.G., 2018. Host species determines egg size in Oriental cuckoo // Journal of Zoology. V. 306. № 3. P. 147–155. https://doi.org/10.1111/jzo.12583
Moksnes A., Røskaft E., Braa A.T., 1991. Rejection behaviour by common cuckoo hosts towards artificial brood parasite eggs // The Auk. V. 108. № 2. P. 348–354. https://doi.org/10.1093/auk/108.2.348
Moksnes A., Røskaft E., Braa A.T., Korsnes L., Lampe H.M. Pedersen H.C., 1991a. Behavioural responses of potential hosts towards artificial cuckoo eggs and dummies // Behaviour. V. 116. № 1. P. 64–89. https://doi.org/10.1163/156853990X00365
Payne R.B., 2005. The Cuckoos. Oxford University Press. 644 p.
Roncalli G., Ibáñez-Álamo J.D., Soler M., 2017. Size and material of model parasitic eggs affect the rejection response of Western Bonelli’s Warbler Phylloscopus bonelli // Ibis. V. 159. № 1. P. 113–123. https://doi.org/10.1111/ibi.12431
Ruiz-Raya F., Soler M., Sánchez-Pérez L.L., Ibáñez-Álamo J.D., 2015. Could a factor that does not affect egg recognition influence the decision of rejection? // PLoS ONE. V. 10. № 8. e0135624. https://doi.org/10.1371/journal.pone.0135624
StatSoft, Inc., 1974-2007. STATISTICA (data analysis software system), version 8. www.statsoft.com.
Stokke B.G., Fossøy F., Røskaft E., Moksnes A., 2017. Adaptations of brood parasitic eggs // Avian brood parasitism: behaviour, ecology, evolution and coevolution. Springer, Cham. P. 363–384. https://doi.org/10.1007/978-3-319-73138-4_20
Stokke B.G., Polačiková L., Dyrcz A., Hafstad I., Moksnes A., Røskaft E., 2010. Responses of Reed Warblers Acrocephalus scirpaceus to non-mimetic eggs of different sizes in a nest parasitism experiment // Acta Ornithologica. V. 45. № 1. P. 98–104. https://doi.org/10.3161/000164510X516137
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал