Зоологический журнал, 2019, T. 98, № 12, стр. 1408-1419
Успешность размножения открытогнездящихся воробьиных птиц: межвидовые различия, временнáя изменчивость и влияние погодных условий
Д. А. Шитиков *
Московский педагогический государственный университет
129278 Москва, Россия
* E-mail: dash.mpgu@gmail.com
Поступила в редакцию 21.10.2018
После доработки 10.02.2019
Принята к публикации 26.02.2019
Аннотация
Представлены современные методы оценки успешности размножения птиц, реализованные в свободно распространяемом программном обеспечении MARK. На примере данных многолетнего контроля успешности размножения двух видов воробьиных птиц демонстрируются возможности метода в оценке внутри- и межгодовой изменчивости суточной сохраняемости гнезд, а также зависимости последней от погодных условий. В анализ включены данные по контролю 523 гнезд северной бормотушки (Iduna caligata) и 553 гнезд лугового чекана (Saxicola rubetra) на заброшенных сельскохозяйственных землях в Вологодской области в 2005–2018 годах. Суточная сохраняемость гнезд не различалась у двух видов и была подвержена существенной межгодовой вариации. Внутрисезонная вариация успешности размножения была выражена слабее межгодовой, суточная сохраняемость гнезд нелинейно зависела от возраста гнезда, причем эта связь имела разную направленность в различные годы. В отдельные годы значимое влияние на суточную сохраняемость гнезд оказывала температура воздуха.
Успех размножения – один из важнейших популяционных параметров открытогнездящихся птиц, влияющий на их численность как прямо, через изменение продуктивности размножения, так и косвенно, через изменение выживаемости взрослых особей (Паевский, 1985, 2008; Шитиков и др., 2017; Martin, 1995; Schaub, von Hirschheydt, 2009; Schaub et al., 2011; Ibáñez-Álamo et al., 2015). Во многих исследованиях показано, что наблюдаемое в последние десятилетия снижение численности целого ряда видов птиц может быть связано с уменьшением успешности размножения, в результате влияния естественных, так и антропогенных факторов (Evans, 2004; Grüebler et al., 2012; Skagen, Yackel Adams, 2012; Kubelka et al., 2018). В связи с этим весьма актуальным является получение надежных оценок успешности размножения и выявление факторов среды, оказывающих влияние на этот показатель (Паевский, 2008; Dinsmore et al., 2002; Jonson, 2007). Традиционно для оценки успешности размножения был использован метод, основанный на вычислении отношения числа успешных гнезд к общему числу найденных (Паевский, 1985; Jonson, 2007). Однако еще в 1960-е годы американский орнитолог Мэйфилд указал на ошибочность такого подхода: часть гнезд в локальной популяции неминуемо разоряется хищниками еще до того, как их нашли исследователи, что приводит к серьезному завышению оценок успешности размножения (Mayfield, 1961). В противовес традиционному способу, Мэйфилд (Mayfield, 1961; 1975) предложил метод оценки успешности размножения, основанный на расчете суточной сохраняемости гнезд, то есть величины, обратной скорости их разорения. К концу 20 века метод Мэйфилда и его модификации стали абсолютным стандартом в мировой экологии птиц (Jonson, 2007; Паевский 2008).
Паевский (1985) модифицировал метода Мэйфилда, предложив принимать за единицу расчета суточной сохраняемости не гнездо, а индивида (яйцо или птенца). Модифицированный метод имел важное преимущество – он позволял учитывать частичную гибель яиц или птенцов, в то время как согласно “классическому” методу Мэйфилда размножение считается успешным даже в том случае, если гнездо покинул всего лишь один птенец (Паевский, 1985). Благодаря авторитету разработчика, модифицированный метод Мэйфилда быстро завоевал популярность у отечественных орнитологов и нередко применяется в настоящее время (Антонов, 2010; Кочанов, Данилова, 2016; Венгеров, 2017, 2018). Вместе с тем, предложенный подход нарушает главное допущение всех методов, основанных на оценке суточной сохраняемости гнезд, – независимость отдельных событий разорения (Dinsmore et al., 2002), так как уничтожение хищником одного яйца или птенца в гнезде в значительном большинстве случаев приводит и к уничтожению остальных. Вследствие этого модифицированный метод Мэйфилда (Паевский, 1985) дает смещенные оценки и не должен применяться для определения успешности размножения птиц.
В начале 21 века были разработаны методы моделирования суточной сохраняемости гнезд (Dinsmore et al., 2002; Shaffer, 2004; Dinsmore, Dinsmore, 2007), быстро завоевавшие популярность и к настоящему времени практически полностью вытеснившие классический метод Мэйфилда из арсенала орнитологов. В отличие от метода Мэйфилда, в котором суточная сохраняемость гнезд принималась за константу в течение каждого периода цикла, новые методы позволяют оценивать динамику этого показателя в течение гнездового сезона. Общедоступное программное обеспечение позволяет моделировать суточную сохраняемость гнезд как функцию групповых и индивидуальных ковариат. Только за последние годы выполнено значительное число исследований, в которых суточная сохраняемость гнезд моделировалась как функция гнездовой плотности (Sofaer et al., 2014; Shitikov et al., 2018a), типа гнездового биотопа и особенностей расположения гнезда в биотопе (Kus et al., 2008; Stephens et al., 2003; DeGregorio et al., 2014) и микробиотопе (Weidinger, 2002; Remeš, 2005), погодных условий (Sofaer et al., 2014; Gullett et al., 2015) и возраста гнезда (Grant et al., 2005; Grant, Shaffer, 2012). Даже беглый анализ этих публикаций показывает, что невозможно выявить какую-либо общую для всех птиц закономерность. Показано, что суточная сохраняемость гнезд может как увеличиваться, так и уменьшаться в ходе сезона размножения, разнонаправленным (для разных видов) может быть и влияние погодных условий (Grant, Shaffer, 2012; Ibáñez-Álamo et al., 2015). Все это указывает на необходимость дальнейшего накопления эмпирических данных и детальной оценки всех вышеперечисленных показателей в каждом конкретном случае.
К сожалению, несмотря на значимые преимущества, упомянутые методы оценки успешности размножения крайне редко используется отечественными специалистами (но см. Демидова, 2012; Чернышов, 2013; Shitikov et al., 2012; 2015; 2018; 2018a). Причины этого не вполне понятны, так как принципиально новых подходов к сбору первичных данных эти методы не требуют, а необходимое программное обеспечение находится в свободном доступе в сети Интернет и снабжено детальным руководством для пользователей (Rotella, 2019). Целью настоящего сообщения является знакомство русскоязычных читателей с методом оценки успешности размножения птиц, реализованном в программном модуле “Nest survival” в свободно распространяемой программе MARK (Dinsmore et al., 2002). На примере данных многолетнего контроля успешности размножения двух видов воробьиных птиц демонстрируются возможности метода в оценке внутри- и межгодовой изменчивости сохраняемости гнезд, а также зависимости последней от погодных условий.
МАТЕРИАЛ И МЕТОДИКА
Сбор полевого материала
В основе предлагаемой работы лежит выборка из 523 гнезд северной бормотушки (Iduna caligata) и 553 гнезд лугового чекана (Saxicola rubetra), которые находились под контролем в 2005–2018 годах на обширном (450 га) участке заброшенных сельскохозяйственных угодий в южной части национального парка “Русский Север” (Вологодская область). Подробная характеристика района исследований приведена нами ранее (Шитиков и др., 2017). Было показано, что успешность размножения обоих видов на контрольной площадке была подвержена существенным межгодовым колебаниям (Shitikov et al., 2012, 2015), а в состав разорителей входило не менее 15 видов наземных позвоночных, среди которых ведущую роль играли серая ворона (Corvus cornix) и обыкновенная гадюка (Vipera berus) (Shitikov et al., 2012; Samsonov et al., 2018).
Ежегодно гнезда искали с середины мая по конец второй декады июля путем наблюдения за поведением взрослых птиц. С наибольшей интенсивностью вели поиск гнезд на стадии строительства, что позволяло впоследствии точно определить дату откладки первого яйца. Для гнезд, найденных на более поздних стадиях, дату откладки первого яйца рассчитывали на основе известного возраста птенцов, исходя из того, что период насиживания у обоих видов составлял 13 дней, а инкубация начиналась с предпоследнего отложенного яйца (Shitikov et al., 2012, 2015). Все найденные гнезда проверяли не реже 1 раза в 3 дня, во время каждой проверки оценивали состояние гнезда (активно/не активно) и проводили подсчет числа яиц или птенцов. В возрасте 5–7 дней птенцов кольцевали стандартными металлическими и пластиковыми цветными кольцами, все птенцы одного выводка получали одинаковую комбинацию цветных колец. В 2016–2018 годах часть гнезд (51 гнездо северной бормотушки и 75 гнезд лугового чекана) контролировали с помощью автоматических фотокамер (Samsonov et al., 2018). Успешными считали гнезда, которые покинул хотя бы один птенец, вывод об успешности размножения делали на основе наблюдения за взрослыми птицами, кормящими слетков после вылета из гнезда. Точную дату вылета птенцов определяли путем визуального контроля гнезда или по данным фотоловушек. Продолжительность гнездового цикла рассчитывали как разность между датой вылета и датой откладки первого яйца, нам удалось оценить этот показатель (известны обе даты) для 92 гнезд (65 гнезд северной бормотушки и 27 гнезд лугового чекана). Размножение считали неудачным, если содержимое гнезда бесследно исчезало или взрослые птицы не наблюдались у него в течение двух последовательных проверок. В случае бесследного исчезновения содержимого и (или) повреждения гнезда его считали разоренным хищниками. В анализ включены данные по контролю гнезд двух видов за 14-летний период общей продолжительностью 13 364 гнездо-дня (7295 гнездо-дней для северной бормотушки и 6069 гнездо-дней для лугового чекана).
Подготовка данных к анализу успешности размножения с помощью модуля “Nest survival” программы MARK
Как и метод Мэйфилда (1975), реализованный в программе MARK подход к оценке успешности размножения (Dinsmore et al., 2002) основан на вычислении суточной сохраняемости гнезд (nest daily survival rate), то есть величины, обратной скорости гибели гнезд (Паевский, 1985), и представляет собой расширение метода, впервые описанного Бартом и Робсоном (Bart, Robson, 1982). Этот метод позволяет увеличить информативность оценок суточной сохраняемости гнезд за счет использования групповых, индивидуальных и время-зависимых ковариат. В его основе лежат несколько исходных допущений: (1) возраст гнезд в день находки должен быть корректно определен, (2) судьба гнезд должна быть корректно определена, (3) обнаружение гнезда и последующие проверки не должны влиять на его сохраняемость, (4) судьбы гнезд не зависят друг от друга (Dinsmore et al., 2002). Строго говоря, допущения (2–4) справедливы и для оригинального метода Мэйфилда (Mayfield, 1975)
Для использования метода требуется следующая минимальная информация: (1) дата находки гнезда, (2) дата последнего наблюдения активного гнезда, (3) дата последней проверки гнезда, (4) судьба гнезда (0 – гнездование успешно, 1 – гнездование неудачно) и (5) – общее число гнезд с подобными характеристиками. Отсчет дней ведется от даты находки первого гнезда в выборке, которая принимается за единицу. Если в выборку предполагается включать данные за несколько лет, за единицу принимается самая ранняя дата наблюдения гнезда за все годы. Указанная информация представляет собой индивидуальную историю гнезда и вносится в виде строчки в текстовый файл. Например, индивидуальная история “5 15 17 1 1” кодирует гнездо, найденное на 5-й день наблюдений, последний раз наблюдавшееся активным на 15-й день наблюдений и обнаруженное разоренным на 17-й день наблюдений. Если гнездование завершилось успешно, дата последнего наблюдения активного гнезда и дата последней проверки должны совпадать и соответствовать дате вылета птенцов из гнезда. Например, индивидуальная история “5 16 16 0 1” означает, что гнездо было найдено на 5-й день наблюдений, а птенцы его благополучно покинули на 16-й день наблюдений. Если точную дату вылета определить не удалось (но есть уверенность в успешном завершении гнездования), за таковую принимается последняя дата наблюдения активного гнезда.
Как указывалось выше, программа MARK позволяет моделировать зависимость суточной сохраняемости гнезд от групповых, индивидуальных и временны́х ковариат. Под групповой ковариатой (группирующая переменная) понимается независимая переменная, общая для нескольких гнезд в выборке. Так, в одну группу могут быть объединены все гнезда, найденные в один год или в одном местообитании (на контрольной площадке), или принадлежащие одному виду птиц. Индивидуальные истории гнезд, относящихся к одной группе, предваряются записью с номером этой группы, например:
Nest survival group = 1;
5 16 16 0 1;
4 15 17 1 1;
…
Nest survival group = 2;
…
Под индивидуальной ковариатой понимается независимая переменная, специфичная для конкретного гнезда (“возраст” гнезда в момент находки, высота расположения гнезда над землей, размер кладки и т.п.). Индивидуальные ковариаты записываются в индивидуальной истории гнезда после его базовых характеристик. Например, запись “5 16 16 0 1 8” будет обозначать гнездо “возрастом” 8 дней (т.е. найденное на 8-й день после откладки первого яйца). Наконец, метод позволяет учитывать влияние время-специфичных ковариат – независимых переменных, специфичных для каждого временнóго отрезка, для которого оценивается сохраняемость гнезд. Так, при оценке суточной сохраняемости гнезд модель может учитывать влияние на сохраняемость среднесуточной температуры, суммарного за сутки количества осадков и других погодных факторов. Время-специфичные ковариаты не вносятся в файлы индивидуальных историй гнезд, а добавляются непосредственно в матрицы программы MARK в ходе анализа (Rotella, 2019).
Анализ данных по успешности размножения модельных видов
Детальное описание работы с модулем “Nest survival” программы MARK приведено в руководстве пользователя, находящемся в свободном доступе в сети Интернет (Rotella, 2019), поэтому мы остановимся лишь на описании работы с конкретной выборкой. Приступая к анализу, необходимо сформулировать набор априорных гипотез, которые будут описывать зависимость суточной сохраняемости гнезд от тех или иных факторов (Dinsmore et al., 2002). В нашем случае были сформулированы следующие гипотезы: (1) суточная сохраняемость гнезд не изменяется во времени, одинакова у двух видов и не зависит от погодных факторов (“константная” модель), (2) имеются видовые различия в суточной сохраняемости гнезд (фактор “Вид”), (3) суточная сохраняемость гнезд изменяется по годам (фактор “Год”), суточная сохраняемость гнезд изменяется в течение гнездового сезона (фактор “День”) и/или зависит от “возраста” гнезда (фактор “Возраст”), суточная сохраняемость гнезд зависит от среднесуточной температуры (“Температура”) или суммарного количества осадков за сутки (“Осадки”). Индивидуальные истории гнезд модельных видов (n = 1076) были организованы в 28 групп, среди которых группы 1–14 включали индивидуальные истории гнезд северной бормотушки за 2005–2018 годы соответственно, а группы 15–28 – индивидуальные истории гнезд лугового чекана за те же годы. Далее с помощью инструментария программы MARK строятся регрессионные модели, учитывающие зависимость суточной сохраняемости гнезд от выбранных отдельных факторов и их комбинаций. Общее число моделей, учитывающих все возможные комбинации факторов, оказалось слишком велико, поэтому мы применяли ступенчатую процедуру анализа (Arnold, 2010), позволяющую сократить число тестируемых моделей. Первоначально была построена “константная” модель, предполагающая отсутствие какой-либо вариации суточной сохраняемости гнезд. Далее были построены модели “Вид” и “Год”, учитывающие соответственно межвидовую и межгодовую вариации суточной сохраняемости гнезд, а также модель “Вид * Год”, принимающая во внимание оба указанных фактора. Построенные модели ранжировали по величине информационного критерия Акаике, скорректированного для малых выборок (AICc); модели, обладающие значением ΔAICc (разница между AICc текущей модели и минимальным среди всех тестируемых моделей значением AICc) менее 2-х единиц, считали адекватно описывающими данные (Burnham, Anderson, 2002). Кроме того, для каждой модели с помощью инструментария программы MARK рассчитывали ее нормализованный вес, для определения относительной значимости факторов использовали суммарные веса моделей, включающих тот или иной фактор.
На втором этапе анализа тестировали внутрисезонную изменчивость суточной сохраняемости гнезд. Известно, что величина суточной сохраняемости гнезд у открыто гнездящихся воробьиных птиц может изменяться в течение сезона размножения и (или) зависеть от “возраста” гнезда (т.е. фактически от стадии гнездового цикла; Grant et al., 2005; Grant & Shaffer, 2012). В первом случае динамика сохраняемости гнезд определяется изменением внешних условий (активность разорителей, погода, развитие защитных качеств растительного покрова) в течение гнездового сезона, во втором – изменением доступности гнезд для разорителей на разных стадиях гнездового цикла. Таким образом, при анализе внутрисезонной изменчивости суточной сохраняемости гнезд необходимо раздельно тестировать влияние переменных “День” и “Возраст”, причем для каждой из них тестируются линейные и квадратичные зависимости. В последнем случае предполагается, что зависимость суточной сохраняемости гнезд от хода гнездового сезона (или стадии гнездового цикла) имеет вид параболы, из чего следует наличие ярко выраженного максимума (или минимума) суточной сохраняемости гнезд в течение гнездового сезона (Grant et al., 2005). Более того, связь суточной сохраняемости гнезд с их “возрастом” у воробьиных птиц может описываться также кубической функцией, что может быть объяснено разной сохраняемостью гнезд на стадиях откладки яиц, насиживания и выкармливания (Grant et al., 2005). Мы тестировали линейную и квадратичную зависимости суточной сохраняемости гнезд от дня сезона (факторы “День” и “День2” соответственно) и линейную, квадратичную и кубическую зависимости суточной сохраняемости гнезд от “возраста” гнезда (факторы “Возраст”, “Возраст2” и “Возраст3” соответственно). Каждую из переменных добавляли к “лучшей” модели, полученной на первом этапе анализа (т.е. имеющей значение ΔAICc менее двух единиц, в нашем случае это была модель “Год”). Учитывали, что связь между временнóй ковариатой и суточной сохраняемостью гнезд может быть одинаковой во все годы (аддитивные модели, например “Год + День”) или может иметь разную направленность в разные годы (модели взаимодействия, например “Год * День”). Таким образом, всего на втором этапе анализа было построено 10 моделей (5 аддитивных моделей и 5 моделей взаимодействия), которые были ранжированы по величине AICc. Адекватно описывающими данными считали модели, имеющие значение ΔAICc менее двух единиц (Burnham, Anderson, 2002).
На заключительном этапе анализа тестировали влияние погодных факторов на суточную сохраняемость гнезд. Сведения о погоде с метеостанции № 22 939 Белозерск, расположенной в 40 км северо-западнее полевого стационара, получили с сайта https://rp5.ru. Среднесуточные значения температуры и суточные суммы осадков использовали как время-специфичные ковариаты (“Температура” и “Осадки”) в программе MARK. Эти ковариаты добавляли к моделям, которые были полученны на втором этапе анализа и обладающим значениями ΔAICc менее двух единиц. Учитывали, что влияние погодных факторов на суточную сохраняемость гнезд могло быть как одинаковым во все годы исследований (аддитивная модель, например, “Год + Температура”), так и могло иметь различную направленность в разные годы (модель взаимодействия, например, “Год * Температура”). Полученные модели ранжировали по величине AICc. Адекватно описывающими данными считали модели, имеющие значение ΔAICc менее двух единиц (Burnham, Anderson, 2002). Направленность, силу и значимость влияние ковариат оценивали по абсолютной величине бета-коэффициентов регрессионной модели и их 95% доверительным интервалам. Связь считали статистически значимой, если 95% доверительные интервалы оценки параметра не включали ноль.
Оценки суточной сохраняемости гнезд, полученные из модели “Год”, позволяют рассчитать годовую успешность размножения, т.е. показатель, который обычно вычисляют орнитологи, использующие классический метод Мэйфилда (Shaffer, Thompson, 2007). Для оценки годовой успешности размножения величину суточной сохраняемости гнезд, полученную из модели “Год”, возводили в степень, соответствующую общей продолжительности (в днях) гнездового периода каждого из видов. Стандартные ошибки полученных показателей вычисляли с помощью дельта метода (Powell, 2007).
РЕЗУЛЬТАТЫ
Продолжительность гнездового цикла и судьба гнезд
Размножение закончилось успешно в 283 (54.1%) гнездах бормотушки и 352 (63.7%) гнездах лугового чекана. Главной причиной гибели гнезд обоих видов было хищничество – всего было разорено 194 гнезда северной бормотушки (81% всех “неуспешных” гнезд) и 172 гнезда лугового чекана (86% всех “неуспешных” гнезд). К другим факторам гибели гнезд относились забрасывание кладок без видимых причин (28 гнезд северной бормотушки и 15 гнезд лугового чекана) и гибель птенцов во время похолоданий (6 гнезд северной бормотушки и 1 гнездо лугового чекана). В редких случаях северные бормотушки (n = 10) и луговые чеканы (n = 10) бросали гнезда после отлова взрослых птиц, такие гнезда были исключены из дальнейших расчетов успешности размножения. Средняя продолжительность гнездового цикла у двух видов различалась на один день и составила 28.9 ± 0.23 дня у северной бормотушки (n = 65) и 30.2 ± 0.45 дней у лугового чекана (n = 27). Эти различия связаны с большей величиной кладки у лугового чекана по сравнению с северной бормотушкой (Shitikov et al., 2012, 2015) и, соответственно, с большей продолжительностью периода откладки яиц.
Суточная сохраняемость гнезд и ее динамика
На первом этапе анализа мы оценили сравнительное влияние групповых факторов (год исследований и видовая принадлежность гнезда) на суточную сохраняемость гнезд. Было построено 4 модели-кандидата, из которых значением ΔAICc менее 2-х единиц обладала модель, учитывающая только межгодовую вариацию суточной сохраняемости гнезд (табл. 1). Суммарный вес моделей, учитывающих межгодовую вариацию, был ω = 1.00, в то время как для моделей, учитывающих видовую принадлежность, этот показатель составил лишь ω = 0.01. Модель “Вид” обладала значением ΔAICc= 90.9. Таким образом, суточная сохраняемость гнезд была подвержена значимой межгодовой вариации (рис. 1) и не зависела от видовой принадлежности гнезда. На основе полученных значений суточной сохраняемости гнезд были получены оценки ежегодной успешности размножения каждого из видов (табл. 2). Несмотря на то, что суточная сохраняемость гнезд двух видов была одинаковой, итоговая успешность размножения северной бормотушки оказалась несколько более высокой, так как средняя продолжительность периода гнездования у этого вида была на 1 день меньше, чем у лугового чекана.
Таблица 1.
Результаты выбора моделей суточной сохраняемости гнезд северной бормотушки и лугового чекана на контрольной площадке в 2005–2018 гг.
| Модель | ΔAICc | Вес | К |
|---|---|---|---|
| Шаг 1: оценка видовых различий и межгодовой изменчивости | |||
| S(Год) | 0.00 | 0.99 | 14 |
| Шаг 2: оценка вариации в течение сезона размножения | |||
| S(Год * Возраст2) | 0.00 | 0.47 | 42 |
| S(Год + Возраст3) | 1.58 | 0.21 | 17 |
| S(Год * Возраст3) | 1.64 | 0.21 | 56 |
| Шаг 3: оценка влияния погодных факторов | |||
| S(Год * Темп + Возраст3) | 0.00 | 0.50 | 31 |
Примечание. ΔAICc – разница между значениями критерия Акаике, скорректированного для малых выборок (AICc) модели и модели с минимальным значением AICc. Показаны только модели, обладающие значением ΔAICc менее 2-х единиц. Минимальная величина AICc: шаг 1 – AICc = 2721.15; шаг 2 – AICc = 2706.35; шаг 3 – AICc = 2693.49). Вес – “вклад” модели, K – число параметров в модели. Обозначения параметров: “Год” – год исследования, “Возраст” – возраст гнезда (линейная зависимость), “Возраст2” – возраст гнезда (квадратичная зависимость), “Возраст3” – возраст гнезда (кубическая зависимость), “Темп” – средняя суточная температура.
Рис. 1.
Динамика суточной сохраняемости гнезд северной бормотушки и лугового чекана в 2005–2018 годах. Оценки суточной сохраняемости гнезд получены из модели “Год”.
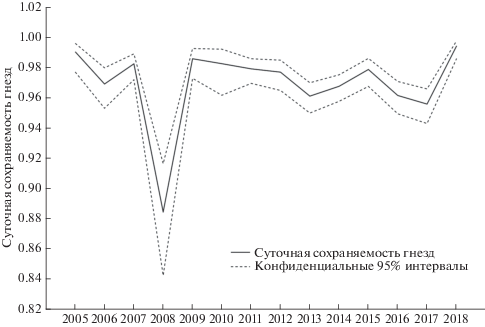
Таблица 2.
Оценки годовой успешности размножения северной бормотушки и лугового чекана на контрольной площадке в 2005–2018 гг.
| Год | Успешность размножения (±SE *) | |
|---|---|---|
| Северная бормотушка | Луговой чекан | |
| 2005 | 0.76 ± 0.09 | 0.75 ± 0.10 |
| 2006 | 0.40 ± 0.08 | 0.39 ± 0.08 |
| 2007 | 0.60 ± 0.07 | 0.59 ± 0.08 |
| 2008 | 0.03 ± 0.02 | 0.03 ± 0.02 |
| 2009 | 0.66 ± 0.09 | 0.65 ± 0.09 |
| 2010 | 0.60 ± 0.13 | 0.59 ± 0.13 |
| 2011 | 0.54 ± 0.07 | 0.53 ± 0.07 |
| 2012 | 0.51 ± 0.08 | 0.50 ± 0.08 |
| 2013 | 0.32 ± 0.05 | 0.30 ± 0.05 |
| 2014 | 0.38 ± 0.05 | 0.37 ± 0.05 |
| 2015 | 0.53 ± 0.07 | 0.52 ± 0.07 |
| 2016 | 0.32 ± 0.05 | 0.31 ± 0.05 |
| 2017 | 0.27 ± 0.05 | 0.26 ± 0.05 |
| 2018 | 0.84 ± 0.07 | 0.84 ± 0.07 |
| Среднее за все годы | 0.48 ± 0.07 | 0.47 ± 0.07 |
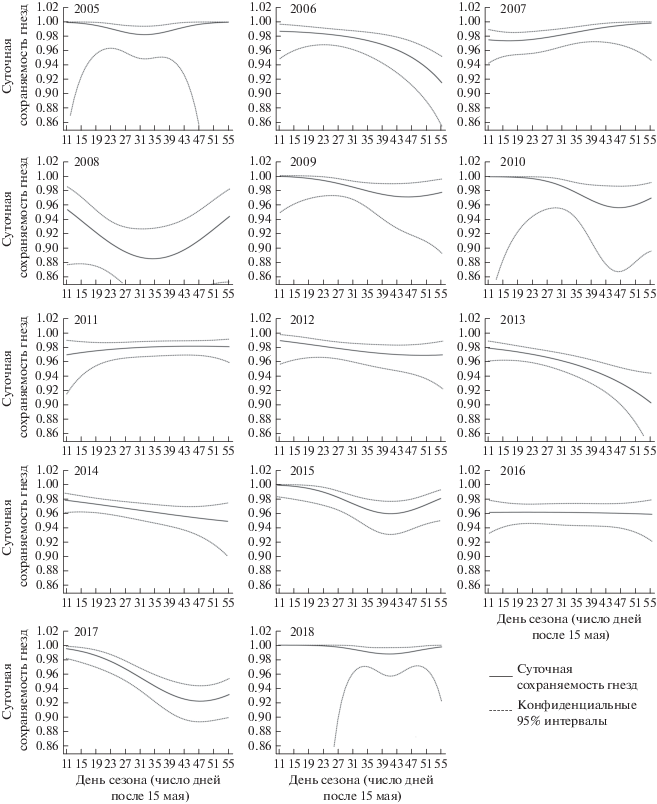
На следующем этапе анализа мы оценивали изменчивость суточной сохраняемости гнезд в течение сезона размножения. Всего было построено 11 моделей-кандидатов, из которых значениями ΔAICc менее трех единиц обладали три модели, обладающие суммарным весом ω = 0.89 (табл. 1). Согласно этим моделям, суточная сохраняемость гнезд нелинейно зависела от возраста гнезда, причем по двум моделям (суммарный вес ω = 0.68) эта связь имела различную направленность в разные годы, а согласно третьей модели (вес ω = = 0.21) – одинаковую. Анализ данных по внутрисезонной динамике суточной сохраняемости гнезд, извлеченных из “лучшей” модели (Год * * Возраст2, рис. 2), показывает, что в некоторые годы (2006, 2013, 2014) суточная сохраняемость гнезд нелинейно снижалась в течение всего сезона размножения, что свидетельствует о росте пресса хищников. В 2008–2010, 2015 и 2017 годах минимальный уровень суточной сохраняемости гнезд достигался приблизительно к началу третьей декады июня, после чего этот показатель начинал повышаться. Наконец, в отдельные годы суточная сохраняемость гнезд практически не изменялась в течение гнездового сезона (2016) или даже показывала положительную динамику (2007, 2011). Фактически, каждый из проанализированных 14 гнездовых сезонов обладал своим уникальным профилем изменчивости суточной сохраняемости гнезд.
Рис. 2.
Изменчивость суточной сохраняемости гнезд северной бормотушки и лугового чекана в течение гнездового сезона, 2005–2018 гг. Оценки суточной сохраняемости гнезд получены из модели “Год * Возраст2”.
На последнем этапе анализа тестировали влияние на суточную сохраняемость гнезд погодных факторов (средняя суточная температура и суточная сумма осадков). Всего было построено 17 моделей-кандидатов, из которых значениями ΔAICc менее двух единиц обладала лишь одна (табл. 1). Согласно этой модели, суточная сохраняемость гнезд обоих видов определялась взаимодействием факторов “Год” и “Температура” и аддитивным эффектом возраста гнезда (кубическая зависимость). При этом влияние текущей температуры на суточную сохраняемость гнезд было статистически значимым лишь в два из четырнадцати гнездовых сезонов (2013 и 2016, табл. 3), причем в 2013 г. среднесуточные температуры оказывали отрицательное воздействие на суточную сохраняемость гнезд, а в 2016 г. – положительное. Во все остальные годы конфиденциальные 95% интервалы оценки данного параметра включали ноль, что говорит об отсутствии статистически значимой связи между среднесуточными температурами и сохраняемостью гнезд. Для некоторых из этих лет оценки были близки к статистически значимым, в эти годы связь также могла быть как прямой (2007, 2011), так и обратной (2017).
Таблица 3.
Оценки значимости (бета-коэффициенты) влияния среднесуточных температур на суточную сохраняемость гнезд северной бормотушки и лугового чекана на контрольной площадке в 2005–2018 гг.
| Год | Оценка (бета ± SE) | Конфиденциальные 95% интервалы |
|---|---|---|
| 2005 | 0.03 ± 0.25 | –0.46, 0.53 |
| 2006 | 0.04 ± 0.06 | –0.08, 0.15 |
| 2007 | 0.29 ± 0.12 | 0.06, 0.51 |
| 2008 | 0.03 ± 0.07 | –0.10, 0.16 |
| 2009 | –0.03 ± 0.10 | –0.23, 0.16 |
| 2010 | 0.02 ± 0.11 | –0.20, 0.24 |
| 2011 | 0.11 ± 0.06 | –0.01, 0.22 |
| 2012 | 0.09 ± 0.09 | –0.08, 0.27 |
| 2013 | –0.12 ± 0.04 | –0.20, –0.05 |
| 2014 | 0.03 ± 0.04 | –0.05, 0.10 |
| 2015 | 0.06 ± 0.09 | –0.12, 0.24 |
| 2016 | 0.10 ± 0.04 | 0.03, 0.18 |
| 2017 | –0.09 ± 0.07 | –0.22, 0.03 |
| 2018 | –0.01 ± 0.13 | –0.26, 0.24 |
ОБСУЖДЕНИЕ
Важным требованием к любому современному методу определения успешности размножения является возможность получения оценок, сравнимых с таковыми, полученными классическим методом Мэйфилда (1975). Методы, основанные на моделировании суточной сохраняемости гнезд, позволяют получать такие оценки за счет построения моделей с суточной сохраняемостью гнезд, не изменяющейся в течение гнездового сезона (Dinsmore et al., 2002; Lloyd, Tewksbury, 2007). Используя этот подход, мы оценили годовые показатели успешности размножения двух видов воробьиных за 14-летний период (табл. 2). Усредненная за этот промежуток успешность размножения лугового чекана (47 ± 7%) оказалась существенно более высокой, чем на интенсивно используемых сенокосах в Швейцарии (менее 10%, Grüebler et al., 2012) и неиспользуемых лугах в южной Англии (25%, Border et al., 2017), но значительно ниже, чем на заброшенных сельскохозяйственных землях в Польше (74%; Frankiewicz, 2008) и экстенсивно используемых лугах в Германии (85%; Fischer et al., 2013). Аналогичный показатель для северной бормотушки (48 ± 7%) оказался более высоким, чем в лесостепи Западной Сибири (30%; Чернышов, 2013).
Традиционно при изучении успешности размножения птиц применяется моновидовой подход, предполагающий получение самостоятельных оценок сохраняемости гнезд для каждого вида (Newmark, Stanley, 2011; Ludlow et al., 2014; Shitikov et al., 2018; 2018a). Многовидовой подход, при котором видовая принадлежность гнезд используется в качестве независимой переменной в общей модели, встречается гораздо реже (Shake et al., 2011; Grant et al., 2017; Roach et al., 2018). Вместе с тем такой подход к анализу суточной сохраняемости гнезд может быть очень перспективным, так как позволяет включать в анализ данные по редким видам с незначительными выборками гнезд и оценивать сохраняемость гнезд на уровне сообщества (Loman et al., 2018). Нам удалось показать, что суточная сохраняемость гнезд не зависела от их видовой принадлежности. Отсутствие значимых различий в суточной сохраняемости гнезд между двумя видами может быть объяснено прессом хищничества – мы предполагаем, что на заброшенных сельскохозяйственных землях по крайней мере часть разорителей с приблизительно равной вероятностью уничтожает гнезда всех видов открытогнездящихся воробьиных. Ранее мы показали, что на сохраняемость гнезд каждого из двух видов оказывала существенное влияние общая плотность населения воробьиных, в то время как эффект плотности конкретного вида был незначимым (Shitikov et al., 2018а).
Методы оценки успешности размножения, основанные на моделировании суточной сохраняемости гнезд позволяют не только получать оценки средней успешности размножения за сезон, но и выявить внутрисезонную изменчивость суточной сохраняемости гнезд, а также оценить ее связь с особенностями расположения гнезд и/или факторами среды (Dinsmore et al., 2002; Shaffer, 2004; Grant et al., 2005). Прежде всего, нам удалось подтвердить полученные ранее (Shitikov et al., 2012, 2015) выводы о значимости межгодовой изменчивости успешности размножения лугового чекана и северной бормотушки. В отдельные годы успешность размножения обоих видов снижалась до критически низких величин (табл. 2), в то время как в наиболее “удачные” годы этот показатель достигал максимальных значений, известных для этих видов из других частей ареала. Столь высокая вариабельность определяется прежде всего годовыми особенностями пресса хищничества. Так, в 2008 г. хищниками были разорены практически все найденные нами гнезда обоих видов, в то время как в 2018 г. факты разорения гнезд были единичны и, по всей видимости, носили случайный характер. Наши результаты лишний раз свидетельствуют о необходимости многолетних исследований для получения адекватных оценок успешности размножения в локальных популяциях отурытогнездящихся воробьиных.
Суточная сохраняемость гнезд открыто гнездящихся воробьиных птиц часто бывает подвержена нелинейной внутрисезонной изменчивости вследствие изменения активности хищников в ходе сезона размножения и разной уязвимостью гнезд на разных стадиях (Grant et al., 2005; Grant, Shaffer, 2012). Например, многие хищники чаще разоряют гнезда с птенцами, чем гнезда с кладками, так как частые визиты родителей с кормом к гнездам могут демаскировать их (Martin et al., 2000). Выявленная нами нелинейная связь сохраняемости гнезд с “возрастом” гнезд у луговых чеканов и северных бормотушек также может быть объяснена изменением активности хищников. Так, обыкновенные гадюки разоряют исключительно гнезда с птенцами, причем пик хищничества гадюки приходится на вторую половину июня – начало июля. Следовательно, снижение суточной сохраняемости гнезд, наблюдаемое в этот период в некоторые годы, может быть объяснено именно хищничеством гадюки. Серая ворона также чаще разоряет гнезда на стадии выкармливания, чем гнезда с кладками, но при этом пик хищничества этого вида приходится на первую половину июня (Samsonov et al., 2018).
Зная величину суточной сохраняемости гнезд для каждого из дней гнездового цикла, можно рассчитать успешность размножения для части популяции, приступившей к гнездованию в каждую конкретную дату сезона (period survival, Shaffer, Thompson, 2007). Например, в 2014 г. успешность размножения луговых чеканов, в гнездах которых первое яйцо появилось 1 июня, составляла 34%, а в гнездах с откладкой первого яйца 15 июня успешность размножения была лишь 25%. При этом оба показателя занижены по сравнению со средней за сезон оценкой (37 ± 5%), так как значительная часть луговых чеканов на нашей контрольной площадке приступает к размножению в конце второй–начале третьей декады мая (Shitikov et al., 2015). Таким образом, для корректной оценки успешности размножения необходимость охватывать наблюдениями весь гнездовой сезон или хотя бы значительную его часть.
Наконец, обсуждаемый метод позволяет оценить влияние на суточную сохраняемость гнезд широкого спектра внешних факторов, например, погодных условий. При этом имеется возможность учесть влияние как интегральных (за сезон или его часть: суммы тепла и осадков, даты перехода суточных температур через ноль и т.п.), так и суточных (средняя суточная температура, суммарное количество осадков за сутки) показателей. Последний подход представляется наиболее перспективным, так как позволяет оценить влияние погодных условий как на межгодовую, так и на внутрисезонную динамику успешности размножения (Skagen, Yackel Adams, 2012). На нашей контрольной площадке суточная сохраняемость гнезд северной бормотушки и лугового чекана зависела только от среднесуточных температур, эффекта осадков нам выявить не удалось. Выявленная взаимосвязь проявлялась не ежегодно, а ее направленность различалась в разные годы. Известно, что влияние погоды на успешность размножения может быть как прямым (через увеличение смертности кладок и птенцов при резком ухудшении погоды), так и косвенным из-за изменения активности разорителей гнезд (Cox et al., 2013). В нашем случае практически не вызывает сомнений косвенная связь через хищничество, так как подавляющее большинство “неуспешных” гнезд обоих модельных видов было разорено. Возможно, отрицательная взаимосвязь среднесуточной температуры с суточной сохраняемостью гнезд в 2013 г. может быть объяснена активностью обыкновенной гадюки, которая, в свою очередь, сильно зависит от температуры воздуха (Коросов, 2010).
Таким образом, метод, реализованный в программе MARK, представляет собой универсальный инструмент, позволяющий количественно оценить успешность размножения и выявить зависимости последней от широкого набора факторов среды (Dinsmore et al., 2002; Dinsmore, Dinsmore, 2007). Его применение позволило не только установить среднегодовые показатели успешности размножения двух видов воробьиных птиц на заброшенных сельскохозяйственных землях, но и выявить направленность внутрисезонной динамики суточной сохраняемости гнезд, а также количественно оценить влияние на последнюю погодных условий. Все перечисленные параметры оказались подвержены существенной межгодовой изменчивости.
Список литературы
Антонов А.И., 2010. Гнездовая экология дальневосточного кроншнепа Numenius madagascariensis (Linnaeus, 1766) на юге ареала // Экология. № 4. С. 310–311.
Венгеров П.Д., 2017. Влияние роста весенней температуры воздуха на сроки и продуктивность размножения певчего дрозда (Turdus philomelos CL Brehm) в условиях лесостепи русской равнины // Экология. № 2. С. 134–140.
Венгеров П.Д., 2018. Экология размножения большой синицы (Parus major) в островном лесу Центрального Черноземья (на примере Воронежского заповедника) // Вестник Оренбургского государственного педагогического университета. Электронный научный журнал. № 1. С. 9–24.
Демидова Е.Ю., 2012. Жизненные циклы дроздов (роды Turdus, Zoothera) енисейской средней тайги. Автореферат дис. … канд. биол. наук. М. С. 1-27.
Коросов А.В., 2010. Экология обыкновенной гадюки на севере. Петрозаводск: Изд-во Петрозаводского государственного университета. 261 с.
Кочанов С.К., Данилова Е.В., 2016. Экология грача (Corvus frugilegus Linnaeus, 1758) на северной границе его распространения (европейский северо-восток России) // Вестник Института биологии Коми НЦ УрО РАН. № 2 (196). С. 12–17.
Паевский В.А., 1985. Демография птиц. Л.: Наука. 285 с.
Паевский В.А., 2008. Демографическая структура и популяционная динамика певчих птиц. С.Пб.–М.: Товарищество научных изданий КМК. 235 с.
Чернышов В.М., 2013. Экологические особенности северной бормотушки Hippolais caligata в Барабинской лесостепи // Сибирский экологический журнал. Т. 20. № 1. С. 101–109.
Шитиков Д.А., Вайтина Т.М., Макарова ТВ., Федотова С.Е., Красных Н.А., Юрченко Ю.Ю., 2017. Влияние успешности размножения на видимую выживаемость луговых воробьиных птиц // Зоологический журнал. Т. 96. № 7. С. 827-837.
Arnold T.W., 2010. Uninformative parameters and model selection using Akaike’s information criterion // Journal of Wildlife Management. V. 74. P. 1175–1178.
Bart J., Robson D.S., 1982. Estimating survivorship when the subjects are visited periodically // Ecology. V. 63. № 4. P. 1078–1090.
Border J. A., Henderson I.G., Hartley I.R., 2017. Characterising demographic contributions to observed population change in a declining migrant bird // Journal of Avian Biology. V. 48. P. 1139–1149.
Burnham K.P., Anderson D.R., 2002. Model selection and inference: a practical information theoretic approach. USA Springer, New York. 487 p.
Cox W.A., Thompson F.R., Reidy J.L., 2013. The effects of temperature on nest predation by mammals, birds, and snakes // The Auk. V. 130. № 4. P. 784–790.
DeGregorio B.A., Weatherhead P.J., Sperry J.H., 2014. Power lines, roads, and avian nest survival: effects on predator identity and predation intensity // Ecology and Evolution. V. 4. № 9. P. 1589–1600.
Dinsmore S.J., Dinsmore J.J., 2007. Modeling avian nest survival in program MARK // Studies in Avian Biology. № 34. P. 11.
Dinsmore S.J., White G.C., Knopf F.L., 2002. Advanced techniques for modeling avian nest survival // Ecology. V. 83. № 12. P. 3476–3488.
Evans K.L., 2004. The potential for interactions between predation and habitat change to cause population declines of farmland birds // Ibis. V. 146. № 1. P. 1–13.
Fischer K., Busch R., Fahl G., Kunz M., Knopf M., 2013. Habitat preferences and breeding success of Whinchats (Saxicola rubetra) in the Westerwald mountain range // Journal of Ornithology. V. 154. P. 339–349.
Frankiewicz J., 2008. Breeding biology and ecology of Whinchat Saxicola rubetra on abandoned farmland of Opole Province (SW Poland) // Acta Zoologica Cracoviensia - Series A: Vertebrata. V. 51. P. 35–47.
Grant T.A., Shaffer T.L., 2012. Time-specific patterns of nest survival for ducks and passerines breeding in North Dakota // The Auk. V. 129. № 2. P. 319–328.
Grant T.A., Shaffer T.L., Madden E.M., Pietz P.J., Johnson D.H., 2005. Time-specific variation in passerine nest survival: new insights into old questions // The Auk. V. 122. № 2. P. 661–672.
Grant T.A, Shaffer T.L., Madden E.M., Nenneman M.P., 2017. Contrasting nest survival patterns for ducks and songbirds in northern mixed-grass prairie // The Journal of Wildlife Management. № 4 (81). C. 641–651.
Grüebler M.U., Schuler H., Horch P., Spaar R., 2012. The effectiveness of conservation measures to enhance nest survival in a meadow bird suffering from anthropogenic nest loss // Biological Conservation. V. 146. P. 197–203.
Gullett P.R., Hatchwell B.J., Robinson R.A., Evans K.L., 2015. Breeding season weather determines Long-tailed Tit reproductive success through impacts on recruitment // Journal Avian Biol. V. 46. № 5. P. 441–451.
Ibáñez-Álamo, J.D., Magrath R.D., Oteyza J.C., Chalfoun A.D., Haff T.M., Schmidt K.A., Thomson R.L., Martin T.E., 2015. Nest predation research: recent findings and future perspectives // Journal of Ornithology. V. 156. P. 247–262.
Johnson D.H., 2007. Estimating nest success: A guide to the methods // Stud. Avian Biol. № 34. P. 65–72.
Kubelka V., Šálek M., Tomkovich P., Végvári Z., Freckleton R.P., Székely T., 2018. Global pattern of nest predation is disrupted by climate change in shorebirds // Science. V. 362. P. 680–683.
Kus B.E., Peterson B.L., Deutschman D.H., 2008. A multiscale analysis of nest predation on least Bell’s Vireos (Vireo bellii pusillus) // The Auk. V. 125. № 2. P. 277–284.
Lloyd J.D., Tewksbury J.J., 2007. Analyzing avian nest survival in forests and grasslands: a comparison of the Mayfield and logistic-exposure methods // Studies in Avian Biology. V. 34. P. 96–104.
Loman Z.G., Monroe A.P., Riffell S.K., Miller D.A., Vilella F.J., Wheat B.R., Rush S.A., Martin J.A., 2018. Nest survival modeling using a multi-species approach in forests managed for timber and biofuel feedstock // Journal of Applied Ecology. V. 55. № 2. P. 937–946.
Ludlow S.M., Brigham R.M., Davis S.K., 2014. Nesting ecology of grassland songbirds: effects of predation, parasitism, and weather // The Wilson Journal of Ornithology. V. 126. P. 686–699.
Martin T.E., 1995. Avian life history evolution in relation to nest sites, nest predation, and food // Ecological Monographs. V. 65. C.101–127.
Martin T.E., Scott J., Menges C., 2000. Nest predation increases with parental activity: separating nest site and parental activity effects // Proc. Royal Soc. Lond. B. 267. P. 2287–2293.
Mayfield H.F., 1961. Nesting success calculated from exposure // Wilson Bulletin. V. 73. № 3. P. 255–261.
Mayfield H.F., 1975. Suggestions for calculating nest success // Wilson Bulletin. V. 87. № 4. P. 456–466.
Newmark W.D., Stanley T.R., 2011. Habitat fragmentation reduces nest survival in an Afrotropical bird community in a biodiversity hotspot // Proceedings of the National Academy of Sciences. V. 108. P. 11488–11493.
Powell L.A., 2007. Approximating variance of demographic parameters using the delta method: a reference for avian biologists // The Condor . V. 109. № 4. P. 949–954.
Remeš V., 2005. Nest concealment and parental behaviour interact in affecting nest survival in the blackcap (Sylvia atricapilla): an experimental evaluation of the parental compensation hypothesis // Behavioural Ecology and Sociobiology. V. 58. № 3. P. 326–332.
Roach M.C., Thompson F.R., Jones-Farrand T., 2018. Songbird nest success is positively related to restoration of pine–oak savanna and woodland in the Ozark Highlands, Missouri, USA // The Condor. V. 120. P. 543–556.
Rotella J., 2019. Nest survival models // Cooch E., White G. (eds.). Program Mark. A Gentle Introduction. 19th edition. www.phidot.org/software/ mark/docs/book/ Accessed 09.01.2019
Samsonov S. V., Makarova T. V., Shitikov D.A., 2018. Nest predator species of open nesting songbirds of abandoned fields in «Russky Sever» National Park (Russia) // Nat. Conserv. Res. Заповедная наука. V. 3. № 2. P. 104–107.
Shake C.S., Moorman C.E., Burchell M.R., 2011. Cropland edge, forest succession, and landscape affect shrubland bird nest predation // The Journal of Wildlife Management. V. 75. P. 825–835.
Schaub M., Jakober H., Stauber W., 2011. Demographic response to environmental variation in breeding, stopover and non-breeding areas in a migratory passerine // Oecologia. V. 167. P. 445–459.
Schaub M., von Hirschheydt J., 2009. Effect of current reproduction on apparent survival, breeding dispersal, and future reproduction in barn swallows assessed by multistate capture-recapture models // Journal of Animal Ecology. V. 78. P. 625-635.
Shaffer T.L., 2004. A unified approach to analyzing nest success // The Auk. V. 121. № 2. P. 526–540.
Shaffer T.L., Thompson F.R., 2007. Making meaningful estimates of nest survival with model-based methods // Studies in Avian Biology. № 34. P. 84–95.
Shitikov D., Knyazeva I., Grabovsky A., 2018. Breeding phenology, reproductive traits and apparent survival of sympatric Marsh Warbler Acrocephalus palustris and Blyth’s Reed Warbler Acrocephalus dumetorum // Bird Study. V. 65. № 2. P. 241–248.
Shitikov D.A., Fedotova S.E., Gagieva V.A., 2012. Nest survival, predators and breeding performance of Booted Warblers Iduna caligata in the abandoned fields of the North of European Russia // Acta Ornithologica. V. 47. P. 137–146.
Shitikov D.A., Vaytina T.M., Gagieva V.A, Fedchuk D.V., 2015. Breeding success affects site fidelity in a Whinchat Saxicola rubetra population in abandoned fields // Bird Study. V. 62. P. 96–105.
Shitikov D., Vaytina T., Makarova T., Fedotova S., Volkova V., Samsonov S., 2018a. Species-specific nest predation depends on the total passerine nest density in open-nesting passerines // Journal of Ornithology. V. 159. № 2. P. 483–491.
Skagen S.K., Yackel Adams A.A., 2012. Weather effects on avian breeding performance and implications of climate change // Ecological Application. V. 22. P.: 1131–1145.
Sofaer H.R., Sillett T.S, Langin K.M., Morrison S.A., Ghalambor C.K., 2014. Partitioning the sources of demographic variation reveals density-dependent nest predation in an island bird population // Ecology and Evolution. V. 4. № 13. P. 2738–2748.
Stephens S.E., Koons D.N., Rotella J.J., Willey D.W., 2003. Effects of habitat fragmentation on avian nesting success: a review of the evidence at multiple spatial scales // Biological Conservation. V. 115. № 1. P. 101–110.
Weidinger K., 2002. Interactive effects of concealment, parental behaviour and predators on the survival of open passerine nests // Journal of Animal Ecology. V. 71. № 3. P. 424–437.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


