Зоологический журнал, 2019, T. 98, № 2, стр. 203-213
Влияние трофического и погодно-климатического факторов на динамику численности птиц-миофагов в местах их размножения
А. В. Шариков 1, *, С. В. Волков 2, **, Т. В. Свиридова 2, В. В. Буслаков 1
1 Московский педагогический государственный университет
129164 Москва, Россия
2 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
677980 Москва, Россия
* E-mail: avsharikov@ya.ru
** E-mail: owl_bird@mail.ru
Поступила в редакцию 02.02.2018
После доработки 17.05.2018
Принята к публикации 10.05.2018
Аннотация
В 2001–2016 гг. авторы изучали совместное влияние трофических и погодно-климатических факторов на динамику численности трех видов птиц-миофагов на модельной территории северного Подмосковья – в заказнике “Журавлиная родина” (56.7573° с.ш., 37.792° в.д.). Ежегодно осуществляли учеты гнездовой численности обыкновенной пустельги (Falco tinnunculus), ушастой (Asio otus) и болотной (A. flammeus) сов, а также мелких млекопитающих в весенние и летние месяцы. Различные показатели, характеризующие погодно-климатические условия в районе исследований в период существования здесь гнездовых группировок модельных видов птиц, рассчитаны по данным ближайшей метеостанции. Результаты моделирования показали, что на численность ушастой совы достоверно влияет только трофический фактор (β = 0.77 ± 0.1). Для болотной совы и пустельги статистически значимыми оказались оба фактора. Степень влияния кормовых условий на изменение численности хищников была наибольшей для болотной совы (β ± SE = 1.64 ± 0.16) и наименьшей для пустельги (β = 0.38 ± 0.12). Для пустельги влияние климатических факторов (β = 0.41 ± 0.09) на численность несколько превышало по значимости действие трофического фактора. Влияние климатического фактора на численность болотной совы в 4.5 раза меньше, чем трофического (β = 0.36 ± 0.09). Сочетания температуры и влажности в весенний период могут вносить существенные коррективы в амплитуду и частоту колебаний численности рассмотренных видов.
Изучение динамики численности хищников в естественных сообществах – традиционное направление популяционной экологии (Пианка, 1981; Newton, 2010). Большая часть осуществленных в этом направлении исследований выявили корреляцию между численностью хищников и обилием их основных жертв (Korpimäki, 1984; Литвин, Овсяников, 1990; Tome, 2003; Sundell et al., 2004 и др.). Однако нередко отмечается и нарушение синхронности циклических колебаний в системе “хищник–жертва”, которые определяются не только обилием жертв. Причины таких нарушений не всегда понятны, особенно при проведении исследований на небольших по площади территориях.
Не вполне ясны и причины цикличного характера динамики численности мышевидных грызунов, хотя эти циклы наблюдаются в большинстве районов таежной и арктической зон. В последние десятилетия на динамику численности мелких млекопитающих, которые служат основной добычей для большинства пернатых и наземных хищников, оказывает влияние широкомасштабное изменение климата (Stenseth et al., 2002; Korpela, 2014). Это, в свою очередь, может негативно отражаться на популяционной динамике хищников (Solonen, 2010; Schmidt et al., 2012; Cornulier et al., 2013). Так, в Гренландии потепление климата привело к резкому сокращению обилия леммингов и затуханию циклических колебаний их численности, обусловливавших ранее возможность гнездования на этом острове белых сов (Nyctea scandiaca) в годы высокого обилия грызунов (Gilg et al., 2009; Schmidt et al., 2012). Сходные реакции отмечены и у других арктических хищников – песца (Vulpes lagopus) и длиннохвостого поморника (Stercorarius longicaudus), выживаемость и успешность размножения которых также зависят от обилия леммингов (Henden et al., 2008; Barraquand et al., 2013).
Непосредственное влияние погодных и климатических колебаний на динамику численности птиц в районах гнездования исследовано в меньшей степени. Многочисленные публикации касаются в основном проблем результативности гнездования, изменения сроков миграции, начала размножения и других фенологических явлений (Соколов и др., 1999; Both et al., 2005; Соколов, 2006; Jonzen et al., 2006; Zalakevicius et al., 2006; Tottrup et al., 2010; Guillemain et al., 2013; Волков и др., 2013, 2016). Возможное воздействие на динамику численности обсуждается во многих статьях, но прямых наблюдений пока немного. В Германии гнездовая плотность пустельги (Falco tinnunculus) в значительной мере определялась зимними температурами и глубиной снежного покрова (Kostrzewa, Kostrzewa, 1991). В неблагоприятные годы птицы не могли набрать достаточной массы для того, чтобы приступить к откладке яиц. Однако метеорологические параметры не оказывали значимого влияния на другие виды – канюка (Buteo buteo), ястреба-тетеревятника (Accipiter gentilis), мохноногого сыча (Aegolius funereus) и беркута (Aquila chrysaetos) (Kostrzewa, Kostrzewa, 1991; Korpimaki, Hakkarainen, 1991; Steenhof et al., 1997). Для серой цапли (Ardea cinerea) в Англии отмечено сокращение численности гнездовой популяции после суровых зим, сопровождавшихся длительным замерзанием водоемов, поскольку птицы не могли найти достаточного количества пищи (Stafford, 1971).
В последние десятилетия отмечается нарушение цикличности в динамике обилия грызунов в ряде регионов западной и центральной Европы (Cornulier et al., 2013; Korpela, 2014; Millon et al., 2014). Затухание циклических колебаний численности грызунов должно приводить к разбалансировке связей в системах “хищник–жертва” и, вероятнее всего, к снижению численности птиц-миофагов. Для территории России подобных наблюдений пока не опубликовано, но можно предполагать существование таких тенденций в арктических и умеренных районах.
Обыкновенная пустельга, ушастая (Asio otus) и болотная (A. flammeus) совы – обычные виды открытых и частично зарастающих деревьями и кустарниками местообитаний в средней полосе европейской части России, в том числе сельскохозяйственных и селитебных. Гнездовая численность этих видов изменяется циклически и связана, прежде всего, с ежегодными изменениями кормовой базы (Cramp, 1985). Основа питания всех трех видов – грызуны, прежде всего серые полевки рода Microtus (Korpimäki, Norrdahl, 1991; Волков и др., 2009; Шариков и др., 2009). Несмотря на значительное сходство как в кормовых рационах, так и в выборе гнездовых и охотничьих местообитаний, межгодовые флуктуации численности выбранных для исследования видов зачастую не синхронны. Можно предполагать, что помимо обилия кормовых объектов на динамику численности хищных птиц дополнительно влияют и другие факторы, в частности метеорологические и климатические (Korpimäki, 1992; Solonen, 2010 и др.).
Целью нашего исследования было изучение совместного влияния трофических и погодно-климатических факторов на динамику численности трех упомянутых выше видов птиц-миофагов.
МАТЕРИАЛ И МЕТОДИКА
Исследования проводили в северном Подмосковье в 2001–2016 гг. на стационаре площадью 48 км2, расположенном в заказнике “Журавлиная родина” (56.75732 с.ш., 37.79202 в.д.). Ежегодно в гнездовой период определяли численность хищных птиц путем картирования их гнезд, выводков и территорий. В течение сезона картирование проводилось многократно: ранней весной в период токовой активности, в середине и конце весны в период насиживания, летом в период выкармливания выводков, покинувших гнезда. В случае с болотной совой, гнездящейся на земле, гнездовыми считали пары, у которых были найдены гнезда, выводки или наблюдали многократные территориальные конфликты с другими видами хищных птиц или врановыми, принос корма к гнезду, регулярные воздушные территориальные демонстрации по защите гнездового участка. Данные учетов наносили на карты масштаба 1 : 10 000, местоположение гнезд и выводков регистрировали с помощью GPS. Учеты и стационарные наблюдения организованны таким образом, что возможность повторного учета одних и тех же пар исключена. Всего в работе используются данные по 315 гнездам/выводкам и 162 гнездовым участкам.
Относительную численность мелких млекопитающих оценивали стандартными методами (Наумов, 1963). Отловы проводили с помощью ловушек Геро дважды за сезон: весной после схода снежного покрова и летом, в первой половине июня. Первые в большей степени характеризуют численность перезимовавших мелких млекопитающих, а вторые – успешность их размножения в начале лета. Учетами были охвачены основные биотопы, используемые модельными видами для охоты и гнездования. Это, прежде всего, различные луговые сообщества и закустаренные открытые пространства. Линии по 50 давилок размещали на трое суток, проверку проводили один раз в сутки, как правило, в утренние часы. Всего за время исследования отработано 27 348 ловушко-суток.
Анализируемые метеорологические показатели рассчитаны по данным ближайшей к району наших исследований метеостанции в г. Тверь, полученным из источников NOAA Climate Prediction Center (http://www.cpc.ncep.noaa.gov). Они включают: полумесячные средние температуры со второй половины февраля до конца мая, глубину снежного покрова в феврале–апреле и количество осадков в марте–мае. В качестве климатической характеристики выбран циркуляционный индекс EA-WR (East Atlantic/West Russia Pattern) – интегральный показатель, отражающий широкомасштабные колебания атмосферных явлений в Восточной Европе. Для его расчета используются данные с нескольких десятков метеостанций, и в многочисленных работах показано влияние этих индексов на основные гидрометеорологические поля в атлантико-европейском регионе. В период положительной фазы EA-WR наблюдаются относительно более сухая и жаркая погода в европейских регионах России (Barnston, Livezey, 1987).
Анализ возможной зависимости динамики численности хищников от условий среды проводили с помощью метода построения обобщенных линейных моделей (GLM) с логарифмической функцией связи и пуассоновским распределением зависимой переменной (Zuur et al., 2009). Используя метод главных компонент, мы объединили исходные показатели в два основных обобщающих фактора – трофический (фактор 1) и климатический (фактор 2). Трофический фактор отражает ситуацию с кормовой базой, т.е. численностью серых полевок и мышевидных грызунов в целом в весенний и летний периоды. В качестве климатического фактора был выбран интегральный ежемесячный индекс EA-WR (за март–май), который в обобщенном виде характеризует климатические условия в восточной Европе через оценку температуры, атмосферного давления и уровня осадков. В качестве зависимой переменной использовали число ежегодно гнездящихся пар хищников на модельной территории, а в качестве независимых – объединенные факторы. При анализе корреляции численности птиц с упомянутыми факторами использованы материалы только за 2004–2016 гг. Для проверки равенства медиан нескольких выборок использовали непараметрический критерий Краскела-Уоллиса (Н). Статистическую обработку данных осуществляли в программе Statistica 8.0 (StatSoft, Inc., 2007).
РЕЗУЛЬТАТЫ
Динамика численности хищных птиц. С 2001 по 2016 гг. у каждого из модельных видов зарегистрировали по 4–5 пиков высокой численности: у ушастой совы – в 2003, 2007, 2013 и 2016 гг.; у болотной совы – в 2004, 2007, 2010, 2013 и 2016 гг.; у пустельги – в 2003, 2010, 2013 и 2016 гг. (рис. 1). У всех трех видов пики высокой численности совпали только дважды – в 2013 и 2016 гг. У ушастой совы не было высокой численности в потенциально благоприятном по кормовым условиям 2010 г., а у пустельги – в 2007 г. Численность болотной совы в течение анализируемого периода времени коррелировала с численностью ушастой совы (rs = 0.7, p ≤ 0.05) и пустельги (rs = 0.67, p ≤ ≤ 0.05). Корреляции численности ушастой совы и пустельги не обнаружено (rs = 0.38, p = 0.15).
Рис. 1.
Динамика численности ушастой совы (1), болотной совы (2) и пустельги (3) на модельной территории в 2001–2016 гг.
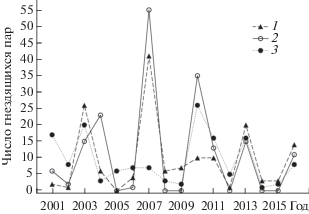
В анализируемый период пики высокой численности у болотной совы происходили через каждые 3 года, у пустельги интервал между ними составлял 7 лет и дважды по 3 года, у ушастой совы – 4, 6 и 3 года (рис. 1). Средняя численность (медиана) гнездящихся на модельной территории пар ушастой и болотной сов была равной 6 и 4 пары, соответственно, а у пустельги – 7 пар. В отдельные годы ушастая и болотная совы на модельной территории не гнездились.
Начало и продолжительность гнездового периода у видов различались. У ушастой совы он был наиболее растянут – самые ранние известные нам даты начала откладки яиц приходились на конец февраля, а самые поздние – на начало июня (медиана 31 марта, n = 24). У болотной совы эти даты варьировали от конца марта до середины июня (медиана 9 апреля, n = 9), а у обыкновенной пустельги – с начала второй декады апреля до середины июня (медиана 1 мая, n = 5). Таким образом, формирование итоговой численности этих трех видов происходит в районе исследований в период с конца февраля по первую половину июня. Поэтому в наибольшей степени на ежегодное число гнездящихся пар должны влиять условия среды в этот отрезок времени.
Влияние обилия добычи на численность птиц-миофагов. На модельной территории зарегистрировано 14 видов мелких млекопитающих – потенциальной добычи изучаемых хищников: 4 вида землеройкообразных (Soricomorpha): обыкновенная (Sorex araneus), малая (S. minutus), равнозубая (S. isodon), средняя (S. caecutiens) бурозубки и 10 видов мышевидных грызунов (Myomorpha): обыкновенная полевка (Microtus arvalis), темная полевка (M. agrestis), полевка-экономка (M. oeconomus), рыжая полевка (Clethrionomys glareolus), водяная полевка (Arvicola amphibius), малая лесная мышь (Sylvaemus uralensis), полевая мышь (Apodemus agrarius), домовая мышь (Mus musculus), лесная мышовка (Sicista betulina) и мышь-малютка (Micromys minutus).
Влияние обилия потенциальной добычи на численность птиц-миофагов анализировали, сгруппировав представленные в отловах виды в 3 когорты: 1) серые полевки: только представители рода Microtus (3 вида); 2) мышевидные грызуны: серые полевки и все остальные грызуны (8 видов); 3) мелкие млекопитающие: мышевидные грызуны и землеройки (14 видов).
Обилие представителей каждой из трех когорт изменялось циклически (рис. 2). В начале лета пики высокого обилия мышевидных грызунов наблюдали в 2004, 2007, 2010, 2011, 2013, 2016 гг., их периодичность за редким исключением составила 3 года. С 2009 г. доля серых полевок в отловах стала снижаться, в то же время произошло постепенное увеличение обилия рыжей полевки и малой лесной мыши, ставших обычными в населении мышевидных грызунов на модельной площадке. Возрастание суммарного обилия потенциальной добычи в годы пиков численности мелких млекопитающих до 2008–2009 гг. происходило в основном за счет увеличения обилия серых полевок (когорта 1), преимущественно обыкновенной полевки и полевки-экономки. После 2012 г. пики суммарной численности мелких млекопитающих были обусловлены преимущественно массовостью рыжей полевки и малой лесной мыши (когорта 2).
Рис. 2.
Обилие мелких млекопитающих на модельной территории в 2004 – 2016 гг. весной и летом: 1 – когорта “серые полевки”; 2 – когорта “мышевидные грызуны”; 3 – когорта “мелкие млекопитающие”.
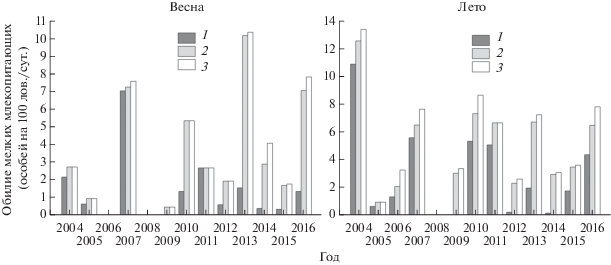
Обилие мелких млекопитающих весной, в период формирования гнездовых группировок хищных птиц, достоверно влияло на их численность (табл. 1). Для ушастой совы наиболее значимым оказалось суммарное обилие мышевидных грызунов и всех мелких млекопитающих (когорта 2 и 3), для болотной совы и пустельги самым высоким был коэффициент корреляции с обилием серых полевок (когорта 1).
Таблица 1.
Корреляция численности пустельги, ушастой и болотной сов с обилием потенциальной добычи в гнездовой период (коэффициент корреляции Спирмена, rs)
| Вид | Серые полевки | Мышевидные грызуны | Мелкие млекопитающие | |||
|---|---|---|---|---|---|---|
| Весна | Лето | Весна | Лето | Весна | Лето | |
| Asio otus | 0.56** | 0.54* | 0.64** | 0.63** | 0.63** | 0.68*** |
| Asio flammeus | 0.79*** | 0.90*** | 0.68*** | 0.81*** | 0.66** | 0.84*** |
| Falco tininculus | 0.57** | 0.58** | 0.46 | 0.45 | 0.47 | 0.46 |
В летний период обилие серых полевок (когорта 1) сохраняло значимость для всех трех видов хищных птиц, а обилие мышевидных грызунов (когорта 2) и мелких млекопитающих (когорта 3) было значимым только для сов (табл. 1). У болотной совы показатели коэффициента корреляции ее численности с обилием всех трех когорт потенциальной добычи были несколько выше в летний период, чем в весенний. У ушастой совы и пустельги значения индекса корреляции летом и весной практически не различались.
Влияние метеорологических и климатических параметров на численность птиц-миофагов. Мы рассчитали различные показатели, характеризующие погодно-климатические условия в районе исследований в период существования там гнездовых группировок сов и обыкновенной пустельги, и проанализировали влияние этих показателей на численность птиц-миофагов (табл. 2). В большинстве случаев корреляция не наблюдается.
Таблица 2.
Корреляция численности пустельги, ушастой и болотной сов с метеорологическими и климатическими параметрами (коэффициент корреляции Спирмена, rs)
| Параметр и временнóй интервал | Asio otus | Asio flammeus | Falco tininculus | |
|---|---|---|---|---|
| Средняя месячная температура | Февраль | 0.07 | –0.31 | –0.33 |
| Март | 0.12 | 0.01 | –0.52* | |
| Апрель | –0.20 | –0.27 | 0.21 | |
| Май | 0.02 | 0.13 | 0.13 | |
| Средняя температура за период | 1–15 февраля | 0.28 | –0.18 | –0.15 |
| 16–29 февраля | –0.31 | –0.59** | –0.69*** | |
| 1–15 марта | 0.05 | –0.16 | –0.58** | |
| 16–31 марта | 0.01 | –0.02 | –0.62** | |
| 1–15 апреля | 0.09 | 0.02 | 0.36 | |
| 16–31 апреля | 0.11 | –0.06 | 0.22 | |
| 1–15 мая | 0.30 | 0.26 | 0.36 | |
| 16–31 мая | 0.15 | 0.13 | 0.22 | |
| Глубина снегового покрова | Март | 0.08 | 0.29 | 0.67** |
| Апрель | –0.32 | –0.34 | 0.09 | |
| Количество осадков | Апрель | –0.06 | –0.02 | 0.18 |
| Май | –0.49* | –0.62** | –0.43* | |
| Индекс EA-WR | Март | –0.09 | 0.22 | 0.41 |
| Апрель | 0.21 | 0.04 | –0.40 | |
| Май | –0.21 | –0.29 | –0.57** | |
Корреляция с некоторыми погодно-климатическими факторами обнаружена только для численности пустельги и болотной совы. Чем более холодные условия были в конце февраля и в марте, и чем больше была глубина снега в марте, тем выше оказывалась гнездовая численность пустельги. Помимо этого ее численность отрицательно коррелировала со значением климатического индекса в мае. Численность территориальных пар болотной совы отрицательно коррелировала с температурой конца февраля – начала периода предгнездовых перемещений этого вида, а также с количеством осадков в мае – в период откладки и насиживания яиц.
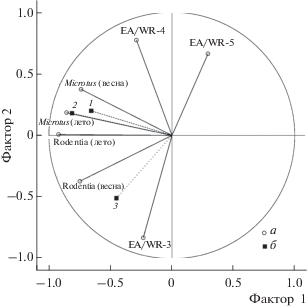
Оценка совокупного влияния климатических и трофических факторов на динамику численности птиц-миофагов. Можно предположить, что трофические и метеорологические факторы влияют на численность птиц-миофагов совместно, дополняя друг друга. Для проверки этой гипотезы мы объединили методом главных компонент трофические и погодно-климатические параметры в два обобщающих фактора для дальнейшего анализа их возможного совместного влияния на численность птиц (рис. 3). Этот анализ показал, что численность ушастой и болотной сов положительно коррелирует с весенним и летним обилием серых полевок (когорта 1) и летним обилием мышевидных грызунов (когорта 2). Численность пустельги положительно коррелирует с весенним обилием мышевидных грызунов (когорта 2) и климатическими характеристиками марта.
Рис. 3.
Результаты объединения методом главных компонент параметров сезонной численности грызунов и циркуляционных индексов EA–WR в два фактора: климатический (ось X, Фактор 1) и трофический (ось Y, Фактор 2). а – факторные нагрузки основных переменных: весенней и летней численности полевок рода Microtus или суммарное обилие мышевидных грызунов (Rodentia), а также значения нагрузок климатических индексов EA-WR в марте, апреле и мае (месяц обозначен цифрой). б – факторные нагрузки вспомогательных переменных: 1 – численность гнездящихся пар ушастой совы, 2 – болотной совы, 3 – пустельги.
Все 13 лет наблюдений можно условно разбить на 4 группы, различающиеся различной комбинацией трофического и погодно-климатического факторов. К первой группе относятся 2004, 2007, 2011 гг., попавшие в 1-й сектор на графике (рис. 4). В эти годы наблюдалось наиболее благоприятное для птиц-миофагов сочетание факторов: высокое обилие грызунов, теплая и сухая погода. Во второй сектор попали 2010, 2013 и 2016 гг., отличавшиеся хорошими кормовыми условиями, но влажной и относительно холодной погодой в начале гнездования. 2008, 2009, 2014, 2015 гг., относящиеся к третьему сектору, характеризовались низкими показателями обилия грызунов, но в целом благоприятными погодными условиями. В четвертом секторе сгруппированы сезоны, отличавшиеся низким обилием грызунов и неблагоприятными для гнездования погодными характеристиками: низкой температурой и высокой влажностью (2005, 2006 и 2012 гг.).
Рис. 4.
Характеристика сезонов исследований 2004–2016 гг. (1) и распределение численности ушастой совы (2), болотной совы (3) и пустельги (4) в зависимости от сочетания трофических (Фактор 1) и погодно-климатических (Фактор 2) условий. Точки на графиках соответствуют конкретному году, цифрой рядом обозначено количество пар данного вида в определенный год.
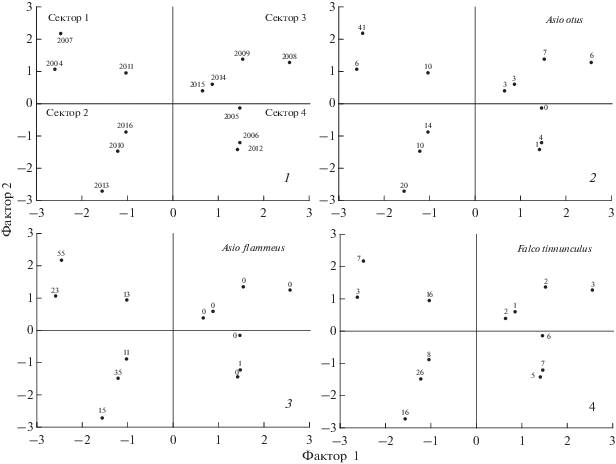
Применение критерия Краскела-Уоллиса показало статистически достоверные различия средних показателей (медиан) численности ушастой совы (H (3, 13) = 8.8, p = 0.03), болотной совы (H (3, 13) = 10.2, p = 0.02) и пустельги (H (3, 13) = = 9.4, p = 0.02) между анализируемыми секторами (табл. 3).
Таблица 3.
Характеристика (медиана) численности хищных птиц, обилия грызунов и метеорологических условий в разные сезоны, ранжированные методом главных компонент (см. рис. 4)
| Параметр | Номер сектора | |||
|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |
| Численность, пар | ||||
| Asio otus | 19.0 | 14.0 | 4.5 | 1.0 |
| Asio flammeus | 30.3 | 15.0 | 0 | 0 |
| Falco tinnunculus | 8.7 | 16.0 | 2.0 | 6.0 |
| Средняя температура с марта по май, °С | 6.2 | 6.7 | 6.6 | 4.4 |
| Сумма осадков с марта по май, мм | 91.3 | 157.0 | 159.0 | 199.0 |
| Обилие, особей на 100 лов./сут. | ||||
| Microtus весной | 3.9 | 1.3 | 0.2 | 0.6 |
| Rodentia весной | 4.2 | 7.0 | 1.1 | 0.9 |
| Microtus летом | 7.2 | 4.4 | 0.1 | 0.6 |
| Rodentia летом | 8.6 | 6.7 | 3.0 | 2.1 |
По относительной благоприятности условий для гнездования выделяются 1 и 2 сектора, когда численность всех трех видов птиц-миофагов значительно выше (табл. 3). Для этих сезонов характерно высокое обилие потенциальной добычи. Весенняя температура в такие сезоны может быть в среднем как относительно высокой (рис. 4, сектор 1), так и относительно низкой (сектор 2). При этом при низких температурах обычно ниже численность сов (табл. 3).
В годы с низким обилием потенциальной добычи (сектор 3 и 4 на рис. 4) численность всех трех видов птиц-миофагов существенно снижается, в 3 раза и более. При этом реакция исследуемых видов на разные сочетание температуры и осадков в такие годы несколько различна (табл. 3): большее число пар ушастой совы приступают к гнездованию в сухие и относительно теплые сезоны, а пустельги – во влажные и холодные. Болотные совы не гнездятся в районе исследований в сезоны с недостаточной кормовой базой.
Для того чтобы одновременно оценить и сравнить влияние трофического и климатического факторов на численность трех видов хищников, был применен регрессионный анализ (табл. 4). Результаты моделирования показали, что на численность ушастой совы достоверно влияет только трофический фактор. Для болотной совы и пустельги статистически значимыми оказались оба фактора. Степень влияния кормовых условий на изменение численности хищников была наибольшей для болотной и наименьшей для пустельги. У пустельги влияние климатических факторов несколько превышало по значимости действие трофического фактора. У болотной совы действие климатического фактора было в 4.5 раза меньше, чем трофического.
Таблица 4.
Оценка связи (β коэффициент ±SE) численности хищных птиц и параметров среды, полученная по результатам моделирования методом обобщенных линейных моделей (GLM)
| Параметр модели | Asio otus | Asio flammeus | Falco tinnunculus |
|---|---|---|---|
| Интерсепт | 1.99 ± 0.11* | 1.39 ± 0.19* | 1.88 ± 0.12* |
| Фактор 1 (трофический) | 0.77 ± 0.10* | 1.64 ± 0.16* | 0.38 ± 0.12* |
| Фактор 2 (климатический) | 0.03 ± 0.09 | 0.36 ± 0.09* | 0.48 ± 0.09* |
ОБСУЖДЕНИЕ
Занимая верхние трофические уровни, хищные птицы составляют важную часть природных экосистем. Изменение их численности – отражение происходящих в природных сообществах процессов, поэтому может быть использовано в качестве индикатора текущего состояния и прогноза устойчивости этих сообществ, в том числе в условиях меняющегося климата.
Болотная сова, ушастая сова и пустельга – облигатные миофаги, значительную часть рациона которых, вне зависимости от региона и сезона, составляют мелкие млекопитающие, преимущественно мышевидные грызуны. Чаще всего они добывают грызунов из рода серых полевок (Korpimäki, 1987; Korpimäki, Norrdahl, 1991; Шариков и др., 2009), соответственно весеннее и летнее обилие именно этой когорты оказывает наибольшее влияние на динамику численности хищников. Но влияние трофического фактора на динамику численности не одинаково выражено у изученных видов птиц. Максимальная зависимость обнаружена для болотной совы, а наименьшая – для пустельги. Выявленные различия могут быть обусловлены разной шириной кормового спектра этих видов: в районе исследований он наибольший у пустельги, а наименьший – у болотной совы (Шариков и др., 2009; Буслаков, 2012).
Рост среднемесячных температур в зимний и весенний периоды, отмечаемый во многих регионах Европы, включая Подмосковье (Волков и др., 2013), способствует более раннему снеготаянию, смещению сроков паводка и более раннему началу вегетации. В арктических районах последствия подобных климатических изменений наиболее заметны и могут быть весьма значительны, влияя в естественных сообществах на демографические и пространственные характеристики популяций различных видов (Henden et al., 2008; Gilg et al., 2009; Schmidt et al., 2012; Barraquand et al., 2013 и др.). В умеренной зоне влияние потепления климата на динамику численности мелких мышевидных грызунов, а через них и на хищников пока слабо изучено, однако не исключено, что оно также имеет широкомасштабные последствия. В частности, некоторые исследователи объясняют исчезновение цикличных изменений численности у мышевидных грызунов в Западной и Центральной Европе именно потеплением климата (Hörnfeldt 2004; Ims et al., 2008; Cornulier et al., 2013). Для многих видов, населяющих очень разные типы местообитаний, локальные причины, например фрагментация лесных массивов или зарастание сельхозугодий, не могут полностью объяснить наблюдаемые тренды резкого снижения численности или изменения ее динамики (Hörnfeldt, 2004; Hörnfeldt et al., 2006). Так, в Великобритании снижение суровости зим привело к смещению сроков начала гнездования у оседлых серых неясытей; зимняя погода во многом определяла также результативность размножения этого вида, в частности количество успешно выращенных слетков, хотя связь между погодой и колебаниями численности сов не была установлена (Millon et al., 2014).
Продолжительность снежного периода может определять характер цикличности изменений численности полевок в умеренной зоне (Hansson, Henttonen, 1985; Hansson, 1999; Taylor et al., 2013). Сокращение этого периода считают причиной выравнивания амплитуды колебаний обилия представителей этой группы мелких грызунов с продвижением к югу. То есть имеются указания на то, что их популяционная динамика несомненно чувствительна к климатическим факторам, хотя прямые корреляции исследователями зачастую найти не удается. Предполагается, что цикличность колебаний численности полевок в районах, где снежный покров держится дольше, более выражена за счет снижения влияния хищников-генералистов (Hansson, Henttonen, 1985; Hansson, 1987; Norrdahl, Korpimäki, 2002) и сокращения сезона размножения (Taylor et al., 2013).
В Италии изменения климата привели к перестройке сообществ мелких млекопитающих, в которых все больше стали доминировать южные ксерофильные виды, и это повлияло на изменение состава добычи у сипухи (Szpunar et al., 2008). В районе наших исследований также происходит перестройка сообществ мелких млекопитающих – доминировавшая ранее в населении грызунов открытых сельскохозяйственных ландшафтов обыкновенная полевка в последнее время имеет низкую численность. Если до 2009 г. динамика обилия мышевидных грызунов была обусловлена преимущественно вспышками численности обыкновенной полевки, то на современном этапе колебания ее численности имеют невысокую амплитуду и слабо влияют на суммарное обилие мышевидных грызунов. Уменьшение амплитуды колебаний у этого вида определялось в основном не изменением климата, а происходившей в те же годы кардинальной перестройкой структуры биотопов вплоть до значительного зарастания их древесно-кустарниковой растительностью при выведении обширных угодий из хозяйственного оборота в годы кризиса сельского хозяйства (Свиридова и др., 2006, 2016). В результате, в населении мелких млекопитающих возросло участие экотонных и лесных видов – рыжей полевки, малой лесной мыши. Цикличность динамики численности мышевидных грызунов сохраняется, но из-за изменений в видовом составе, при сохранении амплитуды колебаний, промежутки между годами с высокой численностью стали непредсказуемыми. Наблюдения на заброшенных сельхозугодиях в Испании показывают сходные тенденции (Torre et al., 2015).
Локальные метеорологические условия могут влиять на динамику численности хищников либо напрямую, либо опосредованно через изменения численности их жертв (Millon et al., 2014). Однако влияние температурных условий зимы, так же как и глубины снежного покрова, на динамику численности мелких грызунов часто не подтверждается статистически (Steenhof et al., 1997; Korpela, 2014). В то же время, значительные изменения погодных условий в позднезимний и весенний периоды негативно влияют на сроки начала и успешность размножения грызунов, вызывая заметное снижение их численности (Aars, Ims, 2002; Bierman et al., 2006; Korslund, Steen, 2006; Korpela, 2014).
Демографические показатели локальных популяций хищников не всегда связаны исключительно с обилием кормовой базы в тот или иной год. Это становится особенно заметным в годы с холодной и дождливой погодой, когда неблагоприятные условия приводят к снижению численности и успешности размножения миофагов. Степень влияния погодных условий на разные виды не одинакова. Для ушастой совы метеорологические условия в районе размножения не значимы, а для болотной совы и пустельги погода оказалась значимой в период, непосредственно предшествующий их прилету в район гнездования. Причина таких различий между видами, скорее всего, заключается в особенностях их жизненных циклов: ушастая сова обычно совершает кочевки на относительно короткие расстояния от мест гнездования, а в отдельные годы может оставаться зимовать в районе исследований. Соответственно, погодные условия в конце зимы–начале весны для этого вида не столь важны, а птицы ориентируются на обилие и доступность добычи. Болотная же сова и пустельга мигрируют на более дальние расстояния, и потенциально имеют больше возможностей для выбора района размножения. Холодная погода весной в северных частях их гнездового ареала может задерживать птиц этих видов в южных регионах, в том числе и в районе наших исследований, где часть из них приступает к гнездованию. Подобная ситуация наблюдается у некоторых мигрирующих воробьиных птиц, гнездовая численность которых может локально возрастать в условиях холодной весны (Соколов, 2006).
Таким образом, помимо обилия потенциальной добычи, на динамику численности пернатых хищников могут влиять климатические и локальные метеорологические факторы. Амплитуда колебаний численности птиц-миофагов определяется в первую очередь обилием добычи. Однако абиотические факторы среды (прежде всего сочетания температуры и влажности в весенний период) могут вносить существенные коррективы как в амплитуду колебаний численности миофагов, так и в частоту формирующихся пиков или спадов численности хищных птиц.
БЛАГОДАРНОСТИ
Авторы благодарны О.С. Гринченко за всестороннюю помощь в проведении полевых исследований в заказнике “Журавлиная родина”, а также А.В. Макарову за предоставленный полевой материал по пустельге за 2001–2003 гг. и А.А. Лисовскому, сделавшему ценные замечания по структуре и содержанию рукописи. Большое спасибо также всем нашим коллегам, особенно студентам, аспирантам и сотрудникам кафедры зоологии и экологии МПГУ за помощь при сборе и обработке полевого материала.
Список литературы
Буслаков В.В., 2012. Разнообразие и изменчивость питания обыкновенной пустельги в северном Подмосковье // Хищные птицы в динамической среде третьего тысячелетия: состояние и перспективы. Кривой Рог: Издатель ФЛ-П Чернявский Д.А. С. 420–422.
Волков С.В., Гринченко О.С., Свиридова Т.В., 2013. Сроки прилета серого журавля (Grus grus) в северном Подмосковье и их связь с погодными и климатическими факторами // Зоологический журнал. Т. 92. № 7. С. 834–840.
Волков С.В., Гринченко О.С., Свиридова Т.В., 2016. Влияние погодных и климатических колебаний на изменение сроков осенней миграции серого журавля (Grus grus) в северном Подмосковье // Зоологический журнал. Т. 95. № 10. С. 1182–1191.
Волков С.В., Шариков А.В., Басова В.Б., Гринченко О.С., 2009. Влияние обилия мелких млекопитающих на выбор местообитаний и динамику численности ушастой (Asio otus) и болотной (Asio flammeus) сов // Зоологический журнал. Т. 88. № 10. С. 1248–1257.
Литвин К.Е., Овсяников Н.Г., 1990. Зависимость размножения и численности белых сов и песцов от численности леммингов на острове Врангеля // Зоологический журнал. Т. 69. № 4. С. 52–64.
Наумов Р.Л., 1963. Организация и методы учета птиц и вредных грызунов. М.: Изд-во АН СССР. 137 с.
Пианка Э., 1981. Эволюционная экология. М.: Изд-во Мир. 400 с.
Свиридова Т.В., Волков С.В., Гринченко О.С., Зубакин В.А., Конторщиков В.В. и др., 2006. Влияние интенсивности сельскохозяйственной деятельности на птиц агроландшафтов северного Подмосковья // Труды XII междунар. орнитол. конф. Ставрополь. С. 371–399.
Свиридова Т.В., Волков С.В., Гринченко О.С., Кольцов Д.Б., 2016. Мониторинг птиц и их местообитаний в сельскохозяйственных ландшафтах северного Подмосковья: итоги 20-летних наблюдений // Птицы и сельское хозяйство: современное состояние, проблемы и перспективы изучения. М. С. 268–277.
Соколов Л.В., 2006. Влияние глобального потепления климата на сроки миграции и гнездования воробьиных птиц в ХХ веке // Зоологический журнал. Т. 85. № 3. С. 317–341.
Соколов Л.В., Марковец М.Ю., Шаповал А.П., Морозов Ю.Г., 1999. Долговременный мониторинг сроков весенний миграций у воробьиных птиц на Куршской косе // Зоологический журнал. Т. 78. № 6. С. 709–717.
Шариков А.В., Холопова Н.С., Волков С.В., Макарова Т.В., 2009. Обзор питания сов в Москве и Подмосковье // Совы Северной Евразии: экология, пространственное и биотопическое распределение. М. С. 188–203.
Aars J., Ims R.A., 2002. Intrinsic and climatic determinants of population demography: The winter dynamics of tundra voles // Ecology. V. 83. P. 3449–3456.
Barnston A.G., Livezey R.E., 1987. Classification, seasonality and persistence of low-frequency atmospheric circulation patterns // Monthly Weather Review. V. 115. P. 1083–1126.
Barraquand F., Høye T.T., Henden J-A., Gilg O., Schmidt N.M. et al., 2013. Demographic responses of a site-faithful and territorial predator to its fluctuating prey: long-tailed skuas and arctic lemmings // Journal of Animal Ecology. V. 83. P. 375–387.
Bierman S.M., Fairbairn J.P., Petty S.J., Elston D.A., Tidhar D., Lambin X., 2006. Changes over time in the spatiotemporal dynamics of cyclic populations of field voles (Microtus agrestis L.) // American Naturalist. V. 167. P. 583–590.
Both C., Piersma T., Roodbergen S.P., 2005. Climate change explains much of the 20th century advance in laying date of Northern Lapwing Vanellus vanellus in The Netherlands // Ardea. V. 93. № 1. P. 79–88.
Cornulier T., Yoccoz N.G., Bretagnolle V., Brommer J.E., Butet A., et al., 2013. Europe-Wide Dampening of Population Cycles in Keystone Herbivores // Science. V. 340. № 6128. P. 63–66.
Cramp S. 1985. The Birds of the Western Palearctic. V. 4. Oxford: Oxford University Press. 960 p.
Gilg O., Sittler B., Hanski I., 2009. Climate change and cyclic predator–prey population dynamics in the high Arctic // Global Change Biology. V. 15. P. 2634–2652.
Guillemain M., Pöysä H., Fox A.D., Arzel C., Dessborn L., et al., 2013. Effects of climate change on European ducks: what do we know and what do we need to know? // Wildlife Biology. V. 19. № 4. P. 404–419.
Hansson L., 1987. An interpretation of rodent dynamics as due to trophic interactions // Oikos. V. 50. P. 308–318.
Hansson L., 1999. Intraspecific variation in dynamics: small rodents between food and predation in changing landscapes // Oikos. V. 86. P. 159–169.
Hansson L., Henttonen H., 1985. Gradients in density dariations of small rodents – the importance of latitude and snow cover // Oecologia. V. 67. P. 394–402.
Henden J-A, Bårdsen B-J, Yoccoz N.G, Ims R.A., 2008. Impacts of differential prey dynamics on the potential recovery of endangered arctic fox populations // Journal of Applied Ecology. V. 45. P. 1086–1093.
Hörnfeldt B., 2004. Long-term decline in numbers of cyclic voles in boreal Sweden: analysis and presentation of hypotheses // Oikos. V. 107. P. 376–392.
Hörnfeldt B., Christensen P., Sandström P., Ecke F., 2006. Long-term decline and local extinction of Clethrionomys rufocanus in boreal Sweden // Landscape Ecol. V. 21. P. 1135–1150.
Ims R.A., Henden J., Killengreen S.T., 2008. Collapsing population cycles // Trends in Ecology & Evolution. V. 23. P. 79–86.
Jonzen N., Linden A., Ergon T., Knudsen E., Vik J.O., et al., 2006. Rapid advance of spring arrival dates in long-distance migratory birds // Science. V. 312. № 5782. P. 1959–1961.
Korpela K., 2014. Biological Interactions in the Boreal Ecosystem Under Climate Change – Are the Vole and Predator Cycles Disappearing? Jyväskylä: University of Jyväskylä. 57 p.
Kostrzewa R., Kostrzewa A., 1991. Winter weather, spring and summer density, and subsequent breeding success of Eurasian kestrels common buzzards and northern goshawks // Auk. V. 108. P. 342–347.
Korpimäki E., 1984. Population dynamics of birds of prey in relation to fluctuations in small mammal populations in western Finland // Annales Zoologici Fennici. V. 21. P. 287–293.
Korpimäki E., 1987. Dietary shifts, niche relationships and reproductive output of coexisting Kestrels and Long-eared Owls // Oecologia. V. 74. P. 277–285.
Korpimäki E., 1992. Population dynamics of Fennoscandian owls in relation to wintering conditions and between-year fluctuations of food // The ecology and conservation of European owls. Peterborough. P. 1–10.
Korpimäki E., Norrdahl K., 1991. Do breeding nomadic avian predators dampen population fluctuations of small mammals? // Oikos. V. 62. P. 195–208.
Korpimaki E, Norrdahl K., 1991. Numerical and functional responses of kestrels, short-eared owls, and long-eared owls to vole densities // Ecology. V. 72. P. 814–826.
Korslund L., Steen H., 2006. Small rodent winter survival: snow conditions limit access to food resources // Journal of Animal Ecology. V. 75. P. 156–166.
Millon A., Petty S.J., Little B., Gimenez O., Cornulier T., Lambin X., 2014. Dampening prey cycle overrides the impact of climate change on predator population dynamics: a long-term demographic study on tawny owls // Global change biology. V. 20. № 6. P. 1770–1781.
NOAA Climate Prediction Center. [Электронный ресурс]. Режим доступа: http://www.cpc.ncep.noaa.gov. Дата обновления: 05.12.2017.
Newton I., 2010. Population ecology of raptors. Berkhamsted: A&C Black. 399 p.
Norrdahl K., Korpimäki E., 2002. Seasonal changes in the numerical responses of predators to cyclic vole populations // Ecography. V. 25. P. 428–438.
Schmidt N.M., Ims R.A., Høye T.T., Gilg O., Hansen L.H., et al., 2012. Response of an arctic predator guild to collapsing lemming cycles // Proceedings of the Royal Society of London B: Biological Sciences. V. 279. № 1746. P. 4417–4422.
Solonen T., 2010. Reflections of winter season large-scale climatic phenomena and local weather conditions in abundance and breeding frequency of vole-eating birds of prey // Trends in ornithology research. New York: Nova. P. 95–119.
Steenhof K., Kochert M., Mcdonald T., 1997. Interactive effects of prey and weather on Golden Eagle reproduction // Journal of Animal Ecology. V. 66. № 3. P. 350–362.
Stafford J., 1971. Heron populations of England and Wales 1928–1970 // Bird Study. V. 18. P. 218–221.
StatSoft, Inc., 2007. STATISTICA (data analysis software system), version 8. www.statsoft.com.
Steenhof K., Kochert M.N., McDonald T.L., 1997. Interactive effects of prey and weather on golden eagle reproduction // Journal of Animal Ecology. V. 66. P. 350–362.
Stenseth N.C., Mysterud A., Ottersen G., Hurrell J.W., Chan K.S., Lima M., 2002. Ecological effects of climate fluctuations // Science. V. 297. P. 1292–1296.
Sundell J., Huitu O., Henttonen H., Kaikusalo A., Korpimäki E., et al., 2004. Large scale spatial dynamics of vole populations in Finland revealed by the breeding success of vole eating avian predators // Journal of Animal Ecology. V. 73. P. 167–178.
Szpunar G., Aloise G., Mazzotti S., Nieder L., Cristaldi M., 2008. Effects of global climate change on terrestrial small mammals communities in Italy // Fresenius Environmental Bulletin. V. 17. P. 1526-1533.
Taylor R.A., White A., Sherratt J.A., 2013. How do variations in seasonality affect population cycles? // Proceedings of the Royal Society of London B: Biological Sciences. V. 280. 20 122 714; doi 10.1098/rspb.2012.2714
Tome D., 2003. Functional response of the Long-eared Owl (Asio otus) to changing prey numbers: a 20-year study // Ornis fennica. V. 80. № 2. P. 63–70.
Torre I., Gracia-Quintas L., Arrizabalaga A., Baucells J., Díaz M., 2015. Are recent changes in the terrestrial small mammal communities related to land use change? A test using pellet analyses // Ecological Research. V. 30. № 5. P. 813–819.
Tottrup A.P., Rainio K., Coppack T., Lehikoinen A., Rahbek C., Thorup K., 2010. Local temperature fine-tunes the timing of spring migration in birds // Integrative and Comparative Biology. V. 50. P. 293–304.
Zalakevicius M., Bartkeviciene G., Raudonikis L., Janulaitis J., 2006. Spring arrival response to climate change in birds: a case study from Eastern Europe // Journal of Ornithology. V. 147. P. 326–343.
Zuur A.F., Ieno E.N., Walker N.J., Saveliev A.A., Smith G.M., 2009. Mixed effects models and extensions in ecology with R. New York: Springer, NY U.S.A. 574 p.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


