Зоологический журнал, 2019, T. 98, № 2, стр. 182-192
Поведение молоди окуня Perca fluviatilis (Percidae) в гетеротермальной среде при разной обеспеченности пищей
А. К. Смирнов 1, *, Е. С. Смирнова 1
1 Институт биологии внутренних вод им. И.Д. Папанина РАН
152742
пос. Борок, Россия
* E-mail: smirnov@ibiw.yaroslavl.ru
Поступила в редакцию 05.03.2018
После доработки 23.05.2018
Принята к публикации 27.04.2018
Аннотация
Среди множества факторов окружающей среды, воздействию которых подвергается молодь рыб, температура и доступная пища являются одними из ключевых. В экспериментальных условиях было исследовано взаимодействие пищевых и терморегуляционных поведенческих реакций на примере годовиков речного окуня. В опытах продолжительностью 10 суток отслеживали поведение рыб, находящихся в температурно-неоднородной среде с различным уровнем насыщения кормовыми организмами: “избыточном” (кормовые объекты в количестве 20% от совокупной массы рыб в каждом из отсеков экспериментальной установки), “ограниченном” (3%) и “нулевом” (0%). Полученные значения окончательных избираемых температур достоверно различались и составили 26, 24 и 22°C соответственно. Двигательная активность рыб была минимальной при избыточном количестве пищи. Масса корма, съеденного молодью в течение 15 мин, фактически не зависела от насыщения среды кормовыми организмами. При “избыточном” и “ограниченном” уровне насыщения среды кормом его потребление составляло 14.2 и 15.2% от массы тела рыб, соответственно. Несмотря на это, прирост особей был отмечен только при избытке кормовых организмов, что, вероятно, определялось меньшей двигательной активностью молоди. Полученные данные могут быть полезны при оценке доминирующих форм поведения молоди рыб как в экспериментальных, так и полевых условиях.
Успешное существование эктотермных организмов в среде, подверженной значительным колебаниям температур, обеспечивается наличием у них развитого комплекса физиолого-биохимических адаптаций (Озернюк, 2000; Hochachka, Somero, 2014). Тем не менее, на изменения, происходящие в окружающем пространстве, животные реагируют, прежде всего, с помощью поведения (Hutchison, Maness, 1979; Bicego et al., 2007). Реализация тех или иных терморегуляционных поведенческих реакций в значительной мере определяет качество условий обитания организма, а также обеспечивает ему максимально возможные темпы роста и развития (Brett, 1971; Крогиус, 1974; Neverman, Wurtsbaugh, 1994; Gutowsky et al., 2017 и др.).
Достаточное и регулярное снабжение пищей служит не менее важным фактором, определяющим успешность существования гидробионтов. Однако в естественной среде доступность кормовых ресурсов может быть ограничена рядом факторов (например, присутствие хищников, сильная рассредоточенность кормовых объектов и др.). Также временами возникают ситуации пространственного разделения зон, оптимальных по термическому режиму и по доступности пищи. В этих случаях для поведения рыб характерно появление суточных вертикальных миграций между слоем воды благоприятным по температурным условиям и слоем богатыми кормовыми организмами, что было хорошо изучено для лососевых и сиговых рыб, обитающих в водоемах с выраженной летней стратификацией (Brett, 1971; Крогиус, 1974; Bevelhimer, Adams, 1993 и др.). Кроме того, в литературе имеется информация о существовании суточных горизонтальных миграций у лососевых в реках, где температура воды и трофические условия верховьев и низовьев различны (Armstrong et al., 2013). Значительно меньше исследований на эту тему было выполнено на видах рыб из других систематических групп (Neverman, Wurtsbaugh, 1994; Garner et al., 1998). Во всех этих работах было показано, что реализуя определенные схемы поведения (регулярные миграции между участками оптимальными либо по температурному, либо по трофическому фактору), рыбы получали значительный энергетический выигрыш.
Для молоди окуня также были отмечены суточные вертикальные миграции, а степень их проявления в значительной мере определялась спецификой водоема (Sajdlová et al., 2018). В глубоких озерах и водохранилищах с выраженным термоклином личинки и мальки этого вида днем регистрировались в нижних слоях воды, а с наступлением сумерек перемещались в прогретый и богатый кормом эпилимнион. В мелководных водоемах, в особенности с сильно заросшей литоралью, такие миграции были выражены слабее. Причину подобного поведения обычно связывают со снижением пресса хищников при переходе молоди окуня в слои воды с низкой освещенностью (Čech et al., 2017; Sajdlová et al., 2018). Следует принять во внимание, что в таких условиях рыбы значительную часть времени проводят в неблагоприятной по температурному показателю среде, тем самым лишаясь некоторой части потенциального прироста (Kratochvíl et al., 2008). Вместе с тем лабораторные исследования показывают, что молодь данного вида предпочитает температуры 24–26°C начиная с личиночного возраста и до момента полового созревания (Свирский, Лапкин, 1987; Смирнов, Смирнова, 2012). В связи с этим длительное нахождение особей при относительно низких температурах (<12°С) не только угнетает их рост, но и может приводить к гибели, что наблюдалось у молоди окуня, лишенной возможности регулярно перемещаться из холодных придонных слоев воды в прогретый эпилимнион (Čech et al., 2017). Следует также отметить, что в таких миграциях участвуют не все особи, некоторая их часть постоянно находится в теплом приповерхностном слое воды, компенсируя высокий пресс хищников повышенными показателями роста (Kratochvíl et al., 2008). В то же время нам не удалось найти в литературе количественных данных о взаимосвязи пищевого и терморегуляционного поведения у речного окуня в естественной среде. Однако согласно результатом лабораторных исследований, выполненных на сеголетках данного вида, подобные поведенческие реакции возможны (Смирнов, 2013).
Приведенные примеры обнаруживают высокую пластичность поведения гидробионтов и их врожденную способность к поиску компромиссного решения в выборе участка окружающей среды с определенным комплексом условий. Температурный и трофический компоненты экосистемы очень важны для жизнедеятельности рыб, как типичных представителей эктотермных животных. Используя широкий спектр поведенческих реакций, они способны оптимизировать процессы роста и развития даже в условиях значительной неоднородности пространственного распределения ресурсов. В связи с этим целью работы стал анализ изменений терморегуляционного и пищевого поведения молоди окуня в гетеротермальной среде при различной обеспеченности пищей.
МАТЕРИАЛ И МЕТОДИКА
Работа выполнена на молоди речного окуня, отловленной в Рыбинском водохранилище вблизи п. Борок в марте 2017 г. После вылова рыб помещали в аквариум объемом 350 л для прохождения температурной акклимации при температуре 18°С. Ее продолжительность составляла как минимум 14 суток до начала первых опытов. В этот период окуней кормили один раз в сутки личинками хирономид Chirоnomus sp. По завершении температурной адаптации рыб в количестве пяти особей помещали в отсек экспериментальной термоградиентной установки с температурой, равной температуре акклимации. Экспериментальная установка представляла собой лоток с внешними размерами 3150 × 450 × 300 мм, разделенный непрозрачными перегородками на 7 отсеков объемом около 60 л каждый. В перегородках имелись проходы размером 80 × 40 мм, позволяющие молоди окуня беспрепятственно перемещаться между отсеками. Каждый из отсеков установки имел встроенные системы терморегуляции, фильтрации и аэрации воды (рис. 1). Температура в отсеках поддерживалась на заданном уровне (18, 20, 22, 24, 26, 28, 30°С) с помощью электронного восьмиканального терморегулятора (NM8036) и цифровых датчиков (SN18B20). Световой режим 12:12 ч. Распределения рыб в установке фиксировали 24 раза в течение светлого времени суток с использованием четырех IP-камер (D‑Link DCS-2103) с последующей обработкой записей на компьютере. Ночью съемка не проводилась из-за низкой освещенности. Всего было исследовано 30 годовиков окуня со средней длиной тела 66.5 ± 1.7 мм и массой 4.0 ± 0.2 г.
Рис. 1.
Схема поперечного сечения отсека экспериментальной термоградиентной установки: 1 – рабочая камера, 2 – цифровой датчик температуры, 3 – проход между отсеками, 4 – теплообменник, 5 – нагреватель, 6 – фильтрационный материал, 7 – водяной насос, 8 – магнитный вентиль, 9 – общий для всех отсеков установки резервуар с холодной водой (8–9°С), РТ – электронный 8-канальный регулятор температуры, ХА – холодильный агрегат, УВ – уровень воды.
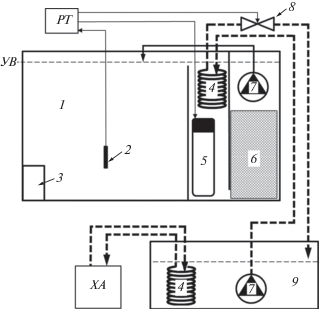
Для решения задач эксперимента опыты проводились сериями, каждая из которых состояла из двух повторностей. Продолжительность опытов 10 суток (суммарно более 60 суток). В первой серии эксперимента в течение всего опыта корм ежедневно размещали на специальных пятнах, расположенных по одному в каждом из отсеков установки. Его количество на каждом из пятен составляло 20% от совокупной массы рыб на момент их посадки. Во второй серии кормление осуществляли таким же образом, но в меньшем объеме – 3% от массы рыб. В третьей серии в течение опытов рыб не кормили.
Определение избираемых температур. При анализе экспериментальных данных рассчитывали следующие показатели: средняя избираемая молодью температура за сутки, средняя избираемая температура за период до кормления, средняя избираемая температура за период после кормления. Также определялась окончательно избираемая температура по отсутствию достоверных различий между значениями средних избираемых температур за несколько последовательных суток.
Определение двигательной активности. Двигательная активность молоди окуня в термоградиентном поле рассчитывалась на основании данных о посещении рыбами отсеков экспериментальной установки. При этом использовался тот же материал, что и для анализа избираемых температур. Двигательная активность определялась в целом за сутки (на основании 24 наблюдений распределения рыб в установке), а также отдельно за периоды до (12 наблюдений) и после (12 наблюдений) кормления. Вычисление проводилось по формуле:
ДА – двигательная активность за расчетный период,
N – число наблюдений рыб в отсеке установки за расчетный период,
Nо – удаленность отсека, выраженная в числах (1-й, 2-й, 3-й и т.д), от отсека с максимумом встречаемости рыб.
Пищевое поведение. Кормление рыб живыми личинками хирономид осуществляли один раз в середине светлого периода суток (в 14.00). Пищу в необходимом количестве (в зависимости от задач опыта) помещали на кормовые пятна. Кормовое пятно – кормушка оригинальной конструкции, располагавшаяся по одной в каждом из отсеков экспериментальной установки. Устройство кормушек предотвращало расползание личинок и позволяло извлекать из воды все несъеденные остатки. При закладке и изъятии кормовых организмов старались оказывать минимальное воздействие на экспериментальную среду. Продолжительность нахождения личинок в кормушках составляла 15 мин. В течение этого времени производилось удаленное наблюдение за посещением каждой кормушки. После этого кормушки извлекали, а несъеденные остатки взвешивали на электронных весах с точностью до 0.01 г раздельно для каждого из отсеков. Определяли процент потребленного корма от начального его количества в каждом из отсеков, а также суммарный рацион группы рыб в процентах от массы тела.
Опыты выполняли при соблюдении правил проведения научных исследований с использованием экспериментальных животных, утвержденных распоряжением Президиума АН СССР от 2 апреля 1980 N 12 000-496 и приказом Минвуза СССР от 13 сентября 1984 N 22.
Статистическая обработка данных выполнена в программном пакете STATISTICA 6.0. Для оценки достоверности различий в рационе и двигательной активности молоди окуня из разных опытов и разных повторностей применяли непараметрический критерий χ2. При сравнении избираемых температур рыб использовали непараметрический критерий Манна-Уитни.
РЕЗУЛЬТАТЫ
Терморегуляционное поведение. Во всех выполненных опытах молодь окуня демонстрировала четкую реакцию поведенческой терморегуляции. Рыбы, помещенные в отсек экспериментальной установки с температурой, равной акклимационной (18°С), после некоторого латентного периода, длившегося от 1 до 6 ч, начинали посещать отсеки с температурой свыше 24°С. Чаще всего к концу первых суток наблюдений окуни полностью покидали стартовый отсек, смещаясь в зону более высоких температур. В целом поведение молоди в эксперименте отвечало обычной схеме взаимодействия рыб с температурно-неоднородной средой (Лапкин и др., 1979; Свирский, 1996). Оно включало в себя “переходный процесс”, длившийся от 4 до 6 суток, и “период стабильного выбора”, когда среднесуточные величины избираемых температур не претерпевали значительных изменений. Как правило, в опытах отмечалась реакция “избыточного реагирования”, в ходе которой рыбы поначалу скапливались в более теплых температурных зонах, чем впоследствии. Среднесуточные значения избираемых температур, полученные в разных повторностях эксперимента, имели определенные различия, более выраженные в период “переходного процесса”, однако для лучшего восприятия графического материала они были объединены (рис. 2).
Рис. 2.
Динамика температур, избираемых молодью окуня в средах с различным уровнем кормовых ресурсов: 1 – в каждый отсек установки помещали живых личинок хирономид в количестве 20% от суммарной массы рыб, 2 – относительная масса корма 3% и 3 – отсутствие корма. Та – температура акклимации. Планки погрешностей – стандартная ошибка средней.
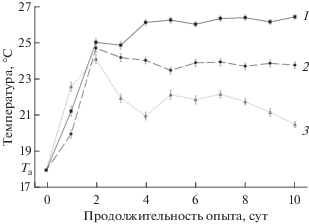
Сравнение полученных данных показало, что при различной обеспеченности кормовыми организмами молодь окуня предпочитала разные температуры. В первой серии эксперимента, когда корм в установке был в избытке, стабилизация значений избираемых рыбами температур наступала на 4-е сутки в первой повторности и на 6-е сутки во второй. Начиная с шестых суток и до конца опыта различия между средними значениями избираемой температуры в разных повторностях исчезали. Средние значения избираемых рыбами температур за этот период составили 26.2 и 26.3°C соответственно (p > 0.05). Таким образом, в качестве окончательно избираемой температуры можно указать величину ~26°С. Во второй серии, при ограничении кормовых ресурсов, значения избираемых рыбами температур стабилизировались несколько позже. Различия между данными разных повторностей опыта отсутствовали с 7-х по 10-е сутки (23.9 и 23.8°C, p > 0.05). Расчетное значение окончательно избираемой температуры в данном случае было достоверно ниже, чем в первой серии (p < 0.05), и составляло ~24°С. В третьей серии эксперимента, при полном отсутствии кормовых объектов, поведение молоди окуня отличалось заметно большей вариабельностью. Стабилизация избираемых молодью температур на одном уровне была относительно краткосрочной. В первой повторности опыта различия отсутствовали с 7-х по 9-е сутки (21.8°С), а во второй – с 7-х по 8-е сутки (21.6°С). В этот же период данные разных повторностей были близки между собой и статистически не различались (p > 0.05). В последние сутки эксперимента величины избираемых температур в отсутствии пищи снизились до 21.0 и 20.0°C соответственно. В этом случае оценка значения окончательно избираемой температуры несколько затруднена, однако исходя из наименьшего различия данных как внутри опытов, так и между повторными испытаниями, можно указать значение ~22°С.
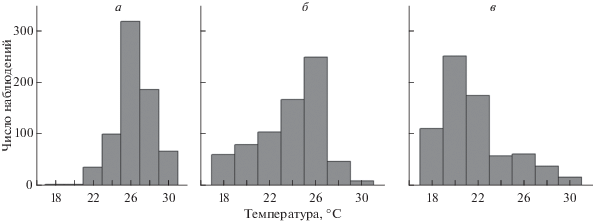
Сосредоточение молоди окуня в зоне окончательно избираемых температур не означало полного избегания ею отсеков установки с иными температурными значениями. Это хорошо видно на диаграммах распределения рыб в градиенте температур, построенных на момент стабильного выбора (рис. 3). В случае избыточного количества корма, а также при его ограничении самым посещаемым оставался отсек с температурой 26°C (44 и 35% наблюдений, соответственно). Вместе с тем в ответ на уменьшение количества пищи в кормушках возрастала частота посещения рыбами отсеков установки с низкими температурами. Полное отсутствие кормовых организмов в экспериментальной среде существенно изменяло диапазон температур, предпочитаемых молодью окуня. При этом рыбы чаще всего отмечались в отсеке с температурой 20°C (35% наблюдений), в то время как отсеки с температурой выше 22°C посещались ими относительно редко (менее 25% наблюдений).
Рис. 3.
Распределение молоди окуня в термоградиентной установке в период стабильного выбора температуры (7–10-е сутки для первой и второй серий эксперимента, 7–9-е сутки для третьей): а – пища в количестве 20% от суммарной массы рыб на каждое кормовое пятно, б – относительная масса корма 3%, в – отсутствие корма.
На протяжении светлого времени суток температурный диапазон, предпочитаемый молодью окуня, несколько изменялся (табл.1). В первой серии опыта рыбы до момента питания чаще отмечались в более теплой зоне градиента. В отличие от этого, во второй серии опытов наблюдалась обратная ситуация. В третьей серии различия между значениями избираемых температур, определенными в разное время суток, были недостоверны.
Таблица 1.
Избираемая температура и двигательная активность молоди окуня в температурно-неоднородной среде с различной обеспеченностью кормовыми ресурсами
| Масса пищи (% от совокупной массы рыб) | Избираемая температура1 за первую и вторую половину суток , °С | Двигательная активность, у.е. | Средний рацион, % | |
|---|---|---|---|---|
| за первую и вторую половину суток | среднее за опыт | |||
| 20 | 26.6 ± 0.1 | 555 | 112.1 ± 10.5 | 14.2 ± 0.7 |
| 26.0 ± 0.1* | 494 | |||
| 3 | 23.1 ± 0.2 | 792 | 142.7 ± 2.7** | 15.2 ± 1.2 |
| 24.5 ± 0.1* | 526* | |||
| 0 | 21.6 ± 0.2 | 672 | 144.7 ± 8.6** | ‒ |
| 21.9 ± 0.2 | 719 | |||
Примечания 1 Для избираемой температуры приведены усредненные данные за период стабильного выбора (7–10-е сутки для первой и второй серий эксперимента, 7–9-е сутки для третьей). * Различия между показателями, полученными в течение первой и второй половины суток, достоверны при p < 0.05. ** Различия достоверны (p < 0.05) в сравнении с первым вариантом эксперимента. Прочерк – кормление не проводилось.
Двигательная активность. Данные по молоди окуня, находящейся в гетеротермальной среде с различным уровнем обеспеченности пищей, представлены в табл. 1. Видно, что в опытах первой серии этот показатель был достоверно ниже, чем во второй и третьей (на 27 и 29% соответственно). Кроме того, двигательная активность рыб, получавших пищу в избытке, демонстрировала отрицательную регрессионную зависимость от времени нахождения в эксперименте (r = ‒0.9, R2 = 0.8 при p < 0.05). При расчете данной зависимости не учитывались первые сутки опытов, так как в это время рыбы испытывали определенный стресс от пересадки в экспериментальную установку. В случае уменьшения количества пищи на кормовых пятнах высокий уровень двигательной активности молоди сохранялся на протяжении всего опыта (r = ‒0.2, R2 = 0.05 при p > 0.05). При полном отсутствии кормовых организмов, как и при их избытке, наблюдалось достоверное снижение значений двигательной активности рыб к окончанию эксперимента (r = ‒0.7, R2 = 0.5 при p < 0.05). Средние значения двигательной активности окуней определенные для второй и третьей серии эксперимента, не различались между собой (p > 0.05).
Как и в случае реакции термопреферендума, двигательная активность рыб в течение светлого времени суток претерпевала определенные изменения (табл. 1). При избыточном кормлении молодь в первой половине дня двигалась на 11% интенсивнее, чем во второй (p > 0.05). Уменьшение количества доступной пищи значимо увеличивало эти различия до 34% (p < 0.05). Однако при полном отсутствии корма разность между показателями двигательной активности молоди, полученными в первой и второй половине дня, вновь исчезала (менее 7% при p > 0.05).
В ходе эксперимента у молоди окуня были зафиксированы случаи внутригрупповой агрессии, как правило, во время кормления. Чаще они отмечались для рыб, получавших ограниченное количество пищи (3% на кормовое пятно). Акты агрессии проявлялись не ранее чем на 6–9-е сутки опыта. Выглядело это следующим образом: одна из особей в процессе питания старалась вытеснить остальных рыб за пределы занятого ею отсека, при этом активно их преследуя. Обычно это происходило в температурных зонах, близких к оптимуму (26–28°С). При полном отсутствии в экспериментальной среде пищи агрессивного поведения не наблюдалось.
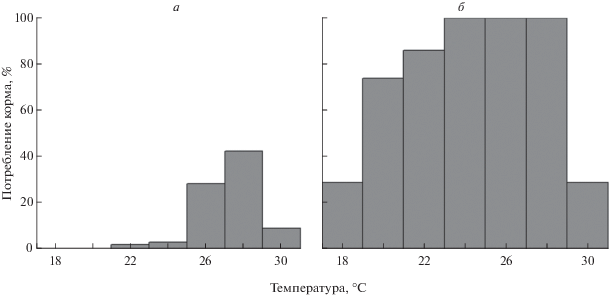
Пищевое поведение. Средний рацион рыб, определенный для опытов первой и второй серии, имел очень близкие значения (14.2 и 15.2% от массы тела соответственно, p > 0.05), несмотря на более чем шестикратные различия в количестве пищи на кормовых пятнах. И в том, и другом случае имелась четкая тенденция к повышению данного показателя к концу опыта, описываемая линейной регрессионной зависимостью (r = 0.7, R2 = 0.5 для первой серии опытов и r = 0.9, R2 = 0.8 для второй, в обоих случаях p < 0.05). К моменту окончания опытов суточный рацион рыб из обеих серий эксперимента составлял в среднем 19% от их собственной массы. В то же время широта диапазона температур, в которых питались рыбы, существенно различалась (рис. 4). При избыточном количестве корма его потребление наблюдалось на участках с температурой от 22 до 30°C, при этом бóльшая доля (82%) съеденных личинок хирономид приходилась на отсеки с температурами 26 и 28°С. Ограничение доступной пищи расширяло температурный диапазон питания фактически на все отсеки установки (18–30°С). Так как в разных сериях опыта количество личинок хирономид на кормовых пятнах значительно различалось, то и доля их потребления сильно разнилась (рис. 4). Если в первой серии эксперимента этот показатель не превышал 42% в отсеке с температурой 28°C, то для второй серии было характерно высокое потребление предоставленной в кормушках пищи от 74 до 100% в широком температурном диапазоне от 20 до 28°С.
Рис. 4.
Потребление корма молодью окуня в отсеках экспериментальной установки на 8–10-е сутки опыта (доля от задаваемого количества): а – пища в количестве 20% от суммарной массы рыб на каждое кормовое пятно, б – относительная масса корма 3%.
Несмотря на непродолжительное (10 сут) нахождение молоди окуня в опытах, у нее наблюдались определенные изменения весовых характеристик (табл. 2). В первой серии эксперимента был отмечен небольшой, но достоверный (p < 0.05) прирост суммарной массы посаженых в установку рыб (~5%). Однако во второй серии значимого увеличения массы молоди не происходило, несмотря на сходное количество потребляемого корма. Как и следовало ожидать, полное отсутствие пищи в течение опыта вызывало значительную (30%) потерю массы экспериментальными рыбами (p < 0.05).
ОБСУЖДЕНИЕ
Результаты выполненного исследования показывают, что при нахождении в температурно-неоднородной среде молодь окуня способна изменять свое терморегуляционное поведение в ответ на снижение доступности пищи. В условиях, когда в каждый из отсеков установки вносилось избыточное количество пищи, рыбы скапливались в температурной зоне ~26°С. Полученное значение является обычным для данного вида и возраста, а ранее установленные величины окончательно избираемых температур сеголеток и годовиков окуня вполне ему соответствуют (Свирский, Лапкин, 1987; Свирский, 1996; Смирнов, 2013, 2017). Вероятно, такие температуры отражают оптимум для жизнедеятельности неполовозрелых особей окуня в условиях достаточной обеспеченности пищей. Следует отметить, что подобные температурные предпочтения возникают у окуней уже на ранних этапах онтогенеза, в первые месяцы после выклева (Смирнов, Смирнова 2012). Кроме того, указанная температура избирается рыбами в течение достаточно продолжительного периода их жизни и начинает изменяться только с началом полового созревания (Свирский, Лапкин, 1987). И как было показано ранее для молоди окуня, такие предпочтения слабо зависят от температуры предварительного содержания и сезона года (Голованов, 2013).
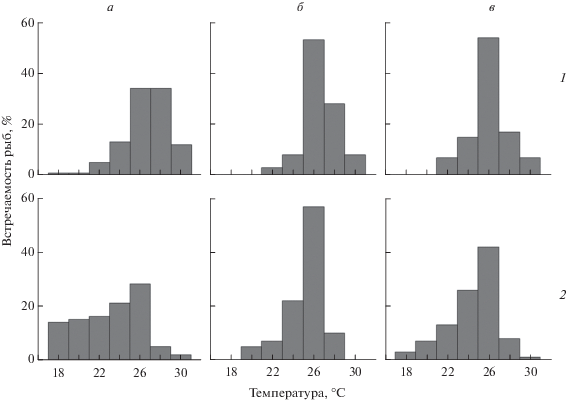
Интересен тот факт, что в течение двух часов после кормления частота встречаемости рыб в отсеке с температурой 26°C заметно возрастала (53 и 57% наблюдений для первой и второй серии эксперимента соответственно) (рис. 5). При этом в условиях ограниченного количества пищи значение избираемой окунями температуры в этот период времени увеличивалось до 25.2°C, заметно отличаясь от такового, полученного в первой половине дня, на 2.1°C (p < 0.05). В связи с этим можно предположить, что температура ~26°C также оптимальна для процессов пищеварения у исследованного вида.
Рис. 5.
Распределение молоди окуня в отсеках термоградиентной установки в опытах первой (1) и второй (2) серии (8–10-е сутки опыта): а – первая половина дня до момента кормления, б – в течение двух часов после питания, в – вторая половина дня.
Молодь окуня в полевых и лабораторных условиях демонстрирует устойчивый суточный ритм двигательной активности (Eriksson, 1978; Свирский, 1981). Как правило, период активного состояния особей приходится на светлое время суток. Вместе с тем, в естественной среде двигательная активность молоди чаще максимальна на рассвете и закате дня, что определяется целым комплексом внешних факторов (освещенность, пресс хищников и др.). В лабораторных экспериментах утренние и вечерние пики активности рыб выражены заметно слабее. Учитывая эти факты, а также технические ограничения, расчеты двигательной активности выполнялись нами только на период, когда в установке было включено освещение.
При избытке кормовых объектов в зоне температурного оптимума постепенно снижались частота и протяженность (количество и удаленность посещенных отсеков) перемещений окуней по мере нахождения рыб в установке. Молодь бóльшую часть времени проводила в отсеке с температурой 26°C, и в смежных с ним (84% наблюдений) отсеках. Кроме того, в опытах первой серии различия в показателях двигательной активности рыб в течение светлого времени суток были слабо выражены (табл. 1). Вероятно, подобный стереотип поведения предоставлял максимальные энергетические выгоды, что, в свою очередь, проявилось в достоверном приросте массы посаженных в экспериментальную установку рыб (табл. 2). Но даже в этом случае некоторую часть времени окуни проводили в отсеках с температурами, которые были на несколько градусов ниже или выше оптимального значения, тем самым расширяя диапазон воздействующих на организм температур. Такие колебания, по утверждению ряда авторов, способствуют значительному ускорению роста и развития у различных групп организмов (Кузнецов и др., 2015).
Уменьшение количества пищи вызывало достоверное снижение температуры окончательно избираемой молодью окуня на ~2°C (p < 0.05). Это было следствием того, что существенную часть времени рыбы проводили вне зоны температурного оптимума (рис. 3). Подобная реакция определялась значительным рассредоточением кормовых объектов, вследствие чего на момент стабильного выбора температуры у молоди окуня вырабатывался определенный навык поиска пищи во всем пространстве экспериментальной установки. В этих условиях, у рыб преобладает поисковое поведение, при этом отсеки с температурами, которые были ниже оптимума обследовались ими значительно чаще.
Ранее подобная реакция была отмечена для сеголеток окуня при постоянном размещении кормовых объектов вне зоны температурного оптимума (Смирнов, 2013). Величины снижения температур избираемых рыбами были схожи с установленными в данной работе. Аналогичная ситуация также была продемонстрирована на молоди осетровых (Acipenser ruthenus, A. baeri) и золотой рыбки (Carassius auratus), даже после непродолжительного (1 сут) периода голодания (Zdanovich, 2006). Таким образом, недостаточное количество пищи в зоне температурного оптимума стимулирует рыб к расширению поискового пространства в предоставленном им градиенте температур. Чаще это происходит в средах с температурой ниже оптимального значения, что, вероятно, выгоднее с точки зрения снижения затрат энергии.
Усиление поисковой активности молоди окуня во второй серии эксперимента привело к тому, что двигательная активность рыб сохранялась на высоком уровне в течение всего опыта. Встречаемость особей в отсеке с оптимальным значением температуры, а также в смежных с ним отсеках была заметно ниже (65%), чем в первой серии. Несколько неожиданными оказались повышенные значения двигательной активности окуней в первой половине дня. Предполагалось, что частота и протяженность перемещений рыб будет возрастать только на временном отрезке, связанном непосредственно с питанием, вследствие большего рассредоточения кормовых объектов в среде. Однако молодь демонстрировала высокую двигательную активность фактически на протяжении всей первой половины светлого времени суток (с 8.00 до 14.00), заканчивающей 15-минутным периодом кормления. Сразу после насыщения, данный показатель резко снижался, вновь нарастая только спустя три часа. Таким образом, нехватка пищи в зоне температурного оптимума значительно увеличивала продолжительность поведенческих актов, направленных на ее поиск, и вследствие этого происходило снижение среднего значения температуры избираемой окунями. Вероятно, возросшие при этом затраты энергии, а также продолжительное пребывание в температурах, которые были ниже оптимальных значений, напрямую отразились на отсутствии прироста массы особей, даже несмотря на большое количество потребляемого корма (табл. 2). Сходным образом, ранняя молодь окуня, совершая регулярные вертикальные миграции в нижние холодные слои воды, демонстрировала пониженные показатели роста в сравнении с рыбами, постоянно находящимися в прогретом эпилимнионе (Kratochvíl et al., 2008).
Как и ожидалось, отсутствие кормовых объектов в температурно-неоднородной среде приводило к выраженному снижению температуры окончательно избираемой молодью окуня. Подобная ответная реакция была ранее неоднократно продемонстрирована на различных видах пресноводных и морских рыб (Javaid, Anderson, 1967; Mac, 1985; Sogard, Olla, 1996; van Dijk et al., 2002; Zdanovich, 2006; Голованов, 2013 и др.). За редкими исключениями, снижение значений температур избираемых голодными рыбами укладывается в диапазон от 1 до 5°С и зависит от видовых особенностей, а также сроков голодания. Чаще всего спонтанное перемещение рыб в область пониженных температур объясняется снижением энергетических затрат на поддержание жизнедеятельности вследствие замедления обменных процессов (Crowder, Magnuson, 1983; van Dijk et al., 2002; Zdanovich, 2006). У исследованной нами молоди окуня отсутствие пищи в экспериментальной среде приводило к снижению окончательно избираемой температуры на ~4°C, что совпадает с полученными ранее результатами (Смирнов, 2017) либо несколько отличается от них (1.2°C) (Голованов, 2013). Вероятно, такие различия связаны с особенностями методики экспериментов или с различным физиологическим состоянием опытных особей.
При полном отсутствии в экспериментальной среде пищи окуни демонстрировали относительно высокие показатели двигательной активности (табл. 1). Ранее было показано, что даже после непродолжительного голодания молодь рыб становится более активной и передвигается в более широком температурном диапазоне в сравнении с сытыми особями (Zdanovich, 2006). Тем не менее с увеличением периода голодания в поведении окуней наметилась четкая тенденция к снижению двигательной активности, что, наиболее вероятно, вызвано стремлением сэкономить оставшиеся в организме запасы энергии. На примере молоди плотвы было продемонстрировано, что такая реакция даже более эффективна, чем просто перемещение рыб в зоны с низкими температурами (van Dijk et al., 2002). Таким образом, при полном отсутствии кормовых объектов пищевое поведение уступало главную роль терморегуляционному, что выражалось в предпочтении рыбами более “прохладных” температурных зон и в постепенном снижении своей активности. Вероятно, при этом происходило определенное замедление скорости обменных процессов, позволявшее голодным особям уменьшить траты имеющихся у них запасов энергии.
В условиях свободного выбора температуры молодь окуня демонстрировала высокие показатели питания даже при однократном кормлении в течение суток. На момент окончания опытов вес потребленных личинок хирономид за 15 мин кормления достигал 18–20% от совокупной массы рыб. При этом существенные различия в количестве кормовых объектов, помещаемых в кормушки, в первой и второй серии эксперимента не оказывали значимого влияния на объем съедаемой пищи. Это достигалось, прежде всего, за счет расширения молодью температурного диапазона питания, а также увеличения процента съеденной пищи на каждом из кормовых пятен (рис. 4). Следует также отметить, что акты внутригрупповой конкуренции отмечались лишь в среде с ограниченным количеством пищи.
Рассчитанный ранее оптимальный суточный рацион для молоди окуня весом 0.22–18.9 г составлял 7.4–2.2% от массы тела (Fiogbé, Kestemont, 2003), что заметно отличается от полученного нами значения. Однако в данном случае речь идет о сухих гранулированных кормах. Мы попробовали пересчитать полученные в эксперименте данные, исходя из того, что влажность комбикорма обычно составляет ~10%, а содержание сухих веществ в личинках хирономид – 19.95% (Fard et al., 2014). Полученный в результате этого средний рацион молоди окуня в первой и второй сериях эксперимента составил 3.2–3.4% от массы тела, а максимальный – 4.4%. Эти величины оказались близки к ранее оцененным оптимальным значениям.
Ранее была предложена теоретическая модель, которая условно разделяла реакцию молоди рыб на исчезновение и повторное появление в окружающей среде пищи на несколько фаз: “стресс” (stress), “переходный период” (transition), “адаптация” (adaptation) и “восстановление” (recovery) (Méndez, Wieser, 1993). Их выраженность и продолжительность в значительной мере зависят от видовых особенностей, размера и возраста рыб, а также от температуры и других экологических факторов. Но несмотря на это, модель, по мнению авторов, описывает общие закономерности реакции рыб и других животных на отсутствие в среде пищи и возобновление питания.
Некоторые фазы предложенной модели прослеживались и в поведении молоди окуня. Фаза “стресса” – начальная реакция организма (первые 24 ч), возникающая в ответ на исчезновение доступной пищи, отчетливо проявлялась в поведении рыб из первой и второй серий эксперимента. При этом у молоди наблюдался всплеск двигательной активности, связанный с поиском пищи и наиболее выраженный при слабой обеспеченности кормовыми объектами. Продолжалась эта фаза до наступления момента кормления. В опытах третьей серии, при полном отсутствии корма, вычленить фазу “стресса” оказалось фактически невозможно. В данном случае первые сутки голодания приходились на момент пересадки рыб в термоградиентную установку, что неизбежно вызывало дополнительный стресс. Поэтому, вопреки ожиданиям, двигательная активность окуней в первые 24 часа голодания была относительно слабой и составляла лишь 60% от максимума, зарегистрированного на второй день. В то же время фазу “переходного периода” можно было наблюдать лишь в третьей серии эксперимента, когда после периода выраженной гиперактивности у рыб происходило постепенное снижение интенсивности перемещений вплоть до окончания опыта. О происходящих при этом изменениях в скорости метаболических реакций можно судить лишь косвенно, так как подобные исследования нами не выполнялись, возможно, спонтанное перемещение голодных рыб в “холодную” зону установки сопровождалось замедлением обменных процессов.
Работа, выполненная в экспериментальных условиях, наглядно отражает компромисс между терморегуляционным и пищевым поведением, присущий множеству эктотермных организмов. Отмеченная в опытах пластичность поведения молоди рыб, возникающая в ответ на изменение доступности пищи в температурно-неоднородной среде, определяется биоэнергетическими основами их жизнедеятельности (Kitchell et al., 1977; Jobling, 1994). Выбор температурного оптимума, поиск пищи на удалении от него и возращение обратно для переваривания и ассимиляции, снижение двигательной активности, переход голодных особей в зоны с пониженной температурой и другие отмеченные в эксперименте поведенческие реакции позволяют молоди окуня извлекать максимально возможные выгоды из текущего состояния внешних факторов среды.
ВЫВОДЫ
1. Обеспеченность (избыток, ограничение, отсутствие) пищей оказывала существенное влияние на показатели терморегуляционного и пищевого поведения молоди окуня в экспериментальной термоградиентной среде.
2. Уменьшение количества кормовых объектов в зоне температурного оптимума вызывало значимое снижение значений температур избираемых рыбами и увеличивало их двигательную активность, связанную с поиском пищи. Голодные рыбы предпочитали наиболее низкие температуры на момент окончания опытов.
3. Несмотря на значительные различия в концентрации кормовых объектов, находящихся в кормушках, суммарный и средний рационы молоди окуня были одинаковыми для первых двух серий эксперимента. В то же время прирост массы рыб наблюдался лишь при большей концентрации кормовых организмов, что, вероятно, определялось меньшими энергетическими затратами на добывание пищи.
Работа выполнена в рамках государственного задания № АААА-А18-118012690102-9, а также при частичной поддержке темы Президиума РАН: 0122-2018-0001.
Список литературы
Голованов В.К., 2013. Эколого-физиологические закономерности распределения и поведения пресноводных рыб в термоградиентных условиях // Вопросы ихтиологии. Т. 53. № 3. С. 286–314.
Крогиус Ф.В., 1974. Значение вертикальных миграций в энергетическом балансе молоди красной в оз. Дальнем // Известия ТИНРО. Т. 90. С. 39–48.
Кузнецов В.А., Зданович В.В., Лобачёв Е.А., Лукиянов С.В., 2015. К вопросу об астатическом экологическом оптимуме // Успехи современной биологии. Т. 135. № 5. С. 437–452.
Лапкин В.В., Свирский А.М., Сопов Ю.Н., 1979. Избираемая температура и температура акклимации рыб // Зоологический журнал. Т. 58. № 11. С. 1659–1670.
Озернюк Н.Д., 2000. Температурные адаптации. М.: Изд-во Московского университета. 205 с.
Свирский А.М., 1996. Поведение рыб в гетеротермальных условиях // Поведение и распределение рыб. Докл. 2-го Всерос. совещ. Борок. С. 140–152.
Свирский А.М., 1981. Сезонно-возрастная зависимость суточного ритма двигательной активности окуня // Биология внутренних вод: Информационный бюллетень. № 50. С. 52–55.
Свирский А.М., Лапкин В.В., 1987. Сезонная и возрастная изменчивость избираемых температур у рыб рыбинского водохранилища: 1. Окунь (Perca fluviatilis L.) // Биология внутренних вод: Информационный бюллетень. № 76. С. 45–49.
Смирнов А.К., Смирнова Е.С., 2012. Динамика избираемых и летальных температур молоди речного окуня Perca fluviatilis L. в течение первого месяца жизни // Фундаментальные исследования. № 11. С. 313–316.
Смирнов А.К., 2013. Влияние наличия пищи в зоне температурного оптимума на поведение молоди речного окуня Perca fluviatilis L. // Вестник Астраханского государственного технического университета. Серия: Рыбное хозяйство. № 1. С. 75–82.
Смирнов А.К., 2017. Влияние пищевого и оборонительного поведения на избираемые температуры молоди речного окуня // Труды ИБВВ РАН. Вып. 78. № 81. С. 159–181.
Armstrong J.B., Schindler D.E., Ruff C.P., Brooks G.T., Bentley K.E., Torgersen C.E., 2013. Diel horizontal migration in streams. Juvenile fish exploit spatial heterogeneity in thermal and trophic resources // Ecology. V. 94. № 9. P. 2066–2075.
Bevelhimer M.S., Adams S.M., 1993. A Bioenergetics Analysis of Diel Vertical Migration by Kokanee Salmon, Oncorhynchus nerka // Canadian Journal of Fisheries and Aquatic Sciences. V. 50. № 11. P. 2336–2349.
Bicego K.C., Barros R.C.H., Branco L.G.S., 2007. Physiology of temperature regulation. Comparative aspects // Comparative biochemistry and physiology. Part A, Molecular & integrative physiology. V. 147. № 3. P. 616–639.
Brett J.R., 1971. Energetic responses of salmon to temperature. A study of some thermal relations in the physiology and freshwater ecology of sockeye salmon (Oncorhynchus nerka) // American Zoologist. V. 11. P. 99–113.
Čech M., Frouzová J., Peterka J., Jůza T., Draštık V. et al., 2017. Sampling of deep benthic perch fry: insight into the diel vertical migrations // Hydrobiologia. V. 784. P. 1–8.
Crowder L.B., Magnuson J.J., 1983. Cost benefit analysis of temperature and food resource use: a synthesis with an example from the fishes // Aspey W.P., Lustick S.I. (Eds). Behavioral Energetics: The Cost of Survival in Vertebrates. Columbus, OH: Ohio State University Press. P. 189–221.
Eriksson L., 1978. A laboratory study of diel and annual activity rhythms and vertical distribution in the perch, Perca jluviatilis, at the Arctic circle // Environmental Biology of Fishes. V. 3. № 3. P. 301–307.
Fard M.S., Pasmans F., Adriaensen C., Du Laing G., Janssens G.P.J., Martel A., 2014. Chironomidae bloodworms larvae as aquatic amphibian food // Zoo biology. V. 33. № 3. P. 221–227.
Fiogbé E.D., Kestemont P., 2003. Optimum daily ration for Eurasian perch Perca fluviatilis L. reared at its optimum growing temperature // Aquaculture. V. 216. № 1–4. P. 243–252.
Garner P., Clough S., Griffiths S.W., Deans D., Ibbotson A., 1998. Use of shallow marginal habitat by Phoxinus phoxinus // Journal of Fish Biology. V. 52. № 3. P. 600–609.
Gutowsky L.F.G., Harrison P.M., Martins E.G., Leake A., Patterson D.A. et al., 2017. Daily temperature experience and selection by adfluvial bull trout (Salvelinus confluentus) // Environmental Biology of Fishes. V. 100. № 10. P. 1167–1180.
Hochachka P.W., Somero G.N., 2014. Biochemical Adaptation. Princeton: Princeton University Press. 560 p.
Hutchison V.H., Maness J.D., 1979. The Role of Behavior in Temperature Acclimation and Tolerance in Ectotherms // American Zoologist. V. 19. P. 367–384.
Javaid M.Y., Anderson J.M., 1967. Influence of Starvation on Selected Temperature of some Salmonids // Journal of the Fisheries Research Board of Canada. V. 24. № 7. P. 1515–1519.
Jobling M., 1994. Fish Bioenergetics. London: Chapman and Hall. 309 p.
Kitchell J.F., Stewart D.J., Weininger D., 1977. Applications of a Bioenergetics Model to Yellow Perch (Perca flavescens) and Walleye (Stizostedion vitreum vitreum) // Journal of the Fisheries Research Board of Canada. V. 34. № 10. P. 1910–1921.
Kratochvíl M., Peterka J., Kubečka J., Matěna J., Vašek M. et al., 2008. Diet of larvae and juvenile perch, Perca fluviatilis performing diel vertical migrations in a deep reservoir // Folia Zoologica. V. 57. № 3. P. 313–323.
Mac M.J., 1985. Effects of ration size on preferred temperature of lake charr Salvelinus namaycush // Environmental Biology of Fishes. V. 14. P. 227–231.
Méndez G., Wieser W., 1993. Metabolic responses to food deprivation and refeeding in juveniles of Rutilus rutilus (Teleostei. Cyprinidae) // Environmental Biology of Fishes.V. 36. P. 73–81.
Neverman D., Wurtsbaugh W.A., 1994. The thermoregulatory function of diel vertical migration for a juvenile fish, Cottus extensus // Oecologia. V. 98. № 3–4. P. 247–256.
Sajdlová Z., Frouzová J., Draštık V., Jůza T., Peterka J. et al., 2018. Are diel vertical migrations of European perch (Perca fluviatilis L.) early juveniles under direct control of light intensity? Evidence from a large field experiment // Freshwater Biology. V. 63. P. 473–482.
Sogard S.M., Olla B.L. 1996. Food deprivation affects vertical distribution and activity of a marine fish in a thermal gradient. Potential energy-conserving mechanisms // Marine Ecology Progress Series. V. 133. P. 43–55.
van Dijk P., Staaks G., Hardewig I., 2002. The effect of fasting and refeeding on temperature preference, activity and growth of roach, Rutilus rutilus // Oecologia. V. 130. № 4. P. 496–504.
Zdanovich V.V., 2006. Alteration of thermoregulation behavior in juvenile fish in relation to satiation level // Journal of Ichthyology. V. 46. № S2. P. S188–S193.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


