Зоологический журнал, 2019, T. 98, № 2, стр. 193-202
Гнездовая биология чешуйчатого крохаля (Mergus squamatus, Mergini, Anatidae) в Приморье
Д. В. Соловьёва 1, *, С. Л. Вартанян 2, **
1 Институт биологических проблем Севера ДВО РАН
685000 Магадан, Россия
2 Северо-Восточный комплексный научно-исследовательский институт
им. Н.А. Шило ДВО РАН
685000 Магадан, Россия
* E-mail: diana_solovyova@mail.ru
** E-mail: sergey-vartanyan@mail.ru
Поступила в редакцию 07.02.2018
После доработки 12.04.2018
Принята к публикации 20.03.2018
Аннотация
Представлены результаты 17-летнего (2001‒2017 гг.) исследования гнездовой биологии чешуйчатого крохаля (Mergus squamatus) при его гнездовании в дуплянках разных типов и естественных дуплах в Приморском крае. Дупляночное хозяйство было развернуто на 15 реках. Всего нами было описано 205 гнезд, из них 190 гнезд в дуплянках и 15 гнезд в естественных дуплах. Занимаемость дуплянки конструкции “ящик” составила в среднем 27.8% и была достоверно выше, чем занимаемость дуплянки конструкции “труба” в 20.2%. Средний размер кладки 11.08 ± 0.05 яйца. Оценены внутри- и межвидовой гнездовой паразитизм и его влияние на успех гнездования. Выявлена тенденция более раннего начала гнездования (средняя по срокам, т.е. медианная, кладка) в последние годы исследования по сравнению с начальными годами. Успех гнездования (70–75%) не зависел от типа укрытия, т.е. гнездование в естественных дуплах и гнездование в дуплянках было одинаково успешным. Дупляночное хозяйство оказалось эффективным средством для увеличения численности редкого вида птиц. За 2002‒2017 гг. в дуплянках достоверно вылупилось 1334 птенца.
Чешуйчатый крохаль (Mergus squamatus) – эндемик восточной Азии – гнездится в поймах горных рек юга Дальнего Востока России (практически исключительно на хребте Сихоте-Алинь), в двух изолированных анклавах на севере Китая (массив Чанбайшань и одна речная система в Малом Хингане) и, предположительно, на севере Северной Кореи (Solovyeva et al., 2014). Численность мировой популяции в предгнездовой период оценивается в 1937 пар, или 4664 особей, включая неполовозрелых птиц возраста 1–2 года, не принимающих участие в размножении, но прилетающих в пределы гнездового ареала. Большая часть мировой популяции чешуйчатого крохаля (85%) гнездится в России, где численность на некоторых реках испытывает слабый рост после заметного спада в 1960–1980-е (Solovyeva et al., 2014). Чешуйчатый крохаль внесен в Красную Книгу МСОП (категория Endangered; IUCN, 2016) и Красную Книгу РФ (категория 3 – редкий вид, Сурмач, 2000). Эта птица – облигатный дуплогнездник, для гнездования которого необходимы дуплистые лиственные деревья с внутренним диаметром дупел более 20 см (Шибнев, 1976; Коломийцев, 1992; Yelsukov, 1994; Zhao et al., 1994; Соловьёва и др., 2005). Описание гнездовых дупел и их типизация, средний размер кладки и яиц, продолжительность инкубации и период между откладкой последовательных яиц у этого вида были исследованы в 1981–1988 гг. в бассейне р. Киевка, Южное Приморье и в горах Чанбайшань в 1976–78 и 1986–91 гг. (Коломийцев, 1992; Zhao et al., 1994).
Настоящая работа представляет результаты 17-летнего (2001‒2017 гг.) исследования гнездовой биологии чешуйчатого крохаля при его гнездовании в дуплянках разных типов и естественных дуплах в Приморье. Материалы по биологии гнездования частично опубликованы нами (Соловьёва и др., 2005; Solovieva, Shokhrin, 2008; Solovyeva et al., 2013). Многолетние данные по фенологии гнездования, размеру кладки, внутри- и межвидовому гнездовому паразитизму, успеху размножения и причинах гибели кладок, а также анализ этих данных публикуются впервые.
МАТЕРИАЛЫ И МЕТОДЫ
Дупляночное хозяйство для чешуйчатого крохаля было развернуто на 15 реках Приморского края (рис. 1 ). Первые дуплянки были повешены в 2000 г. и до 2003 г. мы использовали только конструкцию гнездовая труба (здесь и далее “труба”). С 2003 г. мы ввели в обращение ящики-гоголятники высотой 65 см, с 2008 г. – удлинили ящики до 85–90 см, а с 2012 г. стали использовать длинные ящики с дополнительным боковым летком, предназначенным для выхода самки в случае проникновения хищника через основной леток. Трубы представляют собой открытый сверху цилиндр (бочку) с диаметром дна 27 см, высотой 85–95 см, повешенный на ветку дерева под углом от 30° до 70°. На дно дуплянок любой конструкции насыпали 5–10 см опилок. Подробно конструкция труб и ящиков (кроме ящиков с боковым летком, введенных позже) описана в статье Соловьёвой с соавторами (Solovyeva et al., 2013). Всего нами было повещено 253 дуплянки разных типов, продолжительность работы дуплянки не превышала 14 лет для ящиков и 8 лет для труб, скорость и причины разрушения дуплянок проанализированы в нашей предшествующей работе (Solovyeva et al., 2013).
Рис. 1.
Карта района работ с указанием рек и числа дуплянок на каждой из рек (числo после названия реки).
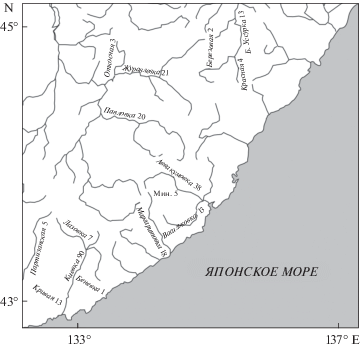
Поиск естественных гнездовых дупел проводили только на р. Киевка и ее притоках. В поиске участвовали от 2 до 5 человек, которые распределялись вдоль реки и следили за самкой, возвращающейся в гнездо после кормежки. Начиная с 2010 г. в ходе поиска дупел мы стали регистрировать самок, гнездящихся преимущественно в дуплянках, и прекратили поиск естественных дупел.
Проверка дуплянок на занимаемость проводилась в первой и второй декадах мая каждого года. До 2014 г. наблюдатель поднимался на дерево при проверке дуплянки и, соответственно, выпугивал насиживающую птицу. С 2014 г. мы начали практиковать использование видеокамеры для проверки дуплянок, в этом случае наседка не всегда покидала гнездо. Такой способ не позволял точно определить размер и дату начала кладки; таким образом, кладки, осмотренные только видеокамерой, не используются в анализе. Стадию насиженности яиц определяли водным тестом (Westerskov, 1950). Дату начала откладки яиц определяли по стадии насиженности обратным отсчетом от момента посещения гнезда. Мы использовали продолжительность инкубационного периода в 34.5 дней, полученную нами эмпирически для гнезд с известной датой откладки яиц и известной датой вылупления (N = 15). Интервал между последовательными откладками яиц был принят за 1.5 суток (Коломийцев, 1992). Успех гнездования (в процентах) определяли при повторном посещении гнезда после предсказанной даты вылупления. После вылупления птенцов из яиц в гнезде остаются подскорлуповые мембраны. Гнездо считали успешным, если хотя бы один птенец вылупился и покинул гнездо. Гнездо считали уничтоженным хищником, если (а) в гнезде была найдены скорлупа от съеденных яиц; (б) в гнезде не было найдено ни одной подскорлуповой мембраны. Гнездо считали брошенным, если яйца были холодными, и самка не была отмечена на гнезде при повторном посещении, при каждом случае брошенной кладки мы старались определить причину (внутри- и межвидовой гнездовой паразитизм, спугивание самки наблюдателем в момент откладки ею яйца, отлов самки). Мы считали, что самка погибла в ходе насиживания (убита хищником или людьми), если гнездо было осмотрено без спугивания самки (самки не было на гнезде в ходе осмотра), но полная кладка оказалось брошенной при повторном посещении. Гибель самки мы предполагали также в случае, если при первом посещении гнезда насиженная кладка была уже брошена без причины, и яйца не были повреждены хищниками. При таком способе оценки мы можем переоценивать гибель самок и недооценивать беспричинное бросание кладок, но, учитывая пресс хищничества и браконьерства на реках Приморья, первое кажется нам более вероятной причиной отсутствия самки.
Занимаемость дуплянок рассчитывалась как отношение занятых чешуйчатым крохалем дуплянок к числу доступных дуплянок данного типа в сезоне (в %). Недоступными для крохаля были дуплянки, занятые другими видами животных: гнездами шершней предыдущего лета; зимними и родовыми гнездами белок и летяг; гнездами сов. С 2007 г. мы начали практиковать чистку части дуплянок в марте, до прилета чешуйчатого крохаля на гнездовые реки.
РЕЗУЛЬТАТЫ
Занимаемость дуплянок
Всего нами было описано 205 гнезд чешуйчатого крохаля, из них 190 гнезд – в дуплянках и 15 гнезд в естественных дуплах. Число гнезд в дуплянках разных типов (труба и ящик) за все годы наблюдений представлено в табл. 1. Мы использовали только данные о дуплянках вдоль рек с нарушенными (вырубленными) пойменными лесами для сравнения занимаемости дуплянок по типам. На р. Партизанская дуплянки не занимались крохалем никогда, тогда как на остальных реках с вырубленными поймами занималось от 1.5 до 85.7% дуплянок. Занимаемость дуплянок достоверно различалась на разных реках (P < 0.03, ANOVA ящики Киевка + Аввакумовка, 15 лет; ANOVA ящики + трубы, все реки, первые 4 года; табл. 2).
Таблица 1.
Число гнезд чешуйчатого крохаля в дуплянках (ящиках и трубах) и естественных дуплах, Приморье, 2002‒2017 гг.
| Год | Число гнезд | |||
|---|---|---|---|---|
| в трубах | в ящиках | в естественных дуплах | всего | |
| 2002 | 3 | 0 | 0 | 3 |
| 2003 | 4 | 1 | 1 | 6 |
| 2004 | 3 | 2 | 3 | 8 |
| 2005 | 3 | 2 | 3 | 8 |
| 2006 | 7 | 3 | 2 | 12 |
| 2007 | 8 | 4 | 2 | 14 |
| 2008 | 6 | 5 | 1 | 12 |
| 2009 | 8 | 6 | 1 | 15 |
| 2010 | 10 | 7 | 2 | 19 |
| 2011 | 2 | 9 | 0 | 11 |
| 2012 | 2 | 5 | 0 | 7 |
| 2013 | 4 | 8 | 0 | 12 |
| 2014 | 3 | 9 | 0 | 12 |
| 2015 | 8 | 15 | 0 | 23 |
| 2016 | 7 | 11 | 0 | 18 |
| 2017 | 12 | 13 | 0 | 25 |
| Всего | 90 | 100 | 15 | 205 |
| Доля, % | 43.9 | 48.8 | 7.3 | 100 |
Размер кладки, внутри- и межвидовой гнездовой паразитизм
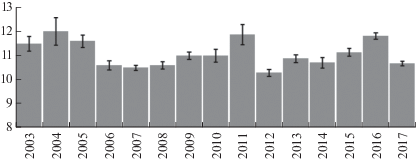
Полные кладки чешуйчатого крохаля насчитывали в среднем 11.08 ± 0.05 (SE) яйца (N = 145, пределы 7–18 яиц). Размер кладки по годам показан на рис. 2. В случае внутривидового гнездового паразитизма достоверно можно отличить только яйца, подложенные другими самками после начала насиживания, такие яйца оказываются насиженными слабее. Подкладные яйца, отличающиеся от собственных по стадии насиживания, были выявлены в 2015‒2017 годах, в среднем доля таких яиц составила 4.1% (3–4.7%) от всех яиц с известной стадией насиживания. В случае, если подкладывание произошло в ходе откладки, подкладные яйца выявить невозможно. В 2011 г. две кладки крохаля содержали по 16 и 18 яиц каждая, однако все яйца были насижены одинаково. Наша попытка отличить подкладные яйца от собственных яиц самки по размерам не увенчалась успехом (Соловьёва и др., 2005). Таким образом, мы не можем утверждать, что кладки, использованные для расчета размера кладки, не содержат подкладных яиц. Кладка из 21 яйца (отложены, как минимум, двумя самками) не насиживалась ни одной из самок.
Рис. 2.
Средний размер кладки чешуйчатого крохаля (яиц) по годам (планка погрешностей – величина стандартной ошибки) в Приморье.
Из уток только мандаринка (Aix galericulata) подкладывает яйца в гнезда чешуйчатого крохаля: из 205 гнезд крохаля, осмотренных нами за весь период работ, 10 содержали яйца мандаринки. В одном из этих гнезд кладку насиживала мандаринка, в двух случаях кладки были брошены до начала насиживания, в остальных 7 случаях насиживали самки крохаля. В этих 7 кладках содержалось в среднем по 3.3 (от 1 до 5) яйца мандаринки. В кладке, насиживаемой мандаринкой, было 11 яиц мандаринки и 10 яиц крохаля. В первые годы существования дуплянок на реке, мандаринки не подкладывали яйца в гнезда крохаля. В бассейне р. Киевка подкладывание яиц мандаринками впервые было отмечено в 2011 г., т.е. на 11-й год существования дуплянок и далее регистрировалось практически ежегодно. На р. Аввакумовка первое (и единственное) подкладывание яиц мандаринки случилось в 2010 г. – на 10-й год работы дупляночного хозяйства. На р. Журавлевка, где дупляночное хозяйство существует только с 2013 г., межвидовой гнездовой паразитизм еще не наблюдался. Межвидовой гнездовой паразитизм при гнездовании чешуйчатого крохаля в естественных дуплах нами отмечался только один раз.
Фенология гнездования
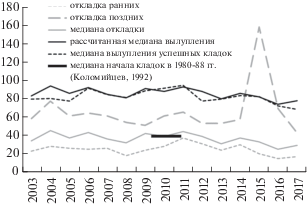
Для чешуйчатого крохаля характерно несинхронное начало гнездования, в среднем период между началом откладки яиц самых ранних и самых поздних кладок составил 33.9 ± 2.3 (N = 136) суток в 2003‒2017 годах (табл. 3). Рано гнездящиеся самки начинают откладывать яйца в середине марта, т.е. практически сразу после прилета на гнездовые реки, который происходит также в середине марта (Solovyeva et al., 2012). Нами зарегистрирован аномальный случай откладки яиц после 3 августа. Вероятно, эта кладка была отложена молодой самкой, кладка не насиживалась и состояла из 3 яиц (рис. 3).
Таблица 3.
Сроки начала гнездования чешуйчатого крохаля в Приморье, 2003‒2017 гг.
| Год | Начало откладки яиц | Число гнезд | |||
|---|---|---|---|---|---|
| самая ранняя кладка | самая поздняя кладка | продолжительность периода (сутки) | медиана | ||
| 2003 | 21 марта | 25 апреля | 35 | 4 апреля | 6 |
| 2004 | 28 марта | 16 мая | 49 | 15 апреля | 7 |
| 2005 | 26 марта | 30 апреля | 35 | 7 апреля | 6 |
| 2006 | 25 марта | 3 мая | 39 | 13 апреля | 11 |
| 2007 | 26 марта | 1 мая | 35 | 6 апреля | 13 |
| 2008 | 18 марта | 22 апреля | 36 | 2 апреля | 12 |
| 2009 | 24 марта | 20 апреля | 27 | 12 апреля | 14 |
| 2010 | 28 марта | 30 апреля | 33 | 9 апреля | 11 |
| 2011 | 7 апреля | 5 мая | 28 | 14 апреля | 7 |
| 2012 | 1 апреля | 23 апреля | 22 | 9 апреля | 7 |
| 2013 | 24 марта | 23 апреля | 29 | 31 марта | 4 |
| 2014 | 30 марта | 26 апреля | 27 | 7 апреля | 8 |
| 2015 | 20 марта | 4 августа | 137 | 3 апреля* | 12 |
| 2016 | 15 марта | 8 мая | 54 | 25 марта | 7 |
| 2017 | 17 марта | 12 апреля | 26 | 29 марта | 11 |
Успех гнездования
В среднем за все годы прямой успех гнездования составил 70.4 ± 4.0% (N = 181) (рис. 4). Основными причинами гибели кладок были: (1) хищничество: поедание яиц, убийство самок в дуплах и дуплянках, а также, вероятно, гибель самок от хищников на реке во время кормежки, суммарно 17.7% гнезд; (2) бросание кладки: как в результате спугивания или отлова самки наблюдателями, так и в результате внутри- и межвидового гнездового паразитизма, суммарно 11.1% гнезд (табл. 4). Единственный случай разрушения (сбрасывания людьми) дуплянки с гнездом крохаля произошел в 2008 г. Убийство самки в дуплянке (ящик) и естественном дупле отмечено дважды, в обоих случаях наиболее вероятным хищником была харза (Martes flavigula) или соболь (M. zibellina). Оба эти вида, вероятно, ответственны за разорение большинства гнезд уток-дуплогнездников в Приморье. Фотоловушка, установленная возле одного из гнезд чешуйчатого крохаля в 2010 г., зафиксировала разорение этого гнезда харзой: зверю потребовалось менее 2 часов (26 апреля с 18:57 до 21:18 по местному времени), чтобы съесть и унести полную кладку крохаля. В одном из разоренных гнезд крохаля в 2017 г. нами была найдена шерсть, предположительно, амурского лесного кота (Prionailurus bengalensis). Амурский полоз Elaphe schrenckii ‒ один из типичных хищников на кладках дуплогнездников в Приморье. Полозы отмечались нами в 7 гнездах уток (6 гнезд крохаля и 1 гнездо мандаринки), в дуплянках – 4 случая, в естественных дуплах ‒ 3 случая. При условии, что мы посещаем гнезда 2–5 раз в течение сезона, проводя у гнезда не более 30 мин., частота регистрации полозов очень высока. Амурский полоз не способен заглотить яйцо чешуйчатого крохаля целиком, но способен заглотить яйцо мандаринки. Ненасиживаемые яйца крохаля могут быть добычей амурского полоза, в этом случае полоз разбивает яйцо головой и потом выпивает его, такой случай был отмечен в мае 2013 г., полоз произвел все эти действия в дуплянке в присутствии наблюдателя. Полоз опасен для вылупившихся птенцов чешуйчатого крохаля (Соловьёва и др. 2005). Реакцию самок крохаля на присутствие полоза в гнездах мы наблюдали дважды: в первом случае самка боялась вернуться на кладку и вернулась только тогда, когда мы изъяли полоза из дупла; во втором случае самка насиживала кладку, поверх которой обвился небольшой полоз. Насиживание кладки со змеей вызывало стресс у самки, вероятно в результате стресса она потеряла значительное количество кроющих перьев спины, спина птицы была почти голой.
Рис. 4.
Доля успешных гнезд (ось абсцисс) от общего числа гнезд чешуйчатого крохаля в Приморье, 2003‒2017 гг.
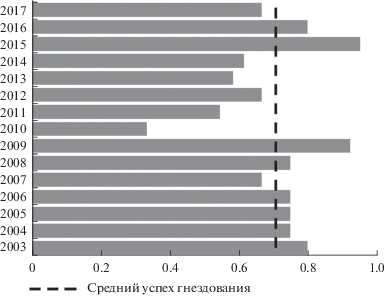
Таблица 4.
Успех гнездования чешуйчатого крохаля и причины гибели гнезд в Приморье, 2003‒2017 гг.
| Год | Число гнезд | ||||||
|---|---|---|---|---|---|---|---|
| успешных | разоренных | брошенных | разрушение дупла | гибель самки | гнездовой паразитизм | всего | |
| 2003 | 4 | 0 | 1 | 0 | 0 | 0 | 5 |
| 2004 | 6 | 1 | 1 | 0 | 0 | 0 | 8 |
| 2005 | 6 | 0 | 2 | 0 | 0 | 0 | 8 |
| 2006 | 9 | 1 | 0 | 0 | 2 | 0 | 12 |
| 2007 | 8 | 1 | 2 | 0 | 1 | 0 | 12 |
| 2008 | 9 | 0 | 1 | 1 | 1 | 0 | 12 |
| 2009 | 12 | 0 | 0 | 0 | 1 | 0 | 13 |
| 2010 | 5 | 9 | 0 | 0 | 0 | 1 | 15 |
| 2011 | 6 | 0 | 3 | 0 | 1 | 1 | 11 |
| 2012 | 4 | 2 | 0 | 0 | 0 | 0 | 6 |
| 2013 | 7 | 3 | 1 | 0 | 1 | 0 | 12 |
| 2014 | 8 | 2 | 2 | 0 | 0 | 1 | 13 |
| 2015 | 20 | 0 | 1 | 0 | 0 | 0 | 21 |
| 2016 | 12 | 1 | 0 | 0 | 0 | 2 | 15 |
| 2017 | 12 | 3 | 1 | 0 | 2 | 0 | 18 |
| Всего | 128 | 23 | 15 | 1 | 9 | 5 | 181 |
| Доля, % | 70.7 | 12.7 | 8.3 | 0.6 | 5.0 | 2.8 | |
Массовое разорение гнезд крохаля отмечено в 2010 г., когда были разорены 9 из 15 гнезд (табл. 4). В остальные годы разорению подвергались не более 2–3 гнезд. В бассейне р. Киевка и на р. Журавлевка разорение гнезд наблюдалось после 3 лет существования дуплянок (с 2004 г. на р. Киевка и с 2017 г. на р. Журавлевка). На р. Аввакумовка гнезда крохаля хищниками не разорялись.
ОБСУЖДЕНИЕ
Занимаемость дуплянок
Опыт привлечения чешуйчатого крохаля в искусственные гнездовья (дуплянки) впервые был использован Коломийцевым (1986; 1992), который в период с 1981 по 1985 годы развесил около 60 дуплянок в бассейне р. Киевка. Этим же автором была предложена и конструкция оптимальной дуплянки для чешуйчатого крохаля, т.н. “гнездовая труба” (Коломийцев, 1986), впоследствии усовершенствованная нами (Solovyeva et al., 2013). Дуплянки привлекали чешуйчатых крохалей только на реках с вырубленными пойменными лесами по берегам, в нетронутых рубками поймах крохали (как и другие животные) не гнездились в дуплянках, вероятно предпочитая многочисленные естественные дупла (Solovyeva et al., 2013). Коломийцев (1992) полагал, что “широкое входное отверстие, обеспечивающее достаточно хорошую освещенность гнезда”, является значимым для этого вида. Наши данные противоречат этому заключению: ящики с летком 9 × 12 см занимались более активно, чем открытые трубы с диаметром входа 30 см. В 2006‒2017 гг. в бассейне р. Киевка занимаемость ящиков составила в среднем 27.8% по сравнению с занимаемостью труб в 20.2% (t-test, P = 0.021). Для анализа использованы только данные из бассейна р. Киевка, где оба типа дуплянок существуют давно (трубы с 2001 г., ящики с 2003) и в большом количестве (рис. 1 ), причем учтены только годы, когда занимаемость стабилизировалась. В первые годы занимаемость дуплянок низка, птицам требуется время, чтобы найти новые гнездовые укрытия и освоиться с ними (Solovyeva et al., 2013). На остальных реках мы использовали преимущественно один тип дуплянок (ящики – Аввакумовка, трубы – Павловка и Журавлевка). В 1960-е на р. Киевка использование ящиков чешуйчатым крохалем не отмечено, что мы можем объяснить как низкой численностью этого вида в то время, так, возможно, и размерами ящиков, предназначавшихся для мандаринок (Поливанов, 1981; Коломийцев, 1992). Размер и конструкция гнездового ящика и размер летка имеют значение для чешуйчатого крохаля. В Китае ящики с очень большим летком не занимались крохалем, хотя дупляночное хозяйство существовало с 2006 по 2016 г. (П. Лиу и Ч. Цинь, личные сообщения). Развешивание в 2016 г. в Чанбайшане 10 длинных ящиков с овальным летком (размером 9 × 12 см) обусловило немедленное гнездование в одном из них крохаля (в первый же год) и первое успешное вылупление птенцов в дуплянке в Китае (General Motors Green, 2015). Невольный эксперимент с дуплянками, проведенный природоохранными службами в Китае, показал, что размер летка для чешуйчатого крохаля не должен превышать размер тела самки со сложенными крыльями. Этот вид не отличается от остальных дуплогнездников, предпочитающих укрытие с размером летка минимально возможного для проникновения самки, но создающим препятствие при проникновении крупного хищника.
В работе Коломийцева (1992) отсутствуют данные о доли дуплянок, занятых чешуйчатым крохалем в годы его исследования, поэтому мы не можем провести сравнительный анализ занимаемости дуплянок в разные периоды. За 9 лет в 1980‒1988 гг. в бассейне р. Киевка было осмотрено 17 гнезд чешуйчатого крохаля, т.е. в среднем по 2 гнезда в год (Коломийцев, 1992). С 2001 по 2017 гг. в этом же бассейне мы исследовали 163 гнезда, т.е. в среднем 10 гнезд в год. Таким образом, наблюдается зависимость между числом гнезд (5-кратное увеличение) и числом пар (3‒5-кратное увеличение).
Размер кладки, внутри- и межвидовой гнездовой паразитизм
Как и большинство уток-дуплогнездников, чешуйчатый крохаль имеет относительно большую кладку (см. обзор размера кладок водоплавающих птиц в Alisauskas, Ankney, 1992), по массе соизмеримую с массой тела самки (Solovieva, Shokhrin, 2008). Средние размеры кладок в разные годы были достоверно различными (рис. 2; ANOVA, P < 0.03). Сравнение размера кладки в искусственных и естественных гнездовых полостях в период 2003‒2008 гг. (годы, когда мы имели возможность осмотреть естественные дупла) показало отсутствие различий в среднем размере кладок в дуплянках (n = 37) и естественных дуплах (N = 10) (t-test, P = 0.36). Внутривидовой гнездовой паразитизм типичен для чешуйчатого крохаля, как и для остальных уток-дуплогнездников (Jones, Leopold, 1967; Andersson, Ericsson, 1982; Mallory, Weatherhead, 1990; Dugger et al., 1999; Соловьёва и др., 2005). В целом внутривидовой паразитизм оказывает незначительное влияние на успех гнездования у этого вида, за весь период наших наблюдений была брошена только одна кладка. Эта кладка содержала 21 яйцо, насиживать ее самка не могла, поскольку яйца занимали всю площадь дна дуплянки и располагались вертикально. В остальных кладках, для которых влияние внутривидового паразитизма доказано, из подложенных после окончания основной кладки яиц просто не вылуплялись птенцы. В случае межвидового паразитизма более крупный чешуйчатый крохаль почти всегда выигрывает у мандаринки. Обе смешанные кладки, брошенные еще на стадии откладки, вероятно, находились в гнездах мандаринки, по крайней мере, в годы, предшествовавшие смешанным кладкам, в обеих этих дуплянках гнездились мандаринки. Таким образом, это мандаринка бросала кладку, когда туда подкладывал яйца крохаль, а не наоборот. В семи гнездах крохаля были яйца мандаринки, что не мешало самкам крохаля насиживать. Вылупление птенцов в этих гнездах со смешанными кладками либо не было прослежено (исследователи посещали гнезда через несколько дней после того, как самка уводила птенцов и когда судьба каждого яйца не понятна), либо мы изымали яйца мандаринки до момента вылупления, чтобы самка крохаля не успела увести птенцов мандаринки и бросить собственных невылупившихся птенцов. В единственном случае насиживания смешанной кладки мандаринкой (11 собственных и 10 крохалиных яиц) вылупились только мандаринки, все яйца крохаля погибли.
Фенология гнездования
Выявлена тенденция более раннего начала гнездования (средняя по срокам, т.е. медианная, кладка) в последние годы исследования по сравнению с начальными годами (регрессия медиана начала откладки – годы; F = 5.49, P = 0.036; рис. 3). Интересно, что начало появления ранних гнезд не имеет достоверной связи с годами (F = 1.00, p = = 0.334), т.е. первые птицы всегда начинают гнездиться в одни и те же даты. Значит, за смещение медианы ответственны не те особи, которые гнездятся первыми, а остальные птицы. В 1980‒1988 гг. самая ранняя кладка была начата 2 апреля, самая поздняя кладка – 27 мая, медиана начала кладок рассчитана нами как 14 апреля (Коломийцев, 1992). В годы нашего исследования самая ранняя откладка 15 марта, самая поздняя – 16 мая, медиана между годами – 6 апреля; кладка в августе исключена из анализа (табл. 3, рис. 3). В 1980-е годы откладка яиц чешуйчатым крохалем в бассейне Киевки происходила позже, чем в 2000-е.
В противоположность предположению Коломийцева (1992) мы не предполагаем, что самки, потерявшие кладки на ранней стадии, могут повторно гнездиться, по крайней мере, таких данных у нас нет. Все самки, чей бюджет времени нам известен (данные геолокации, 17 годовых записей от 11 самок, неопубликованные данные), откладывали яйца только в течение одного цикла за сезон.
Насиживание яиц начинается после откладки предпоследнего яйца (Коломийцев, 1992). На откладку 11 яиц (средняя кладка) самка затрачивает 15 суток. Соответственно насиживание начинается в среднем через 14 суток после начала откладки, т.е. во второй-третьей декада апреля по медиане (табл. 3). Насиживание продолжается в среднем 34.5 суток (пределы 31–39 суток). Период вылупления птенцов растянут от первых чисел мая до конца июля, разброс по времени появления между ранними и поздними кладками (33.9 суток) приблизительно равен периоду инкубации (34.5 суток), и птенцы в ранних гнездах появляются тогда, когда поздние самки только приступают к инкубации (рис. 3). Медиана вылупления птенцов в успешных гнездах не отличалась достоверно от медианы, рассчитанной для всех гнезд (и успешных и не успешных), это означает, что ранние гнезда не имеют выигрыша в успехе по сравнению со средними (t-test, P = 0.097; рис. 3).
Успех гнездования
Уcпех гнездования у чешуйчатого крохаля в 24.5–95.5% (рис. 2) оказался ниже, чем у родственного капюшонового крохаля (Lophodytes cucullatus) – 63‒100%, также гнездящегося в дуплянках (Zicus, 1990). Как и у капюшонового крохаля, основной причиной неуспешного гнездования было разорение гнезд хищниками (табл. 4). В Северной Америке основным хищником, разоряющим гнезда в дуплянках, является енот-полоскун (Procyon lotor), животное неповоротливое и плохо лазающее по деревьям (по сравнению с куницами). Защита дуплянок от енота в виде металлического конуса вокруг дерева давно разработана и применяется в большинстве дупляночных хозяйств (Corrigan et al., 2011). За все годы работы нам не удалось разработать способы защиты дуплянок от таких искусных древолазов, как харза и соболь (испробованы черный перец, ринардин, металлическая колючая сеть и жестяной полозок вокруг дерева).
Успех гнездования чешуйчатого крохаля не зависел от типа укрытия (от 0.70 до 0.75), т.е. гнездование в естественных дуплах и гнездование в дуплянках было одинаково успешным (табл. 5). Мы не анализируем причины неуспешного гнездования, не зависящие от типа укрытия (гибель самки, разрушение укрытия). Разорение гнезд было более высоким при гнездовании в трубах – 20% по сравнению с 8 и 7% в естественных дуплах и ящиках, соответственно. Объяснить, почему трубы оказались более заметными (привлекательными) для хищников, чем ящики, мы затрудняемся. При этом внутривидовой гнездовой паразитизм отмечен только в ящиках и не отмечен в других типах укрытий, паразитизм мандаринки в ящиках так же был существенно выше, чем в трубах. Возможно, что входное отверстие ящиков, небольшое по размеру и хорошо заметное с реки, делает их более привлекательными для всех уток, в том числе молодых самок, подбрасывающих яйца в чужие гнезда. Бросание гнезд было высоким в ящиках (12%) и в естественных дуплах (17%) и низким в трубах (3%). Одной причиной этого является бросание кладок в результате паразитизма в ящиках. Другой причиной может быть боязнь самки быть пойманной хищником в укрытии с одним узким входом (ящики и естественные дупла). Два случая убийства самок хищниками произошли в ящике и естественном дупле, имевшем единственный терминальный вход, в таких укрытиях самка не может покинуть гнездо при проникновении хищника, хищник закрывает весь вход своим телом. В трубе с широким входом самка может очень быстро вылететь до того, как хищник закроет леток, или даже перескочить через него.
Таблица 5.
Судьба гнезд чешуйчатого крохаля в Приморье в зависимости от типа гнездового укрытия, 2003–2017 гг.
| Судьба гнезда | Тип гнездового укрытия | ||
|---|---|---|---|
| труба | ящик | естественное | |
| Успешное | 56 (0.71) | 63 (0.70) | 9 (0.75) |
| Разорено | 16 (0.20) | 6 (0.07) | 1 (0.08) |
| Брошено | 2 (0.03) | 11 (0.12) | 2 (0.17) |
| Дупло разрушено | 1 (0.01) | 0 (0.0) | 0 (0.0) |
| Самка погибла | 4 (0.05) | 5 (0.06) | 0 (0.0) |
| Гнездовой паразитизм | 0 (0.0) | 5 (0.06) | 0 (0.0) |
В целом, несмотря на имеющиеся проблемы с защитой дуплянок, работа дупляночного хозяйства в 2001‒2017 гг. оказалась эффективным средством для увеличения численности редкого вида птиц – чешуйчатого крохаля. За все годы в наших дуплянках достоверно вылупилось 1334 птенца, с учетом гнезд с неизвестной судьбой это число возможно достигает 1850.
БЛАГОДАРНОСТИ
Авторы крайне признательны коллегам-зоологам, принимавшим активное участие в работе: В.П. Шохрину, А.Г. Дондуа, Д.Н. Кочеткову. Эта работа была бы невозможна без помощи волонтеров проекта, среди которых О.Н. Вороной, С.В. Немеров, П.Н. Кауров.
Исследование выполнено при финансовой поддержке Треста Водоплавающих птиц и Водно-болотных угодий (Wildfowl and Wetlands Trust, UK), фонда Раффорд (Rufford Foundation, UK) и Лесного Бюро Совета по сельскому хозяйству Правительства Тайваня (Forestry Bureau, Council of Agriculture, Taiwan).
Список литературы
Коломийцев Н.П., 1986. Факторы, лимитирующие численность чешуйчатого крохаля M. sqamatus и рекомендации по его охране и рациональному использованию // Изучение птиц в СССР, их охрана и рациональное использование. Тез. докл. Т. 1. Л. С. 36‒37.
Коломийцев Н.П., 1992. К биологии чешуйчатого крохаля в бассейне р. Киевка (Южное Приморье) // Орнитологические исследования в заповедниках. Отв. ред. Соколов В.Е. М.: Наука. С. 68‒83.
Поливанов В.М., 1981. Экология птиц-дуплогнездников Приморья. М.: Наука. С. 1‒171.
Соловьева Д.В., Шохрин В.П., Вартанян С.Л., Дондуа А.Г., 2005. Чешуйчатый крохаль (Mergus squamatus) в бассейне реки Киевка: численность, биология и успехи дупляночного хозяйства // Научные исследования природного комплекса Лазовского заповедника. Труды Лазовского гос. прир. зап-ка. Вып. 3. Владивосток: Русский остров. С. 188‒202.
Сурмач С.Г., 2000. Чешуйчатый крохаль Mergus squamatus // Красная Книга Российской Федерации. Животные. Т. 1 Режим доступа: http://biodat.ru/db/ rb/rb.php?src=1&vid=270. Дата доступа: 06.02.2018.
Шибнев Б.К., 1976. Краткие сообщения о чешуйчатом крохале на р. Бикине // Редкие, исчезающие и малоизученные птицы СССР. Рязань. С. 73‒74.
Alisauskas R.T., Ankney C.D., 1992. The cost of egg-laying and its relationship to nutrient reserves in waterfowl // Ecology and management of breeding waterfowl. Batt B.D.J. (Eds). Minneapolis: University of Minnesota Press. P. 30–61.
Andersson M., Eriksson M.G., 1982. Nest parasitism in Goldeneyes Bucephala clangula: some evolutionary aspects // American Naturalist. V. 120. P. l‒l6.
Corrigan R.M., Scrimgeour G.J., Paszkowski C., 2011. Nest boxes facilitate local-scale conservation of common goldeneye (Bucephala clangula) and bufflehead (Bucephala albeola) in Alberta, Canada // Avian Conservation and Ecology. V. 6. №. 1. http://dx.doi.org/ 10.5751/ACE-00435-060101
Dugger B.D., Bollmann L.C., Fredrickson L.H.,1999. Response of female hooded mergansers to eggs of an interspecific brood parasite // Auk. V. 116. № 1. P. 269‒273.
Yelsukov S.V., 1994. The scaly-sided merganser Mergus squamatus (Gould) in the Central Sikhote-Alin mountains, Far-East Russia // The Scaly-sided Merganser Mergus squamatus in Russia and China. Hughes B., Hunter J. (Eds). TWRG Special Publ. №. 1. Slimbridge: Wildfowl and Wetlands Trust. P. 18‒21.
General Motors Green. 2015. Режим доступа: http:// www.generalmotors.green/product/public/us/en/ GMGreen/resource_preservation.detail.html/content/Pages/news/us/en/gm_green/2015/0729-merganser.html. Дата доступа: 06.02.2018.
IUCN., 2016. Red List. Режим доступа: http:// www.iucnredlist.org/details/22680488/0. Дата доступа: 24.01.2018.
Jones R.E., Leopold A.S., 1967. Nesting interference in a dense population of Wood Ducks // Journal of Wildlife Management. V. 31. P. 221‒228.
Mallory M.L., Weatherhead P.J., 1990. Effects of nest parasitism and nest location on eggshell strength in waterfowl // Condor. № 92. P. 1031‒1039.
Solovieva D., Shokhrin V., 2008. Egg size, weight and fresh egg density of the Scaly-sided Merganser Mergus squamatus in South Primorye, Russia // Wildfowl. V. 58. P. 106‒111.
Solovyeva D.V., Afanasiev V., Fox J.W., Shokhrin V., Fox A.D., 2012. Use of geolocators reveals previously unknown Chinese and Korean scaly-sided merganser wintering sites // Endangered Species Research. V. 17. P. 217–225.
Solovyeva D.V., Vartanayan S.L., Vartanayan N. I-F., 2013. Artificial nest-sites for Scaly-sided Merganser Mergus squamatus (Gould, 1864) – a way to breeding habitat restoration // Amurian zoological journal. № 2. 201‒207.
Solovyeva D.V., Liu P., Antonov A.I., Averin A.A., Pronkevich V.V. et al., 2014. The population size and breeding range of the Scaly-sided Merganser Mergus squamatus // Bird Conservation International. V. 24. № 4. P. 393–405.
Westerkov K., 1950. Methods for determining the age of game bird eggs // Journal of Wildlife Management. V. 54. P. 627‒628.
Zhao Z.J., Zhang X.L., Zhang S.H., Wu J.C., Liu P.Q. et al., 1994. The breeding biology and foraging ecology of the Scaly-sided Merganser Mergus squamatus in the Changbai Mountains. China // The Scaly-sided Merganser Mergus squamatus in Russia and China. Hughes B., Hunter J. (Eds). TWRG Special Publ. № 1. Slimbridge: Wildfowl and Wetlands Trust. P. 24‒28.
Zicus M.C., 1990. Nesting Biology of Hooded Mergansers Using Nest Boxes // Journal of Wildlife Management. V. 54. № 4. P. 637.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал