Зоологический журнал, 2019, T. 98, № 3, стр. 245-259
Адаптивная морфология биссуса у Mytilus coruscus, Crenomytilus grayanus и Modiolus modiolus (Mytilidae, Bivalvia) из Японского моря
Е. Е. Вехова *
Национальный научный центр морской биологии ДВО РАН
690041 Владивосток, Россия
* E-mail: evechova@gmail.com
Поступила в редакцию 29.03.2018
После доработки 25.07.2018
Принята к публикации 10.08.2018
Аннотация
На примере трех массовых видов митилид мы изучили адаптации моллюсков к прикрепленному образу жизни. Установлено, что Mytilus coruscus, Crenomytilus grayanus, Modiolus modiolus характеризуются сходными чертами организации биссуса и его отдельных структур, соответствующих их функциональному значению. Показано, что Мyt. coruscus имеет наиболее короткие, толстые биссусные нити с наиболее крупными, армированными прикрепительными дисками, что отражает адаптацию этого вида к обитанию в зоне моря с активной гидродинамикой. По сравнению с первым видом, C. grayanus и Mod. modiolus имеют более тонкие и длинные нити меньших размеров и co слабо армированными прикрепительными дисками; это свидетельствует об адаптации этих видов к обитанию в биотопах, защищенных от прямого волнового воздействия.
Для успешного выживания в прибойной зоне верхней сублиторали двустворчатые моллюски семейства Mytilidae на протяжении всей жизни используют способность прочно прикрепляться к субстрату посредством биссуса, также называемого биссусным аппаратом (Lee et al., 1990). Она дает митилидам ряд преимуществ перед другими двустворчатыми моллюсками с иным способом прикрепления. Наряду с прочной фиксацией, биссусное прикрепление обеспечивает более рассеянное и сглаженное воздействие волн на организм, чем у прочно цементирующихся моллюсков. Помимо этого, биссусная адгезия обеспечивает перманентную фиксацию: при неблагоприятных условиях моллюск может откинуть старый биссус и, переместившись в более пригодное местообитание, образовать новый (Waite, 1983, 1997; Denny, 1987; Denny et al., 1998). Таким образом, биссус является единственной структурой, которая связывает живые ткани моллюска с подстилающим субстратом. В основе биссусной адгезии митилид лежит способность молекул биссуса к когезии, что, несомненно, представляет огромный научный интерес.
До настоящего времени морфология биссуса двустворчатых моллюсков, а в частности биссусных нитей – структур, непосредственно участвующих в прикреплении моллюска к субстрату и ответственных за прочность его прикрепления, изучена методами электронной микроскопии у некоторых представителей рода Mytilus (Tamarin, Keller, 1972; Bairati, Vitellaro-Zuccarello, 1974; Allen et al., 1976; Price, 1983; Eckroat, Steel, 1993; Carrington, Gosline, 2004), Pinna (Fitton et al., 1953), Pinctada (Mikkelsen et al., 2004), Venerupis (Bieler et al., 2005), а также у Dreissena polymorpha (Eckroat, Steel, 1993; Bonner, Rockhill, 1994). Вместе с тем, накопился огромный багаж литературных данных по внешней морфологии биссуса на уровне световой микроскопии у ряда представителей двустворчатых моллюсков (табл. 1). Как и многие другие двустворчатые моллюски, эти виды оставляют биссус на постличиночной стадии развития для физической стабильности на субстрате и дальнейшего превращения во взрослую особь (Yonge, 1962).
Таблица 1.
Морфологические характеристики биссуса у некоторых представителей двустворчатых моллюсков (Bivalvia)
| Вид | l, мм | Цвет* | Корень | Стебель | Биссусные нити | Прикрепительные диски | Образ жизни | Источник |
|---|---|---|---|---|---|---|---|---|
| Mytilus edulis Linnaeus 1758 | ≥32 | Светло-бежевый | Есть | Есть | Все разделены | Диски | Эпифаунный | Brown, 1952; Fitton Jackson et al., 1953; Allen et al., 1976; Price, 1983; Бергер и др., 1985 |
| Mytilus galloprovincialis Lamark 1819 | ≥44 | Золотисто-желтые в проксимальной части, коричневые в дистальной | Есть | Есть | Все разделены | Диски | Эпифаунный | Bairati, Vitellaro- Zuccarello, 1974 |
| Mytilus californianus Conrad 1837 | ≥50 | Желтый | Есть | Есть | Все разделены | Диски | Эпифаунный | Carrington, Gosline, 2004 |
| Perna viridis Linnaeus 1758 | – | Желтовато- коричневый | Есть | Есть | Все разделены, рифленая проксимальная часть нити составляет ¾ длины | Диски | Эпифаунный | Banu et al., 1980 |
| Perna indica Kuriakose, Nair, 1976 | – | Желтовато- коричневый | Есть | Есть | Все разделены, рифленая проксимальная часть нити составляет ¾ длины | Диски | Эпифаунный | Banu et al., 1980 |
| Modiolus metcalfei Hanley 1843 | – | Темно- коричневый | Есть | Есть | Все разделены, с одной стороны нити рифленая проксимальная часть составляет ¾ длины | Диски | Полуинфаунный | Banu et al., 1980 |
| Septifer bilocularis (Linnaeus 1758) | – | Коричневый | Есть | Есть | Все разделены, рифленая проксимальная часть нити составляет ¾ длины | Диски | Эпифаунный | Banu et al., 1980 |
| Beguina variegatа (Bruguière 1792) | – | Желтовато- коричневый | Есть | Есть | Цилиндрические нити все разделены | Расширенные закругленные дистальные концы нитей | Эпифаунный | Banu et al., 1980 |
| Dreissena polymorpha (Pallas 1771) | 30 | Светло- коричневый | Есть | Есть | Все разделены, отходят пучком от дистального конца стебля | Диски | Эпифаунный | Eckroat, Steel, 1993; Bonner, Rockhill, 1994 |
| Mytilopsis sallei (Récluz 1849) | – | Желтовато- коричневый | Есть | Есть | Плоские нити все разделены, рифленая проксимальная часть нити составляет ¾ длины | Продолговатые диски | Эпифаунный | Banu et al., 1980 |
| Arca symmetrica Reeve 1844 | 4 | Желтый | – | – | Все части биссуса слиты в один тяж | Подошва | Эпифаунный | Banu et al., 1980 |
| Barbatia obliquata (Wood 1828) | 8 | Желтоватый | – | – | Все части биссуса слиты в один тяж | Подошва | Эпифаунный | Banu et al., 1980 |
| Venerupis galactites (Lamarck 1818) | ≥8 | Полупрозрачный | – | Есть | От одной до трех первичных лентовидных нитей отходят многочисленные вторичные нити | Диски | Инфаунный | Bieler et al., 2005 |
| Pinna nobilis Linnaeus 1758 | ≥138 | Золотисто- каштановый | Нет | Нет | Очень тонкие, все разделены | Нет | Полуинфаунный | Fitton Jackson et al., 1953 |
| Atrina vexillum Born 1778 | Желтовато-коричневый, иногда темно-коричневый | Есть | Есть | Прямые, все разделены | Диски | Полуинфаунный | Banu et al., 1980 | |
| Mantellina translucens Harasewych, Temkin 2015 | ≥50 | Светло-зеленые нити | Есть | Нет | Все разделены, сливаются проксимально | Диски, иногда слитые вместе | Эпифаунный | Harasewych, Tёmkin, 2015 |
| Pinctada fucata Gould 1850 | 30 | Зеленый | Есть | Есть | Все разделены | Диски | Эпифаунный | Dharmaraj et al., 1987 |
| Pinctada longisquamosa (Dunker 1852) | – | Золотисто- зеленый | Есть | Нет | Все разделены, сливаются частично проксимально | Веерообразные диски | Эпифаунный, эпибионт | Mikkelsen et al., 2004 |
| Pinctada imbricate Röding 1798 | 18 | Коричнево- зеленый | Есть | Есть | Все разделены | Кисточки, иногда слитые вместе | Эпифаунный | Vekhova, 2013 |
| Pinctada mazatlanica (Hanley 1856) | 30 | Зеленый стебель, желтовато- зеленые нити | Есть | Есть | Все разделены | Кисточки, иногда слитые вместе | Эпифаунный | Vekhova, 2013 |
| Pinctada margaritifera (Linnaeus 1758) | 30 | Темно-зеленый | Есть | Есть | Все разделены | Диски | Эпифаунный | Banu et al., 1980; Vekhova, 2013 |
| Pinctada capensis (Sowerby1889) | 60 | Коричневый стебель, коричнево-зеленые нити | Есть | Есть | Все разделены | Кисточки, иногда слитые вместе | Эпифаунный, эпибионт | Vekhova, 2013 |
| Pteria brevialata (Dunker 1872) | 21 | Темно- коричневый | Есть | Есть | Полностью слиты | Один диск-подошва | Эпибионт | Vekhova, 2013 |
| Pteria hirundo (Linnaeus 1758) | 22 | Коричневый | Есть | Есть | Слиты проксимально | Диски, иногда слитые вместе | Эпибионт | Vekhova, 2013 |
| Pteria howensis Lamprell, Healy 1997 | 12 | Светло- коричневый | Есть | Есть | Полностью слиты | Один диск-подощва | Эпибионт | Vekhova, 2013 |
| Pteria loveni (Dunker 1879) | 17 | Темно- коричневый | Есть | Есть | Полностью слиты | Один диск-подошва | Эпибионт | Vekhova, 2013 |
| Electroma papilionacea (Lamarck 1819) | 10 | Светло-желтый | Есть | Есть | Все разделены | Кисточки | Эпифаунный, эпибионт | Vekhova, 2013 |
| Electroma alacorvi (Dillwyn 1817) | 8 | Коричневый стебель, зеленые нити | Есть | Есть | Все разделены | Кисточки, иногда слитые вместе | Эпифаунный, эпибионт | Vekhova, 2013 |
| Isognomon nucleus (Lamarck 1819) | – | Темно-зеленый | Есть | Есть | Лентовидные нити разделены | Диски | Эпифаунный | Banu et al., 1980 |
| Isognomon ephippium (Linnaeus 1758) | 28 | Коричнево- зеленый стебель, зеленые нити | Есть | Есть | Слиты частично | Кисточки | Эпифаунный, эпибионт | Vekhova, 2013 |
| Malleus malleus (Linnaeus 1758) | 30 | Коричневый стебель, зеленые нити | Есть | Есть | Слиты проксимально до ⅔ длины | Диски | Эпифаунный | Vekhova, 2013 |
| Malleus albus Lamarck 1819 | 14 | Темно-коричневый стебель, зелено-коричневые нити | Есть | Есть | Слиты проксимально до ⅔ длины | Кисточки | Полуинфаунный | Vekhova, 2013 |
| Pulvinites exempla (Hedley 1914) | 21 | Золотистый | Есть | Есть | Раздельные, радиально направленные, плоские нити, слиты частично проксимально | Диски | Эпифаунный | Tёmkin, 2006; Vekhova, 2013 |
Это ограничивает создание цельного представления о совокупности адаптивных черт организации разных видов двустворчатых моллюсков, лежащих в основе закономерностей их современного пространственного распределения. Прочность прикрепления митилид в значительной мере определяется морфологическим строением нитей и прикрепительных дисков, которые, судя по некоторой разобщенности мест обитания исследуемых видов моллюсков (Higo et al., 1999; Lutaenko, Noseworthy, 2012; Голиков, Скарлато, 1967; Скарлато и др., 1967; Скарлато, 1981), по-видимому, также должны различаться. Поэтому мы провели сравнительный межвидовой анализ морфологических особенностей строения этих структур.
Цель работы – провести сравнительный анализ морфологии биссусного аппарата в целом и нитей в частности, а также оценить изменение параметров биссусных нитей в онтогенезе моллюсков, чтобы выявить характерные черты адаптации мидии блестящей (Mytilus coruscus Gould 1861), мидии Грея (Crenomytilus grayanus (Dunker 1853)) и модиолуса (Modiolus modiolus (Linnaeus 1758)) к прикрепленному образу жизни в прибрежной зоне море.
МАТЕРИАЛ И МЕТОДИКА
Для сравнительного анализа параметров биссусных нитей использовали исследуемых моллюсков, собранных вместе с субстратом в 2006–2016 гг. с помощью водолазной службы Национального научного центра морской биологии ДВО РАН на глубине 1‒3 м в заливе Восток (залив Петра Великого, Японское море) с крупных валунов и скал на участке дна. Этот мыс представляет собой умеренно защищенное побережье и относится к третьему биономическому типу сублиторали (3-я степень прибойности) (Лукин, Фадеев, 1982). В лабораторных условиях с помощью штангенциркуля с точностью до ± 0.1 мм измеряли длину раковины (L, мм) у каждого моллюска, на весах ВЛКТ-500 с точностью до ± 0.1 г у них оценивали прижизненную массу тела (W, г). По кольцам роста на наружной поверхности раковины и структурным меткам на продольном спиле створки оценивали возраст моллюсков (Золотарев, 1989). У 11–24 экз. каждого вида с длиной раковины 15–140 мм изучали морфологические особенности функциональных нитей (прикрепленных к грунту) и инертных нитей, место локализации на биссусном стебле, окраску, размер, а также оценивали их количество. У каждой особи случайным образом брали по 30 неповрежденных нитей из разных частей биссусного стебля и измеряли их длину. Под бинокуляром при окулярах ×8 и тубусе ×7 оценивали ширину нитей в проксимальной (q, мкм) и дистальной частях (t, мкм), в местах перехода проксимального участка нити в дистальный (v, мкм) и дистального участка нити в диск (s, мкм), а также долю проксимального участка нити от всей ее длины (Dp, %), измеряли диаметр прикрепительного диска вдоль наибольшей и наименьшей осей. Результаты измерения использовали для расчета средних величин параметров биссуса у моллюсков одного возраста и для расчета средних для вида величин длины (l, мм), ширины (d, мм) нити, диаметра диска (В, мм). На основании полученных измерений рассчитаны уравнения регрессии парных зависимостей, позволяющие статистически оценить изменения в онтогенезе моллюсков этих параметров. В качестве математической модели использовали степенное уравнение Y = aX b и уравнение линейной зависимости Y = a + bX, где Y – зависимая переменная l, d (B), X – независимая переменная L (W), a и b – коэффициенты, определяемые расчетным путем по эмпирическим данным. Критерием успешного подбора математической модели для описания данных той или иной парной зависимости послужили высокие показатели совпадения расчетных и эмпирических данных. Для изучения морфологии продольных тяжей на внешней поверхности дисков случайным образом брали по 30 неповрежденных биссусных нитей у 10 экз. каждого вида одного возраста и под бинокуляром при окулярах ×8 и тубусе ×7 изучали особенности расположения и длину армирующих продольных тяжей на внешней поверхности прикрепительного диска, подсчитывали их количество.
Внешнюю морфологию биссусных нитей изучали методами световой микроскопии (СМ) и сканирующей электронной микроскопии (СЭМ). Для этого использовали моллюсков одного возраста с длиной раковины C. grayanus 61 ± 5 мм, Myt. coruscus 61 ± 4 мм и Mod. modiolus 59 ± 7 мм, собранных в том же биотопе. Для СЭМ образцы биссусных нитей фиксировали в 2.5% растворе глютаральдегида, приготовленном на фосфатном буфере (pH 7.4) в течение 24–48 ч при температуре 5°С, затем промывали их 15 мин в том же буфере и обезвоживали в спиртах возрастающей концентрацией, постепенно доводя до чистого ацетона (Миронов и др., 1994). После этого образцы окончательно высушивали в диоксиде углерода по методике сушки в критической точке, используя прибор critical point dryer 030 фирмы “BAL-TEC”, помещали на поверхность алюминиевых столиков и напыляли хромом, используя вакуумный прибор для покрытия тонких мембран Q 150T ES. После чего особенности морфологии полученных образцов биссуных нитей трех видов митилид исследовали на сканирующем электронном микроскопе Carl Zeiss, Evo 40. Для изучения внутренней морфологии биссусных нитей (10 экз.) их аккуратно под бинокуляром фрагментировали на дистальный и проксимальный участки, замораживали в жидком азоте и выполняли криосколы. Далее образцы подготавливали по вышеописанной методике (Миронов и др., 1994) для изучения с помощью СЭМ. Все полученные изображения редактировали с использованием графической программы Adobe Photoshop CS6.
Статистическую обработку данных выполняли с использованием обычных приемов корреляционно-регрессионного и дисперсионного анализов на персональном компьютере по стандартным алгоритмам, реализованным в пакетах прикладных программ Statgraphics Plus for Windows и Microsoft Excel. Различие между одноименными парными зависимостями считали значимым, если сравниваемые линии регрессии различались углом наклона и/или одна из них значимо превышала другую при уровне значимости (p) не менее 95% и высоком значении критерия Фишера (F факт.).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Общий план организации биссуса у трех видов митилид Японского моря
Результаты исследований показали, что биссус у Myt. coruscus, C. grayanus и Mod. modiolus характеризуется сходным строением с таковым других представителей семейства Mytilidae, в частности рода Mytilus (Brown, 1952; Tamarin, Keller, 1972; Bairati, Vitellaro-Zuccarello, 1974; Price, 1983; Eckroat, Steel, 1993; Бергер и др., 1985) (табл. 1). Он состоит из корня, стебля и биссусных нитей цилиндрической формы в поперечном сечении, оканчивающихся прикрепительными дисками (рис. 1; 2а, 2б). Корень биссуса глубоко внедрен в проксимальную часть ноги и связан посредством мышц-ретракторов с раковиной моллюска. Cтебель распространяется в вентральном направлении от корня и выходит из раковины наружу через биссусное зияние. От стебля отходят биссусные нити, с помощью которых моллюски прикрепляются к субстрату и которые ориентированы к макушкам и задней части раковины митилид. При детальном рассмотрении можно видеть, что стебель имеет ламеллярную структуру и окружен со всех сторон манжетами, которые дают начало биссусным нитям (рис. 2). При этом, в центральной части пластинки стебля плотно упакованы в округлый сердечник и расположены под углом 90° относительно вентральной бороздки ноги (рис. 2а, 2б). Снаружи, словно футляр, сердечник охватывается сросшимися манжетами (рис. 2б).
Рис. 1.
Внешний вид биссуса у Mytilus coruscus (а), Crenomytilus grayanus (б) и Modiolus modiolus (в). Длина раковины моллюсков 103 мм. Масштаб 1 см.

Рис. 2.
Морфологическое строение биссусного аппарата митилид на примере Crenomytilus grayanus (СЭМ): а – фрагмент ноги и выходящего из нее биссуса; б – поперечный срез стебля биссуса; в – фрагмент биссусной нити; г – поперечное сечение биссусной нити в дистальной части; д – криоскол дистального участка биссусной нити; е – криоскол проксимального участка биссусной нити. Масштаб мкм.
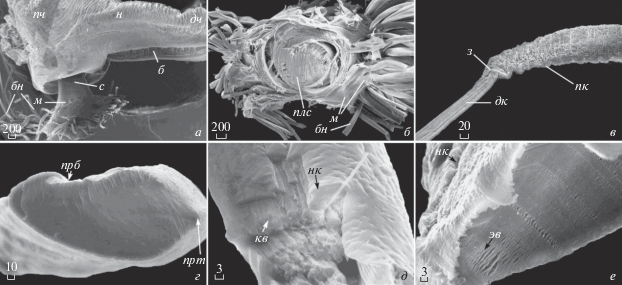
Такое морфологическое сходство характерно и для других структур у представителей этого семейства, что объясняется сходством выполняемых ими функций и одинаковым образом жизни моллюсков (Selin, Vekhova, 2002; Vekhova, 2013a). Наряду со сходством эти виды характеризуются также некоторыми различиями внешней морфологии биссуса, обусловленными их обитанием в разных биотопах (Selin, Vekhova, 2002; Скарлато, 1981). У Myt. coruscus на участке стебеля расположены несущие лишь функциональную нагрузку нити, непосредственно участвующие в прикреплении моллюска (рис. 1а). Оценка соотношения функциональных и инертных нитей на стебле у особей размером 15–140 мм показала, что у этого вида более 90% нитей участвуют в прикреплении моллюска к субстрату. По-видимому, в условиях высокой волновой активности, что соответствует 3-й степени прибойности побережья (Лукин, Фадеев, 1982), характерной для мест обитания Myt. coruscus, поврежденные нити не сохраняются на стебле.
У C. grayanus и Mod. modiolus стебель гораздо тоньше и длиннее (рис. 1б, 1в), чем у Myt. coruscus (рис. 1а); даже при сомкнутых створках он часто распространяется наружу через биссусное зияние, доля инертных нитей составляет около 70%. Можно предположить, что процесс удаления инертных нитей у C. grayanus и Mod. modiolus происходит значительно медленнее, чем у Myt. coruscus, что вполне соответствует адаптации этих видов к существованию в более стабильных условиях (Higo et al., 1999; Selin, Vekhova, 2002; Lutaenko, Noseworthy, 2012; Vekhova, 2013a; Голиков, Скарлато, 1967; Скарлато и др., 1967; Скарлато, 1981).
Отмеченные особенности согласуются с различиями окраски стебля и биссуса у трех исследуемых митилид. В целом, разное индивидуальное соотношение функциональных и инертных нитей демонстрируют широкий цветовой спектр, что в полнее согласуется с литературными данными (табл. 1). В независимости от исследуемого вида митилид, удлиненный проксимальный конец стебля биссуса у взрослых особей, как правило, был серо-черного цвета. Дистальный участок стебля всегда желто-коричневых оттенков, как и прикрепленные к нему манжетами биссусные нити. У Мyt. coruscus стебель и нити, как правило, светло- или красно-коричневого цвета, при этом биссусные нити в проксимальной части светлее (рис. 1а). У С. grayanus стебель светло-серого цвета, нити окрашены светло-серым иногда темно-серым цветом в проксимальной части и светло-желтым в дистальной (рис. 1б). У Mod. modiolus стебель и биссусные нити могут быть различного цвета: серого, бежевого или даже черного (рис. 1в). Все наблюдаемые различия биссуса у этих трех видов митилид соответствуют особенностям условий их местообитания (Selin, Vekhova, 2002; Скарлато и др., 1967; Скарлато, 1981). У моллюсков, взятых из природных условий, прикрепительные диски темнее биссусных нитей, однако в экспериментальных условиях недавно образованные биссусные нити и их диски у всех трех видов были светло-желтого цвета (Vekhova, 2006).
Изменение в онтогенезе моллюсков морфометрических показателей биссусных нитей у Crenomytilus grayanus, Mytilus coruscus и Modiolus modiolus
У исследуемых видов митилид наблюдаются значительные различия в морфометрии биссусных нитей, хотя в целом они имеют сходный план строения. Проведенные нами исследования показали (табл. 2), что между параметрами биссусной нити и тела моллюска существует тесная связь (коэффициент детерминации 51.8–89.6%). Согласно эмпирическим данным зависимость длины, ширины нити и диаметра диска от размера и массы тела моллюсков хорошо аппроксимируется уравнением линейной зависимости Y = a + bX, где Y – зависимая переменная (длина, ширина нити или диаметр диска), Х длина (масса) тела, a и b коэффициенты, рассчитанные по эмпирическим данным (табл. 2).
Таблица 2.
Параметры уравнений, описывающих взаимосвязь между длиной и шириной биссусных нитей, диаметром дисков, размером и массой тела у Crenomytilus grayanus, Mytilus coruscus и Modiolus modiolus
| Вид | Коэффициенты ± ошибки | R2 | p | n | |
|---|---|---|---|---|---|
| a ± SE ln a | b ± SEb | ||||
| C. grayanus | 5.8786 ± 3.6562 | 0.2103 ± 0.0365 | 64.8 | <0.001 | 20 |
| Myt. coruscus | –0.1832 ± 3.0206 | 0.2308 ± 0.0344 | 83.3 | <0.001 | 11 |
| Mod. modiolus | 8.5832 ± 1.9153 | 0.2022 ± 0.0229 | 89.6 | <0.001 | 11 |
| C. grayanus | 15.2353 ± 2.9246 | 0.0703 ± 0.0165 | 51.8 | <0.001 | 19 |
| Myt. coruscus | 11.5362 ± 2.2437 | 0.0609 ± 0.0132 | 70.2 | <0.001 | 11 |
| Mod. modiolus | 16.3901 ± 1.6758 | 0.0983 ± 0.0165 | 79.7 | <0.001 | 11 |
| C. grayanus | 0.0523 ± 0.0118 | 0.0007 ± 0.00012 | 63.6 | <0.001 | 21 |
| Myt. coruscus | 0.0409 ± 0.0335 | 0.0020 ± 0.00040 | 72.4 | <0.001 | 12 |
| Mod. modiolus | 0.0385 ± 0.0109 | 0.0005 ± 0.00013 | 65.0 | <0.001 | 11 |
| C. grayanus | 0.0776 ± 0.0073 | 0.00024 ± 0.00004 | 64.8 | <0.001 | 20 |
| Myt. coruscus | 0.1460 ± 0.0225 | 0.00050 ± 0.00014 | 57.0 | <0.001 | 12 |
| Mod. modiolus | 0.0594 ± 0.0076 | 0.00025 ± 0.00007 | 56.0 | <0.001 | 11 |
| C. grayanus | 0.3047 ± 0.0342 | 0.0036 ± 0.00035 | 83.7 | <0.001 | 22 |
| M. coruscus | 0.3626 ± 0.0839 | 0.0116 ± 0.00095 | 87.1 | <0.001 | 24 |
| M. modiolus | 0.3652 ± 0.0329 | 0.0029 ± 0.00039 | 81.4 | <0.001 | 14 |
| C. grayanus | 0.4488 ± 0.0329 | 0.0012 ± 0.00019 | 67.5 | <0.001 | 22 |
| Myt. coruscus | 1.0636 ± 0.0544 | 0.0029 ± 0.00041 | 69.4 | <0.001 | 24 |
| Mod. modiolus | 0.4867 ± 0.0287 | 0.0013 ± 0.00028 | 62.4 | <0.001 | 14 |
Линии регрессии, построенные по соответствующим уравнениям регрессии (рис. 3, табл. 2), свидетельствуют, что в онтогенезе моллюсков, по мере увеличения длины раковины и массы тела, длина и ширина нити, а также диаметр диска увеличиваются. Аналогичные изменения отражены и в литературе (Allen et al., 1976; Бергер и др., 1985). Согласно полученным результатам, на протяжении всей жизни при равной длине раковины наиболее длинные биссусные нити имеет Mod. modiolus, а самые короткие Myt. coruscus (рис. 3а). C. grayanus характеризуется промежуточными величинами (рис. 3а). Например, у моллюсков размером 30 и 120 мм длина биссусных нитей у этих трех видов составляет в среднем соответственно 15 и 33 мм; 7 и 27.5 мм; 12 и 31 мм. Различия между C. grayanus и Myt. coruscus, а так же между Myt. coruscus и Mod. modiolus статистически значимы (F факт. = 5.1‒18.8, р = 0.05), между C. grayanus и Mod. modiolus носят случайный характер (F факт. = = 1.3, p > 0.05). Та же картина наблюдается при анализе онтогенетической изменчивости длины биссусных нитей моллюсков относительно прижизненной массы тела моллюсков (рис. 3б, табл. 2). Различия между этими видами статистически значимы (F факт. = 4.4‒15, р = 0.05).
Рис. 3.
Изменение в онтогенезе соотношения между параметрами биссусных нитей, размером и массой тела у Crenomytilus grayanus (1), Mytilus coruscus (2) и Modiolus modiolus (3): а − изменение длины нити относительно длины раковины; б − изменение длины нити относительно массы тела; в − изменение ширины нити относительно длины раковины; г − изменение ширины нити относительно массы тела; д – изменение диаметра диска нити относительно длины раковины; е − изменение диаметра диска нити относительно массы тела.
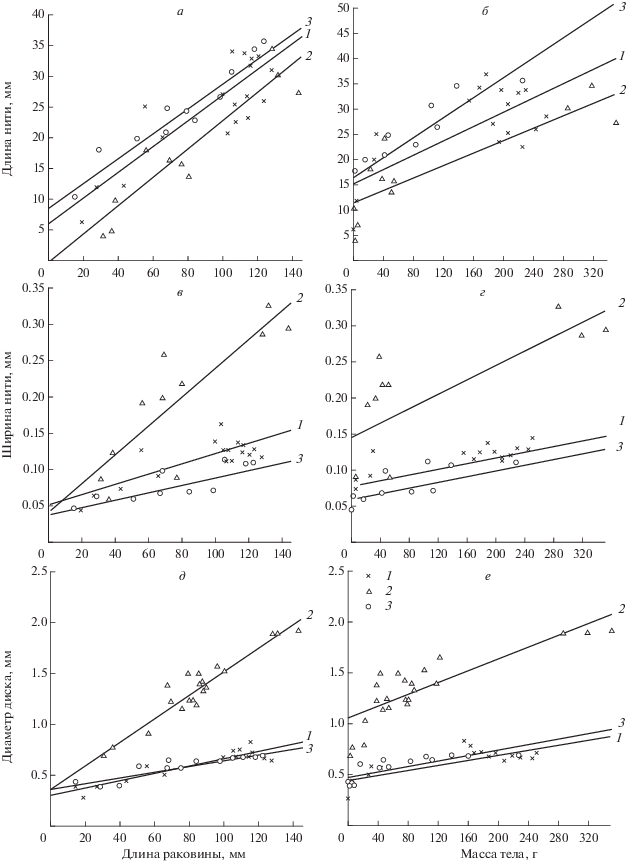
Несколько иная картина прослеживается при анализе онтогенетического изменения ширины биссусной нити относительно размера и массы тела моллюсков. Оказывается, что с ранних этапов онтогенеза при равной длине раковины (массе тела) моллюсков ширина биссусных нитей наибольшая у Myt. coruscus и самая маленькая у Mod. modiolus (рис. 3в, 3г). Например, у особей размером 30 и 120 мм ширина биссусных нитей для этих трех видов составляет в среднем соответственно 0.1 и 0.3 мм, 0.05 и 0.1 мм, 0.07 и 0.14 мм. Во всех случаях наблюдаемые различия статистически значимы (F факт. = 17‒73, р < 0.001).
Результаты свидетельствуют (рис. 3д, 3е), что моллюски различаются размером прикрепительного диска на значимом уровне (F факт. = = 187‒706, р < 0.001), лишь между C. grayanus и Mod. modiolus эти различия носят случайный характер (F факт. = 0.05‒1.9, p > 0.05). Отчетливо видно, что Myt. coruscus имеет значимо больший диаметр прикрепительного диска, чем C. grayanus и Mod. modiolus. У последних двух видов диаметр прикрепительного диска почти не изменяется по мере увеличения в онтогенезе размера раковины и массы тела (табл. 2). При длине раковины 30 и 120 мм диаметр диска у Myt. coruscus равен в среднем соответственно 0.7 и 1.75 мм, у C. grayanus – 0.45 и 0.74 мм, у Mod. modiolus – 0.4 и 0.7 мм.
Наблюдаемые межвидовые различия параметров биссусных нитей отражают адаптации моллюсков к обитанию в разных условиях прибрежной зоны моря, вполне соответствующие особенностям их пространственного распределения, роста и биологическим чертам строения (Higo et al., 1999; Selin, Vekhova, 2002; Lutaenko, Noseworthy, 2012; Vekhova, 2013a; Голиков, Скарлато, 1967; Скарлато и др., 1967, Скарлато, 1981). Еще адаптации моллюсков видны еще более отчетливо при исследовании внешней морфологии биссусных нитей и прикрепительного диска методами световой и сканирующей электронной микроскопии (табл. 3).
Таблица 3.
Некоторые параметры биссусных нитей у Crenomytilus grayanus, Mytilus coruscus и Modiolus modiolus из Японского моря, полученные по результатам СМ и СЭМ
| Вид | l, мм | Dp, % | d, мм | B, мм | q, мкм | v, мкм | t, мкм | s, мкм | n |
|---|---|---|---|---|---|---|---|---|---|
| C. grayanus | 23 ± 7 | 11.4 ± 2 | 0.1 ± 0.08 | 0.7 ± 0.2 | 100–135 | 80 | 40‒70 | 88–209 | 10 |
| Myt. coruscus | 22 ± 6 | 17.2 ± 4 | 0.2 ± 0.03 | 1.2 ± 0.5 | 220–250 | 180 | 120‒150 | 118–327 | 10 |
| Mod. modiolus | 31 ± 9 | 6.4 ± 2 | 0.1 ± 0.02 | 0.9 ± 0.2 | 50–110 | 67 | 20‒55 | 82–187 | 10 |
Сравнительная морфология биссусных нитей у Crenomytilus grayanus, Mytilus coruscus и Modiolus modiolus
У исследованных видов митилид в пределах каждой биссусной нити условно можно выделить рифленую проксимальную часть, составляющую ⅓ ее длины, и относительно гладкую, упругую дистальную часть (⅔ длины нити). Эта дистальная часть заканчивается клейким диском, посредством которого моллюск прикрепляется к субстрату (рис. 1, 4). Характерные участки нити были отмечены также у других представителей семейства Mytilidae: Myt. galloprovincialis, Myt. edulis, Myt. californianus и др. (Tamarin, Keller, 1972; Bairati, Vitellaro-Zuccarello, 1974; Price, 1983; Bell, Gosline, 1996; Carrington, Gosline, 2004) (табл. 1). Отмечено, что формирование биссуса тесно связано с единой для митилид природой механических процессов, протекающих в продольной бороздке и дистальной ямке ноги в момент формирования нити и ее прикрепления к поверхности субстрата (Pujol et al., 1970; Price, 1983; Waite, 1983). Даже невооруженным глазом заметно, что биссусные нити различаются не только длиной и шириной, но и строением (рис. 1; 2в), поэтому мы предприняли детальное исследование биссусных нитей в местах перехода проксимальной части нити в дистальную и дистальной части нити в прикрепительный диск (табл. 3).
Рис. 4.
Морфология биссусной нити Mytilus сoruscus (а, г, ж, к), Crenomytilus grayanus (б, д, з, л) и Modiolus modiolus (в, е, и, м) (СЭМ): а–в ‒ наружная поверхность прикрепительного диска; г–е ‒ подошва диска; ж–и – дистальный участок биссусной нити; к–м – проксимальный участок биссусной нити. Масштаб мкм.
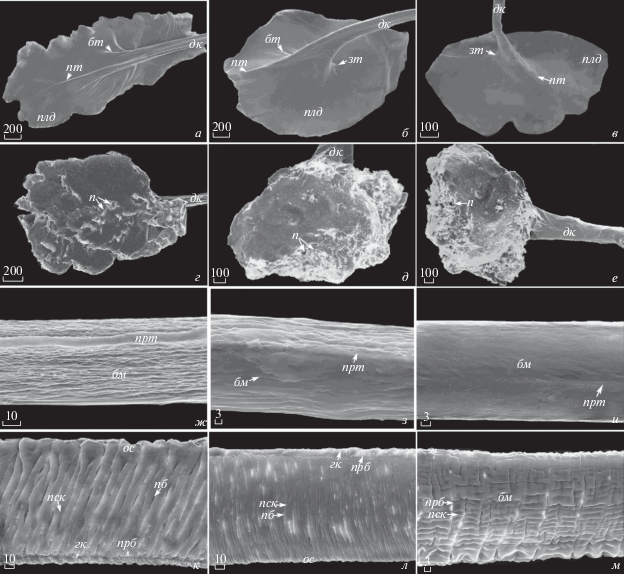
Проксимальная часть нити. Полученные результаты свидетельствуют (рис. 1, 2а, 2б), что стебель биссуса по всей его длине плотно охватывается со всех сторон манжетами, от которых в двух направлениях отходят биссусные нити: вперед к макушке раковины и в обратном направлении к заднему концу раковины, чтобы смягчить отраженное волновое воздействие, постоянно оказываемое на раковину митилид силами окружающей среды (Denny, 1987; Denny et al., 1998). Проксимальный участок нити начинается за манжетой (рис. 1; 2б). Согласно полученным в работе данным по микроскопии наиболее часто биссусные нити рвутся у исследуемых моллюсков в проксимальной части (рис. 1; 2). На рис. 4 отчетливо видно, что поверхность нити покрыта многочисленными поперечными складками и бороздами, ориентированными почти перпендикулярно продольной оси нити. Ширина нити варьирует вдоль нити у каждой особи и различается как в пределах вида, так и между ними (рис. 2в; 4). Наибольшая ширина нити в проксимальном участке была отмечена у Myt. coruscus (табл. 3), а наименьшая – у Mod. modiolus и составляет всего 50 мкм (табл. 3). Складчатая поверхность проксимального участка нити с двух сторон очерчивается гофрированной каймой. Кайма проходит в виде мелких, близко расположенных друг к другу складочек более мелкого порядка и с одной стороны может быть выражена значительно слабее или вовсе отсутствовать, например, в ряде случаев у модиолуса (рис. 4м). У Myt. coruscus (рис. 4к) отмечается наиболее широкая кайма, которая составляет в среднем 9–30 мкм. У C. grayanus и Mod. modiolus ее ширина варьирует соответственно 5–16 и 2–5 мкм (рис. 4л, 4м). Между основными складками и мелкими складочками, отделяя кайму, проходит продольная борозда (рис. 4). Степень компактности складок изменяется вдоль проксимального участка нити у всех трех видов митилид. Так, у Myt. coruscus ширина основных поперечных складок в центральной части проксимального участка нити варьирует в среднем 10‒34 мкм, у C. grayanus – 3‒13 мкм, у Mod. modiolus – 2‒8 мкм (табл. 3). Например, на 30 мкм длины нити у первого, второго и третьего вида приходится соответственно 2, 7 и 6 складок.
Сравнительный анализ свидетельствует, что у Myt. coruscus наиболее широкий и длинный, лучше армированный проксимальный участок нити, чем у двух других видов (рис. 4, табл. 3). По-видимому, проксимальный участок амортизирует механические нагрузки (Bell, Gosline, 1996; Gosline et al., 2002; Carrington, Gosline, 2004), связанные с волновой активностью (Denny, 1987; Denny et al., 1998). Таким образом, Myt. coruscus лучше адаптирован к условиям обитания в прибрежной зоне моря с высокой волновой активностью, чем C. grayanus и Mod. modiolus (Higo et al., 1999; Selin, Vekhova, 2002; Lutaenko, Noseworthy, 2012; Голиков, Скарлато, 1967; Скарлато, 1981).
Дистальная часть нити. Морфология места перехода проксимального участка нити в дистальный участок сочетает в себе их структурные черты (рис. 2в). У всех трех видов митилид в этом месте наблюдается плавный изгиб нити. Ширина нити здесь варьирует (табл. 3). Дистальный участок нити начинается после переходной зоны (рис. 2в), непосредственно за проксимальным участком нити и заканчивается участком перехода дистальной части в прикрепительный диск. Поверхность нити в дистальной части гладкая (рис. 4). Вдоль поверхности тянется хорошо заметный, плотный округлый продольный тяж, занимающий латеральное положение на одной из сторон нити (рис. 2г, 4). В поперечном сечении биссусная нить сплющенная в форме эллипса (рис. 2г). Вдоль дистального участка нити тянется продольная борозда (рис. 4ж, 4з, 4и). У Myt. coruscus нити с более мощным продольным тяжом и глубокой продольной бороздой, которые наименее выражены у нитей C. grayanus и Mod. modiolus. Для мидий Myt. coruscus и C. grayanus на поверхности нити характерно наличие едва заметных мелких бугорков и более мелких бороздок, тогда как у модиолуса она более гладкая (рис. 4ж, 4з, 4и). Дистальная часть, как правило, варьирует у каждой особи по ширине и самая широкая у мидии Myt. coruscus, а наиболее тонкая ‒ у модиолуса Mod. modiolus (табл. 3).
Место перехода дистального участка нити в прикрепительный диск широкое и слегка уплощенное, с бороздами и армирующими тяжами на поверхности, которые наиболее выражены у Myt. coruscus, у C. grayanus борозды и тяжи мельче и значительно короче, а у Mod. modiolus они слабо выражены (рис. 4а, 4б, 4в). Наиболее широкая нить в этом участке у Myt. coruscus, по сравнению с шириной нити у двух других исследованных видов митилид (табл. 3).
Прикрепительный диск. На дистальном конце нить заканчивается прикрепительным диском, хорошо заметным невооруженным глазом (рис. 1а‒в; 4а–4в). Он имеет вид уплощенной пластинки в форме эллипса. Этот эллипс ориентирован продольной осью вдоль направления максимальной механической нагрузки, испытываемой нитью при волновом воздействии. У Myt. coruscus продольная ось нити располагается под углом к плоскости диска (рис. 4а). Для C. grayanus и Mod. modiolus характерно, что плоскость диска ориентирована перпендикулярно к продольной оси нити (рис. 4б, 4в). Нижняя поверхность дисков повторяет контур субстрата и по внешней структуре напоминает застывшую пену (рис. 4г‒4е).
На поверхности диска различимы округлые тяжи (рис. 4а‒4в). Для всех трех видов митилид характерен один мощный тяж, распространяющийся по поверхности диска до его края и ориентированный вперед к макушкам раковины моллюска (рис. 4а‒4в). Наряду с ним, обычно отчетливо виден задний тяж, ориентированный симметрично переднему, но не доходящий до края пластинки диска (рис. 4а–4в). Кроме этого, наблюдаются от одного до четырех боковых, менее выраженных тонких коротких тяжей. Для каждого вида митилид характерно разное количество тяжей (рис. 4а‒4в). У Myt. coruscus их бывает до шести, у C. grayanus и Mod. modiolus – не более четырех. У первого вида прикрепительные диски с двумя, тремя, четырьмя, пятью и шестью тяжами встречаются соответственно в 2, 38, 43, 7 и 10% случаев. У C. grayanus диски с двумя, тремя и четырьмя тяжами составляют соответственно 30, 50 и 20%, у Mod. modiolus – соответственно 76, 17, 7%. Лишь в ряде случаев (0.4%) у модиолуса Mod. modiolus диски были с одним передним тяжом. По-видимому, расположение тяжей на диске и степень их выраженности показывает направление волнового воздействия на моллюска, который испытывает фронтальное, отраженное, а также более или менее выраженные боковые воздействия волн (Denny, 1987; Denny et al., 1998). Наши результаты, касающиеся степени армированности дисков, также вполне согласуются с литературными данными, полученными в ходе экспериментальной работы (Wi et al., 2005). По мнению авторов, такое строение прикрепительных дисков у Myt. coruscus и Myt. edulis связано с прикрепительными способностями биссусных нитей, что может учитываться при культивировании этих митилид.
В целом, строение биссусной нити наглядно отражает комплекс морфологических адаптаций, направленных на улучшение физической стабильности моллюска на поверхности или в верхних слоях субстрата. Широкая и уплощенная пластинка прикрепительного диска прочно фиксирует нить на поверхности субстрата, в то время как другой конец нити прочно связывается с моллюском прикрепительной манжетой, в виде обруча плотно обхватывающего стебель биссуса со всех сторон. Между двумя этими “крепежами” находится участок нити, выполняющий функцию швартового каната, в дистальной части прочного и упругого, а в проксимальной ‒ чрезвычайно эластичного и растяжимого в продольном направлении. Такое строение нити позволяет максимально поглощать механическое напряжение (Bell, Gosline, 1996; Gosline et al., 2002; Carrington, Gosline, 2004), вызванное воздействием волн, течений и других сил (Denny, 1987; Denny et al., 1998). На сегодняшний день более полные сведения о механических свойствах биссусных нитей мидилид приведены лишь для одного вида: Myt. edulis (Allen et al., 1976; Smeathers, Vincent, 1979; Бергер и др., 1985). Коллагеновые волокна, входящие в состав биссусных нитей, имеют различные молекулярные градации, что отражается на потенциальной энергии, освобождающейся при воздействии механической нагрузки (Bell, Gosline, 1996; Carrington, Gosline, 2004). Биссусные нити моллюсков и шелк паучьей сети относятся к биополимерам с эластичной структурой из-за их значительной прочности, жесткости и растяжимости (Gosline et al., 2002). По некоторым данным (Smeathers, Vincent, 1979), биссусные нити митилид имеют довольно высокий предел прочности на разрыв, который превышает растяжение многих других биополимеров. Известно, что дистальная часть биссусных нитей в 5 раз прочнее сухожилий позвоночных животных (Qin, Waite, 1995; Waite, 1997). Прочность биссусных нитей в проксимальной части невелика по сравнению с дистальной частью, однако растяжимость проксимального участка нити в 15–20 раз выше, благодаря чему нить может удлиняться на 120–140% от ее оригинальной величины. Таким образом, по нашим данным различия биомеханических свойств биссусных нитей являются отражением морфологических различий в структуре дистального и проксимального участков нити образующего их материала (Waite, 1983; Qin, Waite, 1995; Waite, 1997). Такая структура детально просматривается при увеличении сколов дистального и проксимального участков биссусных нитей (рис. 2д, 2е). В центральной части дистального участка нить состоит из прочных коллагеновых волокон, упакованных в плотные пучки диаметром 0.85‒1.7 мкм, тогда как на проксимальном участке нити эти волокна имеют более растяжимую, эластичную структуру и покрыты снаружи плотной оболочкой ‒ кутикулой (рис. 2д, 2е). Такие различия в строении отдельных участков биссусной нити в значительной мере объясняют различия в их прочности: наиболее низкая прочность в рыхлой, растяжимой проксимальной части, где при создании механической нагрузки в 90‒92% случаях происходит разрыв нити. Это является характерным не только для Myt. coruscus, C. grayanus и Mod. modiolus, но, согласно литературным данным, и для других видов моллюсков (Allen et al., 1976; Smeathers, Vincent, 1979; Bell, Gosline, 1996).
Результаты наглядно свидетельствуют, что двустворчатые моллюски C. grayanus, Myt. coruscus и Mod. modiolus имеют как сходные черты организации биссуса, связанные с их прикрепленным образом жизни, так и существенные различия, отражающие длительный эволюционный процесс адаптации каждого вида к обитанию в определенных условиях. Эти особенности позволяют моллюскам вырабатывать адаптации, обеспечивающие им быстрое и прочное прикрепление к грунту, противостояние гидродинамическому воздействию среды и хищникам, а также нормальное осуществление всех других жизненных функций. У митилид стабильное положение на грунте в значительной мере обеспечивается наличием биссуса, возникшего в процессе неотении (Yonge, 1962). Результаты нашего исследования и анализ литературных данных свидетельствуют, что биссус организован у исследованных видов семейства Mytilidae сходным образом. Это отражает единство функционального значения биссуса и близкое родство трех исследованных родов моллюсков (рис. 1, 4). Вместе с тем наблюдаются определенные, порой весьма существенные, межвидовые различия в морфологии биссусных нитей и прикрепительного диска, их прочности (рис. 3; 4а‒4в; табл. 2, 3).
Таким образом, исследование морфометрии, морфологии и тонкого строения биссусных нитей и прикрепительного диска ярко свидетельствуют о внутривидовой специфичности. Установленные особенности отчетливо отражают адаптации моллюсков к обитанию при разных условиях среды (Higo et al., 1999; Lutaenko, Noseworthy, 2012; Голиков, Скарлато, 1967; Скарлато и др., 1967; Скарлато, 1981). Для Myt. coruscus характерны толстые, короткие биссусные нити с мощными дистальным и проксимальным участками и крупными прикрепительными дисками, хорошо армированными продольными тяжами (рис. 1; 4). Каждый из этих структурных элементов свидетельствует о том, что моллюски этого вида способны выдерживать гораздо бóльшие гидродинамические нагрузки, чем C. grayanus и Mod. modiolus. Благодаря этому, Myt. coruscus успешно заселяет скалистые участки побережий на глубине 0.2–3 м, где отмечается прибойность 3-й степени (Скарлато, 1981; Лукин, Фадеев, 1982; Гоголев, 1983; Селин, 1988). Южнее, где толща воды прогревается более значительно Myt. coruscus распространяется до глубины 20 м (Higo et al., 1999). Самые длинные нити с небольшим слабо развитым проксимальным участком и относительно маленькими продолговатыми слабо армированными дисками свойственны Mod. modiolus, что вполне соответствует условиям обитания этого вида. Mod. modiolus чаще всего заселяет защищенные от волнобоя приглубые участки дна с заиленным песчано-галечно-гравийным грунтом, в который моллюск обычно погружается почти на ⅓ длины тела. У C. grayanus нити на некоторых участках имеют промежуточную степень развития, что отражает адаптацию вида к разным по гидродинамическим условиям биотопам. Этот вид успешно заселяет участки дна в верхней сублиторали (1–60 м, преимущественно не глубже 20 м), предпочитая селиться на твердых скально-валунных грунтах на участках побережий с умеренным воздействием волн (Higo et al., 1999; Lutaenko, Noseworthy, 2012; Голиков, Скарлато, 1967; Скарлато и др., 1967; Скарлато, 1981).
ЗАКЛЮЧЕНИЕ
Пространственное распределение двустворчатых моллюсков C. grayanus, Myt. coruscus и Mod. modiolus довольно отчетливо коррелирует с морфологическими особенностями строения их биссусного аппарата, а также раковины (Selin, Vekhova, 2002; Vekhova, 2013а). Визуально эти митилиды довольно сходны, однако сравнительный анализ абсолютного и аллометрического роста позволил выявить существенные межвидовые различия формы раковины, обусловленной различиями темпов линейного роста. Быстрый рост молодых особей Myt. coruscus приводит к формированию хорошо обтекаемой уплощенной раковины, способной сглаживать волновое воздействие в прибойной зоне, а медленный, как в случае с Mod. modiolus, ‒ массивной и выпуклой раковины у взрослых особей, постоянно находящихся под сильным гидродинамическим воздействием среды. Наши исследования межвидовых особенностей изменения пропорций тела и биссуса в онтогенезе трех видов митилид показали формирование разной формы раковины и морфологических особенностей строения биссуса даже в тех случаях, когда моллюски обитают в сходных гидродинамических условиях (Selin, Vekhova, 2002; Vekhova, 2013а).
Результаты детального исследования наглядно показали (рис. 4), что C. grayanus, Myt. coruscus и Mod. modiolus существенно различаются строением биссуса. Эти различия у исследуемых митилид выражаются мощностью развития отдельных участков биссусных нитей и армирующих тяжей на поверхности дисков и нитей, определяющих прочность прикрепления моллюсков к субстрату. Наиболее мощные, прочные биссусные нити с крупными армированными дисками характерны для Myt. coruscus, что позволяет виду успешно заселять прибойные скальные участки побережий на незначительной глубине (Higo et al., 1999; Lutaenko, Noseworthy, 2012; Скарлато, 1981). Два других видов различаются по развитию этого биссусного аппарата, но в целом он выражен слабее, чем у Myt. coruscus. В местах обитания Myt. coruscus эти два вида образуют лишь эфемерные скопления молоди и заселяют разнообразные биотопы с умеренным воздействием волн.
БЛАГОДАРНОСТИ
Автор выражает глубокую признательность Д.В. Фомину (Центр коллективного пользования ННЦМБ ДВО РАН) за помощь в использовании сканирующего электронного микроскопа Carl Zeiss, Evo 40.
Работа поддержана Фондом содействия отечественной науке.
Буквенные обозначения на рис. 1, 2 и 4: бн – бисуссные нити; к – корень биссуса; м – прикрепительные манжеты; с – стебель биссуса; пд – прикрепительные диски; н – нога мидии; пч – проксимальная часть ноги; дч – дорсальная часть ноги; б – вентральная бороздка ноги; плс ‒ пластинки стебля, формирующие сердечник; з – переходная зона из дистального в проксимальный участок нити; дк – дистальный конец нити; пк – проксимальный конец нити; прт ‒ продольный тяж; нк – наружная кутикула; кв – прочные пучки коллагеновых волокон; эв – эластичные коллагеновые волокна; плд – пластинка диска; пт – передний тяж; зт – задний тяж; бт – боковой тяж; п – полость; бм – борозды мелкого порядка; ос – оппозитная сторона нити; гк – гофрированная кайма; прб – продольная бороздка; пб – поперечная бороздка; пск – поперечная складка.
Список литературы
Бергер В.Я., Летунов В.Н., Вшевцов Г.В., Саранчова О.Л., 1985. Морфофункциональные и экологические аспекты биссусообразования у мидии (Mytilus edulis L.) // Экология обрастания в Белом море. Л.: ЗИН АН СССР. С. 67‒75.
Голиков А.Н., Скарлато О.А., 1967. Моллюски залива Посьет (Японское море) и их экология // Труды зоологического института Академии Наук СССР. Л. Т. 42. С. 5‒152.
Гоголев А.Ю., 1983. Агрегированность и темп роста Mytilus coruscus (Bivalvia, Mytilidae) в заливе Восток Японского моря // Доклады АН СССР. Т. 271. № 4. С. 1012‒1015.
Золотарев В.Н., 1989. Склерохронология морских двустворчатых моллюсков. Киев: Наукова думка. 112 с.
Лукин В.И., Фадеев В.И., 1982. Особенности планирования гидробиологических работ на акваториях большой протяженности // Подводные гидробиологические исследования. Владивосток: ДВНЦ АН СССР. С. 13‒20.
Миронов А.А., Комиссарчик Я.Ю., Миронов В.А., 1994. Методы электронной микроскопии в биологии и медицине: методическое руководство. СПб.: Наука. 400 с.
Селин Н.И., 1988. Размерно-возрастной состав поселений и рост мидии Mytilus coruscus в заливе Петра Великого Японского моря // Биология моря. Т. 5. С. 45‒49.
Скарлато O.A., 1981. Двустворчатые моллюски умеренных широт западной части Тихого океана. Л.: Наука. 479 с.
Скарлато О.А., Голиков А.Н., Василенко С.В. и др., 1967. Состав, структура и распределение донных биоценозов в прибрежных водах залива Посьет (Японское море) // Исследования фауны морей. Т. 5. № 13. P. 5‒61.
Allen J.A., Cook M., Jackson D.J. et al., 1976. Observations on the rate of production and mechanical properties of the byssus threads of Mytilus edulis L. // Journal of Molluscan Studies. V. 42. № 2. P. 279‒289.
Banu A., Shymasundari K., Hanumantha Rao K., 1980. The organization and chemistry of the byssus of some bivalves of the Waltair coast, India // The Veliger. V. 23. № 1. P. 77‒82.
Bairati A., Vitellaro-Zuccarello L., 1974. The ultrastructure of the byssal apparatus of Mytilus galloprovincialis. II. Observations by microdissection and scanning electron microscopy // Marine Biology. V. 28. P. 145‒158.
Bell E.C., Gosline J.M., 1996. Mechanical design of mussel byssus material yield enhances attachment strength // The Journal of Experimental Biology. V. 199. № 4. P. 1005‒1017.
Bieler R., Mikkelsen P.M., Prezant R.S., 2005. Byssus-attachment by infaunal clams: Seagrass-nestling Venerupis in Esperance Bay, Western Australia (Bivalvia: Veneridae) // The Marine Flora and Fauna of Esperance (Eds Wells F.E., Walker D.I., Kendrik G.A.). Western Australia: Western Australian Museum, Perth. P. 177‒198.
Bonner T.P., Rockhill R.L., 1994. Ultrastructure of the byssus of the zebra mussel (Dreissena polymorpha, Mollusca, Bivalvia) // Transactions of the American Microscopical Society. V. 113. № 3. P. 302‒315.
Brown C.H., 1952. Some structural proteins of Mytilus edulis // The Quarterly Journal of Microscopical Science. V. 93. P. 487‒502.
Carrington E., Gosline J.M., 2004. Mechanical design of mussel byssus: Load cycle and strain rate dependence // American Malacological Bulletin. V. 18. P. 135‒142.
Denny M.W., 1987. Lift as a mechanism of patch initiation in mussel beds // Journal of Experimental Marine Biology and Ecology. V. 113. P. 231‒245.
Denny M., Gaylord B., Helmuth B., Daniel T., 1998. The menace of momentum: Dynamic forces of flexible organisms // Limnology and Oceanography. V. 43. № 5. P. 955‒968.
Dharmaraj S., Kandasami D., Alagarswami K., 1987. Some aspects of physiology of pearl oyster // Central Marine Fisheries Research Institute Bulletin. V. 39. P. 21‒28.
Eckroat L.R., Steel L.M., 1993. Comparative morphology of the byssi of Dreissena polymorpha and Mytilus edulis // American Malacological Bulletin. V. 10. P. 103‒108.
Fitton Jackson S., Kelly F.C., North A.C.T., Randall J.T., Seeds W.E. et al., 1953. The byssus threads of Mytilus edulis and Pinna nobilis. In Nature and structure of collagen (Ed. Randall J.T.). New York: Academic Press Inc., Publishers. P. 106‒117.
Gosline J., Lillie M., Carrington E., Guerette P., Ortlepp C., Savage K., 2002. Elastic proteins: biological roles and mechanical properties // Philosophical Transactions of the Royal Society of London. Series B, Biological Sciencs. V. 357. № 1418. P. 121‒132.
Higo S., Callomon P., Goto Y., 1999. Catalogue and bibliography of the marine shell-bearing mollusca of Japan. Gastropoda. Bivalvia. Polyplacophora. Scaphopoda. Elle Scientific Publications. 748 p.
Harasewych M.G., Tëmkin I., 2015. The Miocene genus Mantellina (Bivalvia: Limidae) discovered living on the deep reefs off Curacao, with the description of a new species // Journal of Molluscan Studies. V. 81. № 4. P. 442−454.
Lee C.Y., Lim S.S.L., Owen M.D., 1990. The rate and strength of byssal reattachment by blue mussels (Mytilus edulis L.) // Canadian Journal of Zoology. V. 68. P. 2005‒2009.
Lutaenko K.A., Noseworthy R.G., 2012. Catalogue of the Living Bivalvia of the Continental Coast of the Sea of Japan (East Sea). Vladivostok: Dalnauka. 247 p.
Mikkelsen P.M., Tëmkin I., Bieler R., Lyons W.G., 2004. Pinctada longisquamosa (Dunker, 1852) (Bivalvia: Pteriidae), an unrecognized pearl oyster in the Western Atlantic // Malacologia. V. 46. № 2. P. 473−501.
Price H.A., 1983. Structure and formation of the byssus complex in Mytilus (Mollusca, Bivalvia) // Journal of Molluscan Studies. V. 49. № 1. P. 9−17.
Pujol J.P., Rolland M., Lasry S., Vinet S., 1970. Comparative study of the amino acid composition of the byssus in some common bivalve mollusks // Comparative Biochemistry and Physiology. V. 34. P. 193‒201.
Qin X., Waite J.H., 1995. Exotic collagen gradients in the byssus of mussel M. edulis // Journal of Experimental Biology. V. 198. P. 633–644.
Smeathers J.E., Vincent J.F.V., 1979. Mechanical properties of mussel byssus threads // Journal of Molluscan Studies. V. 45. P. 219‒230.
Selin N.I., Vekhova E.E., 2002. // Morphology of the bivalve mollusks Crenomytilus grayanus and Mytilus coruscus in relation to their spatial distribution in the upper subtidal zone // Russian Journal of Marine Biology. V. 28. № 3. P. 213‒217.
Tamarin A., Keller P.J., 1972. An ultrastructural study of the byssal thread forming system in Mytilus // Journal of Ultrastructure Research. V. 40. P. 401–416.
Tëmkin I., 2006. Anatomy, shell morphology, and microstructure of the living fossil Pulvinites exempla (Hedley, 1914) (Mollusca: Bivalvia: Pulvinitidae) // Zoological Journal of the Linnean Society. V. 148. P. 523–552.
Vekhova E.E., 2006. Reattachment of certain species of mytilid bivalves to various substrates // Russian Journal of Marine Biology. V. 32. № 5. P. 308‒311.
Vekhova E.E., 2013. The significance of byssi and their morphological diversity within the superfamily Pterioidea // The Malacologist. № 61. P. 14‒16.
Vekhova E.E., 2013a. Growth and shell morphology of three Mytilidae (Bivalvia) species from the Sea of Japan // Biology Bulletin. V. 40. №9. P. 728–737.
Waite J., 1983. Adhesion in byssally attached bivalves // Biological Reviews of the Cambridge Philosophical Society. V. 58. № 2. P. 209–231.
Waite J.H., 1997. Marine bioadhesion: unraveling the chemistry // Journal of The Adhesion Society of Japan. V. 33. № 5. P. 186–194.
Wi Ch.H., Kim H.S., Kim J.H., Chang Y.J., Jung M.M., 2005. Attachment of Hard Shelled Mussel, Mytilus coruscus and Blue Mussel, Mytilus edulis // Aquaculture. V. 18. № 3. P. 142–146.
Yonge C.M., 1962. On the primitive significance of the byssus in the Bivalvia and its effects in evolution // Journal of the Marine Biological Association of the United Kingdom. V. 42. № 1. P. 113–125.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


