Зоологический журнал, 2019, T. 98, № 3, стр. 319-331
Роль частоты исполнения и сложности пения в территориальном поведении голосистой пеночки (Phylloscopus schwarzi)
А. С. Опаев 1, *, Ю. А. Колесникова 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Россия
* E-mail: aleksei.opaev@gmail.com
Поступила в редакцию 18.02.2018
После доработки 05.09.2018
Принята к публикации 11.10.2018
Аннотация
Песня воробьиных птиц – один из самых сложных сигналов в мире животных, т.к. может состоять из многих типов исходных элементов (звуков или песен), чередующихся по определенным правилам. Не вполне ясно, как используется (и используется ли) такая сложность в коммуникации. Самцы воробьиных птиц часто поют во время территориальных взаимодействий. Эту ситуацию можно имитировать, транслируя видовую песню через динамик. Записывая акустический ответ самца и сравнивая с пением до трансляции, можно выяснить, какие параметры пения потенциально могут кодировать территориальную агрессию. Мы реализовали этот подход на примере голосистой пеночки. Для этого вида характерны короткие песни (около 1 с), разделенные паузами, а вся совокупность песен самца распадается на 18–43 (медиана 38) стереотипных типов. При спонтанном пении песни часто исполняются в линейной последовательности: после данного типа следует другой, строго определенный тип. Каждый эксперимент состоял из трех последовательных фаз, каждая по 5 мин: до, во время и после экспериментальной трансляции (5 мин). Для описания фонограмм каждой из фаз использованы девять параметров: (1) медиана длительности песни, (2) медиана длительности паузы между песнями, (3) частота пения (песен/мин), (4) размер репертуара (число типов песен: показатель структурной сложности пения), (5) частота смены напева. Для анализа сложности организации пения анализировали матрицы переходов между песнями разных типов. По матрицам рассчитывали (6) индекс линейности, (7) индекс постоянства, (8) индекс стереотипности и (9) относительную энтропию первого порядка. Пение во время трансляции не отличалось от пения до нее. Но при этом самец совершал активные перелеты вокруг динамика, откуда транслировалась видовая песня. При пении после экспериментальной трансляции, по сравнению с пением до, сокращались паузы между песнями, увеличивались частота пения и размер репертуара, а организация пения становилась менее упорядоченной (уменьшались индексы линейности, постоянства и стереотипности и увеличивалась относительная энтропия). Таким образом, структурная сложность пения и сложность ее организации, наряду с частотой пения, могут выражать территориальную агрессию самцов изученного вида.
Пение воробьиных птиц (подотряд Oscines) – многофункциональный сигнал. Он используется, во-первых, при саморекламировании. В этом случае птица поет “спонтанно”, вне социального контекста, предупреждая конкурентов о занятости участка и привлекая партнера. Во-вторых, песня характерна для непосредственных взаимодействий между птицами – чаще всего, территориальных конфликтов самцов, а также во время ухаживания самца за самкой. В этом случае кратковременные изменения в пении могут указывать на мотивацию особи и/или могут быть ситуационно-специфичными.
Разнообразие конкретных способов таких мотивационно- или ситуативно-специфичных модификаций в пении птиц широко. Дело в том, что песня воробьиных птиц – один из самых сложных сигналов в мире животных. Изучение этой сложности уже несколько десятилетий находится в фокусе внимания исследователей. Многочисленные работы показали, что самцы многих видов обладают обширными репертуарами из многих типов песен, которые они помнят и воспроизводят в неизменном виде. Например, индивидуальные репертуары самцов многоголосого пересмешника (Mimus polyglottos) могут включать более 400 типов песен (Derrickson, 1987), а южного соловья (Luscinia megarhynchos) – более 200 (Kipper et al., 2004). Самцы многих видов, впрочем, используют при пении лишь один тип или несколько типов песен (Beecher, Brenowitz, 2005). Каждый тип песни, в свою очередь, состоит из отдельных типов звуков и/или слогов. Разнообразие типов песен, звуков и слогов в репертуаре (т.е. размер репертуара) служит популярной мерой структурной сложности пения (Garamszegi et al., 2005).
Как правило, разные типы звуков, слогов и/или типов песен чередуются при пении не случайно. Поэтому говорят, что пение птиц имеет синтаксис – т.е. набор правил, определяющих чередование разных акустических единиц (типов звуков или песен). Эти правила стали активно изучать, начиная с 1970-х годов. В последнее время чередование вокальных структур при пении анализируют методами теории информации (da Silva et al., 2000; Briefer et al., 2010; Kershenbaum, 2014; Palmero et al., 2014; Opaev, 2016), нейронных сетей (Sasahara et al., 2012; Weiss et al., 2014) и деревьев суффиксов (Markowitz et al., 2013). Результаты этих и многих других исследований показали, что в большинстве случаев последовательность акустических единиц при пении, с одной стороны, детерминирована не жестко, а с другой стороны, эта последовательность не случайна (Kershenbaum et al., 2014). Было выделено два главных типа синтаксической организации птичьего пения (Иваницкий, 2015). При линейном синтаксисе очередность исполнения вокальных компонентов более или менее строго фиксирована. При комбинаторном синтаксисе выделяются один кластер типов песен или несколько таких кластеров; внутри кластера возможны изменения порядка исполнения типов песен. Разные типы синтаксиса могут встречаться у близких видов (некоторые пеночки Phylloscopus и соловьи Luscinia sensu lato: Ivanitskii et al., 2012; 2017) или даже в пределах одного вида (как у дикой и одомашненной форм бронзовой амадины (Lonchura striata): Okanoya, 2013). А корольковая пеночка (Phylloscopus proregulus) совмещает два типа синтаксиса, которые проявляются на разных уровнях интеграции ее пения (Ivanitskii, Marova, 2012). Все проявления синтаксиса можно отнести к сложности организации пения.
Помимо изучения сложности пения, многие авторы анализируют сложность единичной песни. Под структурной сложностью песни понимается разнообразие (число) типов звуков и/или слогов в ней (Catchpole, Slater, 2008). Активно изучается и синтаксис песни. К примеру, в песне зарянки (Erythacus rubecula) обычно чередуются фразы, состоящие из высокочастотных и низкочастотных компонент (Bremond, 1968): это одно из синтаксических правил организации песни этого вида (синтаксис песни).
Функциональное значение сложности пения и песен, как структурной сложности, так и сложности организации, интересовало многих исследователей. Есть данные, что сложность пения играет роль в защите территории и привлечении самки – т.е. двух наиболее важных функциях пения (Catchpole, Slater, 2008). В контексте данной работы нас интересует только первый аспект – роль сложности пения и песен в территориальном поведении.
Роль сложности песни в территориальном поведении показана экспериментально. Самцы некоторых видов активнее реагируют на трансляцию им более сложных и продолжительных песен, имеющих большее количество слогов и/или типов слогов. Такие данные имеются для новозеландского туи (Prosthemadera novaeseelandiae) (Hill et al., 2018), зяблика (Fringilla coelebs) (Leitão et al., 2006), пеночки-трещотки (Phylloscopus sibilatrix) (Горецкая, 2013) и пеночки-теньковки (Ph. collybita) (Linhart et al., 2012).
Синтаксис песни также важен: реакции ряда видов на типичные песни и песни с модифицированным синтаксисом различалась. Это показано для полевой воробьиной овсянки (Spizella pusilla) (Nelson, 1988), болотной овсянки (Melospiza geogriana) (Balaban, 1988), крапивника (Troglodytes troglodytes) (Holland et al., 2000), полевого жаворонка (Alauda arvensis) (Briefer et al., 2013) и калифорнийского кривоклювого пересмешника (Toxostoma redivivum) (Taylor et al., 2017).
В качестве меры структурной сложности пения ряд авторов использовал разнообразие типов песен (song type versatility) в единицу времени либо разнообразие типов в некотором числе (например, в десяти) исполненных подряд песен. В большинстве случаев оказалось, что разнообразие возрастает в ответ на изменение внешней обстановки – при появлении самки или конкурента (Kroodsma, Verner, 1978; Searcy, Yasukawa 1990; Searcy, Beecher 2009; Vehrencamp et al., 2007). Однако у многоголосого пересмешника при патрулировании границ участков используется меньше типов песен, чем в других ситуациях (Derrickson, 1987).
Что же касается сложности организации пения, то данных здесь существенно меньше. Насколько нам известно, только у южного соловья выявлена изменчивость синтаксиса пения в зависимости от контекста (Weiss et al., 2014).
В то же время, ряд других параметров организации пения, не имеющих прямого отношения к сложности, меняются в территориальном контексте. Маркировать агрессию в пении могут изменения таких параметров, как частота пения и частота смены напева. Территориальную агрессию могут также отражаться специфические поведенческие паттерны: перекрывание песен (song overlapping), копирование песен (song type matching) и использование специфических “агрессивных” типов песен (Todt, Naguib, 2000; Catchpole, Slater, 2008; Searcy, Beecher, 2009).
В приведенном кратком обзоре бегло упомянуты все основные способы кодирования территориальной агрессии в пении певчих воробьиных птиц. Данные здесь, таким образом, весьма многочисленны. Однако, на наш взгляд, роль сложности (структурой и сложности организации) пения остается изученной недостаточно.
Данное исследование посвящено именно этой проблематике. Мы изучили изменения в структуре и организации пения голосистой пеночки в ситуации имитации территориального вторжения, по сравнению со спонтанным пением вне социального контекста. “Вторжение” имитировали, транслируя через динамик видовую песню. Наблюдаемый (т.е. отмеченный на данной фонограмме) размер репертуара мы использовали в качестве показателя структурной сложности. А для оценки сложности организации пения анализировали матрицы переходов между песнями разных типов. Помимо этого, мы использовали более общепринятые в этой области науки параметры пения. Таким образом, мы более комплексно, по сравнению с рядом других исследователей, сравнили спонтанное пение с пением в ответ на экспериментальное предъявление видовой песни.
МАТЕРИАЛ И МЕТОДЫ
Объект исследования и сбор материала
Голосистая, или толстоклювая пеночка – небольшая певчая птица, населяющая в нашей стране Центральную и Восточную Сибирь, Дальний Восток и Сахалин. На гнездовании предпочитает опушки лесов либо разреженные леса. Материал по этому виду мы собирали в Антоновском лесничестве Хинганского заповедника (Амурская обл.). Здесь эти пеночки обычны и достаточно равномерно заселяют пригодные местообитания – опушки березовых и дубовых рёлок, часто поселяясь также и в глубине светлых дубняков (Антонов и др., 2016; наши данные). Сбор материала осуществлен в период с 17 по 31 мая 2017 г. Проведены эксперименты (см. ниже) с 21 самцом. Координаты каждой экспериментальной точки отмечали с помощью навигатора Garmin. Для анализа использовали только 19 птиц: два эксперимента были исключены потому, что во время трансляции близ динамика пел не только фокальный самец, но и его сосед, что затруднило анализ. 7 из этих 19 самцов были отловлены и помечены для индивидуального опознавания цветными пластиковыми кольцами и окрашены театральным гримом. Во всех случаях птицы были отловлены в течение часа после завершения эксперимента.
Территории самцов голосистой пеночки в Хинганском заповеднике могут быть достаточно обширны. Так, по данным П.В. Квартальнова, также работавшего в Антоновском лесничестве, крайние точки пения одного самца находились на расстоянии 700 м одна от другой (Антонов, Квартальнов, 2014). По нашим фрагментарным наблюдениям, максимальное расстояние между песенными постами меченого самца составило в два последовательных дня 165 м. Вероятно, размеры индивидуальных участков часто меньше. В нашей выборке минимального расстояние между единовременно поющими самцами, один из которых был помечен, составило всего 55 м. А медианное расстояние между ближайшими протестированными самцами – 166 м (n = 21). Это число может служить показателем среднего расстояния между соседями, так как во время работы мы старались провести эксперименты со всеми самцами на контрольном участке.
Голосистая пеночка – территориальный вид, поющий много и активно. Хотя мы не проводили эксперименты позднее 31 мая, птицы активно пели вплоть до завершения наших полевых исследований в Антоновском лесничестве (23 июня 2017). Социальная система вида – факультативная полигиния; самцы не принимают участия в насиживании и выкармливании птенцов, хотя иногда вместе с самками беспокоятся у гнезд (Антонов, Квартальнов, 2014).
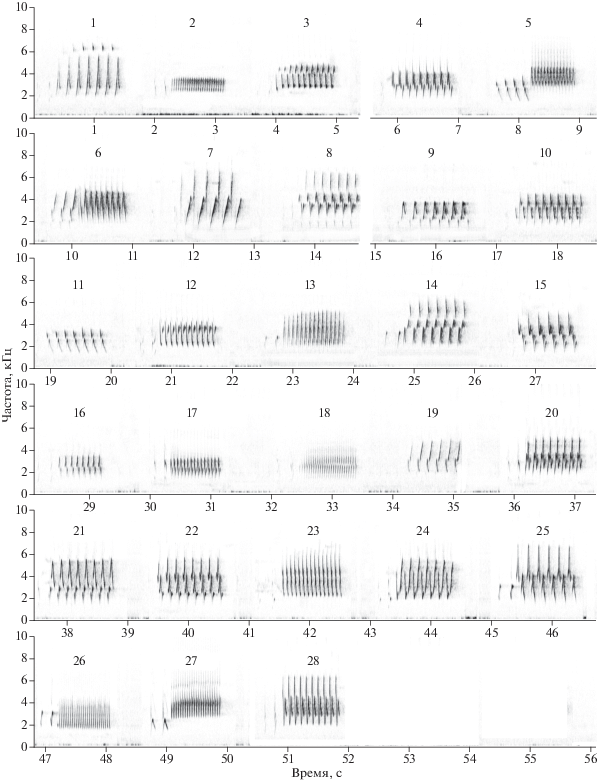
Структура и организация спонтанного (т.е. в отсутствие социального контекста) пения голосистой пеночки подробно описана Иваницким с соавторами (2011; Ivanitskii et al., 2012). Песня голосистой пеночки – это обычно короткая звонкая трель из нескольких одинаковых нот или слогов, предваряемая 1–3 короткими тихими тресками. В составе некоторых песен объединены две последовательные трели. Манера пения – раздельная, т.е. все песни разделены четкими паузами. В пении каждой особи выделяются строго-стереотипные типы песен, каждый из которых самец воспроизводит время от времени в неизменном виде (см. рис. 1). Что касается организации пения, то для многих (хотя и не всех) самцов характерен жесткий линейный синтаксис. Это значит, что самец исполняет в определенной последовательности все песни из своего репертуара, а затем начинает сначала (см. рис. 4).
Подготовка тестовой (экспериментальной) записи
Для подготовки тестовой записи обработаны фонограммы спонтанного пения трех самцов, полученные нами в мае 2013 г. в Антоновском лесничестве Хинганского заповедника. Наша тестовая запись длилась 5 мин и содержала 40 песен, относящихся к 20 типам: сначала 20 разных типов песен подряд, потом снова те же 20 типов (жесткий линейный синтаксис, см. выше). Контрольная запись имела следующие типичные для пятиминутного пения голосистой пеночки параметры (см. также: Иваницкий и др., 2011; Ivanitskii et al., 2012): (а) длительность песни = 1 с, (б) длительность паузы между песнями = 6.6 с, (в) размер репертуара = 20 типов песен, (г) частота смены напева = 1 (т.е. все последовательные песни разные). Типы песен, использованные в тестовой записи, выбирались примерно поровну от каждой из трех особей. При этом мы старались подобрать наиболее отличные друг от друга типы песен. Таким образом, мы синтезировали для экспериментов “усредненное” пение голосистой пеночки.
Полевые эксперименты
До начала эксперимента в течение 5 мин мы записывали пение фокального самца. Затем включали контрольную (экспериментальную) запись аналогичной длительности и записывали “ответное” пение фокального самца. Далее, после окончания трансляции, пение данной особи записывали на протяжении следующих 5 мин. Таким образом, результаты каждого эксперимента представлены одной непрерывной фонограммой (примерно 15 мин), содержащей пение фокального самца до, во время и после экспериментальной трансляции.
Динамик с Bluetooth-приемником для проведения эксперимента устанавливали в 20–30 м от поющего самца – т.е. с наибольшей вероятностью внутри его участка. Для включения/выключения тестовой записи и передачи ее на динамик использовали смартфон. Наблюдатель (А.С. Опаев) находился в 15–20 м от динамика и до, во время и после эксперимента, помимо записи “ответного” пения, фиксировал количество перелетов (длиной более 1 м) самца в радиусе 10 м от динамика. Это служило показателем его реакции.
Для записи пения использовали магнитофон Marantz PMD-660 и микрофон Sennheiser ME66 с предусилителем К6.
Анализ фонограмм
Общая длительность проанализированных записей экспериментов с 19 самцами составила 270.2 мин (в среднем 14.2 ± 1.4 мин для каждого самца). Они содержали суммарно 2221 песню (в среднем 117 ± 28 для каждого самца).
Пение, записанное для каждой особи до, во время и после трансляции видовой песни, проанализировано отдельно – по 9 параметрам, отмеченным ниже сплошной нумерацией. Визуализацию и обработку записей проводили в программе Syrinx. При построении спектрограмм использовали окно Блэкмана и длину быстрого преобразования Фурье, равную 256 точкам.
На первом этапе для каждой фонограммы составляли каталог типов песен. Количество типов песен – это (1) наблюдаемый размер репертуара (показатель структурной сложности пения).
Каждый тип песни был обозначен цифрой (рис. 1), а пение было представлено в виде последовательности цифр. На основании этой последовательности в программе Past3 строили матрицы наблюдаемых переходов и матрицы переходных вероятностей. В данном случае последовательность песен рассматривалась как Марковская цепь первого порядка – т.е. такая, где событие n + 1 зависит только от события n. Мы пошли на это допущение по следующей причине. Известно, что у многих видов Марковская цепь первого порядка адекватно описывает организацию последовательности песен (Gentner, 2007; Briefer et al., 2010; Okanoya, 2013). Это применимо и ко многим (хотя и не всем) видам пеночек (Gill, Slater, 2000; Ivanitskii, Marova, 2012; Ivanitskii et al., 2012; Opaev, 2016).
По матрицам наблюдаемых переходов рассчитывали (2) индекс линейности (SLIN), (3) индекс постоянства (SCONS) и (4) индекс стереотипности (S) (Scharff, Nottebohm, 1991; см. также: Woolley, Rubel 1997; Roach et al., 2012; Okanoya, 2013; Ivanitskii et al., 2017) по формулам: SLIN = размер репертуара/число типов переходов между песнями разных типов; SCONS = ∑ наиболее частых переходов (для каждого типа)/∑ всех переходов; S = = SLIN + SCONS/2.
По матрицам переходных вероятностей рассчитывали (5) относительную энтропию первого порядка RE1 = E1/E0 (Briefer et al., 2010). Для расчета E1 (энтропия первого порядка) и E0 (энтропия нулевого порядка) использовали формулу Шеннона:
где К – размер репертуара; где Pi – наблюдаемая вероятность каждого типа переходов между песнями.Таким образом, E0 описывает гипотетическую последовательность, где все переходы равновероятны, и зависит только от размера репертуара. E1 описывает наблюдаемые переходы. А отношение этих двух параметров (RE1) можно использовать как показатель “свободы выбора” самцом каждой следующей песни. Например, в случае, если RE1 = 0.70, можно считать, что самец имеет 70% “свободы” при выборе следующей песни (Briefer et al., 2010). Или, по-другому, – последовательность песен на 70% случайна.
Параметры (2)–(5) служили нам показателями сложности организации пения. Эти переменные варьируют от 0 до 1.
Кроме того, мы использовали параметры, общепринятые для подобных исследований: (6) частота смены напева (отношение переходов между песнями разных типов к общему числу переходов), (7) частота пения (количество песен в минуту), (8) медианная длительность песни (с) и (9) медианная длительность паузы между песнями (с).
Статистический анализ
Статистическая обработка проведена в среде программирования R 3.3.2 (R Core Team, 2016).
Мы сравнивали попарно фонограммы до трансляции с записями во время и после, отдельно по каждому из девяти вышеописанных параметров. Для этого использовали обобщенную наименьшую квадратичную регрессию (GLS – generalized least square regression) в пакете “nlme” в среде R (Pinheiro et al., 2017). GLS специально адаптирован для анализа зависимых данных (например, повторных измерений одних и тех же особей). По этой и другим причинам в поведенческих исследованиях он считается лучше основных “конкурентов” – например, обобщенных линейных смешанных моделей (GLMM – generalized linear mixed models) (Pekár, Brabec, 2016). Логика использования GLS, а не одномерных тестов (тест Уилкоксона для связанных выборок), состоит в необходимости учета возможного влияния случайных факторов (random effect) на результаты. В GLS мы использовали “контекст” (до, во время и после трансляции) в качестве заданного эффекта (fixed effect), а номер самца был первым случайным фактором. Количество песен на фонограмме, очевидно, может влиять на оценку, по меньшей мере, наблюдаемого размера репертуара и параметров сложности организации пения. Поэтому мы использовали второй случайный фактор – количество песен в записи (именно для его учета и был нужен GLS). Так как мы проводили множественные сравнения, то уровень значимости (p) рассчитывали с поправкой Бонферрони.
Для визуализации наблюдаемых переходов между песнями разных типов использовали пакет ‘markovchain’ в среде R (Spedicato et al., 2017).
Для парных сравнений наблюдаемых репертуаров данного самца до, во время и после экспериментальной трансляции использовали коэффициенты несходства Жаккара и Симпсона. Первый учитывает главным образом “замену” одних типов песен другими (Jost, 2007). А коэффициент несходства Симпсона описывает “исчезновение”/ “появление” типов песен во второй выборке, по сравнению с первой (Lennon et al., 2001). Оба варьируют от 0 (полное сходство) до 1 (несходство). Расчеты коэффициентов проводили в пакете “betapart” в среде R (Baselga, Orme, 2012; Baselga et al., 2017).
Кроме того, мы использовали непараметрический парный тест – корреляцию Спирмена.
РЕЗУЛЬТАТЫ
Размер репертуара и организация спонтанного пения
Мы оценили размер репертуара каждого самца по всем трем его фонограммам – т.е. подсчитали суммарное количество типов песен на записях до, во время и после экспериментальной трансляции. Этот параметр у разных особей варьировал от 18 до 43, медиана 38 типов песен (n = 19). Каталог типов песен одного из самцов приведен на рис. 1.
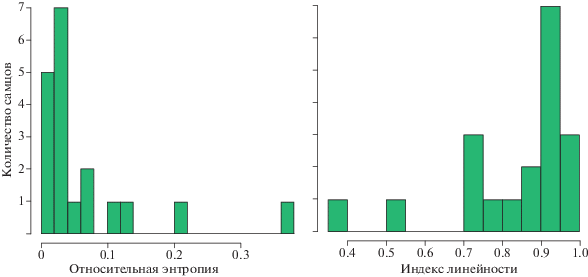
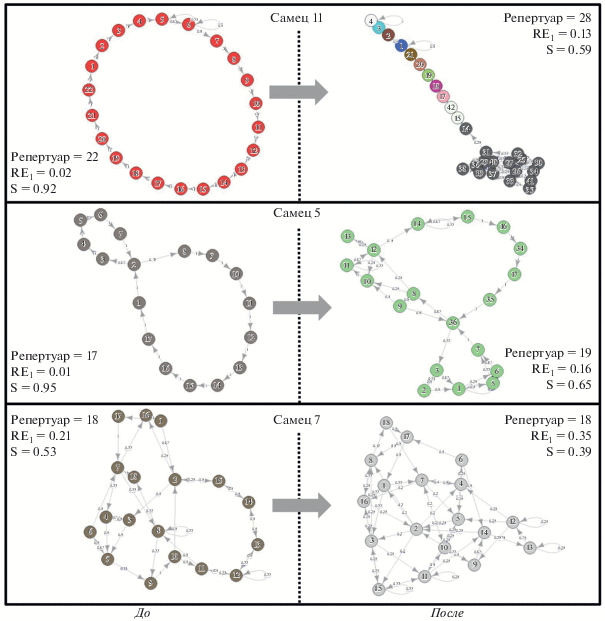
Организация спонтанного пения (т.е. на фонограммах до трансляции) большинства самцов соответствовала линейному синтаксису. В этом случае после каждого данного типа песни в большинстве случаев следовал другой строго определенный тип (примеры: самцы № 11 и № 5 на рис. 4). Такая организация пения соответствовала низким значениям энтропии RE1, приближающимся к 0, и высоким значениям индекса линейности, стремящегося к единице (рис. 2). В то же время, у двух самцов из девятнадцати организация пения была далека от линейной, о чем свидетельствовали относительная высокая энтропия (>0.2) и низкий индекс линейности (<0.6) (рис. 2). Организацию спонтанного пения одного из них, самца № 7, также иллюстрирует рис. 4.
Изменения пения в ответ на экспериментальную трансляцию
Пение голосистой пеночки до трансляции достоверно не отличалось от пения во время (GLS: p > 0.05 для всех переменных кроме длительности пауз, n = 19). Однако интенсивность пения несколько возросла: сокращение длительности паузы между песнями во время трансляции приближалось к порогу достоверности (GLS: F1,36 = 4.75, p = 0.04, не достоверно с поправкой Бонферрони). Таким образом, самцы продолжали петь во время трансляции примерно так же, как и до нее. При этом все они подлетали (сокращали дистанцию) и активно перелетали вокруг динамика: количество перелетов увеличилось от 0 (до) до 2–29 (медиана 21) во время (GLS, F1,36 = 137.45, p < < 0.0001).
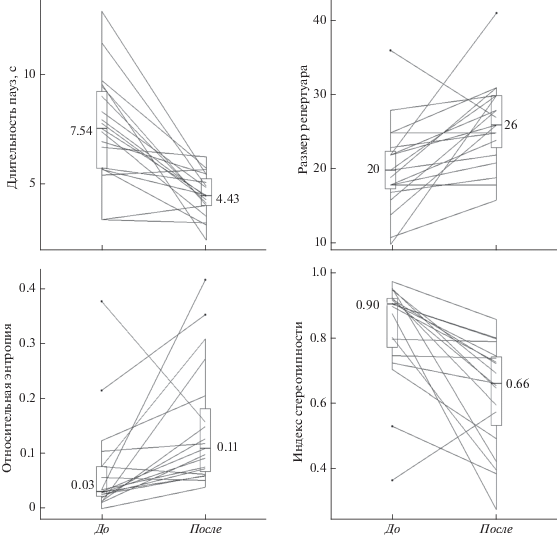
Ситуация изменилась сразу после трансляции. Выяснилось, что пение голосистых пеночек отличается до и после трансляции им видовой песни по ряду параметров. По сравнению с пением до, при пении после достоверно сокращаются паузы между песнями, увеличиваются частота пения и наблюдаемый размер репертуара. Кроме того, пение становится менее упорядоченным: сокращаются индексы линейности, постоянства и стереотипности, и увеличивается (хотя и недостоверно с поправкой Бонферрони) относительная энтропия (табл. 1, рис. 3).
Таблица 1.
Влияние контекста (до/после трансляции видовой песни) на параметры пения голосистой пеночки (n = 19 самцов)
| Параметр | До трансляции (медиана) | После трансляции (медиана) | F1,36 | p |
|---|---|---|---|---|
| Длительность песни (с) | 1.12 | 1.17 | 0.39 | 0.53 |
| Длительность паузы (с) | 7.54 | 4.43 | 28.68 | <0.0001 |
| Частота пения (в мин) | 5.80 | 10.29 | 17.86 | 0.0004 |
| Размер репертуара | 20 | 26 | 9.56 | 0.0038 |
| Частота смены напева | 0.96 | 0.98 | 0.38 | 0.54 |
| Индекс линейности | 0.91 | 0.63 | 15.65 | 0.0003 |
| Индекс постоянства | 0.89 | 0.72 | 12.78 | 0.001 |
| Индекс стереотипности | 0.90 | 0.66 | 14.46 | 0.0005 |
| Относительная энтропия | 0.03 | 0.11 | 6.11 | 0.0183 |
| Количество перелетов | 0 | 1 | 14.69 | 0.0005 |
Рис. 3.
Сравнение медианных длительностей пауз, наблюдаемого размера репертуара, относительной энтропии первого порядка и индекса стереотипности на фонограммах самцов голосистой пеночки (n = 19) до и после экспериментальной трансляции. Линии соединяют значения для одного самца, белые столбики показывают квартили, горизонтальные линии внутри столбиков – медианы (цифры рядом с ними – значения медиан).
Все эти параметры можно считать кодирующими территориальную агрессию и/или отражающими общий уровень возбуждения самца. Если это так, то названные метрики, по идее, должны зависеть от уровня агрессивности самца. Однако мы выявили лишь одну такую взаимосвязь, оценивая агрессивность особи как количество перелетов в радиусе 10 м от динамика во время трансляции. Корреляционный анализ (корреляция Спирмена с поправкой Бонферрони) показал, что количество переплетов достоверно коррелировало с длительностью пауз после трансляции (R = –0.73, p = 0.003). Прочие параметры пения во время и после трансляции с количеством перелетов не были связаны.
Таким образом, если говорить о параметрах сложности пения, то после экспериментальной трансляции (1) увеличивается наблюдаемый размер репертуара, а (2) организации пения становится менее упорядоченной (менее линейной). Тренды такой направленности, хотя и выраженные в разной степени, демонстрировали большинство самцов нашей выборки (табл. 2).
Таблица 2.
Направления изменения размера репертуара и относительной энтропии после трансляции видовой песни, по сравнению со спонтанным пением до эксперимента
| Размер репертуара | Относительная энтропия | ||
|---|---|---|---|
| (+) увеличение | 16 | 13 | (+) увеличение |
| 3 | (–) уменьшение | ||
| (0) нет изменений | 2 | 2 | (+) увеличение |
| 0 | (–) уменьшение | ||
| (–) уменьшение | 1 | 1 | (+) увеличение |
| 0 | (–) уменьшение | ||
Обычная практика состояла в том, что самец, певший более или менее в соответствии с принципом линейного синтаксиса, после трансляции видовой песни начинал более свободно чередовать песни разных типов (см. рис. 4).
Рис. 4.
Наблюдаемые переходы между песнями у самцов № 11, 5 и 7 до и после экспериментальной трансляции. Каждый кружок соответствует одному типу песни, стрелки – все отмеченные переходы между ними на соответствующей фонограмме. Приведены значения наблюдаемого размера репертуара, относительной энтропии (RE1) и индекса стереотипности (S).
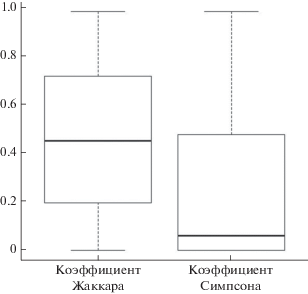
Рассчитав коэффициенты несходства Жаккара и Симпсона, мы посмотрели, как меняется набор типов песен, использованных самцом до и после трансляции. Коэффициент Жаккара варьировал от 0 до 0.98 (медиана 0.45, n = 19), а коэффициент Симпсона – в пределах 0–0.98 (медиана 0.06, n = 19) (рис. 5). Эти результаты следует понимать таким образом. Несходство в наблюдаемых репертуарах данного самца до и после трансляции может быть довольно высоким (в среднем относительно большие коэффициенты Жаккара), но в основном это объясняется добавлением новых типов песен после трансляции с сохранением исполнявшихся ранее (низкие значения коэффициентов Симпсона). Так, 7 из 19 самцов после трансляции исполняли все типы песен, использованные до. 6 из этих 7 пеночек добавили к ним 4–20 новых типов (у одного репертуар не изменился): т.е. размер репертуара увеличился, коэффициент Симпсона равнялся 0, а Жаккара – 0.15–0.67 (n = 6). Прочие особи при пении после трансляции “пропускали” один из несколько типов песен, зафиксированных при пении до, но обычно с лихвой компенсировали это добавлением новых типов.
ОБСУЖДЕНИЕ
В данной работе мы сопоставили спонтанное пение самцов голосистой пеночки с пением в ответ на экспериментальное предъявление типичной видовой песни. Таким образом, в экспериментах мы имитировали “вторжение” постороннего самца на территорию резидента. Зафиксированные изменения могут указывать либо на агрессивную мотивацию самца, либо на нарастание общей мотивации, ситуативно неспецифичной (гипотеза неспецифической активации поведения: Панов, 1978).
Мы выявили, что после экспериментальной трансляции, по сравнению с пением до нее, сокращаются паузы между песнями, увеличиваются частота пения и размер репертуара, а организация пения становится менее упорядоченной (сокращаются индексы линейности, постоянства и стереотипности и увеличивается относительная энтропия). При этом пение во время трансляции практически не менялось по сравнению со спонтанным (до). Скорее всего, во время трансляции самец “пытался” не только (или не столько) петь “агрессивно”, сколько обнаружить “вторженца”. Об этом говорят частые перелеты тестируемых пеночек непосредственно у динамика. Количество таких перелетов существенно сокращалось после завершения трансляции. Наиболее яркие изменения пения не во время, а сразу после проигрывания видовой песни известны и для других воробьиных птиц (Горецкая, 2013).
Среди всех изученных нами параметров наиболее важным выглядит длительность паузы между последовательными песнями (в меньшей степени – частота пения). Во-первых, различия между пением до и после трансляции видовой песни по этой переменной максимальны: об этом говорят, например, наибольшие значения статистики F (табл. 1). Во-вторых, только длительность пауз коррелировала с количеством перелетов самца близ динамика – параметра, косвенно указывающего на его агрессивную мотивацию.
Увеличение частоты пения (количество песен в единицу времени) и, соответственно, сокращение длительности пауз между песнями часто наблюдается при территориальных взаимодействиях у воробьиных птиц, в том числе – в ответ на трансляцию видовой песни (Todt, Naguib, 2000; Searcy, Beecher, 2009). Это известно и для пеночек (Scordato, 2017; Szymkowiak, Kuczyński, 2017). В этом нет ничего удивительного, ведь это, судя по всему, самый простой способ модификации последовательности песен. К тому же – весьма лабильный, так как такие модификации слушателю заметны сразу и могут отражать сиюминутное состояние исполнителя (Searcy et al., 2000; Baker et al., 2012; Szymkowiak, Kuczyński, 2017).
Рассмотрим теперь роль сложности пения в кодировании территориальной агрессии. Первый уровень сложности – структурная сложность песен – нами не анализировалось. Данные по этому поводу имеются для некоторых видов, о чем мы писали в начале статьи.
Второй уровень – структурная сложность пения. Ее можно оценить размером репертуара – использованным количеством типов песен. В ответ на экспериментальное предъявление видовой песни пение фокальных самцов становилось более сложным – т.е. увеличивался наблюдаемый размер репертуара. Подобные данные есть и для других видов. Самцы травяного короткоклювого крапивника (Cistothorus platensis) пели разнообразнее (использовали большее число типов песен), когда неподалеку вокализировал другой самец или самцы (Kroodsma, Verner, 1978). Пеночки Клаудии (Phylloscopus claudiae) в ответ на предъявление им видовой песни также увеличивали количество исполняемых типов песен (Opaev et al., in press). Судя по всему, аналогичный тренд характерен для рыжебокой древесницы (Setophaga pensylvanica). Самцы этого вида имеют в репертуаре в среднем 8 типов песен. При обычном пении используются чаще лишь два типа, а остальные удается услышать редко. Доля таких редких типов достоверно увеличивалась при пении в ответ на трансляцию видовой песни (Byers, 2017). А самцы красноплечего трупиала (Agelaius phoeniceus) использовали больше типов песен, когда ухаживали за самкой (Searcy, Yasukawa, 1990). Таким образом, структурная сложность пения увеличивается при появлении самки или конкурента и/или при увеличении возбуждения поющего самца. Функциональное значение этого может состоять в увеличении времени привыкания к стимулу. Известно, что при монотонном повторении единственного типа сигнала привыкание к нему происходит быстрее, чем если типов сигналов в последовательности больше (Flower et al., 2014).
Наконец, третий уровень – это сложность организации пения. Мы выявили, что у голосистой пеночки пение в ответ на трансляцию видовой песни становилось менее упорядоченным. Говорить о функциональном значении этого тренда сложно. Дело в том, что, по большому счету, функция сложной организации вокальных последовательностей животных, в том числе птиц, не ясна (Ruxton, Schaefer, 2011). Одна из идей состоит в том, что используемые правила помогают птицам максимизировать разнообразие акустической продукции в единицу времени (Панов и др., 2004). Роль переходов между песнями разных типов в коммуникации специально изучалась лишь у южного соловья. Было выявлено, что от особенностей предъявляемой фокальному самцу записи пения зависят не только используемые в “ответном” пении типы песен, но и типы переходов (Weiss et al., 2014). Что касается нашего объекта, то мы склоняемся к тому, что выявленный тренд не имеет здесь собственного функционального значения. Мы уже говорили о том, что большинство самцов голосистой пеночки при спонтанном пении придерживаются жесткого линейного синтаксиса. Т.е. для каждого типа песни (или большинства из них) существует “правило” – какой тип песни должен быть следующим. Сразу после экспериментальной трансляции “правил” становилось меньше либо они были менее четкие. Как мы полагаем, это могло быть связано с тем, что в это время самцы начинали использовать, среди прочих, более редкие типы песни, для которых у них не имелось четких “правил” исполнения.
Таким образом, мы выявили, что у голосистой пеночки структурная сложность и сложность организации пения, наряду с частотой исполнения, могут указывать на агрессивную мотивацию исполнителя. Однако пока неизвестно, могут ли сами птицы “понимать” эту информацию. Потому не ясно, играют ли выявленные различия в пении роль в коммуникации голосистых пеночек.
Список литературы
Антонов А.И., Кадетова А.А., Мельникова Ю.А., Парилов М.П., Кастрикин В.А. и др. 2016. Кадастр наземных позвоночных животных Хинганского заповедника и прилегающих территорий. Благовещенск. 80 с.
Антонов А.И., Квартальнов П.В., 2014. Уточнение списка гнездящихся птиц Хинганского заповедника // Амурский зоологический журнал. Т. VI. С. 85–87.
Горецкая М.Я., 2013. Изменчивость тонкой структуры песни у воробьиных птиц: случайные вариации или направленные изменения, несущие информацию // Зоологический журнал. Т. 92. № 6. С. 718–730.
Иваницкий В.В., Марова И.М., Малых И.М., 2011. Контрасты синтаксиса в рекламном пении близких видов пеночек (Phylloscopus, Sylvidae) // Доклады Академии наук. Т. 438. № 4. С. 570–573.
Иваницкий В.В., 2015. Песня птиц как микрокосм современной науки: между биоакустикой и лингвистикой // XIV орнитологическая конференция Северной Евразии. II. Доклады. Алматы. С. 418–435.
Панов Е.Н., 1978. Механизмы коммуникации у птиц. М.: Наука. 306с.
Панов Е.Н., Непомнящих В.А., Рубцов А.С., 2004. Организация песни у камышевки-барсучка, Acrocephalus schoenobaenus (Aves: Sylviidae) // Зоологический журнал. Т. 83. № 4. С. 464–479.
Baker T., Wilson D., Mennill D., 2012. Vocal signals predict attack during aggressive interactions in Black-capped Chickadees // Animal Behaviour. V. 84. P. 965–974.
Balaban E., 1988. Bird song syntax: learned inrtraspecific variation in meaningful // Proceedings of the National Academy of Sciences of the United States of America. V. 85. P. 3657–3560.
Baselga A., Orme D., 2012. betapart: an R package for the study of beta diversity // Methods in Ecology and Evolution. V. 3. P. 808–812.
Baselga A., Orme D., Villeger S., De Bortoli J., Leprieur F., 2017. Partitioning beta diversity into turnover and nestedness. https://cran.r-project.org/web/packages/betapart
Beecher M.D., Brenowitz E.A., 2005. Functional aspects of song learning in songbirds // Trends in Ecology and Evolution. V. 20. P. 143–149.
Bremond J.-C., 1968. Recherches sur la semantique et les elements vecteurs d’information dans les signaux acoustiques du rouge-gorge Erithacus rubecula // La Terre et la Vie. V. 2. P. 109–220.
Briefer E., Osiejuk T., Rybak F., Aubin T., 2010. Are bird song complexity and song sharing shaped by habitat structure? An information theory and statistical approach // Journal of Theoretical Biology. V. 262. P. 151–164.
Briefer E., Rybak F., Aubin T., 2013. Does true syntax or simple auditory object support the role of skylark song dialect? // Animal Behaviour. V. 86. P. 1131–1137.
Byers B.E., 2017. Chestnut-sided warblers use rare song types in extreme aggressive context // Animal Behaviour. V. 125. P. 33–39.
Carlson N.V., Healy S.D., Templeton C.N., 2017. A comparative study of how British tits encode predator threat in their mobbing calls // Animal Behaviour. V. 125. P. 77–92.
Catchpole C.K., Slater P.J.B., 2008. Bird song: biological themes and variations. Cambridge: Cambridge University Press. 335 p.
Derrickson K.C., 1987. Yearly and situational changes in the estimate of repertoire size in northern mockingbirds (Mimus polyglottos) // The Auk. V. 104. P. 198–207.
Flower T.P., Gribble M., Ridley A.R., 2014. Deception by flexible alarm mimicry in an African bird // Science. V. 344. P. 513–516.
Garamszegi L.Z., Balsby T.J.S., Bell B.D., Borowiec M., Byers B.E. et al., 2005. Estimating the complexity of bird song by using capture–recapture approaches from community ecology // Behavioral Ecology and Sociobiology. V. 57. P. 305–317.
Gentner T., 2007. Mechanisms of temporal auditory pattern recognition in songbirds // Language Learning and Development. V. 3. P. 157–178.
Gil D., Slater P.J.B., 2000. Song organization and singing patterns of the willow warbler, Phylloscopus trochilus // Behaviour. V. 137. P. 759–782.
Hill S.D., Brunton D.H., Anderson M., Ji W., 2018. Fighting talk: complex song elicits more aggressive responses in a vocally complex songbird // Ibis. V. 160. P. 257–268.
Holland J., Dabelsteen T., Paris A.P., 2000. Coding in the song of the wren: importance of rhythmicity, syntax and element structure // Animal Behaviour. V. 60. P. 463–470.
Ivanitskii V.V., Marova I.M., 2012. Huge memory in a tiny brain: unique organization in the advertising song of Pallas’s Warbler Phylloscopus proregulus // Bioacoustics. V. 21. P. 87–105.
Ivanitskii V.V., Marova I.M., Malykh I.M., 2012. Between order and chaos: contrasting syntax in the advertising song of dusky (Phylloscopus fuscatus) and Radde’s (Ph. schwarzi) warblers // Journal of Ornithology. V. 153. P. 337–346.
Ivanitskii V.V., Ivlieva A., Gashkov S., Marova I., 2017. The song structure of the Siberian Blue Robin Luscinia [Larvivora] cyane and a comparison with related species // Ornithological Science. V. 16. P. 71–77.
Jost L., 2007. Partitioning diversity into independent alpha and beta components // Ecology. V. 88. P. 2427–2439.
Kershenbaum A., 2014. Entropy rate as a measure of animal vocal complexity // Bioacoustics. V. 23. P. 195–208.
Kershenbaum A., Blumstein D.T., Roch M.A., Akcay C., Backus G. et al., 2014. Acoustic sequences in non-human animals: a tutorial review and prospectus // Biological Reviews of Cambridge Philosophical Society. V. 91. P. 13–52.
Kipper S., Mundry R., Hultsch H., Todt D., 2004. Long-term persistence of song performances rules in nightingales (Luscinia megarhynchos): a longitudinal field study on repertoire size // Behaviour. V. 141. P. 371–390.
Kroodsma D.E., Verner J., 1978. Complex singing behaviors among Cistothorus wrens // The Auk. V. 95. P. 703–716.
Leitão A., ten Cate C., Riebel K., 2006. Within-song complexity in a songbird is meaningful to both male and female receivers // Animal Behaviour. V. 71. P. 1289–1296.
Lennon J.J., Koleff P., Greenwood J.J.D., Gaston K.J., 2001. The geographical structure of British bird distributions: diversity, spatial turnover and scale // Journal of Animal Ecology V. 70. P. 966–979.
Linhart P., Slabbekoorn H., Fuchs R., 2012. The communicative significance of song frequency and song length in territorial chiffchaffs // Behavioral Ecology. V. 23. P. 1338–1347.
Markowitz J.E., Ivie E., Kligler L., Gardner T.J., 2013. Long-range order in canary song // PLOS Computational Biology. V. 9. e1003052
Nelson D.A., 1988. Feature weighting in species song recognition by the field sparrow (Spizella pusilla) // Behaviour. V. 106. P. 158–181.
Okanoya K., 2013. Finite–state song syntax in Bengalese finches: sensorimotor evidence, developmental processes, and formal procedures for syntax extraction // Bolhuis J.J., Everaert M., eds. Birdsong, speech, and language. Exploring the evolution of mind and brain. London. P. 229–242.
Opaev A., 2016. Relationships between repertoire size and organization of song bouts in the Grey-crowned Warbler (Seicercus tephrocephalus) // Journal of Ornithology. V. 157. P. 949–960.
Opaev A., Kolesnikova Y., Liu M., Kang Z. Singing of Claudia’s Leaf-warbler (Phylloscopus claudiae) in aggressive context: role of song rate, song-type diversity and song-type transitional pattern // Journal of Ornithology. In press.
Palmero A.M., Espelosín J., Laiolo P., Illera J.C., 2014. Information theory reveals that individual birds do not alter song complexity when varying song length // Animal Behavior. V. 87. P. 153–163.
Pekár S., Brabec M., 2016. Marginal models via GLS: a convenient yet neglected tool for the analysis of correlated data in the behavioural sciences // Ethology. V. 122. P. 621–631.
Pinheiro J., Bates D., DebRoy S., Sarkar D., Heisterkamp S. et al., 2017. Linear and nonlinear mixed effects models. https://cran.r-project.org/web/packages/nlme
R Core Team., 2016. R: A language and environment for statistical computing. Vienna: R Foundation for Statistical Computing. https://www.r-project.org
Roach S.P., Johnson L., Phillmore L.S., 2012. Repertoire composition and singing behaviour in two eastern populations of the Hermit Thrush (Catharus guttatus) // Bioacoustics. V. 21. P. 239–252.
Ruxton G.D., Schaefer H.M., 2011. Resolving current disagreements and ambiguities in the terminology of animal communication // Journal of Evolutionary Biology. V. 24. P. 2574–2585.
Sasahara K., Cody M.L., Cohen D., Taylor C.E., 2012. Structural design principles of complex bird songs: a network-based approach // PloS ONE. e44446
Scharff C., Nottebohm F., 1991. A comparative study of the behavioral deficits following lesions of various parts of the Zebra Finch song system: implication for vocal learning // Journal of Neuroscience. V. 11. P. 2896–2913.
Scordato E.S.C., 2017. Geographic variation in male territory defense strategy in an avian ring species // Animal Behaviour. V. 126. P. 153–162.
Searcy W.A., Yasukawa K., 1990. Use of the song repertoire in intersexual and intrasexual context by male red-winged blackbirds // Behavioral Ecology and Sociobiology. V. 27. P. 123–128.
Searcy W.A., Beecher M.D., 2009. Song as an aggressive signal in songbirds // Animal Behaviour. V. 78. P. 1281–1292.
Searcy W.A., Nowicki S., Hogan C., 2000. Song type variants and aggressive context // Behavioural Ecology and Sociobiology. V. 48. P. 358–363.
da Silva M.L., Piqueira J.R.C., Vielliard J.M.E., 2000. Using Shannon entropy on measuring the individual variability in the rufous-bellied thrush Turdus rufiventris vocal communication // Journal of Theoretical Biology. V. 207. P. 57–64.
Spedicato G.A., Kang T.S., Yalamanchi S.B., Thoralf M., Yadav D. et al., 2017. Easy handling discrete time Markov chains. https://cran.r-project.org/web/packages/markovchain
Szymkowiak J., Kuczyński L., 2017. Song rate as a signal of male aggressiveness during territorial contests in the wood warbler // Journal of Avian Biology. V. 48. P. 275–283.
Taylor C.E., Brumley J.T., Hedley R.W., Cody M.L., 2017. Sensitivity of California Thrashers (Toxostoma redivivum) to song syntax // Bioacoustics. V. 26. P. 259–270.
Todt D., Naguib M., 2000. Vocal interactions in birds: the use of song as a model in communication // Advances in the Study of Behavior. V. 29. P. 247–296.
Vehrencamp S.L., Hall M.L., Bohman E.R., Depeine C.D., Dalziel A.H., 2007. Song matching, overlapping, and switching in the banded wren: the sender’s perspective // Behavioral Ecology. V. 18. P. 849–859.
Weiss M., Hultsch H., Adam I., Scharff C., Kipper S., 2014. The use of network analysis to study complex animal communication systems: a study on nightingale song // Proceedings of the Royal Society B. V. 281. 20140460.
Woolley S.M.N., Rubel E.W., 1997. Bengalese finches Lonchura striata domestica depend upon auditory feedback for the maintenance of adult song // Journal of Neuroscience. V. 17. P. 6380–6390.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал