Зоологический журнал, 2019, T. 98, № 4, стр. 365-370
Эпибионты и комменсалы северного литода (Lithodes maja, Decapoda, Lithodidae) в Баренцевом море
А. Г. Дворецкий 1, *, В. Г. Дворецкий 1
1 Мурманский морской биологический институт Кольского научного центра РАН
183010 Мурманск, Россия
* E-mail: dvoretskiya@mmbi.info
Поступила в редакцию 29.01.2018
После доработки 23.06.2018
Принята к публикации 19.08.2018
Аннотация
Исследованы видовой состав и индексы заселенности северного литода (Lithodes maja) эпибионтами и комменсалами в губе Дальнезеленецкая (прибрежье Баренцева моря). На крабах отмечено 26 видов ассоциированных организмов. Из обрастателей наиболее часто встречались гидроиды Obelia longissima (94.6%), а также полихеты Placostegus tridentatus (64.9%) и Circeis armoricana (59.5%). Массовые комменсалы были представлены амфиподами Ischyrocerus commensalis (94.6%) и Ischyrocerus anguipes (48.6%), полихетами Harmothoe imbricata (70.3%). Видовой состав эпибионтов L. maja сходен с тем, что был отмечен ранее для близкородственного камчатского краба Paralithodes camtschaticus. Различия в индексах заселенности двух крабов-литодид объясняются различиями в размерах тела хозяев и различиями в структуре их экзоскелета.
Ареал литодеса, или северного литода (Lithodes maja (L. 1758)), который относится к семейству Lithodidae (Королевские крабы), является довольно обширным. В Северо-Западной Атлантике литод встречается у восточного и южного побережья Гренландии и вдоль побережья Лабрадора к югу до новой Шотландии и залива Мэн, а также в глубоководных районах (>400 м) устья Святого Лаврентия. Литоды отмечены у южного и западного берегов Ньюфаундленда, вдоль континентального склона новой Шотландии, а также в устье залива Фанди. Южной границей ареала в Северо-Западной Атлантике является Мэриленд. Глубина обитания обычно 100–1000 м (Woll, Burmeister, 2002; Соколов, 2003; Stevens, Lovrich, 2014). В Северо-Восточной Атлантике и прилегающей части Арктики границы распределения от 74°25′ с.ш.–17°36′ в.д. и побережья Западного Шпицбергена на севере и Белого моря на востоке до Исландии, Юго-Восточной Гренландии, Фарерских и Британских островов (Соколов, 2003). Согласно последним данным, в районе Шпицбергена вид отсутствует (Stevens, Lovrich, 2014; Zimina et al., 2015). В Баренцевом море данный крабоид встречается в открытой части моря, преимущественно на глубинах 70–100 м (Кузнецов, 1964). Северный литод не относится к промысловым видам, так как не образует скоплений, в отличие от ряда других крабов-литодид (Соколов 2003). Тем не менее, у берегов Гренландии L. maja является потенциальным ресурсом для промысла, хотя его лов и обработка довольно трудоемки (Woll, Burmeister, 2002).
Исследований биологии L. maja немного, они ограничиваются в основном описанием его распространения, размерного состава и репродуктивных особенностей (Кузнецов, 1964; Woll, Burmeister, 2002). Данные о видовом составе эпибионтов и комменсалов L. maja в Баренцевом море ограничены предварительными исследованиями (Дворецкий, Дворецкий, 2012), несмотря на то, что подобная информация может быть полезна с точки зрения потенциальной промысловой ценности краба, а также как индикатор возможных изменений в экосистемах в связи с распространением эпибионтов при миграциях хозяев. Цель работы – описание видового состава и определение индексов заселенности организмов, ассоциированных с L. maja. Для этого проанализирована представительная выборка хозяев, охватывающая обширный временнóй диапазон. Это позволило расширить список ассоциированных организмов, уточнить особенности локализации обрастателей и индексы их заселенности.
МАТЕРИАЛ И МЕТОДИКА
Материалом для исследования послужили сборы организмов, обитающих на экзоскелете и в жабрах Lithodes maja. Отбор проб осуществляли в губе Дальнезеленецкой Баренцева моря в период c июля по сентябрь в 2004–2010 гг. Всего проанализировано 37 особей L. maja, которые были отловлены водолазами с глубин 5–40 м (26 экз.) и при помощи донных ставных ловушек с глубин 120–180 м (11 экз.). Плотность крабоидов оценивали на основе площадного метода по данным водолазных работ только на глубинах 5–40 м (Соколов, Милютин, 2006). Все крабы оказались самцами и характеризовались третьей поздней стадией линочного цикла (возраст экзоскелета более одного года). Ассоциированных животных отбирали непосредственно после поимки крабов. Материал фиксировали в 4% растворе формальдегида для последующего анализа.
Под экстенсивностью заселения понимали отношение количества крабов, заселенных эпибионтами, к общему количеству исследованных хозяев; средней интенсивностью – отношение общего количества эпибионтов в пробах к количеству заселенных хозяев (Martin, Britayev, 1998). Для сравнения сообщества обрастателей северного литода с сообществом обрастателей близкородственного камчатского краба использовали индексы заселенности камчатского краба (42 особи со старым экзоскелетом, отловленные в том же районе, Dvoretsky, Dvoretsky, 2010). Сравнение проводили при помощи критерия χ2 (процентные данные) и с использованием теста Краскела-Уоллиса (количественные величины).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ширина карапакса проанализированных особей варьировала от 79.5 до 109.0 мм, среднее – 91.8 мм. Наиболее часто встречались крабы размерного диапазона 90–99 мм.
В целом, за период исследований плотность литодов в губе Дальнезеленецкая (глубины до 40 м) была относительно низкой (0.002 экз/м2) по сравнению с данными предыдущих исследований (Кузнецов, 1964). Это может быть связано с тем, что наши данные в основном характеризуют малые глубины, где литод изначально имеет малую плотность поселения. Возможно также, что L. maja испытывает конкуренцию со стороны вселенного в Баренцевом море камчатского краба (Paralithodes camtschaticus (Tliesius 1815)), который имеет сходную экологическую нишу (Кузьмин, Гудимова, 2002; Павлова, 2008) и постепенно вытесняет этот аборигенный вид.
Ассоциированные с L. maja организмы были отмечены на всех крабах, при этом показатели экстенсивности заселения литодов каждым из отмеченных видов достоверно не различалась на разных диапазонах глубин (5–40 и 120–180 м) (р > 0.05). Этот результат вполне объясним, поскольку особи северного литода, отловленные на относительно небольших глубинах, по всей видимости, мигрировали из глубоководных районов, где на них поселилась основная часть обрастателей. Сходную закономерность, когда сообщества обрастателей по видовому составу достоверно не различались на хозяевах, отловленных на разных глубинах в одном и том же районе, наблюдали для краба-стригуна (Chionoecetes opilio) у берегов Канады (Savoie et al., 2007).
Всего в пробах обнаружено 26 видов ассоциированных организмов (табл. 1).
Таблица 1.
Видовой состав и индексы заселенности северного литода (Lithodes maja) ассоциированными организмами в губе Дальнезеленецкая в 2004–2010 гг.
| Таксон | Экстенсивность заселения, % | Интенсивность заселения, экз. | Средняя интенсивность заселения, экз./краб |
|---|---|---|---|
| Hydrozoa | |||
| Obelia geniculata (L. 1758) | 48.6 | – | – |
| Obelia longissima (Pallas 1766) | 94.6 | – | – |
| Nemertini | |||
| Nemertini g. sp. | 10.8 | 1–12 | 4.3 ± 2.6 |
| Polychaeta | |||
| Bushiella (Jugaria) similis (Bush 1905) | 2.7 | 2–2 | 2.0 ± 0.0 |
| Circeis armoricana Saint-Joseph 1894 | 59.5 | 4–345 | 89.4 ± 32.5 |
| Eumida sanguinea (Örsted 1843) | 5.4 | 1–2 | 1.5 ± 0.5 |
| Harmothoe imbricata (L. 1767) | 70.3 | 1–3 | 1.3 ± 0.2 |
| Lepidonotus squamatus (L. 1758) | 2.7 | 1–1 | 1.0 ± 0.0 |
| Spirobranchus triqueter (L. 1758) | 8.1 | – | – |
| Placostegus tridentatus (Fabricius 1779) | 64.9 | – | – |
| Hirudinea | |||
| Johanssonia arctica (Johansson 1898) | 2.7 | 3–3 | 3.0 ± 0.0 |
| Bivalvia | |||
| Mytilus edulis L. 1758 | 32.4 | 1–3 | 1.4 ± 0.2 |
| Heteranomia squamula (L. 1767) | 48.6 | 1–79 | 13.9 ± 9.4 |
| Hiatella arctica (L. 1767) | 13.5 | 1–5 | 4.4 ± 2.4 |
| Copepoda | |||
| Ectinosoma neglectum Sars G.O. 1904 | 2.7 | 2–2 | 2.0 ± 0.0 |
| Tisbe furcata (Baird 1837) | 8.1 | 1–3 | 2.0 ± 0.6 |
| Amphipoda | |||
| Ischyrocerus commensalis Chevreux 1900 | 94.6 | 8–109 | 26.5 ± 3.5 |
| Ischyrocerus anguipes Krøyer 1838 | 48.6 | 1–23 | 9.1 ± 1.2 |
| Gammarellus homari (Fabricius 1779) | 5.4 | 1–3 | 2.0 ± 1.0 |
| Cirripedia | |||
| Balanus balanus (L. 1758) | 35.1 | 1–3 | 1.7 ± 0.2 |
| Balanus crenatus Brugiere 1789 | 32.4 | 1–8 | 3.2 ± 0.6 |
| Bryozoa | |||
| Callopora lineata (L. 1767) | 29.7 | – | – |
| Crisia denticulata (Smitt 1865) | 10.8 | – | – |
| Lichenopora hispida (Fleming 1828) | 27.0 | – | – |
| Lichenopora verrucaria (Fabricius 1780) | 13.5 | – | – |
| Scrupocellaria arctica (Smitt 1868) | 18.9 | – | – |
Среди эпибионтов (несимбиотических организмов, колонизирующих твердые субстраты) наиболее часто на крабах встречался гидроид Obelia longissima (экстенсивность заселения 94.6%). Гидроиды рода Obelia довольно распространены в морях Российской Арктики (Пантелеева, 2004), ранее O. longissima была отмечена на камчатских крабах в Баренцевом (Dvoretsky, Dvoretsky, 2010) и Охотском морях (Клитин, 2003). Другими распространенными обрастателями были сидячие полихеты Circeis armoricana (59.5%) и Placostegus tridentatus (64.9%), также довольно часто встречающиеся в ассоциации с различными ракообразными (Дворецкий, Дворецкий, 2012). Реже на литодах отмечались другие прикрепленные организмы (двустворчатые моллюски, мшанки и усоногие раки), которые являются обычными сожителями крабов по всему миру (Кузнецов, 1964; Бакай, 2003; Клитин, 2003; Savoie et al., 2007, Дворецкий, Дворецкий, 2012).
Наиболее распространенными симбионтами литода были амфиподы Ischyrocerus commensalis, встреченные на каждом хозяине (экстенсивность заселения 100%). Ранее бокоплавы этого вида были отмечены на различных видов крабов: Paralithodes camtschaticus в Баренцевом и Охотском морях (Jansen et al., 1998; Бакай, 2003; Клитин, 2003; Дворецкий, Дворецкий, 2009; Dvoretsky, Dvoretsky, 2009, 2011), Hyas araneus в Баренцевом и Норвежском морях (Vader, 1996; Dvoretsky, 2012), Chionoecetes opilio у берегов Канады (Steele et al., 1986). Ассоциация с крабом выгодна для амфипод, поскольку обеспечивает им защиту от хищников (литоды находятся на верхнем уровне пищевой пирамиды и сами становятся жертвами рыб или морских млекопитающих лишь в период линьки), создает благоприятные условия для размножения (на это указывают находки икряных самок и ювенильных бокоплавов), а также, по всей видимости, обеспечивает комменсалов питанием (органическими остатками от других организмов, остающихся на ротовом аппарате и других частях тела), так же, как это было показано ранее для камчатского краба (Dvoretsky, Dvoretsky, 2009).
Особенности локализации I. commensalis на северных литодах показаны на рис. 1. Видно, что основная доля бокоплавов была сконцентрирована в жабрах литодов. При сравнении с камчатским крабом прослеживаются достоверные различия (df = 4, χ2 = 217.35, P < 0.001), поскольку на последних доля I. commensalis в жабрах в 2 раза ниже, а на ротовом аппарате 3 раза выше, чем у северного литода. Видимо, такой результат обусловлен различиями в питании двух видов хозяев, в частности известно, что литод в большей степени является падальщиком (Кузнецов, 1964), тогда как камчатский краб предпочитает свежий корм (Кузьмин, Гудимова, 2002).
Рис. 1.
Особенности локализации массовых симбиотических амфипод рода Ischyrocerus на северных литодах Lithodes maja в губе Дальнезеленецкая (Баренцево море).
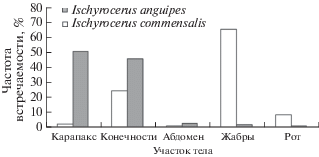
Близкородственный вид Ischyrocerus anguipes также достаточно часто заселял литодов (экстенсивность заселения 48.6%), но локализован был преимущественно на карапаксе и конечностях краба точно так же, как это было отмечено нами ранее для камчатского краба (Дворецкий, Дворецкий, 2010) (рис. 1). Различий в распределении I. anguipes на двух видах крабов не выявлено (df = 4, χ2 = 7.25, P = 0.123). Это подтверждает предположение о том, что данный бокоплав является менее специализированным симбионтом по сравнению с I. commensalis.
Другой распространенный комменсал северного литода – полихета Harmothoe imbricata (экстенсивность заселения 70.3%). Этот вид ранее был отмечен в качестве факультативного симбионта раков-отшельников (Williams, McDermott, 2004) и камчатского краба (Dvoretsky, Dvoretsky, 2010). Полихеты были наиболее обильные под абдоменом крабов. Такая локализация обеспечивает им защиту от хищников. Также нельзя исключать и возможность питания органическим веществом, концентрирующимся на нижней части тела хозяина, как это было отмечено при поселении полихет этого вида на раках-отшельниках (Pettibone, 1963).
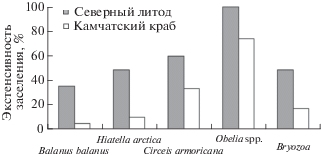
Видовой состав обрастателей и симбионтов, а также индексы заселенности L. maja, в Баренцевом море во многом сходны с теми показателями, которые мы отмечали ранее для камчатского краба в том же районе (Dvoretsky, Dvoretsky, 2010, 2013). При этом имеются и различия. На камчатских крабах в целом частота встречаемости обрастателей была существенно ниже, чем на литодах (рис. 2), а некоторые виды, в частности сидячие полихеты Spirobranchus triqueter и Placostegus tridentatus, вообще не встречались.
Рис. 2.
Частота встречаемости обрастателей на северных литодах Lithodes maja и камчатских крабах Paralithodes camtschaticus в губе Дальнезеленецкая (Баренцево море).
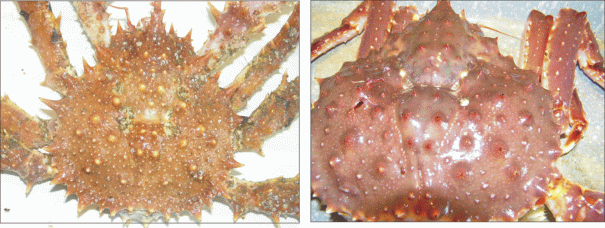
Возможно, химический состав панциря двух видов крабов несколько различается, что может иметь значение для оседания планктонных личинок полихет-обрастателей. Однако, на наш взгляд, гораздо большее влияние оказывает характер поверхности карапакса, который различается у литода и камчатского краба. Известно, что у ювенильных особей L. maja на панцире присутствует множество шипов, большая часть из которых у взрослых особей редуцируется (Кузнецов, 1964), из-за чего поверхность тела L. maja гораздо более шероховатая, чем у P. camtschaticus. Это видно даже невооруженным глазом (рис. 3). Соответственно, колонизация литодов проходит быстрее и на его теле закрепляется большое количество обрастателей. Отметим, что частота линек сравниваемых видов хозяев, несмотря на меньший размер литода, проходит с одинаковой периодичностью: взрослые особи линяют 1 раз в год или, в случае самцов, могут пропускать линьку.
Рис. 3.
Визуальные различия в структуре панциря северного литода (слева) и камчатского краба (справа).
Другим различием в заселенности обоих видов является более низкая интенсивность заселения литодов амфиподами I. commensalis (27 против 80 экз. на камчатских крабах, df = 1, Н = 27.38, P < 0.001). Вероятно, это обусловлено тем, что литоды имели меньшие размеры, чем камчатские крабы (91.9±2.6 мм против 154.9 ± 2.5 мм по ширине карапакса, df = 1, Н = 58.28, P < 0.001), это в свою очередь вело к снижению доступной для поселения площади. Для амфипод I. commensalis это особенно важно, так как они концентрируются в основном на относительно небольших по площади участках тела хозяина (ротовом аппарате и в жабрах). С другой стороны, для камчатских крабов характерна меньшая степень заселенности обрастателями, которые зачастую являются конкурентами амфипод (Дворецкий, Дворецкий, 2011).
ЗАКЛЮЧЕНИЕ
Баренцевоморский крабоид Lithodes maja служит хозяином для широкого спектра комменсалов и обрастателей, среди которых чаще всего отмечаются гидроиды Obelia spp., амфиподы Ischyrocerus spp. и полихеты Harmothoe imbricata, Placostegus tridentatus и Circeis armoricana. Для северного литода характерна более высокая заселенность обрастателями, чем для близкородственного камчатского краба, в связи с более шероховатой поверхностью панциря.
Список литературы
Бакай Ю.И., 2003. Паразитологические исследования камчатского краба в Баренцевом море // Камчатский краб в Баренцевом море. Мурманск: Изд-во ПИНРО. С. 203–218.
Дворецкий А.Г., Дворецкий В.Г., 2009. Обрастатели и симбионты камчатского краба (Paralithodes camtschaticus) в губе Долгая Баренцева моря // Зоологический журнал. Т. 88. № 11. С. 1320–1325.
Дворецкий А.Г., Дворецкий В.Г., 2010. Некоторые черты биологии амфипод Ischyrocerus anguipes, обитающих на камчатском крабе (Paralithodes camtschaticus) в Баренцевом море // Зоологический журнал. Т. 89. № 9. С. 1062–1069.
Дворецкий А.Г., Дворецкий В.Г. 2011. Межвидовая конкуренция симбионтов и обрастателей камчатского краба в Баренцевом море // Доклады академии наук. Т. 440. № 3. С. 283–285.
Дворецкий А.Г., Дворецкий В.Г., 2012. Эпифауна крабов-литодид в Баренцевом море. Апатиты: Изд-во КНЦ РАН. 410 с.
Клитин А.К., 2003. Камчатский краб у берегов Сахалина и Курильских островов: биология, распределение и функциональная структура ареала. М.: Нацрыбресурсы. 253 с.
Кузнецов В.В., 1964. Биология массовых и наиболее обычных видов ракообразных Баренцева и Белого морей. Л.: Наука. 244 с.
Кузьмин С.А., Гудимова Е.Н., 2002. Вселение камчатского краба в Баренцево море. Особенности биологии, перспективы промысла. Апатиты: Изд-во КНЦ РАН. 236 с.
Павлова Л.В., 2008. Трофические связи камчатского краба и его воздействие на донные биоценозы // Биология и физиология камчатского краба прибрежья Баренцева моря. Апатиты: Изд-во КНЦ РАН. С. 77–104.
Пантелеева Н.Н., 2004. Адаптация жизненных циклов гидроидных к условиям существования на примере отдельных видов; значение фрустуляции // Материалы II Всероссийской школы по морской биологии (г. Мурманск, 3-5 ноября 2003 г.). Апатиты: КНЦ РАН. С. 127–149.
Соколов В.И., 2003. Фауна десятиногих ракообразных (Crustacea, Decapoda) Баренцева моря // Труды ВНИРО. Т. 142. С. 25–76.
Соколов В.И., Милютин Д.М., 2006. Распределение, численность и размерный состав камчатского краба Paralithodes camtschaticus в верхней сублиторали Кольского полуострова Баренцева моря в летний период // Зоологический журнал. Т. 85. № 2. С. 158–170.
Dvoretsky A.G., 2012. Epibionts of the great spider crab, Hyas araneus (Linnaeus, 1758), in the Barents Sea // Polar Biology. V. 35. P. 625–631.
Dvoretsky A.G., Dvoretsky V.G., 2009. Distribution of amphipods Ischyrocerus on the red king crab, Paralithodes camtschaticus: Possible interactions with the host in the Barents Sea // Estuarine Coastal and Shelf Science. V. 82. P. 390–396.
Dvoretsky A.G., Dvoretsky V.G., 2010. Epifauna associated with an introduced crab in the Barents Sea: a 5-year study // ICES Journal of Marine Science. V. 67. P. 204–214.
Dvoretsky A.G., Dvoretsky V.G., 2011. Population biology of Ischyrocerus commensalis, a crab-associated amphipod, in the southern Barents Sea: a multi-annual summer study // Marine Ecology. V. 32. P. 498–508.
Dvoretsky A.G., Dvoretsky V.G., 2013. Copepods associated with the red king crab Paralithodes camtschaticus (Tilesius, 1815) in the Barents Sea // Zoological Studies. V. 52:17. P. 1–7.
Jansen P.A., Mackenzie K., Hemmingsen W., 1998. Some parasites and commensals of red king crab Paralithodes camtschaticus in the Barents Sea // Bulletin of European Association of Fish Pathologists. V. 18. № 2. P. 46–49.
Martin D., Britayev T.A., 1998 Symbiotic polychaetes: review of known species // Oceanography and Marine Biology: an Annual Review. V. 36. P. 217–340.
Pettibone M.H., 1963. Marine polychaete worms of the New England region: I. Families Aphroditidae through Trochochaetidae // Bulletin of U.S. Natural Museum. V. 227. P. 1–356.
Savoie L., Miron J., Biron M., 2007. Fouling community of the snow crab Chionoecetes opilio in Atlantic Canada // Journal of Crustacean Biology. V. 27. P. 30–36.
Steele D.H., Hooper R.G., Keats D., 1986. Two corophioid amphipods commensal on spider crabs in Newfoundland // Journal of Crustacean Biology. V. 6. P. 119–124.
Stevens B.G., Lovrich G.A., 2014. King crabs of the world: species and distributions // King crabs of the world: biology and fisheries management. Boca Raton: CRC Press (Taylor and Francis Group). P. 1–30.
Vader W., 1996. Amphipoda as associates of other Crustacea // Book of Abstracts of the Second European Crustacean Conference, Liege (Belgium), September 2–6. Liege: Liege University Press. P. 67.
Williams J.D., McDermott J.J., 2004. Hermit crab biocoenoses; a worldwide review of the diversity and natural history of hermit crab associates // Journal of Experimental Marine Biology and Ecology. V. 305. P. 1–128.
Woll A.K., Burmeister A.D., 2002. Occurrence of Northern stone crab (Lithodes maja) at Southeast Greenland // Crabs in Cold Water Regions: Biology, Management, and Economics. Fairbanks: University of Alaska. P. 81–96.
Zimina O.L., Lyubin P.A., Jørgensen L.L., Zakharov D.V., Lyubina O.S., 2015. Decapod Crustaceans of the Barents Sea and adjacent waters: species composition and peculiarities of distribution // Arthropoda Selecta. V. 24(3). P. 417–428.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


