Зоологический журнал, 2019, T. 98, № 6, стр. 649-664
Связь успешности межвидового выкармливания птенцов с шириной трофической ниши вида-реципиента у птиц-дуплогнездников
Т. А. Ильина 1, *, А. В. Крупицкий 2, **, А. В. Бушуев 1, ***
1 Московский государственный университет им. М.В. Ломоносова,
Биологический факультет
119234 Москва, Россия
2 Институт проблем экологии и эволюции РАН
119071 Москва, Россия
* E-mail: ilyina@mail.bio.msu.ru
** E-mail: nephrurus@yandex.ru
*** E-mail: a_bushuev@mail.ru
Поступила в редакцию 08.04.2018
После доработки 30.01.2019
Принята к публикации 01.02.2019
Аннотация
Проанализирована структура рациона птенцов воробьиных для выявления возможных способов снижения пищевой конкуренции между этими видами в период размножения. Мы предположили, что анализ эффектов от получения птенцами рационов чужих видов птиц в природе может помочь лучшему пониманию их видоспецифических адаптаций к условиям обитания, и в качестве ключевого звена рассмотрели случай совместного гнездования синицы московки (Periparus ater (L. 1758)) (СМ) и мухоловки-пеструшки (Ficedula hypoleuca (Pallas 1764)) (МП) в Московской области. Самец МП привлек самку в искусственную дуплянку, которая уже была занята парой СМ. Самки обоих видов насиживали смешанную кладку, сидя бок о бок. Птенцы СМ вылупились раньше птенцов МП, и родители обоих видов принялись их кормить. На 4-й день совместного кормления птенцы СМ начали погибать один за другим, а на 11-й день погиб последний птенец. Этот случай подтолкнул нас к сопоставлению рационов питания птенцов из 22 выводков СМ и МП в одном и том же регионе. Для сравнения рационов питания птенцов мы собирали порции пищи, которые доставляли птенцам их родители, и анализировали видеозаписи у гнезд. Рацион птенцов МП оказался существенно разнообразнее, чем у СМ (обратные индексы Бергера-Паркера (1/d) равнялись, соответственно, 3.01 и 2.11). В рационе СМ доминировали гусеницы и пауки – объекты с большим содержанием каротиноидов и таурина, важных для развития птенцов. В корме МП эти объекты занимали существенно меньшую долю. Помимо сказанного, по сравнению с московками, МП приносили птенцам: – существенное количество объектов с грубыми, сильно хитинизированными покровами (Coleoptera, Homoptera и т.п.); – объекты с резким вкусом, такие как клопы (Heteroptera), божьи коровки (Coleoptera, Coccinellidae), кивсяки (Diplopoda, Julidae); – насекомых, содержащих токсин кантаридин, – мягкотелок (Coleoptera, Cantharidae). В гнездах МП, в которых родители приносили такие кормовые объекты, птенцы успешно развивались. Размерные диапазоны объектов в рационах МП и СМ полностью перекрывались. По нашему мнению, большее количество грубых, сильно хитинизированных продуктов питания и некоторых ядовитых насекомых (Cantharidae) в рационе МП делают принципиально важными различия в питании птенцов МП и СМ. Возможно, МП обладают резистентностью к кантаридину и некоторым другим токсинам, которые содержатся в насекомых, и поэтому обладают более широкой трофической нишей.
Основной путь к ослаблению конкуренции между видами – снижение доли общих эксплуатируемых ресурсов, главным образом, за счет достижения различий в занимаемых микроместообитаниях, потребляемой пище и времени активности (Maurer, 1984; Julliard et al., 2006; Miller, Spoolman, 2011). Сильное перекрывание по одному из перечисленных параметров требует расхождения по другим из них. Такое расхождение ведет к комплементарности экологических ниш конкурирующих видов одного сообщества и способствует повышению его устойчивости (Пианка, 1981; Одум, 1975, 1986; Бигон и др., 1989; MacArtur, 1972). Концепция об экологических нишах, сформулированная во второй половине прошлого века, сохраняет актуальность и в настоящее время. Ее разработка идет как в теоретическом, так и прикладном направлениях. В частности, серия работ на разных видах продемонстрировала на практике, что виды-специалисты более чувствительны к изменению внешней среды, чем генералисты (Kitahara et al., 2000; Dapporto, Dennis, 2013). Было показано формирование “функциональной гомогенизации” сообщества при “вымывании” видов-специалистов, менее устойчивых к изменениям внешней среды, прежде всего, антропогенным, в силу своей повышенной чувствительности к ним (Colles et al., 2009). Причины этой повышенной чувствительности не всегда ясны (Barnagaud et al., 2011; Clavel et al., 2011), и не всегда понятны причины проявления устойчивости к внешней среде у видов-генералистов (Brandl et al., 1994; Julliard, 2004; Abrams, 2012). Особенно важны исследования таких причин в те периоды годового цикла вида, когда его требования к окружающей среде повышены. Период размножения – наиболее критическая фаза годового цикла. Во-первых, потому, что при появлении молодняка и, соответственно, увеличении численности особей в популяции, возрастает потребность в ресурсах. Во-вторых, пределы экологической толерантности для размножающихся и растущих особей уже, чем для взрослых неразмножающихся (Одум, 1986). Известно, что для вторичных дуплогнездников, т.е. видов птиц, которые строят гнезда в готовых убежищах, последние представляют собой дефицитный ресурс (см. обзор Newton, 1994). С самыми большими проблемами при устройстве гнезда сталкиваются облигатные дуплогнездники – виды, которые, занимают убежища с маленьким входом, соизмеримым с диаметром их тела. Чем однообразнее видовой стереотип гнездования, тем выше конкуренция за места для его постройки. Следовательно, для снижения межвидовой конкуренции необходима диверсификация жизненных стратегий. В первую очередь, это разобщенность по срокам гнездования и сопряженные с этими сроками адаптации к трофическим условиям. Среди европейских лесных птиц, которые являются облигатными дуплогнездниками, – преимущественно кочующие виды: поползень (Sitta europaea (L. 1758) и шесть наиболее часто встречающихся видов синиц (Paridae) (Птушенко, Иноземцев, 1968; Мальчевский, Пукинский, 1983; Симкин, 1990). В силу своего пространственного статуса, оседлые виды первыми, по сравнению с перелетными, получают возможность занять подходящее место для гнездования. Виды-мигранты приступают к размножению позже и имеют дело уже с остатками дефицитного ресурса. Среди лесных видов-мигрантов, гнездящихся в убежищах, много полудуплогнездников, таких, как зарянка (Erithacus rubecula (L. 1758)), обыкновенная горихвостка (Phoenicurus phoenicurus (L. 1758)), серая мухоловка (Muscicapa striata (Pallas 1764)), малая мухоловка (Ficedula parva (Bechstein 1792)). Эти виды более пластичны в выборе места для постройки гнезда, чем облигатные дуплогнездники, что ослабляет конкуренцию при выборе мест гнездования. К облигатным дуплогнездникам-мигрантам можно отнести только скворца (Sturnus vulgaris (L. 1758)), мухоловку-пеструшку (Ficedula hypoleuca), распространенных на юге Европы полуошейниковую мухоловку (Ficedula semitorquata (von Homeyer 1885)) и мухоловку-белошейку (Ficedula albicollis (Temminck 1815)). Основные кормовые стации скворца – открытые местообитания, а мухоловка-пеструшка – типичный лесной вид, конкурирующий с оседлыми видами облигатных дуплогнездников. В гнездовой сезон все перечисленные виды-дуплогнездники питаются и выкармливают птенцов насекомыми и другими мелкими беспозвоночными. Между некоторыми дуплогнездниками в гнездовой период отмечены биотопические различия вплоть до почти полной сегрегации (Симкин, 1990; Lack, 1971), вместе с тем трофическое пространство многих из этих видов перекрывается. Особенно сильное перекрытие происходит при добыче объектов, которые обладают большой пищевой ценностью для птенцов, таких, как гусеницы (Korňan, Adamík, 2007; Visser et al., 2004; Samplonius et al., 2016).
Сосуществование видов с различной степенью специализации при условии ограниченности ресурсов возможно в следующих вариантах: при полном перекрывании спектров питания пластичного вида-генералиста с гильдией специалистов; при использовании видом-генералистом невостребованных конкурентами ресурсов (Пианка, 1981). Расширение спектра питания возможно вследствие применения дополнительных охотничьих приемов, которые позволят добывать менее доступную для других видов добычу, а также при употреблении в пищу менее пригодных для других объектов (Конторщиков, 2001; Бурский и др., 2004; Lack, 1971; Moreno, Carrascal, 1993; Brandl et al., 1994). Сравнение рационов экологически близких видов и выявление их пищевых предпочтений в естественной среде обитания позволяют судить о степени конкуренции между этими видами, что объясняет интерес к такого рода исследованиям у большого числа орнитологов (Bures, 1995; Sedláček et al., 2007; De León et al., 2014; Burin et al., 2016). Вместе с тем, работы в естественных условиях, как правило, дают мало информации о значимости для вида тех или иных компонентов рациона, о наличии адаптаций, способствующих усвоению тех или иных объектов, об эффекте, который оказывают компоненты рациона вида-конкурента. С нашей точки зрения, исследования в этом направлении требуют экспериментального подхода. Иногда природа сама “проводит” своего рода эксперименты, по результатам которых можно судить о влиянии рационов чужих видов на растущих птенцов. Данные о находках смешанных межвидовых кладок и выкармливании птенцов особями другого вида описывают результаты подобного рода природных экспериментов (Бушуев, Вострецова, 2011; Shy, 1982; Slagsvold, 2004). В большинстве таких случаев, а также при искусственных перекладках яиц и птенцов в другие гнезда, отмечена несимметричность эффекта перекрестного выращивания птенцов чужого вида. Отмечено, в частности, что птенцы мухоловок-пеструшек благополучно вырастают в гнездах синиц разных видов, а успешность выкармливания синиц мухоловками-пеструшками низка (Вилкс, Вилкс, 1958; Бушуев, Вострецова, 2011; Slagsvold, 2004). Эти данные позволяют сделать предположение о несовместимости рациона относительно специализированных в пищевом отношении видов с рационом видов-генералистов.
Для проверки этого предположения мы поставили перед собой задачу провести сравнение рационов двух видов: синицы московки, Periparus ater, и мухоловки-пеструшки, Ficedula hypoleuca. Эти виды-дуплогнездники нередко обитают в одном и том же локальном лесном сообществе, их смешанное гнездование было зарегистрировано нами ранее в Подмосковье, на территории Звенигородской биологической станции МГУ (Бушуев, Вострецова, 2011). Результаты, полученные нами на двух видах, мы дополнили анализом литературных данных о судьбе птенцов из 377 выводков 15 видов при выкармливании родителями чужих видов (Вилкс, Вилкс, 1958). Сведения о рационах этих видов мы позаимствовали из публикаций других авторов (Милованова, 1956; Поливанова, 1957, 1985; Кадочников, 1960; Иноземцев, 1978; Бардин и др., 1991; Нефедов, 2003, Прокофьева, 2003, 2003а, 2009; Бельский, Бельская, 2009; Барановский, 2011; Ломадзе, Лебедева, 2012; Зацаринный и др., 2014; Sedláček et al., 2007; Belskii, Belskaya, 2013).
МАТЕРИАЛ И МЕТОДИКА
Сбор полевого материала проводили на Звенигородской биологической станции им. С.Н. Скадовского биологического факультета МГУ им. М.В. Ломоносова (55°44′ с.ш., 36°51′ в.д.). Биологическая станция расположена в 70 км к западу от Москвы в древней долине реки Москвы и на прилегающем водоразделе. Территория покрыта смешанным елово-березовым лесом. В точке исследований в верхнем ярусе леса доминируют деревья ели европейской (Picea abies ((L.) Karsten 1881)) и березы повислой (Betula pendula (Roth. 1788)) высотой 25 м. Сопутствующие породы деревьев – липа сердцевидная (Tilia cordata (Mill. 1768)), рябина обыкновенная (Sorbus aucuparia (L. 1753)), в подлеске – бересклет бородавчатый (Euonymus verrucosus (Scop. 1771)), крушина ломкая (Frangula alnus (Mill. 1768)) и лещина обыкновенная (Corylus avellana ((L.) Karsten 1881)). На территории биологической станции расположены площадки и линейные развески искусственных гнездовий, на которых проводят мониторинг видов-дуплогнездников с 1980 г. (Керимов и др., 1994; Гаврилов и др., 1996; Иванкина и др., 2014; Иванкина и др., 2017). Общее число контролируемых дуплянок варьировало в разные годы от 89 до 717 штук (Иванкина и др., 2017). В 2007 г. на территории биостанции было обнаружено совместное гнездование московки и мухоловки-пеструшки. Птенцы московки вылупились раньше, чем мухоловки, после чего обе пары птиц приступили к их кормлению. Яйца мухоловки-пеструшки оказались под птенцами московки, инкубационный режим был нарушен, большая часть эмбрионов погибла на поздней стадии развития, а оба вылупившихся птенца – в течение первых нескольких дней жизни. Совместное выкармливание выводка московки двумя парами родителей не было успешным: все птенцы, несмотря на нормальный обогрев самкой московки, один за другим погибли в возрасте от 4 до 11 дней (Бушуев, Вострецова, 2011). Во избежание вмешательства, мы не проводили контроль за питанием птенцов этого уникального выводка.
Мы изучали рационы птенцов мухоловки-пеструшки и московки из обычных гнезд в 2009–2017 гг. двумя дополняющими друг друга методами – при помощи видеозаписей и путем наложения шейных лигатур (Мальчевский, Кадочников, 1953) в модификации Бардина (Бардин и др., 1991). Подробно особенности этой модификации описаны в статье Ильиной (2011). Видеосъемка – метод практически неинвазивный. Он одинаково хорошо применим при работе с выводками любого возраста, но степень детализации материала существенно меньшая, чем при работе с шейными лигатурами. Применение последних, однако, нарушает нормальный ритм кормления, что не исключает искажения типичной структуры рациона. Помимо этого, мы обнаружили, что в нескольких гнездах родители-московки не отдавали принесенный корм птенцам, если на них в этот момент были наложены лигатуры. К видеокамере они были индифферентны. Данные видеосъемки, несомненно, дают лишь приблизительное представление о числе доставляемых родителями кормовых объектов, так как не всегда можно хорошо рассмотреть принесенные порции. Основная проблема заключается в трудности подсчета мелких объектов и, соответственно, недооценке их количества. Метод шейных лигатур позволяет проанализировать все принесенные объекты, за исключением сильно поврежденных, что случается нечасто. Вместе с тем, этот метод тоже может искажать представление о числе объектов в порции, принесенной родителем: по нашим наблюдениям, мухоловки-пеструшки, доставив порцию корма в гнездо, могут либо разделить ее между несколькими птенцами, либо отдать целиком одному из них. Подобную картину в гнездах мухоловки-пеструшки наблюдали и другие исследователи (Милованова, 1956). Не исключено, что московки тоже делят принесенный корм между птенцами.
Размеры выводков с 2–12-дневными птенцами мухоловки-пеструшки варьировали от 4 до 8 птенцов, а у московки – от 5 до 9. Цифровые видеокамеры Sony DCR-SR80 и Panasonic HC-V750 размещали в 1.5–2 м от гнезда, предварительно приучив к ним птиц при помощи муляжей, устанавливаемых за сутки до съемки. Одновременно с установкой муляжей к дуплянке перед летком крепили присаду из толстой проволоки, на которой птицы ненадолго задерживались перед тем, как влететь внутрь. Это позволяло рассмотреть принесенные ими кормовые объекты. Видеозаписи просматривали на компьютере с помощью программы VLC mediaplayer. На основе видеозаписей мы оценивали интенсивность кормления птенцов, число и размер объектов в приносимых порциях корма. Размеры оценивали в условных единицах путем сравнения с длиной клюва птицы-родителя. Длина клюва мухоловки-пеструшки равна 9.3 мм (SE = 0.81, n = 47), а московки – 9.4 (SE = 0.81, n = 47), т.е. практически одинакова у этих двух видов. Проанализированы 87 ч видеозаписей у 29 гнезд мухоловки-пеструшки и 42 ч видеозаписей у шести гнезд московки, а также данные визуальных наблюдений в течение более 1000 ч за интенсивностью кормления птенцов у 255 гнезд мухоловки-пеструшки. Пробы корма были взяты у птенцов из 17 гнезд мухоловки-пеструшки, пяти гнезд московки и зафиксированы в 70% этиловом спирте. Объекты после идентификации взвешивали на аналитических весах, предварительно обсушив фильтровальной бумагой. Линейные промеры делали по методике Бельского и Бельской (2009). Пауков и насекомых определяли с точностью до отряда, выделяя при этом личинок Чешуекрылых (Lepidoptera) и Жесткокрылых (Coleoptera) в отдельные группы. Имаго жуков, по возможности, определяли еще и до семейства.
Для оценки степени пищевой специализации московки и мухоловки-пеструшки мы сравнивали структуры их рационов, выявленные как по нашим данным, так и по сведениям из публикаций других авторов (Осмоловская, Формозов, 1950; Милованова, 1956; Поливанова, 1957, 1985; Зубцовский, 1978; Иноземцев, 1978; Ломадзе, Лебедева, 2012). Сравнение проводили на уровне отрядов, применяя индекс Бергера-Паркера (d), который отражает долю особей доминантного таксона в рационе и обратный индекс Бергера-Паркера (1/d): d = Nmax/N, где Nmax – число особей наиболее многочисленного таксона, а N – общее число объектов в выборке. Индекс Бергера-Паркера, по сравнению с другими индексами для оценки биоразнообразия, наиболее прост для расчетов и хорошо подходит для случайной выборки, не требуя полной информации о составе сообщества (Шитиков, Розенберг, 2005).
Анализ выживаемости птенцов при выкармливании родителями чужого вида мы провели, взяв за основу результаты экспериментов по перекрестной перекладке яиц между гнездами разных видов птиц (Вилкс, Вилкс, 1958). Из изложенных в статье материалов мы исключили гнезда, которые были разорены, брошены, или в них погибла кладка из-за нарушения инкубации, то есть тех, где причины гибели выводка были иные, чем приносимый родителями корм. Мы анализировали материалы из работы Вилксов только по тем видам, для которых нашли литературные сведения о структуре рационов по массе. Конкретные цифры приведены в разделе “Результаты”. Основное внимание мы уделили тому, какую долю от массы всего рациона составляют гусеницы и пауки вместе взятые, т.е. оптимальный для птенцов корм, а также жуки, т.е. неоптимальный корм (подробнее об характеристиках этих объектов изложено в разделе “Обсуждение”). В связи с тем, что не для всех видовых пар “воспитатель-выкормыш” выборка была достаточной для корректного расчета доли успешно выкормленных выводков, мы поделили их на две категории: 1) сочетание видов “воспитатель-выкормыш” с высокой выживаемостью – успешно выкормлены более половины выводков; 2) сочетание с относительно низкой выживаемостью – выжили не более половины выводков.
Для статистической обработки материала применяли преимущественно непараметрические методы (ссылки в тексте). В случае использования параметрических методов выборка предварительно проходила тест на нормальность распределения при помощи теста Шапиро–Уилка (Shapiro, Wilk, 1965), который является наиболее мощным среди распространенных тестов на нормальность распределения (Razali, Wah, 2011). Для сравнения московки и мухоловки-пеструшки (вид дуплогнездников выступал в качестве категориального фактора) по числу объектов в порции корма и по суммарному размеру порции (зависимая переменная) использовали Общие линейные модели (General linear model, GLM – частный случай Обобщенных линейных моделей (Generalized linear model, GLZ) по терминологии статистического пакета STATISTICA). Это было необходимо для того, чтобы провести сравнение видов с учетом их различий по возрасту птенцов и размеру выводка, которые были использованы в модели в качестве ковариаты. В обеих моделях GLM обе ковариаты были значимыми (p < 0.005). Приведенные в результатах статистики относятся к категориальному фактору (вид птиц). Статистический анализ проводили при помощи программы StatSoft STATISTICA v. 8.0
РЕЗУЛЬТАТЫ
Количественные характеристики корма птенцов
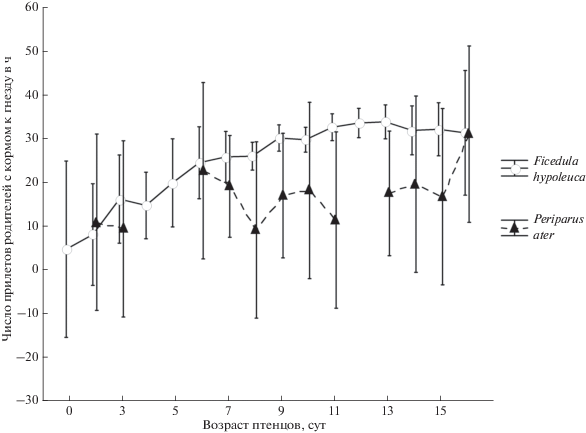
Выводки московки, находившиеся под нашим наблюдением, по размеру были больше, чем выводки мухоловок-пеструшек (соответственно, M1 = 8.63, SD1 = 1.21, n1 = 16 и M2 = 5.75, SD2 = = 0.97, n2 = 254, различия достоверны, U-тест Манна–Уитни: Z = 5.92, p < 0.001), что типично для этих двух видов (Симкин, 1990; Артемьев, 2008; Птушенко, Иноземцев, 1968). Вместе с тем, по данным визуальных наблюдений и видеосъемок, интенсивность кормления птенцов в гнездах мухоловок-пеструшек была выше, чем у московок (U-тест Манна–Уитни: Z = 5.23, p < 0.001), несмотря на сходство в возрасте птенцов (U-тест Манна–Уитни: Z = –0.81, p > 0.05) (рис. 1). При помощи видеорегистраций выявлено, что московки приносили за один визит большее число объектов, чем мухоловки (GLM: F = 67.74, p < < 0.001).
Рис. 1.
Интенсивность кормления птенцов разного возраста в выводках мухоловки-пеструшки (Ficedula hypoleuca) и московки (Periparus ater). Вертикальные отрезки – 95-процентный доверительный интервал.
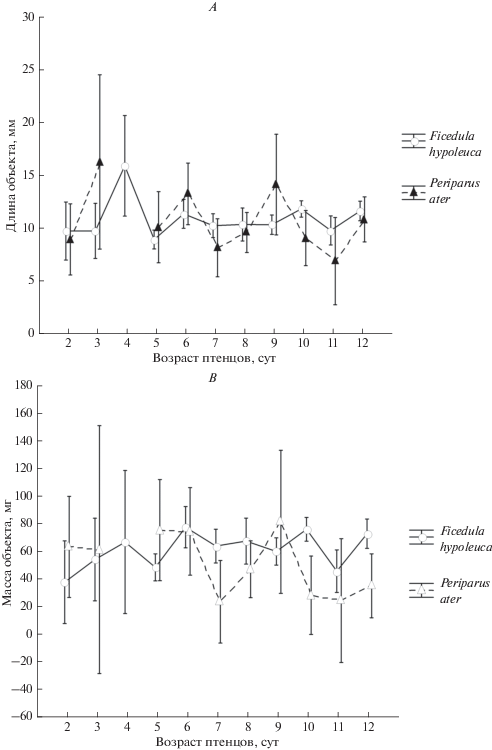
Размерные диапазоны жертв обоих видов практически полностью перекрывались, но в среднем, приносимые московками объекты были немного мельче, чем объекты добычи мухоловок-пеструшек (табл. 1). Тем не менее, вся порция целиком, то есть суммарный размер всех ее компонентов, у московки была больше, чем у мухоловки-пеструшки (GLM: F = 31.42, p < 0.001).
Таблица 1.
Параметры кормовых объектов мухоловки-пеструшки и московки
| Показатели | Мухоловка-пеструшка | Московка | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | M | med | SD | min | max | n | M | med | SD | min | max | |
| Длина объекта, у.е., по данным видеорегистраций | 3536 | 1.44 | 1.50 | 0.64 | 0.25 | 4.0 | 883 | 1.29 | 1.0 | 0.64 | 0.5 | 4.0 |
| Длина объекта, мм, по данным метода шейных лигатур | 570 | 10.60 | 10.45 | 4.17 | 1.4 | 24.2 | 81 | 10.02 | 8.80 | 4.77 | 2.2 | 23.7 |
| Сырая масса объекта, мг | 555 | 63.62 | 56.0 | 47.93 | 2.38 | 385.71 | 81 | 46.56 | 41.7 | 31.41 | 3.7 | 131.2 |
| Число объектов в порции, принесенной родителем (по данным видеосъемки) | 2275 | 1.59 | 1.0 | 0.80 | 1 | 6 | 352 | 2.35 | 2.0 | 1.0 | 1 | 11 |
| Число объектов в порции, скормленной одному птенцу | 214 | 2.63 | 2.0 | 1.79 | 1 | 11 | 41 | 1.98 | 2.0 | 1.27 | 1 | 6 |
Примечание. 1 у.е. (условная единица) равна длине клюва птицы-родителя (подробности – в разделе “Материал и методика”). Средний возраст птенцов (M) при наложении лигатур у мухоловки-пеструшки составлял 8.25 сут. (медиана (Med) – 9 сут., минимальный (Min) и максимальный (Max) возраст – 2 и 12 сут.), у московки – 8.14 сут. (медиана – 8 сут., минимальный и максимальный возраст – 2 и 12 сут.); средний возраст птенцов во время видеосъемки у мухоловки-пеструшки составлял 10.68 сут. (медиана – 11 сут., минимальный и максимальный возраст – 3–14 сут.), у московки – 9.56 сут. (медиана – 8 сут., минимальный и максимальный возраст – 2 и 16 сут.).
Линейные размеры кормовых объектов из проб, полученных методом шейных лигатур, не имели существенных видовых различий (U-тест Манна–Уитни: Z = 1.55, p > 0.05, n1 = 570, n2 = 81) (рис. 2A). В то же время сырая масса одного кормового объекта у мухоловки-пеструшки была выше, чем у московки (U-тест Манна-Уитни: Z = = 3.04, p < 0.01, n1 = 555, n2 = 81) (рис. 2B). Порция корма, получаемая каждым птенцом мухоловки-пеструшки за одно кормление, также весила больше, чем порция птенца московки (U-тест Манна–Уитни: Z = 4.52, p < 0.001, n1 = 555, n2 = 81). Это означает, что московки делили принесенный корм между птенцами более дробно, чем это делали мухоловки-пеструшки.
Качественный состав корма птенцов
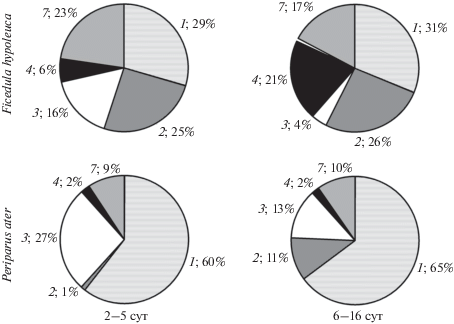
По нашим данным, диета мухоловки-пеструшки более разнообразна, чем диета московки (табл. 2). Вместе с тем, по данным Осмоловской и Формозова (1950), рацион мухоловок-пеструшек в сезон обилия гусениц огневки (Pyralididae) на ЗБС МГУ был довольно однообразен и состоял преимущественно из этих массовых объектов. Мы рассчитали индексы разнообразия (d и 1/d) рационов птенцов мухоловки-пеструшки и московки для разных точек во времени и пространстве, взяв за основу данные, опубликованными другими авторами (табл. 3). Результаты показали, что диета птенцов мухоловки-пеструшки в разных условиях может варьировать сильнее, чем диета птенцов московки (коэффициенты вариации индекса 1/d составили соответственно 44.54 и 9.37). Оба метода – видеорегистрация и наложение шейных лигатур – показали сходные результаты при выявлении доминирующих групп кормовых объектов. У мухоловки-пеструшки наиболее многочисленными были “летающие насекомые” (Diptera, Hymenoptera, имаго Lepidoptera), жуки (Coleoptera), а также “гусеницы” (гусеницы чешуекрылых, Lepidoptera, и ложногусеницы пилильщиков, Hymenoptera: Symphyta); у московки доминировали “гусеницы” и пауки (Araneae) (табл. 2, рис. 3). По данным видеосъемки, “гусеницы” и пауки в корме московок были представлены в большем количестве, чем у мухоловок-пеструшек, как в выводках с младшими птенцами, так и со старшими. По мере роста птенцов, в добыче мухоловок-пеструшек происходило существенное снижение доли пауков (критерий хи-квадрат χ2 = 77.4, p < 0.001) и такое же существенное увеличение доли жесткокрылых (критерий хи-квадрат χ2 = 34.8, p < 0.001), в сходных количествах представленных личинками и имаго (рис. 3). В корме московок пауков тоже становилось меньше, но Жесткокрылые продолжали присутствовать лишь в ничтожном количестве, причем в основном в форме личинок: из 17 представителей этого отряда было всего два экземпляра имаго. К сожалению, определить по видеозаписи до семейства удалось меньшую часть объектов. В корме мухоловок-пеструшек среди имаго Жесткокрылых обоими методами выявлены представители семейств Tenebrionidae, Curculionidae, Elateridae, Carabidae, Cerambycidae, Cantharidae, Chrysomelidae. Помимо этого, по видеонаблюдениям дополнительно обнаружены Scarabeidae, Staphylinidae, Coccinellidae, а по лигатурам – Curculionidae: Scolytinae.
Таблица 2.
Рационы птенцов мухоловки-пеструшки и московки по результатам наложения шейных лигатур
| Пищевой объект | Количество в пробах корма, шт. | |
|---|---|---|
| Мухоловка-пеструшка | Московка | |
| Araneae | 82 | 38 |
| Coleoptera (larvae) | 18 | |
| Coleoptera (imago) | 61 | |
| Dermaptera | 1 | |
| Diptera | 191 | 8 |
| Ephemeroptera | 3 | |
| Gastropoda | 8 | |
| Heteroptera | 19 | |
| Homoptera | 5 | |
| Hymenoptera (larvae) | 11 | |
| Hymenoptera (imago) | 27 | |
| Lepidoptera (larvae) | 103 | 31 |
| Lepidoptera (imago) | 28 | 3 |
| Myriapoda | 5 | |
| Trichoptera | 1 | |
| Всего | 563 | 80 |
Таблица 3.
Показатели разнообразия рационов птенцов мухоловки-пеструшки и московки
| Вид | Индекс Бергера-Паркера, d | Обратный индекс Бергера-Паркера, 1/d | Доминирующие объекты (1) и объекты-субдоминанты (2) | Место исследований | Источник информации о рационе |
|---|---|---|---|---|---|
| Мухоловка- пеструшка | 0.33 | 3.01 | Diptera1, Coleoptera2, Lepidoptera (larvae)2 | Московская обл., ЗБС | Наши данные |
| 0.78 | 1.27 | Lepidoptera (larvae)1 | Московская обл., ЗБС | Осмоловская, Формозов, 1950 | |
| 0.19 | 5.38 | Coleoptera1, Diptera2, Lepidoptera (larvae)2 | Московская обл. | Иноземцев, 1978 | |
| 0.44 | 2.27 | Diptera1, Coleoptera2 | Московская обл. | Иноземцев, 1978 | |
| 0.25 | 4.03 | Diptera1, Coleoptera2 | Московская обл. | Иноземцев, 1978 | |
| 0.43 | 2.32 | Lepidoptera1 | Ильменский заповедник | Зубцовский, 1978 | |
| 0.20 | 4.89 | Lepidoptera (larvae)1, Diptera2, Araneae2 | Приокско-Террасный заповедник | Милованова, 1956 | |
| 0.47 | 2.11 | Araneae1, Diptera2 | Дарвинский заповедник | Поливанова, 1957 | |
| Московка | 0.48 | 2.11 | Araneae1, Lepidoptera (larvae)2 | Московская обл., ЗБС | Наши данные |
| 0.42 | 2.40 | Araneae1, Lepidoptera (larvae)2 | Адыгея | Ломадзе, Лебедева, 2012 | |
| 0.51 | 1.95 | Lepidoptera (larvae)1 | Тебердинский заповедник | Поливанова, 1985 | |
| 0.43 | 2.31 | Araneae1, Diptera2, Lepidoptera (larvae)2 | Тебердинский заповедник | Поливанова, 1985 |
Рис. 3.
Рационы птенцов мухоловки-пеструшки и московки младшего и старшего возраста по данным видеозаписей. Группы жертв: 1 – “гусеницы”; 2 – активно летающие насекомые; 3 – пауки; 4 – жуки; 5 – клопы, многоножки; 7 – не определены.
Выживаемость птенцов при перекрестном выкармливании приемными родителями чужих видов не всегда имела симметричный характер (приложение). Отмечено, что разные виды корма по-разному влияли на судьбу выводков. Мы выявили, что успешность выкармливания птенцов была относительно высокой в тех случаях, когда доли жуков в видовых рационах воспитателей и приемных птенцов были сходными. В тех экспериментах, когда рацион воспитателей был более насыщен жуками, чем рацион вида-выкормыша, выживало не больше половины выводков (U-тест Манна–Уитни: Z = –2.46, p = 0.013, n1 = 21, n2 = 9). В то же время, относительное сходство видовых рационов воспитателей и выкормышей по содержанию гусениц не оказывало существенного влияния на попадание в категорию высокой или низкой успешности (U-тест Манна–Уитни: Z = 0.20, p = 0.83, n1 = 21, n2 = 9). Например, такие виды, как белая трясогузка (Motacilla alba (L. 1758)) и сорокопут-жулан (Lanius collurio (L. 1758)), в рационе которых содержится меньше гусениц и пауков, чем в рационе их воспитателей, мухоловок-пеструшек, не получали преимуществ от обогащения своей диеты, а наоборот, проигрывали (приложение). Обращает на себя внимание факт, что птенцы мухоловки-пеструшки успешно выживали в чужих гнездах, в то время как в качестве кормильца этот вид был относительно менее успешен. Наименее успешно в гнездах мухоловок-пеструшек выживали птенцы, в видовом рационе которых отсутствовали жуки семейства Cantharidae, причем выживаемость не была связана с потенциальным дефицитом оптимальных компонентов в корме. Например, доля успешных выводков синиц разных видов (семейство Paridae), чей рацион существенно богаче гусеницами и пауками, чем рацион мухоловок-пеструшек, равнялась 0.33. Для сравнения, видовые рационы ряда видов (белой трясогузки (Motacilla alba), сорокопута-жулана (Lanius collurio), пеночки-теньковки (Philloscopus collybita (Vieillot 1817)), пеночки-трещотки (Ph. sibilatrix (Bechstein 1793)), лесного конька (Anthus trivialis (L. 1758)), садовой славки (Sylvia borin (Boddaert 1783))) содержат упомянутых объектов не больше, чем рацион мухоловки-пеструшки, то есть дефицита в этом виде корма у приемных птенцов нет. Вместе с тем, выживаемость этих приемных птенцов составила 0.29, то есть была практически такой же, как у синиц (χ2 = 0.16, различия не значимы). Птенцы видов, которым, как и мухоловке-пеструшке, свойственно потребление Cantharidae (Ph. phoenicurus (L. 1758), Saxicola rubetra (L. 1758), Erithacus rubecula), выживали успешно (приложение).
ПРИЛОЖЕНИЕ
Результаты выкармливания птенцов родителями другого вида
| Вид (по: Вилкс, Вилкс, 1958) | Число выводков (по: Вилкс, Вилкс, 1958) | Весовая доля в рационе вида* | Наличие (1) или отсутствие (0) семейства Cantharidae в рационе вида** | ||||||
|---|---|---|---|---|---|---|---|---|---|
| выкормыша | воспитателя | ||||||||
| выкормыш | воспитатель | выживших | погибших | гусеницы и пауки | жуки | гусеницы и пауки | жуки | выкормыша | воспитателя |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ficedula hypoleuca | Parus major | 23 | 1 | 0.45 | 0.07 | 0.67 | 0.06 | 1 | 0 |
| Ficedula hypoleuca | Periparus ater | 2 | 0 | 0.45 | 0.07 | 0.73 | 0.04 | 1 | 0 |
| Ficedula hypoleuca | Phoenicurus phoenicurus | 43 | 1 | 0.45 | 0.07 | 0.65 | 0.08 | 1 | 1 |
| Ficedula hypoleuca | Saxicola rubetra | 25 | 0 | 0.45 | 0.07 | 0.40 | 0.12 | 1 | 1 |
| Ficedula hypoleuca | Motacilla alba | 3 | 0 | 0.45 | 0.07 | 0.11 | 0.01 | 1 | 0 |
| Ficedula hypoleuca | Fringilla coelebs | 1 | 0 | 0.45 | 0.07 | 0.54 | 0.10 | 1 | 1 |
| Ficedula hypoleuca | Phylloscopus sibilatrix | 11 | 0 | 0.45 | 0.07 | 0.45 | 0.00 | 1 | 0 |
| Ficedula hypoleuca | Phylloscopus collybita | 1 | 0 | 0.45 | 0.07 | 0.59 | 0.00 | 1 | 0 |
| Ficedula hypoleuca | Prunella modularis | 1 | 0 | 0.45 | 0.07 | 0.75 | 0.03 | 1 | 0 |
| Ficedula hypoleuca | Sylvia borin | 1 | 0 | 0.45 | 0.07 | 0.47 | 0.03 | 1 | 0 |
| Ficedula hypoleuca | Lanius collurio | 2 | 1 | 0.45 | 0.07 | 0.07 | 0.07 | 1 | 0 |
| Parus major | Ficedula hypoleuca | 18 | 50 | 0.67 | 0.06 | 0.45 | 0.07 | 0 | 1 |
| PARIDAE | PARIDAE | 7 | 0 | 0.73 | 0.04 | 0.73 | 0.04 | 0 | 0 |
| Parus major | Motacilla alba | 2 | 0 | 0.67 | 0.07 | 0.11 | 0.01 | 0 | 0 |
| Parus major | Ficedula hypoleuca | 18 | 50 | 0.67 | 0.06 | 0.45 | 0.07 | 0 | 1 |
| Periparus ater | Ficedula hypoleuca | 2 | 0 | 0.73 | 0.04 | 0.45 | 0.07 | 0 | 1 |
| Cyanistes caeruleus | Ficedula hypoleuca | 1 | 1 | 1 | 0 | 0.45 | 0.07 | 0 | 1 |
| Phoenicurus phoenicurus | Ficedula hypoleuca | 40 | 6 | 0.65 | 0.08 | 0.45 | 0.07 | 1 | 1 |
| Erithacus rubecula | Ficedula hypoleuca | 2 | 0 | 0.66 | 0.02 | 0.45 | 0.07 | 1 | 1 |
| Sitta europaea | Parus major | 2 | 0 | 0.64 | 0.25 | 0.67 | 0.06 | 1 | 0 |
| Motacilla alba | Parus major | 1 | 0 | 0.11 | 0.01 | 0.67 | 0.06 | 0 | 0 |
| Motacilla alba | Ficedula hypoleuca | 3 | 4 | 0.11 | 0.01 | 0.45 | 0.07 | 0 | 1 |
| Sylvia borin | Ficedula hypoleuca | 1 | 0 | 0.47 | 0.03 | 0.45 | 0.07 | 0 | 1 |
| Fringilla coelebs | Ficedula hypoleuca | 0 | 2 | 0.54 | 0.10 | 0.45 | 0.07 | 1 | 1 |
| Saxicola rubetra | Ficedula hypoleuca | 17 | 4 | 0.40 | 0.12 | 0.45 | 0.07 | 1 | 1 |
| Saxicola rubetra | Lanius collurio | 1 | 1 | 0.40 | 0.12 | 0.07 | 0.07 | 1 | 0 |
| Phylloscopus sibilatrix | Ficedula hypoleuca | 2 | 11 | 0.45 | 0.00 | 0.45 | 0.07 | 0 | 1 |
| Phylloscopus collybita | Ficedula hypoleuca | 1 | 1 | 0.59 | 0.00 | 0.45 | 0.07 | 0 | 1 |
| Lanius collurio | Ficedula hypoleuca | 0 | 3 | 0.07 | 0.07 | 0.45 | 0.07 | 0 | 1 |
| Lanius collurio | Saxicola rubetra | 1 | 1 | 0.07 | 0.07 | 0.40 | 0.12 | 0 | 1 |
| Sturnus vulgaris | Turdus philomelos | 1 | 0 | 0.40 | 0.13 | 0.51 | 0.03 | 1 | 1 |
Примечания к приложению. * Сведения о рационах взяты из следующих источников: Мухоловка-пеструшка (Ficedula hypoleuca) – Поливанова, 1957, 1985; Бельский, Бельская, 2009; Belskii, Belskaya, 2013; наши данные; Большая синица (Parus major) – Поливанова, 1985; Зацаринный и др., 2014; Московка (Periparus ater) – Поливанова, 1985; наши данные; Лазоревка (Cyanistes caeruleus), обыкновенная горихвостка (Phoenicurus phoenicurus), пеночка-теньковка (Phylloscopus collybita), лесная завирушка (Prunella modularis), зарянка (Erithacus rubecula), поползень (Sitta europaea) – Поливанова, 1985; Белая трясогузка (Motacilla alba) – Поливанова, 1985; Барановский, 2011; Зяблик (Fringilla coelebs) – Поливанова, 1957, 1985; Пеночка-трещотка (Phylloscopus sibilatrix) – Бардин и др., 1991; Садовая славка (Sylvia borin), скворец (Sturnus vulgaris), певчий дрозд (Turdus philomelos) – Поливанова, 1957; Луговой чекан (Saxicola rubetra), сорокопут-жулан (Lanius collurio) – Барановский, 2011; ** Источники о дополнительных сведениях о наличии или отсутствии жуков семейства Cantharidae в рационах птиц: Милованова, 1956; Кадочников, 1960; Иноземцев, 1978; Нефедов, 2003, Прокофьева, 2002, 2003, 2003а, 2009; Ломадзе, Лебедева, 2012; Atiénzar et al., 2013; Sedláček et al., 2007.
ОБСУЖДЕНИЕ
Пищевая ценность некоторых представителей беспозвоночных, входящих в рацион птенцов
Общеизвестно, что в первые дни жизни птенцов родители приносят им кормовые объекты небольшого размера с относительно мягкими покровами. По мере роста птенцов увеличивается доля объектов с грубыми покровами и более крупных размеров. По результатам исследований рационов разных видов Воробьинообразных (Passeriformes) выявлено, что предпочитаемым стартовым кормом для многих из них служат мелкие гусеницы и пауки (Милованова, 1956; Поливанова, 1957; Иноземцев, 1978; Samplonius et al., 2016). Выявлено, что чешуекрылые – основной источник каротиноидов, так как содержат их в себе приблизительно в два раза больше, чем другие насекомые (Eeva et al., 2010). Каротиноиды служат не только для формирования окраски, но и являются антиоксидантами и иммуностимуляторами, выполняя важную роль в поддержании здоровья организма (Brush, 1990; Navara et al., 2006; Badyaev, 2007; Fitze et al., 2007). Особенно важно поступление этих пигментов во время формирования оперения, т.е. во время роста птенцов, линьки (Ильина и др., 2013; Senar et al., 2003; Galván et al., 2009; Griggio et al., 2009; Ilyina et al., 2013). Отмечено, что большая пищевая ценность пауков заключается в содержании в них большого количества таурина. Эта сульфокислота важна для нормального развития и функционирования центральной нервной системы, формирования сетчатки глаз, принимает участие в обмене липидов, способствует эмульгированию жиров в кишечнике. Таурин особенно важен для растущего организма (Arnold et al., 2007; Pagani-Nunez et al., 2011). Оба ценных компонента, гусеницы и пауки, в большей мере представлены в рационе специализированного вида, московки, по сравнению с рационом мухоловки-пеструшки, вида-генералиста. В корме птенцов мухоловок-пеструшек, в отличие от корма московок, присутствовали объекты с резким неприятным вкусом, такие, как многоножки, клопы и божьи коровки (Coccinellidae). Обнаружены также жесткокрылые из семейств, представители которых содержат в себе токсины. Например, кантаридин, по данным ряда исследований (Hemp, Dettner, 2001; Nikbakhtzadeh, Tirgari, 2002), обнаружен у различных видов мягкотелок (Cantharidae), малашек (Melyridae). Последних мы не отмечали, но об их наличии в рационе птенцов мухоловки-пеструшки, наряду с представителями Cantharidae, свидетельствуют несколько опубликованных работ (Поливанова, 1957; Иноземцев, 1978).
Эффект от получения птенцами рационов чужих видов
В настоящее время выполнено много исследований по видоспецифическим особенностям рационов птиц, но об усвояемости и пищевой ценности кормовых объектов известно не так много. В то же самое время накопились косвенные данные о негативном влиянии рационов одних видов птиц на птенцов других. Подобные сведения были получены в результате наблюдений за совместным гнездованием видов-дуплогнездников, подобные тому, который наблюдали мы (Бушуев, Вострецова, 2011), а также в результате многочисленных экспериментов по перекладке яиц и птенцов в гнезда других видов (Вилкс, Вилкс, 1958; Slagsvold, 2004). Проведенный нами анализ выживаемости выводков в экспериментах Вилксов (Вилкс, Вилкс, 1958) показал, что негативное влияние на птенцов могла оказывать не столько нехватка оптимальных кормовых объектов, т.е. гусениц и пауков, сколько присутствие в их рационе несвойственной виду “вредной” пищи, в рассматриваемом нами случае – большой доли жуков. Существуют данные о том, что причиной гибели птенцов могут быть излишне крупные кормовые объекты, которыми птенцы, как правило, самые младшие, давятся (Slagsvold, Wiebe, 2007). Наши материалы по питанию мухоловки-пеструшки и московки не исключают наличия таких случаев, так как несмотря на полное перекрывание размерных диапазонов кормовых объектов, относительно крупная добыча у мухоловок встречается чаще, чем у московок. Вместе с тем мы сомневаемся, что большинство пересаженных в чужие гнезда птенцов погибали только из-за механических свойств чужого рациона. По данным Вилксов (Вилкс, Вилкс, 1958), гибель приемных птенцов в гнездах мухоловки-пеструшки чаще всего происходила постепенно, в возрасте, когда они начинали оперяться. Разными авторами было отмечено, что если в первые дни после вылупления птенцов родители-мухоловки кормят их преимущественно мелкими гусеницами и пауками, то позже расширяют спектр своей добычи, в том числе и за счет жуков (Милованова, 1956; Поливанова, 1957; Samplonius et al., 2016). В такой ситуации возрастает вероятность получения птенцами насекомых, содержащих токсические вещества.
Расширение трофической ниши у мухоловки-пеструшки
Сроки размножения мухоловки-пеструшки в меньшей степени, чем сроки размножения синиц, приурочены к сезонному пику биомассы гусениц бабочек и ложногусениц пилильщиков (Ильина, 2009; Иванкина и др., 2014; Visser et al., 2004). При вспышке численности этих объектов мухоловки-пеструшки включают их в свой рацион в достаточно больших количествах (Осмоловская, Формозов, 1950; Зубцовский, 1978), но при возникновении дефицита, как было отмечено нами выше, легко переходят на другой корм. Способность птенцов мухоловки-пеструшки усваивать пищу, которая негативно, вплоть до гибели, влияет на птенцов видов-конкурентов, свидетельствует в пользу адаптаций на физиологическом или более глубоком уровне. Обращает на себя внимание факт, что к корму, содержащему жуков семейства Cantharidae, толерантны обыкновенная горихвостка, зарянка и луговой чекан, систематически близкие к мухоловкам-пеструшкам (Jarvis et al., 2014). Мы, к сожалению, не имеем информации о количественном содержании токсинов, в частности, кантаридина, в насекомых именно тех видов семейства Cantharidae и ряда других, которые входят в состав анализируемых нами рационов птиц. Наше предположение о том, что некоторые виды птиц обладают повышенной резистентностью к кантаридину, что в свою очередь позволяет им расширить свою трофическую нишу, основано лишь на разном эффекте от рационов с наличием или отсутствием в них представителей семейства Cantharidae, и поэтому остается лишь гипотезой, которая требует экспериментальной проверки.
БЛАГОДАРНОСТИ
В сборе полевого материала участвовали студенты биологического факультета МГУ имени М.В. Ломоносова, проходившие летнюю практику на Звенигородской биостанции: Рубцова С., Агафонова Е., Королева Е., Назина Е., Нечаев С., Побезинский Л., Прищепова А., Романова Л., Сибиряк М., Шорина Е., Юсс А., Абызова Г., Большаков Ф., Бурлак Н., Веденин А., Лавров А., Щербакова Т., Вергунова А., Даниленко Н., Ефремова И., Разумкина Е., Филатов М., Цымбалова А., Александрова Е., Замятнина К., Комкова А., Маргарит А., Петрусенко Ю., Токарева В., Целлариус Ф. Данные о размерах клювов московок любезно предоставил В.В. Гаврилов. Неоценимую помощь в поиске гнезд оказали Е.В. Иванкина и А.Б. Керимов. Большое им всем за это спасибо! Авторы также благодарят анонимного рецензента за его весомый вклад в работу над рукописью.
Оценка кормовой базы птиц-дуплогнездников осуществлена при финансовой поддержке РФФИ (09-04-01690, 13-04-01309 и 18-04-00536), а мониторинг популяций птиц-дуплогнездников – при финансовой поддержке РНФ (14-50-00029).
Список литературы
Артемьев А.В., 2008. Популяционная экология мухоловки-пеструшки в северной части ареала. М.: Наука. 267 с.
Барановский А.В., 2011. Питание птиц луговых угодий в окрестностях города Рязани // Вестник Рязанского государственного агротехнологического университета им. П.А. Костычева. № 4. С. 3–7.
Бардин А.В., Ильина Т.А., Литвинова Е.О., Смирнова Т.В., 1991. Питание гнездовых птенцов веснички (Phylloscopus trochilus) и трещотки (Ph. sibilatrix) на Куршской косе // Эколого-популяционные исследования у птиц. Труды Зоологического института АН СССР. Т. 231. С. 3–25.
Бельский Е.А., Бельская Е.А., 2009. Структура рациона птенцов мухоловки-пеструшки Ficedula hypoleuca Pall. в условиях промышленного загрязнения // Экология. № 5. С. 363–371.
Бигон М., Харпер Дж., Таунсенд К., 1989. Экология. Особи, популяции и сообщества: в 2-х т. Т. 2. М.: Мир. 477 с.
Бурский О.В., Конторщиков В.В., Батова О.Н., 2004. Стереотипы кормового поведения пеночек веснички (Phylloscopus trochilus) и теньковки (P. сollybita) // Зоологический журнал. Т. 83. № 7. С. 839–850.
Бушуев A.B., Вострецова E.B., 2011. Совместное гнездование московки и мухоловки-пеструшки // Орнитология. Вып. 36. М.: Издательство Московского университета. С. 226–229.
Вилкс К.А., Вилкс Е.К., 1958. Результаты опытов по пересаживанию яиц и птенцов в гнезда чужих видов (Предварительное сообщение) // Привлечение полезных птиц-дуплогнездников в лесах Латвийской ССР. Рига. С. 167–176.
Гаврилов В.М., Керимов А.Б., Александров Л.И., Голубева Т.Б., Иванкина Е.В., Ильина Т.А. Шишкин В.С., 1996. Энергетика, морфофизиологическая разнокачественность особей и структура популяций у птиц. 2.Энергетика, морфофизиологическая разнокачественность особей и структура популяций у мухоловки-пеструшки // Орнитология. Вып. 27. С. 74–97.
Зацаринный И.В., Косякова А.Ю., Ананьева С.И., Марочкина Е.А., Чельцов Н.В., Тимошина Ю.А., 2014. Состав корма птенцов большой синицы Parus major в лесных экосистемах северо-запада Кольского полуострова // Русский орнитологический журнал. Т. 23. № 1001. С. 1525–1530.
Зубцовский Н.Е., 1978. Структура населения птиц лесных биоценозов Ильменского заповедника и определяющие ее факторы. Дис. … канд. биол. наук. Свердловск. 194 с.
Иванкина Е.В., Ильина Т.А., Гриньков В.Г., Бушуев А.В., Керимов А.Б., 2014. Многолетние данные по популяционной динамике и успеху размножения мухоловок-пеструшек в Подмосковье // Птицы-дуплогнездники как модельные объекты в решении проблем популяционной экологии и эволюции. Материалы междунар. конференции. М.: Товарищество научных изданий КМК. С. 121–124.
Иванкина Е.В., Керимов А.Б., Ильина Т.А., Бушуев А.В., Гриньков В.Г., 2017. Многолетняя динамика численности и показатели репродуктивного успеха подмосковных популяций большой синицы (Parus major) и мухоловки-пеструшки (Ficedula hypoleuca) // Динамика численности птиц в наземных ландшафтах. Материалы Всерос. науч. Конференция, Звенигородская биологическая станция МГУ, 17–21 марта 2017. М.: Товарищество научных изданий КМК. С. 207–210.
Ильина Т.А., 2009. Изучение трофических связей насекомоядных птиц: некоторые итоги, актуальные вопросы и перспективы // Экология, эволюция и систематика животных. Материалы науч.-практ. конференции. Рязань, 17-19 ноября 2009 г. Рязань: Голос губернии. С. 216.
Ильина Т.А., 2011. Вариации рациона гнездовых птенцов мухоловки-пеструшки (Ficedula hypoleuca) на Звенигородской биостанции МГУ // Труды Звенигородской биологической станции МГУ. Т. 5. М.: Издательство Московского университета. С. 226–231.
Ильина Т.А, Керимов А.Б., Загубиженко М.В., Максимов Г.В., 2013. Сезонная динамика биомассы листогрызущих насекомых и ее влияние на содержание каротиноидов в перьях птенцов большой синицы // Экология. № 6. С. 454–454.
Иноземцев А.А., 1978. Роль насекомоядных птиц в лесных биоценозах. Л.: Издательство Ленинградского университета. 263 с.
Кадочников Н.П., 1960. Материалы по питанию гнездовых птенцов насекомоядных птиц Савальского лесничества Воронежской области и оценка их с точки зрения лесохозяйственного значения птиц в гнездовой период // Труды Всесоюзного института защиты растений. Т. 15. С. 225–316.
Керимов А.Б., Иванкина Е.В., Шишкин В.С., 1994. Неустойчивый половой диморфизм и параметры размножения мухоловки-пеструшки // Орнитология. Вып. 26. С. 13–27.
Конторщиков В.В., 2001. Взаимосвязь кормового поведения, морфологии и выбора местообитаний у пеночек теньковки, веснички и трещотки // Орнитология. Вып. 29. М.: Издательство Московского университета. С. 112–124.
Ломадзе Н.Х., Лебедева Н.В., 2012. Биология московки (Parus ater L.) на северо-западном Кавказе // Социально-гуманитарные и экологические проблемы развития современной Адыгеи: сборник научных статей. Отв. ред. акад. Матишов Г.Г., Хунагов Р.Д.. Ростов-на-Дону: Издательство Южного научного центра Российской академии наук. С. 481–494.
Мальчевский А.С., Кадочников Н.П., 1953. Методика прижизненного изучения питания гнездовых птенцов насекомоядных птиц // Зоологический журнал. Т. 32. № 2. С. 277–282.
Мальчевский А.С., Пукинский Ю.Б., 1983. Птицы Ленинградской области и сопредельных территорий. Т. 2. Л.: Издательство Ленинградского университета. 504 с.
Милованова Г.А., 1956. Материалы по питанию мухоловки-пеструшки и большой синицы // Пути и методы использования птиц в борьбе с вредными насекомыми. М.: Министерство сельского хозяйства СССР. С. 21–37.
Нефедов Н.А., 2003. Некоторые особенности питания птенцов мухоловки-пеструшки и горихвостки-лысушки на юге Свердловской области // Проблемы глобальной и региональной экологии: Материалы конф. молодых ученых, 31 марта–4 апреля 2003 г. / Институт экологии растений и животных Уральского отделения РАН. Екатеринбург: Академкнига. С. 169–170.
Одум Ю., 1975. Основы экологии. М.: Мир. 740 с.
Одум Ю., 1986. Экология: В 2-х т. Т. 2. М.: Мир. 376 с.
Осмоловская В.И., Формозов А.Н., 1950. Очерки экологии некоторых полезных птиц леса // Птицы и вредители леса. Серия “Среди природы”. Вып. 19. М.: Издательство Московского общества испытателей природы. С. 34–142.
Пианка Э., 1981. Эволюционная экология. М.: Мир. 400 с.
Поливанова Н.Н., 1957. Питание птенцов некоторых видов полезных насекомоядных птиц в Дарвинском заповеднике // Труды Дарвинского заповедника. Т. 4. № 15. С. 7–244.
Поливанова Н.Н., 1985. Питание птенцов лесных птиц в Тебердинском заповеднике // Птицы Северо-Западного Кавказа. М.: Центральная научно-исследовательская лаборатория охотничьего хозяйства и заповедников РФ. С. 101–124.
Прокофьева И.В., 2002. Проявления индивидуальных особенностей питания среди воробьиных птиц // Русский орнитологический журнал. Т. 11. № 204. С. 1066–1072.
Прокофьева И.В., 2003. О поведении и питании сорокопутов-жуланов Lanius collurio в гнездовое время и после него // Русский орнитологический журнал. Т. 12. № 217. С. 343–351.
Прокофьева И.В., 2003а. Об особенностях питания лесных коньков Anthus trivialis разного возраста // Русский орнитологический журнал. Т. 12. № 247. С. 1430–1437.
Прокофьева И.В., 2009. Мягкотелки Cantharidae в пище воробьиных птиц и стрижей // Русский орнитологический журнал. Т. 18. № 461. С. 151–153.
Птушенко Е.С., Иноземцев А.А., 1968. Биология и хозяйственное значение птиц Московской области и сопредельных территорий. М.: Издательство Московского университета. 461 с.
Симкин Г.Н., 1990. Певчие птицы. М.: Лесная промышленность. 399 с.
Шитиков В.К., Розенберг Г.С., 2005. Оценка биоразнообразия: попытка формального обобщения // Структурный анализ экологических систем. Количественные методы экологии и гидробиологии. Сборник научных трудов, посвященный памяти А.И. Баканова. Отв. ред. чл.-корр. РАН Розенберг Г.С. Тольятти: Самарский научный центр РАН. С. 91–129.
Abrams P.A., 2012. The eco-evolutionary responses of a generalist consumer to resource competition // Evolution. V. 66. № 10. P. 3130–3143.
Arnold K.E., Ramsay S.L., Donaldson C., Adam A., 2007. Parental prey selection affects risk-taking behaviour and spatial learning in avian offspring // Proceedings of the Royal Society of London B: Biological Sciences. V. 274. № 1625. P. 2563–2569.
Atiénzar F., Belda E.J., Barba E., 2013. Coexistence of Mediterranean tits: a multidimensional approach // Ecoscience. V. 20. № 1. P. 40–47.
Badyaev A.V., 2007. Evolvability and robustness in color displays: bridging the gap between theory and data // Evolutionary Biology. V. 34. № 1–2. P. 61–71.
Barnagaud J.Y., Devictor V., Jiguet, F., Archaux F., 2011. When species become generalists: on-going large-scale changes in bird habitat specialization // Global Ecology and Biogeography. V. 20. № 4. P. 630–640.
Belskii E., Belskaya E., 2013. Diet composition as a cause of different contaminant exposure in two sympatric passerines in the Middle Urals, Russia // Ecotoxicology and Environmental Safety. V. 97. P. 67–72.
Brandl R., Kristin A., Leisler B., 1994. Dietary niche breadth in a local community of passerine birds: an analysis using phylogenetic contrasts // Oecologia. V. 98. № 1. P. 109–116.
Brush A.H., 1990. Metabolism of carotenoid pigments in birds // Federation of American societies for experimental biology journal. V. 4. № 12. P. 2969–2977.
Bures S., 1995. Comparison of diet in collared flycatcher (Ficedula albicollis) and pied flycatcher (Ficedula hypoleuca) nestlings in a hybrid zone // Folia zoologica. V. 44. P. 247–253.
Burin G., Kissling W.D., Guimarães Jr. P.R., Şekercioğlu Ç.H., Quental T.B., 2016. Omnivory in birds is a macroevolutionary sink // Nature communications. V. 7. № 11 250. P. 1–10.
Clavel J., Julliard R., Devictor V., 2011. Worldwide decline of specialist species: toward a global functional homogenization? // Frontiers in Ecology and the Environment. V. 9. № 4. P. 222–228.
Colles A., Liow L.H., Prinzing A., 2009. Are specialists at risk under environmental change? Neoecological, paleoecological and phylogenetic approaches // Ecology Letters. № 12. V. 8. P. 849–863.
Dapporto L., Dennis R.L.H., 2013. The generalist–specialist continuum: testing predictions for distribution and trends in British butterflies // Biological Conservation. V. 157. P. 229–236.
De León L.F., Podos J., Gardezi T., Herrel A., Hendry A.P., 2014. Darwin’s finches and their diet niches: the sympatric coexistence of imperfect generalists // Journal of evolutionary biology. V. 27. №. 6. P. 1093–1104.
Eeva T., Helle S., Salminen J.-P., Hakkarainen H., 2010. Carotenoid composition of invertebrates consumed by two insectivorous bird species // Journal of Chemical Ecology. V. 36. № 6. P. 608–613.
Fitze P.S., Tschirren B., Gasparini J., Richner H., 2007. Carotenoid-based plumage colors and immune function: is there a trade-off for rare carotenoids? // American Naturalist. V. 169. Suppl. 1. P. 137–144.
Galván I., Díaz L., Sanz J.J., 2009. Relationships between territory quality and carotenoid-based plumage colour, cell-mediated immune response, and body mass in Great Tit Parus major nestlings // Acta Ornithologica. V. 44. № 2. P. 139–150.
Griggio M., Morosinotto C., Pilastro A., 2009. Nestlings’ carotenoid feather ornament affects parental allocation strategy and reduces maternal survival // Journal of Evolutionary Biology. V. 22. № 10. P. 2077–2085.
Hemp C., Dettner K., 2001. Compilation of canthariphilous insects // Beiträge zur Entomologie. V. 51. № 1. P. 231–245.
Ilyina T.A., Kerimov A.B., Zagubizhenko M.V., Maksimov G.V., 2013. Seasonal dynamics of leaf-eating insects biomass and its influence on carotenoid content in feathers of Great Tit nestlings // Russian journal of ecology. V. 44. № 6. P. 507–514.
Jarvis E.D., Mirarab S., Aberer A.J., Li B., Houde P., Li C. et al., 2014. Whole-genome analyses resolve early branches in the tree of life of modern birds // Science. V. 346. № 6215. P. 1320–1331.
Julliard R., Jiguet F., Couvet D., 2004. Common birds facing global changes: what makes a species at risk? // Global Change Biology. V. 10. № 1. P. 148–154.
Julliard R., Clavel J., Devictor V., Jiguet F., Couvet D., 2006. Spatial segregation of specialists and generalists in bird communities // Ecology letters. V. 9. № 11. P. 1237–1244.
Kitahara M., Sei K., Fujii K., 2000. Patterns in the structure of grassland butterfly communities along a gradient of human disturbance: further analysis based on the generalist/specialist concept // Population Ecology. V. 42. № 2. P. 135–144.
Korňan M., Adamík P., 2007. Foraging guild structure within a primaeval mixed forest bird assemblage: a comparison of two concepts // Community Ecology. V. 8. № 2. P. 133–149.
Lack D.L., 1971. Ecological isolation in birds. Oxford: Blackwell Scientific Publications. 416 p.
MacArtur R.H., 1972. Geographical Ecology: Patterns in the Distribution of Species. N.Y.: Harper and Row. 296 p.
Maurer B.A., 1984. Interference and exploitation in bird communities // Wilson Bulletin. V. 96. P. 380–395.
Miller G., Spoolman S., 2011. Living in the environment: principles, connections, and solutions. Nelson Education. 800 p.
Moreno E., Carrascal L.M., 1993. Leg morphology and feeding postures in four Parus species: an experimental ecomorphological approach // Ecology. V. 74. № 7. P. 2037–2044.
Navara K.J., Badyaev A.V., Mendonça M.T., Hill G.E., 2006. Yolk antioxidants vary with male attractiveness and female condition in the house finch (Carpodacus mexicanus) // Physiological and biochemical zoology. V. 79. № 6. P. 1098–1105.
Newton I., 1994. The role of nest sites in limiting the numbers of hole-nesting birds: A review // Biological Conservation. V. 70. № 3. P. 265–276.
Nikbakhtzadeh M.R., Tirgari S., 2002. Blister beetles (Coleoptera: Meloidae) in Nahavand County (Hamedan Province, Iran) and their ecological relationship to other Coleopteran families // Iranian Journal of Public Health. V. 31. № 1-2. P. 55–62.
Pagani-Nunez E., Ruiz I., Quesada J., Negro J.J., Senar J.C., 2011. The diet of Great Tit Parus major nestlings in a Mediterranean Iberian forest: the important role of spiders // Animal Biodiversity and Conservation. V. 34. № 2. P. 355–361.
Razali N.M., Wah Y.B., 2011. Power comparisons of Shapiro-Wilk, Kolmogorov-Smirnov, Lilliefors and Anderson-Darling tests. Journal of Statistical Modeling and Analytics. V. 2. № 1. P. 21–33.
Samplonius J.M., Kappers E.F., Brands S., Both C., 2016. Phenological mismatch and ontogenetic diet shifts interactively affect offspring condition in a passerine // Journal of Animal Ecology. V. 85. № 5. P. 1255–1264.
Sedláček O., Fuchs R., Exnerová A., 2007. Differences in the nestling diets of sympatric Redstarts Phoenicurus phoenicurus and Black Redstarts P. ochruros: species-specific preferences or responses to food supply? // Acta ornithologica. V. 42. № 1. P. 99–106.
Senar J.C., Figuerola J., Domènech J., 2003. Plumage coloration and nutritional condition in the great tit Parus major: the roles of carotenoids and melanins differ // Naturwissenschaften. V. 90. № 5. P. 234–237.
Shapiro S.S., Wilk M.B., 1965. An analysis of variance test for normality (complete samples) // Biometrika. V. 52. № 3-4. P. 591–611.
Shy M.M., 1982. Interspecific feeding among birds: a review // Journal of Field Ornithology. V. 53. № 4. P. 370–393.
Slagsvold T., 2004. Cross-fostering of pied flycatchers (Ficedula hypoleuca) to heterospecific hosts in the wild: a study of sexual imprinting // Behaviour. V. 141. № 9. P. 1079–1102.
Slagsvold T., Wiebe K.L., 2007. Hatching asynchrony and early nestling mortality: the feeding constraint hypothesis // Animal Behaviour. V. 73. № 4. P. 691–700.
Visser M.E., Both C., Lambrechts M.M., 2004. Global climate change leads to mistimed avian reproduction // Advances in ecological research. V. 35. P. 89–110.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал