Зоологический журнал, 2019, T. 98, № 7, стр. 778-784
Жесткокрылые (Coleoptera) стоячих водоемов средней части Гыданского полуострова
А. А. Прокин 1, 2, *, В. А. Столбов 1, **, П. Н. Петров 3, ***, М. О. Филимонова 1
1 Тюменский государственный университет
652003 Тюмень, Россия
2 Институт биологии внутренних вод РАН им. И.Д. Папанина
152742Ярославская обл., Некоузский р-н, пос. Борок, Россия
3 Московский государственный университет
им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: prokina@mail.ru
** E-mail: vitusstgu@mail.ru
*** E-mail: tinmonument@gmail.com
Поступила в редакцию 22.04.2018
После доработки 28.11.2018
Принята к публикации 10.12.2018
Аннотация
Изучена фауна водных жесткокрылых основных типов стоячих водоемов средней части Гыданского п-ова. Обнаружено 20 видов, по 2–16 в водоемах каждого типа. Наибольшим числом видов представлено семейство Dytiscidae. В этом семействе наиболее разнообразны роды Agabus и Hydroporus (по 6 видов), которые вместе составляют 60% общего отмеченного видового богатства. Большинство видов имеют обширные ареалы как в долготном (голарктические составляют 56%), так и в широтном отношении. Отмечен восточнопалеарктический вид на западных пределах распространения в “области проникновения” – Helophorus niger J. Sahlberg 1880. В изученном материале преобладают Agabus serricornis (Paykull 1799) (52%) и A. arcticus arcticus (Paykull 1798) (38%). Максимальная численность жуков отмечена в пойменных озерах и временных водоемах. По сходству фауны наиболее близки временные водоемы и болота.
Водные беспозвоночные Гыданского п-ова практически не изучены: существует лишь несколько работ по зообентосу и зоопланктону водоемов (Шарапова, Абдуллина, 2004; Столбов и др., 2017).
Водные жуки уральских и сибирских тундр изучены фрагментарно. Имеются публикации о фауне водных жуков подотрядa Adephaga Ямала, Полярного Урала и Карской тундры (Зайцев, 1953; Андреева, Петров, 2004, 2007; Прокин и др., 2016); в которых, однако, не приводятся количественные характеристики таксоценов. В результате исследований Большеземельской тундры и островов Печорского моря выявлено 42 вида водных жуков, в том числе 19–26 видов в различных участках материковой тундры, 19 на о-ве Долгий, 9 на о-ве Вайгач (Prokin et al., 2017).
Многолетние сборы в южных тундрах Ямала позволили выявить 65 видов семейства Dytiscidae, 5 – Haliplidae, 2 – Gyrinidae, 4 – Helophoridae, 2 – Hydrophilidae (Зайцев, 1953; Андреева, Петров, 2004, 2007; Prokin et al., 2008), что указывает на высокий потенциал дальнейших исследований водной колеоптерофауны п-ова Гыдан.
В отличие от Ямала, подверженного сильному антропогенному прессу (разработка нефтегазовых месторождений, вылов рыбы, перевыпас оленей), Гыданский п-ов относительно слабо затронут хозяйственной деятельностью человека. Это привлекает внимание к экосистемам полуострова как к фоновым и повышает значимость данного исследования в контексте изучения Арктики в целом.
Подавляющее большинство типов континентальных водоемов является азональными или интразональными экосистемами, а небольшая часть редких и уникальных типов свойственна, как правило, не природным зонам, а определенным ландшафтам. По этой причине крайне сложно выделить зональные фаунистические комплексы водных жуков, в то время как среди наземных такие комплексы выделяются на основании заселения зональных плакорных экосистем (например: Бабенко, 2009). Изучение распределения видов в разнотипных водоемах Арктики, возможно, приблизит нас к решению этой фундаментальной проблемы.
МАТЕРИАЛ И МЕТОДЫ
Изучение водных жесткокрылых проводили в Ямало-Ненецком автономном округе, в средней части Гыданского п-ова (30 км к СВ от с. Антипаюта; 69°17′1″ с.ш., 77°21′56″ в.д.), в зоне типичной (средней) тундры.
Были исследованы основные типы водных объектов в пойменной зоне реки Нгеванаётаяха (бассейн р. Антипаётаяха). Местность сильно обводнена и занята различными типами низинных осоково-сфагновых и пушицево-сфагновых болот. Многочисленны небольшие озера, малые и временные водоемы. Вследствие близости исследованных водоемов (расстояние между крайними точками составило 3 км) и высокой обводненности территории многие из них связаны друг с другом.
Всего был изучен 21 наиболее типичный для этой местности водный объект: озера, старица, малые и временные водоемы, осоково-сфагновые и пушицево-сфагновые низинные болота.
Для проведения дальнейшего анализа мы сочли возможным объединить исследованные водоемы в несколько групп:
I (рис. 1a). Пойменные озера без макрофитов (n = 5). Площадь от 0.03 до 0.075 км2, глубина от 1.8 до 6 м. Озера характеризовались отсутствием высшей водной растительности, чистой водой и песчаными грунтами.
II (рис. 1b). Пойменные заросшие водоемы (n = 2). Изучены старица р. Нгеванаётаяха и протока, ведущая к ней. Отличались небольшой глубиной, развитой высшей водной растительностью (шелковник, водяная сосенка, стрелолист) и мхами.
III (рис. 1c). Малые и временные водоемы (n = 4). Малые неглубокие водоемы, окруженные болотами, обильно заросшие высшей водной растительностью (ежеголовник, водяная сосенка, сабельник) и мхами.
IV (рис. 1d). Осоково-сфагновые, сабельниково-осоково-сфагновые и пушицево-сфагновые болота (n = 10). Занимают большую часть территории, глубина в большинстве составляет 20–30 см. Иногда развиты по берегам пойменных озер.
Пробы отбирали в середине августа 2015 г. гидробиологическим скребком диаметром 35 см, облавливая водоем от поверхности до дна с захватом верхней части грунта. Пробы отбирали с определенной площади, 2 × 2 или 3 × 3 м, при этом скребок протаскивали такое количество раз, чтобы покрыть всю выбранную площадь. В сфагновых болотах при облове выбирали мхи, которые затем промывали в сачке. Полученные данные пересчитывали на 1 м2. Так как личинки большинства видов рассматриваемой фауны не описаны, но в то же время составляют значительную часть численности жесткокрылых, мы не исключали их из анализа, рассматривая как таксоны на уровне рода или подсемейства.
Данные о распространении и особенностях экологии видов взяты из следующих литературных источников: Кужугет и др., 2013; Angus, 1992; Fikáček et al., 2015; Larson et al., 2000; Mazzoldi, 2003; Nilsson, 2003; Nilsson, Holmen, 1995; Nilsson, Hájek, 2017.
Для построения дендрограммы фаунистичеcкого сходства использовали метод одиночного присоединения на основе расчета коэффициента Брея–Кертиса в программе PAST 3.01.
РЕЗУЛЬТАТЫ
Собранный материал представлен 20 видами (табл. 1). Семейства Haliplidae, Gyrinidae и Helophoridae представлены единичными видами; 85% общего видового богатства жуков приходится на семейство Dytiscidae. Среди плавунцов наиболее разнообразны роды Hydroporus и Agabus (по 6 видов), которые вместе составляют 60% общего видового богатства жуков. Относительно высокая представленность этих родов – типичная черта арктобореальной фауны в целом (Зайцев, 1953; Chernov et al., 2014).
Таблица 1.
Таксономический состав, средняя численность, экологические и зоогеографические характеристики водных жесткокрылых
| Таксон, показатель | Экологическая группа | Тип ареала | Группа водоемов | |||
|---|---|---|---|---|---|---|
| I | II | III | IV | |||
| экз./м2 | экз./м2 | экз./м2 | экз./м2 | |||
| Семейство Gyrinidae | ||||||
| Gyrinus opacus C. Sahlberg 1819 | C | H, A-M | 0.73 | – | – | 0.07 |
| Семейство Dytiscidae | ||||||
| Hygrotus novemlineatusnovemlineatus (Stephens 1829) | C | wP, A-B | 0.04 | – | – | – |
| Hydroporus lapponum (Gyllenhal 1808) | C | H, A-B-M | 0.20 | – | – | 0.18 |
| H. morio Aubé 1838 | C | H, A-T | – | – | 0.08 | 0.29 |
| H. nigrita (Fabricius 1792) | Э | wP, Pz | – | – | – | 0.07 |
| H. sibiricus J. Sahlberg 1880 | C | H, A-B | 0.08 | – | – | 0.35 |
| H. punctipennis J. Sahlberg 1880 | C | P, A-B | – | – | – | 0.10 |
| Hydroporus spp. (larvae) | – | – | – | – | 0.62 | 0.63 |
| Agabus arcticusarcticus (Paykull 1798) | Э | H, A-B | 3.43 | – | 1.33 | 1.10 |
| A. elongatus (Gyllenhall in C. Sahlberg 1827) | T | wP, A | – | – | – | 0.18 |
| A. fuscipennis (Paykull 1798) | Э | H, A-T | – | – | – | 0.02 |
| A. lapponicus (Thomson 1867) | С | P, A-B-M | – | – | – | 0.02 |
| A. serricornis (Paykull 1799) | С | P, A-T | 0.75 | 0.16 | 0.71 | 0.38 |
| A. zetterstedti Thomson 1856 | С | H, A-B | 0.04 | – | – | – |
| Ilybius angustior (Gyllenhal 1808) | T | H, A-B-M | – | – | 0.30 | 0.04 |
| Agabinae spp. (larvae) | – | – | – | 3.50 | 2.10 | 0.86 |
| Colymbetes dolobratus (Paykull 1798) | C | H, A-M | – | – | 0.16 | 0.09 |
| Rhantus sp. (larvae) | – | – | – | – | 0.08 | – |
| Семейство Haliplidae | ||||||
| Haliplus sp. (larvae) | – | – | – | – | 0.12 | – |
| Семейство Helophoridae | ||||||
| Helophorus niger J. Sahlberg 1880 | C | eP, A | – | – | – | 0.10 |
| Общая численность жуков (экз./м2) | 5.27 | 3.66 | 5.50 | 4.48 | ||
| Видовое богатство | 7 | 2 | 9 | 16 | ||
| Удельное видовое богатство | 1.4 | 1 | 2.2 | 1.6 | ||
Примечание. I – пойменные озера, II – заросшие старицы, III – малые водоемы, IV – болотные водоемы; Т – тельмато-палюстрофилы, С – стагнофилы, Э – эврибионты. Типы ареалов: долготные группы – P, транспалеарктический; wP, западно-палеарктический; eP – восточно-палеарктический, заходящий в Западную Сибирь; H – голарктический; широтные группы – A, арктический; B, эвбореальный; M, монтанный, на юг до бореального пояса; T, температный; Pz, полизональный.
Среди 16 надежно определенных видов выявлено 11 типов ареала, учитывая поясную и секторную составляющую (табл. 2). Большая часть видов (56%) имеет голарктические ареалы, несколько меньше транспалеарктических и западнопалеарктических (по 19%). Лишь один вид жуков (Helophorus niger) можно отнести к условно “восточнопалеарктическим”, так как основная часть его ареала лежит восточнее Енисея, а более западные находки – на Ямале и Гыдане можно рассматривать как “область проникновения”, которую отделяют по спорадичности находок видов от “области преобладания” – основной территории видового ареала (Бобринский и др., 1946; Коровчинский, 2004; Котов, 2016).
Таблица 2.
Распределение числа видов водных жесткокрылых по типам ареалов
| Секторная характеристика ареала | Поясная характеристика ареала | Всего | |||||
|---|---|---|---|---|---|---|---|
| A | A-M | A-B | A-B-M | A-T | Pz | ||
| H | – | 2 | 3 | 2 | 2 | – | 9 |
| P | – | – | 1 | 1 | 1 | – | 3 |
| wP | 1 | – | 1 | – | – | 1 | 3 |
| eP | 1 | – | – | – | – | – | 1 |
| Всего | 2 | 2 | 5 | 3 | 3 | 1 | 16 |
Обозначения как в табл. 1.
В широтном отношении преобладают аркто-эвбореальные виды (31%), аркто-борео-монтанные и аркто-температные составляют по 19% (табл. 2). Широкие как в секторном, так и в поясном отношении ареалы вообще характерны для водных жуков. Доля “северных” видов выше, чем широко-распространенных широтно (аркто-температные + полизональные) во всех типах водоемов, за исключением зарастающих пойменных (группа II), где, кроме не определенных до вида личинок, встречен лишь аркто-температный A. serricornis.
Большая часть видов предпочитает различные стоячие водоемы (69%), эврибионтов и специализированных обитателей временных водоемов и болот: 19 и 12% соответственно. Во всех типах водоемов преобладают стагнофилы, составляя от 100% в пойменных заросших водоемах (за счет единственного обитателя A. serricornis), до 60% в малых водоемах. Доля эврибионтов колеблется от 21% в болотах до 14% в пойменных незаросших озерах. Тельмато-палюстробионты составляют 20% населения в малых водоемах и 14% в болотах.
Видовой состав и численность водных жесткокрылых значительно различались в водоемах разных типов.
В постоянных пойменных озерах без макрофитов (группа I) видовое разнообразие жуков было невысоким, максимальной частотой встречаемости (80%) и средней численностью (3.43 экз./м2) характеризовался Agabus arcticus arcticus – голарктический арктоборео-монтанный эврибионт (табл. 1, 3). Во время последнего оледенения ареал этого вида в Европе смещался в южном направлении до Германии, Франции и Польши (Abellán et al., 2011), что указывает на высокие расселительные способности и экологическую пластичность вида. Средняя численность прочих видов жуков варьировала в пределах 0.04–0.75 экз./м2 (табл. 1).
Таблица 3.
Частота встречаемости в группах водоемов, средняя и максимальная численность водных жесткокрылых
| Виды | Частота встречаемости, % | Численность средняя, экз./м2 | Численность максимальная, экз./м2 | ||||
|---|---|---|---|---|---|---|---|
| I | II | III | IV | средняя в водоеме | |||
| Gyrinus opacus | 60 | – | – | 10 | 19.05 | 0.21 | 2.33 |
| Hygrotus novemlineatus novemlineatus | 20 | – | – | – | 4.8 | 0.01 | 0.2 |
| Hydroporus lapponum | 40 | – | – | 40 | 28.6 | 0.13 | 0.8 |
| H. morio | – | – | 25 | 50 | 28.6 | 0.15 | 1.33 |
| H. nigrita | – | – | – | 20 | 9.5 | 0.03 | 0.5 |
| H. sibiricus | 20 | – | – | 10 | 9.5 | 0.19 | 3.5 |
| H. punctipennis | – | – | – | 10 | 4.8 | 0.05 | 1 |
| Hydroporus spp. | – | – | 50 | 50 | 33.3 | 0.32 | 3 |
| Agabus arcticus arcticus | 80 | – | 50 | 10 | 38.1 | 1.83 | 11.33 |
| A. elongatus | – | – | – | 30 | 14.3 | 0.09 | 0.67 |
| A. fuscipennis | – | – | – | 10 | 4.8 | 0.01 | 0.2 |
| A. lapponicus | – | – | – | 10 | 4.8 | 0.01 | 0.2 |
| A. serricornis | 60 | 50 | 75 | 40 | 52.4 | 0.51 | 3 |
| A. zetterstedti | 20 | – | – | – | 4.8 | 0.01 | 0.2 |
| Ilybius angustior | – | – | 50 | 10 | 14.3 | 0.07 | 0.67 |
| Agabinae spp. | – | 100 | 100 | 60 | 61.9 | 1.14 | 5.33 |
| Colymbetes dolobratus | – | – | 50 | 30 | 23.8 | 0.07 | 0.33 |
| Rhantus sp. | – | – | 25 | – | 4.8 | 0.02 | 0.33 |
| Haliplus sp. | – | – | 25 | – | 4.8 | 0.02 | 0.5 |
| Helophorus niger | – | – | – | 10 | 4.8 | 0.05 | 1 |
В старице и ведущей к ней протоке (группа II), несмотря на наличие погруженной растительности, видовое богатство жуков было минимальным. Здесь зарегистрирован лишь Agabus serricornis с минимальным значением средней численности среди выделенных групп водоемов и личинки подсемейства Agabinae, средняя численность которых достигала 3.5 экз./м2 (табл. 1).
В малых водоемах (группа III) видовое разнообразие жуков было средним (9 видов), стопроцентной частотой встречаемости и максимальной средней численностью (2.1 экз./м2) отличались личинки Agabinae (табл. 1, 3). Лишь в данной группе водоемов отмечены личинки Haliplidae.
В осоково-сфагновых и пушицево-сфагновых болотах (группа IV) выявлено максимальное число видов водных жуков (16), но специфические болотные виды встречались нечасто и обладали средней численностью. Лишь здесь обнаружены представители Helophoridae. Наиболее обычны (60%) были личинки Agabinae (табл. 3), а наиболее многочисленным видом (1.1 экз./м2) был A. a. arcticus (табл. 1).
ОБСУЖДЕНИЕ
Выявленное разнообразие (20 видов) водных жесткокрылых водоемов изученного участка среднего Гыдана сопоставимо с материковыми участками Большеземельской тундры, где таковое колеблется от 19 до 26 видов (Prokin et al., 2017). Основу фауны составляют стагнофильные виды с широким долготным распространением, в широтном аспекте не выходящим за пределы бореального пояса.
Чаще других в изученном материале отмечались жуки Agabus serricornis (52%) и A. arcticus (38%), а наиболее многочисленными были A. arcticus и личинки Agabinae (табл. 3). Видимо, эти хищные виды среднего размера, способные к полету, наиболее приспособлены к обитанию в водных объектах изученного региона в целом и не проявляют особенных биотопических предпочтений.
Редкими, то есть представленными небольшим числом экземпляром в одном водоеме, были 8 видов (Hygrotus n. novemlineatus, Hydroporus punctipennis, Agabus fuscipennis, A. lapponicus, A. zetterstedti, Rhantus sp., Haliplus sp., Helophorus niger). Они встречены лишь в пойменных водоемах (2 вида, 29% от общего числа) и болотах (6 видов, 43%) (табл. 1).
Общее видовое богатство менялось от 2 видов в группе заросших протоки и старицы до 16 в болотах, хотя удельные величины (на 1 пробу) были максимальными в группе временных водоемов (табл. 1). Возможно, это связано с различным биотопическим разнообразием и трофическими условиями в водных объектах разного типа.
В хорологической структуре преобладали виды с широкими ареалами. Известно, что стагнофильные виды жуков имеют более широкое распространение, чем реофильные (Arribas et al., 2012), особенно – в регионах с теплым климатом (Jäch, Balke, 2008). Это в первую очередь объясняется их большей вагильностью (Dijkstra et al., 2014), которую связывают с меньшей в геологическом масштабе времени стабильностью большинства водоемов (временные и эфемерные, малые озера, мочажины, топи и др.), по сравнению с водотоками, что вынуждает стагнофилов постоянно расселяться (Ribera, 2008). Наибольшее число видов, выявленных нами на арктических равнинах, как раз стагнофилы (табл. 1), в основном представители семейства Dytiscidae. Для многих из них известны значительные изменения ареалов в связи с ледниковыми событиями (Coope, 1978; Abellán et al., 2011), что, вероятно, могло привести к увеличению вагильности у арктических плавунцов.
Максимальная численность жуков отмечена в пойменных озерах и временных водоемах, где она превышала 5 экз./м2, минимальная – в заросших старице с протокой (табл. 3). Вероятно, это связано с тем, что первые из них более стабильны и обогащаются биогенами первичных продуцентов, а вторые существуют за счет терригенной органики.
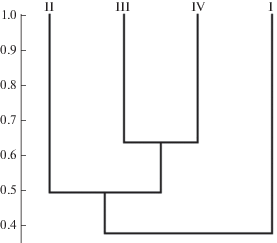
По сходству таксоценов (рис. 2) наиболее близки оказались временные водоемы и болота, к которым на уровне 50% примыкали старица с протокой. Сходство незарастающих пойменных озер с этим кластером было менее 40%. Видимо, такую картину фаунистического сходства следует объяснять сходством параметров болотных и временных водоемов. В частности, малая глубина обеспечивает здесь хорошее прогревание воды в летний период, а обилие растительности увеличивает гетерогенность среды и, следовательно, число местообитаний. Важный фактор – отсутствие пресса верховных позвоночных хищников – рыб, которых в гидробиоценозах замещают беспозвоночные, в частности хищные водные жуки (Arnott et al., 2006; Ponomarenko, Prokin, 2015), которые преобладали в наших сборах.
Список литературы
Андреева Т.Р., Петров П.Н., 2004. Водные жесткокрылые подотряда Adephaga (Coleoptera) Южного Ямала и Полярного Урала // Бюллетень Московского общества испытателей природы. Отдел биологический. Т. 109. Вып. 3. С. 9–20.
Андреева Т.Р., Петров П.Н., 2007. Дополнения к списку жуков-плавунцов (Coleoptera, Dytiscidae) Южного Ямала и Полярного Урала // Проблемы водной энтомологии России и сопредельных стран. Материалы III Всероссийского симпозиума по амфибиотическим и водным насекомым. Воронеж: Издательско-полиграфический центр Воронежского гос. ун.-та. С. 27–30.
Бабенко А.Б., 2009. Много ли тундровых видов среди коллембол тундровой зоны? // Виды и сообщества в экстремальных условиях. Сборник, посвященный 75-летию академика Юрия Ивановича Чернова. Москва-София: Товарищество научных изданий КМК – Pensoft Pbl. С. 74–91.
Бобринский Н.А., Зенкевич Л.А., Бирштейн Я.А., 1946. География животных. М.: Советская Наука. 453 с.
Зайцев Ф.А., 1953. К фауне водных жесткокрылых (Coleoptera) Полярного Урала и Карской тундры // Энтомологическое обозрение. Т. 33. С. 226–232.
Коровчинский Н.М., 2004. Ветвистоусые ракообразные отряда Ctenopoda мировой фауны (морфология, систематика, экология, зоогеография). М.: Товарищество научных изданий КМК. 410 с.
Котов А.А., 2016. Фаунистические комплексы Cladocera (Crustacea, Branchiopoda) Восточной Сибири и Дальнего Востока России // Зоологический журнал. Т. 9. № 7. С. 748–768.
Кужугет Ч.Н., Прокин А.А., Заика В.В., 2013. Водные жесткокрылые (Insecta, Coleoptera) Тувы. I. Семейства Haliplidae, Dytiscidae, Gyrinidae и Hydrophilidae // Евразиатский энтомологический журнал. Т. 12 (3). С. 278–290.
Прокин А.А., Петров П.Н., Сажнев А.С., Столбов В.А., Филиппов Д.А., 2016. Новые указания водных жесткокрылых (Coleoptera: Dytiscidae, Gyrinidae, Hydrophilidae) для Вологодской и Тюменской областей // Проблемы водной энтомологии России и сопредельных стран: Материалы VI Всероссийского (с международным участием) симпозиума по амфибиотическим и водным насекомым. Владикавказ: Изд-во СОГУ. С. 114–117.
Столбов В.А., Алешина О.А., Прокин А.А., Аллаяров Д.А., 2017. К изучению гидрохимического состава, зоопланктона и макрозообентоса некоторых пойменных озер типичной тундры Гыданского полуострова // Вода: химия и экология. № 8. С. 11–18.
Шарапова Т.А., Абдуллина Г.Х., 2004. К изучению водных беспозвоночных южных тундр Западной Сибири // Вестник экологии, лесоведения и ландшафтоведения. № 5. С. 97–115.
Abellán P., Benetti C.J., Angus R.B., Ribera I., 2011. A review of Quaternary range shifts in European aquatic Coleoptera // Global Ecology and Biogeography. V. 20. P. 87–100.
Angus R., 1992. Insecta: Coleoptera: Hydrophilidae: Helophorinae // Süsswasserfauna von Mitteleuropa. Eds. Schwoerbel J. & Zwick P. Bd. 20. № 10 (2). Stuttgart; Jena; etc.: Gustav Fischer Verlag. 144 p.
Arnott S.E., Jackson A., Alarie Y., 2006. The distribution and potential effects of water beetles in lakes recovering from acidification // Journal of the North American Benthological Society. V. 25. P. 811–824.
Arribas P., Velasco J., Abell’an P., S’anchez-Fern’andez D., And’ujar C., et al., 2012. Dispersal ability rather than ecological tolerance drives differences in range size between lentic and lotic water beetles (Coleoptera: Hydrophilidae) // Journal of Biogeography. V. 39. P. 984–994.
Chernov Yu.I., Makarova O.L., Penev L.D., Khruleva O.A., 2014. Beetles (Insecta, Coleoptera) in the Arctic fauna: Communication 1. Faunal composition // Entomological Review. V. 94. № 4. P. 438–478.
Coope G.R., 1978. Constancy of insect species versus inconstancy of Quaternary environments // Symposium of the Royal Entomological Society of London. V. 9. P. 176–187.
Dijkstra B., Monaghan M.T., Pauls S.U., 2014. Freshwater biodiversity and aquatic insects diversification // The Annual Review of Entomology. V. 59. P. 143–163.
Jäch M.A., Balke M., 2008. Global diversity of water beetles (Coleoptera) in freshwater // Hydrobiologia. V. 595. P. 419–442.
Larson D.J., Alarie Y., Roughley R.E., 2000. Predaceous Diving Beetles (Coleoptera: Dytiscidae) of the Nearctic Region, with Emphasis of the Fauna of Canada and Alaska, Ottawa: NRC Research Press. 982 p.
Mazzoldi P., 2003. Family Gyrinidae Latreille, 1810 // Löbl I., Smetana A. (eds): Catalogue of Palaearctic Coleoptera. Vol.1. Archostemata-Myxophaga-Adephaga. Stenstrup: Apollo Books. P. 26–30.
Nilsson A.N., 2003. Family Dytiscidae Leach, 1815 // Löbl I., Smetana A. (eds): Catalogue of Palaearctic Coleoptera. V. 1. Archostemata-Myxophaga-Adephaga. Stenstrup: Apollo Books. P. 34–78.
Nilsson A.N., Hájek J., 2017. Catalogue of Palearctic Dytiscidae (Coleoptera). 2017. [Электронный ресурс]. Режим доступа: http://www.waterbeetles.eu/documents/PAL_CAT_Dytiscidae_2017.pdf Дата обновления: 01.01.2017.
Nilsson A.N., Holmen M., 1995. The aquatic Adephaga (Coleoptera) of Fennoskandia and Denmark. II. Dytiscidae // Fauna entomologica scandinavica. V. 32. 192 p.
Fikáček M., Angus R.B., Gentili E., Jia F., Minoshima Y.N., et al., 2015. Family Helophoridae Leach, 1815 // Catalogue of Palaearctic Coleoptera. V. 2/1. Revised and Updated Edition / Ed. by Löbl I. and Löbl D. Leiden-Boston: Brill. P. 25–33.
Ponomarenko A.G., Prokin A.A., 2015. Review of paleontological data on the evolution of aquatic beetles (Coleoptera) // Paleontological Journal. V. 49. № 13. P. 1383–1412.
Prokin A.A., Ryndevich S.K., Petrov P.N., Andrejeva T.R., 2008. New data on the distribution of Helophoridae, Hydrochidae and Hydrophilidae (Coleoptera) in Russia and adjacent lands // Russian Entomological Journal. V. 17. № 2. P. 145–148.
Prokin A.A., Petrov P.N., Makarova O.L., 2017. Water beetles (Coleoptera) of coastal areas of the Bolshezemelskaya Tundra, extreme northeastern Europe // Aquatic Insects. V. 37. Issue 4. P. 197–218. https://doi.org/10.1080/ 01650424.2017.1387270
Ribera I., 2008. Habitat constraints and the generation of diversity in freshwater macroinvertebrates. Lancaster J., Briers R.A. (eds). Aquatic Insects: Challenges to Populations. Edinburgh: CAB International. P. 289–311. doi https://doi.org/10.1079/9781845933968.0000
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал