Зоологический журнал, 2019, T. 98, № 7, стр. 749-757
Байкальская амфипода Gmelinoides fasciatus (Amphipoda, Crustacea) в питании окуня литоральной зоны Онежского озера (возрастной и сезонный аспекты)
А. П. Георгиев 1, *, А. И. Сидорова 1, Ю. А. Шустов 2, **, М. А. Лесонен 2
1 Институт водных проблем Севера – обособленное подразделение
Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Карельский научный центр РАН”
185030 Петрозаводск, Россия
2 Петрозаводский государственный университет
185910 Петрозаводск, Россия
* E-mail: a-georgiev@mail.ru
** E-mail: shustov@petrsu.ru
Поступила в редакцию 13.04.2018
После доработки 06.12.2018
Принята к публикации 10.12.2018
Аннотация
Исследована роль инвазионной амфиподы Gmelinoides fasciatus (Stebbing 1899) в пищевой сети Онежского озера (северная граница ареала в европейской части России), и оценивается ее значение в качестве объекта питания для речного окуня (Perca fluviatilis (L.)). Установлено, что данный вселенец стал доминирующим в составе пищевого спектра окуня в течение всего года. Встречаемость его в питании окуня в возрасте 1+–3+ в среднем составляет около 80%, у особей старших возрастов встречаемость рачка в питании снижается, и преобладают другие представители донной фауны, а также молодь рыб. По биомассе роль вселенца в питании окуня (1–7+) в среднем составляет 50% (max до 90% – 1–2+) в течение года. По мере удаления от берега (на глубинах более 1.5 м) доля рачков-вселенцев в питании окуня существенно снижается до 3–10%. Имеющиеся факты позволяют рассматривать вселение G. fasciatus в Онежское озеро как положительное явление – происходит увеличение потенциальной рыбопродуктивности водоема.
Cо второй половины 20 столетия проникновение в естественные и искусственные экосистемы несвойственных для них видов из других регионов – биологические инвазии – становится более интенсивным в результате глобализации хозяйственной деятельности человека (Walther et al., 2009; Panov et al., 2010; Strayer, 2010; Keller et al., 2011). Инвазионные чужеродные виды считаются второй по значению угрозой биоразнообразию (после разрушения мест обитания), одной из угроз естественным аборигенным экосистемам, устойчивости биологических ресурсов (Алимов и др., 2004). В России проблема биоинвазий в пресноводные экосистемы связана со строительством каналов (инвазионных коридоров) и работами по обогащению водоемов видами байкальского и понто-каспийского происхождения. Преднамеренную интродукцию водных беспозвоночных проводили в 1960–1970-х гг. с целью увеличения кормовой базы рыб (Иоффе, 1968; Бекман, 1962). В 1970-х гг. амфипода байкальского происхождения Gmelinoides fasciatus (Stebbing 1899) была внесена в ряд озер Карельского перешейка. Впоследствии вид-вселенец успешно акклиматизировался и начал проникать в другие водоемы по системе рек. К 1996 г. рачок заселил всю литоральную зону Ладожского озера (Панов, 1994; Барков, 2006). В 2001 г. он был обнаружен вдоль юго-западного берега Онежского озера (Березина, Панов, 2003). В 2006 г. байкальский вид отмечен практически по всей литорали Онежского озера (Кухарев и др., 2008). С его вселением бентос Онежского озера в энергетическом отношении приобрел высококалорийный питательный объект для рыб. Поскольку его распространение происходит достаточно интенсивно, можно говорить об улучшении кормовой базы рыб литоральной зоны. Исследований, посвященных роли вселенца в питании рыб Онежского оз., крайне мало (Ильмаст, Кучко, 2012; Лобанова и др., 2017).
Целью нашей работы являлось проанализировать сезонную динамику биомассы и численности байкальской амфиподы Gmelinoides fasciatus, а также роль этого вида в питании окуня литоральной зоны северной части Онежского оз. (район Кумса-губа Повенецкого залива) в возрастном и сезонном аспектах.
МАТЕРИАЛ И МЕТОДИКА
Для изучения сезонной динамики популяционных показателей инвазионного рачка G. fasciatus на литорали Кумса-губы Повенецкого залива Онежского озера, а также его роли в питании рыб, в частности окуня, был собран гидробиологический материал в период с 2008 по 2018 гг.: бентосные пробы – с конца мая по начало октября каждые 10 дней в двух повторностях; ихтиологический материал – ежемесячно.
Район исследования – Кумса-губа – находится в Повенецком заливе (север Онежского оз.). Залив занимает третье место среди других районов озера по размеру, уступая только Центральному и Южному Онего. Его площадь 872 км2, объем водной массы 16.5 км3, средняя глубина около 19 м (Крупнейшие…, 2015) (рис. 1). Кумса-губа – узкий залив, вытянутый в северо-западном направлении. Берега в вершине губы низкие, ближе к выходу в озеро переходят в высокие, которые хорошо защищают эту часть водоема от ветрового воздействия (Фрейндлинг, 1974). Площадь этого залива 1.2 км2, средняя глубина 7 м, при максимальной 17 м. Максимальная глубина отмечается ближе к выходу из губы.
Рис. 1.
Карта-схема места отбора гидробиологических и ихтиологических проб – Кумса-губа Повенецкого залива Онежского озера. Черным кружком обозначена мониторинговая станция.
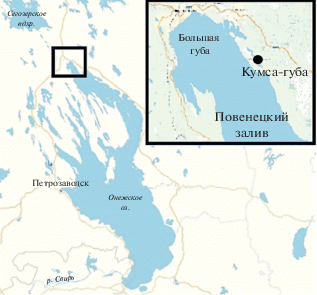
Отбор и обработку проб макрозообентоса осуществляли в соответствии со стандартными руководствами по сбору пресноводного бентоса (Методические рекомендации.., 1984; Панов, Павлов, 1986; Методические рекомендации.., 2005). Станция наблюдения находилась на глубине 0.4 м, где численность рачка была максимальная (Сидорова, 2013). Выбор района наблюдения в Повенецком заливе был обусловлен тем, что здесь проходит северная граница ареала инвазионного вида G. fasciatus в европейской части России (Кухарев и др., 2008).
Ихтиологический материал отлавливали с помощью жаберных сетей. Сети ставили около берега, на глубине до 4 м (здесь в условиях Онежского оз. встречается вселенец), на 1.5–2.0 ч. Первичная информация отражала размерно-весовую и возрастной структуру популяции окуня. Для изучения его питания желудки фиксировали на месте поимки 96% медицинским спиртом, а камеральную обработку проводили в лабораторных условиях. При исследовании питания окуней мы учитывали пищевой спектр и долю байкальской амфиподы (методом фактических весов кормовых организмов) от пищевого комка (%) и частоту встречаемости (%). Всего исследовано 382 желудка окуня.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Макрозообентос в глубоководной части Кумса-губы характеризуется средней годовой биомассой 5.2 г/м2, при численности 6 тыс. экз./м2. В северной части залива донное сообщество представлено почти полностью малощетинковыми червями и личинками рода Chironomus (до 80% биомассы) (Полякова, 1992). Осенью значения плотности и биомассы по данным 1986–1988 гг. достигают своих максимальных величин (16.1 тыс. экз./м2 и 27.0 г/м2). С удалением от вершины губы растет разнообразие личинок Orthocladiinae, Tanytarsini и других групп. В Кумса-губе Повенецкого залива доля инвазионной амфиподы G. fasciatus достигает от общей численности литорального бентоса 60–75%. Доля вида от общей биомассы составляет 7–13%, что связано с доминированием здесь моллюсков прудовиков Lymnaea stagnalis (L.) и жуков (Coleoptera) рода Dytiscus.
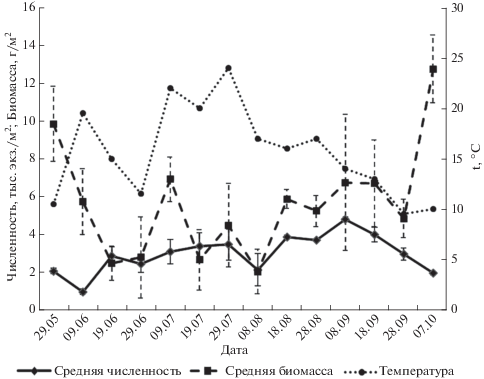
Результаты исследования популяционных показателей вида-вселенца в Кумса-губе Повенецкого залива показали, что максимальные значения численности G. fasciatus достигали 4885 экз./м2, биомассы 14.0 г/м2, при средних значениях 2970 экз./м2 и 5.6 г/м2 соответственно. Анализ сезонной динамики рачка показал, что в начале периода исследования амфиподы были представлены прошлогодней генерацией с длиной тела 3.0–11.5 мм. Молодые рачки начали появляться с начала июня при температуре воды 10°С, т.е. процесс размножения начинался в мае. В течение июня возрастала доля только что вышедшей молоди, по сравнению с долей старовозрастных рачков. Массовый выход молодых рачков в озере зарегистрирован в конце июня – начале июля, когда их численность достигает 85%. В августе происходит постепенное снижение числа молодых рачков с длиной тела менее 1.5 мм, наряду с увеличением числа особей размером 1.5–3.0 мм. В первой половине сентября отмечены бокоплавы всех размерных групп. В конце сентября рачков с длиной тела менее 1.5 мм не обнаружено, что указывает на завершение размножения амфиподы в условиях Повенецкого залива. Таким образом, в сезонной динамике популяционных показателей инвазионной амфиподы в Кумса-губе Онежского оз. отмечено два пика численности в июле и августе (рис. 2). Кроме того, в то время обнаружены генерации прошлого и текущего лета. Таким образом, на северной границе ареала европейской части России в условиях 63° с.ш. температура воды не лимитирует развитие инвазионного вида G. fasciatus.
Рис. 2.
Сезонная динамика средней численности (тыс. экз./м2), биомассы (г/м2) Gmelinoides fasciatus и температуры воды (°С) на станции Кумса-губы Повенецкого залива Онежского озера.
В целом, по Онежскому озеру данные по численности и биомассе вида-вселенца G. fasciatus сопоставимы с популяционными показателями рачка в других водоемах и доказывают его успешную натурализацию. Так, в Ладожском оз. в 2004–2005 гг. численность рачка составила 936–3141 экз./м2, при биомассе 4.2–10.3 г/м2 (Барков, 2006); в 2009 г. численность изменялась от 8 до 7160 экз./м2, при биомассе 0.024–15.300 г/м2 (Литоральная…, 2011). Различия показателей численности вида-вселенца на литорали Ладожского оз. с 1988 г. до 2009 г., по-видимому, связаны с разными типами биотопов станций наблюдения, поскольку известно, что популяционные показатели данного вида выше в местообитаниях с зарослями макрофитов закрытых от волновых воздействий (Сидорова, 2013).
Как правило, в Онежском озере чужеродный вид G. fasciatus встречается до глубины 4 м, основные скопления – до 1 м (Сидорова, 2013). В условиях озера Отрадное вид обитает до глубины 2–3 м, причем наибольшее количество рачков отмечается на глубине 1.0–1.2 м (Нилова, 1976). В целом, максимальные численности байкальской амфиподы приурочены к глубине около 1 м в водоемах-рецепиентах: оз. Псковско-Чудское, оз. Ладожское, Финском заливе Балтийского моря (табл. 1).
Таблица 1.
Популяционные показатели популяции Gmelinoides fasciatus в разных водоемах
| Водоемы, год исследований | Численность популяции, экз./м2 | Биомасса популяции, г/м2 | Глубины с максимальной плотностью, м | Источник |
|---|---|---|---|---|
| Озеро Байкал (Посольский Сор) | 10 000–20 000 | 63–100 | 0–1.0 | Бекман, 1962 |
| Оз. Псковско-Чудское | 50–17300 | 0.1–102.0 | 0.3 | Panov et al., 2000 |
| Оз. Отрадное | 26–692 | Нет данных | 1.0–1.2 | Нилова, 1976 |
| Ладожское озеро. 1988–1990 гг. | 8–53800 | 0.02–158.60 | 0–1.0 | Панов, 1994 |
| Ладожское озеро. 1992 | 6000–7000 | 80–100 | Нет данных | Slepukhina et al., 1996 |
| Ладожское озеро. 2004–2005 гг. | 936–3141 | 4.2–10.3 | 0.3–0.5 | Барков, 2006 |
| Ладожское озеро. 2006 | 9090 ± 2024 | 18.65 ± 3.61 | Нет данных | Литоральная…, 2011 |
| Ладожское озеро. 2009 г. | 8–7160 | 0.024–15.3 | Нет данных | Курашов и др., 2010 |
| Финский залив Балтийского моря | 300–3000 | 0.4–8.8 | 0.4–1.2 | Березина, 2005 |
| Рыбинское водохранилище | 6800 | 19.8 | Нет данных | Скальская, 1994 |
| Западное побережье оз. Онежское. 2001 г. | 1696–8256 | 3.9–40.3 | 0.2–0.5 | Березина, Панов, 2003 |
| Оз. Онежское 2005 г. Петрозаводская губа |
132–462 | 0.2–6.2 | 0.5 | Калинкина и др., 2006 |
| Оз. Онежское. 2006 г. | 310–18 740 | 0.2–12.2 | Нет данных | Кухарев и др., 2008 |
Наряду с интенсивным увеличением численности бокоплава в Онежском оз., остается не ясным, на какой фазе роста количественных характеристик находится инвазионный вид (вселенец живет в озере более 15 лет) (Рябинкин, Полякова, 2008). Учитывая устойчивость байкальского бокоплава к неблагоприятным факторам среды и особенности его биологии, важно также изучить пути расширения ареала и возможности проникновения его по притокам в другие водоемы бассейна Онежского оз., что запланировано нами на будущие исследования.
Рыбная часть сообщества прибрежной зоны Онежского оз., как и для ряда других крупных водоемов Республики Карелия (Черепанова, Георгиев, 2014), представлена в основном окунем, ершом, щукой, налимом, плотвой и лещом (Черепанова и др., 2018), остальные виды немногочисленны. Продукционные свойства (темп роста, плодовитость) основных промысловых рыб не имеют значимых отличий аналогичных показателей тех же видов в прошлые годы. Исключением является плотва, у которой отмечается некоторое снижение интенсивности роста, произошедшее, очевидно, из-за увеличения ее плотности. Во второй половине лета в акватории прибрежной полосы Онежского озера плотва образует большие скопления, что позволяет рекомендовать рыбодобывающим opгaнизациям проведение более активного вылова данного вида в это время года. О недоиспользовании запасов свидетельствуют, не только снижения темпов роста, но и расширение возрастного ряда популяции. Кроме того, в данном районе в промышленных объемах вылавливается ряпушка (Черепанова и др., 2018(б)), что делает данный район очень перспективным в рыбодобывающем аспекте.
В данной статье мы остановимся на питании окуня прибрежной зоны северной части Онежского озера (р-он Кумса-Губа). Информация о питании окуня в данном водоеме в литературе не много и относится к середине прошлого века (Гуляева, 1951; Александров, 1969). Сеголетки окуня питаются вначале микробентическими формами, затем, на втором году жизни молодь переходит к смешанному питанию бентосом и планктоном. Трехлетки окуня полностью переходят на питание бентосом. Достигнув размеров 10 см и более, молодь начинает хищничать (Lobanova et al., 2017). Отмечено, что окуни в возрасте от 2 до 8 лет и старше в подавляющем большинстве хищники. Более 85% особей длиной свыше 10 см питались рыбой и лишь 10% – бентосом. Из бентосных организмов в пищевом рационе окуня Онежского оз. отмечены в основном личинки водных насекомых: Chironomidae, Trichoptera, Megaloptera, Ephemeroptera, Coleoptera и ракообразные (Mysis relicta, Monoporeia affinis (Lindström 1855), Pallaseopsis quadrispinosa, Gammarus lacustris (Sars 1867), Asellus aquaticus (Linnaeus 1758)). Прочие группы встречены единично.
Оценка роли вселенца (Gmelinoides fasciatus) в питании окуня различных возрастных групп Кумса-губы Онежского озера. В период исследования возрастной состав уловов окуня был представлен особями в возрасте 1+–15+ (доминировали 1+–7+ (около 80%). По материалам наших исследований в Онежском оз. инвазионный вид играет весьма существенную роль в питании окуня младших размерно-весовых групп. Встречаемость G. fasciatus в питании окуня в возрасте 1–3+ составляет в среднем около 81%, в то время как в пищевом рационе последующих групп преобладают молодь рыб и другие представители донной фауны (табл. 2).
Таблица 2.
Биологические показатели окуня Онежского озера и встречаемость Gmelinoides fasciatus в его питании, % (382 экз.)
| Окунь | Доля возрастной группы в выборке | Встречаемость Gmelinoides fasciatus в питании окуня, % |
||
|---|---|---|---|---|
| возраст | вес, г | длина AD, см | ||
| 1+ | 4 | 6.2 | 2.1 | 100.0 |
| 2+ | 9 | 9.4 | 5.4 | 87.0 |
| 3+ | 30 | 12.7 | 7.1 | 59.0 |
| 4+ | 48 | 14.9 | 12.7 | 41.0 |
| 5+ | 84 | 17.7 | 14.9 | 15.0 |
| 6+ | 117 | 19.6 | 27.1 | 5.0 |
| 7+ | 168 | 21.9 | 10.2 | 0.7 |
| 8+ | 217 | 23.7 | 5.3 | 0.0 |
| 9+ | 283 | 26.1 | 5.7 | 0.0 |
| 10+ | 348 | 27.5 | 3.3 | 0.0 |
| 11+ | 431 | 29.6 | 2.6 | 0.0 |
| 12+ | 512 | 31.2 | 1.7 | 0.0 |
| 13+ | 611 | 33.1 | 1.1 | 0.0 |
| 14+ | 709 | 34.4 | 0.5 | 0.0 |
| 15+ | 824 | 36.4 | 0.3 | 0.0 |
Исходя из результатов исследования, роль G. fasciatus в питании окуня Онежского оз. достаточно велика. Одной из причин, на наш взгляд, является широкое его распространение на современном этапе, что играет одну из ключевых ролей в его доступности для рыб, в частности окуня. По мере удаления от берега доля G. fasciatus в питании окуня существенно снижается (наибольшая на глубине до 0.5–1.0 м).
Оценка роли вселенца (G. fasciatus) в питании окуня Кумса-губы Онежского озера в сезонном аспекте. В сезонном аспекте доля G. fasciatus в питании окуня Онежского озера сильно меняется. В зимний период он занимает до 90% по массе пищевого комка (табл. 3). Весной окунь переходит на питание чужеродным видом. Летом пищевой комок окуня был полностью представлен куколками хирономид, вылет которых происходил в этот период. В июле вид-вселенец уже составлял 50% по массе, субдоминантом выступают личинки хирономид. Осенью доминирующей пищей становятся дафнии (70% по массе), а доля G. fasciatus падает до 30%.
Таблица 3.
Спектр питания окуня (1–7+) Кумса-Губы в сезонном аспекте, % от массы пищевого комка (среднее значение)
| Объект питания | Зима | Весна | Лето | Осень |
|---|---|---|---|---|
| Gmelinoides fasciatus | 58.7 | 34.2 | 35.0 | 45.0 |
| Chironomidae | 0.0 | 15.4 | 16.1 | 18.2 |
| Asellus aquaticus | 0.0 | 0.0 | 4.7 | 7.9 |
| Gastropoda | 12.3 | 8.7 | 7.9 | 6.7 |
| Insecta | 0.0 | 0.0 | 0.7 | 1.5 |
| Plecoptera | 0.0 | 6.7 | 6.5 | 2.1 |
| Oligochaeta | 10.7 | 18.1 | 8.9 | 0.0 |
| Ephemeroptera | 4.1 | 4.2 | 11.2 | 14.7 |
| Trichoptera | 0.9 | 1.1 | 2.9 | 2.5 |
| Hydracarina | 0.1 | 0.1 | 0.4 | 0.5 |
| Мальки рыб | 4.9 | 4.9 | 4.8 | 0.2 |
| Длина (АD) рыб, см | 15.4 | 15.4 | 15.7 | 14.8 |
| Вес, г | 39.3 | 40.5 | 47.5 | 32.4 |
| Средний индекс наполненности желудка, ‰o |
23.2 | 29.7 | 33.5 | 27.8 |
| Число особей | 61 | 73 | 69 | 179 |
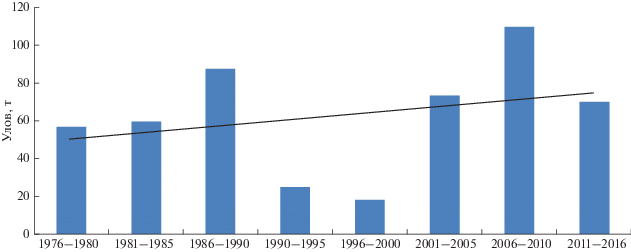
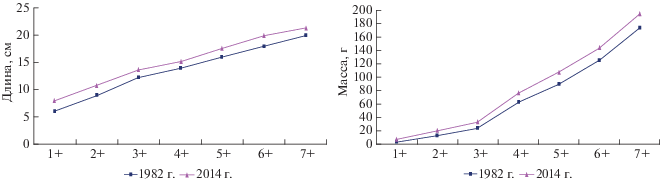
Амфипода G. fasciatus, являясь высококалорийным питательным объектом для бентосоядных рыб (табл. 4), возможно, косвенно является причиной увеличения средних весовых приростов окуня по сравнению с 1980-ми годами, когда вселенца не было на литорали Онежского оз. По нашим предположениям, в связи с изменением спектра питания рыб в результате биоинвазий вполне возможно происходит изменение и в биологических показателях, в том числе и в росте окуня. Как можно заметить за последние 30 лет (рис. 3), средние размерно-весовые характеристики окуня Онежского оз. повысились. Нельзя исключить, что одной из причин подобного роста может быть и улучшение кормовой базы за счет вида-вселенца G. fasciatus. Если проследить вылов окуня в Онежском озере за последние 40 лет, не считая 1990-х гг. (спад уловов в целом по региону), он имеет тенденцию к увеличению (рис. 4), что возможно связано и с появлением инвазионного рачка G. fasciatus. В этой связи рост вылова окуня мог быть обусловлен изменениями в среде обитания, в частности увеличения кормовой базы в качественном и количественном отношении.
Таблица 4.
Удельная продукция и калорийность для отдельных групп животных
| Таксон | Удельная продукция (Cw) | Калорийность, ккал/г сырой массы |
|---|---|---|
| Oligochaeta (в среднем) | 0.0300 | 0.998 |
| Stylaria lacustris (Linnaeus 1767) | 0.1000 | |
| Hirudinea | 0.0200 | 1.000 |
| Amphipoda | 0.896 | |
| Monoporeia affinis (Lindström 1855) | 0.0073 | |
| Gammarus lacustris (Sars 1867) | 0.0069 | |
| Gmelinoides fasciatus (Stebbing 1899) | 1.170 | |
| Mollusca | 0.35 (с раковиной) | |
| Sphaeriidae | 0.0044 | |
| Gastropoda | 0.0200 | 0.400 |
| Ephemeroptera | 0.0270 | 0.920 |
| Coleoptera | 0.0270 | 0.700 |
| Trichoptera | 0.0270 | 0.920 |
| Odonata | 0.0270 | 0.900 |
| Heteroptera | 0.500 | |
| Plecoptera | 0.010 | 0.920 |
| Chironomidae | 0.500 | |
| нехищные | 0.0350 | 0.630 |
| хищные | 0.0400 | |
| Hydracarina | 0.0300 | 0.500 |
| Megaloptera | 0.900 |
Рис. 3.
Динамика размерно-весовой структуры популяции окуня Онежского озера в ретроспективном аспекте.
Анализ структуры промысловых уловов, биологических показателей окуня, состояния кормовой базы и условий воспроизводства рыб, экологической ситуации в бассейне озера позволяют констатировать, что в целом его запасы находятся в удовлетворительном состоянии, а продукционные возможности популяций позволяют в ближайшие годы обеспечить получение уловов на стабильном и высоком промысловом уровне. В настоящее время уловы окуня порой превышают 100 т. Подобные величины фиксировались лишь в 1930-е годы – в период с максимально развитой и разнообразной рыбодобывающей базой.
ЗАКЛЮЧЕНИЕ
Анализ полученных данных по питанию окуня показал, что у молоди и части половозрелых особей в период исследования доминировал бентосный тип питания. Интенсивное проникновение чужеродного вида Gmelinoides fasciatus в северные районы Онежского озера привело к существенным изменениям структуры литоральных биоценозов, появлению нового высококалорийного (1.17 ккал/г) доступного объекта питания рыб в составе пищи окуня. Данный вид стал доминирующим в пищевом спектре окуня Онежского оз. на протяжении всего года. Встречаемость его в питании окуня в возрасте 1+–3+ в среднем составляет около 80%, у особей старших возрастов встречаемость в питании снижается; преобладают другие представители донной фауны и молодь рыб. По мере удаления от берега (на глубинах более 1.5 м) доля рачков-вселенцев в питании окуня существенно снижается до 3–10%.
Таким образом, в настоящее время в Онежском озере G. fasciatus стал важнейшим трофическим ресурсом для рыб-бентофагов и молоди рыб. Имеющиеся факты позволяют рассматривать его вселение в Онежское озеро как положительное явление – увеличение потенциальной рыбопродуктивности водоема. Анализ структуры сетных и траловых уловов за 1976–2016 гг. показал тенденцию к увеличению уловов окуня (от 20 до 110 тонн), что, возможно, связано с улучшением кормовой базы популяции окуня за счет вселенца. Учитывая устойчивость байкальского бокоплава к различным факторам среды, особенности его биологии, способность к активной миграции и возможность проникновения по притокам в другие водоемы бассейна Онежского озера, а также увеличение его ареала на север в сторону Выгозерского водохранилища по Беломоро-Балтийскому каналу, можно прогнозировать дальнейшее улучшение кормовой базы для бентосоядных рыб, что предположительно будет объектом нашего исследования в будущем.
Список литературы
Александров Б.М., 1969. О составе пищи бентосоядных рыб Онежского озера // Предварительные результаты работ комплексной экспедиции по исследованию Онежского озера. Вып. 4. Петрозаводск. С. 106–110.
Алимов А.Ф., Финогенова Н.П., Балушкина Е В., Аракелова Е.С., 1986. Продуктивность зообентоса // Исследование взаимосвязи кормовой базы и рыбопродуктивности. Л.: Наука. С. 87–124.
Барков Д.В., 2006. Экология и биология байкальского вселенца Gmelinoides fasciatus (Stebbing, 1899) и его роль в экосистеме Ладожского озера. Автореф. дис. … канд. биол. наук. СПб. 26 с.
Бекман М.Ю., 1962. Экология и продукция Micruropus possolsii Sow и Gmelinoides fasciatus Stebb // Труды Лимнологического института Сибирского отделения АН СССР. Т. 2. Ч. 1. С. 141–155.
Березина Н.А., 2005. Сезонная динамика структуры и плодовитость популяции байкальского бокоплава (Gmelinoides fasciatus, Ampipoda, Crustacea) в зарослевой зоне Невской губы // Зоологический журнал. Т. 84. № 4. С. 411–419.
Березина Н.А., Панов В.Е., 2003. Вселение байкальской амфиподы Gmelinoides fasciatus (Amphipoda, Crustacea) в Онежское озеро // Зоологический журнал. Т. 82. № 6. С. 731–734.
Гуляева А.М., 1951. Материалы по биологии окуня (Perca fluviatilis L.) Онежского озера // Труды Карело-Финского отделения ВНИОРХ. Т. 3. Петрозаводск. С. 150–168.
Ильмаст Н.В., Кучко Я.А., 2012. Байкальский бокоплав (Gmelinoides fasciatus) как кормовой объект рыб литоральной зоны Онежского озера // Вопросы рыболовства. Т. 13. № 1 (49). С. 35–40.
Иоффе Ц.И., 1968. Обзор выполненных работ по акклиматизации кормовых беспозвоночных для рыб в водохранилищах // Известия ГосНИОРХ. Т. 67. С. 7–29.
Калинкина Н.М., Сярки М.Т., Федорова А.С., 2006. Динамика популяционных показателей инвазионного вида Gmelinoides fasciatus (Stebbing) в Петрозаводской губе Онежского озера // Северная Европа в XXI веке: природа, культура, экономика. Материалы междунар. конф., посвящ. 60-летию КарНЦ РАН (24–27 окт. 2006 г.). Петрозаводск: Карельский научный центр РАН. С. 269–271.
Крупнейшие озера-водохранилища Северо-Запада европейской территории России: современное состояние и изменения экосистем при климатических и антропогенных воздействиях, 2015. Петрозаводск: Карельский научный центр РАН. 375 с.
Курашов Е.А., Панов В.Е., Барбашова М.А., 2010. Первое обнаружение инвазивной амфиподы Chelicorophium curvispinum (Sars 1895) (Amphipoda, Crustacea) в Ладожском озере // Российский журнал биологических инвазий. № 3. С. 62–71.
Кухарев В.И., Полякова Т.Н., Рябинкин А.В., 2008. Распространение байкальской амфиподы Gmelinoides fasciatus (Stebbing) (Ampipoda, Crustacea) в Онежском озере // Зоологический журнал. Т. 87. № 10. С. 1270–1273.
Литоральная зона Ладожского озера, 2011. СПб.: Нестор-История. 416 с.
Лобанова А.С., Сидорова А.И., Георгиев А.П., Шустов Ю.А., Алайцев Д.П., 2017. Роль инвазионного вида Gmelinoides fasciatus (Stebbing) в питании речного окуня Perca fluviatilis L. литоральной зоны Онежского озера // Российский журнал биологических инвазий. № 2. С. 81–87.
Методические рекомендации по сбору и обработке материалов при ведении мониторинга биологического загрязнения на Финском заливе, 2005. Санкт-Петербург. 68 с.
Методические рекомендации по сбору и обработке материалов при гидробиологических исследованиях на пресноводных водоемах. Зообентос и его продукция, 1984. Л.: ГосНИОРХ. 52 с.
Нилова О.И., 1976. Некоторые черты экологии и биологии Gmelinoides fasciatus Stebb., акклиматизированных в озере отрадное Ленинградской области // Известия ГосНИОРХ. Т. 110. С. 10–15.
Панов В.Е., 1994. Байкальская эндемичная амфипода Gmelinoides fasciatus Stebb. в Ладожском озере // Доклады Академии наук. Т. 336. № 2. С. 279–282.
Панов В.Е., Павлов А.М., 1986. Методика количественного учета водных беспозвоночных в зарослях камыша и тростника // Гидробиологический журнал. Т. 22. № 6. С. 87–88.
Полякова Т.Н., 1992. Современное состояние донных сообществ Большой губы Повенецкого залива // Большая губа Повенецкого залива Онежского озера. Петрозаводск. Карельский научный центр РАН. С. 88–98.
Рябинкин А.В., Полякова Т.Н., 2008. Макрозообентос озера и его роль в питании рыб // Биоресурсы Онежского озера. Петрозаводск: Карельский научный центр РАН. С. 67–91.
Сидорова А.И., 2013. Структурно-функциональные характеристики популяции байкальского вселенца Gmelinoides fasciatus Stebbing (Crustacea: Amphipoda) на северной границе ареала (Онежское озеро). Автореф. дис… канд. биол. наук. Петрозаводск: Карельский научный центр РАН. 25 с.
Скальская И.А., 1994. Расселение байкальского бокоплава Gmelinoides fasciatus (Stebbing) в Рыбинском водохранилище // Биология внутренних вод. Информационный бюллетень. № 96. СПб.: Наука. С. 35–40.
Фрейндлинг В.А., 1974. Физико-географическая характеристика северной части Повенецкого залива Онежского озера // Охрана и использование водных ресурсов Карелии. Петрозаводск: Карелия. С. 4–12.
Черепанова Н.С., Георгиев А.П., 2014. Характеристика ихтиофауны и условий среды обитания водоемов Куйто (Карелия) в условиях зарегулирования стока // Вопросы рыболовства. Т. 15. № 3. С. 262–276.
Черепанова Н.С., Широков В.А., Георгиев А.П., 2018. Особенности биологии и промысла леща (Abramis brama L.) в некоторых озерах Республики Карелия // Ученые записки Петрозаводского государственного университета. № 3 (172). С. 97–103.
Черепанова Н.С., Широков В.А., Георгиев А.П., 2018 (б). Особенности биологии и промысла ряпушки (Coregonus albula L.) в некоторых озерах Республики Карелия // Известия Самарского научного центра РАН. Т. 20. № 5. С. 60–70.
Keller R.P., Geist J., Jeschke J.M., Kühn I., 2011. Invasive species in Europe: ecology, status, and policy // Environmental Sciences Europe. V. 23. P. 1–17.
Lobanova A.S., Sidorova A.I., Georgiev A.P., Shustov Yu.A., Alaytsev D.P., 2017. The Role of Invasive Amphipod Gmelonoides fasciatus (Stebbing) in the Feeding of Perch Perca fluviatilis L. in the Littoral Zone of Lake Onega // Russian Journal of Biological Invasions. V. 8. № 3. P. 261–265.
Panov V.E., Alexandrov B., Arbačiauskas K., Binimelis R., Copp G.H. et al., 2010. Risk Assessment of Aquatic Invasive Species Introductions via European Inland Waterways // Atlas of Biodiversity Risk. Sofia: Pensoft. P. 140–143.
Panov V.E., Timm T., Timm H., 2000. Current status of an introduced Baikalian amphipod Gmelinoides fasciatus Stebbing, in the littoral communities of Lake Peipsi // Proceedings of Estonian Academy of Sciences, Biology, Ecology. V. 49. 71–80.
Slepukhina T.D., Belyakova I.V, Chichikalyuk Y.A., Davydova N.N., Frumin G.T., et al., 1996. Bottom sediments and biocoenoses of northern Ladoga and their changes under human impact // Hydrobiology. V. 322. P. 23–28.
Strayer D.L., 2010. Alien species in fresh water: ecological effects, interactions with other stressors, and prospects for the future // Freshwater Biology. V. 55. P. 152–174.
Walther G.R., Roques A., Hulme P.E., Sykes M.T., Pyšek P., et al., 2009. Alien species in a warmer world – risks and opportunities // Trends in Ecology and Evolution. V. 24. P. 686–693.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал