Зоологический журнал, 2019, T. 98, № 7, стр. 725-731
Формирование цестодофауны двух видов куликов рода Calidris в местах гнездовий
А. Н. Пельгунов *
Центр паразитологии Института проблем экологии и эволюции РАН
119071 Москва, Россия
* E-mail: apelgunov@list.ru
Поступила в редакцию 06.06.2018
После доработки 14.01.2019
Принята к публикации 14.01.2019
Аннотация
Проведен экологический анализ изменений цестодофауны двух видов куликов – Calidris minuta Leisler 1812 (кулик-воробей) и C. temminckii Leisler 1812 (белохвостый песочник) – с момента прилета их на места гнездовий (Обская Губа) и до отлета. Исследованные птицы были условно разделены на группы по срокам сбора и по возрасту. Сходство цестодофауны групп куликов по видам цестод рассчитано по индексу общности Чекановского-Съеренсена, по полученным матрицам построены дендрограммы сходства. Проанализированы изменения в видовом составе и структуре сообщества цестод, а также проведено сравнение цестодофауны молодых и взрослых особей.
При организации природоохранных мер важно знать места гнездовий популяций птиц, пролетные пути этих птиц и зимовки. Наряду с методами кольцевания, существенно могут помочь методы, основанные на изучении распространения и сезонной динамики паразитов птиц.
Работа посвящена экологическому анализу изменений цестодофауны двух видов куликов – Calidris minuta Leisler 1812 (кулик-воробей) и C. temminckii Leisler 1812 (белохвостый песочник) – с момента прилета их на места гнездовий и до отлета, сравнению цестодофауны молодых и взрослых птиц.
МАТЕРИАЛ И МЕТОДЫ
Во время работы экспедиции Лаборатории гельминтологии АН СССР летом 1974–1975 гг. в Обской губе был обследован 251 кулик C. minuta и 201 – C. temminckii. Птиц исследовали методом полного гельминтологического вскрытия и найденных у них цестод фиксировали в 70° спирте. В лабораторных условиях цестод окрашивали железным гематоксилином и изготавливали тотальные препараты. Всего обнаружено и обработано 6403 экз. цестод.
Нами были использованы принятые в паразитологии значения – экстенсивность инвазии (ЭИ): отношение количества зараженных птиц к общему количеству исследованных, и индекс обилия (ИО): отношение количества найденных паразитов одного вида к общему количеству обследованных хозяев.
Относительное обилие вида (Р) по количеству особей (по численности) может выражаться в процентах или долях, где общая численность видов равна 100% или 1 ${{P}_{j}} = \frac{{{{n}_{j}}}}{S}$, где: nj – количество экземпляров j-вида; S – общее количество особей всех видов.
Для анализа изменений цестодофауны двух видов песочников в местах гнездовий исследованные птицы были распределены на группы по срокам сбора и по возрасту: ad (лат. adultus) – взрослая особь; subad. (лат. subadultus) – полувзрослая особь, уже летающий птенец. Данные о времени сбора, возрасте и количестве исследованных птиц представлены в табл. 1.
Таблица 1.
Данные об исследованных птицах (группы 1–8)
| Показатель | C. minuta | C. temminckii | ||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| Возраст | ad | ad | ad | subad | ad | ad | ad | subad |
| Сроки сбора | 10.06–30.06 | 01.07–31.07 | 01.08–12.09 | 01.08–12.09 | 10.06–30.06 | 01.07–31.07 | 01.08–12.09 | 01.08–12.09 |
| Количество птиц, экз. | 54 | 95 | 40 | 62 | 51 | 58 | 45 | 47 |
Сходство цестодофауны групп куликов по видам цестод рассчитывали по индексу общности Чекановского-Съеренсена:
где: а – число общих видов в двух сравниваемых списках;b – число видов имеющихся только в первом списке;
с – число видов, имеющихся только во втором списке;
• (a + b) – первый сравниваемый список видов;
• (a + c) – второй сравниваемый список видов.
Индекс общности Чекановского-Съеренсена является одним из самых простых и легко интерпретируемых мер для характеристики парного сходства (Андреев, 1980). В то же время индекс общности Чекановского-Съеренсена как мера относительного сходства линейно связан с мерой абсолютного сходства (Песенко, 1982). На практике такую связь, как правило, считают линейной, что является еще одним доводом в пользу использования именно этого индекса общности.
Для вычисления сходства между списками видов цестод по количественным данным мы использовали индекс общности Чекановского-Съеренсена в количественном выражении (Песенко, 1982).
Вместо обилия вида в этой формуле мы использовали индекс обилия. Это не меняет смысл данного выражения, но уменьшает ошибку из-за разного количества исследованных птиц в каждой группе куликов.
ИОik – индекс обилия вида в k-списке;
min/ИОij × ИОik – меньшее из двух чисел ИОij и ИОik.
Для выделения групп сходных объектов (классификация) и нахождения основных направлений их варьирования мы по полученным матрицам сходства строили дендрограммы, использовав сложение матриц методом ближнего соседа.
Все сообщества характеризуются своим соотношением обилий входящих в них видов. Для определения различий в количестве цестод по видам в разных группах куликов мы использовали показатель – концентрация доминирования по Симпсону, который выражается формулой – $C = \sum\nolimits_{i = 1}^s {P_{i}^{2}} ,$ где: P – относительное обилие каждого вида, то есть – доля каждого вида в общем количестве цестод в данной группе куликов (общее количество цестод принимается за 1).
Для сравнения этих групп куликов по видовому составу мы использовали показатель разнообразия, выражающийся формулой $d = \frac{S}{{\lg N}}$, где: N – показатель учетной площадки (в нашем случае число экземпляров обследованных птиц), а S – количество видов цестод. Количество видов в выборках различного размера для данного сообщества приблизительно пропорционально логарифму площади этих учетных площадок. Поэтому эта зависимость, мера – d, может быть использована для сравнения разнообразия сообществ, проведенных на площадках разного размера, если эти различия не слишком велики (Уиттекер, 1980).
Для характеристики сезонных изменений в структуре цестодофауны использовали относительное обилие видов цестод в каждой группе птиц.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
У C. minuta и C. temminckii было найдено 26 видов цестод (табл. 2).
Таблица 2.
Зараженность цестодами C. minuta и C. temminckkii в местах гнездовий
| № п/п | Виды цестод | C. minuta | C. temminckii | ||||||
|---|---|---|---|---|---|---|---|---|---|
| ad | subad | ad | subad | ||||||
| ЭИ (%) | ИО | ЭИ (%) | ИО | ЭИ (%) | ИО | ЭИ (%) | ИО | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 1 | Anomotaenia anadyrensis Spassky et Konovalov 1963* | 1.06 ± 0.73 | 0.21 ± 0.15 | 3.22 ± 2.25 | 0.10 ± 0.07 | 8.97 ± 2.29 | 0.65 ± 0.18 | 25.5 ± 6.35 | 2.29 ± 0.64 |
| 2 | A. gallinaginis Davies 1938 | – | – | – | – | 2.56 ± 1.26 | 0.03 ± 0.01 | – | – |
| 3 | A. microrhyncha (Krabbe 1869) Cohn 1900* | – | – | – | – | 3.85 ± 1.54 | 0.06 ± 0.03 | 2.12 ± 2.10 | 0.24 ± 0.24 |
| 4 | Arctotaenia tetrabothrioides (Loennberg 1890) Baer 1956 | 3.17 ± 1.28 | 0.82 ± 0.33 | 4.83 ± 2.73 | 0.05 ± 0.03 | – | – | 2.12 ± 2.10 | 0.06 ± 0.06 |
| 5 | Dictymetra nymphaea (Schrank 1790) Spasskaja et Spassky 1971 | 1.59 ± 0.91 | 0.31 ± 0.18 | 1.61 ± 1.59 | 0.02 ± 0.02 | – | – | – | – |
| 6 | Kowalewskiella cingulifera (Krabbe 1869) Lopez-Heyra 1952* | 22.2 ± 3.01 | 1.84 ± 0.28 | – | – | 2.56 ± 1.26 | 0.05 ± 0.03 | – | – |
| 7 | Trichocephaloides birostrata Clerc 1906 | 34.9 ± 3.48 | 2.53 ± 0.28 | 4.83 ± 2.73 | 0.11 ± 0.07 | 0.64 ± 0.64 | 0.01 ± 0.01 | – | – |
| 8 | T. megalocephala (Krabbe 1869) Clerc 1902 | 0.53 ± 0.51 | 0.01 ± 0.01 | 1.61 ± 1.59 | 0.10 ± 0.10 | 0.64 ± 0.64 | 0.01 ± 0.01 | – | – |
| 9 | T. temminckii Belopolskaia 1958* | – | – | – | – | 11.5 ± 2.55 | 1.58 ± 0.27 | 4.25 ± 2.94 | 0.40 ± 0.29 |
| 10 | Lateriporus skrjabini Mathevossian 1946 | 0.53 ± 0.51 | 0.01 ± 0.01 | – | – | – | – | – | – |
| 11 | Aploparaksis bulbocirrus Deblock et Rausch 1968* | 9.00 ± 2.09 | 0.41 ± 0.10 | 11.3 ± 4.05 | 0.48 ± 0.18 | 19.2 ± 3.15 | 1.58 ± 0.27 | 17.0 ± 5.48 | 8.00 ± 2.67 |
| 12 | A. crassirostris (Krabbe 1869) Clerc 1903 | 1.06 ± 0.73 | 0.01 ± 0.01 | – | – | 0.64 ± 0.64 | 0.01 ± 0.01 | – | – |
| 13 | A. diagonalis Spassky et Bobova 1961* | 3.17 ± 1.28 | 0.04 ± 0.02 | 4.83 ± 2.73 | 0.06 ± 0.04 | 6.41 ± 1.96 | 0.38 ± 0.12 | 4.25 ± 2.94 | 0.04 ± 0.03 |
| 14 | A. leonovi Spassky 1961* | 11.6 ± 2.34 | 0.59 ± 0.13 | 9.67 ± 3.79 | 1.00 ± 0.40 | 19.2 ± 3.15 | 7.13 ± 1.25 | 25.5 ± 6.35 | 4.00 ± 1.09 |
| 15 | A. rauschi Webster 1955* | 10.1 ± 2.20 | 0.21 ± 0.05 | 3.22 ± 2.25 | 0.15 ± 0.10 | 3.85 ± 1.54 | 0.21 ± 0.09 | – | – |
| 16 | A. octacantha Spassky 1950* | 3.17 ± 1.28 | 0.09 ± 0.03 | 1.61 ± 1.59 | 0.03 ± 0.03 | 1.28 ± 1.00 | 0.01 ± 0.01 | – | – |
| 17 | A. secessivus Gubanov et Mamaev 1959 | 0.53 ± 0.51 | 0.01 ± 0.01 | – | – | 1.28 ± 1.00 | 0.01 ± 0.01 | – | – |
| 18 | Echinocotyle dubininae (Deblock et Rose 1966) Spasskaja et Spassky 1966* | 0.53 ± 0.51 | 0.21 ± 0.21 | – | – | 38.5 ± 3.90 | 4.06 ± 0.50 | – | – |
| 19 | E. kornyuchini Golovkova 1979* | 7.98 ± 1.98 | 0.86 ± 0.27 | – | – | 3.85 ± 1.54 | 0.19 ± 0.07 | – | – |
| 20 | E. longirostris (Rudolphi 1819) Deblock 1964* | 7.98 ± 1.98 | 0.65 ± 0.18 | – | – | – | – | – | – |
| 21 | E. nitida (Clerc 1902. 1903) Fuhrmann 1932, nec Krabbe 1896* | 59.3 ± 3.58 | 12.2 ± 2.42 | – | – | – | – | – | – |
| 22 | E. tenuis (Clerc 1906)* | 16.9 ± 2.73 | 0.20 ± 0.06 | – | – | – | – | – | – |
| 23 | Echinocotyle sp. n. I | – | – | – | – | 1.92 ± 1.10 | 0.09 ± 0.05 | – | – |
| 24 | Limnolepis amphitricha (Rudolphi 1819) Spassky et Spasskaja 1954 | 0.53 ± 0.51 | 0.01 ± 0.01 | – | – | 0.64 ± 0.64 | 0.08 ± 0.08 | – | – |
| 25 | Monorcholepis dujardini (Krabbe 1869) Oschmarin 1961 | 0.53 ± 0.51 | 0.01 ± 0.01 | – | – | – | – | – | – |
| 26 | Ophryocotyle proteus Friis 1870 | 0.53 ± 0.51 | 0.03 ± 0.03 | – | – | – | – | – | – |
Все найденные цестоды относятся к двум семействам – Dilepididae (Fuhrman 1907) и Hymenolepididae (Ariola 1899).
У C. minuta (ad) было зарегистрировано 23 вида цестод, а у subad – 11; у C. temminckii (ad) – 19 видов цестод, а у subad – 7 видов.
Виды Arctotaenia tetrabothrioides, Trichocephaloides birostrata, Echinocotyle nitida, E. tenuis и E. longirostris встречаются практически только у C. minuta (ad). Виды Anomotaenia microrhyncha, Kowalewskiella cingulifera, Aploparaksis bulbocirrus, A. leonovi, A. rauschi встречаются как у C. temminckii, так и у C. minuta. Но, в то же время, экстенсивность инвазии (ЭИ) и индекс обилия (ИО) K. cingulifera у C. minuta значительно больше, чем у C. temminckii, а ЭИ и ИО A. anadyrensis выше у C. temminckii, чем у C. minuta.
Для цестодофауны молодых птиц обоих видов характерно отсутствие К. cingulifera и всех видов р. Echinocotyle Blanchard 1891. Но эти виды цестод встречались у взрослых птиц, собранных в это же время, и некоторые из них были даже доминирующими в цестодофауне взрослых птиц. Причем, у взрослых птиц в августе–начале сентября встречались и молодые цестоды (цестоды с развивающейся стробилой, без половозрелых члеников) этих видов.
Сравнивая видовой состав цестод у птиц разных групп, можно выделить вид M. dujardini, который встречается только после прилета, и который можно было бы отнести к южным формам. Но этот вид цестод - типичный паразит дроздов, и у куликов не регистрировался ранее. Нами найден у одного C. minuta и одного C. temminckii. Мы считаем, что это случайное заражение, и оно произошло во время весенней миграции. Также можно выделить три вида цестод, которые встречаются с середины лета и осенью – D. nymphaea, A gallinaginis и A tetrabothrioides, которые можно отнести к северным формам.
Первые два вида имеют очень низкую ЭИ у куликов рода Calidris, видимо, основными хозяевами этих двух видов цестод являются другие кулики.
Цестод вида А. tetrabothrioides у C. minuta в июне не регистрировали, в июле их ИО был равен 0.01 ± 0.002, ЭИ – 1.1 ± 0.01%, в августе–начале сентября, соответственно, 3.85 ± 0.4 и 12.5 ± 0.05%. В этот период (август–начало сентября) А. tetrabothrioides зарегистрирован у молодых птиц обоих видов. Цестоды 14 видов встречаются в течение всего периода нахождения куликов в местах гнездовья, и их можно отнести к убиквистам (табл. 2).
Для выявления изменений в структуре цестодофауны в зависимости от сезона года было проведено сравнение относительного обилия видов цестод каждой группы птиц (табл. 3). В таблицу включены данные о цестодах, относительное обилие которых превышает 5% от общего числа цестод, принятого за 100%. Процентное соотношение цестод (относительное обилие) для каждой группы рассчитывалось, исходя из численности цестод этой группы.
Таблица 3.
Относительное обилие видов цестод по группам куликов
| Вид кулика | № группы | Виды цестод* | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 4 | 6 | 7 | 9 | 11 | 13 | 14 | 18 | 19 | 20 | 21 | ||
| C. minuta | 1 | 2.9 | – | 6.8 | 29.0 | – | 2.3 | 0.4 | 6.5 | 2.9 | 0.8 | 3.4 | 42.5 |
| 2 | – | 0.1 | 4.3 | 3.4 | – | 2.5 | 0.2 | 1.0 | – | 7.5 | 4.0 | 70.6 | |
| 3 | – | 17.7 | 20.7 | 3.2 | – | 0.3 | – | 0.9 | – | 2.0 | 0.6 | 52.9 | |
| 4 | 4.6 | 2.3 | – | 5.3 | – | 23.0 | 3.0 | 47.6 | – | – | – | – | |
| C. temminckii | 5 | 4.1 | – | – | 0.1 | 1.1 | 10.5 | 3.7 | 70.3 | 6.8 | 0.2 | – | – |
| 6 | 1.1 | – | 1.1 | – | 1.1 | 3.5 | – | 8.6 | 78.0 | – | – | – | |
| 7 | 7.8 | – | 0.9 | – | 1.3 | 17.0 | 0.4 | 5.3 | 54.0 | 5.8 | – | – | |
| 8 | 15.0 | 0.4 | – | – | 2.3 | 53.0 | – | 27.0 | – | – | – | – | |
* Номера видов цестод соответствуют таковым в табл. 2.
Анализ цестодофауны каждой группы куликов выявил один-два вида цестод, которые являются доминирующими в этих сообществах, и для каждого вида кулика характерны свои виды-доминанты, причем у взрослых и молодых птиц одного вида доминируют разные виды цестод. В цестодофауне C. minuta (ad) (1, 2 и 3) преобладает цестода E. nitida (относительное обилие 42–71%), а в цестодофауне молодых C. minuta (4) – это A. leonovi (39%). В сообществе цестод C. temminckii (ad) в июле (5) – A. bulbocirrus (30%) и E. dubininae (20%), а в июле, августе и начале сентября это – E. dubininae (76% и 55%, соответственно), в цестодофауне молодых C. temminckii (8) – A. bulbocirrus (52%) и A. leonovi (27%).
Также видно, что для цестодофауны обоих видов куликов в июне (1 и 5) характерно более равномерное распределение количества цестод по видам, чем в цестодофауне этих же куликов в другое время. Особенно резкое преобладание одного вида в цестодофауне как у C. minuta, так и у C. temminckii, проявляется в июле, при очень низком относительном обилии других видов цестод (2 и 6). Для того чтобы определить, не связано ли это с уменьшением количества видов, и действительно ли имеются различия в “концентрации” цестод по видам в разных группах, мы использовали два показателя – концентрацию доминирования (С) и меру видового разнообразия (d) (табл. 4).
Таблица 4.
Значения индекса разнообразия и индекса доминирования в цестодофауне исследованных групп куликов
| Пока-затель | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|---|---|---|---|---|---|---|---|---|
| C | 0.28 | 0.52 | 0.36 | 0.30 | 0.17 | 0.59 | 0.35 | 0.38 |
| d | 8.7 | 8.1 | 8.1 | 5.6 | 7.0 | 7.9 | 7.3 | 4.2 |
Наибольшее значение индекса доминирования характерно для цестодофауны куликов 2 и 6 групп (июль, время гнездования). Наименьший показатель для сообщества цестод в группах 1 и 5 (июнь, после прилета). Показатель доминирования в августе – начале сентября (3 и 7 групп) имеет приблизительно среднее значение между показателями этого индекса для цестодофауны в июне и июле. Индекс разнообразия цестодофауны взрослых птиц в местах гнездовий изменяется незначительно, но и он всегда достоверно больше, чем у молодых птиц. Также интересно отметить, что этот показатель несколько выше как для цестодофауны взрослых птиц C. minuta (аd – 1, 2, 3 группы) по сравнению с таковым C. temminckii (аd – 5, 6, 7 группы), так и для сообщества цестод у молодых птиц C. minuta (subad – 4 группа) по сравнению с таковым у молодых C. temminckii (subad – 8 группа).
Используя индекс общности Чекановского-Съеренсена для сравнения списков разных групп куликов, мы получили симметричную матрицу сходства групп куликов по видам цестод.
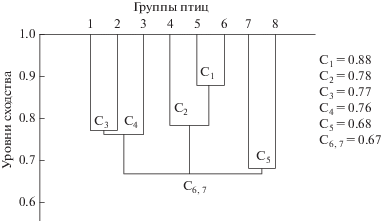
По данным матрицы для выделения групп сходных объектов мы построили дендрограмму 1 (рис. 1).
Из этой дендрограммы видно, что данные группы куликов составляют три “класса” цестодофауны. Первый “класс” – это цестодофауна C. minuta (ad) в июне, июле и августе – начале сентября (1, 2 и 3 группы), соединение этих групп происходит на уровне сходства – С3 = 0.77 и С4 = 0.76. Второй “класс” – цестодофауны взрослых C. temminckii (ad) в июне, июле, августе – начале сентября (5, 6 и 7 группы), присоединение происходит на уровне сходства С1 = 0.88 и С2 = 0.78. Третий “класс” – цестодофауны молодых птиц C. minuta и C. temminckii (4 и 8 группы), присоединение на уровне сходства – С5 = 0.68. Полное соединение цестодофаун всех групп куликов происходит на уровне сходства C6,7 = 0.67. Исходя из выше изложенного, можно считать, что сообщества цестод молодых птиц (4 и 8 группы) являются самостоятельными “классом”.
В результате расчета сходства цестодофаун этих групп куликов с использованием индекса обилия видов цестод, мы получили матрицу – сходство сообществ цестод групп куликов по количественным данным.
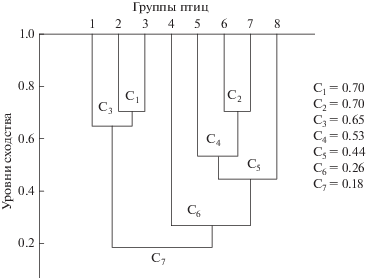
По данным этой матрицы мы построили дендрограмму 2 (рис. 2).
Из этой дендрограммы видно, что цеcтодофауны куликов также группируются в три “класса” – цестодофауна взрослых птиц C. minuta (один “класс”), молодых C. minuta (второй “класс”) и C. temminckii (третий “класс”).
На этой дендрограмме можно проследить порядок образования этих “классов”. Первоначально в “классы” объединяются цестодофауны куликов, обследованных в середине лета и в конце лета–начале осени, по видам куликов (2 группа с 3 и 4 c 7). Потом к этим двум “классам” присоединяются цестодофауны групп куликов, обследованных в начале лета, соответственно по видам (к 2 и 3 группам – 1 группа и к 6 и 7 – 5 группа). Цестодофауна молодых C. temminckii (8 группа) присоединяется к “классу”, образованному цестодофаунами взрослых птиц C. temminckii (аd) (5, 6 и 7 группы) при довольно низком значении индекса сходства – С5 = 0.44. Сообщество цестод молодых птиц C. minuta (4 группа) присоединяют к “классу”, образованному цестодофаунами C. temminckii на очень низком уровне сходства C6 = 0.26. Цестодофауна молодых птиц C. minuta присоединяется к таковой C. temminckii, проявляя больше сходства с цестодофауной белохвостого песочника. Виды цестод, которые составляют цестодофауну молодых птиц, представлены в малом количестве в цестодофауне взрослых C. minuta, но в значительно большем числе в таковой C. temminckii Полное присоединение цестодофаун этих групп куликов происходит на уровне сходства равном C7 = 0.18.
C. minuta и C. temminckii являются наиболее многочисленными видами куликов в данном районе. Эти виды имеют сходную морфологию и биологию и, по-видимому, занимают близкие экологические ниши. На места гнездовий, в тундру, кулики прилетают в начале июня. До середины июля они насиживают яйца, а в конце июля уже появляются летние молодые птицы. Отлет этих куликов на зимовку начинается с середины августа, и к началу сентября птицы практически уже не встречаются в местах гнездовий (Дементьев и др., 1951).
Несмотря на сходную экологию, C. minuta и C. temminckii имеют различную цестодофауну, причем есть виды цестод, которые встречаются только у одного из этих двух видов. Кроме того, ЭИ и ИО цестод, которые встречаются у обоих видов песочников, различны. Следовательно, можно предположить, что питание этих куликов различается, и они занимают разные стации в местах гнездовий. Этот вывод подтверждает анализ сходства цестодофаун групп куликов, как по видовому составу, так и по количественным данным.
По данным Бондаренко и Контримавичуса (2006) в гелъминтофауне молодых куликов чаще, чем у взрослых, встречаются виды паразитов, обладающих специфичностью. В то же время, в гельминтофауне молодых куликов число видов паразитических червей меньше, чем у взрослых. Действительно, цестодофауна молодых птиц сильно отличается от цестодофауны взрослых птиц этого же вида. Так, у молодых птиц обоих видов отсутствуют К. cingulifera и все виды р. Echinocotyle, несмотря на то, что они встречаются, осенью у взрослых птиц, а некоторые из них являются даже доминирующими в их цестодофауне.
ЗАКЛЮЧЕНИЕ
Значительное различие между цестодофауной молодых и взрослых птиц подтверждается анализом сходства цестодофаун групп куликов по видовому составу цестод. Цестодофауна молодых птиц образует “класс”, отдельный от “классов”, образованных цестодофаунами взрослых птиц. Но и сходство цестодофаун молодых птиц проявляется на уровне, который очень близок к уровню полного соединения цестодофаун всех групп куликов.
Видовое разнообразие цестодофауны у взрослых птиц значительно выше, чем у молодых.
Концентрация доминирования наибольшая в цестодофауне куликов во время их гнездового периода (июль) и наименьшая (то есть количество цестод более равномерно распределено по видам) в начале лета (июнь, после прилета). Это вероятно, можно объяснить следующим: во время гнездового периода птицы ограничены в передвижении, как правило, гнездовым участком, и они заражаются в основном наиболее специфическими для них цестодами, в то время как весной и в начале лета они более подвижны, посещают разнообразные стации и поэтому заражаются значительно чаще разными видами цестод. Тот же эффект, по-видимому, проявляется в конце лета – к моменту отлета. В это время птенцы уже на крыле, птицы образуют смешанные стайки, кочуют по различным участкам и поэтому имеют больше возможности заразиться разными видами цестод.
Таким образом, видовой состав цестодофауны двух видов песочников в местах гнездовий является стабильным. Из 26 видов цестод, зарегистрированных у этих куликов, 14 видов встречаются и весной, и осенью (54%); только 3 вида, возможно, являются северными формами (по классификации Догеля, 1962): D. nymphaea, A. gallinaginis, A. tetrabothrioides. В то же время, выявлены значительные изменения в структуре цестодофаун этих видов куликов во время их пребывания в местах гнездовий. Индекс доминирования наибольший у птиц в гнездовой период и наименьший в первое время после прилета с мест зимовок. Цестодофауна молодых птиц отличается от цестодофауны взрослых птиц обоих видов, как по видовому составу, так и по доминирующим видам. Видовое разнообразие меньше у молодых птиц в сравнении со взрослыми. Цестодофауны двух экологически близких видов куликов отличаются как по видовому составу, так и по доминирующим видам. Для цестодофауны взрослых птиц и молодых каждого вида характерен свой доминирующий вид цестод.
Аналогичные данные получили Ситко и Хенеберг (Sitko, Heneberg, 2015), анализируя структуру сообщества гельминтов, паразитирующих у поганок и гагар. Авторы отмечают сильное различие в распространении и интенсивности инвазии на видо-специфическом уровне гельминтов.
В то же время, Амундсон с соавторами (Amundson et al., 2016), исследуя два вида казарок, нашли у них 10 видов гельминтов. Все виды зарегистрированы у обоих видов казарок, в том числе и у молодых птиц. Авторы также указывают, что имеются различия в уровне заражения по видам птиц и возрасту.
Список литературы
Андреев В.Л., 1980. Классификационные построения в экологии и систематике. М.: Наука. 142 с.
Дементьев Г.П., Гладков Н.А., Спангенберг Е.П., 1951. Птицы Советского Союза. Том З. М.: Советская наука. 680 с.
Догель В.А., 1962. Общая паразитология. Л. 242 с.
Бондаренко С.К., Контримавичус В.Л., 2006. Аплопараксиды диких и домашних птиц (Основы цестодологии Т. XIV). М.: Наука. 443 с.
Песенко Ю.А., 1982. Принципы и методы количественного анализа в фаунистических исследованиях. М.: Наука. 228 с.
Уиттекер Р., 1980. Сообщества и экосистемы. М.: Прогресс. 326 с.
Amundson C.L., Traub N.J., Shmith-Herron A.J., Flint P.L., 2016. Helminth community and structure in two species of arctic-breeding waterfowl // International Journal for Parasitolology: Parasites and wildlife. V. 5(3). P. 263–272.
Sitko J., Heneberg P., 2015. Host specifity and seasonality of helminth component communities in central European grebes (Podicipediformes) and looms (Gaviiformes) // Parasitology Internatuional. V. 64 (5). P. 377–388.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал