Зоологический журнал, 2019, T. 98, № 7, стр. 804-818
Хирономиды (Diptera, Chironomidae) донных сообществ соленых рек Приэльтонья: разнообразие, соленостная толерантность, распределение
Т. Д. Зинченко 1, *, Л. В. Головатюк 1, Э. В. Абросимова 1
1 Институт экологии Волжского бассейна РАН
445003 Тольятти, Россия
* E-mail: zinchenko.tdz@yandex.ru
Поступила в редакцию 02.10.2018
После доработки 14.01.2019
Принята к публикации 16.01.2019
Аннотация
Приведены результаты многолетних (2006–2014 гг.) исследований хирономид (Diptera, Chironomidae) в сообществах макрозообентоса 5 соленых рек (Хара, Ланцуг, Большая Саморода, Чернавка, Солянка) бассейна гипергалинного озера Эльтон (Волгоградская обл.). Реки имеют высокий градиент минерализации от 4 до 41.4 г/л и различаются размерами, пространственной динамикой гидролого-гидрохимических и гидрофизических характеристик. В устьевых участках рек минерализация может достигать более 100 г/л. Всего идентифицировано 25 видов и таксонов хирономид. 10 видов и таксонов характерны для рек Солянка и Чернавка с соленостью выше 20 г/л. В разные годы Chironomus aprilinus Meigen 1838, Chironomus salinarius Kieffer 1915 и Cricotopus salinophilus Zinchenko, Makarchenko et Makarchenko 2009 преобладали по численности в реках Чернавка и Солянка, а Tanytarsus kharaensis Zorina et Zinchenko 2009 – в реках Хара и Большая Саморода. В донных сообществах соленых рек хирономиды представлены эврибионтными галотолерантными видами. Их распределение и численность связаны с комплексом гидролого-гидрофизических факторов (степень зарастаемости, температура воды, рН, гранулометрический состав грунтов и др.). Биоразнообразие хирономид тесно коррелирует с минерализацией, тогда как зависимость численности и биомассы хирономид в диапазоне минерализации 6–41.4 г/л не очевидна. Сезонная динамика численности и биомассы хирономид характеризуется пространственной неоднородностью, обусловленной особенностями жизненных циклов массовых видов поливольтинных хирономид.
Внутренние высокоминерализованные водоемы населены своеобразными гидробионтами, устойчивыми к неблагоприятным и изменяющимся условиям окружающей среды. В соленых реках обитают узкоспециализированные и часто эндемичные виды, что позволяет считать экосистемы аридных территорий уязвимыми к внешним воздействиям (Williams, 1987; Moreno et al., 1997). Обычно видовое разнообразие донных сообществ высокоминерализованных систем низкое с преобладанием нескольких толерантных видов, численность которых может быть значительной (Балушкина и др., 2009). Хотя большинство видов Chironomidae обитает в пресных водоемах, немногие из них могут обитать и в воде с высокой соленостью (Parma, Krebs, 1977; Matěna et al., 2016). Среди донных организмов высокоминерализованных рек бассейна гипергалинного оз. Эльтон личинки хирономид преобладают по численности и биомассе (Зинченко, Головатюк, 2010; Зинченко и др., 2017; Zinchenko et al., 2014; Zinchenko et al., 2017). Устьевые участки высокопродуктивных рек Приэльтонья служат местом откорма огромных скоплений пролетных водоплавающих и околоводных видов птиц. Основным компонентом питания птиц служат личинки двукрылых насекомых, среди которых преобладают хирономиды (Касаткина, Шубин, 2012; Сухарев, 2015). В последние годы, в связи с изменением климата (Доклад об особенностях…, 2018), происходит трансформация мезогалинных рек, связанная с их зарастанием высшей водной растительностью и высыханием верхних участков. Отдельные результаты таксономических, гидробиологических, гидролого-гидрохимических исследований бентоценозов рек Приэльтонья изложены ранее в публикациях (Бенинг, Медведева, 1926; Горелов и др., 2006; Гусаков, Гагарин, 2012; Лазарева и др., 2013; Зинченко и др., 2017; Zinchenko et al., 2011, 2017).
Цель работы состоит в изучении многолетней, пространственной и сезонной динамики таксоценоза хирономид при воздействии абиотических факторов в высокоминерализованных реках.
МАТЕРИАЛ И МЕТОДЫ
Характеристика района исследования
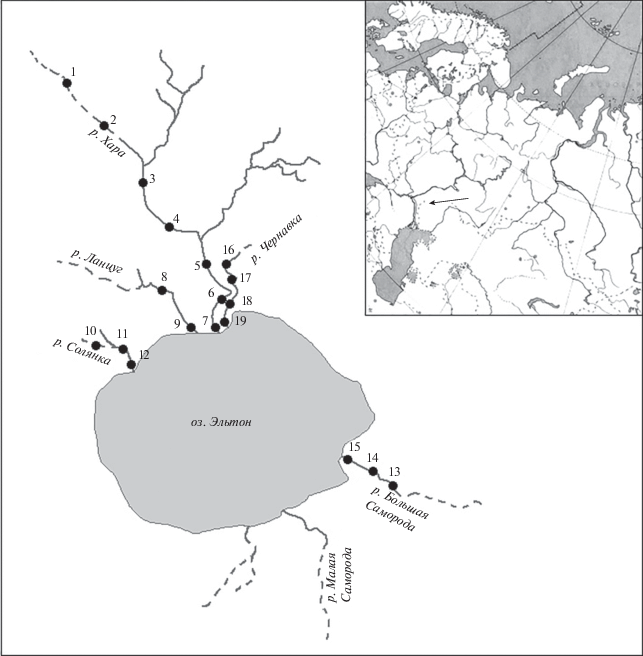
В гидрографическом отношении природно-территориальный комплекс Приэльтонья (49°07′30″ с.ш., 46°30′40″ в.д.) относится к Прикаспийскому бессточному бассейну и отличается слабым развитием речной сети. Для района характерны высокая степень засушливости, дефицит осадков и активный ветровой режим. Температурный режим характеризуется большой амплитудой температур: абсолютный минимум температуры воздуха в январе –36.1°С, абсолютный максимум в августе +41.1°С. Температура воды (в период отбора проб) изменялась от 12 до 33.1°С.
В озеро Эльтон впадает 7 рек (Солянка, Ланцуг, Хара, Чернавка, Большая Саморода, Малая Сморогда, Карантинка), которые относятся к равнинным водотокам с ассиметричными долинами, извилистыми руслами и медленным течением воды (в период исследований скорость течения в реках обычно не превышала 0.01–0.4 м/с, достигая на отдельных участках выхода родников в р. Хара 1.1 м/с). Длина рек варьирует от 3.6 (р. Чернавка) до 47.0 км (р. Хара). Основное русло имеет постоянный поток в среднем и нижнем течении и прерывается в засушливые годы в верхнем течении (рис. 1). Питание рек осуществляется за счет подземных вод и атмосферных осадков. Гидролого-гидрографические и химические показатели рек в значительной мере определяются геологическим строением водосборного бассейна с преобладанием соленосных и карбонатных отложений и, наряду с другими факторами (климат, рельеф, колебания уровня воды и др.), обусловливают разную степень минерализации рек (табл. 1), которая может превышать 40 г/л, а в устьевых участках рек в периоды сгонно-нагонных течений из озера – достигать 100 г/л и более.
Таблица 1.
Гидрологические, гидрофизические и гидрохимические характеристики воды рек Хара, Ланцуг, Чернавка, Солянка, Большая Саморода, впадающих в оз. Эльтон (апрель–сентябрь 2006–2014 гг.)
| Показатель* | Река | ||||
|---|---|---|---|---|---|
| Хара | Ланцуг | Чернавка | Солянка | Б. Саморода | |
| Координаты (верхнее течение) | 49°19′ с.ш. 46°31′ в.д. |
49°13′ с.ш. 46°37′ в.д. |
49°12′ с.ш. 46°40′ в.д. |
49°11′ с.ш. 46°35′ в.д. |
49°06′ с.ш. 46°53′ в.д. |
| Уклон, ‰ | 0.91 | 2.06 | 5.38 | 5.52 | 1.77 |
| Длина, км | 46.4 | 19.9 | 5.2 | 6.7 | 24.3 |
| Глубина, м | 0.05–2.7 | 0.05–1.6 | 0.05–0.5 | 0.05–0.8 | 0.05–7 |
| Площадь водосбора, км2 | 177.0 | 126.0 | 18.4 | 17.8 | 130.0 |
| Скорость течения, м/с | 0.01–1.1 | 0.04–0.23 | 0.05–0.4 | 0.02–0.4 | 0.03–0.25 |
| pH | 6.8–10.0 | 6.9–8.9 | 6.5–8.4 | 6.9–8.4 | 7.4–8.8 |
| О2, мг/л | 3.4–31.3 | 1.8–46.0 | 2.9–33.8 | 2.9–35.0 | 6.2–31.0 |
| Температура воды, °С | 12.0–33.0 | 14.9–33.1 | 12.5–33.1 | 15.1–30.2 | 12.3–31.1 |
| Общая минерализация, г/л | 6.6–41.4 | 4.6–30.0 | 17.2–31.7 | 25.1–29.0 | 4.0–26.3 |
| Na+ + K+, г/л | 1.71–12.31 | 1.19–9.07 | 3.43–10.53 | 7.59–9.41 | 1.12–5.50 |
| Ca2+, г/л | 0.16–1.20 | 0.20–0.80 | 0.30–1.60 | 0.72–1.22 | 0.18–0.60 |
| Mg2+, г/л | 0.15–1.59 | 0.13–1.17 | 0.04–1.22 | 0.51–0.96 | 0.04–2.60 |
| Cl–, г/л | 1.78–22.40 | 2.06–18.64 | 10.24–19.17 | 15.13–17.40 | 1.48–15.98 |
| ${\text{SO}}_{4}^{{2--}}$ , г/л | 1.72–12.11 | 0.55–4.27 | 0.40–0.96 | 0.09–0.84 | 0.41–4.02 |
| ${\text{HCO}}_{3}^{--}$ , г/л | 0.02–3.81 | 0.16–0.44 | 0.21–0.45 | 0.09–0.41 | 0.34–0.72 |
| ${\text{PO}}_{4}^{{3--}}$-P мг/л | 0.003–2.412 | 0.002–2.773 | 0.001–0.250 | 0.007–0.421 | 0.318–1.995 |
| ${\text{NH}}_{4}^{ + }$ -N, мг/л | 0.18–13.31 | 0.42–10.63 | 30.80–45.92 | 13.10–45.30 | 0.18–2.33 |
| ${\text{NO}}_{3}^{--}$ -N мг/л | 0.01–2.14 | 0.01–1.13 | 0.14–2.38 | 0.39–6.58 | 0.06–1.06 |
| БО, мг/л | 15.0–18.0 | 31.0–32.0 | 22.0–26.0 | 16.0–32.0 | 20.0–24.0 |
| Fe, мг/л | 0.22–13.0 | 0.4–2.6 | 0.32–1.35 | 0.27–0.78 | 0.1–3.87 |
| Хлорофилл “а” мг/л** | 23.4–341.0 | 10.5–220.0 | 20.0–221.0 | 4.7–341.0 | 4.5–49.8 |
| Тип грунта | С, П, Ч | Р, С, Ч | С, Ч, П | С, П | С, П, Ч, Р |
Примечание. *Аналитическая обработка гидрохимических образцов воды произведена аккредитованной гидрохимической лабораторией ООО “Центр мониторинга водной и геологической среды” г. Самара. БО – бихроматная окисляемость; показаны пределы колебаний факторов. Грунт: С – серый ил, Ч – черный ил, Р – растительные остатки, П – песок. ** данные за август по: Номоконова и др., 2013 г.
По соотношению главных анионов преобладают хлоридно-сульфатные воды; а по составу катионов основу минерализации составляет натриевая, натрий-магниевая и магниевая группы (табл. 1). Содержание общего фосфора и минерального азота характерны для вод эвтрофного типа (Номоконова и др., 2013).
В верхнем и среднем течении реки зарастают высшей водной растительностью. Площади покрытия тростником Phragmites australis (Cav. 1799) в среднем течении рек составляют ~90%. Прибрежная полоса на отдельных участках характеризуется развитием зеленой водоросли Enteromorpha intestinalis (L.). Nees 1820. В устьевых участках, свободных от зарослей макрофитов, погруженные слои циано-бактериальных матов, представляющие первичные устойчивые нижние слои субстрата, составляют до 30–70% площади биотопа. Грунты представлены в основном заиленным песком, черными и серыми илами (табл. 1).
Сбор образцов макрозообентоса осуществлялся в реках Хара, Ланцуг, Чернавка, Солянка, Большая Саморода в разные месяцы 2006–2014 гг. (апрель 2007 г., сентябрь 2008 г., май 2011, 2013, 2014 гг.; июль 2011 г.; август 2006–2014 гг., май–декабрь, 2013). Образцы бентоса отбирали на 19 станциях (рис. 1) в среднем течении и устьевом участке пяти соленых рек. В связи с периодическим отсутствием стока в верхнем течении рек отбор проб на станциях 1, 2, 10, 13, 16 осуществляли только в 2006 и 2007 гг. Сезонная динамика численности и биомассы личинок отдельных видов хирономид изучалась нами с мая по декабрь 2013 г. в среднем и нижнем течении (станции 14, 15) мезогалинной реки Большая Саморода.
Отбор проб осуществляли в прибрежье и медиали рек с использованием гидробиологического скребка и штангового дночерпателя Экмана-Берджи (1/400 м2 по 8 подъемов на каждой станции) с последующими промыванием грунта через капроновое сито (размер ячеи 300–333 мкм), фиксацией 4% раствором формальдегида и дальнейшей разборкой под бинокулярным микроскопом (Zinchenko et al., 2014). Массив данных включает 238 количественных образцов грунта. Методы сбора и обработки материала, перечень публикаций, использованных при определении видового состава хирономид и других таксонов, приведены ранее (Зинченко, 2011; Zinchenko et al., 2011, Zinchenko et al., 2014).
Соленость определяли портативным рефрактометром ATAGOATC-S/Mill-E. Температуру воды при сезонных отборах проб измеряли в течение суток с помощью термометра WTW, MultiLine (Multi 3410 SET 5). Амплитуда суточной температуры воды в реках с глубиной до 90 см (в августе) составила 5–7°С.
Камеральную обработку с последующим микроскопированием отобранных хирономид проводили согласно общепринятым методам (Методика изучения…, 1975; Методические рекомендации…, 1983; Шилова, 1976). Идентификация хирономид на всех фазах метаморфоза произведена путем выведения имаго в лабораторных условиях. В полевых условиях фиксировали сроки вылета имаго из куколок и зрелых личинок. Сборы имаго хирономид осуществляли энтомологическим сачком. Из кладок отдельных видов, отложенных комарами, получали личинок в лаборатории экологии малых рек Института экологии Волжского бассейна РАН с последующим выращиванием их в бюксах или малых аквариумах в течение 2–3 недель в воде и субстрате, привезенными из соленых рек, при соответствующей исходному водоему температуре воды. В список видов включены данные сборов хирономид на всех станциях за период исследований. Идентификация отдельных видов хирономид проведена в лаборатории Федерального научного центра биоразнообразия наземной биоты Восточной Азии Дальневосточного отделения РАН. Некоторые экологические характеристики хирономид, в том числе и новых для науки видов, представлены в публикациях (Зорина, Зинченко, 2009; Зинченко и др., 2009; Макарченко, Головатюк, 2010; Zinchenko et al., 2014).
Для характеристики ценоза хирономид в составе донных сообществ использовали: число видов, численность (экз./м2), биомассу (г/м2), встречаемость видов и таксонов (%), индекс видового разнообразия Шеннона.
Для анализа взаимосвязи между популяционной плотностью видов хирономид и факторами среды использован метод прямого градиентного анализа (Canonical Correspondence Analysis – ССА) (Ter Braak, 1986; Legendre, Legendre, 2012). Метод позволяет одновременно расположить в многомерном пространстве станций наблюдения гидрохимические параметры показателей обилия видов, связывающие изменчивость видовой структуры хирономид с факторами внешних воздействий: минерализацией воды с учетом ионного состава ${\text{SO}}_{4}^{{2--}}$, Cl–, ${\text{NH}}_{4}^{ + },$ ${\text{PO}}_{4}^{{3--}},$ Pобщ, Т °С воды, содержанием О2, рН, степенью зарастаемости участков макрофитами, скоростью течения, глубиной, гранулометрическим составом грунтов. Статистическая взаимосвязь между пространственным распределением видов хирономид и факторами среды выполнена методом многомерной ординации (Джонгман и др., 1999; Шитиков и др., 2012).
Статистическая обработка данных проводилась с использованием электронных таблиц Microsoft Exсel и пакета программ Canoсo 4.5.
РЕЗУЛЬТАТЫ
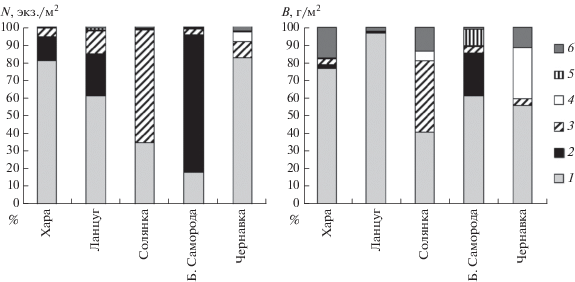
Таксономический состав хирономидофауны. В составе донных сообществ рек Приэльтонья установлен 91 таксон макрозообентоса. По видовому богатству преобладают Insecta – 68 видов и таксонов (Зинченко и др., 2017). Diptera представлены 41 таксоном, из которых 25 составляют сем. Chironomidae. Их доля в общей численности и биомассе бентоса за период исследований рек достигала 18–99% (рис. 2). Впервые, в сравнении с литературными сведениями (Горелов и др., 2006), в соленых реках выявлено 13 видов и таксонов хирономид, включая и новые для науки виды (Зинченко и др., 2009; Зорина, Зинченко, 2009).
Рис. 2.
Соотношение численности (N) и биомассы (B) личинок хирономид в составе донных сообществ в реках Хара, Ланцуг, Солянка, Большая Саморода и Чернавка за период исследований (2006-2014 гг.): 1 – Chironomidae, 2 – Oligochaeta, 3 – Ceratopogonidae, 4 – Coleoptera, 5 – Amphipoda, 6 – прочие.
Таксономический состав хирономидофауны существенно различается в реках с разной соленостью (табл. 2), изменяясь от 12–20 видов в мезогалинных реках (Хара, Ланцуг, Большая Саморода) до 2–3 видов в полигалинных реках (Солянка, Чернавка). С встречаемостью более 30% (табл. 2) в мезогалинных реках обитают виды Cricotopus salinophilus Zinchenko, Makarchenko et Makarchenko, 2009 (34.6–67.4%) и Chironomus salinarius Kieffer, 1915 (30.8–55.8%), а в полигалинных реках исключительно высока встречаемость C. salinophilus (96.2–97.5%). В разные годы преобладающими по численности в реках с минерализацией до 16 г/л (реки Хара, Ланцуг, Б. Саморода) могут становиться галотолерантные хирономиды Tanytarsus kharaensis Zorina et Zinchenko, 2009, Chironomus aprilinus Meigen, 1838, Ch. salinarius, C. salinophilus, Cricotopus gr. sylvestris. В реках с соленостью выше 26 г/л массовыми в отдельные годы были галофильные C. salinophilus и эвригалинные Ch. salinarius (Зинченко, Головатюк, 2010; Зинченко и др., 2017). Уровень минерализации, который обеспечивает устойчивое обитание большинства хирономид в соленых реках, составляет 4.0–41.4 г/л. Однако отдельные виды, такие как C. salinophilus, встречаются в зоне река-озеро при солености более 100 г/л. Личинки Cricotopus (С.) caducus Hirvenoja, 1973, Dicrotendipes notatus (Meigen, 1818), Paratanytarsus sp. отмечены только в р. Хара; Glyptotendipes glaucus (Meigen, 1818), Corynoneura sp., Cricotopus (С.) ornatus (Meigen, 1818), Parasmittia sp. характерны для бентоса р. Ланцуг (табл. 2). Имаго Paratanytarsus sp., пойманные при кошении травы в прибрежье р. Хара, были идентифицированы как Paratanytarsus inopertus (Walker, 1856); одновременно были найдены единичные представители Procladius sp. и Psectrocladius sp.
Таблица 2.
Таксономический состав, частота встречаемости (для каждой реки в %) и максимальная соленость (г/л), при которой личинки хирономид обитают в реках бассейна оз. Эльтон (апрель 2007 г., сентябрь 2008 г., май 2011 г., 2014; июль 2011 г.; август 2006–2013 гг., май–декабрь 2013, август 2014) (n = 282)
| Код | Таксон | Река | Соленость, г/л (max) |
||||
|---|---|---|---|---|---|---|---|
| Хара n = 68 |
Ланцуг n = 44 |
Большая Саморода n = 59 |
Чернавка n = 39 | Солянка n = 28 |
|||
| Chironomidae | |||||||
| ChCor.p | Corynoneura sp. | – | 4.7 | – | – | – | 7.5 |
| ChCri.c | Cricotopus (С.) caducus Hirvenoja 1973* | 3.0 | – | – | – | – | 19.0 |
| ChCri.o | Cricotopus (С.) ornatus (Meigen 1818)* | – | – | 51.9 | – | – | 16.1 |
| ChCri.f | Cricotopus salinophilus Zinchenko, Makarchenko et Makarchenko 2009* | 53.0 | 67.4 | 34.6 | 97.5 | 96.2 | 31.7 |
| ChCri.s | Cricotopus gr. sylvestris | 31.8 | 32.6 | 23.1 | – | – | 28.6 |
| ChCri.p | Cricotopus sp. | 15.2 | 14.0 | 7.7 | – | – | 14.0 |
| ChGly.g | Glyptotendipes glaucus (Meigen 1818)* | – | 4.7 | – | – | – | 14.4 |
| ChGly.p | Glyptotendipes paripes (Edwards 1929)* | 3.0 | 7.0 | 1.9 | – | – | 14.4 |
| ChGly.s | Glyptotendipes salinus Michailova 1987* | 34.8 | 32.6 | 40.4 | – | 3.8 | 28.6 |
| ChChi.a | Chironomus aprilinus Meigen 1838* | 34.8 | 34.9 | 21.2 | – | – | 16.9 |
| ChChi.p | Chironomus gr. plumosus | 12.1 | 16.3 | 7.7 | – | – | 9.6 |
| ChChi.s | Chironomus salinarius Kieffer 1915* | 48.5 | 55.8 | 30.8 | 40 | 30.8 | 41.1 |
| ChCld.l | Cladopelma gr. lateralis | 4.5 | 4.7 | – | – | – | 14.0 |
| ChCld.m | Cladotanytarsus gr. mancus | 4.5 | – | 1.9 | – | – | 21.1 |
| ChDic.n | Dicrotendipes notatus (Meigen 1818)* | 3.0 | – | – | – | – | 21.1 |
| ChMch.d | Microchironomus deribae (Freeman 1957)* | 25.8 | 27.9 | 40.4 | – | – | 28.6 |
| ChPtt.i | Paratanytarsus inopertus (Walker 1856)* | 3.0 | 4.7 | – | – | – | 13.1 |
| ChPtt.p | Paratanytarsus sp. | – | 9.3 | – | – | – | 7.5 |
| ChPas.p | Parasmittia sp. | – | 2.3 | – | – | – | |
| ChPol.n | Polypedilum (P.) nubeculosum (Meigen 1804) | – | 2.3 | – | – | – | 7.5 |
| ChPrc.p | Procladius sp. | – | 4.7 | – | – | – | 6.4 |
| ChPse.p | Psectrocladius sp. | 1.5 | – | – | – | – | 21.1 |
| ChTan.p | Tanypus punctipennis Meigen 1818* | – | 4.7 | – | – | – | 6.8 |
| ChTar.k | Tanytarsus kharaensis Zorina et Zinchenko 2009* | 33.3 | 7.0 | 46.2 | – | – | 16.7 |
| ChTar.p | Tanytarsus sp. | 1.5 | 4.7 | – | – | – | 7.5 |
| Всего | 16 | 20 | 12 | 2 | 3 | ||
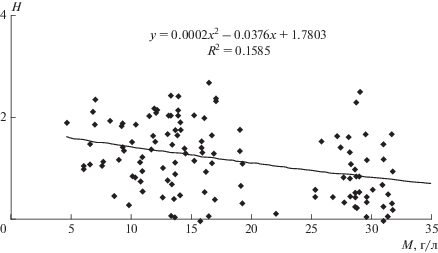
Индекс видового разнообразия Шеннона для хирономид варьировал от 0.06 до 2.7 бит/экз. (рис. 3). Низкие значения разнообразия (0.05 бит/экз.) характерны для ценоза хирономид верхнего течения р. Чернавка (август 2011 г.), а максимальные (2.5–2.7 бит/экз.) – для устьевого участка рек Солянка и Ланцуг (август 2006, 2012 гг.). Снижение видового разнообразия регистрируется при солености выше 20 г/л. Между значениями индекса Шеннона и минерализацией (рис. 3) существует статистически значимая обратно-пропорциональная зависимость (F = 11,96, p ≅ 0).
Рис. 3.
Взаимосвязь между значениями индекса Шеннона (H бит/экз.) и минерализацией воды (M) в соленых реках (2006–2014 гг.).
Соленостная толерантность. Наибольшая устойчивость к солености характерна для хирономид из подсемейств Chironominae (до 41.1 г/л) и Orthocladiinae (до 31.6 г/л), тогда как Tanypodinae зарегистрированы при солености не более 6.8 г/л (табл. 2). В период исследований C. salinophilus и T. kharaensis были массовыми при солености 31.6 и 16.7 г/л соответственно (Зорина, Зинченко, 2009; Зинченко и др., 2009). Эвригалинные личинки Ch. salinarius в реках бассейна оз. Эльтон зарегистрированы при солености, не превышающей 41.1 г/л. В то же время, личинки C. caducus найдены исключительно в зарослях тростника Phragmites australis проточного участка реки Хара при солености 3 г/л. В реке Б. Саморода обитание Cricotopus (С.) ornatus характерно для заросших участков среднего течения реки (16.1 г/л).
Уровень минерализации является определяющим фактором для формирования видового богатства донных сообществ, что особенно характерно для устьевых участков рек (Зинченко, Головатюк, 2013). Галотолерантность хирономид C. salinophilus проявляется весенними пиками численности, отмеченными в устье рек Хара и Чернавка при солености 14 и 32.7 г/л. Массовые вспышки развития T. kharaensis зарегистрированы обычно в августе в низовьях р. Хара при солености выше 16 г/л. При увеличении солености в летний период в устье р. Б. Саморода высокую плотность демонстрируют хирономиды M. deribae (Freeman, 1957), а в устье р. Чернавка – эвригалинные Ch. salinarius и галофильные C. salinophilus.
Межгодовая изменчивость численности и биомассы хирономид (2006–2014 гг.). Плотность личинок эвригалинных видов хирономид в разные годы варьирует в широких пределах (рис. 4). Межгодовая изменчивость состояния донных сообществ определяется, как правило, массовыми “вспышками” численности отдельных видов хирономид и других двукрылых. Так, в среднем течении р. Ланцуг (май 2011 г.) при минерализации 7.5 г/л максимальная численность хирономид в макрозообентосе составила 598.4 тыс. экз./м2, при высокой биомассе – 128 г/м2 за счет личинок эврибионтных хирономид Paratanytarsus sp. (243 тыс. экз./м2) и C. gr. sylvestris (227.2 тыс. экз./м2). В растительных сообществах Enteromorpha intestinalis в мае 2011 г. в реке Б. Саморода численность Сh. salinarius составила 28 тыс. экз./кг сырой массы, а в реке Солянка плотность C. salinophilus достигала 417 тыс. экз./кг сырой массы. В зарослях тростника в реке Б. Саморода в мае 2011 г. численность Glyptotendipes salinus Michailova, 1987 составила 80.6 тыс. экз./кг сырой массы.
Рис. 4.
Многолетняя динамика численности (N, экз./м2) и биомассы (B, г/м2) хирономид в донных сообществах соленых рек в мае (I) и августе (II) на участках среднего (A) и нижнего (D) течения рек. Реки: Х – Хара, Л – Ланцуг, С – Солянка, БС – Большая Саморода, Ч – Чернавка.
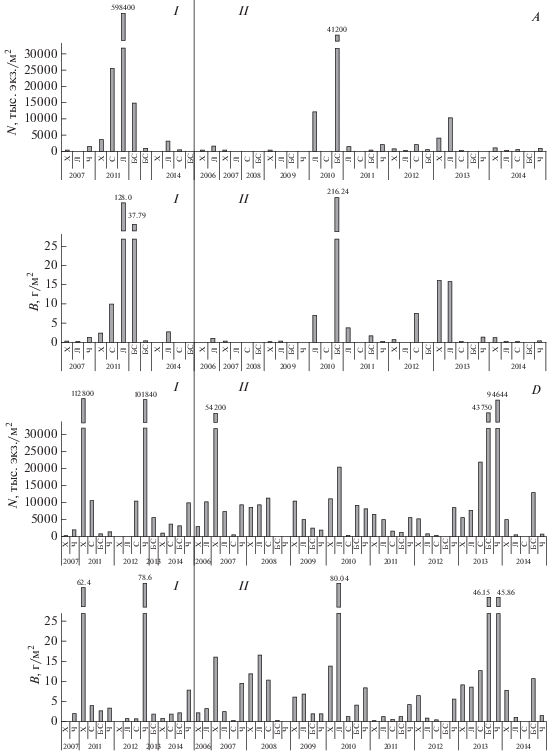
При увеличении солености до 16.9 г/л в августе 2010 г. в бентосе среднего течения р. Ланцуг на песчано-заиленных биотопах развитие получили хирономиды Сh. salinarius (19.0 тыс. экз./м2), а в р. Б. Саморода при солености 10.9 г/л доля галофильных хирономид Glyptotendipes salinus среди заиленной растительности составила 38.4 тыс. экз./м2.
В устьевых участках рек особенностью бентоса является развитие в отдельные годы монодоминантных сообществ хирономид C. salinophilus, доля которых в общей численности при солености 17.6 г/л может достигать 88.8% (рис. 4С, 4D). Высокая плотность бентоса в устье рек Хара (станция 7) и Чернавка (станция 19) отмечена в мае 2011, 2012 гг. за счет развития личинок C. salinophilus при солености 14 и 32.7 г/л (112.8 и 101.8 тыс. экз./м2 соответственно). Летние подъемы численности (рис. 4II) регистрируются в августе 2007 г. в р. Хара, когда массовыми были хирономиды T. kharaensis (28.6 тыс. экз./м2); в 2013 г. в р. Б. Саморода – хирономиды M. deribae (16.0 тыс. экз./м2). В 2013 г. численность бентоса в устье р. Чернавка достигла 94.6 тыс. экз./м2 за счет Ch. salinarius и C. salinophilus. Максимальная численность личинок Ch. aprilinus 4.0 тыс. экз./м2 с биомассой 13.6 г/м2 была зарегистрирована в р. Хара (13.08.2013 г.) при солености 11.7 г/л.
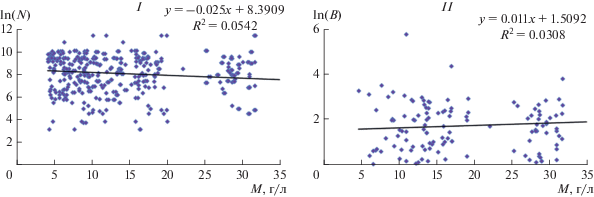
В разные годы величины численности и биомассы хирономид на станциях среднего и нижнего течения в мезогалинных реках Хара, Ланцуг и Б. Саморода могут отличаться в 40–108 раз, а в полигалинных рек Чернавка, Солянка – в 70–220 раз. В этих условиях статистическая связь численности (ln N) и биомассы (ln B) хирономид с уровнем минерализации (рис. 5) оказалась не выраженной (F = 22.64, p ≅ 0).
Рис. 5.
Взаимосвязь между численностью (I, Ln(N)), биомассой (II, Ln(B)) хирономид и минерализацией воды (M) в реках (2006–2014 гг.).
Пространственная и сезонная динамика численности и биомассы хирономид показана на примере распределения личинок в среднем и нижнем течении р. Б. Саморода с мая по декабрь месяц в 2013 г. Станции отбора проб (14, 15) отличаются степенью зарастаемости, скоростью течения, глубиной, величинами рН, минерализации, характером биотопа, гранулометрическим составом грунта и др.
В среднем течении реки Б. Саморода (станция 14) в течение весенне-летнего периода зарегистрировано 7 единично встречающихся видов и личиночных форм хирономид: Ch. plumosus, C. ornatus, C. salinophilus, Cricotopus sp., G. salinus, M. deribae, T. kharaensis (рис. 6). Они обитали при солености 6–11 г/л и температуре воды 23–26°С. Личинки Сh. salinarius на станции 14 в 2013 г. отсутствовали. При зарастании тростником участка реки среднего течения до 50–70%, доминирующими в донных сообществах становились гаммариды Gammarus lacustris Sars, 1863 и олигохеты Limnodrilus profundicola (Verril, 1871). Частота встречаемости хирономид в среднем течении реки в 2013 г. составила для всех видов 10–15% при значительном снижении плотности ранее доминировавших хирономид Сh. salinarius и личинок C. ornatus.
Рис. 6.
Сезонная динамика численности (N, экз./м2) и биомассы (B, г/м2) хирономид на станциях среднего (станция 14) и нижнего (станция 15) течения реки Б. Саморода: ср – численность и биомасса личинок хирономид в среднем течении; I – Ch. salinarius, II – C. salinophilus, III – T. kharaensis, IV – M. deribae, V – C. sylvestris, VI – G. salinus. Стрелками указаны вылеты имаго хирономид.
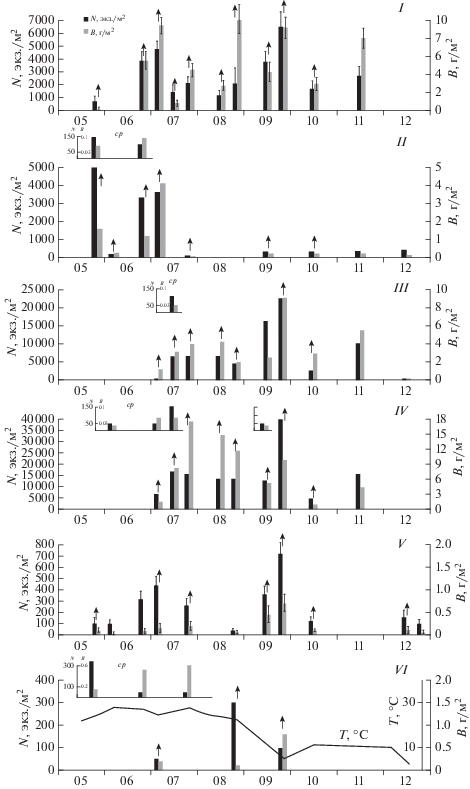
В устьевом участке реки (станция 15) в мае–декабре ценоз хирономид представлен семью галофильными и эвригалинными видами: Сh. salinarius, C. salinophilus, C. sylvesrtis, G. salinus, M. deribae, T. kharaensis, C. ornatus. Частота встречаемости хирономид в нижнем течении реки превышала 87%. Преобладающими по численности были галофильные M. deribae и T. kharaensis (рис. 6). Например, 28 сентября численность M. deribae достигала 37 300 экз./м2, а T. kharaensis – 23 300 экз./м2.
Далее мы акцентируем внимание на сезонной динамике численности и биомассы наиболее массовых хирономид (Сh. salinarius, C. salinophilus, M. deribae, T. kharaensis G. salinus), обитающих в медиали и прибрежье устьевого участка реки Б. Саморода при солености 6–27 г/л (рис. 6).
Численность эвригалинных Сh. salinarius в устьевом участке в течение сезона варьировала от 1 до 7 тыс. экз./м2 с биомассой 1–10 г/м2. В летне-осенний период при температуре воды не ниже 10°С зарегистрировано 5–6 пиков численности и биомассы личинок в популяции Сh. salinarius (рис. 6I) Эффективной температурой развития хирономид р. Chironomus считается +14°С (Константинов, 1961), отмеченная нами в конце мая, когда зарегистрирован первый вылет имаго зимующей генерации Сh. salinarius. Следствием поливольтинности хирономид является растянутый вылет имаго (куколки и имаго регистрировались в течение года, а с 13 по 25 августа вылет имаго был ежедневным и в р. Хара) и короткий жизненный цикл, подтвержденный результатами полевых исследований (рис. 6). Критическая для развития хирономид температура 2–3°С, установленная в ходе полевых исследований, отмечена нами 19 декабря.
Массовое развитие зрелых личинок первого весеннего и летнего поколений C. salinophilus зарегистрировано в мае – начале июля при солености 7–9 г/л и температуре не ниже 25–28°С. Весенне-летние пики численности и биомассы (4950 экз./м2, 4 г/м2) были значительно выше осенних (рис. 6II). Можно констатировать наличие зимующего поколения личинок IV возраста C. salinophilus в заилено-песчаных субстратах устьевого участка реки. В разные годы при крайне высокой динамичности климатических факторов и минерализации (Зинченко и др., 2010) число генераций C. salinophilus в соленых реках может варьировать от 5 до 7.
Ярко выраженная поливольтинность популяций хирономид M. deribae, T. kharaensis отмечена также на заиленно-песчанистых грунтах станций нижнего течении р. Б. Саморода (станция 15). Осенние вылеты имаго регистрируются в сентябре при резком снижении температуры воды до 5–10°С. Анализируя возрастной состав популяций, можно констатировать, что массовое развитие молоди происходит в летне-осенний период (рис. 6II, 6III). Вылет имаго происходит с интервалом примерно в 15–18 дней. Отмечаются достаточно синхронные летне-осенние пики численности и биомассы личинок этих видов.
В отличие от M. deribae и T. kharaensis, в популяции G. salinus в устьевом участке реки отмечено три пика вылета имаго (июль–август) при солености 16.1 г/л. Численность личинок в среднем течении, как и других видов хирономид, в мае–июле при солености 5–6 г/л не превышала 100–300 экз./м2 с биомассой 0.2–0.6 г/м2.
Итак, сезонная динамика развития популяций массовых поливольтинных видов обусловлена в значительной степени изменениями условий обитания в соленых реках и градиентом минерализации. Виды устьевого участка р. Б. Саморода – это таксоны-резиденты, то есть постоянные для региона виды, представленные самоподдерживающимися популяциями.
ОБСУЖДЕНИЕ
В достаточно обширной литературе галофильные личинки Diptera в большинстве случаев не определены до вида, хотя изменение солености влияет именно на распределение видов (Sutcliffe, 1960; Parma, Krebs 1977; Vlasblom et al., 1977; Healy, 1997). Идентификация нами массовых видов Chironomidae в значительной мере позволила избежать ошибок при оценке разнообразия и особенностей биологии видов в соленых реках (Зинченко, 2011; Orel et al., 2014).
Высокое видовое богатство хирономид и экологические особенности популяций делают их удобным объектом изучения (Зинченко, 2011; Rosenberg, Resh, 1993; Matěna et al., 2016). Несмотря на то, что виды, обитающие в реках с высоким градиентом минерализации, имеют низкую толерантность к отдельным факторам среды (Kefford et al., 2004), их эвригалинность обеспечивает достаточно устойчивое многолетнее разнообразие донных сообществ в соленых реках (Зинченко и др., 2017). Отличительной особенностью сообществ бентоса рек аридных территорий являются их пространственно-временные и структурно-функциональные изменения в экстремальных условиях (Dimitriadis, Cranston, 2007; Spaccesi, Capı´tulo, 2009), что приводит к постоянной перестройке гидроэкосистемы при градиенте солености. Представители семейства Chironomidae в мезо- и полигалинных реках Приэльтонья достигают значительного фаунистического разнообразия (Зинченко, Головатюк, 2010; Zinchenko et al., 2017), что характерно и для других аридных регионов (Hart et al., 1991; Velasco et al., 2006). Зарегистрированные в соленых реках Приэльтонья Ch. aprilinus, совместно с C. salinarius и M. deribae, толерантны к широкому спектру солености. Есть несколько сообщений о том, что Ch. aprilinus обитает при солености 5–29‰ (Thienemann, 1954; Yadav, 2003). Ch. salinarius обитает в прибрежных лагунах, морях и озерах при солености от 6 до 80 г/л (Истомина и др., 2012; Koskinen, 1968; Kawai et al., 2000; Suemoto et al., 2004; Ree, Yum, 2006; Gascon et al., 2007; Ponti et al., 2007; Marchini et al., 2008). Виды родов Cricotopus, Tanytarsus, Paratanytarsus, Chironomus, Procladius, Cladotanytarsus в эксперименте выдерживают соленость в диапазоне 16.1–53.8 г/л (Rutherford, Kefford, 2005; Cartier et al., 2011). Высокую толерантность к солености проявляют отдельные виды из родов Procladius Scuse 1889; Cricotopus Van der Vulp 1874; Halocladius Hirvenoja 1973; Nanocladius Kieffer 1913; Semiocladius Sublette & Wirth 1980; Chironomus Meigen 1803; Tanytarsus Van der Vulp 1874; Cladotanytarsus Kieffer 1921; Dicrotendipes Kieffer 1913; Parachironomus Lenz 1921 и др., обитающие в условиях мезогалинных соленостных градиентов (Dimitriadis, Cranston, 2007).
В соленых реках минерализация является одним из основных компонентов, от которого зависит существование отдельных видов (Шмидт-Ниельсен, 1982; Hart et al., 1991; Williams, Williams, 1998; Pinder et al., 2005; Velasco et al., 2006; Zinchenko, Golovatyuk, 2013). При этом, согласно нашим данным, в диапазоне мезо- и полигалинных эвтрофных вод соленость не является основным фактором, лимитирующим количество видов и их разнообразие (Zinchenko et al., 2017). Например, отдельные виды двукрылых C. salinophilus, Palpomyia schmidti) встречаются в разные годы исследований и при солености более 100 г/л в периоды нагона соленых вод в реки из оз. Эльтон.
Результаты анализа многолетней межгодовой динамики макрозообентоса в соленых реках свидетельствует о том, что хирономиды успешно адаптируются к значительной гидрологической изменчивости и экстремально высокой минерализации.
Несмотря на довольно значительный диапазон соленостной устойчивости хирономид, необходимо учитывать и рассматривать и другие абиотические и биотические факторы, которые могут влиять на гидробионтов (Ward, 1992; Velasco et al., 2006). Методы прямой ординации (Джонгман и др., 1999; Goodall, 1954) позволяют отобразить изменение видового состава ценоза хирономид вдоль градиента факторов водной среды: рН, температуры воды, содержания кислорода, ионного и катионного состава воды, степени зарастаемости, мутности, глубины, гранулометрического состава грунтов, содержания биогенов и др.
Анализ ординационной диаграммы (рис. 7) позволил выявить формирование группы эвригалинных видов C. gr. sylvestris (Ch.Cri.s), G. paripes (ChGly.p), C. ornatus (Ch.Cri.o) при достаточно низкой минерализации 3–6 г/л (левый квадрант; реки Хара, Большая Саморода, Ланцуг) и их сопряженность с гидролого-гидрохимическими факторами (векторы R, H, Робщ, рH, SO4). Высокая продуктивность рек обусловливает массовое развитие видов G. paripes (ChGly.p), G. salinus (ChGly.s), T. kharаensis (ChTar.k). Некоторые виды хирономид имеют связь с pH и содержанием в воде сульфат-ионов – M. deribae (ChMch.d), T. kharaensis (ChTar.k) и др. (рис. 7). Статистическая взаимосвязь каждого из перечисленных факторов с популяционной плотностью оценивается при проецировании каждого вида на вектор параметра среды. В правой части обособился комплекс галофильных видов, с преобладанием C. salinophilus (ChCri.f) и C. salinaruis (Ch.Chi.s), для которых характерна статистически значимая взаимосвязь с температурой воды, содержанием кислорода и гранулометрическим составом грунта. В состав этого комплекса в разные сезоны входят виды, характерные в основном для рек Чернавка и Солянка. В отдельные годы, например, в 2006–2007 гг., нами была отмечена тесная корреляция обилия эфемерных хирономид D. notatus в р. Хара с высокой концентрацией кислорода. Для ряда галофильных видов родов Chironomus, Tanytarsus и Cricotopus изменение концентрации кислорода в придонных горизонтах не являлось средообразующим фактором. Для всего массива данных не выявлена четкая взаимосвязь популяционной плотности с факторами среды таких эврибионтных таксонов, как Cricotopus sp. (ChCri.p), C. gr. lateralis (ChCld.l) и др., хотя для отдельных рек (Хара) удаётся выделить экологический оптимум, связанный с более высоким содержанием кислорода и хлоридов (хирономиды Ch. aprilinus, С. gr. lateralis). По-видимому, в условиях эвтрофирования в нижнем течении рек развитие эврибионтных хирономид зависит от содержания кислорода в воде и от наличия доступной пищи.
Рис. 7.
Ординация взаимосвязи факторов среды и видового состава видов хирономид пяти соленых рек (2006–2013 гг., август) методом канонического анализа соответствий (ССА). Векторы: T – температуры воды, O2 – содержание кислорода, pH, М – минерализация воды, Na + K, ${\text{SO}}_{4}^{{2 - }}$, Cl– – ионы и катионы, H – глубина реки в месте отбора проб, R – степень зарастания, D – диаметр частиц грунта, V – скорость течения, P – содержание общего фосфора, S – мутность взвешенная, U – уклон рек. Коды основных таксонов (треугольники) обозначены в табл. 2.
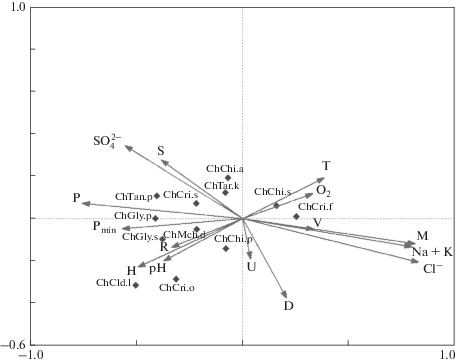
Результат ординационного анализа свидетельствует о том, что таксономическое богатство соленых рек зависит не только от уровня минерализации, но и от комплекса гидрохимических и гидрофизических факторов, определяющих ресурсную обеспеченность донных сообществ. В соленых гиперэвтрофных реках, где нет четкой границы в распределении организмов планктона и бентоса, эвригалинные хирономиды имеют значительный диапазон размещения в пространстве абиотических факторов (Zinchenko et al., 2018).
ЗАКЛЮЧЕНИЕ
Многолетняя пространственная и сезонная изменчивость среды обитания в реках Приэльтонья создает условия для развития видов с жизненной стратегией экстремалов, имеющих неограниченный пищевой ресурс в гиперэвтрофных водотоках. Периодичность циклов развития хирономид в реках с разной соленостью зависит от сезонно-временной динамичности комплекса абиотических факторов.
БЛАГОДАРНОСТИ
Авторы благодарны Е.А. Макарченко, М.А. Макарченко, О.В. Орел (Федеральный научный центр Биоразнообразия наземной биоты Восточной Азии Дальневосточного отделения РАН, Владивосток) за помощь в определении некоторых видов хирономид, Р. Задиевски (R. Szadziewski, University of Gdansk) за идентификацию отдельных представителей Сeratopogonidae и А.А. Прокину (Институт биологии внутренних вод РАН им. И.Д. Папанина, п. Борок) за идентификацию Coleoptera и Heteroptera; сотрудникам Природного парка “Эльтонский” за участие и помощь в сборе полевого материала.
Работа выполнена в рамках государственного задания “Оценка современного биоразнообразия и прогноз его изменения для экосистем Волжского бассейна в условиях их природной и антропогенной трансформации” (АААА–А17-117112040040-3), а также при финансовой поддержке РФФИ (17-04-00135).
Список литературы
Балушкина Е.В., Голубков С.М., Голубков М.С., Литвинчук Л.Ф., Шадрин Н.В., 2009. Влияние абиотических и биотических факторов на структурно-функциональную организацию экосистем соленых озер Крыма // Журнал общей биологии. Т. 70. № 6. С. 504–514.
Бенинг А.Л., Медведева Н.Б., 1926. О микрофауне водоемов окрестностей Эльтона и Баскунчака // Известия Краеведческого института изучения Южно-Волжской Области. Саратов: Сарполиграфпром. Т. 1. 39 с.
Горелов В.П., Голоколенова Т.Б., Кучишкина Н.В., Шевлякова Т.П., 2006. Гидробиологическая характеристика водоёмов Приэльтонья // Биоразнообразие и проблемы природопользования в Приэльтонье. Волгоград: Прин Терра. С. 23–36.
Гусаков В.А., Гагарин В.Г., 2012. Состав и структура мейобентоса высокоминерализованных притоков озера Эльтон // Аридные экосистемы. Т. 18. № 4 (53). С. 45–54.
Доклад об особенностях климата на территории Российской федерации за 2017 год, 2018. Москва: Росгидромет. 69 с.
Джонгман Р.Г.Г., Тер Браак С.Дж.Ф., Ван Тонгерен О.Ф.Р., 1999. Анализ данных в экологии сообществ и ландшафтов. Пер. с английского под редакцией А.Н. Гельфана, Н.М. Новиковой, М.Б. Шадриной. М.: Российская академия сельскохозяйственных наук. 306 с.
Зинченко Т.Д., 2011. Эколого-фаунистическая характеристика хирономид (Diptera, Chironomidae) малых рек бассейна средней и нижней Волги (Атлас). Тольятти: Кассандра. 258 с.
Зинченко Т.Д., Головатюк Л.В., 2010. Биоразнообразие и структура сообществ макроозообентоса соленых рек аридной зоны юга России (Приэльтонье) // Аридные экосистемы. Т. 6. № 3 (43). С. 25–33.
Зинченко Т.Д., Головатюк Л.В., 2013. Соленостная толерантность донных организмов речных вод (обзор) // Аридные экосистемы. Т. 19. № 3 (56). С. 5–11.
Зинченко Т.Д., Макарченко М.А., Макарченко Е.А., 2009. Новый вид рода Cricotopus van der Wulp (Diptera, Chironomidae) из солёной реки бассейна озера Эльтон (Волгоградская область, Россия) // Евразиатский энтомологический журнал. Т. 8. Прил. 1. С. 83–88.
Зинченко Т.Д., Головатюк Л.В., Выхристюк Л.А, Шитиков В.К., 2010. Разнообразие и структура сообществ макрозообентоса высокоминерализованной реки Хара (Приэльтонье) // Поволжский экологический журнал. № 1. С. 14–30.
Зинченко Т.Д., Головатюк Л.В., Абросимова Э.В., Попченко Т.В., Никуленко Т.Д., 2017. Изменения сообществ макрозообентоса при градиенте минерализации в реках бассейна гипергалинного оз. Эльтон (2006–2013 гг.) // Известия Самарского научного центра РАН. Т. 19. № 5. С. 140–156.
Зорина О.В., Зинченко Т.Д., 2009. Новый вид рода Tanytarsus van der Wulp (Diptera, Chironomidae) из соленой реки бассейна озера Эльтон (Волгоградская область, Россия) // Евразиатский энтомологический журнал. № 8 (1). С. 105–110.
Истомина А.Г., Зинченко Т.Д., Кикнадзе И.И., 2012. Кариотипическая характеристика Chironomus salinarius Kieffer (Diptera, Chironomidae) // Евразиатский энтомологический журнал. Т. 11. Прил. 2. С. 55–66.
Касаткина Ю.Н., Шубин А.О., 2012. Влияние кормовых ресурсов на поведение пролетных куликов-воробьев (Calidris minuta) на озере Эльтон // Зоологический журнал. Т. 91. № 1. С. 95–110.
Константинов А.С., 1961. О биологии комаров семейства Chironomidae // Научные доклады высшей школы, серия Биологические Науки. № 4. С. 20–23.
Лазарева В.И., Гусаков В.А., Зинченко Т.Д., Головатюк Л.В., 2013. Зоопланктон соленых рек аридной зоны юга России (бассейн оз. Эльтон) // Зоологический журнал. Т. 92. № 8. С. 882–892.
Макарченко М.А., Головатюк Л.В., 2010. Новая находка Cricotopus (s. str.) caducus Hirvenoja (Diptera, Chironomidae, Orthocladiinae) в “соленых” реках бассейна озера Эльтон (Волгоградская обл., Россия) // Евразиатский энтомологический журнал. Т. 9. Вып. 3. С. 375–378.
Методика изучения биогеоценозов внутренних водоемов, 1975. М.: Наука. 240 с.
Методические рекомендации по сбору и обработке материалов при гидробиологических исследованиях на пресноводных водоемах. Зообентос и его продукция, 1983. / Науч. ред. Винберг Г.Г., Лаврентьева Г.М. Л.: Государственный научно-исследовательский институт озерного и речного рыбного хозяйства. 52 с.
Номоконова В.И., Зинченко Т.Д., Попченко Т.В., 2013. Трофическое состояние соленых рек бассейна озера Эльтон // Известия Самарского научного центра РАН. Т. 3. № 1. С. 476–483.
Сухарев Е.А., 2015. Влияние пищевых ресурсов на распределение и экологическое разобщение пролетных куликов. Автореф. дис. … канд. биол. наук. М. 21 с.
Шилова А.И., 1976. Хирономиды Рыбинского водохранилища. Л.: Наука, Ленинградское отделение. 249 с.
Шитиков В.К., Зинченко Т.Д., Розенберг Г.С., 2012. Макроэкология речных сообществ: концепции, методы, модели. Тольятти: Самарский научный центр РАН, Кассандра. 257 с.
Шмидт-Ниельсен К., 1982. Физиология животных. Приспособление и среда. М.: Мир. 416 с.
Cartier V., Claret C., Garnier R., Franquet E., 2011. How salinity affects life cycle of a brackish water species, Chironomus salinarius Kieffer (Diptera: Chironomidae) // Journal of Experimental Marine Biology and Ecology. V. 405. Iss. 1. P. 93–98.
Dimitriadis S., Cranston P.S., 2007. From the mountains to the sea: assemblage structure and dynamics in Chironomidae (Insecta: Diptera) in the Clyde River estuarine gradient, New South Wales, south-eastern Australia // Australian Journal of Entomology. V. 46. P. 188–197.
Gascon S., Bruce, S., Sala J., Boix D., Quintana X.D., 2007. Comparison of the effects of hydrological disturbance events on benthos and plankton salt marsh communities // Estuarine, Coastal and Shelf Science. V. 74. P. 419–428.
Goodall D.W., 1954. Objective methods for the classification of vegetation. III. An essay in the use of factor analysis // Australian Journal of Botany. V. 2. P. 304–324.
Hart B.T., Bailey P., Edwards R., Hortle K., James K., McMahon A., Meredith C. Swadling K., 1991. A review of the salt sensitivity of the Australian freshwater biota // Hydrobiologia. V. 210. P. 105–144.
Healy B., 1997. Long-term changes in a brackish lagoon, Lady’s Island Lake, south-east Ireland // Biology and environment: proceedings of the Royal Irish Academy. V. 97b. № 1. P. 33–51.
Kawai K., Morihiro S., Imabayashi H., 2000. Transectiona distribution patterns of chironomid larvae in estuaries // Medical Entomology Zoology. V. 51. P. 215–220.
Kefford B.J., Dalton A., Palmer C.S., Nugegoda D., 2004. The salinity tolerance of eggs and hathlings of selected aquatic macroinvertebrates in southeast Australia and South Africa // Hydrobiologia. V. 517. P. 179–192.
Koskinen R., 1968. Seasonal and diel emergence of Chironomus salinarius Kieff. (Dipt., Chironomidae) near Bergen Western Norway // Annales Zoolgici Fennici. V. 5. P. 65–70.
Legendre P., Legendre L., 2012. Numerical Ecology. Amsterdam: Elsevier Sci. BV. 1006 p.
Marchini A., Munari C., Mistri M., 2008. Functions and ecological status of eight Italian lagoons examined using biological traits analysis (BTA) // Marine Pollution Bulletin. V. 56. P. 1076–1085.
Matěna J., Šímová I., Brom J., Novotná K., 2016. Benthic communities in inland salinized waters with different salinities and nutrient concentrations and the ecology of Chironomus aprilinus (Diptera: Chironomidae) in the Czech Republic // European Journal Entomology. V. 113. P. 122–129.
Moreno J.L., Millán A., Suárez M.L., Vidal-Abarca M.R., Velasco J., 1997. Aquatic Coleoptera and Heteroptera assemblages in waterbodies from ephemeral coastal streams (“ramblas”) of south-eastern Spain // Archiv für Hydrobiologie. V. 141. P. 93–107.
Orel (Zorina) O.V., Istomina A.G., Kiknadze I.I., Zinchenko T.D., Golovatyuk L.V., 2014. Redescription of larva, pupa and imago male of Chironomus (Chironomus) salinarius Kieffer from the saline rivers of the Lake Elton basin (Russia), its karyotype and ecology // Zootaxa. V. 3841 (4). P. 528–550.
Parma S., Krebs B.P.M., 1977. The distribution of chironomid larvae in relation to chloride concentration in a brackish water region of the Netherlands // Hydrobiologia. V. 52. P. 117–126.
Pinder A.M., Halse S.A., McRae J.M., Shield R.J., 2005. Ocurrence of aquatic invertebrates of the weatbelt region of Western Australia in relation to salinity // Hydrobiologia. V. 543. P. 1–24.
Ponti M., Colangelo M.A., Ceccherelli V.U., 2007. Composition, biomass and secondary production of the macrobenthic invertebrate assemblages in a coastal lagoon exploited for extensive aquaculture: Valle Smarlacca (northern Adriatic Sea) // Estuarine, Coastal and Shelf Science. V. 75. P. 79–89.
Ree H., Yum J.-H., 2006. Redescription of Chironomus salinarius (Diptera: Chironomidae), nuisance midges that emerged in brackish water of Jinhae-man (Bay), Kyongsangnam-do, Korea // Korea Journal of Parasitology. V. 44 (1). P. 63–66.
Rosenberg D.M., Resh V.H., 1993. (Eds). Freshwater biomonitoring and benthic macroinvertebrates. N.Y.: Chapman and Hall. 488 p.
Rutherford J.C., Kefford B.J., 2005. Effects of salinity on stream ecosystems: improving models for macroinvertebrates // The Commonwealth Scientific and Industrial Research Organisation Land and Water Technical Report, CSIRO; Canberra, Australia. V. 22/05. P. 1–64.
Sutcliffe D.W., 1960. Observations on the salinity tolerance and habits of a euryhaline caddis larva, Limnephilus affinis Curtis (Trichoptera: Limnephilidae) // Proceedings of the Entomological Society of London. (A). 35. P. 156–162.
Spaccesi F., Capıtulo A.R., 2009. Benthic invertebrate assemblage in Samborombon River (Argentina, S. America), a brackish plain river // Aquatic Ecology. V. 43. P. 1011–1022.
Suemoto T., Kawai K., Imabayashi H., 2004. A comparison of desiccation tolerance among 12 species of chironomid larvae // Hydrobiologia. V. 515. P. 107–114.
Ter Braak C.J.F., 1986. Canonical correspondence analysis: a new eigennector technique for multivariate direct gradient analysis // Ecology. V. 76. P. 1167–1179.
Thienemann A., 1954. Chironomus. Leben, Verbreitung und wirtschaftliche Bedeutung der Chironomiden. E. Schweizerbartsche: Stuttgart. 834 p.
Velasco J., Millán A., Hernández J., Gutiérrez C., Abellán P., Sánchez D., Ruiz M., 2006. Response of biotic communities to salinity changes in a Mediterranean hyper stream // Saline Systems. V. 2. P. 1–15.
Vlasblom A.G., Elgershuizen J.H.B.W., 1977.Survival and oxygen consumption of Praunus flexuosus and Neomysis integer, and embryonic development of the latter species, in different temperature and chlorinity combinations // Netherlands Journal of Sea Research. № 11. P. 305–315.
Ward J.V., 1992. Aquatic insect ecology: 1. Biology and habitat. John Wiley and Sons. New York. 438 p.
Williams W.D., 1987. Salinization of Rivers and streams: an important environmental hazard. //Ambio. V. 16. № 4. P. 180–185.
Williams D.D., Williams N.E., 1998. Aquatic insects in an estuarine environment: densities, distribution and salinity tolerance // Freshwater Biology. V. 39. P. 411–421.
Yadav M. 2003. Physiology of Insects. Discovery Publishing: New Delhi. 356 p.
Zinchenko T.D., Golovatyuk L.V., 2013. Salinity tolerance of macroinvertebrates in stream waters (review) // Arid Ecosystems. V. 3. № 3. P. 113–121.
Zinchenko T.D., Golovatjuk L.V., Vykhristjuk L.A., Shitikov V.K., 2011. Diversity and Structure of Macrozoobenthic Communities in the Highly Mineralized Khara River (Territory adjacent to Lake Elton) // Biology Bulletin. V. 38. № 10. P. 1056–1066.
Zinchenko T.D., Gladyshev M.I., Makhutova O.N., Sushchik N.N., Galina S. Kalachova G.S., Golovatyuk L.V., 2014. Saline rivers provide arid landscapes with a considerable amount of biochemically valuable production of chironomid (Diptera) larvae // Hydrobiologia. № 722. P. 115–128.
Zinchenko T.D., Golovatyuk L.V., Abrosimova E.V., Popchenko T.V., 2017. Macrozoobenthos in Saline Rivers in the Lake Elton Basin: spatial and Temporal Dynamics // Inland Water Biology. V. 10. № 4. P. 384–398.
Zinchenko T.D., Shitikov V.K., Golovatyuk L.V., Gusakov V.A., Lazareva V.I., 2018. Plankton and Bottom Communities in the Saline Rivers of Lake Elton Basin: Statistical Analysis of Dependences // Arid Ecosystems. V. 8. № 3. P. 225–230.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал