Зоологический журнал, 2019, T. 98, № 9, стр. 1025-1036
О биологии креветки Alpheus lobidens De Haan 1849 (Decapoda, Alpheidae) с литорали Оманского моря
Р. Н. Буруковский a, *, З. Ансари a, **, А. Махсюдлю b, ***
a Калининградский государственный технический университет
236022 Калининград, Россия
b Иранский национальный институт океанографических и атмосферных знаний, № 3
Tehran, Etemad Zadeh St., Fatemi Ave., IR. Iran
* E-mail: burukovsky@klgtu.ru
** E-mail: zeinab6228@gmail.com
*** E-mail: Wahab@inio.ac.ir
Поступила в редакцию 28.11.2018
После доработки 04.04.2019
Принята к публикации 04.04.2019
Аннотация
Исследованы 872 экз. креветок Alpheus lobidens De Haan 1849, собранных в 2014–2015 гг. на литорали Оманского моря на двух станциях: Джод (25°26′58″ с.ш., 59°30′28″ в.д) и Тисс (25°21′10″ с.ш., 60°36′08″ в.д.). Расстояние между станциями 110 км. A. lobidens – индо-вестпацифический вид и лессепсовский мигрант. Обитатель песчано-илистой литорали, богатой валунами и гравием. Ведет зарывающийся образ жизни. Общая длина тела, измеренная от конца рострума до конца тельсона, у самцов достигает 53, у самок – 59 мм, поэтому A. lobidens может быть отнесен к крупным видам рода Alpheus. Суммарная кривая размерного состава обоих полов близка к кривой нормального распределения. Их модальные размеры совпадают и равны 32 мм. Соотношение полов почти постоянно близко 1 : 1. Пары возникают по достижении половозрелости при длине тела 20 мм. Это соотношение нарушается лишь у особей с длиной тела 25–29 мм в сторону преобладания самцов в результате гибели части яйценосных самок после вылупления личинок из вынашиваемых ими яиц. Креветки живут около года. В пред- и постмуссонный периоды (апрель и ноябрь) до 20% особей – крупные креветки (44 и более миллиметров). Среди самок это особи, готовящиеся к третьему-четвертому нерестам. В начале муссонного периода (май–июнь) крупные особи исчезают (вымирают?), и на литорали постоянно присутствуют две генерации креветок с модой 22 и 32 мм, последовательно сменяющие друг друга. Это соответствует двум пополнениям населения литорали рекрутами с длиной тела 12–14 мм (в июне и августе). Самки первой группы или готовятся к первому спариванию, или только что впервые отнерестились. Их доля среди самок постепенно уменьшается. Самки второй группы имеют на плеоподах яйца с продвинутыми в развитии эмбрионами и созревающие гонады. Это особи, готовящиеся ко второму нересту. Их доля среди самок в течение муссонного периода увеличивается, и к началу постмуссонного периода самки второй группы сменяются крупными особями, тоже готовящимися к нересту. В населении креветок постоянно присутствуют готовые к нересту и только что отнерестившиеся самки.
Alpheus lobidens De Haan 1849 относится к семейству Alpheidae Rafinesque 1815. В его состав входит более 700 видов, из которых почти половина (313: De Grave, Fransen, 2011; Worms register of Marine species, 2019) относится к роду Alpheus. Все представители этого рода исключительно бентосные формы, к тому же уникально обитающие в укрытиях. Для этих креветок характерны различные формы симбиоза – от синойкии до комменсализма (терминология по: Беклемишев В.Н., 1951) – с разными группами гидробионтов, как с беспозвоночными (губки, кораллы, эхиуриды), так и позвоночными (рыбы из семейства Gobiidae). Это преимущественно литоральные и сублиторальные формы, живущие на глубинах от 0 до 50 м, хотя отдельные виды достигают верхней части материкового склона, как, например, обитатель подводных гор Наска в восточной части Тихого океана A. romenskyi Burukovsky 1990, пойманный на глубине 500 м (Буруковский, 1990). Несколько видов найдены в подводных гротах, а также в мангровых зарослях, лагунах и эстуариях, т.е. их можно считать солоноватоводными. Более того, на Малайском полуострове и о-ве Калимантан (в Сараваке) обнаружен вид (A. cyanoteles Yeo, Ng, 1990), облигатно обитающий в пресноводных водотоках (Yeo, Ng, 1996; Anker, 2001). Несмотря на это, биология креветок этого рода изучена очень слабо. Складывается впечатление, что наибольшее количество имеющейся информации в этой области базируется лишь на наблюдениях за поведением креветок в естественных условиях или в аквариуме.
В водах Ирана известны 9 видов креветок из семейства Alpheidae, и из них только три относятся к роду Alpheus (Naderloo, Tűrkay, 2012). Изученность их ограничена фаунистической информацией. Лишь Alpheus lobidens стал объектом более внимательного изучения (Dabbagh et al., 2012; Буруковский и др., 2017, 2018). Нами было показано, что этот вид выполняет функцию санитара литорали (Буруковский и др., 2018) и может быть использован в качестве “модельного вида” для экологического мониторинга. Предлагаемая здесь работа служит логическим продолжением наших исследований экологии этого вида. Ее цель – описание размерного состава и репродуктивной биологии A. lobidens, которые ранее совершенно не были изучены.
МАТЕРИАЛ И МЕТОДИКА
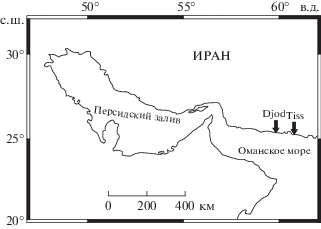
Материал был собран в 2014–2015 гг. на литорали Оманского моря на двух станциях: Джод (Djod: 25°26′58″ с.ш., 59°30′28″ в.д) и Тисс (Tiss: 25°21′10″ с.ш., 60°36′08″ в.д.). Расстояние между станциями 110 км (рис. 1).
Станция Тисс расположена в заливе Чехбахар, к северо-западу от крупного одноименного морского порта, на типичном берегу эрозионного происхождения с хорошо развитыми клифом и бенчем (по: Сафьянов, 1996). Бенч сложен из камней и песка, образующих полосы, тянущиеся вдоль побережья, длиной 200–300 м и шириной 50–70 м. Их разделяют участки песчаного грунта аккумулятивного происхождения примерно такой же протяженности. Илистая фракция бенча относительно невелика. Нижняя сизигийная граница литорали образует ступеньку. Здесь зимой формируется мощный штормовой прибой. Именно участки песчано-илистого грунта с галькой и мелкими валунами служат биотопом A. lobidens.
28.08.2014 г. на станции Тисс были собраны 209 креветок. Кроме того, в 2015 г. с апреля по сентябрь и в ноябре здесь же проведены ежемесячные сборы креветок (в период 27 по 29 числа каждого месяца, во время сизигий). Количество собираемых каждый раз креветок из-за трудоемкости их сбора и краткосрочности периода малой воды, в течение которого креветки доступны для сбора, составляло около 50 экз. в пробе (максимум 70 экз. в апреле и минимум 34 экз. в ноябре), всего 352 особи. С декабря по март включительно участки биотопа вида стали недоступны из-за упоминавшегося выше мощного штормового прибоя, захлестывающего биотоп A. lobidens даже во время сизигийного отлива. Станция Джод находилась северо-западнее. Биотоп A. lobidens здесь был таким же. 26.08.2014 года было собрано 311 креветок.
Общее количество собранных и исследованных креветок 875 экз., из них 3 экз. были использованы для изучения морфологии вида (Буруковский и др., 2017).
Для отлова креветок раскапывали грунт лопатой или руками или же вручную удаляли крупные валуны и гальку на песчано-илистых и илисто-песчаных островках галечно-валунного поля литорали. Освободившиеся участки с мелкими фракциями субстрата и образовавшиеся при удалении крупных камней ямы тут же заполнялись водой. В этих ямах вручную отлавливали креветок и фиксировали их в 4%-ном нейтрализованном растворе формалина.
В лабораторных условиях креветок подвергали биологическому анализу (Буруковский, 1992). Анализ предусматривал: измерение длины тела, определение пола, стадий зрелости гонад у самок, стадий эмбрионального развития яиц в кладке у яйценосных особей. За размеры тела принята общая длина тела, измеренная от конца рострума до заднего края тельсона вдоль спинной стороны. Измерение производили с помощью окуляр-микрометра стереоскопического микроскопа МБС-10 с точностью до 0.1 мм. Для определения стадий зрелости самок и стадий эмбрионального развития яиц мы использовали пятибалльные шкалы (Буруковский, 1992).
РЕЗУЛЬТАТЫ
Размерный состав
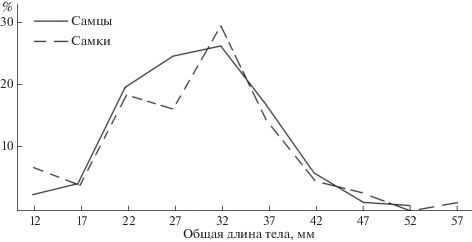
Общая длина тела A. lobidens с литорали Оманского моря варьирует от 12 до 59 мм. Наименьшая общая длина особей, у которых возможно различить пол по наличию appendix masculina (самцы) или его отсутствию (самки), у обоих полов совпадает. Максимальная длина тела самцов не превышает 53 мм, а самок – 59 мм, но это были единственные находки. Самцы с длиной тела 50–52 мм и самки 50–58 мм встречены не были. Исходя из этого, реальным максимальным размером для креветок обоих полов можно считать длину 49 мм. Кривые размерного состава A. lobidens (рис. 2) включают в себя результаты измерения 872 особей, из которых 429 были самцами, а 443 – самками, т.е. соотношение полов практически 1 : 1 (49.2 и 51.8%, соответственно). Креветки были собраны 26.08.2014 на двух участках литорали Оманского моря, располагающихся друг от друга на расстоянии 110 км, и в 2015 г. – в одном из этих мест, но в период с апреля по ноябрь (с пропуском в октябре). Следовательно, эти данные заведомо гетерогенны.
Кривые размерного состава обоих полов почти на всем их протяжении практически идеально совпадают друг с другом. Это говорит о том, что соотношения полов 1 : 1 у A. lobidens сохраняется в течение большей части онтогенеза. Его нарушение наблюдается у самых мелких (неполовозрелых) особей, среди которых преобладают самки, и у креветок с длиной тела 25–29 мм. У креветок этих размерных групп, напротив, самки уступают самцам. Как будет показано ниже, это имеет важный биологический смысл.
Суммарная кривая размерного состава напоминает кривую нормального распределения с модой 32 мм. Это позволяет предположить, что креветки живут около года. Но доля особей модальной и предшествующей групп вместе составляют половину от количества всех самцов (соответственно 25.9 и 24.2%), т.е. приближается к “плато”. Следовательно, население вида в районах сбора материалов содержит группировки креветок, различающиеся по их биологическому состоянию и размерам тела.
Это подтверждается размерным составом креветок, собранных на станции Tiss с апреля по сентябрь и в ноябре 2015 г. (рис. 3a). Единообразие по времени (сизигии), месту и методам сбора креветок минимизировало отклонения внутривидовых особенностей их поведения, подчеркнув сезонные аспекты изменения размерного состава.
Рис. 3.
Размерный состав креветок на станции Tiss в апреле–ноябре 2015 г. (a) и сезонная динамика размерного состава особей обоего пола (b).
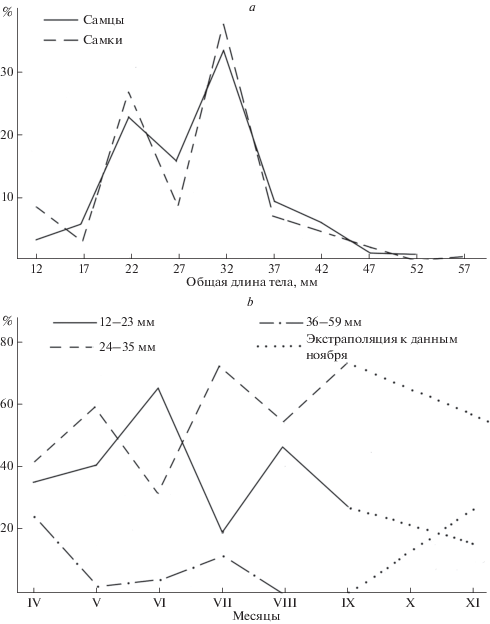
У обоих полов кривые размерного состава двухвершинные и хорошо совпадают друг с другом. Они дополнены маленьким пиком мелких (вероятно, неполовозрелых) самок и хорошо выраженным “хвостом” крупных особей обоего пола. Моды двух основных размерных группировок у самцов и самок совпадают и равны 22 и 32 мм. Вероятно, это свидетельствует о двух последовательных генерациях креветок, сменяющих друг друга и, вероятно, о двух пиках нереста креветок и, как следствие, двух пиках пополнения популяции.
Исходя из наличия трех упомянутых выше группировок, мы подразделили всех креветок на три размерные группы, независимо от пола: 12–23 мм (мода 22 мм), 24–35 мм (мода 32 мм) и все крупные особи (36–47 мм плюс еще три “гигантские” особи с длиной тела 51, 53 и 59 мм) (рис. 3b). В апреле все три размерные группы по их доле не очень сильно отличаются друг от друга. В мае доля самых крупных особей резко уменьшается, и доминируют среднеразмерные креветки, которых вытесняют в июне мелкие особи. К августу крупные особи исчезают полностью, а мелко- и среднеразмерные демонстрируют колебания в противофазе с диапазоном два месяца. Но в течение всего времени наблюдается тенденция общего снижения доли мелких и возрастания доли среднеразмерных особей, достигающих в сентябре 75% относительной численности от всех креветок. Это отражение роста: доля мелких креветок уменьшается, доля среднеразмерных возрастает, а самые крупные особи исчезают. В октябре, к сожалению, сбор креветок не производился. В ноябре повторилась картина, которая наблюдалась в апреле: опять появились крупные особи, среди которых самки, достигающие рекордных для вида A. lobidens размеров. Это подтверждает наше предположение о существовании, по крайней мере, двух генераций креветок, сменяющих друг друга на литорали станции Tiss в период с апреля сентябрь.
Репродуктивная биология
Как и у подавляющего большинства исследованных видов креветок, визуальные изменения гонады в процессе ее созревания заметны только у самок (Буруковский, 1992). Кроме этого, у тепловодных каридных креветок гонадный цикл синхронизирован с эмбриональным развитием яиц, вынашиваемых на плеоподах. Он состоит из следующих этапов: готовности к первому спариванию и созреванию гонады (по шкале для определения стадий зрелости гонады – II стадия зрелости); линьки спаривания, после которой гонада вступает в вителлогенез и происходит ее созревание, что соответствует III–V стадиям зрелости; следующей линьки и спаривания, откладки яиц на плеоподы (после этого гонада возвращается во II стадию зрелости), вынашивания яиц на плеоподах, одновременно в гонаде развиваются ооциты следующей генерации. Вылупление личинок совпадает с достижением гонадой преднерестовой стадии. Затем цикл повторяется, если имеются условия, благоприятные для этого. Если нет, самка может пропустить гонадный цикл. Но обычно начало очередного вителлогенеза (“созревания гонады”) совпадает с началом эмбриогенеза у только что отложенных на плеоподы яиц (Судник, 2008; Буруковский, 2012; Буруковский, Судник, 2014). Это справедливо и для A. lobidens (рис. 4).
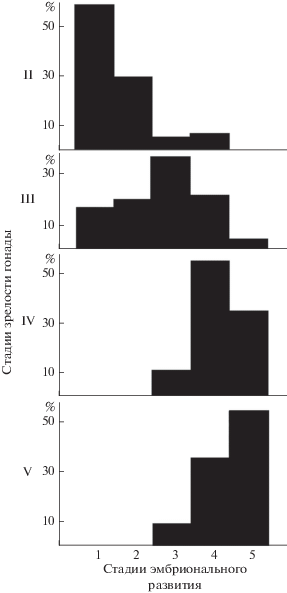
У самок с гонадами на II стадии зрелости на плеоподах абсолютно преобладают только что отложенные яйца на 1-й и 2-й стадиях эмбрионального развития. Чем более зрелая гонада, тем более развитые вынашиваемые на плеоподах эмбрионы. У преднерестовой креветки в яйцах находятся эмбрионы личинок, готовых к выклеву. Благодаря этому среди самок в населении креветок в данном месте и в данное время одновременно существуют особи, находящиеся на разных этапах репродуктивного цикла, что позволяет расшифровать особенности его динамики (рис. 5).
Рис. 5.
Размерно-половая структура Alpheus lobidens. Побережье Оманского моря. 26.08.2014 г. (271 самец и 253 самки): a – размерный состав креветок (1 – самцы, 2 – самки), b – стадии зрелости гонад, c – стадии эмбрионального развития яиц в кладках, d – размерный состав самок с гонадами на разных стадиях зрелости (1 – самки без яиц на плеоподах, 2 – только что отнерестившиеся самки (гонады на II стадии зрелости и только что отложенные яйца на плеоподах), 3 – самки с яйцами на плеоподах и гонадами на III–V стадиях зрелости, 4 – самки без яиц на плеоподах и с гонадами в IV–V стадиях зрелости), e – стадии зрелости гонад самок без яиц на плеоподах, f – стадии зрелости гонад самок с яйцами на плеоподах.
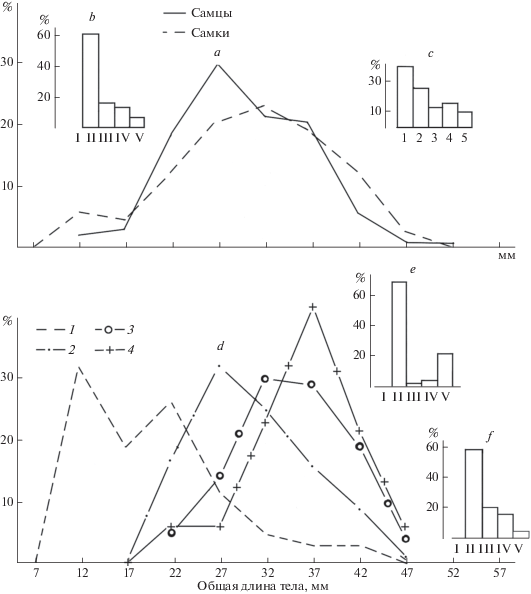
Для описания размерно-половой структуры креветок нами были выбраны материалы 2014 г. Они собраны в один день, благодаря чему отсутствует влияние на размерно-половой состав креветок его сезонной динамики. В результате изображенная на рис. 5d размерно-половая структура самок A. lobidens представляет собой как бы мгновенную фотографию репродуктивных процессов у креветок в данном конкретном месте в данный момент времени.
Итак, самки в 2014 г. были представлены особями с общей длиной тела 12–51 мм. Среди этих самок, собранных как в августе на станциях Tiss и Djod в августе 2014 г., так и в период с апреля по ноябрь 2015 г. на первой из станций, ни разу не были встречены ювенильные особи (с гонадами в I стадии зрелости – рис. 5b), а самые мелкие особи с яйцами на плеоподах имели длину тела 15 мм. Вероятно, ювенильные креветки находятся за пределами биотопа молоди и взрослых особей вида, т.е. вне литорали.
Суммарный график размерного состава представляет собой практически унимодальную кривую (мода 32 мм – рис. 5a) с дополнительной небольшой группой мелких особей с длиной тела до 14 мм (мода 12 мм). Их было всего 14 экз., что составляет 5.5% от общего числа самок (рис. 5a, 2). Среди самок 61.1% имели гонады во II стадии зрелости (рис. 5b), а 75.9% самок были яйценосными. 62% яйценосных самок несли на плеоподах только что отложенные яйца (на 1 и 2 стадиях эмбрионального развития, т.е. без следов дробления или с только намеченной зародышевой полоской) (рис. 5c). Это свидетельствует о достаточно активном нересте.
Однако размерно-половая структура самок неоднородна. В зависимости от их размерного состава, состояния гонад, наличия или отсутствия яиц на плеоподах, а также стадии эмбрионального развития вынашиваемых на плеоподах яиц, все самки могут быть подразделены на следующие группы.
1. Самки без яиц на плеоподах (рис. 5d, 1, 5e). Они представлены двухвершинной кривой с модами 12 и 22 мм, а также “хвостом” крупных самок.
Среди них имеются:
1.1. Неполовозрелые самки длиной 12–13 мм, образующие левый пик на рис. 5d, 5i (всего 14 особей); у них ни разу не были найдены яйца на плеоподах.
1.2. Самки с гонадами во II стадии без яиц на плеоподах. Их длина варьирует от 15 до 34 мм. Кривая очень неравновесная, т.к. мода (22 мм) смещена влево. Она явно состоит из двух групп креветок: готовых к первому спариванию (подавляющее большинство особей – 24 самки) и всего лишь 4 экз. крупных особей. Их можно было бы отнести к отдельной группе самок, которые, вероятно, отнерестились (т.е. отложили яйца на плеоподы), выносили их, но после вылупления личинок и после линьки, не спаривались снова. Но, возможно, это остатки группы, которую мы обозначили пунктом 4 (см. ниже).
2. Только что отнерестившиеся самки (гонады II стадии зрелости, на плеоподах яйца на 1–2-й стадиях эмбрионального развития) (рис. 5d, 2; 5f).
Это хорошо выраженная унимодальная кривая. Креветки с длиной тела от 15 до 49 мм. Мода 27 мм. Она совпадает с модой суммарного графика размерного состава самок. Креветки этой группы составляют 44.4% от всех самок и 58.3% от самок с яйцами на плеоподах. Мода только что отнерестившихся креветок совпадает с размерами тела, при которых нарушается соотношение полов 1 : 1 и начинают преобладать самцы (рис. 2), составляющие в этой размерной группировке 59.7%.
3. Самки с яйцами на плеоподах на 3–5-й стадиях эмбрионального развития и с гонадами в III–V стадиях зрелости (рис. 5d, 3). Они составляют 38% от всех самок с яйцами на плеоподах, и большая часть этих яиц находится на 4-й и 5-й стадиях эмбрионального развития, т.е. на стадиях, достаточно близких к вылуплению из них личинок. Размах колебаний от 20 до 47 мм. С первого взгляда это унимодальная кривая с модой 32 мм. Но фактически это плато, где модальная группа отличается от следующей группы всего на 1 особь, т.е. вершина кривой объединяет особей с длиной 30–39 мм. Вероятно, это креветки предыдущей генерации, отнерестившиеся впервые при длине 22 мм, после вылупления личинок, во время линьки спаривания достигшие длины 27 мм, и у них в настоящее время эмбрионы почти готовы или готовы к вылуплению. Судя по сезонной динамике размерного состава самок (рис. 3b), эта линька спаривания должна была произойти за месяц или полтора до этого, т.е. в июле.
4. Самки с гонадами на IV–V стадиях зрелости и без яиц на плеоподах. Мода креветок данной группы 37 мм (рис. 5d, 4). Это креветки, оставшиеся яловыми после второго нереста, который должен был быть четвертым в их жизни, но по факту будет лишь третьим.
Вероятно, подавляющее большинство самок могут нереститься дважды в жизни и лишь немногие – три или четыре раза.
Итак, в конце августа 2014 г. население самок A. lobidens Оманского моря представлено, по крайней мере, пятью группировками, члены которых различаются размерами и тем, что они находятся на разных последовательных этапах репродуктивного цикла, разделенных между собой линьками нагула и линьками спаривания. Самые мелкие особи – неполовозрелые, но готовые к спариванию, а подавляющее большинство самых крупных самок или находятся в преднерестовом состоянии без яиц на плеоподах, или имеют на плеоподах яйца с почти готовыми или готовыми к вылуплению эмбрионами.
Возникает картина идущих одновременно процессов, начало каждого из которых сдвинуто по отношению друг к другу по времени. Это свидетельствует о том, что наряду с двумя хорошо выраженными пиками нереста существует непрерывное пополнение литорали креветками, готовыми к спариванию и нересту.
Очевидно, что самок с созревающими гонадами относительно мало. Особенно креветок с гонадами на III стадии зрелости. Такие особи или уступают по относительной численности другим креветкам с созревающими гонадами, или полностью отсутствуют (в мае, июне и ноябре). Это позволяет предположить, что данный этап вителлогенеза протекает быстрее остальных. По этой же причине, вероятно, в пробах преднерестовых особей меньше, чем самок с гонадами на IV стадии зрелости.
ОБСУЖДЕНИЕ
Вид ранее считался широко Индо-Вестпацифическим. Однако после описания подвида Alpheus lobidens polynesica Banner et Banner 1974 (Banner, Banner, 1974) и указания Анкера (2001), что A. polynesica самостоятельный вид, A. lobidens De Haan 1849 можно считать типичным представителем собственно Индо-Вестпацифики. Он встречается у берегов Восточной Африки в Натале, Занзибаре, Сомали, у Мадагаскара (зал. Носи-Бе, Тулеар), в Красном море, у о-ва Маврикия, Сейшельских о-вов и о-вов Сообщества; в Персидском заливе – повсеместно от Кувейта и Бушера до о-ва Кешм, расположенного на самом его юге, в Ормуздском проливе и Оманском море, в Бенгальском заливе (лагуна Чилка), Бангла-Деш, у Никобарских о-вов. Далее на восток он известен из вод Тайланда и Индонезии (у берегов о-ва Ява и Молукского архипелага), в водах Вьетнама, Сингапура, у Филиппин, о-вов Яп и Тайвань. Вероятно, обитает в водах архипелага Рюкю (авторы публикации, из которой мы почерпнули эту информацию, не уверены в точности идентификации креветок, отнесенных ими предварительно к виду A. lobidens). Отмечен у восточного побережья Японии (у островов Кюсю и Хонсю). Широко распространен в водах Австралии вдоль всего северного побережья: у мыса Норт-Уэст-Кэйп, в заливе Коллиер, в районе города Дарвин, в заливе Карпентария и на самом севере Австралии: в Торресовом проливе; известны находки этого вида и с другого побережья этого пролива – Новой Гвинеи. У восточного побережья Австралии он встречен от Таунсвиля до Сиднея. К востоку от Австралии A. lobidens найден у островов Норфолк и Лорд-Хау (примерно 160° в.д.). В 1956 г. был обнаружен в Средиземном море. Сначала в Южном Тунисе, а затем у берегов Израиля и у эгейского побережья Турции и Сирии. Считают, что это результат Лессепсовской миграции (Barnard, 1950; Banner, Banner, 1974, 1981, 1982, 1983; Chace, 1988; Jeng, Chang, 1988; Zafar, Datta, 1989; Corfield, Alexander, 1995; Nomura et al., 1996; Anker, 2001; Galil, 2007; Hasan et al., 2008; Scheibani, 2007; Hosseini, 2009; Naderloo, Türkay, 2012; Bakir et al., 2015; The Atlas of Living …, 2016).
Как правило, встречается на литорали (Banner, Banner, 1982; Jeng, Chang, 1988; Corfield, Alexander, 1995; Anker, 2001; Naderloo, Türkay, 2012), но в заливе Карпентария однажды был пойман креветочным тралом на глубине 25.5 м (Banner, Banner, 1981).
Впервые обнаружили у A. lobidens более или менее постоянные разнополые пары и провели ряд экспериментов, наблюдая за ними в аквариумах, иранские исследователи (Dabbagh et al., 2012). Для креветок рода Alpheus об этом явлении сообщают многие его исследователи. Анкер (Anker, 2001) отмечает это у A. armatus Rathbun 1901, A. californiensis Holmes 1900, A. clipeatus Coutière 1905, A. deuteropus Hildendorf 1879, A. euphrosyne De Man 1897, A. lottini Guérin Méneville 1829, A. parvirostris Dana 1852 и A. sudara A.H&D.M. Banner 1966. Вероятнее всего, данный образ жизни у креветок этого рода распространен значительно шире. Рэтлифф (Ratliff, 2014) вообще считает его облигатным. Образование постоянных гетеросексуальных пар этологи называют “социальной моногамией” (Моногамия. 2017). Применительно к креветкам семейства Alphaeidae это означает, что самец и самка живут в едином пространстве, вступают в сексуальные отношения и совместно выполняют ряд общих задач, таких, например, как защита партнера (особенно самки во время линек спаривания), забота о потомстве – самка вынашивает на плеоподах яйца, самец защищает территорию, к которой тяготеют постличинки (Ratliff, 2014) (у нашего вида мы это явление не могли обнаружить). Поведенческие аспекты моногамии изучали в экспериментах с A. angulatus McClure 1995 (Mathews, 2002, 2002a), A. heterochaelis Say 1818 (Rahman et al., 2003) и с A. lobidens (Dabbagh et al., 2012). Целью этих экспериментов было выяснить, выгодна могогамия для субъектов “сотрудничества”, или осуществить реконструкцию механизма отбора, приводящего к моногамии.
Наши наблюдения базируются исключительно на полевых сборах, ограниченных периодом низкой воды. Поэтому мы судим по материалам биологических анализов, хотя еще при сборах креветок было замечено, что в тех ямах, заполненных мутной взвесью песка и ила, в которых мы вручную ловили креветок, чаще всего они встречались парами. Очень редко – поодиночке или по трое. В полевых условиях из-за мелких размеров креветок и из-за ограниченности времени сбора периодом малой воды невозможно было определять пол даже по такому признаку, как наличиe яиц на плеоподах (они были просто не видны невооруженным глазом). Поэтому моногамия была обнаруженa апостериори и подтверждена упомянутой выше публикацией (Dabbagh et al., 2012). Уже на рис. 2 хорошо заметно, совпадают как участки кривых размерного состава самцов и самок, свидетельствующие о равном или достаточно близком к 1 : 1 соотношении полов, так и те, где оно более или менее сильно от него отклоняется. В двух случаях отклонение происходит в пользу самок. В первом случае – у особей с длиной тела 12–13 мм. Их было всего 20 экз., из них 4 самца, а остальные – самки. Это неполовозрелая молодь. Во втором случае – у особей крупнее 40–44 мм. Возможно, это следствие более короткой жизни самцов. К сожалению, за два года было поймано всего 17 особей с длиной тела более 45 мм, что составляет менее 2% от всего числа пойманных креветок.
Судя по всему, партнерство между самцами и самками устанавливается по достижении длины тела примерно 20 мм. Это совпадает с наименьшей длиной тела половозрелых самок. Сильное отклонение от близкого 1 : 1 соотношения полов наблюдается у креветок размерной группировки 25–29 мм. Это примерно 160 креветок обоих полов (около 20% от всех креветок). Здесь превалируют самцы, составляющие 60%. Можно предположить, что произошел распад ранее образовавшихся пар. И именно к этой размерной группе относятся только что отнерестившиеся самки (гонады на II стадии зрелости, на плеоподах яйца на 1–2-й стадиях эмбрионального развития). Вероятно, у данной категории самок наблюдается повышенная смертность. Это явление у креветок известно (Fu et al., 2001). Затем, вероятно, партнерство восстанавливается, т.к. соотношение полов возвращается к 1 : 1. Оставшиеся без пары самцы находят других самок. Не исключено, что происходит распад пар вообще, а затем перераспределение партнеров. Возможно, существуют и то, и другое. Рэтлифф (2014) не очень внятно упоминает о некоем диапазоне самостоятельности у самок A. heterochaelis после вылупления личинок.
Сезонные особенности биологии A. lobidens обусловлены аридным климатом побережья Мекран и юго-западными муссонами. Здесь существуют муссонный (май–сентябрь), постмуссонный (октябрь–февраль) и предмуссонный (март–апрель) периоды. Температуры воздуха ниже всего в январе–феврале (22°C на широте иранского побережья в районе Оманского моря). В апреле–мае температуры возрастают здесь до 30°C (Робинсон, 1974; Иран, 2016; Chiffings, 1995; Fatemi, 2006; Taheri et al., 2010).
Это объясняет наличие цикличности сезонных колебаний размерного состава (рис. 3b). В конце предмуссонного периода более 20% креветок – крупные особи с длиной тела 44 мм и более. С наступлением муссонного периода их доля снижается до полного исчезновения в июле, и они вновь появляются в ноябре – в постмуссонный период. Что происходит в декабре–феврале, нам неизвестно, т.к. мощный штормовой прибой, захлестывающий биотоп A. lobidens, не позволил нам собрать креветок. К концу лета уменьшается доля самых мелких особей (12–23 мм). И, напротив, возрастает доля среднеразмерных креветок (24–35 мм). Именно они формируют два пика, соответствующие двум генерациям креветок на рис. 3 (моды 22 и 32 м). У самок это впервые и вторично нерестящиеся особи, составляющие основу репродуктивного контингента.
В течение всего времени наблюдений на литорали Оманского моря среди самок полностью преобладали особи, только что отложившие яйца на плеоподы: от 69.6% (в июле) до 93.5 и 93.7% (в июне и ноябре, соответственно). Следовательно, нерест у A. lobidens круглогодичен, а его два пика лишь опосредованно связаны с конкретным временем года, так как представлены двумя размерными группировками, отмеченными нами выше (рис. 3). Они соответствуют двум генерациям креветок, возникшим в результате непрерывной цикличности размножения, существующей у A. lobidens, как у всех тепловодных каридных креветок. Этому соответствуют и всего два подхода рекрутов на литораль (в июне и августе), среди которых неполовозрелые, но готовые к спариванию самки (длина тела 12–14 мм, гонады на II стадии зрелости, без яиц на плеоподах).
Рэтлифф (2014) описал жизненный цикл креветки A. heterochaelis из Флориды. По размерам тела (максимальная общая длина тела равна 57 мм) этот вид очень близок к A. lobidens. У A. heterochaelis размножение происходит круглогодично и соответствует ритму линочного цикла самки. К сожалению, автор не приводит никаких количественных данных и ничего не сообщает о наличии или отсутствии у этого вида пиков нереста. Вероятно, потому, что он имел дело с отдельными особями, находящимися в аквариуме. Под “размножением” Рэтлифф, видимо, понимал период спаривания, откладки яиц на плеоподы и выклев из них личинок. По данным этого автора, размножение происходит следующим образом.
Самка готова к спариванию в течение нескольких часов после линьки. Сигналом этому служат химические вещества, поступающие в воду во время линьки (вероятно, гормон линьки экдизон – примечание наше), а также “стрельба” самки щелкающей клешней. После спаривания начинается вителлогенез, т.е. “созревание” гонады. Если это не первое спаривание в жизни, то одновременно и синхронно идут: вителлогенез в гонаде и развитие яиц, в это же время вынашиваемых на плеоподах. Этот период длится у A. heteochaelis 28 дней. Рэтлиф (2014) упоминает также о существовании “периода независимости” (“range time to independence”). Вероятно, это время между вылуплением личинок из яиц и следующей линькой самки, во время которой она готова снова спариваться и откладывать на плеоподы яйца.
В экспериментах, которые проводили над A. lobidens для изучения поведенческих аспектов его социальной моногамии (Dabbagh et al., 2012), было установлено, что при температуре 27°C самки линяют со средним интервалом 21 день. Правда, авторы не сообщают диапазон варьирования времени между линьками. Не пишут они и о размерах линяющих креветок, и о том, что это за линьки: спаривания или нагула.
Мы имеем право предположить, что данные обоих авторов о величине межлиночного периода относятся к наиболее многочисленным группам особей каждого вида. У A. lobidens это креветки с длиной тела 20–34 мм. И у самцов, и у самок они составляют около 50% всех особей. Вероятно, именно у них межлиночный период равен примерно месяцу. С увеличением длины тела его длительность должна увеличиваться после каждой линьки, а величина прироста за линьку, напротив, уменьшаться. Это наблюдается, как у низших так и высших ракообразных (Хмелева, Голубев, 1984; Comeau et al., 1998).
Половозрелость самок A. lobidens, вероятно, наступает в возрасте 2–3 месяцев, как у сравнимого с ним по размерам A. heterochaelis (Ratliff, 2014). У A. lobidens обнаружены четыре группы половозрелых самок, которые различаются по длине тела и которые отнерестились от одного до четырех раз. Суммирование всех этих данных, с учетом удлинения межлиночного периода, позволяет предположить, что большая часть креветок живет около года. Это совпадает с нашим предположением, сделанным по результатам анализа кривой размерного состава.
ЗАКЛЮЧЕНИЕ
Итак, Alpheus lobidens De Haan 1849 – индо-вестпацифический вид и лессепсовский мигрант. Он ведет зарывающийся образ жизни на песчано-илистой литорали, богатой валунами и гравием, выполняя функцию ее санитара. Максимальная длина тела A. lobidens, измеренная от конца рострума до конца тельсона, достигает 53 мм у самцов и 59 мм у самок. Длительность жизни достигает примерно 1 года, но самцы, вероятно, имеют несколько меньшую длительность жизни. Модальные размеры обоих полов совпадают и равны 32 мм. Соотношение самцов и самок почти всегда близко 1 : 1 в результате существования у этого вида моногамии, т.е. гетеросексуального партнерства. Пары возникают по достижении половозрелости при длине тела 20 мм. Партнерство, вероятно, не пожизненное. Некоторые пары, состоящие из особей с длиной тела 25–29 мм, разрушаются, т.к. часть самок, впервые участвующих в репродуктивном процессе, гибнет после вылупления личинок из яиц, вынашиваемых на плеоподах. Соотношение полов 1 : 1 восстанавливается у более крупных особей. Вероятно, самцы находят новых партнерш. Не исключена, правда, возможность полного перераспределения пар после завершения первого репродуктивного цикла. В пред- и постмуссонный периоды (апрель и ноябрь) до 20% населения креветок – крупные особи (по меньшей мере 44 мм). В начале муссонного периода (май–июнь) крупные особи исчезают (вымирают?), и на литорали постоянно присутствуют две доминирующие по численности генерации креветок с модой 22 и 32 мм, среди самок которых есть впервые и вторично нерестящиеся особи. Они представляют собой основу репродуктивного контингента вида и последовательно сменяют друг друга. Это соответствует двум пополнениям населения литорали рекрутами с длиной тела 12–14 мм (в июне и августе). Кроме них постоянно присутствуют относительно малочисленные более крупные самки, тоже готовые к нересту или только что отнерестившиеся. Доля впервые нерестящихся особей в течение муссонного периода уменьшается, а доля вторично нерестящихся, наоборот, возрастает. Они, вероятно, становятся к наступлению постмуссонного периода крупными особями.
Эти особенности биологии A. lobidens, обуславливают, с одной стороны, его популяционную лабильность под влиянием внешних воздействий, а, с другой – достаточный потенциал самовосстановления населения креветок. На песчано-илистой с камнями и гравием литорали Оманского моря A. lobidens выполняет функцию ее санитара, и поэтому может быть использован в качестве модельного в мониторинге ее состояния в данном регионе.
Список литературы
Беклемишев В.Н., 1951. О классификации биоценологических (симфизиологических) связей // Бюллетень Московского общества испытателей природы. Отд. Биол. Т. 56. № 5. С. 3–30.
Буруковский Р.Н., 1990. Креветки подводных возвышенностей Сала-и-Гомес и Наска // Труды ИОАН СССР. Т. 124. Планктон и бентос подводных хребтов Наска и Сала-и-Гомес. М.: Наука. 187–218.
Буруковский Р.Н., 1992. Методика биологического анализа некоторых тропических и субтропических креветок // Промыслово-биологические исследования морских беспозвоночных. М.: ВНИРО. С. 77–84.
Буруковский Р.Н., 2012. Глубоководные креветки семейства Nematocarcinidae: история изучения, систематика, географическое распространение, биологическая характеристика. СПб.: Проспект Науки. 288 с.
Буруковский Р.Н., Ансари З., Махсюдлю А., 2017. Морфология креветки Alpheus lobidens De Haan, 1849 с литорали Оманского моря (Иран) // Известия КГТУ. № 45. С. 72–82.
Буруковский Р.Н., Ансари З., Махсюдлю А., 2018. Состав пищи у креветки Alpheus lobidens De Haan, 1849 (Decapoda: Crustacea: Alpheidae) с литорали Оманского моря // Invertebrate zoology. Т. 15 (4). С. 383–401.
Буруковский Р.Н., Судник С.А., 2014. Оогенез и созревание яичников как базис репродуктивной стратегии самок креветки Nematocarcinus africanus Crosnier et Forest 1973 (Crustacea, Caridea, Nematocarcinidae) // Наука и мир. Т. 2. № 12 (16). С. 16–27.
Иран, 2016. [Электронный ресурс]. Режим доступа: https://ru.wikipedia. org/wiki. Дата обновления: 04.12.2016
Моногамия, 2017. [Электронный ресурс]. Режим доступа: https://ru.wikipedia.org/wiki/ Дата обновления: 31.01.2017
Робинсон М.К., 1974. Аравийское море // Океанографическая энциклопедия. Л.: Гидрометеоиздат. С. 22–25.
Сафьянов Г.А., 1996. Геоморфология морских берегов. М.: МГУ. 400 с.
Судник С.А., 2008. Экологические аспекты репродуктивных стратегий креветок. Дис. … канд. биол. наук. Калининград: Калининградский государственный университет. 313 с.
Хмелева Н.Н., Голубев А.П., 1984. Продукция кормовых и промысловых ракообразных. Минск: Наука и техника. 215 с.
Anker A., 2001. Taxonomie et évolution des Alpheidae (Crustacea: Decapoda). Thèse pour l’obtention du grade de Docteur. Fasc. II. Paris: Muséum National d’Histoire Naturelle. 365 p.
Ansari Z., Seyfabadi J., Owfi F., Rahimi M., 2014. Habitat classification of southern coast Queshm Island based of survey geological structure // Indian Journal Geo-Marine Science. V. 43. № 9. P. 1757–1763.
Bakir K., Ilkyaz A.T., Aydin C., Türkmen G., 2015. The presence of Alpheus lobidens De Haan, 1849 (Decapoda, Alpheidae) on the Turkish Aegean Sea coast // Crustaceana. V. 88. Issue 6. P. 651–656.
Banner A.H., Banner D.M., 1974. Contributions to the Knowledge of the Alpheid Shrimp of the Pacific Ocean. Part XVII. Additional Notes on the Hawaiian Alpheids: New Species, Subspecies, and Some Nomenclatorial Changes // Pacific Sciences. V. 28. P. 1–4.
Banner A., Banner D., 1983. An annotated checklist of the alpheid shrimps from the Western Indian ocean // Travaux et documents de l’ORSTOM. № 158. Paris. 41 p.
Banner D.M., Banner A.H., 1981. Annotated checklist of the Alpheid shrimp of the Red Sea and Gulf of Aden // Zoologische Verhandelingen. № 190. 99 p.
Banner D., Banner A., 1982. The alpheid shrimp of Australia. Part III. The remaining alpheids, principally the genus Alpheus, and the family Ogyrididae // Records of the Australian Museum. V. 34. № 1. 357 p.
Barnard K.H., 1950. Descriptive catalogue of South African Decapoda Crustacea // Ann. S. Afr. Mus. V. 38. 837 p.
Chace F.A., Jr., 1988. The Caridean Shrimps (Crustacea: Decapoda) of the Albatross Philippine Expedition, 1907–1910, Part 5: Family Alpheidae // Smithsonian Contributions to Zoology. № 466. 99 p.
Chiffings A.W., 1995. Arabian Seas. A global representative system of Marine Protected Areas // Kelleher G., Bleakley C., Wells S. (eds). Central Indian Ocean, Arabian Seas, East Africa and East Asian Seas. Great Barrier Reef Marine Park Authority. International Union for Conservation of Nature/World Bank 3. P. 39–70.
Comeau M., Conan G.Y., Maynou F., Robichaud G., Therriault J., Starr M., 1998. Growth, spatial distribution and abundance of benthic stages of the snow crab (Chionoecetes opilio) in Bonne Bay, Newfoundland, Canada // Canadian Journal of Fisheries and Aquatic Sciences. V. 55. P. 262–279.
Corfield J.L., Alexander C.G., 1995. The distribution of two species of alpheid shrimps, Alpheus edwardsii and A. lobidens, on a tropical beach // Journal Marine Biological Assotiation. UK. V. 75. P. 675–687.
Dabbagh A.-R., Kamrani E., Taherzadeh M.R., 2012. Studies on social monogamy in the snapping shrimp, Alpheus lobidens De Haan, 1849 // Asian Journal of Animal and Veterinary Advances. V. 7. № 4. P. 361–365.
De Grave S., Fransen C.H.J.M., 2011. Carideorum catalogus the recent species of the dendrobranchiate, stenopodidean, procarididean and caridean shrimps (Crustacea, Decapoda). Zoologische Mededelingen. V. 85. № 9. Leiden. P. 195–588.
Fatemi M.R., 2006. Ecology of Oman Sea // Publication Department of Environment. Iran. 16 p.
Fu C., Quinn T.J., Shirley T.C., 2001. The role of sex change, growth and mortality in Pandalus population dynamics and management // ICES Journal of Marine Science. № 58. P. 607–621.
Galil B.S., 2007. Seeing Red: Alien species along the Mediterranean coast of Israel // Aquatic Invasions. V. 2. Issue 4. P. 281–312.
Hasan H., Zeini A., Noël P.Y., 2008. The marine decapod crustacea of the area of Lattakia, Syria // Crustaceana. V. 81. № 5. P. 513–536.
Hosseini S.H., 2009. The intertidal Decapods of Bushehr, northern part of the Persian Gulf // Iranian Journal Fisheries Sciences. V. 8. № 1. P. 37–46.
Jeng M.-S., Chang K.-H., 1988. Study on the habitat preference of the snapping shrimp Alpheus edwardsii (Audouin) // Bulletin Institute Zoology. Academia Sinica. V. 27. № 2. P. 91–103.
Mathews L.M., 2002. Tests of the mate-guarding hypothesis for social monogamy: does population density, sex ratio, or female synchrony affect behavior of male snapping shrimp (Alpheus angulatus) // Behavior Ecology Sociobiology. V. 51. P. 426–432.
Mathews L.M., 2002a. Territorial cooperation and social monogamy: factors affecting intersexual behaviors in pair-living snapping shrimp // Animal Behavior. V. 63. P. 767–777.
Naderloo R., Türkay M., 2012. Decapod crustaceans of the littoral and shallow sublitoral Iranian coast of the Persian Gulf: Faunistics, biodiversity and zoogeography // Zootaxa. 3374. Aucland. New Zealand: Magnolia Press. 67 p.
Nomura K., Nagai S., Asakura A., Komai T., 1996. A preliminary list of shallow water decapods crustacean in the Kerama group, the Ryukyu Archipelago // Bulletin Biogeography Society Japan. V. 51. 2. P. 7–21.
Rahman N., Dunham D.W., Govind C.K., 2003. Social monogamy in the big-clawed snapping shrimp, Alpheus heterochaelis // Ethology. V. 109. Issue 6. P. 457–473.
Ratliff S., 2014. “Alpheus heterochaelis” (Online), animal diversity web [Электронный ресурс]. Режим доступа: http://animaldiversity.org/ accounts/Alpheus_heterochaelis. Дата обновления: 20.02.2017
Sheibani R., 2007. Zoogeography and taxonomy of littoral caridean shrimps of the Persian Gulf and Gulf of Oman. PHD Thesis. Shahid Beheshti University. Faculty of Biological Sciences. Tehran. 144 p.
Taheri M., Foshtomi Y., Bagheri H., 2010. Community structure and biodiversity of intertidal sandy beach macrofauna in Chabahar Bay, Northeast of Oman Gulf, IR Iran // Journal Persian Gulf. P. 19–25.
The Atlas of Living Australia is a collaborative, national project that aggregates biodiversity data from multiple sources and makes it available and usable online, 2016. [Электронный ресурс] Режим доступа: http:// bie.ala.org.au/species/urn:lsid:biodiversity.org.au:afd.taxon: 25db7905 -8064-48b9-8f8b-7d09c2ed91d8#names. Дата обновления: 13.01.2017
Worms register of Marine species, 2019. Alpheus Fabricius, 1798. [Электронный ресурс] http://www.marinespecies.org/aphia.php?p=taxdetails&id=106978. Дата обновления: 17.03.2019
Yeo D.C.G., Ng P.K.L.N., 1996. A new species of freshwater snapping shrimp, Alpheus cyanoteles (Decapoda: Caridea: Alpheidae) from peninsular Malaysia and a redescription of Alpheus paludicola Kemp, 1915 // The Raffle Bull. Zoology. V. 44. № 1. P. 37–63.
Zafar M.N., Datta M.K., 1989. On the length-weight relationship of Alpheus lobidens De Haan, 1950, from the coast of Bangladesh // [Электронный ресурс] Режим доступа: http://www.barc.gov.bd/home.php/ Дата обновления 13.01.2017
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал