Зоологический журнал, 2020, T. 99, № 1, стр. 39-44
Особенности кариотипа и состав гемоглобинов комара-звонца Chironomus sp. Ya3 (Diptera, Chironomidae) из дельты реки Печора
В. В. Большаков a, *, Е. Б. Фефилова b
a Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 пос. Борок, Россия
b Институт биологии Коми научного центра УрО РАН
167982 Сыктывкар, Россия
* E-mail: victorb@ibiw.yaroslavl.ru
Поступила в редакцию 12.12.2018
После доработки 13.01.2019
Принята к публикации 28.02.2019
Аннотация
Приведены данные о структуре кариотипа и составе гемоглобинов вида комара-звонца Chironomus sp. Ya3 (Kiknadze, Istomina, Salova, 1996), обнаруженного нами в водоеме дельты р. Печора в зоне вечной мерзлоты. Морфологически найденные личинки соответствуют первоописанию. Среди 9 обнаруженных последовательностей дисков политенных хромосом, Ya3A2 впервые встречена в гомозиготном состоянии, Ya3E2 в гетерозиготном состоянии. Данные электрофоретических исследований свидетельствуют о сложном устройстве гемоглобинов. В результате диск-электрофореза обнаружено 9 фракций с подвижностью (Rf ) от 0.43 до 0.84, которые образованы субъединицами с молекулярной массой от 11.5 до 15.6 kDa. Вероятно, благодаря сложному устройству гемоглобинов вид способен переносить экстремальные условия внешней среды. По составу нативных гемоглобинов вид имеет сходство с Ch. plumosus (L. 1758), по составу субъединиц, входящих в отдельные фракции гемоглобинов, исследуемый вид обладает значительным сходством с Ch. riparius (Meigen 1804).
Впервые вид Chironomus sp. Ya3 (Kiknadze, Istomina et Salova 1996) был обнаружен в нескольких водоемах близ пос. Усть-Нера, Оймяконского р-на, Республика Саха (Якутия), в зоне вечномерзлых грунтов (Кикнадзе и др., 1996). Вид относится к примитивной группе riihimakiensis. Эта группа состоит из нескольких видов-двойников, встречающихся в Скандинавии и Сибири (Kiknadze et al., 1994). Благодаря освоению природных ресурсов удаленных и труднодоступных северных регионов, у нас появляется возможность детальнее изучить фауну, населяющую биотопы с уникальными природными условиями. Особый интерес представляют водоемы дельты реки Печора, находящейся за полярным кругом в зоне вечной мерзлоты. Именно в таких суровых условиях, на значительном расстоянии от первой находки нами был обнаружен исследуемый вид.
Считается, что способность хирономид заселять разнообразные водоемы обеспечивается их высокой морфологической, хромосомной (Кикнадзе и др., 1991, 1996) и биохимической изменчивостью (Bolshakov, Andreeva, 2012). Было установлено, что структура их кариотипа в большей степени зависит от условий в водоеме, чем от его географического положения (Шобанов, 1994; Gunderina et al., 1999; Shobanov, Bolshakov, 2011; Большаков, Шобанов, 2017). Кроме этого, в гемолимфе некоторых хирономид содержится уникальный, низкомолекулярный и при этом внеклеточный гемоглобин (Osmulski, Leyko, 1986; Bolshakov, Andreeva, 2012), обладающий высоким сродством к кислороду (Weber, Vinogradov, 2001). Несмотря на это, запасенного кислорода личинкам хватает приблизительно на 9 мин (Walshe, 1950), поэтому, вероятно, он может принимать участие в поддержании осмотического гомеостаза внутренней среды при неблагоприятных условиях (Шобанов, 2004).
Цель работы – изучить особенности кариотипа Ch. sp. Ya3 из устья р. Печора и провести его сравнение с обнаруженным ранее; изучить электрофоретический спектр гемоглобинов.
Материалом для работы послужили личинки Chironomus sp. Ya3, собранные 8 августа 2016 г. из водоема на острове в протоке Большой Гусинец дельты р. Печора. Координаты точки сбора: 68°10′282″ с.ш., 53°39′368″ в.д. Водоем представлял собой небольшое озерко, зарастающее осокой и сообщающееся с рекой в период половодья, площадью около 200 × 20 м2, глубиной около 1 м. В период сбора материала температура воды составляла 17.5°C, pH 8.04.
Процесс обнаружения личинок имел свои особенности. Проба донного субстрата (смесь ила с песком) из водоема была доставлена в лабораторию и хранилась без фиксации герметично упакованная в пластиковый пакет в холодильнике при температуре +4°C до января 2017 г. При просмотре пробы в январе 2017 г. в ней были обнаружены живые личинки хирономид размером 3–5 мм. Личинки были отсажены в отдельную чашку Петри для доращивания по методике, описанной ранее (Bolshakov, 2015). Затем 4 февраля 2017 г. у трех наиболее крупных личинок была отобрана гемолимфа, а сами они зафиксированы в 96% этаноле. Для кариологического анализа оказались пригодными две особи.
Препараты политенных хромосом окрашивали орсеином (Merck, Германия) по стандартной методике (Демин, 1989). Фотографирование препаратов хромосом проводили на микроскопе “МикМед-6C” (ЛОМО, Россия) видеоокуляром “ToupCam5.1” (Китай), при увеличении ×1000. При видовой идентификации по кариотипу использовали цитофотокарты из монографии “Кариофонды хирономид криолитозоны Якутии: Триба Chironomini” (Кикнадзе и др., 1996) и “Karyotypes of Palearctic and Holarctic species of the genus Chironomus” (Kiknadze, 2016). Картирование хромосомных плеч A, E и F проведено по Кейлу (Keyl, 1962), а для плеч C и D – по Деваи с соавторами (Dévai et al., 1989).
Собранную гемолимфу немедленно замораживали и хранили при –25°С. Разделение белков проводили как в нативных условиях диск-электрофореза 10-% ПААГ (Maurer, 1971), так и в денатурирующих в присутствии додецилсульфата натрия (SDS) по Леммли (Laemmli, 1970; Bolshakov, Andreeva, 2012). В качестве контрольного вида был использован хорошо изученный массовый вид Ch. plumosus (L. 1758) из Рыбинского водохранилища.
Белки гемолимфы окрашивали Coomassie R-250 (Merck, Германия). Для определения молекулярной массы (ММ) денатурированных белков использовали набор PageRulerTM Prestained Protein Ladder Plus (Fermentas, США). Результаты обрабатывали статистически с помощью специализированного программного пакета “OneDScan”.
Морфологически личинки соответствуют первоописанию (Кикнадзе и др., 1996), за исключением размеров, в длину личинки едва достигали 15 мм, что, вероятно, может быть связано с их выращиванием на искусственном субстрате (Bolshakov, 2015).
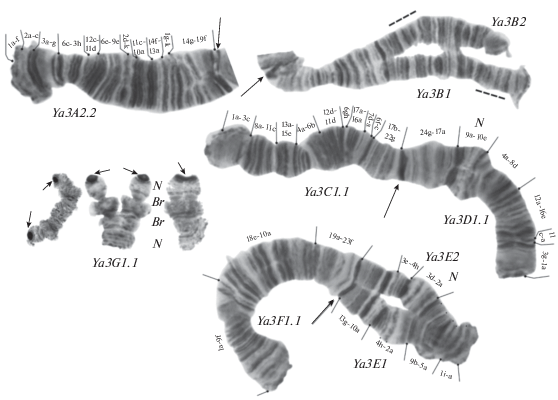
В результате кариологического анализа у двух особей были обнаружены одинаковые кариотипы. Сочетание хромосомных плеч AB, CD, EF, G – соответствует цитокомплексу thummi. B-хромосом не обнаружено. В плечах D, E и G отмечены ядрышки. Теломерные диски разделены на хорошо окрашивающиеся глыбки, кроме этого, встречаются эктопические контакты плеч C и F (рис. 1).
Рис. 1.
Кариотип Chironomus sp. Ya3. Ya3A2.2., Ya3B1 и т.д. – генотипические комбинации последовательностей дисков хромосомных плеч; N – ядрышковый организатор; Br – кольцо Бальбиани. Пунктирной линией указан район инверсии в плече B.
Хромосома I
В плече A встречена одна последовательность Ya3A2 в гомозиготном состоянии, отличается от Ya3A1 простой инверсией (Кикнадзе и др., 1996; Kiknadze et al., 2016)
Ya3A2 1a-f.2a-c.3a-g.6c-3h.12c-11d.6e-9e.2d-k.11c-10a.14f-13a.1g-k.14g-19f.
В плече B встречено две последовательности Ya3B1 и Ya3B2, отмеченная впервые. Обе последовательности пока не картированы.
Хромосома II
В плече C отмечена одна последовательность Ya3C1 (Кикнадзе и др., 1996; Kiknadze et al., 2016).
Ya3C1 1a-3c.8a-11c.13a-15e.4a-6b.12d-11d.6gh.17a-16a.7d-a.6f-c.17b-22g.
В плече D одна последовательность Ya3D1 (Кикнадзе и др., 1996; Kiknadze et al., 2016).
Ya3D1 1a-3g.11a-c.16e-12a.8d-4a.10e-9a.17a-24g.
Хромосома III
В плече E обнаружено две последовательности Ya3E1 и Ya3E2.
Ya3E1 1a-i.5a-9b.2a-4h.10a-13g
Ya3E2 1a-i.5a-9d.2a-3d.4h-3e.10a-13g.
В плече F одна последовательность Ya3F1.
Ya3F1 1a-9f.18e-10a.19a-23f.
Хромосома IV
В плече G одна последовательность Ya3G1, не картирована. Гомологи могут быть полностью или частично спарены.
Всего нами было обнаружено 9 последовательностей, при этом последовательность Ya3A2 впервые встречена в гомозиготном состоянии, а последовательность Ya3E2 в виде гетерозиготы отмечена у обеих личинок, хотя ранее она была обнаружена лишь в одном из 69 изученных кариотипов (Кикнадзе и др., 1996).
В результате диск-электрофореза в гемолимфе Ch. sp. Ya3 было обнаружено 9 компонентов с различной электрофоретической подвижностью (Rf) (рис. 2; табл. 1). Для удобства несколько фракций были объединены в блоки, как было описано ранее у Ch. plumosus (Bolshakov, Andreeva, 2012). В итоге, в блоке 0 у Ch. sp. Ya3 была выделена одна фракция с подвижностью 0.33 (относительное содержание 5.5%), в блоке 1 – две фракции 0.43 (5.0%) и 0.50 (4.7%), в блоке 2 – нет фракций, в блоке 3 – две фракции 0.65 (7.7%) и 0.67 (4.0%), в блоке 4 – две фракции 0.73 (14.7%) и 0.78 (8.7%), в блоке 5 – две фракции 0.83 (18.1%) и 0.84 (31.7%).
Рис. 2.
Диск-электрофорез белков гемолимфы Ch. sp. Ya3 (1, 2) и Ch. plumosus (3). Стрелками указаны блоки фракций гемоглобинов (0–5). Вертикальная стрелка указывает направление электрофореза.
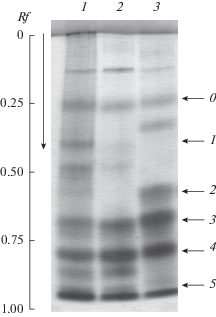
Таблица 1.
Электрофоретическая подвижность, относительное содержание и ММ компонентов гемоглобинов Ch. sp. Ya3 в нативных и денатурирующих условиях
| Номер фракции |
Диск-электрофорез | SDS-электрофорез | |
|---|---|---|---|
| Rf | относительное содержание, % | MM, kDa | |
| 1 | 33 | 5.5 | 12.05 |
| 2 | 43 | 5 | 11.70 |
| 3 | 50 | 4.7 | 11.80 |
| 4 | 65 | 7.7 | 11.50 |
| 5 | 67 | 4 | 12.70 |
| 6 | 73 | 14.7 | 11.60 |
| 12.90 | |||
| 7 | 78 | 8.7 | 12.30 |
| 8 | 83 | 18.1 | 12.50 |
| 9 | 84 | 31.7 | 15.60 |
| 12.10 | |||
В результате SDS-электрофореза в гемолимфе личинок Ch. sp. Ya3 было обнаружено 11 компонентов гемоглобина, представленных субъединицами с ММ от 11.5 до 15.6 kDa. В 2-D SDS-электрофорезе видно, что фракции из блоков 0 и 1 образованы субъединицами со сходными ММ 12.05 kDa (Rf 0.33), 11.7 (0.43), 11.8 (0.50), из 3 блока – из двух типов субъединиц с ММ около 11.5 (0.65) и 12.7 (0.67) kDa, из 4 блока – 11.6 (0.73), 12.9 (0.73) и 12.3 (0.78), из 5 блока – 12.5 (0.83) и 15.6 (0.84), кроме этого, в области 0.84 были обнаружены субъединицы с ММ 12.1 kDa. Как видно, в области фракции с подвижностью 0.73 выделяются субъединицы с разной ММ. Вероятно, в этой области находится два типа гемоглобинов со сходной электрофоретической подвижностью, но состоящих из разных субъединиц. В итоге, на одномерном SDS-электрофорезе близкие по ММ субъединицы объединяются в четыре фракции с ММ около 11.5, 11.96, 12.8 и 15.6 kDa (рис. 3).
Рис. 3.
SDS-электрофорез белков гемолимфы: а – Ch. sp. Ya3, б – Ch. plumosus. Слева – 1D-, справа – 2D-SDS-электрофорез. Стрелками указано направление электрофореза.

Количества собранной гемолимфы оказалось недостаточно для проведения электрофореза в градиенте концентраций ПААГ, и установить структурную организацию гемоглобинов из отдельных фракций довольно сложно. Однако, опираясь на характеристики спектров уже изученных нами видов (Bolshakov, Andreeva, 2012), можно предположить, что гемоглобины Ch. sp. Ya3 сложно устроены и могут включать от одной (мономеры) до шести (гексамеры) и более субъединиц.
При первом взгляде на спектры нативных белков из гемолимфы Ch. sp. Ya3 и Ch. plumosus заметно их сходство. Однако подвижность всех фракций с близкими значениями ММ у Ch. sp. Ya3 оказывается несколько выше. То же наблюдается при сравнении спектров денатурированных белков: близкие по значению ММ фракции у Ch. sp. Ya3 примерно на 0.5 kDa легче, чем у Ch. plumosus. При сравнении состава субъединиц Ch. sp. Ya3 оказывается ближе к Ch. riparius (Meigen 1804) (Bolshakov, Andreeva, 2012), в спектре которого также преобладают субъединицы из фракций со средней подвижностью, в отличие от Ch. plumosus, в спектре которого преобладают субъединицы из фракций с высокой подвижностью. Это согласуется с данными работ по установлению филогенетических отношений в роде Chironomus, где Ch. sp. Ya3 оказывается ближе к Ch. riparius и Ch. piger (Strenzke 1959) (Шобанов, Зотов, 2001).
Ранее Шобановым (2004) было высказано предположение, что фракции с высокой, средней и низкой подвижностью обладают разной функциональностью. Быстрые фракции (Rf 0.85 и выше) представляют собой продукты деградации гемоглобина, средние (0.58–0.83), вероятно, обладают высоким сродством к кислороду и обеспечивают его утилизацию при низких концентрациях в окружающей среде, медленные (0.43 и ниже) имеют высокую ММ и выполняют буферную функцию при анаэробиозе (Шобанов, 2004). У Ch. sp. Ya3 в “медленной” области отмечено три фракции с относительным содержанием 15.2%, что может свидетельствовать о его высокой устойчивости в бескислородных (анаэробных) условиях.
Таким образом, специфика местообитания может привести к тому, что у хирономид появляются значительные межпопуляционные различия, в том числе возникают уникальные хромосомные последовательности (Кикнадзе и др., 1996).
Находка Ch. sp. Ya3 в дельте р. Печора является первой для европейской части России и второй с момента его описания. Однако несмотря на расстояние более чем в 3500 км от места первой находки, новые последовательности нами не встречены, что, вероятно, обусловлено некоторым сходством условий обитания личинок. Разница по широте между сравниваемыми точками составляет около 3.5°, что соответствует примерно 380 км. В поселке Усть-Нера, где впервые был обнаружен исследуемый вид, и в устье р. Печора в зимний период регулярно фиксируются значения температуры ниже –40°C, а короткое и прохладное лето, когда температура в течение суток не опускается ниже 10°C, длится до полутора месяцев (Lavrienko et al., 2000). Кроме этого, немногочисленные исследования показывают высокое сходство между фаунами хирономид бассейна р. Печора, озер плато Путорана и бассейна р. Колыма (Nazarova et al., 2015), что также свидетельствует о сходстве условий.
Количества исследованных нами личинок из устья р. Печора недостаточно для оценки внутрипопуляционного хромосомного полиморфизма и его адаптивного значения у Ch. sp. Ya3. Тем не менее в исследуемой популяции имеется ряд особенностей. В результате цитогенетического исследования у личинок Ch. sp. Ya3 было обнаружено 9 известных последовательностей. При этом последовательность Ya3A2 впервые встречена в гомозиготном состоянии, а Ya3E2 с высокой частотой в гетерозиготном состоянии. Анализ спектра нативных гемоглобинов показал его высокое сходство с Ch. plumosus, в то время как по субъединичному составу изученный вид оказался ближе к Ch. riparius. Высокое разнообразие нативных гемоглобинов с разной подвижностью и их субъединиц может свидетельствовать о высокой выносливости вида, что косвенно подтверждается особенностью находки.
Список литературы
Большаков В.В., Шобанов Н.А., 2017. Влияние микроусловий среды обитания на формирование цитогенетической структуры популяции Chironomus plumosus из Рыбинского водохранилища // Генетика и биохимия водных животных. Труды Института биологии внутренних вод им. И.Д. Папанина РАН. Борок. № 80 (83). С. 20–29.
Демин С.Ю., 1989. Изменчивость степени конденсированности политенных хромосом в клетках разных органов личинок Chironomus plumosus из природы: Автореф. дис. … канд. биол. наук. Л. 25 с.
Кикнадзе И.И., Истомина А.Г., Гундерина Л.И., Салова Т.А., Айманова К.Г., Саввинов Д.Д., 1996. Кариофонды хирономид криолитозоны Якутии: Триба Chironomini. Новосибирск: Наука. 166 с.
Кикнадзе И.И., Шилова А.И., Керкис И.Е., Шобанов Н.А., Зеленцов Н.И., Гребенюк Л.П., Истомина А.Г., Прасолов В.А., 1991. Кариотипы и морфология личинок трибы Chironomini. Атлас. Новосибирск: Наука. 115 с.
Шобанов Н.А., 1994. Кариофонд Chironomus plumosus (L.) (Diptera, Chironomidae). IV. Внутри- и межпопуляционный полиморфизм // Цитология. Т. 36. № 11. С. 1129–1146.
Шобанов Н.А., 2004. Гетерогенность и гетерофункциональность гемоглобинов мотыля (Diptera, Chironomidae) // Журнал эволюционной биохимии и физиологии. Т. 40. № 4. С. 311–315.
Шобанов Н.А., Зотов С.Д., 2001. Цитогенетические аспекты филогении рода Chironomus Meigen (Diptera, Chironomidae) // Энтомологическое обозрение. Т. 80. № 1. С. 180–193.
Bolshakov. V.V., 2015. On techniques of maintenance of Chironomus dilutus larvae (Diptera, Chironomidae) on Bacto agar // Entomological Review. V. 95. № 6. P. 811–816.
Bolshakov V.V., Andreeva A.M., 2012. Peculiarities of structural organization of hemoglobin of Chironomus plumosus L. (Diptera: Chironomidae) // Journal of Evolutionary Biochemistry and Physiology. V. 48. № 3. P. 265–271.
Dévai G., Miskolczi M., Wülker W., 1989. Standardization of chromosome arms B, C and D in Chironomus (Diptera: Chironomidae) // Acta Biologica Debricina. Supplementum Oecologica Hungarica. V. 2. P. 79–92.
Gunderina L.I., Kiknadze I.I., Golygina V.V., 1999. Intraspecific differentiation of the cytogenetic structure in natural populations of Chironomus plumosus L., the central species in the group of sibling species (Chironomidae: Diptera) // Russian Journal of Genetics. V. 35. № 2. P. 142–150.
Gunderina L.I., Kiknadze I.I., Istomina A.G., Gusev V.D., Miroshnichenko L.A., 2005. Divergence patterns of banding sequences in different polytene chromosome arms reflect relatively independent evolution of different genome components // Russian Journal of Genetics. V. 41. № 4. P. 549–558.
Keyl H.G., 1962. Chromosomen evolution bei Chironomus. II Chromosomenumbauten und phylogenetische Beziehungen der Arten // Chromosoma. V. 13. № 4. P. 464–514.
Kiknadze I.I., 2016. Karyotypes of Palearctic and Holarctic species of the genus Chironomus [Electronic resource] / [Kiknadze I., Istomina A.G., Golygina V.V., Gunderina L.I., 2016. Russian Academy of Sciences, Siberian Branch, Federal Research Center Institute of Cytology and Genetics. Novosibirsk: Academic Publishing House “GEO”. 489 p.]
Kiknadze I.I., Siirin M.T., Wülker W., 1994. Siberian species of the riihimakiensis-group in the genus Chironomus. 2. Inversion polymorphism and cytophylogeny // Spixiana. V. 20. P. 115–125.
Laemmli U.K., 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage // Nature. V. 227. № 5259. P. 680–685.
Lavrinenko I.A., Rusanova G.V., Leummens H.J.L., 2000. General landscape and climate // Pechora Delta. Structure and dynamics of the Pechora Delta ecosystems (1995-1999) (ed. M.R. van Erden). Lelystad: Henk Bos, RIZA. P. 21–35.
Maurer H.R., 1971. Disc electrophoresis and related techniques of polyacrylamide gel electrophoresis. Walter de Gruyter. Berlin and New York. 222 p.
Nazarova L., Self A., Brooks S.J., van Hardenbroek M., Herzschuh U., Diekmann B., 2015. Northern Russian chironomid-based modern summer temperature data set and inference models // Global and planetary change. V. 134. P. 10–25.
Osmulski P.A., Leyko W., 1986. Structure, function and physiological role of Chironomus haemoglobin // Comparative Biochemistry and Physiology. V. 85B. № 4. P. 701–722.
Shobanov N.A., Bolshakov V.V., 2011. Karyofund of Chironomus plumosus (L.) (Diptera, Chironomidae): V. Terminal and Interstitial populations // Cell and Tissue Biology. V. 5. № 2. P. 196–201.
Walshe B., 1950. The function of haemoglobin in Chironomus plumosus under natural conditions // Journal of Experimental Biology. V. 27. P. 73–95.
Weber R., Vinogradov S., 2001. Nonvertebrate Hemoglobins: function and molecular adaptations // Physiological Review. V. 81. P. 569–628.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


