Зоологический журнал, 2020, T. 99, № 1, стр. 85-92
О дивергенции песни в группе “коричневых” форм пеночки-теньковки (Phylloscopus collybita sensu lato)
И. Ю. Ильина a, *, И. М. Марова a, П. В. Квартальнов a, В. В. Иваницкий a
a Биологический факультет Московского государственного университета
им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: irinailina.bio@gmail.com
Поступила в редакцию 08.11.2016
После доработки 26.11.2018
Принята к публикации 10.12.2018
Аннотация
Географическая изменчивость песни дает важный материал для понимания эволюции и уточнения таксономической структуры политипических видов птиц с обширными и сложно расчлененными ареалами. К числу таких видов принадлежит пеночка-теньковка. На пространстве ее транспалеарктического ареала выделяют несколько аллопатричных и парапатричных форм, которые различаются по размерам и вокализации, а по окраске оперения подразделяются на две группы: “зеленые” и “коричневые”. Мы провели сравнительный анализ песни трех аллопатричных “коричневых” форм (lorenzii, sindianus, tristis), а также одной “зеленой” формы (caucasicus), которая симпатрична с lorenzii (единственный случай практически полной симпатрии разных форм теньковок). Выявлена значительная степень дивергенции по ряду фонетических и синтаксических параметров. Полное разделение изученных форм может быть произведено по максимальной частоте песни и скорости ее исполнения (нот/с). Форму sindianus выделяет относительно высокочастотная и широкополосная песня. Самой низкочастотной песней и самым узким диапазоном обладает tristis. Она же лидирует по скорости исполнения песни (до 6–7 нот/с). Доля нот с восходящей модуляцией максимальна у tristis и минимальна у lorenzii; у caucasicus такие ноты отсутствуют – как и у прочих “зеленых” теньковок. Выявленные различия обсуждаются в свете гипотезы “акустической адаптации” и в связи с таксономическими взаимоотношениями между разными формами пеночки-теньковки.
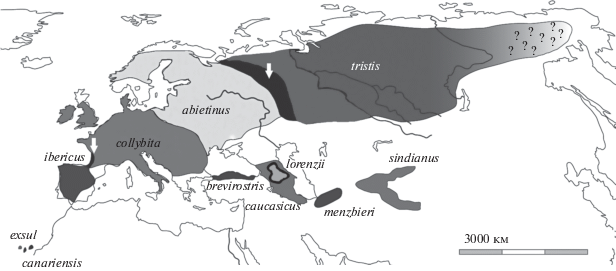
Географическая изменчивость песни птиц составляет традиционный предмет исследований в орнитологии и биоакустике. Во многих случаях такие исследования способствуют лучшему пониманию путей эволюции и таксономической структуры политипических видов птиц с обширными и сложно расчлененными ареалами (Payne 1986, Alström, Ranft, 2003). К числу таких видов принадлежит и пеночка-теньковка (Phylloscopus collybita sensu lato), чей ареал простирается от Северной Африки и Пиренеев до Байкала и Чукотки (Птушенко, 1954, Степанян, 1990). На этой огромной территории обитают несколько форм преимущественно с аллопатричным и парапатричным распространением (рис. 1). В настоящее время их объединяют в надвид, включающий несколько видов: 1) обыкновенная теньковка с подвидами Phylloscopus collybita collybita, Ph. c. abietinus, Ph. c. brevirostris, Ph. c. caucasicus и Ph. c. menzbieri; 2) пиренейская теньковка Ph. ibericus; 3) канарская теньковка Ph. canariensis c подвидами canariensis и exsul; 4) горная теньковка Ph. sindianus с подвидами lorenzii и sindianus; 5) сибирская теньковка Ph. tristis (Helbig et al., 1996; Clement, Helbig, 1998; del Hoyo, Collar, 2016). Форму tristis прежде считали подвидом обыкновенной теньковки (Helbig et al., 1996; Clement, Helbig, 1998; del Hoyo et al., 2006), но в настоящее время выделяют в самостоятельный вид (del Hoyo, Collar, 2016).
По окраске оперения разные формы теньковок традиционно разделяют на две группы: “зеленые” (greenish) и “коричневые” (brownish) (Ticehurst, 1938; Watson, 1962). У первых всегда присутствуют зеленоватые и желтые тона, степень выраженности которых варьирует у разных форм. У вторых зеленоватые и желтые тона практически полностью замещены серыми и бурыми. Различия между формами также хорошо выражены в размерах и песне. В зонах вторичного контакта некоторые формы гибридизируют друг с другом и встречаются особи с промежуточной окраской, размерами и смешанной песней (Salomon, 1987; Hansson et al., 2000; Helbig et al., 2001; Bensch et al., 2002; Марова, 2002; Mарова, Леонович, 1993; Marova et al., 2013; Shipilina et al., 2017).
В этой статье мы приводим результаты сравнительного анализа структуры песни у трех форм “коричневых” теньковок. Их географическое распространение строго аллопатричное: lorenzii обитает в восточной Турции, в Закавказье и на Кавказе; sindianus – на Памире и в Гималаях; tristis – к востоку от Северной Двины, Коми и Южного Урала до Байкала и Колымы. Хотя по внешним признакам все 3 формы похожи друг на друга и хорошо отличаются от “зеленых” теньковок, генетические исследования показали, что монофилия “коричневых” теньковок не является бесспорной. Близкое родство lorenzii и sindianus не вызывает сомнений (Tietze et al., 2015), однако tristis, по крайней мере по строению митохондриальной ДНК, стоит ближе к “зеленым” формам (Helbig et al., 1996), причем с одной из них (abietinus) гибридизирует на всем протяжении зоны вторичного контакта (Марова и др., 2009; Marova et al., 2017; Shipilina et al., 2017).
Хотя сведения о песне “коричневых” теньковок имеются в литературе (Martens, Hänel, 1981; Martens, Meincke, 1989; Mahler, Gil, 2009; Marova et al., 2013; Шипилина, Марова, 2013; Tietze et al., 2015), особенности их вокализации известны пока лишь в самых общих чертах, что весьма затрудняет анализ их таксономического статуса и эволюционных связей как между собой, так и с “зелеными” теньковками.
Взаимоотношения “коричневых” и “зеленых” теньковок заслуживают специального внимания. На западных рубежах своего обширного ареала “коричневая” tristis образует узкую, но протяженную зону гибридизации с “зеленой” abietinus (Марова и др., 2009; Marova et al., 2013, 2017). Интересна также ситуация на Кавказе, где перекрываются ареалы “коричневой” lorenzii и “зеленой” caucasicus. Это единственный пример широкой симпатрии разных форм теньковок. Хотя lorenzii и caucasicus населяют в целом разные местообитания, в некоторых районах Кавказа они живут бок о бок, и между ними происходит гибридизация (Моламусов, 1967; Марова, 2002; Шипилина, Марова, 2013, Marova, 1998). Поэтому нам представляется интересным наряду с песней “коричневых” форм рассмотреть в сравнительном плане также и песню caucasicus, тем более что в обобщающих работах о вокализации пеночек сведения об этой форме отсутствуют или же представлены скудно (Mahler, Gil, 2009; Tietze et al., 2015).
МАТЕРИАЛЫ И МЕТОДЫ
Материалы собраны в рамках нашего многолетнего проекта по изучению географической дифференциации пеночки-теньковки на всем пространстве ее ареала. Для записи в полевых условиях использовали цифровые рекордеры Marantz PMD 620 и 660, выносные направленные конденсаторные микрофоны Sennheiser МЕ 66 с модулем-предусилителем К 6, а также микрофоны Philips SBS ME 570 с параболическим рефлектором Sony PBR-330. Визуализацию и измерение сигналов проводили в программах Syrinx (J.M. Burt: http://syrinxpc.com) и Avisoft SASLab Pro.
Для анализа были сформированы следующие выборки: 1) caucasicus из двух поселений на Черноморском побережье Кавказа: из окрестностей г. Туапсе (Краснодарский край; 44°07′ с.ш., 39°01′ в.д.) и из окрестностей с. Цебельда (Цабал) (республика Абхазия; 43°02′ с.ш., 41°17′ в.д.) (по 5 самцов из каждой популяции, всего 10); 2) tristis из среднего течения Енисея (поселок Мирное, Красноярский край; 62°29′ с.ш., 81°01′ в.д.) и из Якутии (62°04′ с.ш., 129°75′ в.д.) (по 5 самцов из каждой популяции, всего 10); 3) lorenzii из Кавказского заповедника (Краснодарский край; 43°07′ с.ш., 40°26′ в.д.) и Тебердинского заповедника (Карачаево-Черкесская республика; 43°42′ с.ш., 41°74′ в.д.) (по 5 самцов из каждой популяции, всего 10); 4) sindianus из двух изолированных поселений в Западном Бадахшане: из долины р. Пяндж (кишлак Зумудг, Горно-Бадахшанская автономная область республики Таджикистан; 36°55′ с.ш., 72°11′ в.д.) и из долины р. Гунт (кишлак Дехмиёна, Горно-Бадахшанская автономная область республики Таджикистан; 37°42′ с.ш., 071°54′ в.д.) (по 5 самцов из каждого поселения, всего 10).
Из фонограммы каждого самца мы включили в анализ 3 фрагмента песни продолжительностью 3 с. Для каждого фрагмента определили следующие параметры: 1) максимальную частоту, 2) минимальную частоту, 3) пиковую частоту, 4) частотный диапазон, 5) скорость пения (число нот песни, исполненных за 1 с, 6) продолжительность нот, 7) вокальный индекс (доля нот с восходящей частотной модуляцией на начальном отрезке от общего числа нот) (Марова и др., 2009), 8) число типов нот (объем репертуара). Поскольку для каждого самца имелось по 3 измерения, для дальнейших расчетов использовали их медианные значения (с целью избегания псевдорепликации данных). При оценке параметра 6 (продолжительность нот) каждый 3-секундный отрезок характеризовали медианой этого параметра, а потом считали медиану для данного самца.
Достоверность влияния фактора принадлежности к выборке оценивали с помощью теста Крускала-Уоллиса с последующим анализом парных различий. Для интегральной оценки сходства между выборками по всем измерениям использовали непараметрический метод построения деревьев классификации, реализованный в программном пакете Statistica 8.0. Суть этого метода состоит в том, что первоначальная выборка объектов – в зависимости от их сходства по выбранным признакам – несколько раз последовательно делится на две выборки. При этом в каждой выборке оказываются объекты, более сходные один с другим, нежели с объектами из другой выборки. Этот метод иногда рассматривается как непараметрический аналог дискриминантного анализа. Оба метода предсказывают принадлежность отдельных наблюдений (самцы) к определенному классу независимой категориальной переменной (популяции) в зависимости от соответствующих значений независимых переменных (измерения песни). Как и дискриминантный анализ, метод деревьев классификации позволяет анализировать вклады отдельных переменных в процедуру классификации.
РЕЗУЛЬТАТЫ
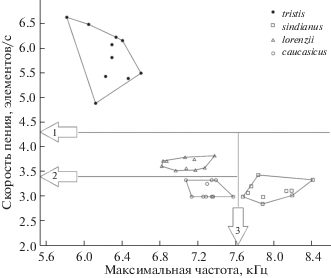
Образцы песен изученных форм теньковки и их количественные параметры приведены на рис. 2 и 3. Обращает на себя внимание весьма значительная степень дивергенции песни у всех “коричневых” теньковок. Прежде всего это касается частотных характеристик. Форму sindianus выделяет высокочастотная и широкополосная песня. Верхняя и нижняя границы частотного диапазона достоверно выше, чем у других “коричневых” теньковок (тест Крускала-Уоллиса, р < 0.01), однако, по величине пиковой частоты, достоверных отличий от lorenzii не найдено. Самой низкочастотной песней и самым узким диапазоном обладает tristis. Вместе с тем, по значению пиковой частоты песня tristis не отличается от песни caucasicus.
Рис. 2.
Образцы песни теньковок: А, Б, В – sindianus; Г, Д – lorenzii; Е, Ж – tristis; З – caucasicus. На каждой сонограмме представлен фрагмент песни одного самца. По вертикальной оси – частота, кГц; по горизонтальной оси – время, с.
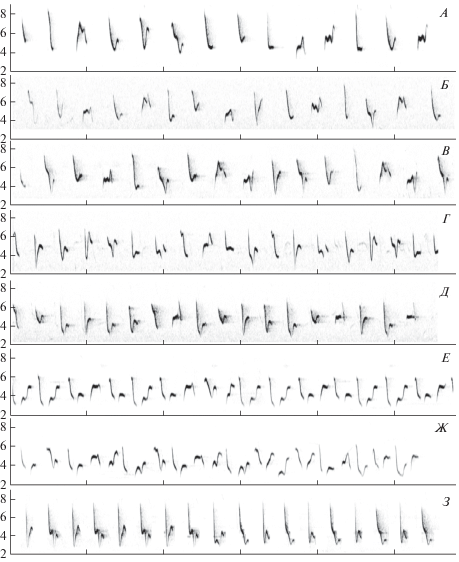
Рис. 3.
Параметры песни теньковок: 1 – sindianus, 2 – lorenzii, 3 – tristis, 4 – caucasicus. A – максимальная частота, Б – минимальная частота, В – частотный диапазон, Г – пиковая частота, Д – скорость пения, Е – объем репертуара, Ж – вокальный индекс, З – продолжительность отдельных нот. Достоверность парных различий: * P < 0.05, ** P < 0.01, *** P < 0.001.
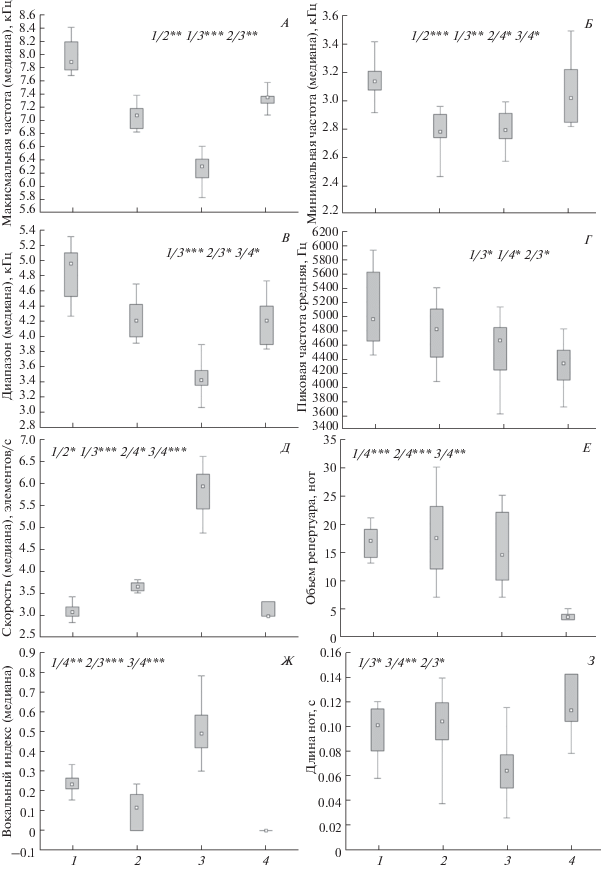
По скорости исполнения песни (плотность “упаковки” нот) с большим отрывом лидирует tristis (до 6–7 нот/с), отчего ее пение резко отличается на слух от других форм теньковок и воспринимается на слух как практически слитное. Отметим также значительный размах изменчивости по этому параметру именно у формы tristis, что заметно выделяет ее среди прочих форм, в ряду которых относительно быстрой песней выделяется lorenzii (3–4 нот в секунду). Самцы sindianus и caucasicus чаще всего исполняют 3 ноты за 1 с. Такой ритм типичен также и для других “зеленых” теньковок (collybita, abietinus) (наши данные).
Ноты с восходящей модуляцией частоты на начальном отрезке в целом присущи всем “коричневым” теньковкам. Более того, репертуары всех трех форм, обитающих вдалеке друг от друга на Кавказе, на Памире и в Сибири, содержат по крайней мере один общий и притом достаточно своеобразный тип нот с восходящей модуляцией (рис. 2). Максимальной величиной вокального индекса характеризуется пение tristis, которая по этому параметру достоверно отличается как от lorenzii, так и от sindianus (тест Крускала-Уоллиса; р < 0.05). Минимальные значения вокального индекса среди “коричневых” форм присущи lorenzii, однако отличия от sindianus не достигают порога статистической достоверности. Отметим, что некоторые самцы lorenzii вообще исполняют ноты с восходящей модуляцией очень редко (рис. 2Г). В песне caucasicus такие ноты всегда отсутствуют. Эта особенность типична для всех “зеленых” теньковок. Вокальный индекс в этом случае равен нулю (рис. 2А).
По объему репертуара разные формы “коричневых” теньковок между собой не различаются. Репертуар caucasicus намного беднее, и в этом отношении эта форма отчетливо сближается с прочими “зелеными” формами. Еще одна характерная особенность пения, свойственная всем “зеленым” теньковкам, это регулярное повторение одинаковых нот по ходу исполнения песни (до 5–6 нот подряд). В пении “коричневых” теньковок такие повторения отсутствуют, каждая следующая нота всегда отлична от предыдущей. В то же время для tristis типичны так называемые “мотивы” – многократные серийные повторения стереотипных последовательностей, состоящих из 3–5 нот.
Таким образом, вокализация изученных форм различается по целому ряду фонетических и синтаксических параметров. Это подтверждают результаты разделения выборок с помощью построения дерева классификации, в схематичной форме представленные на рис. 4. На первом шаге разделяющим признаком служит скорость пения с пороговым значением 4.3 нот/с. По этому признаку отделяются все 10 самцов tristis. На следующем шаге на первое место выходит максимальная частота песни, отделяющая sindianus от lorenzii и caucasicus. Две последние формы полностью разделяются на третьем шаге – снова по значению скорости пения, но на этот раз с порогом 3.4 нот/с. Таким образом, полная “дискриминация” всех четырех изученных нами форм может быть произведена всего по двум признакам песни: ее максимальной частоте и скорости исполнения (рис. 3).
ОБСУЖДЕНИЕ
Как уже отмечалось, все формы “коричневых” теньковок строго аллопатричны и, следовательно, биоакустические различия между ними не могут быть связаны с поддержанием репродуктивной изоляции.
Согласно гипотезе “акустической адаптации” частотно-временны́е параметры сигналов животных отражают их адаптацию к тем особенностям среды, которые влияют на распространение звука. Так, в местообитаниях с густой растительностью, где основной помехой является реверберация, выгодно использовать относительно низкочастотные и узкополосные сигналы с более продолжительными паузами между нотами. Напротив, в открытых местообитаниях, распространение звука в которых часто бывает затруднено порывами ветра, преимущество имеют более высокочастотные сигналы с широким частотным диапазоном и короткими разделяющими паузами (Morton, 1975).
Местообитания “коричневых” теньковок существенно различаются по характеру растительности и по абсолютной высоте над уровнем моря. Так tristis – строго лесная, таежная форма. На большей части своего обширного ареала она обитает в высокоствольной равнинной тайге и поднимается в горы лишь в пределах распространения типичной таежной растительности до высоты 1500–2000 м над ур. м. (Алтай, Саяны). Характерные местообитания lorenzii на Кавказе и в восточной Турции сосредоточены у верхней границы леса, где этот форма многочисленна в полосе кустарников, редколесий и криволесья на высотах от 1800 до 2500 м над ур. м. Еще выше обитает sindianus. Область ее распространения на Памире и в Западных Гималаях простирается от 2000 до 4500 м над ур. м. (Квартальнов и др., 2015; Tiсehurst, 1938). В Бадахшане она обитает преимущественно в поймах горных рек, заросших облепихой, ивами и тамариском (Квартальнов и др., 2015), поселяясь и по берегам стремительных шумных потоков.
Такое распространение видов и такие особенности их пения лишь отчасти соответствуют гипотезе “акустической адаптации”. Использование высоких частот и ширина частотного диапазона падает в ряду sindianus – lorenzii – tristis параллельно с увеличением густоты растительности. Вместе с тем, временнáя структура песни вышеупомянутой гипотезе не соответствует. Самые короткие промежутки между нотами мы видим в песне tristis, а самые длинные – у sindianus. Скорее всего, дивергенция физических параметров песни у разных форм теньковки была обусловлена сложным комплексом причин, в ряду которых наряду с приспособительными механизмами могли иметь место и чисто случайные изменения в условиях аллопатрического распространения популяций, отделенных одна от другой тысячами километров.
Хотя песни sindianus и lorenzii различаются по частотному диапазону и скорости исполнения, по “морфологии” нот они, несомненно, сходны. С этой точки зрения, версия конспецифичности этих форм под общим названием “горная теньковка” (Ph. sindianus) выглядит обоснованной, тем более что она поддерживается и достаточно высоким генетическим сходством. Вопрос о взаимоотношениях горной и сибирской теньковок (форма tristis) более сложен и, как уже отмечалось, едва ли может быть решен однозначно. Сходство их пения (и их отличие от всех “зеленых” форм) обусловлено использованием нот с восходящей частотной модуляцией, хотя и в разной пропорции. В песне “зеленых” теньковок такие ноты полностью отсутствуют, поэтому отнесение tristis в качестве подвида к европейской теньковке Phylloscopus collybita (del Hoyo et al., 2006) с биоакустической точки зрения вряд ли оправдано. В то же время, по генетическим признакам “коричневая” сибирская теньковка стоит ближе именно к “зеленым” формам, а вовсе не к “горным” теньковкам (Helbig et al., 1996; Tietze et al., 2015). Кроме того, в зоне вторичного контакта “коричневой” tristis и “зелёной” abietinus между ними происходит массовая гибридизация и имеет место значительная генетическая интрогрессия, а в экспериментах с трансляцией территориальные самцы реагируют на песню другой формы (Марова и др., 2009; Marova et al., 2013, 2017; Shipilina et al., 2017).
Любопытно, что при сравнении песен теньковок по количественным параметрам наиболее сходны оказались “коричневая” lorenzii и “зеленая” caucasicus, т.е. формы, удаленные друг от друга по морфологическим и генетическим признакам, но широко симпатричные на Кавказе. Несомненное сходство между ними можно видеть и в “морфологии” нот (т.е. в форме частотной модуляции отдельных нот) регулярно используемых в песне этих форм (рис. 2). Примечательно, что такие ноты, будучи весьма популярными на Кавказе и в Предкавказье, крайне редко исполняются прочими “зелеными” теньковками (collybita и abietinus) (Марова и др., 2018). Тем менее, в целом по форме частотной модуляции (в частности, это присутствие нот с восходящей модуляцией) все “коричневые” теньковки ближе одна к другой, чем к кавказской теньковке caucasicus, у которой, как и у всех “зеленых” форм, нот с восходящей модуляцией в песне нет вовсе. Что касается сходства песен caucasicus и lorenzii, то не исключено, что оно, по крайней мере отчасти, обязано своим происхождением длительному контакту между этими формами, широко симпатричными на Кавказе и в Закавказье. Хотя их местообитания в целом приурочены к разным высотным поясам и разной растительности, местами они все же обитают бок о бок (Марова, 2002; Marova, 1998), что может способствовать гибридизации, взаимному вокальному обучению и, в итоге, сближению вокальной манеры этих форм. Сходство песен lorenzii и caucаsicus – явно не случайное явление и, вероятно, отражает сложные взаимодействия двух форм (или видов) в далеком прошлом.
Список литературы
Квартальнов П.В., Ильина И.Ю., Абдулназаров А.Г., Грабовский А.В., 2015. Гнездовая биология горной теньковки (Phylloscopus sindianus: Aves, Phylloscopidae) // Бюллетень Московского общества испытателей природы. Отдел биол. Т. 120. С. 11–27.
Марова И.М., 2002. Пространственные, экологические и репродуктивные отношения между зелеными и коричневыми формами теньковок в зонах вторичного контакта на Кавказе // Птицы южной России. Материалы Междунар. орнитол. конференции “Итоги и перспективы развития орнитологии на Северном Кавказе в XXI веке”. Труды Тебердинского государственного природного биосферного заповедника. Вып. 31. С. 139–142.
Марова И.М., Ильина И.Ю., Квартальнов П.В., Грабовский В.И., Иваницкий В.В., 2018. От Босфора до Копетдага: биоакустическая дифференциация теньковок в Турции, на Кавказе и в Западном Туркменистане // Материалы Всерос. конф., посвященной 120-летию со дня рождения профессора Г.П. Дементьева, сборник “Орнитология: история, традиции, проблемы и перспективы”. M.: Товарищество научных изданий КМК. С. 232–236.
Марова И.М., Леонович В.В., 1993. О гибридизации сибирской (Phylloscopus collybita tristis) и восточно-европейской (Ph. c. abietinus) теньковок в зоне их симпатрии // Гибридизация и проблема вида у позвоночных. Сборник трудов Зоомузея МГУ. Т. 30. С. 147–163.
Марова И.М., Фёдоров В.В., Шипилина Д.А., Алексеев В.Н., 2009. Генетическая и вокальная дифференциация в гибридных зонах воробьиных птиц: сибирская и восточно-европейская теньковки (Phylloscopus [collybita] tristis и Ph. [c.] abietinus) на Южном Урале // Доклады Академии Наук. Т. 427. С. 384–386.
Моламусов Х., 1967. Птицы центральной части Северного Кавказа. Нальчик: Кабардино-Балкарское книжное изд-во. 121 с.
Птушенко Е.С., 1954. Семейство славковые Sylviidae. Птицы СССР. М.: Советская наука. Т. 4. С. 142–398.
Степанян Л. С., 1990. Конспект орнитологической фауны СССР. М.: Наука. 726 с.
Шипилина Д.А., Марова И.М., 2013. Местообитания, структура популяции и индивидуальная изменчивость песни кавказской пеночки (Phylloscopus lorenzii) на Северном Кавказе // Орнитология. Т. 38. С. 54–63.
Alström P., Ranft R., 2003. The use of sounds in avian systematics and the importance of bird sound archives // Bulletin of the British Ornithologists’ Club 123A. P. 114–135.
Bensch S., Helbig A.J., Salomon M., Seibold I., 2002. Amplified fragment length polymorphism analysis identifies hybrids between two subspecies of warblers // Molecular Ecology. V. 11. P. 473-481.
Clement P., Helbig A.J., 1998. Taxonomy and identification of chiffchaffs in the Western Palearctic // British Birds. V. 91. P. 361–376.
Hansson M.C., Bensch S., Brännström O., 2000. Range expansion and the possibility of an emerging contact zone between two subspecies of chiffchaff Phylloscopus collybita ssp. // Journal of Avian Biology. V. 31. P. 548–558.
Helbig A.J., Martens J., Seibold I., Henning F., 1996. Phylogeny and species limits of the Palaearctic chiffchaff Phylloscopus collybita complex: mitochondrial genetic differentiation and bioacoustic evidence / // Ibis. V. 138. P. 650–666.
Helbig A.J., Salomon M., Bensch S., Seibold I., 2001. Male-biased gene flow across an avian hybrid zone: Evidence from mitochondrial and microsatellite DNA // Journal of Evolutionary Biology. V. 14. P. 277–287.
del Hoyo J., Elliott A., Christie D. A. eds., 2006. Handbook of the birds of the World. Old World Flycatchers to Old World Warblers // Lynx edition. Barcelona. V. 11. P. 798.
del Hoyo J., Collar N.J., 2016. Handbook and BirdLife International Illustrated Checklist of the Birds of the World // Lynx edition. Barcelona. V. 2. P. 1013.
Mahler B., Gil D., 2009. The Evolution of Song in the Phylloscopus Leaf Warblers (Aves: Sylviidae): A Tale of Sexual Selection, Habitat Adaptation, and Morphological Constraints // Advances in the study of behavior. V. 40. P. 35–65.
Marova I.M., 1998. Räumliche, ökologische und reproductive Beziehungen zwishen der „grünen“ und “braunen“ Form des Zilpzalpes (Phylloscopus collybita caucasicus – Ph.lorenzii) in Sekundärkontaktzone im Kaukasus // 130. Jahresversammlung der Deutschen Ornithologen-Gesellschaft, Neubrandenburg, 24-29 Sept. 1997. Journal für Ornithologie. Bd. 139. S. 212.
Marova I.M., Shipilina D.A., Fedorov V.V., Ivanitskii V.V., 2013. Siberian and East European chiffchaffs: geographical distribution, morphological features, vocalization, phenomenon of mixed singing, and evidences of hybridization in sympatry zone // In N.R. Garcia & J.L. CJ (Eds), El mosquitero ibérico. Grupo Iberico de Anillamiento. P. 119–139.
Marova I., Shipilina D., Fedorov V., Alekseev V., Ivanitskii V., 2017. Interaction between Common and Siberian Chiffchaff in a contact zone // Ornis Fennica. V. 94. P. 66–81.
Martens J., Hänel S., 1981. Gesangsformen und Verwandtschaft der asiatischen Zilpzalpe Phylloscopus collybita abietinus und Ph. c. sindianus // Journal für Ornithologie. V. 122. P. 403–427.
Martens J., Meincke J., 1989. Der sibirische Zilpzalp (Phylloscopus collybita tristis): Gesang und Reaktion einer mitteleuropaischen Population im Freilandversuch // Journal für Ornithologie. V. 130. P. 455–473.
Morton E.S., 1975. Ecological sources of selection on avian sounds // American Naturalist. V. 109. P. 17–34.
Payne R.B., 1986. Bird songs and avian systematics // Current Ornithology. V. 3. P. 87–126.
Salomon M., 1987. Analyse d’une zone de contact entre deux formes parapatriques: le cas des Pouillots velose Phylloscopus c. collybita and P. c. brehmii in the western Pyrenees // Revue d’Ecologie (Terre et Vie). V. 42. P. 377–420.
Shipilina D., Serbyn M., Ivanitskii V., Marova I., Backström N., 2017. Patterns of genetic, phenotypic, and acoustic variation across a chiffchaff (Phylloscopus collybita abietinus/tristis) hybrid zone // Ecology and Evolution. V. 7. P. 2169–2180.
Ticehurst C.B., 1938. A Systematic Review of the Genus Phylloscopus (Willow-Warblers or Leaf-Warblers). London: Trustees of the British Museum. P. 193.
Tietze D.T., Martens J., Fischer B.S., Sun Y.H., Klussmann-Kolb A., Päckert M., 2015. Evolution of leaf warbler songs (Aves: Phylloscopidae) // Ecology and Evolution. V. 5(3). P. 781–798.
Watson G., 1962. A re-evaluation and redescription of a difficult Asia Minor Phylloscopus // Ibis. V. 104. P. 347–352.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал