Зоологический журнал, 2020, T. 99, № 10, стр. 1187-1195
Cladocera и Copepoda горных болот Северного Кавказа: состав и закономерности формирования видовых комплексов
М. Д. Аксенова a, *, Е. С. Чертопруд a, b, **, А. А. Новичкова a, b, ***, А. Н. Цыганов a, b, ****, Д. С. Печёнкин c, *****, Ю. А. Мазей a, b, ******
a Биологический факультет Московского государственного университета
имени М.В. Ломоносова
119234 Москва, Россия
b Институт экологии и эволюции имени А.Н. Северцова РАН
119071 Москва, Россия
c Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии
107140 Москва, Россия
* E-mail: masha.d.aksenova@gmail.com
** E-mail: horsax@yandex.ru
*** E-mail: anna.hydro@gmail.com
**** E-mail: andrey.tsyganov@bk.ru
***** E-mail: pechenkinds@gmail.com
****** E-mail: yurimazei@mail.ru
Поступила в редакцию 08.04.2020
После доработки 12.04.2020
Принята к публикации 25.04.2020
Аннотация
В 2018 г. исследована фауна Cladocera и Copepoda горных сфагновых болот: четырех болот Республики Северная Осетия и пяти болот Республики Кабардино-Балкария. Для каждого болота описаны видовые комплексы, характерные для центральной части вторичных водоемов и для окружающей их сфагновой сплавины (на урезе воды). В собранных материалах обнаружен 31 вид микроскопических ракообразных. Среди них два вида Cladocera и восемь видов Copepoda впервые обнаружены для горных водоемов Северного Кавказа. Показано, что горные сфагновые болота являются форпостом распространения северных видов, что подтверждают находки двух видов Copepoda, типичных для более северных регионов. Численность микроракообразных в сфагновой сплавине часто в десятки раз больше, чем в толще воды болотных водоемов. Выявлено, что тип биотопа, сезонность, широта, долгота, высота над уровнем моря, температура, кислотность и минерализация совместно объясняют только 32.3% вариаций видовых комплексов. Данный факт указывает на сложную факторную регуляцию структуры водных сообществ в условиях высотной поясности.
Исследования сообществ, формирующихся в горных водоемах, расположенных на высоте более 1000 м над уровнем моря (над ур. м.), встречаются нечасто. Данный факт в большой степени объясняется труднодоступностью и невысокой ресурсной значимостью этих объектов. В связи с этим остается открытым ряд вопросов, касающихся закономерностей формирования водных сообществ на градиенте условий, связанных с высотной поясностью. С одной стороны, в условиях субальпийской и альпийской высотных зон водная фауна подвержена воздействию экстремальных значений факторов среды. Так, значительное влияние на структуру сообществ оказывает резкая сезонная изменчивость температуры, что обусловливает промерзание мелководных водоемов в зимний период (Vincent, Hobbie, 2019). Кроме того, в большинстве горных, а в особенности высокогорных (более 2000 м над ур. м.) водоемов обеднена кормовая база фауны за счет слабого развития фитопланктона (De los Ríos, Soto, 2007; Frau et al., 2015) и отсутствия зарослей макрофитов в прибрежной зоне (Rautio, Vincent, 2006). Перечисленные факторы могут отрицательно влиять как на видовое богатство, так и на численность водных организмов. С другой стороны, отсутствие во многих альпийских водоемах рыб (De los Ríos, 2005), напротив, позволяет беспозвоночным животным в ряде случаев достигать высокого обилия и занимать верхний трофический уровень (Vincent, Hobbie, 2019). При этом в условиях ограниченных пищевых ресурсов, в частности при низком обилии фитопланктона, ряд видов водной фауны способен переходить на питание детритом, а также развивающимися на дне бактериальными матами (Rautio, Vincent, 2006). Общие закономерности формирования состава видов, населяющих горные водоемы, также остаются дискуссионными. Условия среды, складывающиеся в высокогорьях, близки к таковым для арктических тундр. Это позволяет развиваться в них элементам фауны высоких широт, даже в тех случаях, когда горный массив находится в относительно южном регионе (Mani, 1968).
Одним из наиболее вероятных вариантов появления северных видов в горных водоемах является постледниковая колонизация. Другой возможный вариант связан с рефугиальным значением постоянных горных водоемов (Dumont, 1981), в особенности сфагновых болот, в которых могли сохраниться ледниковые реликты (Prokin et al., 2019). Относительный вклад реликтовых элементов фауны, постледниковых колонистов и видов, распространенных на прилежащих территориях, в общую фауну отдельных горных массивов пока остается не ясным.
Среди горных систем Евразии одной из крупнейших является Большой Кавказ, северные склоны которого расположены на территории российского региона Северный Кавказ. Основная часть публикаций о водных беспозвоночных Северного Кавказа посвящена сообществам бентоса, населяющим ручьи и малые реки предгорий и субальпийского пояса (Палатов, 2014; Палатов и др., 2016). При этом зоопланктон горных озер региона остается “белым пятном”. Информация о фауне планктонных организмов основана, в первую очередь, на фрагментарных данных середины прошлого века, обобщенных в ряде крупных монографий. Наиболее современные сведения о зоопланктоне горных водоемов Северного Кавказа касаются Башкаринских озер, расположенных в Приэльбрусье, и озер Шадхурей в Кабардино-Балкарии (Пежева и др., 2016). Относительно фауны горных сфагновых болот, формирующихся в котловинах небольших озер, сведения исчерпываются работами Тарноградского (1947, 1947а; 1959). В этих публикациях объединены все сведения о биоте болот, но большинство определений, в связи с изменениями таксономии, на настоящий момент являются сомнительными.
Целью данного исследования являлся анализ таксономического состава и биогеографической структуры фауны планктонных микроракообразных (Cladocera и Copepoda) ряда горных болот и врéменных водоемов Республик Северной Осетии и Кабардино-Балкарии (Северный Кавказ). Параллельно были описаны основные видовые комплексы планктонных ракообразных и выявлены факторы среды, определяющие их формирование.
МАТЕРИАЛЫ И МЕТОДИКА
Район исследований. Материал собран в начале июня и в сентябре 2018 г. в четырех сфагновых болотах Республики Северная Осетия и пяти – Республики Кабардино-Балкария. Изученные болота расположены в диапазоне высот от 800 до 2300 м над ур. м. Основные характеристики болот приведены в табл. 1. Детальные описания семи изученных болот даны в работе Прокина с соавторами (Prokin et al., 2019). Кроме того, в начале лета материал собран в двух врéменных водоемах, а осенью – в одном. Из изученных болот наиболее известно в литературе Тарское, которому посвящен ряд зоологических и геоботанических работ (Тарноградский, 1947а; Prokin et al., 2019 и т.д.). Самым большим (около 1 км2) является болото Чифандзар – крупнейшее в Северной Осетии, сформировавшееся около 5000 лет назад (Князев и др., 1992). Болото Уштулу специфично по гидрохимическому составу, поскольку имеет приток высокоминерализованных нарзанных грунтовых вод.
Таблица 1.
Характеристики изученных болот Северной Осетии и Кабардино-Балкарии
| Название | Координаты | Высота, м над ур. м. | Площадь, км2 | Характеристики воды, лето/осень | ||
|---|---|---|---|---|---|---|
| pH | температура, t °C | общая минерализация, ppm | ||||
| Тарское | 42.963 N 44.726 E | 800 | 0.0534 | 6.2/6.1 | 16.3/18.0 | 37/32 |
| Чифандзар | 42.919 N 43.514 E | 2289 | 0.5560 | 5.5/6.8 | 11.2/16.0 | 16/30 |
| Кубус Нижнее | 42.893 N 43.576 E | 2077 | 0.0049 | 7.0/7.1 | 10.5/12.0 | 7/10 |
| Кубус Верхнее | 42.893 N 43.577 E | 2080 | 0.0020 | 5.9/5.9 | 16.1/18.2 | 7/7 |
| Конское | 43.101 N 43.490 E |
1776 | 0.0002 | 6.7/6.7 | 20.9/19.1 | 42/33 |
| Заячье | 43.098 N 43.478 E | 1810 | 0.0001 | 4.3/4.3 | 12.4/18.3 | 32/28 |
| Высокое | 43.097 N 43.479 E | 1836 | 0.0015 | 4.9/5.1 | 14.4/15.4 | 20/19 |
| Круглое | 43.106 N 43.476 E | 1648 | 0.0001 | 6.9/6.8 | 20.2/21.3 | 194/259 |
| Уштулу | 42.975 N 43.335 E | 1995 | 0.1730 | 5.4/5.4 | 17.4/17.3 | 76/80 |
Отбор проб. В каждом болоте, в каждый из двух сезонов, было отобрано по три количественные пробы зоопланктона, локализованные в разных частях зеркала основного водоема. Зоопланктон отбирали сетью Апштейна (диаметр 0.2 м, размер ячеи 50 мкм), которую протаскивали 4 м в толще воды, параллельно дну. Данную процедуру для каждой количественной пробы повторяли три раза. В дальнейшем три количественные пробы были объединены в одну комплексную пробу. В болотах, не имеющих выраженного озерного зеркала (Тарское, Чифандзар и Кубус Нижнее), зоопланктон отбирали в небольших вторичных водоемах также планктонной сетью Апштейна, стараясь сохранить сходный объем пробы, как и в первом описанном случае. Всего было собрано 11 комплексных проб зоопланктона мае–июне и 9 – в сентябре. Кроме того, в болотах, имеющих выраженную сплавину вокруг основного вторичного водоема, каждый сезон отбирали пробы зоопланктона/мейобентоса из выжимок мха. При отборе этих проб фрагмент сплавины объемом 1 дм3 промывали пропущенной через фильтр водой, извлекая таким образом фауну, населяющую капилляры между растениями Sphagnum. Таких проб было собрано по шесть в начале лета и осенью. Все пробы фиксировали 90% этанолом.
Для каждого водоема были выполнены измерения температуры и основных гидрохимических параметров (pH и общая минерализация) воды (табл. 1), с помощью портативного pH-метра и кондуктометра Combo HI 98129 devices (Hanna Instruments).
Статистический анализ. Попарное сходство между пробами из разных биотопов и разных водоемов было оценено с помощью индекса сходства Сёренсена. Канонический анализ соответствий (CCA), проведенный на основании данных по относительному обилию (%) организмов, был использован для оценки влияния сезонности (включенной в анализ как номер дня отбора образцов в году), высоты над уровнем моря (м), температуры (°C), pH, минерализации (ppm) на структуру видовых комплексов микроракообразных.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фауна. В изученных горных водоемах за все время исследований обнаружен 31 вид ракообразных (табл. 2). Из них 10 видов были впервые отмечены для Северного Кавказа. Ветвистоусые ракообразные относились к двум семействам: Chydoridae (5 видов) и Daphnidae (7 видов). Среди них Daphnia cf. curvirostris и Simocephalus congener были впервые обнаружены для горных водоемов региона. Веслоногие ракообразные включали 17 видов. Кроме того, два представителя были определены только до уровня рода/семейства, в связи с деформацией конечностей особей. Отряд Сyclopoida объединял 14 видов, отряды Calanoida и Harpacticoida – три и два вида, соответственно. Восемь видов копепод впервые отмечены для Северного Кавказа: Acanthocyclops americanus, A. venustus venustus, Diacyclops crassicaudis, D. limnobius, Paracyclops affinis, P. fimbriatus fimbriatus, Arctodiaptomus dentifer и Bryocamptus minutus minutus. Наибольшее число видов встречено в болоте Конское (14 видов), где находится крупный вторичный водоем. Наименьшие показатели видового богатства характерны для небольшого болота Заячье с родниковым питанием и высокоминерализованного болота Уштулу (6 и 9 видов соответственно).
Таблица 2.
Список видов Cladocera и Copepoda, обнаруженных в изученных болотах и врéменных водоемах Северной Осетии и Кабардино-Балкарии в 2018 г.
| Вид | Водоемы | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Т | Ч | КН | КВ | К | З | В | Кр | У | Вв | |
| Cladocera | ||||||||||
| Alona affinis (Leydig 1860) | + | + | + | + | + | |||||
| A. guttata Sars 1862 | + | + | ||||||||
| Alonella excisa (Fischer 1854) | + | + | + | |||||||
| Coronatella rectangula (Sars 1862) | + | + | + | |||||||
| Ceriodaphnia reticulata (Jurine 1820) | + | + | + | |||||||
| Chydorus cf. sphaericus (O.F. Müller 1776) | + | + | + | + | + | + | + | + | + | + |
| Daphnia cf. curvirostris Eylmann 1887* | + | + | + | + | ||||||
| D. cf. obtusa Kurz 1875 | + | + | ||||||||
| D. cf. pulex Leydig 1860 | + | + | + | + | ||||||
| Simocephalus congener (Koch 1841)* | + | + | + | + | ||||||
| S. expinosus (Koch 1841) | + | + | ||||||||
| S. vetulus (O.F. Müller 1776) | + | + | + | + | ||||||
| Copepoda | ||||||||||
| Acanthocyclops americanus (Marsh 1893)* | + | + | + | + | + | + | ||||
| A. vernalis vernalis (Fischer 1853) | + | + | + | + | + | + | ||||
| A. venustus venustus (Norman et Scott 1906)* | + | + | + | + | ||||||
| Diacyclops bicuspidatus bicuspidatus (Schmankevitsch 1875) | + | + | ||||||||
| D. bisetosus (Rehberg 1880) | + | + | ||||||||
| D. crassicaudis (Sars 1863)* | + | |||||||||
| D. limnobius Kiefer 1936* | + | + | ||||||||
| Diacyclops. sp. | + | |||||||||
| Eucyclops serrulatus (Fischer 1851) | + | + | + | + | + | + | + | |||
| Megacyclops viridis (Jurine 1820) | + | + | + | + | + | + | + | |||
| Paracyclops affinis (Sars 1863)* | + | |||||||||
| P. fimbriatus (Fischer 1853)* | + | + | + | + | ||||||
| P. poppei (Rehberg 1880) | + | + | + | + | ||||||
| Platycyclops phaleratus (Koch 1838) | + | + | ||||||||
| Arctodiaptomus dentifer (Smirnov 1928)* | + | + | ||||||||
| A. fischeri (Rylov 1922) | + | + | ||||||||
| Diaptomidae spp. | + | + | + | |||||||
| Bryocamptus minutus minutus (Claus 1863)* | + | |||||||||
| B. zschokkei caucasicus Borutzky 1960 | + | + | ||||||||
| Общее число видов | 10 | 11 | 11 | 11 | 14 | 6 | 10 | 11 | 9 | 11 |
Среди микроракообразных, найденных в горных водоемах, Arctodiaptomus fischeri единственный является эндемиком кавказского региона (Боруцкий и др., 1991; Boxshall, Defaye, 2009). Виды Arctodiaptomus часто имеют узкие ареалы, приуроченные к отдельным высокогорным долинам (Dumont, Van de Velde, 1977). Гарпактикоида Bryocamptus zschokkei caucasicus характерна для горных районов Кавказа и Центральной Азии (Тянь-Шань и Гималаи). Два вида A. venustus venustus и Diacyclops crassicaudis типичны для северных районов Палеарктики и часто широко распространены в тундровой зоне (Фефилова, 2015). В относительно южных регионах эти виды редки и приурочены к родниковым водоемам. Основную часть фауны составляют микроракообразные с широкими Палеарктическими или Голарктическими ареалами (21 вид). Относительно изолированные горные водоемы такие виды заселяют благодаря переносу птицами или ветровому рассеиванию покоящихся стадий (Hurlbert et al., 1986).
Изученные сфагновые болота являются форпостом распространения северных таксонов, что подтверждают найденные в них два вида Copepoda, типичные для более северных регионов. Вероятно, эти виды являются постледниковыми колонистами, а рассматривать их как ледниковые реликты преждевременно ввиду недостаточного объема данных об ареалах. Эндемик найден всего один. Однако, предположительно, дальнейшие исследования увеличат число видов, специфичных для Северного Кавказа. В изолированных водоемах горных систем часто встречаются эндемичные таксоны (Manca et al., 1994; Kotov et al., 2010), что связано с рефугиальным значением этих водоемов, обусловившим сохранение в них элементов фаун других климатических периодов (Dumont, 1981; Zuykova et al., 2019). Однако в основном фауна зоопланктона высокогорий представлена видами с широкими ареалами, а эндемики составляют лишь малую часть видового богатства (Dumont, Van de Velde, 1977; Hamrová et al., 2012).
Данных о фауне зоопланктона горных водоемов Северного Кавказа немного, поэтому не удивительно, что выполненное исследование позволило выявить виды, новые для региона. Суммарное видовое богатство всех изученных болот (31 вид), в основном расположенных на высотах более 1500 м над ур. м., сопоставимо с этим показателем озера Шахдурей (26 видов), находящегося на высоте 1100 м (Пежева и др., 2016). При этом разнообразие Copepoda и Cladocera в более высокогорных Башкаринских озерах (2500 м над ур. м.) значительно ниже – всего девять видов (Пежева и др., 2016). Уменьшение видового богатства микроракообразных в высокогорьях, частично обусловленное снижением трофности водоемов, отмечено для ряда горных массивов (De los Ríos, Soto, 2007; Frau et al., 2015). Кроме того, увеличение интенсивности ультрафиолетового излучения с высотой над уровнем моря оказывает негативное влияние на планктонное сообщество, вызывая значительное замедление фотосинтеза фитопланктона, снижая выживаемость и замедляя рост зоопланктона (Sommaruga, 2001).
Структура видовых комплексов. В большинстве изученных водоемов по численности доминирует C. cf. sphaericus, составляя 40–100% от общей численности ракообразных. В наиболее хорошо прогреваемых болотах (Кубус Верхнее, Конское, Круглое и Уштулу), где температура воды достигает 16–21°C, в число доминантов часто выходят крупные Cladocera родов Daphnia и Simocephalus (до 87% от общей численности). Среди Copepoda чаще всего высокого обилия достигают виды родов Acanthocyclops и Diacyclops (до 66%). Одной из специфических черт видового комплекса в озере болота Конское является высокая численность A. dentifer (39–50%), осенью этот показатель слегка снижается. Доминирование ветвистоусых ракообразных в зоопланктоне в летний период характерно для горных водоемов, расположенных ниже границы альпийской зоны. Для высокогорных водоемов, напротив, характерно преобладание веслоногих ракообразных (Dumont, Van de Velde, 1977). В Гималаях на высотах более 4000 м над ур. м. озерный планктон бывает представлен исключительно видами отряда Calanoida. Веслоногие ракообразные являются термотолерантными (Peterson, 2001), что дает им преимущества при обитании в высокогорьях. Кроме того, веслоногие ракообразные по сравнению с ветвистоусыми нуждаются в более высоком содержании азота в пище, но более низком содержании фосфора (Dubovskaya et al., 2010), а для высокогорных олиготрофных озер как раз характерно низкое стехиометрическое значение P/N.
По составу ракообразных открытая часть изученных вторичных водоемов (озер, крупных бочагов) и сфагновая сплавина различаются незначительно (индекс сходства Сёренсена составляет 0.64 ± 0.19). Однако в пробах из мха обычно отсутствуют крупные Cladocera (Daphnia и Simocephalus), встречающиеся в открытых водоемах. Кроме того, в сфагнуме часто представлены мелкие разнообразные из семейства Chydoridae (Alona affinis, A. guttata и Alonella excisa). Характерно, что численность ракообразных в пространствах между растениями мха может быть в десятки раз больше, чем в толще воды болотных водоемов (для весны 86.8 ± 176.3 и 6.3 ± 15.0 экз./л соответственно). Даже в планктоне крупных вторичных водоемов отмечено много бентосных видов, что обусловлено смешением экологических групп в прибрежной зоне, а также, вероятно, миграциями видов, характерных для мха, из сплавины в толщу воды (Kotov, 2006).
Сравнительный анализ видовых комплексов изученных болот показал, что в начале лета эти болота можно условно разделить на четыре группы. Наиболее обширная из них объединяет шесть водоемов, где развитие зоопланктона находится на начальной стадии сезонной сукцессии (значение индекса Сёренсена 0.63 ± 0.14). Для них характерны низкие видовое богатство (4–5 видов) и обилие ракообразных в толще воды (1.0 ± 1.8 экз./л). Три другие группы сформированы болотами Конское, Круглое и Кубус Нижнее, которые в значительной степени различаются между собой и в такой же степени отличаются от других болот. В данных водоемах сообщество зоопланктона в это время года уже активно развивается и достигает более зрелых стадий сезонной сукцессии (8–12 видов, 19.2 ± 27.8 экз./л). Осенью сходные видовые комплексы формируются в болотах Конское, Уштулу и Кубус Верхнее, где одним из доминантов является D. pulex (0.58 ± 0.1). Кроме того, значительное сходство отмечено для расположенных рядом болот Заячье, Высокое, Конское и Круглое (0.55 ± 0.08).
Тип биотопа, сезонность, широта, долгота, высота над уровнем моря, температура, кислотность и минерализация совместно объясняли 32.3% общей вариации в структуре видовых комплексов зоопланктона (рис. 1). Первая ось ординации (ССА 1) положительно связана с площадью водоема и днем года, а отрицательно – с долготой. Высота и pH положительно связаны со второй осью (ССА 3), а с широтой эта ось связана отрицательно (табл. 3). Ось ССА 2, хотя и объясняет значительную долю дисперсии, на рис. 1 не представлена, поскольку с ней достоверно не связана ни одна из характеристик, выбранных для анализа. Виды Paracyclops fimbriatus, Acanthocyclops venustus, A. americanus, A. vernalis (Fischer 1853), Bryocamptus spp. и Alonella excisa преимущественно встречаются в крупных водоемах (болота Тарское и Чифандзар), расположенных в Северной Осетии, в конце вегетационного сезона. Напротив, Ceriodaphnia reticulata, Coronatella rectangula, Eucyclops serrulatus и Simocephalus expinosus преобладали в сообществах малых водоемов Кабардино-Балкарии весной. Simocephalus congener, S. expinosus, Paracyclops poppei, Megacyclops viridis и Bryocamptus spp. в основном обнаружены в более кислых (pH < 7) водоемах, расположенных на нижнем уровне исследованных высот (800 м над ур. м.). Arctodiaptomus dentifier, Platycyclops phaleratus, Diacyclops spp., Daphnia cf. pulex, Ceriodaphnia reticulata), Coronatella rectangula, Alona guttata, напротив, обильны в водоемах с более нейтральной средой на высотах более 1500 м над ур. м. Таким образом, географическое положение (включая высоту над уровнем моря), гидрологические и гидрохимические характеристики водоема, а также сезон года определяют значительную часть структурных особенностей сообществ. Данный факт хорошо согласуется с данными других работ по горным и арктическим регионам (Padate, Ekhande, 2014; Vincent, Hobbie, 2019). Однако бóльшая доля дисперсии остается не объясненной, что, вероятно, связано с высокой гетерогенностью исследуемых биотопов, а также спецификой отдельных водоемов. Существует ряд характеристик среды, которые не учтены в представленном анализе и которые определяют основную часть вариаций сообществ изученных горных болот.
Рис. 1.
Ординация видовых комплексов зоопланктона методом канонического анализа соответствий (CCA). T – температура, °С.
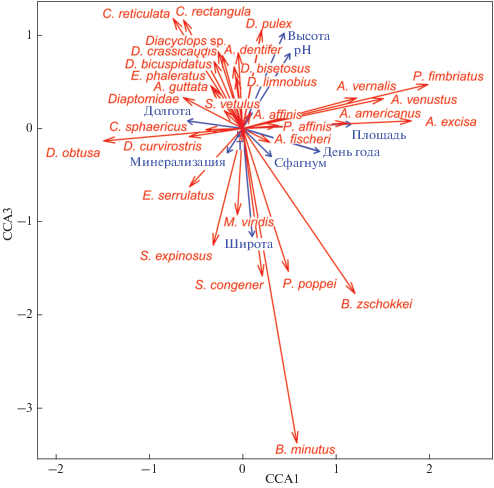
Таблица 3.
Результаты канонического анализа соответствий (CCA, показанные первые четыре оси) таксономического состава зоопланктонных сообществ
| Параметры | CCA1 | CCA2 | CCA3 | CCA4 |
|---|---|---|---|---|
| Собственное значение оси (eigenvalue) | 0.605 | 0.400 | 0.353 | 0.319 |
| p (n = 999 перестановок) | 0.033* | 0.694 | 0.822 | 0.883 |
| Корреляция факторов среды с осями | ||||
| Тип биотопа | 0.19 | –0.25 | –0.16 | –0.38* |
| День года | 0.50** | –0.20 | –0.09 | –0.02 |
| Долгота | –0.35* | –0.21 | 0.04 | 0.35* |
| Широта | 0.06 | –0.04 | –0.62*** | 0.00 |
| Площадь | 0.70*** | 0.26 | 0.03 | 0.10 |
| Высота, м над ур. м | 0.27 | 0.21 | 0.55** | –0.16 |
| Температура, °С | –0.03 | 0.06 | –0.05 | 0.21 |
| Минерализация, ppm | –0.10 | –0.02 | –0.14 | 0.27 |
| pH | 0.30+ | 0.13 | 0.43** | –0.05 |
Список литературы
Князев А.В., Савинецкий А.Б., Гей Н.А., 1992. История растительного покрова Северной Осетии в голоцене. Историческая экология диких и домашних копытных: история пастбищных. М.: Наука. С. 84–108.
Палатов Д.М., 2014. Высотная изменчивость реофильных сообществ макробентоса Кавказа и Закавказья // Материалы II Всероссийской школы-конференции “Экосистемы малых рек: биоразнообразие, экология, охрана”. Ярославль: Филигрань. С. 314–317.
Палатов Д.М., Чертопруд М.В., Фролов А.А., 2016. Фауна и типы сообществ макрозообентоса мягких грунтов водотоков горных районов Восточного Причерноморья // Биология внутренних вод. № 2. С. 45–55.
Пежева М.Х., Казанчев С.Ч., Авалишвили Е.Т., 2016. Типологическая классификация высокогорных карстовых озер Кабардино-Балкарской Республики на основе данных по зоопланктону // Вестник Красноярского государственного аграрного университета. Вып. 6. С. 50–56.
Тарноградский Д.А., 1947. К изучению водоемов северо-восточной Осетии // Работы Северо-Кавказской гидробиологической станции. Т. 5. Вып. 1. С. 3–17.
Тарноградский Д.А., 1947а. Микрофлора и микрофауна торфяников Кавказа. Тарское торфяное болото // Работы Северо-Кавказской гидробиологической станции. Т. 5. № 1. С. 19–34.
Тарноградский Д.А., 1959. Микрофлора и микрофауна торфяников Кавказа. 8. Осоковосфагновые озёра в верховьях реки Балкарский Черек // Работы Северо-Кавказской гидробиологической станции. Т. 6. № 3. С. 3–91.
Фефилова Е.Б., 2015. Веслоногие раки (Copepoda). Фауна европейского Северо-Востока России. М.: Товарищество научных изданий КМК. Т. 12. 319 с.
Boxshall G., Defaye D., 2009. World checklist of freshwater Copepoda species / World Wide Web electronic publication. http://fada.biodiversity.be/group/show/19
De los Ríos P., 2005. Richness and distribution of zooplanktonic crustacean species in Chilean Andes mountains and Southern Patagonia shallow ponds // Polish Journal of Environmental Studies. V. 14. P. 817–822.
De los Ríos P., Soto D., 2007. Crustacean (Copepoda and Cladocera) zooplankton richness in Chilean Patagonian lakes // Crustaceana. V. 80. № 3. P. 285–296.
Dubovskaya O.P., Kotov A.A., Korovchinsky N.M., Smirnov N.N., Sinev A.Y., 2010. Zooplankton of lakes in the spurs of the Putorana Plateau and adjacent territories (North of Krasnoyarsk Krai) // Contemporary Problems of Ecology. V. 3. № 4. P. 401–434.
Dumont H.J., 1981. Cladocera and free-living Copepoda from the Fouta Djalon and adjacent mountain areas in West Africa // Hydrobiologia. V. 85. № 2. P. 97–115.
Dumont H.J., Van de Velde I., 1977. Report on a collection of Cladocera and Copepoda from Nepal // Hydrobiologia. V. 53. № 1. P. 55–65.
Frau D., Battauz Y., Mayora G., Marconi P., 2015. Controlling factors in planktonic communities over a salinity gradient in high-altitude lakes // Annales de Limnologie-International Journal of Limnology. V. 51. P. 261–272.
Hamrova E., Krajicek M., Karanovic T., Cerny M., Petrusek A., 2012. Congruent patterns of lineage diversity in two species complexes of planktonic crustaceans, Daphnia longispina (Cladocera) and Eucyclops serrulatus (Copepoda), in East European mountain lakes // Zoological Journal of the Linnean Society. V. 166. P. 754–767.
Hurlbert S.H., Loayza W., Moreno T., 1986. Fish-flamingo-plankton interactions in the Peruvian Andes // Limnology & Oceanography. V. 31. P. 457–468.
Kotov A.A., 2006. Adaptations of Anomopoda Crustaceans (Cladocera) to the benthic mode of life // Zoologicheskiy Zhurnal. V. 85. P. 1043–1059.
Kotov A.A., Sinev A.Y., Berrios V.L., 2010. The Cladocera (Crustacea: Branchiopoda) of six high altitude water bodies in the North Chilean Andes, with discussion of Andean endemism // Zootaxa. V. 2430. P. 1–66.
Manca M., Cammarano P., Spagnuolo T., 1994. Notes on Cladocera and Copepoda from high altitude lakes in the Mount Everest Region (Nepal) // Hydrobiologia. V. 287. P. 225–231.
Mani M.S., 1968. Ecology and Biogeography of High Altitude Insects // Series Entomologica. V. 4. P. 1–528.
Padate G.S., Ekhande A.P., JV P., 2014. Seasonal Variations in Density and Species richness of Microcrustacea of High Altitude Lotus Lake, Toranmal (MS) India // Weekly Science International Journal. V. 1. № 30. P. 1–9.
Peterson W.T., 2001. Patterns in stage duration and development among marine and freshwater calanoid and cyclopoid copepods: a review of rules, physiological constraints, and evolutionary significance // Hydrobiologia. V. 453. P. 91–105.
Prokin A.A., Sazhnev A.S., Philippov D.A., 2019. Water beetles (Insecta: Coleoptera) of some peatlands in the North Caucasus // Nature Conservation Research. V. 4. P. 57–66.
Rautio M., Vincent W.F., 2006. Benthic and pelagic food resources for zooplankton in shallow high-latitude lakes and ponds // Freshwater Biology. V. 51. P. 1038–1052.
Sommaruga R., 2001. The role of solar UV radiation in the ecology of alpine lakes // Journal of Photochemistry and Photobiology. V. 62. P. 35–42.
Vincent W.F., Hobbie J.E., 2019. Ecology of Arctic Lakes and Rivers. The Arctic: Environment, People, Policies. Chapter 8. UK: Harwood Academic Publishers. P. 197–231.
Zuykova E.I., Bochkarev N.A., Taylor D.J., Kotov A.A., 2019. Unexpected endemism in the Daphnia longispina complex (Crustacea: Cladocera) in Southern Siberia // PLoS One. V. 14. № 9. e0221527. https://doi.org/10.1371/journal.pone.0221527
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


