Зоологический журнал, 2020, T. 99, № 10, стр. 1148-1159
Об особенностях эволюционного процесса у креветок (Crustacea, Decapoda)
Р. Н. Буруковский *
Калининградский государственный технический университет
236035 Калининград, Россия
* E-mail: burukovsky@klgtu.ru
Поступила в редакцию 01.03.2020
После доработки 15.03.2020
Принята к публикации 20.03.2020
Аннотация
Эволюция креветок не затронула существенных сторон их организации, вращаясь в кругу примерно одних и тех же адаптаций и порождая большое количество параллелизмов в пределах этой относительно небольшой группы членистоногих, т.е. шла по пути телогенеза. Древняя фауна креветок, как Dendrobranchiata, так и Pleocyemata, возникла на мелководье не позднее юры, что подтверждается находками остатков первых в мелководных отложениях сеномана (низы верхнего мела), и для вторых – находками представителей примитивных каридных креветок из семейства Procarididae, очень сходных морфологически с ископаемыми креветками юрского периода (например, Udorella agassizi), в качестве обитателей рефугиумов именно мелководий. Позднее, в результате радиации на родовом уровне, креветки освоили материковый склон и пелагиаль. Мелководные виды затем были вытеснены новой фауной креветок, заселяющей шельф. Предыдущая фауна креветок сместилась на материковый склон, как бы окаймляя его. Одна часть видов из разных таксонов уходила вдоль дна глубже, вплоть до абиссали; другая переходила к жизни в пелагиали. Это связано с ограниченностью пищевых ресурсов на склоне в местах с низким уровнем терригенного седиментогенеза. Многие виды перешли из детритной в пастбищную пищевую цепь. Процесс повторялся неоднократно, и каждый раз выжившие представители самой древней и следующей за ней фаун оказывались на еще больших глубинах. Отсюда следует, что для креветок характерен телогенез пульсирующего типа. Поэтому современная фауна креветок состоит из молодых групп шельфа с интенсивным кладогенезом, групп, персистирующих с мелового периода (или юры), и осколков предыдущих фаун, сохранившихся на больших глубинах и в рефугиумах на мелководьях.
Последний обзор исследований по эволюции креветок (Fransen, De Grave, 2009) продемонстрировал, что лишь небольшая их часть была подвергнута филогенетическим исследованиям на высоком и низком таксономических уровнях морфологическими и молекулярно-генетическими методами. Были выявлены многочисленные противоречия между результатами исследований, основанных на тех или других подходах, и в пределах каждого подхода. Это подтолкнуло нас к попытке реконструировать особенности эволюционного процесса и его движущие силы у креветок с помощью подхода, представленного в данной статье.
До этого, в процессе изучения строения мандибул у креветок (182 вида из 29 семейств: Буруковский, 1986б, 2009, 2017), мы столкнулись с тем, что, во-первых, особенности их строения тесно связаны не только с особенностями питания, но и со степенью связи креветок с дном и, во-вторых, возможности эволюционных изменений трофического модуля (трофоадаптациогенез) исчерпаны, и его эволюция представляет собой телогенез (Шмальгаузен, 1939). Это эволюция в сторону узкой специализации, в процессе которой, в частности, новые “игроки” на эволюционной арене демонстрируют раз за разом адаптации, аналогичные таковым у предыдущих “игроков”. Следовательно, они показывают изменения, находящиеся по своему уровню организации в той же плоскости, что и у предыдущих групп. Именно это обстоятельство подтолкнуло нас к поиску других эволюционных маркеров у креветок.
Под названием “креветки”, или “shrimp-like Decapoda” в англоязычной литературе (Fransen, De Grave, 2009), понимают бывший подотряд Natantia отряда Decapoda. Сегодня это две группы десятиногих ракообразных (Crustacea, Decapoda), объединяемых в подотряды Dendrobranchiata и Pleocyemata (Martin, Davis, 2001). На сентябрь 2011 г. они вместе насчитывали 4048 видов (De Grave, Fransen, 2011). Ниже мы рассматриваем данные из этой публикации. В подотряде Dendrobranchiata насчитывается 533 вида в 68 родах, объединяемых в два надсемейства: Penaeoidea (с пятью семействами) и Sergestoidea (с двумя семействами) (De Grave, Fransen, 2011). Креветки надсемейства Penaeoidea – преимущественно обитатели шельфа и его кромки в тропиках и пограничных акваториях субтропиков; имеются также немногочисленные абиссальные виды (обзор Pérez Farfante, Kensley, 1997). Представители семейства Penaeidae Rafinesque 1815, самого богатого видами (240 видов), – в основном донные, зарывающиеся виды, которые обитают на шельфе и его кромке (Pérez Farfante, Kensley, 1997); некоторые виды проникли в солоноватые лагуны и устья рек, где проводят часть своей жизни. Те виды, для которых изучали состав пищи (Буруковский, 2009), используют стратегию хищника-собирателя. Исключение – эпи- и мезопелагические креветки из рода Funchalia Johnson 1868 (5 видов), статус которых на данный момент неясен. Мы выделили их в отдельное подсемейство Funchaliinae (Буруковский, Роменский, 1991), с чем, без какого-либо обоснования этого, не согласились Перес Фарфанте и Кенсли (Pérez Farfante, Kensley, 1997). Фунхалии – типичные нападающие хищники. К донным формам относятся также креветки семейства Sicyonidae c единственным родом Sicyonia Ortman 1898 (52 вида) – циркумтропическим таксоном, который, обитая на шельфе и его кромке, не встречается глубже 500 м (Pérez Farfante, 1985). Возможно, это самая молодая группа пенеоидных креветок. Креветки семейства Solenoceridae, которое по количеству видов уступает только семейству Penaeidae (правда, в три раза: 83 вида в 9 родах), заселили весь шельф и его кромку чуть ли не от уреза воды до глубин примерно 500 м. Так, род Solenocera Lucas 1849 (37 видов) населяет весь материковый склон (Pérez Farfante, 1977), а род Gordonella Tirmizi 1960 (3 вида) представлен настоящими батипелагическими видами, которые обитают в нижней части склона, достигая ложа океана. Его представителей характеризует неокрашенный полупрозрачный мембраноподобный панцирь и отчасти редуцированные переоподы. Еще контрастнее выглядят представители рода Haliporus Spence Bate 1881 (3 вида): H. taprobanensis Alcock et Andersen 1899 – обитатель верхней части материкового склона на глубинах 520–1650, чаще всего – 700–850 м; H. thetis Faxon 1893 известен лишь по четырем находкам из абиссали восточной части Тихого океана на глубинах 2300–3625 м; H. curvirostris Spence Bate 1881 известен лишь по двум находкам, северо-восточней Марианской о-вов, на глубине 5700 м, рядом с Марианской впадиной, и восточнее и юго-западней архипелага Туамоту, на глубине 4361 м (Crosnier, 1978, 1988; Crosnier, Forest, 1973; Perez Farfante, Kensley, 1997; De Grave, Fransen, 2011; Буруковский, 2017). Следующее семейство – Aristeidae (26 видов в 9 родах), освоившее придонные слои океана на глубинах от кромки шельфа до абиссали, топически и трофически связанные с дном. Его представители могут только опираться на дно своими почти рудиментарными переоподами, на всех глубинах, хотя бы в первой половине онтогенеза (Буруковский, 2009, 2017). Последнее семейство – Benthesicymidae (39 видов в 5 родах), объединяющее бати- и мезопелагических креветок, которые потеряли связь с дном, зато приобрели типичные для пелагических креветок мягкие покровы, заметно редуцированные, утончившиеся две последние пары переопод, непригодные для передвижения по дну, и несколько гипертрофированные плеоподы (Pérez Farfante, Kensley, 1997).
Второе надсемейство Dendrobranchiata – Sergestoidea – содержит два облигатно пелагических семейства (Omori, 1975; Judkins, Kensley, 2008; Vereshchaka, 2000, 2010). Небольшое семейство Luciferidae с одним родом Lucifer J.V. Thompson 1829 (7 видов) представляет собой сильно специализированных очень мелких эпипелагических креветок, которых можно считать планктонными организмами прибрежных вод (Brooks, 1882). Второе семейство – Sergestidae – значительно богаче видами (11 родов и 101 вид) представлено в основном эпи-, мезо- и батипелагическими видами (Judkins, Kensley, 2008, Vereshchaka, 2000, 2010). Один из его родов – Acetes H. Milne-Edwards 1830 (12 видов и подвидов) – обитатель пелагиали тропических и, реже, субтропических шельфов. Общая особенность репродуктивной биологии подавляющего большинства дендробранхиат – отсутствие заботы о потомстве, которое выражается в том, что они откладывают очень мелкие пелагические яйца. Лишь креветки семейства Luciferidae приспособились вынашивать небольшое количество мелких яиц под полуредуцированной головогрудью на исхиумах переопод третьей пары (Brooks, 1882). Вероятно, именно поэтому представители Dendrobranchiata не смогли проникнуть в пресные воды и ограничились солоноватоводными участками (устья рек, лагуны – креветки родов Penaeus sensu lato – Holthuis, 1980).
Даже такое общее описание позволяет предположить, что среди Dendrobranchiata самое “старое” семейство – Solenoceridae, достигшее абиссали. Следующее по возрасту – семейство Penaeidae, существующее с низов верхнего мела (Tiwari, 1963), не выходящее за пределы кромки шельфа, но зато проникшее в солоноватые воды (дальше проникнуть, вероятно, пеидам помешало отсутствие заботы о потомстве). Наконец, самое молодое семейство – Sicyonidae. И именно на шельфе наблюдается самый активный кладогенез. Три самых активных в этом отношении рода (Solenocrra, Metapenaeosis и Sicyonia), взятые из каждого семейства, составляют примерно треть всех видов надсемейства Penaeoidea.
Второй путь эволюции надсемейства – проникновение в пелагиаль. На начальных этапах проникновения в пелагиаль находится семейство Aristeidae (26 видов в 9 родах) – при всей его относительной бедности видами оно демонстрирует тяготение к кромке шельфа и верхней части склона (16 видов из 26 в двух родах: Aristeus Duvernoy 1840 и Pseudoaristeus Crosnier 1978) и четко придонный образ жизни. О последнем свидетельствуют заметно редуцированные переоподы 4 и 5, которые позволяют стоять на грунте, и гипертрофированные плеоподы. Остальные 10 видов в 7 родах демонстрируют переход в нижнюю часть склона и, отчасти, в абиссаль (Crosnier, 1978; Gore, 1985), сохраняя придонный образ жизни. И, наконец, семейство Bentheisicymdae является мезо- и батипелагическим (Crosnier, 1978).
Можно заключить, что прослеживаются два основных пути эволюции пенеидных креветок: первый – вдоль дна в абиссаль и второй – в пелагиаль. Промежуточная ступень – придонные креветки семейства Aristeidae, которые дают максимум численности и видового разнообразия в верхней части материкового склона. Ма с соавт. (Ma et al., 2009) провели определение последовательностей ДНК двух ядерных кодирующих белок генов, фосфенол-пируват-карбоксикиназы и натрий-калиевой АТФ-а-субъединицы, у 37 родов Penaeoidea (половина всех родов! – прим. автора), чтобы восстановить эволюционные отношения и оценить возраст дивергенции пенеоидных креветок. Это позволило установить, что Penaeoidea представлены двумя эволюционными линиями. Первая линия включает семейства Solenoceridae, Aristeidae и Bentesicyemidae, вторая – семейства Penaeidae и Sicyonidae. Возможно, диверсификация этих линий может быть связана с глубинами, на которых они обитают. Пенеидная линия диверсифицировалась в триасе, т.е. раньше, чем аристеидоподобная линия, возникшая позже, в юре.
Эти выводы, в основном, не противоречат нашим предположениям, изложенным выше.
Эпипелагические шельфовые и, преимущественно, мезопелагические Sergestidae (Omori, 1975; Judkins, Kensley, 2008; Vereshchaka, 2000, 2010) – вероятно, другая, раньше ушедшая в пелагиаль ветвь дендробранхиатных креветок.
Подотряд Pleocyemata охватывает 7/8 всех известных на 2011 г.видов креветок. Их общая экологическая особенность – забота о потомстве, выражающаяся в вынашивании яиц на плавательных ножках абдомена – плеоподах. Подотряд подразделяется на три инфраотряда (De Grave, Fransen, 2011). Первый, Procarididea, включает в себя единственное семейство Procarididae с двумя родами: Procaris Chace et Manning 1972 (6 видов) и монотипический Vetericaris Kensley et Williams 1986. Эти рода обитают на вулканических островах в своеобразных рефугиумах (полости, которые сообщаются с морем и, которые образовались в застывшей лаве после растворения морем их внутреннего содержимого (Chace, Manning, 1972; Holthuis, 1973; Kensley, Williams, 1986).
Следующий инфраотряд – Stenopodidea, который включает три узко специализированных семейства (De Grave, Fransen, 2011): монотипическое Macromaxillocarididae, Spongicolidae (40 видов в 7 родах) содержит виды, сожительствующие со стеклянными губками (Буруковский, 2009), и Stenopodidae (30 видов в 4 родах) (De Grave, Fransen, 2011), представители которого, в основном, населяют коралловые рифы и знамениты сложным поведением. Например, представители рода Stenopus Latreille 1819 устраивают своеобразные “станции очистки” ротовой полости рыб от остатков пищи и поверхности тела от экзопаразитов (Буруковский, 1981б).
Последний инфраотряд Caridea с 14 надсемействами, 34 семействами, 389 родами и 3438 видами – второй по богатству видов в отряде Decapoda после крабов (Brachyura) (Holthuis, 1993; De Grave, Fransen, 2011). Среди многообразия его таксонов доминирует семейство Palaemonidae (981 вид), состоящее из двух подсемейств. Первое подсемейство – Pontoniinae, которое более богато видами (602), благодаря переходу к комменсализму с различными группами морских беспозвоночных, от Cnidaria до Mollusca (Bruce, 1995). Креветки подсемейства Palaemoninae с 379 видами, среди которых 243 вида относятся к роду Macrobrachium Spence Bate 1868, активно осваивают пресные воды, не теряя связи с морем и солоноватыми водами (Jayachandran, 2001). Следующее по числу видов – семейство Alpheidae включает 663 вида, из них 286 видов относятся к роду Alpheus Fabricius 1798, представители которого освоили разнообразные биотопы, в том числе демонстрируя синойкию в норах с рыбами-бычками (Pisces: Gobiidae) (Anker, 2001). На третьем месте находится семейство Atyidae, представители которого освоили пресные воды тропиков и субтропиков (Chace, 1972; Hobs, Hart, 1982; Holthuis, 1993). Семейство включает 469 видов, из них 290 относятся к роду Caridina H. Milne-Edwards 1837, заселившему, в том числе, все мелкие речки тропиков и демонстрирующему в отдельных регионах строгий эндемизм (De Grave, Fransen, 2011).
Представители этих трех семейств, демонстрирующих активный кладогенез на шельфе, в солоноватых и пресных водах, составляют половину от всего количества видов каридных креветок. Особенно активное видообразование идет на мелководьях тропической климатической зоны, что проявляется в победоносном освоении креветками пресных вод тропиков и субтропиков. Наряду с богатыми видами семействами имеются 12 семейств, содержащих по одному роду, некоторые из них вообще являются монотипическими, например, надсемейство Physetocarididea с единственным видом Physetocaris microphtalma Chace 1940 (Physetocarididae) (Holthuis, 1993; De Grave, Fransen, 2011). В целом же, резюмируя содержимое работ, цитированных выше, каридные креветки заселили весь Мировой океан от супралиторали до абиссали, освоили пресные воды на поверхности земли и под землей (в пещерах). Среди них есть зарывающиеся и живущие в укрытиях, эпибентосные, придонные, придонно-пелагические, пелаго-бентосные и, наконец, пелагические формы. Они могут быть травоядными и хищниками, детритофагами и некрофагами, могут быть комменсалами и могут демонстрировать очень сложные формы взаимоотношений с другими представителями животного мира (например, упомянутые выше креветки-чистильщики из разных таксономических групп или раки-щелкуны, сожительствующие с рыбами и другими гидробионтами) (Буруковский, 2009).
Даже такой макромасштабный обзор креветок позволяет обнаружить некоторые общие эволюционные траектории этой группы: ее возникновение на шельфе (и сохранение реликтовых групп в его рефугиумах), уход в абиссаль как по дну, так и через пелагиаль, а также неоднократные попытки освоения пресных вод, которые были реализованы только после возникновения заботы о потомстве (Palaemonidae и Atyidae – например, вышеупомянутые макробрахиумы и каридины, соответственно).
В основу другой нашей попытки реконструировать основные направления эволюционных процессов у креветок, приведших их мировую фауну к наблюдаемому ныне состоянию, по иным, но тоже косвенным признакам, положены наблюдения и выводы, сделанные в процессе пятидесятилетних исследований в области систематики, фаунистики и экологии креветок из самых разных таксономических групп. Предварительные соображения в этом направлении были нами изложены ранее (Буруковский, 1981в; 2003). Предлагаемый здесь текст содержит существенно переработанное, базирующееся, в том числе, на ранее неизвестной нам информации, расширенное и дополненное обоснование идей, высказанных в этих сообщениях.
Среди Decapoda креветки – относительно древняя группа. Их ископаемые остатки известны с триаса (пенеидные) и юры (каридные креветки). Среди них имеются целые группы, которые известны, по крайней мере, с мелового периода. Сюда относятся, например, представители Penaeus s. l., известные начиная с сеномана (низы верхнего мела) (Tiwari, 1963). Древность группы в какой-то степени подтверждается особенностями распространения некоторых современных видов из таксонов, входящих в Penaeus s. В Атлантическом океане (Буруковский, 1970). С о-ва Возрождения (Ю. Атлантика) был описан первый вид семейства Procarididae (Procaris ascensionis Chace et Manning1972) из полостей в вулканической породе, заполненных морской водой (Chace, Manning, 1972). Затем в аналогичных биотопах были обнаружены P. hawaiana Holthuis 1973 (Holthuis, 1973), Vetericaris chaceorum Kensley et Williams 1986 (Kensley, Williams, 1986) с Гавайских о-вов, P. chacei Hart et Manning 1986 (Hart, Manning, 1986) из подводных гротов на Бермудских о-вах, P. mexicana von Sternberg et Schotte 2004 (von Sternberg, Schotte, 2004) с о-ва Косумель, Кинтана-Роо, Мексика и, наконец, P. noelensis Bruce et Devie, 2006 (Bruce, Devie, 2006) с о-ва Рождества (Индийский океан).
Обнаружение нового циркумтропического-субтропического семейства креветок – событие в истории изучения группы. Но его значение куда выше уровня находки нового относительно крупного таксона. Все представители этого семейства по своему строению чрезвычайно близки к ископаемым креветкам Udorella agassizii Oppel 1862 (Udorellidae) и Udora spp. (семейство не установлено), живших 150 млн лет назад в верхнем мальме (юра) (Balss, 1956; Chace, Manning, 1972). Остатки последних найдены в литографском камне (мраморизованном известняке) Зольхофена (юго-восток Баварии, Германия). Когда-то здесь были морские мелководные лагуны с илистым дном, богатым карбонатами (Schweigert, Garassino, 2004). Можно предположить, что перечисленными примерами список форм, персистирующих в современной фауне с юры или мелового периода или, по крайней мере, с плиоцена и плейстоцена (например, род Typhlatya Creaser 1936: Chace, Manning, 1972, виды рода Nematocarcinus, имеющие амфиамериканские ареалы: Буруковский, 2012), не исчерпывается. К сожалению, особенности среды обитания креветок таковы, что их ископаемые остатки редки. Это ограничивает наши возможности при выработке суждения о путях эволюционного развития креветок.
Однако мы полагаем, что ключ к пониманию эволюционной истории креветок можно и нужно отыскать в особенностях их современной фауны. Это мы и собираемся сделать, используя несколько следующих допущений. Во-первых, мы исходим из того, что биогеографическая схема на видовом уровне отражает современные условия существования живого покрова (Семенов, 1973). Это хорошо демонстрируют, например, особенности распространения креветок в западно-африканских водах, где границы ареалов определяются современной структурой вод, в том числе положением гидроклиматических фронтов (Буруковский, 1998, 2017). В Атлантическом океане границы зоогеографических регионов мигрировали с севера на юг и обратно в течение последних десятков тысяч лет в связи с миграцией упомянутых выше фронтальных зон в результате смены климата (см., например, Бараш, 1974; Бараш, Окунева, 1981), а закономерности осадкообразования, с которыми связано становление экологической структуры таксоценов креветок и ее динамика (Буруковский, 1987), не менялись, как полагают, с мелового периода (Allen, 1964; Лисицин, 1974).
Считается, что экология более инертна, так как экологическая структура экосистем (понимая под этим соотношение жизненных форм в экосистеме: Буруковкий, 2017) устанавливается независимо от географической структуры фауны. Уже в пределах одного рода (особенно в крупных родах) в различных таксономических группах креветок виды обычно несколько различаются по своей экологии. Внутри рода обнаруживается спектр жизненных форм, различающихся по диапазону глубин обитания (как правило, у видов данного таксона, обитающих в одном зоогеографическом регионе), отношению к субстрату, размерам тела (и связанной с этим плодовитостью) и, реже, по типу питания. Для каждого политипического рода этот спектр более или менее широк (Буруковский, 1981а, 1982, 1986). Его можно назвать экологической характеристикой рода. Еще более широк, оказывается, размах спектра жизненных форм семейства, так как он складывается из экологических характеристик каждого из входящих в него родов (Буруковский, 2017). Исходя из этого, можно сформулировать следующее допущение. Экологическая характеристика рода содержит информацию о современном направлении эволюции группы, а спектр жизненных форм семейства и выше отражает филогенетическую траекторию его самого и входящих в него родов. Это допущение основано на признании того, что эволюция такой группы, как креветки, была достаточно канализована благодаря общему морфо-генетическому фундаменту. Действительно, креветкам от их общего эукаридного предка, так же, как от общих предков высших раков, достались: фиксированное количество сегментов тела, общий план подразделения его на тагмы (цефалоторакс и абдомен), общий план строения конечностей, общий план локомоторных органов (три движителя: ходильный, плавательный и “стреляющий”: Буруковский, 1972), двураздельные в исходном виде мандибулы, общий план строения гонад и т.п (Буруковский, 2010). Все многообразие нынешних креветок появилось как вариации около такого исходного типа, что не могло не привести к большому количеству параллелизмов (Буруковский, 1986).
В каждом семействе креветок, демонстрирующем переход некоторых его представителей от донного образа жизни к жизни в пелагиали, мы обнаруживаем признаки редукции рострума (например, Stylopandalus richardi (Coutière 1905) или Parapandalus persicus Kemp 1925 у Pandalidae; придонные Psathyrocaris spp. с маленьким, но настоящим рострумом, и голопелагические Pasiphaea spp. без рострума вообще в семействе Pasiphaeidae). Также в каждом семействе наблюдается независимая эволюция ходильных ног (например, в семействе Pandalidae относительно короткие и крепкие переоподы у Chlorotocus crassicornis (Costa 1871), живущего в нижней части шельфа, и заметно более длинные и тонкие ходильные ноги обитателя кромки шельфа и верхней части склона P. edwadsii (Brandt 1851)) (Буруковский, 1981а). Одновременно наблюдается переход к образу жизни нападающего хищника и связанные с этим переходом редукция жевательного отростка мандибул и появление объемистого тонкостенного желудка без желудочной мельницы (Буруковский, 1986а, 2009, а также предыдущий раздел).
Независимо от их таксономической принадлежности, у креветок, адаптирующихся к жизни в грунте, наблюдаются дорсо-вентральное уплощение тела и редукция рострума (Crangonidae, Glyphocrangonidae), а у живущих в укрытиях появляются клешни, сравнимые по размерам с размерами тела (Alpheidae – Alpheus и другие; Pontoniinae – Hamiger Borradaile 1916, Isopontonia Bruce 1982, Stenopodidea и ряд других). Но особо выразителен пример сходства клешней у Leontocaris Stebbing 1905 из семейства Hippolytidae и у Bathypalaemonella Balss 1914 из семейства Bathypalaemonellidae (Holthuis, 1993). Одновременно со специализацией, выражающейся в соответствующих изменениях формы тела и придатков, наблюдается ряд других изменений некоторых морфо-анатомических структур, общих для многих групп креветок, например изменение жаберной формулы от низко к высокоспециализированным представителям разных групп креветок. Всю совокупность таких параллелизмов можно назвать эволюционными маркерами и, используя их, выделить несколько общих направлений эволюционных изменений для совершенно разных семейств креветок.
1) В морских политипических семействах наименее специализированные роды обитают на наибольших глубинах, а наиболее специализированные – на наименьших (например, семейства Solenoceridae и Pandalidae). Cамые крупные роды таких семейств имеют широкий диапазон глубин обитания в более чем одной глубинной зоне, а внутри рода самые специализированные виды обитают на бόльших глубинах, чем менее специализированные (например, рода Plesionika и Parapandalus (Pandalidae) (Буруковский, 1981а, 1982, 1986).
2) В семействах и родах, содержащих преимущественно эпибентосных и даже зарывающихся креветок (например, Solenoceridae), с увеличением глубины обитания наблюдается ослабление связи с грунтом и переход отдельных видов к придонно-пелагическому и пелагическому образу жизни (например, виды Plesionika carinata и Parapandalus persicus (Pandalidae): Буруковский, 1981а, 1982), а в семействе Solenoceridae – от зарывающихся Solenocera spp. к батипелагическим Gordonella spp. (Pérez Farfante, Kensley, 1997).
3) У облигатно пелагических семейств (например, Pasiphaeidae и Acantephyridae) наименее специализированные роды обитают на наименьших глубинах, демонстрируя хотя бы некоторую связь с субстратом, тогда как специализированные роды обитают значительно глубже и никак не связаны с субстратом. Среди креветок имеются два семейства с пресноводными видами. Одно из них – Atyidae, наряду с признаками специализации, сохранило много примитивных черт, говорящих о его дальнем родстве с океаническим облигатно пелагическим семейством Acantephyridae, из-за чего их ранее объединяли в одно надсемейство (Balss, 1956). Второе семейство – Palaemonidae демонстрирует мощный кладогенез и широчайший спектр адаптаций от обычных эпибентосных видов до комменсалов кораллов, моллюсков и других гидробионтов (последнее характерно и для такой специализированной группы, как Stenopodidea).
4) В двух таких облигатно пелагических нерито-океанических, океанических мезо- и батипелагических семействах, как дендробранхиидные Sergestidae и каридные Pasiphaeidae, имеются, соответственно, шельфовый пелагический и солоноватоводный род Acetes и шельфовый некто-эпипелагический род Leptochela (Omori, 1975; Chace, 1976; Hayashi, 1995). Для обоих родов характерно не только уникальное совпадение образа жизни микронектонных креветок верхней части шельфа, но и совпадение их родовых ареалов в Индо-Вестпацифике, Восточной Пацифике и тропической Западной Атлантике, причем в водах Западной Африки оба рода отсутствуют.
5) Некоторые олиготипические или монотипические семейства и роды пелагических креветок (семейство Physetocarididae и род Stylopandalus (сем. Pandalidae)), наряду с явной специализацией к жизни в пелагиали, имеют целый ряд признаков, говорящих об их относительной примитивности.
Отдельно имеет смысл рассмотреть надсемейство Bresilioidea.. При исследовании особенностей трофоадаптациогенеза у креветок этого семейства мы изучили строения их мандибул (Буруковский, 1986б). В результате оказалось что в надсемействе Bresilioidea имеются формы, сочетающие признаки как примитивности, так и далеко зашедшей специализации к пелагическому образу жизни. Примером может служить Lucaya bigelowi. Поэтому к одному надсемейству можно отнести многое из того, что было сказано выше по отношению креветок в целом. Это придает всему надсемейству признаки реликтовости. Семейство может быть рассмотрено как остаток какой-то предыдущей фауны креветок. Этот вывод был сделан на основании знакомства всего лишь с 11 видами двух семейств: Bresiliidae и Disciadidae. Однако почти за 50 лет объем группы возрос в пять раз, до 56 видов, входящих в 5 семейств надсемейства Bresilioidea (De Grave, Fransen, 2011). 80% видов были описаны с 1986 г. и позднее, в результате ощущение реликтовости надсемейства, представление о том, что оно – осколок предыдущей фауны креветок, еще более утвердилось.
Входящие в состав надсемейства Bresilioidea семейства несравнимы по объему. Например, в семействе Pseudochelidae имеется единственный род с тремя видами, обитающими в верхней части шельфа на глубинах от 1 до 15 м: Pseudocheles chacei Kensley 1983 у п-ова Флорида, P. neutra De Grave et Moosa 2004 – у о-ва Сулавеси, Индонезия, и P. enigma Chace et Brown 1978, – у юго-восточной Австралии (De Grave, Fransen, 2011). Логично считать их остатками большого циркумтропического рода.
В семействе Disciadidae на данный момент имеются четыре рода, три из которых монотипические, а четвертый, Discias (8 видов), может служить еще одной иллюстрацией сказанному выше. Он включает семь видов, обитающих преимущественно в средней части шельфа, и только один эпипелагический вид. Один из самых мелководных видов (D. atlanticus Gurney 1939) – никтипелагический, т.е. ведущий преимущественно донный образ жизни в дневное и поднимающийся в толщу воды для охоты ночью. Все виды характеризуются относительно локальными тропическими ареалами, разбросанными по Индо-Вестпацифике от Восточной Африки до о-ва Пасхи, а также обитают в Восточной Пацифике (Галапагосские о-ва), Западной Атлантике и неизвестны из вод Западной Африки (как Acetes и Leptochela – см. выше) (De Grave, Fransen, 2011). Примерно то же самое наблюдается и в семействе Bresiliidae (2 рода): монотипический Encantada (E. spinoculata Wicksten 1989) с шельфа Галапагосских о-вов и Bresilia (8 видов), обитающий на шельфе, его кромке и верхней части склона от Ирландии до Тасмании.
Противоположную, но еще более контрастную картину, представляет семейство Agostocarididae с единственным родом Agostocaris Hart et Manning 1986 (3 вида), известным лишь из двух “заповедников реликтовых ракообразных” Западной Атлантики: Багамских о-вов и о-ва Косумель.
Казалось бы, исключением из данного правила может служить семейство Alvinocarididae (8 родов, и с наиболее богатым видами родом Alvinocaris Williams et Chace 1982), в котором находится почти половина (26) всех видов надсемейства. Общее у всех представителей этого семейства – их связь с глубоководными гидротермальными источниками кромки шельфа, материкового склона и абиссали всех океанов. Это, казалось бы, подтверждается удивительно широкой радиацией, широким спектром жизненных форм от хищников (Alvinocaris) до симбиотрофов хемосинтезирующих бактерий-архей, обитающих в гидротермальных источниках (см. обзор: Верещака, Гебрук, 2002). Гидротермали – это общепризнанный “заповедник реликтов”. Бактерии-археи – источник высокого видового разнообразия оазисов гидротерм, реликты архейской эры (Москалев, 2002). Фауна брюхоногих моллюсков гидротермалей тоже очень древняя, включает множество реликтов мезозойского и даже палеозойского возраста (Москалев, 2002а). Гептнер и Иваненко (2002) предлагают рассматривать гидротермали как рефугиум примитивных и реликтовых форм веслоногих ракообразных.
Можно заключить, что эволюция креветок, не затронув существенных сторон их организации, вращалась в кругу примерно одних и тех же адаптаций, порождая большое количество параллелизмов. Следовательно, их эволюционную историю можно отнести к телогенезу. Вся приведенная выше совокупность фактов позволяет описать ее следующим образом.
Древняя фауна креветок возникла на мелководье. Это подтверждается и находками ископаемых креветок в породах, имеющих происхождение от илистых грунтов солоноватых мелководных лагун, и сохранением представителей самых примитивных Procarididae в рефугиумах именно мелководий (Chace, Manning, 1972; Hart, Manning, 1986; Holthuis, 1973; von Sternberg, Schotte, 2004; Bruce, Davie, 2006). Позднее, в результате радиации на родовом уровне, креветки освоили материковый склон и пелагиаль. Мелководные виды затем были вытеснены новой фауной креветок, заселившей шельф, а предыдущая фауна сместилась на материковый склон и, далее вдоль дна, в абиссаль или пелагиаль. Мы считаем, что для креветок характерен телогенез пульсирующего типа. Поэтому современная фауна креветок состоит из молодых групп с интенсивным кладогенезом; групп, персистирующих с мелового периода, и осколков предыдущих фаун, сохранившихся на больших глубинах и в рефугиумах на мелководьях.
Вопрос о движущих силах этих процессов остается открытым. Несомненно, что это результат сочетания двух комплексов важнейших экологических факторов: условий и ресурсов. Под “условиями” понимают все экологические факторы, которые неисчерпаемы в процессах жизнедеятельности организмов. “Ресурсы” же объединяют всю совокупность экологических факторов, которые могут быть ими исчерпаны (Бигон и др., 1989). Как показали наши исследования креветок западноафриканских вод (Буруковский, 2017), место приложения этих двух групп факторов – верхняя часть материкового склона на глубинах 600–1000 м. Именно в этом диапазоне глубин наблюдается наивысшая частота встречаемости креветок в уловах, так же как наибольшее количество видов креветок и среднее количество видов в одном улове (Буруковский, 2017). Чтобы объединить эти фаунистические характеристики, мы использовали показатель уровня структурированности фауны в виде коэффициента видового разнообразия Глисона: отношение общего числа видов в улове к логарифму числа (или биомассы) пойманных особей (Буруковский, 2017) (рис. 1), что представляет собой не только функцию от числа видов в данной точке, но и их удельных (т.е. рассчитанных на 1 км2) численности или биомассы, так как они пропорциональны плотности поселений. Коэффициент Глисона отражает определенным образом структуру таксоценов: чем он выше, тем сложнее структура поселений креветок. Это особенно хорошо проявляется, когда мы имеем дело с одновидовыми поселениями, т.е. когда независимо от численности или биомассы креветок в этой точке коэффициент Глисона равен 0. С глубиной частота встречаемости поселений с нулевым коэффициентом видового разнообразия уменьшается до нуля в верхней части материкового склона. Абсолютные величины коэффициента Глисона, определенные по численности и биомассе, различны, но изменяются почти параллельно друг другу (рис. 1а), и разница между ними с увеличением глубины возрастает. Это говорит об увеличении доли крупных креветок в таксоценах больших глубин.
Рис. 1.
Изменения видового разнообразия креветок с увеличением глубины: a – суммарное, b – в разных районах, c – частота встречаемости одновидовых поселений креветок в разных районах. 1 – Коэффициент Глисона, рассчитанный по численности; 2 – то же, по биомассе; 3 – частота встречаемости одновидовых поселений креветок на разных глубинах; 4, 5, 6, и 7 – Коэффициент Глисона и частота встречаемости одновидовых поселений креветок, соответственно, в водах у Марокко, Западной Сахары, Центрально-Восточной Атлантики и Мавритании.
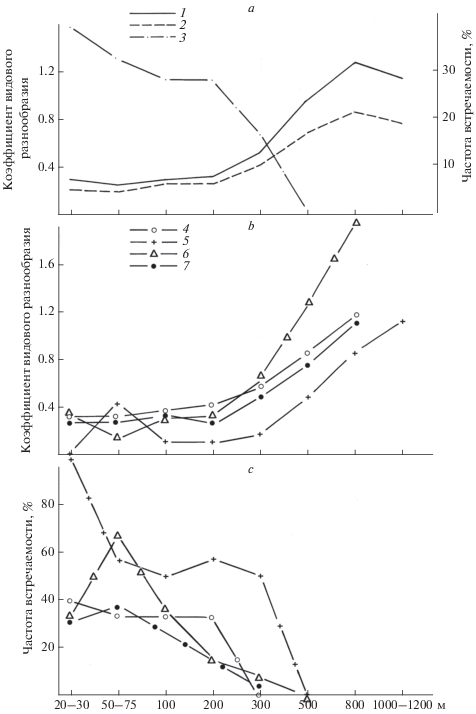
Для всех исследованных районов (рис. 1b) характерны практическое сходство и относительное постоянство коэффициента видового разнообразия в пределах шельфа и его резкое увеличение на материковом склоне, в 3–4 раза по сравнению с шельфом и его кромкой. Исходя из того, что уровень видового разнообразия отражает сложность структуры таксоценов креветок, можно сделать следующие выводы. Во-первых, для креветок западноафриканского шельфа характерны относительно простые и практически совпадающие во всех исследованных регионах уровни сложности структуры таксоценов креветок. Во-вторых, во всех исследованных регионах наблюдается закономерное возрастание сложности структуры поселений креветок с увеличением глубины. И, в-третьих, пик видового разнообразия креветок приходится на глубины примерно 800 м, что совпадает с границей между мезо- и батипелагиалью там, где она “упирается в дно”.
Возрастание коэффициента видового разнообразия в верхней части материкового склона должно быть вызвано появлением специфических взаимоотношений между видами, так как сложность структуры обусловлена в первую очередь внутренними причинами. По Одуму (1975), разнообразие невелико в физически контролируемых экосистемах и увеличивается в экосистемах, контролируемых биологическими факторами. Таксоцен креветок верхней части материкового склона не просто совокупность видов, объединенных лишь топически. Сложность его структуры говорит о существовании здесь биотических связей именно между креветками, в противоположность таксоценам шельфа и его кромки, структура которых регулируется прежде всего абиотическими факторами (Беклемишев, 1976). Среди последних, вероятнее всего, главенствующую роль играет мозаичность распределения субстратов в каждом конкретном районе (Буруковский, 1978, 1989, 2017; Буруковский, Роменский, 1985). Нами было обнаружено, что на верхнюю часть материкового склона приходится своеобразная ось симметрии закономерных изменений с глубиной экологической структуры таксоценов креветок, где все жизненные формы представлены примерно в равных долях, образуя “многоэтажный” таксоцен (Буруковский, 1981, 2017). Он существует только в районах с хорошо выраженным терригенным осадкообразованием гумидного типа, т.е. вблизи устьев тропических рек, где возникают уникальные консорции, завязанные на детритную пищевую цепь (Буруковский, 1989, 2017). Видами-эдификаторами этих консорций служат креветки, по типу питания облигатные или факультативные детритофаги из семейств Nematocarcinidae и Pandalidae, а видами-консортами – крупные придонные креветки, нападающие хищники-креветкоеды из семейства Aristeidae. Эти консорции ограничены трофоклинами. Верхний трофоклин находится на глубинах примерно 300 м. Здесь перестает ощущаться воздействие на донную фауну пастбищной трофической цепи. Второй трофоклин находится на глубинах примерно 800 м. Глубже доля азота в детрите падает очень низко, а доля непредельных углеводородов в нем, наоборот, возрастает. В результате этого детрит становится недоступен для бактерий и бесполезен для видов-эдификаторов. В их роли выступают креветки-детритофаги (Буруковский, 1989). Именно эти трофоклины ограничивают снизу и сверху их ареал в зонах с терригенным осадкообразованием гумидного типа и само существование консорции. Из-за этого бывшие креветки-консорты из семейства Aristeidae переходят в пелагиаль. Там переключаются на жертв из пастбищной трофической сети (Буруковский, 1981, 1989, 2017).
Описанные нами закономерности батиметрического распределения креветок, вероятнее всего, лишь частный случай изменения структуры донной фауны с изменением глубины. В этой глубинной зоне также наблюдается максимум видового разнообразия макробентоса и гастропод в северо-западной части Атлантического океана (Рекс, 1979). Здесь же с увеличением глубины возрастает видовое разнообразие эпифаунных животных (обнаруживаемых на подводных фотографиях от границы между шельфом и склоном (по нашим представлениям – от кромки шельфа)), достигая максимума в средней или нижней батиали и затем уменьшаясь на абиссальном плато по мере удаления от материков (Rex, 1981).
Согласно данным Ришер де Форже и др. (Richer de Forges et al., 2013) глубоководная фауна тропиков очень разнообразна в верхней части батиальной зоны и некоторые экосистемы жестких грунтов и крутых обрывов, очень трудных для сбора материалов, тем не менее, характеризуются высоким видовым богатством. Это позволяет нам предположить, что верхняя часть материкового склона на глубинах 800–1000 м представляет собой нечто вроде “динамического триггера”, некое подобие переключателя, способного неопределенно долгое время находиться в одном из двух устойчивых состояний и срабатывать при изменении напряжений. “Уровнем напряжения” для нашего “триггера” служит уровень терригенного седиментогенеза (т.е. источника ресурсов – “напряжения”), “импульсы” которого меняются в пространстве и времени. Такими “включателями” могли служить и служат сегодня, например, взаимодействие постоянства западного переноса в атмосфере и изменения положения континентальных плит. Это приводило к исчезновению прежних и появлению в других местах новых источников терригенного седиментогенеза. Из-за этого часть видов из разных таксонов уходила еще глубже вдоль дна, другая – переходила к жизни в пелагиали и абиссали. Для многих из них это был и переход из детритной цепи в пастбищную пищевую цепь. Процесс повторялся неоднократно, и каждый раз представители самой древней и следующей за ней фаун оказывались на еще больших глубинах. А это определяло судьбу тех форм из фауны креветок (и, возможно, не только креветок) шельфа, которые вытесняются волнами постоянно идущего кладогенеза с шельфа на его кромку и верхнюю часть склона. Именно здесь решается вопрос, куда им уходить: вдоль дна в абиссаль или в толщу воды.
Список литературы
Бараш М.С., 1974. Миграции климатических поясов Атлантического океана в верхнечетвертичное время // Доклады АН СССР. Т. 216. № 5. С. 1156–1160.
Бараш М.С., Окунева Р.Г., 1981. О позднечетвертичных колебаниях палеотемператур в тропической зоне Северной Атлантики (по планктонным фораминиферам) // Океанология. Т. 21. № 5. С. 845–854.
Беклемишев К.В., 1976. Биотопический подход к морским сообществам и его осуществление во время советских работ по международной биологической программе // Известия АН СССР. Сер. Биол. № 5. С. 688–697.
Бигон М., Харпер Д.Ж., Таунсенд К., 1989. Экология. Особи, популяции и сообщества. Т. 1. М.: Мир. 667 с.
Буруковский Р.Н., 1970. О происхождении амфиатлантического ареала креветки Penaeus duorarum // Океанология. Т. 10. № 6. С. 1086–1089.
Буруковский Р.Н., 1972. Некоторые вопросы систематики и распространения креветок рода Penaeus // Труды АтлантНИРО. Вып. 42. С. 3–21.
Буруковский Р.Н., 1978. Креветки Юго-Восточной Атлантики и закономерности их батиметрического распределения // Зоологический журнал. Т. 57. № 10. С. 1501–1510.
Буруковский Р.Н., 1981. Некоторые общие закономерности батиметрического распределения креветок // Зоологический журнал. Т. 60. № 1. С. 42–52.
Буруковский Р.Н., 1981а. Определитель креветок рода Plesionika Bate (Decapoda, Pandalidae) и сводка их географического распространения // Бюллетень Московского общества испытателей природы. Т. 86. № 4. С. 42–53.
Буруковский Р.Н., 1981б. Креветки-чистильщики // Природа. № 10. С. 116–117.
Буруковский Р.Н., 1981в. О телогенезе креветок // IV съезд ВГБО. Тез. докл., 4 часть. С. 13–15.
Буруковский Р.Н., 1982. Креветки рода Parapandalus: географическое и батиметриченское распределение и ключ для определения видов // Бюллетень Московского общества испытателей природы. Отд. Биол. Т. 87. № 3. С. 39–45.
Буруковский Р.Н., 1986. Новый вид креветки из рода Heterocarpus (Crustacea: Decapoda: Pandalidae) и краткая сводка видов рода // Бюллетень Московского общества испытателей природы. Отд. биол. Т. 91. № 5. С. 62–73.
Буруковский Р.Н., 1986а. О питании креветки Pasiphaea semispinosa // Биологические науки. № 7. С. 47–49.
Буруковский Р.Н., 1986б. Эволюционные аспекты трофоадаптациогенеза у креветок // Питание морских беспозвоночных в естественных условиях. М.: Институт океанологии АН СССР. С. 10–21.
Буруковский Р.Н., 1987. О трофической структуре таксоценов креветок // Питание морских беспозвоночных и его роль в формировании сообществ. М.: Институт океанологии АН СССР. С. 22–35.
Буруковский Р.Н., 1989. Экологический статус таксоцена креветок материкового склона в районах с развитым терригенным осадкообразованием // Журнал общей биологии. Т. 50. № 5. С. 621–631.
Буруковский Р.Н., 1998. О распространении креветок в западноафриканских водах // Зоологический журнал. Т. 77. № 7. С. 778–787.
Буруковский Р.Н., 2003. Об эволюционном процессе у креветок // Проблемы ихтиопатологии и гидробиологии. Сб. научных трудов. Калининград: Изд. Калининградского Государственного технического университета. С. 33–43.
Буруковский Р.Н., 2009. Питание и пищевые взаимоотношения креветок. Калининград: Изд. ФГОУ ВПО КГТУ. 408 с.
Буруковский Р.Н., 2009а. Описание креветки Spongicoloides tabachnicki Bu-rukovsky sp. n. (Decapoda, Spongicolidae) из стеклянной губки Euplectella jovis // Зоологический журнал. Т. 88. С. 498–503.
Буруковский Р.Н., 2010. Зоология беспозвоночных. СПб.: Проспект Науки. 960 с.
Буруковский Р.Н., 2012. Глубоководные креветки семейства Nematocarcinidae: история изучения, систематика, географическое распространение, биологическая характеристика. СПб.: Проспект Науки. 287 с.
Буруковский Р.Н., 2017. Креветки западноафриканских вод: географическое распространение, закономерности горизонтального и вертикального распределения, жизненные формы и экологическая структура таксоценов. СПб.: Проспект Науки. 287 с.
Буруковский Р.Н., Роменский Л.Л., 1985. Об особенностях распределения креветок у атлантического побережья южной Африки // Бюллетень Московского обшества испытателей природы. Отд. Биол. Т. 90. Вып. 4. С. 65–73.
Буруковский Р.Н., Роменский Л.Л., 1991. Креветки-фунхалии (Penaeidae): систематика, распространение и некоторые вопросы биологии // Бюллетень Московского обшества испытателей природы. Отд. Биол. Т. 96. Вып. 6. С. 60–61.
Верещака А.Л., Гебрук А.В., 2002. Креветки (Decapoda, Macrura Natantia) // Биология гидротермальных систем. Под ред. Гебрука А.В. М.: KMK Press. С. 185–198.
Гептнер М.В., Иваненко В.Н., 2002. Веслоногие ракообразные (Copepoda) // Биология гидротермальных систем. Под ред. Гебрука А.В. М.: KMK Press. С. 159–176.
Лисицин А.П., 1974. Осадкообразование в океане. М.: Наука. 438 с.
Зенкевич Л.А., Бирштейн Я.А., Беляев Г.М., 1955. Исследование донной фауны Курило-Камчатской впадины // Труды ИО АН СССР. Т. 12. С. 345–381.
Москалев Л.И., 2002. Открытие и исследование гидротерм и холодных высачиваний сероводорода и метана на дне Мирового океана // Биология гидротермальных систем. Под ред. Гебрука А.В. М.: KMK Press. С. 25–58.
Москалев Л.И., 2002а. Брюхоногие моллюски (Gastropoda) // Биология гидротермальных систем. Под ред. Гебрука А.В. М.: KMK Press. С. 200–207.
Одум Ю., 1975. Основы экологии. М.: Мир. 740 с.
Рекс М.А., 1979. К модели видообразования у глубоководных гастропод // XIV Тихоокеанский конгресс, комитет 1. Секция II. Тез. докл. Хабаровск. С. 87–88.
Семенов В.Н., 1972. Типы ареалов донных беспозвоночных и биогеография южноамериканских умеренных вод // Труды ВНИРО. Т. 77. С. 120–153.
Шмальгаузен И.И., 1939. Пути и закономерности эволюционного процесса. М.-Л.: Изд-во АН СССР. 232 с.
Allen J.R.L., 1964. The Nigerian continental margin: bottom sediments, submarine morphology and geological evolution // Marine Geology. V. 1. № 4. P. 289–343.
Anker A., 2001. Taxonomie et évolution des Alpheidae (Crustacea: Decapoda). Thèse pour l’obtention du grade de Docteur. Fasc. II. Paris: Musée national d’histoire naturelle. 365 p.
Balss H., 1956. Decapoda. 12. Lieferung // Klassen und Ordnungen des Tierreiches. Leipzig. Bd. 1. Abt. 7. S. 1505–1672.
Brooks W.K., 1882. Lucifer, a study in development // Phil. Trans. Roy. Soc. London. V. 173. № 1. P. 53–137.
Bruce A., 1995. A synopsis of the Indo-West Pacific genera of the Pontoniinae (Crustacea: Decapoda: Palaemonidae) // Theses Zoologicae. V. 25. 1–172.
Bruce A.J., Devie P.J.F., 2006. A new anchialine shrimp of the genus Procaris from Christmas Island: the first occurence of the Procarididae in the Indian Ocean (Crustacea: Decapoda: Caridea) // Zootaxa. 1238. P. 23–33.
Chace F. jr., 1972. The shrimps of the Smithsonian-Bredin Caribbean Expeditinons with a summary of the West Indian shallow-water species (Crustacea: Decapoda: Natantia) // Smith. Contrib. Zool. V. 98. P. 1–179.
Chace F.A. jr., 1976. Shrimps of the pasiphaeid genus Gordonella with description three new species (Crustacea: Decapoda: Caridea) // Smith. Contrib. Zool. V. 222. P. 1–51.
Chace F.A. jr., Manning R.B., 1972. Two new caridean shrimps one representing a new family, from marine pools on Ascension Island (Crustacea: Decapoda: Natantia) // Smith. Contrib. Zool. V. 131. P. 1–18.
Crosnier A., 1978. Crustacés Décapodes Pénéides Aristeidae (Benthesicyminae, Aristeinae, Solenocerinae) // Cahiers ORSTOMs. V. 46. P. 1–197.
Crosnier A., 1988. Contribution à l'étude des genres Haliporus Bate 1881et Gordonella Tirnizi 1960 (Crustacea, Decapoda, Penaeoidea). Description de deux espéce nouvelles // Bull. Mus. Hist. Nat. Paris. 4e Sér., Sec. A. V. 10. № 3. P. 563–601.
Crosnier A., Forest J., 1973. Les crevettes profondes de l’Atlantique oriental tropical // Faune Trop. V. 19. P. 1–409.
De Grave S., Fransen C. H.J.M., 2011. Carideorum catalogus: the recent species of the dendrobranchiate, stenopodidean, procaridean and caridean shrimps (Crustacea: Decapoda) // Zoologische. Mededelingenl. V. 85. 195–588.
Fransen C.H.J.M., De Grave S., 2009. Evolution and radiation of shrimp-like decapods: an overview. Martin J.W., Crandall K.A., Felder D.L. (eds). Decapod Crustacean Phylogenetics. Boca Raton: CRC Press. P. 246–259.
Garcia S., 1977. Biologie et dinamique des populations de crevettes roses Penaeus duorarum notialis Perez-Farfante, 1967) en Côte d’Ivoire // Trav. Doc. ORSTOM. № 79. P. 1–272.
Gore R.H., 1985. Abyssobenthic and abyssopelagic penaeoidean shrimp (Families Aristeiidae and Penaeidae) from Venezuela basin, Caribbean Sea (Decapoda, Caridea) // Crustaceana. V. 48. P. 269–285.
Hart C.W. jr., Manning R.B., 1986. Two new shrimps (Procarididae and Agostocarididae, new family) from marine caves of the Western North Atlantic // Journal of Crustacean Biology. V. 6. № 3. P. 408–416.
Hayashi K.I., 1995. Brief revision of the genus Leptochela with description of two new species (Crustacea, Decapoda, Pasiphaeidae) // Richer de Forges D. (ed.). Les fonds meubles des lagons de Nouvelle-Calédonie (Sedimentologie, benthos). V. 2. Paris: ORSTOM. P. 83–99.
Hobbs H.H., Hart C.W., 1982. The shrimp genus Atya (Decapoda: Atyidae) // Smith. Contribut. Zool. V. 364. P. 1–143.
Holthuis L.B., 1973. Caridean shrimps fund in land-locked saltwater pools at four indo-west pacific localities (Sinai Peninsula, Funafuti atoll, Maui and Hawaii Islands), with the description of one new genus and four new species // Zoologische Verhandelingen. V. 128. 48 p.
Holthuis L.B., 1980. Shrimps and Prawns of the World. An annotated Catalogue of Species of Interest to Fisheries // FAO Species Catalogue. V. 1. FAO Fisheries Synopsis. № 125. P. 1–270 p.
Holthuis L.B., 1993. The recent genera of the Caridean and Stenopodidean shrimps (Crustacea, Decapoda): with an appendix on the order Amphionidacea. Leiden: Nat. Natuurhistor. Mus. 328 p.
Jayachandran K.V., 2001. Palaemonid prawns. Biodiversity, taxonomy, biology and management. Enfield: Science Publishers. Inc. 500 p.
Judkins D.C., Kensley B., 2008. New genera in the family Sergestidae (Crustacea: Decapoda: Penaeidea) // Proc. Biol. Soc. Washington. V. 121. P.72–84.
Kensley B., Williams D.N., 1986. New shrimps (Families Procarididae and Atyidae) from a submerged lava tube on Hawaii // Journal Crustacean Biology. V. 6. № 3. P. 417–437.
Ma K.Y., Chan T.-Y., Chu K.H., 2009. Phylogeny of penaeoid shrimps (Decapoda: Penaeoidea) inferred from nuclear protein-coding genes // Journal Molecular Phylogenetics and Evolution. V. 53. P. 45–55.
Martin J.W., Davis G.E. 2001. An updated classification of the recent Crustacea // Nat. Hist. Mus. Sci. Ser. № 39. P. 1–123.
Omori M., 1975. The systematics, biogeography and fishery of epipelagic shrimps of the genus Acetes (Crustacea Decapoda Sergestidae). Tokyo: Bull. Ocean. Res. Inst. Univ. 89 p.
Pérez Farfante I., 1977. American Solenocerid shrimps of the genera Hymenopenaeus, Haliporoides, Pleoticus, Hadropenaeus new genus and Mesopenaeus new genus // Fishery Bulletin. V. 75. № 2. P. 261–346.
Pérez Farfante I., 1985. The rock shrimp genus Sicyonia (Crustacea; Decapoda: Penaeoidea) in the Eastern Pacific // Fishery Bulletin. V. 83. № 1. P. 1–79.
Pérez Farfante I., Kensley B., 1997. Penaeoid and Sergestoid shrimps and prawns of the World keys and diagnoses for the families and genera // Mém. Mus. Natn. Hist. Paris. V. 175. P. 1–233.
Richer de Forges R., Chan T.-Y., Corbari L., Lemaitre R., Macpherson E., Ahyong Sh.T., Ng P.K.L., 2013. The MUSORSTOM-TDSB deep-sea benthos exploration program (1976-2012): An overview of crustacean discoveries and new perspectives on deep-sea zoology and biogeography // Trop. Deep-Sea Benth. V. 27. P. 13–66.
Sternberg R. von, Schotte M., 2004. A new anchialine shrimp of the genus Procaris (Crustacea: Decapoda: Procarididae) from the Yucatan Peninsula // Proc. Biol. Soc. Wash. V. 117. P. 514–522.
Schweigert G., Garassino A., 2004. New genera and species of shrimps (Crustacea: Decapoda: Dendrobranchiata, Caridea) from the Upper Jurassic lithographic limestones of South Germany // Stuttg. Beitr. Naturk. Ser. B. № 350. P. 1–33.
Tiwari K.K., 1963. Lower Tertiary Penaeid shrimps from Kapurdi (Barmer District, Rajasthan, India) // Crustaceana. V. 5. P. 205–212.
Vereshchaka A.L., 2000. Revision of the genus Sergia (Decapoda: Dendrobranchiata: Sergestidae): taxonomy and distribution // Galathea Rep. V. 18. P. 69–207.
Vereshchaka A.L., 2010. The genus Sergestes: taxonomy, systematics, and distribution // Galathea Rep. V. 22. P. 1–137.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


