Зоологический журнал, 2020, T. 99, № 10, стр. 1110-1123
Видовая и генетическая структура группы Daphnia longispina s. l. (Cladocera, Daphniidae) в водоемах Южной Сибири
Е. И. Зуйкова a, *, Н. А. Бочкарев a, А. А. Котов b, c, ***
a Институт систематики и экологии животных СО РАН
630091 Новосибирск, Россия
b Институт проблем экологии и эволюции имени А.Н. Северцова РАН
119071 Москва, Россия
c Казанский (Приволжский) федеральный университет
420008 Казань, Россия
* E-mail: nikson_1960@mail.ru
*** E-mail: alexey-a-kotov@yandex.ru
Поступила в редакцию 15.04.2020
После доработки 03.05.2020
Принята к публикации 10.05.2020
Аннотация
Обобщены данные по видовому разнообразию, морфологической изменчивости, генетической структуре, филогении и филогеографии ветвистоусых ракообразных группы D. longispina s. l. (Cladocera, Daphniidae) из водоемов Южной Сибири. Комплексный подход предусматривает традиционные морфологические исследования, анализ изменчивости формы тела на основе метода геометрической морфометрии, а также изучение генетической изменчивости на основе митохондриальных (12S, 16S, ND2) и ядерного (ITS2) маркеров. Такой подход позволил выявить новые и эндемичные для фауны России формы/виды в пределах рода Daphnia, описать некоторые отличительные особенности их морфологии, реконструировать филогенетические отношения в пределах группы D. longispina s. l., предварительно установить границы распространения массовых и редких видов. Изучение изменчивости генов митохондриальной ДНК дало возможность выдвинуть и обосновать гипотезу о прохождении разными формами/видами этой группы кладоцер разных эволюционных сценариев на территории Северной Евразии.
Ветвистоусые ракообразные (Crustacea, Cladocera) – широко распространенная группа микроскопических ракообразных, обитающих, главным образом, в континентальных водоемах (Smirnov, 2017). За последние десятилетия достигнуты определенные успехи в оценке видового разнообразия, понимании эволюционной истории, филогении и филогеографии разных групп кладоцер (Colbourne, Hebert, 1996; Schwenk et al., 2004; Ishida, Taylor, 2007; Adamowicz et al., 2009; Belyaeva, Taylor, 2009; Thielsch et al., 2009; Ishida et al., 2011; Hamrová et al., 2012; Möst et al., 2012; Ventura et al., 2014; Ma et al., 2015; Kotov et al., 2016; Zuykova et al., 2013; 2018a; 2018b; 2019b). Однако многие вопросы до сих пор ожидают своего разрешения.
Так, морфологическая систематика рода Daphnia и, в частности группы Daphnia longispina s. l. O.F. Müller 1776, до настоящего времени остается запутанной, что во многом объясняется объективными причинами (Korovchinsky, 1996; Kotov, 2015). С одной стороны, использование молекулярно-генетических методов позволило решить целый спектр задач – от уточнения таксономического статуса отдельных форм до понимания микроэволюционных процессов в пределах группы D. longispina s. l. (Adamowitcz et al., 2009; Petrusek et al., 2012; Ballinger et al., 2013; Ishida, Taylor, 2007; Ishida et al., 2011; Zuykova et al., 2018b). С другой стороны, молекулярно-генетический подход выявил множество других проблем в нашем современном понимании эволюционной истории этой группы кладоцер. В частности, нет однозначного мнения о происхождении и статусе глубоко дивергентных митохондриальных линий (которые могут представлять собой потенциальные биологические виды, а могут и не представлять таковые) в пределах обычных видов D. longispina и D. galeata Sars, 1864 (Petrusek et al., 2012; Zuykova et al., 2013). Для некоторых таких линий показана гибридная природа, тогда как происхождение других остается плохо изученным или вовсе неизвестным (Thielsh et al., 2017).
До сих пор нет единого мнения по поводу таксономического статуса некоторых представителей группы D. longispina s.l., самым, пожалуй, известным из которых является форма/вид D. hyalina Leydig 1860 (Petrusek et al., 2008; Thielsch et al., 2009; Кирдяшева, Котов, 2013; Зуйкова, Бочкарев, 2016; Зуйкова и др., 2017; Zuykova et al., 2018b). Трудности при идентификации морфологически слабо дифференцированных видов D. longispina s. str., D. cf. hyalina, D. dentifera Forbes 1893 возникают даже у специалистов-систематиков (Dlouhá et al., 2010), и поэтому генетический анализ часто остается единственным способом для их распознавания. Для некоторых европейских линий, таких как “Berse” и “zschokkei”, требуется ревизия; не было сделано детального морфологического переописания обычного в Арктике и Субарктике таксона D. lacustris Sars, 1862 (Nilssen et al., 2007; Petrusek et al., 2008). Недавно опубликованный ключ для определения кладоцер Палеарктики предполагает определение особей подрода Daphnia s.str. только до уровня групп видов (Rogers et al., 2019), что отражает невозможность более точного определения популяций.
К настоящему времени из всех дафниид только группа видов D. curvirostris считается одной из наиболее изученных как в таксономическом, так и филогенетическом и филогеографическом отношении (Kotov et al., 2006; Kotov, Taylor, 2019). Слабая изученность морфологической и генетической изменчивости видов группы Daphnia longispina s. l. в популяциях из обширного региона – азиатской части России – очевидно, препятствует оценке реального видового разнообразия внутри этой группы и целостному пониманию путей и механизмов его формирования. Между тем, итоги фаунистических и генетических исследований указывают на высокую вероятность обнаружения эндемичных видов кладоцер на огромной территории Восточной Сибири и российской части Дальнего Востока (Korovchinsky, 2009; Смирнов, Шевелева, 2010; Котов, Синев, 2011; Bekker et al., 2016; Garibian et al., 2018; Kotov, Taylor, 2019).
Здесь мы представляем обобщение последних данных о видовом разнообразии, морфологии, филогении и филогеографии обычных и редких представителей группы Daphnia longispina s. l., полученных в результате морфологических и генетических исследований популяций из водоемов юга Сибири.
МАТЕРИАЛЫ И МЕТОДЫ
Работа основана на последних данных о морфологической изменчивости, видовом и генетическом разнообразии, географическом распространении и эволюционной истории дивергентных митохондриальных линий и видов группы Daphnia longispina s. l., которые по большей части получены при непосредственном участии авторов данного сообщения (Зуйкова и др., 2013; 2016; Зуйкова, Бочкарев, 2016; Зуйкова и др., 2017; Зуйкова, 2019; Zuykova et al., 2013; 2018а; 2018b; 2019а; 2019b).
Данная публикация преимущественно представляет обзор предыдущих исследований. Однако, для иллюстрации обсуждаемых результатов мы построили филогенетические деревья по фрагментам некодирующего 12S гена рРНК и белок-кодирующего ND2 (NADH-дегидрогеназа субъединица 2) гена митохондриальной ДНК с использованием всех имеющихся на данный момент (01.03.2020 г.) нуклеотидных последовательностей в международной базе данных GenBank (NCBI). Существенная часть этих последовательностей была получена авторами. Специально отметим, что появление в базе данных GenBank в самое последнее время некоторых новых последовательностей не привело к пересмотру полученных ранее выводов. Всего в анализ включено 637 нуклеотидных последовательностей фрагмента гена 12S длиной 532-538 п.н. и 339 последовательности фрагмента гена ND2 длиной 744 п.н. (табл. 1).
Таблица 1.
Число нуклеотидных последовательностей, включенных в анализ изменчивости фрагментов генов 12S и ND2 митохондриальной ДНК и ITS2 ядерной ДНК
| Вид | 12S | ND2 | ITS2 | Ссылки | ||
|---|---|---|---|---|---|---|
| 1 | 2 | 1 | 2 | 1 | ||
| D. longispina + + D. hyalina |
100 | 146 | 56 | 3 | 39 | Зуйкова, 2019; Petrusek et al., 2007; 2008; Gieβler, Englbrecht, 2009; Hamrová et al., 2012; Möst et al., 2012; Ventura et al., 2014; Xu et al., 2018; Zuykova et al., 2010; 2013; 2018a; 2018b; 2019b |
| D. dentifera | 21 | 66 | 4 | 14 | – | Taylor et al., 1996; Ishida et al., 2011; Möst et al., 2012; Ma et al., 2014; Xu et al., 2018; Zuykova, 2018b; 2019b |
| D. galeata | 134 | 65 | 57 | 167 | 86 | Зуйкова, 2019; Taylor et al., 1996; 2005; Schwenk et al., 2000; Petrusek et al., 2008; Gieβler, Englbrecht, 2009; Thielsch et al., 2009; Ishida et al., 2011; Hamrová et al., 2012; Ma et al., 2014; Zuykova et al., 2010; 2018b; Xu et al., 2018; Yin et al., 2018; Wooller et al., неопубликовано |
| D. cucullata | 24 | 13 | 5 | 4 | 9 | Schwenk et al., 2000; Petrusek et al., 2008; Gieβler, Englbrecht, 2009; Thielsch et al., 2009; Zuykova et al., 2010; 2019b |
| D. turbinata | 7 | – | 9 | – | 2 | Zuykova et al., 2019b |
| D. cf. longispina | 5 | – | 5 | – | 4 | Зуйкова, 2019; Zuykova et al., 2013; 2018b; 2019b |
| Daphnia sp. “Berse” | – | 1 | – | – | – | Petrusek et al., 2008 |
| D. lacustris | – | 12 | – | – | – | Nilssen et al., 2007; Petrusek et al., 2007 |
| D. umbra | 11 | 9 | 5 | – | 12 | Зуйкова, 2019; Schwenk et al., 2000; Taylor et al., 2005; Adamowicz et al., 2009; Gieβler, Englbrecht, 2009; Zuykova et al., 2013; 2018a; 2019b |
| D. cristata | 20 | 3 | 9 | 1 | 3 | Schwenk et al., 2000; Petrusek et al., 2008; Zuykova, 2018b |
Выбор моделей нуклеотидных замен, наилучшим образом описывающих эволюцию изучаемых последовательностей мтДНК, выполнен в программе jModelTest v.2.1.7 (Darriba et al., 2012). Одними из лучших моделей, согласно информационному критерию Акаике, оказались General Time Reversible (GTR + G, параметр α = 0.38) для фрагмента гена 12S (Nei, Kumar, 2000) и Тамуры-Нея (TN93 + G, параметр α = 0.99) для фрагмента гена ND2 (Tamura, Nei, 1993). Данные эволюционные модели использовали при реконструкции филогений с помощью метода максимального правдоподобия (ML) в программе MEGA v.7.0 (Kumar et al., 2016). Оценку достоверности филогенетической реконструкции проводили с помощью бутстреп-теста при числе репликаций 1000 (Saitou, Nei, 1987).
Для большинства популяций группы Daphnia longispina s. l. из водоемов Сибири (за исключением D. dentifera) была изучена изменчивость второго промежуточного транскрибируемого спейсера ITS2 ядерной ДНК, проанализирована возможность дискриминирования криптических видов в пределах группы с учетом вторичной структуры данного маркера и выполнена реконструкция филогенетических отношений. В данной работе проанализировано 155 оригинальных последовательностей ITS2 длиной 674–816 п.н., включающих фланкирующие участки генов 5.8S и 28S (длиной 20 п.н.), аннотированные с помощью инструмента ITS2-Annotation в системе ITS2 Database (Koetschan et al., 2010). Многокопийные последовательности ITS2 в анализ не включались. Предполагаемые модели вторичной структуры ITS2, характеризующиеся минимальной свободной энергией (MFE), получены с помощью RNAfold WebServer (http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi; настройки по умолчанию при 37°С). Выравнивание нуклеотидных последовательностей ITS2 с гомологичными вторичными структурами выполнено с помощью встроенного в программу 4SALE v.1.7 алгоритма ClustalW (Seibel et al., 2008). Результаты выравнивания с информацией о вторичной структуре ITS2 были сохранены для последующего филогенетического анализа (Schultz, Wolf, 2009). Филогенетический анализ выполнен в программе ProfDistS v.0.9.8 с использованием алгоритма RNA/DNA structure Profile Neighbor-Joining при числе репликаций 1000 для модели General Time Reversible и матрице Q = Q_ITS2.txt как специфической модели замен для ITS2 (Friedrich et al., 2005; Wolf et al., 2008). Результирующее дерево визуализировано с помощью программ NJplot v.2.4 (Perrière, Gouy, 1996) и FigTree v.1.4.3 (http:// tree.bio.ed.ac.uk). Для сравнения результатов дополнительное филогенетическое дерево реконструировано без учета вторичной структуры ITS2 на основе модели GTR в программе MEGA v.7 с помощью метода максимального правдоподобия (ML) и числе репликаций 1000.
В качестве внешней группы во всех анализах использовались нуклеотидные последовательности D. cristata Sars 1862.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Видовое разнообразие. Большая часть популяций группы Daphnia longispina s. l. в водоемах Сибири представлена широко распространенными в водоемах Палеарктики видами – D. longispina и D. galeata. В ряде водоемов встречаются другие виды группы – D. cucullata, D. curvirostris Eylmann 1887, а также D. cristata. Помимо этого, были обнаружены редкие и для России виды D. turbinata Sars 1903 и D. umbra Taylor, Hebert et Colbourne, 1996 sensu Zuykova et al. (2018a). Если D. turbinata ранее была описана О.Г. Сарсом из оз. Курту-Коль (бассейн Телецкого озера, Республика Алтай), то последние два вида на территории России были зарегистрированы впервые (Zuykova et al., 2013; Zuykova et al., 2018a).
Предположительно новый вид D. cf. longispina обнаружен в единственном водоеме на территории Западной Сибири ‒ врéменнoм водоеме бассейна оз. Чаны недалеко от г. Барабинска (Новосибирская обл.). Гаплотипы этой глубоко дивергентной митохондриальной линии не связаны монофилетическими отношениями с другими видами группы Daphnia longispina s. l. (рис. 1). Для установления определенного таксономического статуса этой формы требуются дальнейшие морфологические и генетические исследования. Согласно нашим данным, на территории Сибири до сих пор не обнаружена обсуждаемая выше D. hyalina, хотя ранее упоминалось о существовании азиатской клады этого вида (Ishida, Taylor, 2007a).
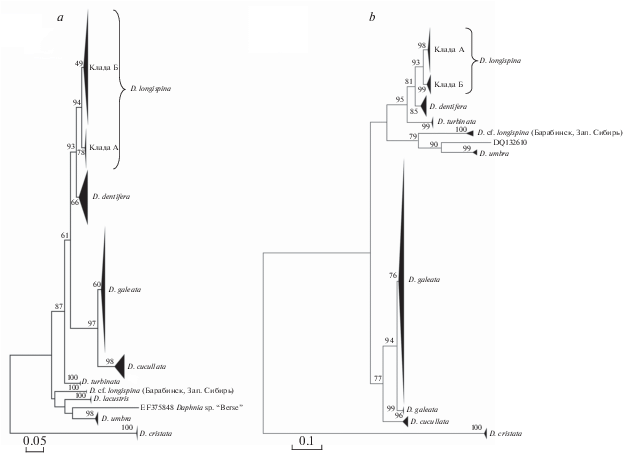
Рис. 1.
Филогенетические деревья для видов группы D. longispina на основе фрагментов 12S (a) и ND2 (b) генов митохондриальной ДНК, реконструированные методом максимального правдоподобия (ML). Показаны бутстрэп значения поддержки ветвей выше 49% (А) и 76% (Б). Масштаб – число ожидаемых замен на сайт.
Морфология. Тщательное исследование отдельных морфологических признаков партеногенетических самок не выявило для большинства из них высокой таксономической значимости для установления границ между близкородственными и криптическими видами группы D. longispina s. l.: D. longispina – D. cf. hyalina – D. dentifera, при этом отмечена более высокая информативность диагностических признаков самцов (Zuykova et al., 2018а). Так, при идентификации видов особое внимание следует уделять длине флагеллума и относительным размерам сенсорной щетинки и эстетасков антенны I. Таксономическая ценность этих признаков ранее была признана при изучении других групп кладоцер, в том числе и рода Daphnia (Kотов, 2013; Kotov et al., 2006; Popova et al., 2016; Kotov, Taylor, 2019). Точная морфологическая идентификация партеногенетических самок D. longispina, D. dentifera и D. cf. hyalina до сих пор невозможна, что нашло отражение в последних определителях (Benzie, 2005; Rogers et al., 2019). В некоторых случаях особей D. cf. hyalina можно отличить по форме вентрального края головы, тогда как дифференцировать D. longispina и D. dentifera по морфологическим признакам невозможно, причем самцы эти видов также неразличимы по морфологическим признакам (Zuykova et al., 2018a). Более того, часто невозможно отличить бесшлемную морфу D. galeata от типичной D. longispina (Кирдяшева, Котов, 2013).
Более заметные морфологические различия выявляются при сравнении широко распространенных видов с эндемичными и криптическими видами комплекса – D. umbra и D. turbinata. В частности, партеногенетические самки D. umbra и D. turbinata отличаются от других представителей группы более развитой антенной I и ее чувствительной щетинкой. Кроме того, особи D. umbra и D. turbinata характеризуются буроватой окраской, нехарактерной для большинства популяций широко распространенных видов (Benzie, 2005; Zuykova et al., 2018а; 2019a). Однако этот признак нельзя отнести к категории надежных, поскольку степень его проявления может сильно варьировать (Taylor et al., 1996), и в пределах группы D. longispina s. l. не зарегистрировано четкой корреляции между степенью меланизированности раковинки и ее принадлежностью к той или иной генетической кладе (Petrusek et al., 2008). В рамках исследования сибирских популяций D. longispina s. str. были обнаружены особи с характерной пигментированной раковиной (например, во врéменных водоемах бассейна оз. Чаны, в прудах Тоджинской котловины). Пигментированные особи этого вида отмечались и в альпийских популяциях Западной Европы (Petrusek et al., 2008); меланизированной раковиной также характеризуются особи D. lacustris – сестринского вида D. umbra (Schwenk et al., 2004; Nilssen et al., 2007).
Геометрическая морфометрия. В последние десятилетия для выявления различий во внешней морфологии тела у криптических видов/дивергентных митохондриальных линий в различных группах животных часто применяются более сложные современные подходы, в частности, метод геометрической морфометрии (Giri, Collins, 2004; Francisco et al., 2008; Silva et al., 2010; Santamaria et al., 2016).
Высокий уровень фенотипической изменчивости особей, особенно партеногенетических самок (как правило, доминирующих в природных популяциях), сильно затрудняет идентификацию видов группы D. longispina s. l., базирующуюся на “традиционном” поиске дискретных диагностических признаков и системе стандартных промеров. Поэтому для установления границ между близкородственными видами группы D. longispina s. l. (и их популяциями) был применен анализ изменчивости формы тела на основе метода геометрической морфометрии (Зуйкова, Бочкарев, 2016; Зуйкова и др., 2017; Zuykova et al., 2013; 2018а). В результате этих исследований выявлены достоверные различия между видами в форме тела и наиболее значимые признаки, определяющие эту изменчивость. Основными дискриминирующими признаками для большинства видов группы D. longispina s. l. являются форма рострума, верхней части вентрального края раковины, вентрального края головы (степень ее изогнутости) и положение глаза относительно вентрального края головы. С помощью метода геометрической морфометрии значимые различия в форме тела выявлены между D. umbra (Тоджинская котловина) и D. longispina – D. hyalina – D. dentifera (Zuykova et al., 2013; 2018а). Было показано, что особи D. umbra характеризуются более прямым дорсальным краем раковинки и более прямым вентральным краем головы.
Митохондриальная филогения группы D. longispina s. l. Филогенетические реконструкции на основе фрагментов двух генов мтДНК (12S и ND2) выявили несколько крупных клад, соответствующих видам группы D. longispina s. l. (рис. 1) В пределах каждой видовой клады отмечены многочисленные, часто глубоко дивергентные, митохондриальные линии (Zuykova et al., 2018b; 2019b). Сходный уровень дивергенции для видов группы отмечался в разных географических регионах (Taylor et al., 1996; Gießler et al., 1999; Schwenk et al., 2004; Petrusek et al., 2008; Thielsch et al., 2009; Ventura et al., 2014). Однако только в результате масштабных генетических исследований сибирских популяций было выявлено, что все гаплотипы вида D. longispina s. str. формируют две крупные группы – “сибирскую” кладу А и “европейскую” кладу Б (Zuykova et al., 2018b; 2019b).
Монофилетические отношения между видами D. longispina–D. dentifera–D. galeata–D. cucullata– D. turbinata подтверждаются только на основе 12S филогении (рис. 1a). В филогенетической схеме на основе фрагмента гена ND2 мтДНК виды D. galeata и D. cucullata формируют отдельную филогруппу (рис. 1b). Таким образом, положение большинства видов в общей филогенетической схеме группы D. longispina на основе разных фрагментов мтДНК оказывается несколько неопределенным. Тем не менее филогения на основе анализа объединенных фрагментов 12S + 16S + ND2 генов представляется нам наиболее достоверной (Zuykova et al., 2019b).
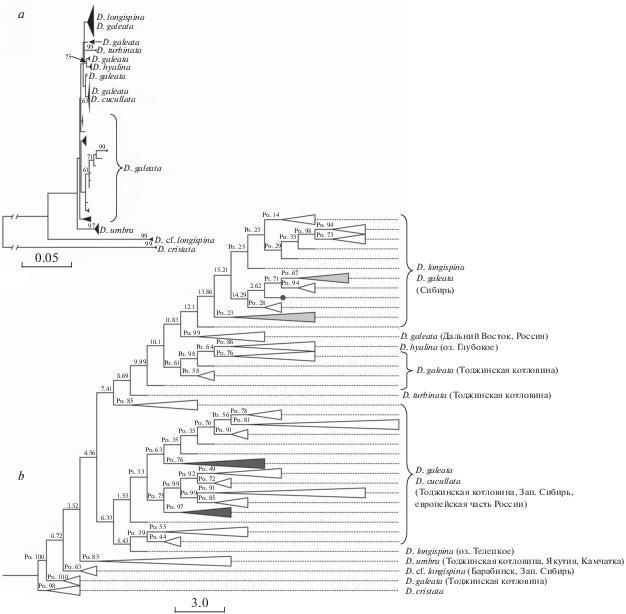
Ядерная филогения группы D. longispina s. l. на основе вторичной структуры фрагмента ITS2. Анализ изменчивости второго промежуточного спейсера ITS2 яДНК у видов группы D. longispina s. l. выявил высокую вариабельность фрагмента, обусловленную различиями в уровне полиморфизма и длине (Зуйкова, 2019). Реконструкция филогенетических взаимоотношений между криптическими видами группы D. longispina с учетом вторичной структуры ITS2, согласно алгоритму Profile Neighbor-Joining, выявила высоко поддерживаемые клады видов D. cf. hyalina, D. umbra и D. cf. longispina (Зуйкова, 2019). Анализ простирающейся сети подтвердил сильную удаленность гаплогруппы D. cf. longispina от гаплогрупп остальных видов, подтверждая тем самым видовую самостоятельность этой формы. В целом ядерная филогения для криптических видов группы D. longispina на основе последовательностей ITS2 соответствует результатам митохондриальной филогении (Зуйкова и др., 2013; 2016; Zuykova et al., 2013).
Филогения, реконструированная на основе последовательностей ITS2 для видов группы D. longispina s. l., не выявила четкого разграничения между видами D. galeata–D. cucullata–D. longispina (рис. 2), и в данном случае было обнаружено несколько смешанных клад, которые разделились на две крупные филогруппы (рис. 2b). По-видимому, это указывает на гибридную природу некоторых особей вышеупомянутых видов. Явно выраженные клады с высокой степенью поддержки сформировали только виды D. turbinata, D. umbra и D. cf. longispina. При этом их изолированное положение в группе видов очевидно как по результату анализа с учетом вторичной структуры фрагмента ITS2 яДНК, так и без него (рис. 2). Очевидно, что использование информации о вторичной структуре ITS2 наиболее пригодно для реконструкции филогенетических отношений именно между криптическими видами и позволяет определять границы между ними даже в начальной стадии их эволюционной радиации, что ранее было показано для других групп артропод (Wiemers et al., 2009; Di Capua et al., 2017).
Рис. 2.
Филогенетические деревья на основе второго промежуточного транскрибируемого спейсера ITS2 яДНК для видов группы D. longispina s. l. a – ML-дерево без учета вторичной структуры ITS2, показаны бутстрэп значения поддержки ветвей выше 63%; b – дерево, реконструированное с учетом вторичной структуры ITS2 с помощью профиля присоединения ближайшего соседа (Profile Neighbor-Joining, PNJ) на основе модели GTR в программе ProfDistS. Дерево визуализировано в программах NJplot и FigTree, показаны бутстрэп значения при 1000 репликаций. Профили получены на основе: Pi – идентичности пороговой величины (identity threshold) и Po – предыдущих итераций (previous iteration). Светло-серым цветом отмечены клады, сформированные образцами D. longispina и D. galeata; темно-серым цветом – образцами D. galeata и D. cucullata; кружок – D. galeata из оз. Большое (бассейн р. Обь). Масштаб – число ожидаемых замен на сайт.
Географическое распространение гаплотипов/ форм/видов группы D. longispina s. l. Проведенные исследования подтверждают факт широкого распространения вида D. galeata в водоемах разного типа по всей территории Северной Палеарктики, от Западной Европы и европейской части России через Западную и Восточную Сибирь, Забайкалье до российского Дальнего Востока. В некоторых водоемах зарегистрировано совместное обитание вида D. galeata с видами D. cucullata, D. longispina и D. cristata. До настоящего времени в водоемах России, как и в Китае (Möst et al., 2012; Ma et al., 2015) не выявлены случаи сосуществования D. galeata и D. dentifera, хотя в Японии и Северной Америке эти два таксона обитают совместно (Ishida et al., 2011).
Один из важных результатов проведенных исследований заключается в выявлении в водоемах Северной Евразии и во всех исследованных сибирских регионах широко распространенного центрального 12S гаплотипа D. galeata (рис. 3). Сходные результаты были получены на ограниченных географических территориях (Ma et al., 2015; Huang et al., 2017). Полученная картина распространения гаплотипов подтверждает гипотезу о недавней и быстрой пространственной экспансии сибирских и забайкальских популяций D. galeata. В водоемах Сибири, российской части Дальнего Востока, Японии, Китая и Западной Европы одновременно с центральным гаплотипом обнаружены общие периферийные гаплотипы. Более того, найдено, что широко распространенный гаплотип D. galeata успешно колонизировал эвтрофируемые в результате человеческой деятельности водоемы южной Австралии (Karabanov et al., 2018).
Рис. 3.
Географическое распространение массового 12S гаплотипа D. galeata (a), а также видов группы D. longispina (b) на территории Евразии. Красные треугольники – D. longispina клады А, черные треугольники – D. longispina клады Б, белые треугольники – D. dentifera.
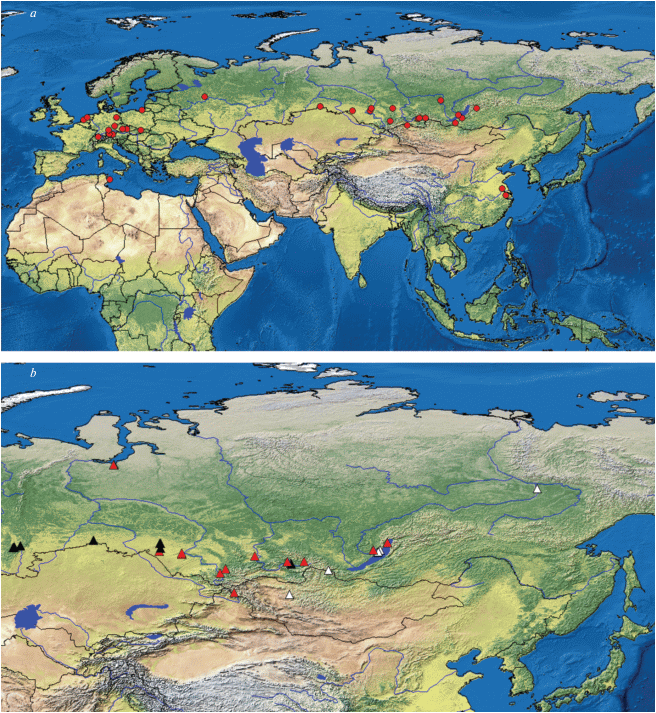
В отличие от D. galeata, нами не зарегистрировано ни одной популяции D. longispina s. str. восточнее бассейна оз. Байкал (рис. 3). На территории Восточной Евразии этот вид, скорее всего, полностью отсутствует, замещаясь на D. dentifera, который и был обнаружен в водоемах Якутии и Байкальского региона. Ранее, Ишида и Тэйлор (Ishida, Taylor, 2007а) сообщали о существовании трех клад D. longispina (у них –“D. rosea”) на территории Северной Евразии: европейской, сибирской (гаплотипы этой клады распространены в Сибири вплоть до бассейна оз. Байкал) и японско-американской. Если первые две клады соответствовали виду D. longispina s. str., то, очевидно, последняя из них была сформирована гаплотипами D. dentifera. Принимая во внимание эти факты, мы заключаем, что бассейн р. Енисей, включая оз. Байкал и р. Ангару, представляет собой переходную зону, заселенную и D. longispina s. str. (которая проникает на восток до 104° в.д.), и D. dentifera (которая проникает на запад до 96° в.д.). Таким образом, есть основания считать викарирующими виды D. longispina и D. dentifera. Здесь необходимо отметить, что если в оз. Байкал встречаются как D. galeata, так и D. longispina, то логично предположить, что дальнейшее детальное исследование водоемов Байкальского региона может выявить популяции с совместным сосуществованием всех этих видов.
Примечательно, что похожая ситуация отмечалась в водоемах Китая, где D. dentifera представляет собой доминирующий вид, а D. longispina встречается крайне редко (Ishida et al., 2011; Möst et al., 2012; Ma et al., 2015; 2019; Xu et al., 2018). К сожалению, существование переходной зоны между этими двумя видами на территории Китая не обсуждалось авторами вышеупомянутых публикаций. Между тем, меридиональная дифференциация с переходной зоной между западными и восточными филогруппами по бассейну р. Енисей отмечалась для нескольких других групп кладоцер (Kotov et al., 2016; Bekker et al., 2016; 2018).
Что касается гаплотипов D. longispina s. str., то, в первую очередь, необходимо отметить разницу в географическом распространении гаплотипов “сибирской” и “европейской” клад. Основу клады А формируют гаплотипы из горных и предгорных регионов Южной Сибири (рис. 2, 3). Напротив, гаплотипы клады Б имеют очень широкое географическое распространение – от Западной Европы до бассейна р. Енисей. Для этой клады характерна высокая генетически структурированность, т.е. она состоит из множества внутренних субклад. Причин глубокой генетической дивергенции может быть несколько. Во-первых, как было показано на примере других таксонов кладоцер, включая D. longispina, она обычно является результатом вторичного контакта гетерогенных популяций и генетически дистантных линий (De Gelas, De Meester, 2005; Belyaeva, Taylor, 2009; Thielsch et al., 2009; Hamrová et al., 2012; Ishida, Taylor, 2007а). Во-вторых, такая дивергенция может возникать вследствие непрерывного видообразования (Xu et al., 2009; Bekker et al., 2016). И, в-третьих, было показано, что источник глубокой дивергенции некоторых митохондриальных линий D. longispina кроется в их гибридном происхождении (Thielsch et al., 2017). Для окончательного понимания причин высокого уровня генетического полиморфизма и дивергенции в пределах клады Б, ассоциированных с сильным морфологическим стазисом, очевидно, требуются дальнейшие исследования генетической структуры популяций видов группы D. longispina s.l . в мировом масштабе.
Эволюционная история форм/видов группы D. longispina s. l. Проведенные молекулярно-генетические исследования позволили реконструировать эволюционную историю массовых и редких/эндемичных видов группы D. longispina s. l. на территории Северной Евразии. Уровень генетического полиморфизма популяций, структуры сетей гаплотипов и модели распределения частот гаплотипов совместно со значениями индексов фиксации FST и тестов на нейтральность эволюции Таджимы D и Фу FS свидетельствуют о том, что эволюция видов этой группы кладоцер на одной и той же территории проходила согласно разным сценариям. Демографическая история D. galeata сильно отличается от таковой у викарирующих видов D. dentifera и D. longispina (Zuykova et al., 2019b). Так, основные генетические показатели для D. galeata свидетельствуют в пользу недавней и быстрой пространственной экспансии этого вида по всей Палеарктике.
Сибирские популяции D. dentifera и D. longispina в целом характеризуются сходной демографической историей. Особенности их популяционно-генетической структуры, скорее всего, объясняются вторичным (и, вероятно, неоднократным) контактом множества генетически дивергентных филогрупп, выживших в различных плейстоценовых рефугиумах (Zuykova et al., 2019b). Результаты генетического анализа свидетельствуют в пользу недавней демографической экспансии клады А, тогда как для клады Б в большей степени соответствует модель демографического равновесия входящих в нее популяций.
Оценка демографической истории для сибирских популяций и видов группы D. longispina s.l. была скорректирована с учетом известных геологических событий в регионе в плейстоцене. Во время самых холодных фаз плейстоцена северный сток крупных сибирских рек был прерван континентальным ледником, что в результате привело к значительному повышению уровня воды в среднем течении и, как следствие, к возникновению огромных предледниковых озер на севере (Гросвальд, Котляков, 1989; Mangerud et al., 2004; Волков, Казьмин, 2007). Распространение горных ледников в южных регионах Центральной и Восточной Сибири было согласовано с направлением основных воздушных масс в зимний период: самый обширный ледник располагался в Алтае-Саянской горной области, и его толщина постепенно уменьшалась в восточном направлении. В это же время такие крупные озера как Телецкое, а также Чуйское и Уймонское палеоозера, служили рефугиумами для пресноводной фауны в Алтае-Саянском регионе (Гросвальд, Котляков, 1989; Vysotskiy, 2001). Основные рефугиумы в бассейне р. Енисей располагались в Тоджинской и Дархатской котловинах, и размер озер здесь претерпевал значительные изменение в течение ледниковых циклов плейстоцена (Аржанников и др., 2000). Эти озера периодически возникали в периоды таяния ледника и подъема уровня воды. В последний раз в Тоджинской котловине такое озеро сформировалось около 10 000–12 000 лет назад. Колонизация южных сибирских озер дафниями могла произойти уже после исчезновения ледника, т.е. около 10–15 000 лет назад, но такой сценарий кажется менее вероятным с учетом оценки времени дивергенции для сибирских популяций D. galeata и D. longispina (Zuykova et al., 2018b). Скорее всего, у дафний была возможность выжить в рефугиумах и в дальнейшем эти эволюционные линии имели значительное преимущество перед линиями “вселенцев”, если следовать логике “гипотезы монополизации” (De Meester et al., 2002).
Очевидно, что гаплотипы D. longispina, составляющие ядро “сибирской” клады А, представляют остатки древней фауны, выжившей в рефугиумах в течение нескольких ледниковых циклов. Учитывая значительный возраст кладоцер (Frey, 1987; Kotov, Korovchinsky, 2006; Van Damme, Kotov, 2016), можно допустить, что некоторые виды группы D. longispina s. l. были широко распространены по всей территории Евразии в доплейстоценовые эпохи. В течение плейстоценовых ледниковых циклов границы их распространения периодически сокращались в размерах, иногда даже ограничивались пределами небольших рефугиумов. Аналогичные модели постледниковой экспансии, датированные поздним плейстоценом, были обнаружены для рода Polyphemus (Xu et al., 2009) и популяций D. galeata из Северной Америки и Японии (Ishida, Taylor, 2007a; 2007b). Современные популяции D. longispina, формирующие “европейскую” кладу Б, возникли в результате вторичного и неоднократного контакта на обширных географических территориях многочисленных митохондриальных линий, частично изолированных друг от друга в течение некоторого временнóго промежутка.
Хотя существование плейстоценовых рефугиумов пресноводных животных в южной Сибири исследовано недостаточно, имеются отдельные свидетельства существования таковых в предгорьях и высокогорьях Алтая, например, у брюхоногих и двустворчатых моллюсков (Vinarski et al., 2017; Bolotov et al., 2020). Сходный сценарий установлен для популяций сигов группы C. lavaretus в водоемах бассейнов рек Обь и Енисей (Bochkarev et al., 2011).
Анализ генетической изменчивости позволяет говорить о том, что эволюционная история D. longispina s. l. в водоемах Сибири представляла собой последовательность дисперсионных и викариантных событий, происходивших неоднократно в разные периоды плейстоцена. В таком случае Сибирь представляет собой модельный регион для дальнейших филогеографических исследований группы D. longispina s. l., особенно с учетом чрезвычайно высокого гаплотипического разнообразия, отмеченного в большинстве сибирских популяций. Как и предполагалось, максимальное число уникальных гаплотипов обнаружено в географически удаленных регионах – в озерах бассейна р. Енисей, бассейне оз. Байкал и Забайкалье, т.е. в местах существования гипотетических плейстоценовых рефугиумов.
К настоящему времени не найдено никаких морфологических различий между D. cf. longispina из Западной Сибири и D. longispina s. str., что может быть объяснено морфологическим стасисом этого таксона, который характерен для многих таксонов ветвистоусых ракообразных (Frey, 1982, 1987; Smirnov, Kotov, 2018). Популяции видов D. umbra и D. turbinata в горных районах юга Сибири и D. cf. longispina из равнинного района Западной Сибири представляют собой остатки пре-плейстоценовой фауны, выжившей в рефугиумах, и могут называться “биогеографическими реликтами” в понимании Grandcolas et al. (2014). Полученные новые данные позволяют рассматривать Западную и Восточную Сибирь как источник новых, еще не идентифицированных таксонов в пределах рода Daphnia вообще и, в частности, в группе D. longispina s. l. Уникальная видовая и гаплотипическая структура этой группы кладоцер в водоемах азиатской части России предполагает необходимость проведения на этой территории дальнейших, более обширных, исследований популяций и форм/видов.
Список литературы
Аржанников С.Г., Алексеев С.В., Глызин А.В., Размахнина Т.Б., Орлова Л.А., 2000. Природная обстановка в Голоцене в Западной части Тоджинской впадины на примере разреза Мерзлый Яр // Проблемы реконструкции климата и природной среды Голоцена и Плейстоцена Сибири. Вып. 2. Новосибирск: Изд. Института Археологии и Этнографии СО РАН. С. 18–29.
Волков И.А., Казьмин С.П., 2007. Сток вод последнего оледенения севера Евразии // География и природные ресурсы. № 4. С.7–10.
Глаголев С.М., 1986. Морфология, систематика и географическое распространение ветвистоусых ракообразных рода Daphnia Евразии. Дис. … канд. биол. наук. М.: ИЭМЭЖ АН СССР. 226 с.
Гросвальд М.Г., Котляков В.М., 1989. Великая приледниковая система стока Северной Азии и ее значение для межрегиональных корреляций // Четвертичный период. Палеография и литология: Сборник научных трудов. Кишинев: Штииница. С. 5–13.
Гросвальд М.Г., 1999. Евразийские гидросистемные катострофы и оледенения Арктики. М.: Научный Мир. 118 с.
Зуйкова Е.И., 2019. Идентификация и филогения криптических видов комплекса Daphnia longispina (Cladocera, Daphniidae) на основе вторичной структуры промежуточного транскрибируемого спейсера 2 (ITS2) ядерной ДНК // Генетика. Т. 55. С. 557–573.
Зуйкова Е.И., Бочкарев Н.А., 2016. Популяционная и межвидовая морфологическая изменчивость видов рода Daphnia O.F. Müller, 1785 (Cladocera, Daphniidae) // Зоологический журнал. Т. 95. С. 805–814.
Зуйкова Е.И., Бочкарев Н.А., Катохин А.В., 2013. Молекулярно-генетическая диагностика и филогения видов рода Daphnia (Crustacea: Cladocera) из водоемов бассейна озера Чаны // Генетика. Т. 49. С. 235–243.
Зуйкова Е.И., Бочкарев Н.А., Шевелева Н.Г., 2016. Генетический полиморфизм, распространение гаплотипов и филогения видов рода Daphnia (Cladocera: Anomopoda) из некоторых водоемов России по результатам секвенирования гена 16S митохондриальной ДНК // Генетика. Т. 52. С. 1–13.
Зуйкова Е.И., Симонов Е.П., Бочкарев Н.А., 2017. Сравнительный морфологический и генетический анализ популяций и видов рода Daphnia O.F. Müller, 1785 (Crustacea; Daphniidae) из озер Глубокого и Чаны // Известия РАН, Серия Биологическая. № 3. С. 1–14.
Кирдяшева А.Г., Котов А.А., 2013. Морфология и возрастная изменчивость Daphnia galeata Sars (Cladocera: Daphniidae) в двух близлежащих водоемах Кольского полуострова // Известия РАН, Серия Биологическая. № 2. С. 174–185.
Котов А.А., 2013. Морфология и филогения Anomopoda (Crustacea: Cladocera). М.: Товарищество научных изданий КМК. 638 с.
Котов А.А., 2016. Фаунистические комплексы Cladocera (Crustacea, Branchiopoda) Восточной Сибири и Дальнего Востока России // Зоологический журнал. Т. 95. С. 748–768.
Котов A.A., Синев А.Ю., 2011. Cladocera (Crustacea, Branchiopoda) бассейна реки Зеи (Амурская Область, Российская Федерация). 2. Описания новых таксонов // Зоологический журнал. Т. 90. С. 272–284.
Смирнов Н.Н., Шевелева Н.Г., 2010. Chydorus irinae sp. n. (Anomopoda, Chydoridae, Chydorinae) из р. Томь (Бассейн Амура, Россия) // Зоологический журнал. Т. 89. № 5. С. 635–638.
Adamowicz S.J., Petrusek A., Colbourne J.K., Hebert P.D.N., Witt J.D.S., 2009. The scale of divergence: A phylogenetic appraisal of intercontinental allopatric speciation in a passively dispersed freshwater zooplankton genus // Molecular Phylogenetics and Evolution. V. 50. P. 423–436.
Ballinger M.J., Bruenn J.A., Kotov A.A., Taylor D.J., 2013. Selectively maintained paleoviruses in Holarctic water fleas reveal an ancient origin for phleboviruses // Virology. V. 446. P. 276–282.
Bekker E.I., Karabanov D.P., Galimov Y.R., Kotov A.A., 2016. DNA barcoding reveals high cryptic diversity in the North Eurasian Moina species (Crustacea: Cladocera) // PLoS ONE. V. 11. e0161737. https://doi.org/10.1371/journal.pone.0161737
Bekker E.I., Karabanov D.P., Galimov Y.R., Haag C.R., Neretina T.V., Kotov A.A., 2018. Phylogeography of Daphnia magna Straus (Crustacea: Cladocera) in Northern Eurasia: Evidence for a deep longitudinal split between mitochondrial lineages // PLoS ONE. V. 13. e0194045. https://doi.org/10.1371/journal.pone.0194045
Belyaeva M., Taylor D.J., 2009. Cryptic species within the Chydorus sphaericus species complex (Crustacea: Cladocera) revealed by molecular markers and sexual stage morphology // Molecular Phylogenetics and Evolution. V. 50. P. 534–546.
Benzie J.A.H., 2005. The genus Daphnia (including Daphniopsis) (Anomopoda: Daphniidae) // Guides to the identification of the microinvertebrates of the continental waters of the world. V. 21. P. 1–376.
Bochkarev N.A., Zuykova E.I., Katokhin A.V., 2011. Morphology and mitochondrial DNA variation of the Siberian whitefish Coregonus lavaretus pidschian (Gmelin) in the upstream water bodies of the Ob and Yenisei rivers // Journal of Evolutionary Ecology. V. 25. P. 557–572.
Bolotov I.N., Kondakov A.V., Konopleva E.S., Vikhrev I.V., Aksenova O.V., Aksenov A.S. et al., 2020. Integrative taxonomy, biogeography and conservation of freshwater mussels (Unionidae) in Russia // Scientific Reports. V. 10. 3072. https://doi.org/10.1038/s41598-020-59867-7
Colbourne J.K., Hebert P.D.N., 1996. The systematic of North American Daphnia (Crustacea: Anomopoda): a molecular phylogenetic approach // Philosophical Transactions of the Royal Society of London. Series B. V. 351. P. 349–360.
Darriba D., Taboada G.L., Doallo R., Posada D., 2012. ModelTest 2: more models, new heuristics and parallel computing // Nature Methods. V. 9. № 8. P. 772.
De Gelas K., De Meester L., 2005. Phylogeography of Daphnia magna in Europe // Molecular Ecology. V. 1. P. 753–764.
De Meester L., Gómez A., Okamura B., Schwenk K., 2002. The monopolization hypothesis and the dispersal-gene flow paradox in aquatic organisms // Acta Oecologia. V. 23. P. 121–135.
Di Capua I., Maffucci F., Pannone R., Mazzocchi M.G., Biffali E., et al., 2017. Molecular phylogeny of Oncaeidae (Copepoda) using nuclear ribosomal internal transcribed spacer (ITS rDNA) // PLOS ONE. V. 12. № 4. e0175662. https://doi.org/10.1371/journal.pone.0175662
Dlouhá S., Thielsch A., Kraus R.H.S., Seda J., Schwenk K., et al., 2010. Identifying hybridizing taxa within the Daphnia longispina species complex: a comparison of genetic methods and phenotypic approaches // Hydrobiologia. V. 643. P. 107–122.
Francisco F.O., Nunes-Silva P., Francoy T.M., Wittmann D., Imperatriz-Fonseca V.L., et al., 2008. Morphometrical, biochemical and molecular tools for assessing biodiversity. An example in Plebeia remota (Holmberg, 1903) (Apidae, Meliponini) // Insectes Sociaux. V. 55. P. 231–237.
Frey D.G., 1982. Questions concerning cosmopolitanism in Cladocera // Archiv für Hydrobiologie. V. 93. P. 484–502.
Frey D.G., 1987. The taxonomy and biogeography of the Cladocera // Hydrobiologia. V. 145. P. 5–17.
Friedrich J., Dandekar T., Wolf M., Muller T., 2005. ProfDist: a tool for the construction of large phylogenetic trees based on profile distances // Bioinformatics. V. 21. P. 2108–2109.
Garibian P.G., Neretina A.N., Klimovsky A.I., Kotov A.A., 2018. A new case of West-East differentiation of the freshwater fauna in Northern Eurasia: the Pleuroxus trigonellus species group (Crustacea: Cladocera: Chydoridae) // Zootaxa. V. 4532. P. 451–482.
Gießler S., 2001. Morphological differentiation within the Daphnia longispina group // Hydrobiologia. V. 442. P. 55–66.
Gießler S., Englbrecht C.C., 2009. Dynamic reticulate evolution in a Daphnia multispecies complex // Journal of Experimental Zoology. V. 311A. P. 531–549.
Gießler S., Mader E., Schwenk K., 1999. Morphological evolution and genetic differentiation in Daphnia species complexes // Journal of Evolutionary Biology. V. 12. P. 710–723.
Giri F., Collins P.A., 2004. A geometric morphometric analysis of two sympatric species of the family Aeglidae (Crustacea, Decapoda, Anomura) from the La Plata basin // Italian Journal of Zoology. V. 71. P. 85–88.
Grandcolas P., Nattier R., Trewick S., 2014. Relict species: A relict concept? // Trends in Ecology and Evolution. V. 29. P. 655–663.
Hamrová E., Krajicek M., Karanovic T. Černý M., Petrusek A., 2012. Congruent patterns of lineage diversity in two species complexes of planktonic crustaceans, Daphnia longispina (Cladocera) and Eucyclops serrulatus (Copepoda), in East European mountain lakes // Zoological Journal of the Linnean Society. V. 166. P. 754–757.
Huang Q., Xu S.L., Xu L., Han B.P., 2017. Haplotype diversity and genetic differentiation of dormant and active populations of Daphnia galeata in Liuxihe Reservoir of Guangdong Province, southern China // Journal of Lake Sciences. V. 29. P. 1209–1216.
Ishida S., Takahashi A., Matsushima N., Yokoyama J., Makino W. et al., 2011. The long-term consequences of hybridization between the two Daphnia species, D. galeata and D. dentifera, in mature habitats // BMC Evolutionary Biology. V. 11. № 209. https://doi.org/10.1186/1471-2148-11-209
Ishida S., Taylor D.J., 2007. Mature habitats associated with genetic divergence despite strong dispersal ability in an arthropod // BMC Evolutionary Biology. V. 7. № 52. https://doi.org/10.1186/1471-2148-7-52
Ishida S., Taylor D.J., 2007a. Quaternary diversification in a sexual Holarctic zooplankter, Daphnia galeata // Molecular Ecology. V. 16. P. 569–582.
Karabanov D.P., Bekker E.I., Shiel R.J., Kotov A.A., 2018. Invasion of a Holarctic planktonic cladoceran Daphnia galeata Sars (Crustacea: Cladocera) in the Lower Lakes of South Australia // Zootaxa. V. 4402. P. 136–148.
Koetschan C., Förster F., Keller A., Schleicher T., Ruderisch B., Schwarz, R., et al., 2010. The ITS2 Database III – sequences and structures for phylogeny // Nucleic Acids Research. V. 38. P. D. 275–279.
Korovchinsky N.M., 1996. How many species of Cladocera are there? // Hydrobiologia. V. 321. P. 191–204.
Korovchinsky N.M., 2009. The genus Leptodora Lilljeborg (Crustacea: Branchiopoda: Cladocera) is not monotypic: description of a new species from the Amur River basin (Far East of Russia) // Zootaxa. V. 2120. P. 39–52.
Kotov A.A., 2015. A critical review of the current taxonomy of the genus Daphnia O. F. Muller, 1785 (Anomopoda, Cladocera) // Zootaxa. V. 3911. P. 184–200.
Kotov A.A., Ishida S., Taylor D.J., 2006. A new species in the Daphnia curvirostris (Crustacea: Cladocera) complex from the eastern Palearctic with molecular phylogenetic evidence for the independent origin of neckteeth // Journal of Plankton Research. V. 28. P. 1067–1079.
Kotov A.A., Karabanov D.P., Bekker E.I., Neretina T.V., Taylor D.J., 2016. Phylogeography of the Chydorus sphaericus group (Cladocera: Chydoridae) in the Northern Palearctic // PLoS ONE. V. 11. e0168711. https://doi.org/10.1371/journal.pone.0168711
Kotov A.A., Korovchinsky N.M., 2006. First record of fossil Mesozoic Ctenopoda (Crustacea, Cladocera) // Zoological Journal of the Linnean Society. V. 146. P. 269–274.
Kotov A.A., Taylor D.J., 2019. Contrasting endemism in pond-dwelling cyclic parthenogens: the Daphnia curvirostris species group (Crustacea: Cladocera) // Scientific Reports. V. 9. 6812. https://doi.org/10.1038/s41598-019-43281-9
Kumar S., Stecher G., Tamura K., 2016. MEGA7: Molecular Evolutionary Genetics Analysis version 7.0 for bigger datasets // Molecular Biology and Evolution. V. 33. P. 1870–1874.
Ma X., Hu W., Smilauer P., Yin M., Wolinska J., 2019. Daphnia galeata and D. dentifera are geographically and ecologically separated whereas their hybrids occur in intermediate habitats: A survey of 44 Chinese lakes // Molecular Ecology. V. 28. P. 785–802.
Ma X., Petrusek A., Wolinska J. Gießler S., Zhong Y., et al., 2015. Diversity of the Daphnia longispina species complex in Chinese lakes: a DNA taxonomy approach // Journal of Plankton Research. V. 37. P. 55–65.
Mangerud J., Jakobsson M., Alexanderson H., Astakhov V., Clarke G.K.C., et al., 2004. Ice-dammed lakes and rerouting of the drainage of northern Eurasia during the Last Glaciation // Quaternary Science Reviews. V. 23. P. 1313–1332.
Möst M., Petrusek A., Sommaruga R. Juračka P.J., Slusarczyk M., et al., 2012. At the edge and on the top: molecular identification and ecology of Daphnia dentifera and D. longispina in high-altitude Asian lakes // Hydrobiologia. V. 715. P. 51–62.
Nei M., Kumar S., 2000. Molecular Evolution and Phylogenetics. Oxford University Press, New York. 333 p.
Nilssen J.P., Hobaek A., Petrusek A., Skage M., 2007. Restoring Daphnia lacustris G.O. Sars, 1862 (Crustacea, Anomopoda): a cryptic species in the Daphnia longispina group // Hydrobiologia. V. 594. P. 5–17.
Perrière G., Gouy M., 1996. WWW-Query: An on-line retrieval system for biological sequence banks // Biochimie. V. 78. P. 364–369.
Petrusek A., Černý M., Mergeay J., Schwenk K., 2007. Daphnia in the Tatra Mountain lakes: multiple colonization and hidden species diversity revealed by molecular markers // Fundamental and Applied Limnology. Archiv für Hydrobiologie. V. 169. P. 279–291.
Petrusek A., Hobaek A., Nilssen J.P., Skage M., Černý M., et al., 2008. A taxonomic reappraisal of the European Daphnia longispina complex (Crustacea, Cladocera, Anomopoda) // Zoologica Scripta. V. 37. P. 507–519.
Petrusek A., Thielsch A., Schwenk K., 2012. Mitochondrial sequence variation suggests extensive cryptic diversity within the Western Palearctic Daphnia longispina complex // Limnology and Oceanography. V. 57. P. 1838–1845.
Popova E.V., Petrusek A., Korinek V., Mergeay J., Bekker E.I., et al., 2016. Revision of the Old World Daphnia (Ctenodaphnia) similis group (Cladocera: Daphniidae) // Zootaxa. V. 161. P. 1−40.
Rogers D.C., Kotov A.A., Sinev A.Y., Glagolev S.M., Korovchinsky N.M., et al., 2019. Keys to Palaearctic Fauna. Chapter 16.2: Arthropoda: Class Branchiopoda // Thorp and Covich’s Freshwater Invertebrates. Fourth Edition. Thorp J.H., Rogers D.C. (Eds). V. 4. London etc.: Academic Press. P. 643‒724.
Saitou N., Nei M., 1987. The neighbor-joining method: a new method for reconstructing phylogenetic trees // Molecular Biology and Evolution. V. 4. P. 6–25.
Santamaria C.A., Mateos M., DeWitt T.J., Hurtado L.A., 2016. Constrained body shape among highly genetically divergent allopatric lineages of the supralittoral isopod Ligia occidentalis (Oniscidea) // Ecology and Evolution. V. 6. P. 1537–1554.
Schultz J., Wolf M., 2009. ITS2 sequence-structure analysis in phylogenetics: A how-to manual for molecular systematics // Molecular Phylogenetics and Evolution. V. 52. P. 520–523.
Schwenk K., Junttila P., Rautio M., Bastiansen F., Knapp J., et al., 2004. Ecological, morphological, and genetic differentiation of Daphnia (Hyalodaphnia) from the Finnish and Russian subarctic // Limnology and Oceanography. V. 49. P. 532–539.
Schwenk K., Posada D., Hebert P.D.N., 2000. Molecular systematics of European Hyalodaphnia: the role of contemporary hybridization in ancient species // Proceedings of the Royal Society of London. Series B: Biological Sciences. V. 267. P. 1833–1842.
Seibel P.N., Müller T., Dandekar T., Wolf M., 2008. Synchronous visual analysis and editing of RNA sequence and secondary structure alignments using 4SALE // BMC Research Notes. V. 1. P. 91.
Silva I.C., Mesquita N., Paula J., 2010. Genetic and morphological differentiation of the mangrove crab Perisesarma guttatum (Brachyura: Sesarmidae) along an East African latitudinal gradient // Biological Journal of the Linnean Society. V. 99. P. 28–46.
Smirnov N.N., 2017. Physiology of the Cladocera. 2nd Edition. London etc.: Academic Press. 418 p.
Smirnov N.N., Kotov A.A., 2018. On morphological radiation of Cladocera (Crustacea) // Invertebrate Zoology. V. 15. P. 231–248.
Tamura K., Nei M., 1993. Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees // Molecular Biology and Evolution. V. 10. P. 512–526.
Taylor D.J., Hebert P.D.N., Colbourne J.K., 1996. Phylogenetics and evolution of the Daphnia longispina group (Crustacea) based on 12S rDNA sequence and allozyme variation // Molecular Phylogenetics and Evolution. V. 5. P. 495–510.
Taylor D.J., Sprenger H.L., Ishida S., 2005. Geographic and phylogenetic evidence for dispersed nuclear introgression in a daphniid with sexual propagules // Molecular Ecology. V. 14. P. 525–537.
Thielsch A., Brede N., Petrusek A., De Meester L., Schwenk K., 2009. Contribution of cyclic parthenogenesis and colonization history to population structure in Daphnia // Molecular Ecology. V. 18. P. 1616–1628.
Thielsch A., Knell A., Mohammadyari A., Petrusek A., Schwenk K., 2017. Divergent clades or cryptic species? Mitonuclear discordance in a Daphnia species complex // BMC Evolutionary Biology V. 17. № 227. https://doi.org/10.1186/s12862-017-1070-4
Van Damme K., Kotov A.A., 2016. The fossil record of the Cladocera (Crustacea: Branchiopoda): evidence and hypotheses // Earth-Science Reviews. V. 163. P. 162–189.
Ventura M., Petrusek A., Miró A. Hamrová E., Buňay D., et al., 2014. Local and regional founder effects in lake zooplankton persist after thousands of years despite high dispersal potential // Molecular Ecology. V. 23. P. 1014– 1027.
Vinarski M.V., Bolotov I.N., Schniebs K., Nekhaev I.O., Hundsdoerfer A.K., 2017. Endemics or strangers? The integrative re-appraisal of taxonomy and phylogeny of the Greenland Lymnaeidae (Mollusca: Gastropoda) // Comptes Rendus Biologies. V. 340. P. 541–557.
Vysotskiy E.M., 2001. Geomorphology of the basin of Teletskoe Lake. Physical and geological environment of Lake Teletskoe. Selegei V., Dehandschutter B., Klerkx J., Vysotsky E. (Eds). Tervuren: Musee Royal de I Afrigue Centrale Tervuren. P. 164–181.
Wiemers M., Keller A., Wolf M., 2009. ITS2 secondary structure improves phylogeny estimation in a radiation of blue butterflies of the subgenus Agrodiaetus (Lepidoptera: Lycaenidae: Polyommatus) // BMC Evolutionary Biology. V. 9. № 300. https://doi.org/10.1186/1471-2148-9-300
Wolf M., Ruderisch B., Dandekar T., Müller T., 2008. ProfDistS: (Profile-) Distance based phylogeny on sequence-structure alignments // Bioinformatics. V. 24. P. 2401–2402.
Xu L., Lin Q., Xu S., Gu Y., Hou J., et al., 2018. Daphnia diversity on the Tibetan Plateau measured by DNA taxonomy // Ecology and Evolution. V. 8. P. 5069–5078.
Xu S., Hebert P.D.N., Kotov A.A., Cristescu M.E., 2009. The non-cosmopolitanism paradigm of freshwater zooplankton: insights from the global phylogeography of the predatory cladoceran Polyphemus pediculus (Crustacea, Onychopoda) // Molecular Ecology. V. 18. P. 5161–5179.
Yin M., Wolinska J., Gießler S., 2010. Clonal diversity, clonal persistence and rapid taxon replacement in natural populations of species and hybrids of the Daphnia longispina complex // Molecular Ecology. V. 19. P. 4168–4178.
Zuykova E.I., Bochkarev N.A., Katokhin A.V., 2013. Identification of the Daphnia species (Crustacea: Cladocera) in the lakes of the Ob and Yenisei River basins: morphological and molecular phylogenetic approaches // Hydrobiologia. V. 715. P. 135–150.
Zuykova E.I., Bochkarev N.A., Semenova A.S., Katokhin A.V., 2010. Morphological differentiation, mitochondrial and nuclear DNA variability between geographically distant populations of Daphnia galeata and Daphnia cucullata (Anomopoda, Daphniidae) // Journal of Siberian Federal University. Biology. V. 4. № 3. P. 434–453.
Zuykova E.I., Simonov E.P., Bochkarev N.A., Abramov S.A., Sheveleva N.G., Kotov A.A., 2018b. Contrasting phylogeographic patterns and demographic history in closely related species of Daphnia longispina group (Crustacea: Cladocera) with focus on North-Eastern Eurasia // PloS ONE. V. 13. № e0207347. https://doi.org/10.1371/journal.pone.0207347
Zuykova E.I., Simonov E.P., Bochkarev N.A., Talor D.J., Kotov A.A., 2018a. Resolution of the Daphnia umbra problem (Crustacea: Cladocera) using an integrated taxonomic approach // Zoological Journal of the Linnean Society. V. 184. P. 969–998.
Zuykova E.I., Sheveleva N.G., Kotov A.A., 2019a. Redescription of Daphnia turbinata Sars, 1903 (Crustacea: Cladocera: Daphniidae) // Zootaxa. V. 4658. P. 317–330.
Zuykova E.I., Bochkarev N.A., Talor D.J., Kotov A.A., 2019b. Unexpected endemism in the Daphnia longispina complex (Crustacea: Cladocera) in Southern Siberia // PLoS ONE. V. 14. № e0221527. https://doi.org/10.1371/journal.pone.0221527
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


