Зоологический журнал, 2020, T. 99, № 11, стр. 1263-1267
Жизненный цикл и таксономический статус Senecella siberica Vyshkvartzeva 1994 (Copepoda, Calanoida) в больших Норильских озерах (бассейн реки Пясина, Центральная Сибирь)
a Институт биофизики Федерального исследовательского центра “Красноярский научный центр”
Сибирского отделения РАН
660036 Красноярск, Россия
b Сибирский федеральный университет
660041 Красноярск, Россия
* E-mail: dubovskaya@ibp.krasn.ru
Поступила в редакцию 01.03.2020
После доработки 10.03.2020
Принята к публикации 15.03.2020
Аннотация
Зимой 2018 г. были отобраны подледные тотальные сетные пробы зоопланктона в одном из больших Норильских озер – оз. Собачье, в западной (13 апреля, 6 мая) и средней (6 мая) частях с глубин 70, 80 и 100 м. Подтверждено ранее сделанное предположение, что Senecella в больших Норильских озерах размножается зимой и является моноциклическим видом с длительным (один год) временем развития генерации. Подтвердилась также принадлежность половозрелых особей виду Senecella siberica Vyshkvartzeva 1994.
Вышкварцева (Vyshkvartzeva, 1994) установила новый вид S. siberica, основываясь на морфологии особей из залива Неелова моря Лаптевых (дельта р. Лена), и предположила, что все популяции из северной Сибири, ранее относимые к S. calanoides Juday 1923, принадлежат к этому виду. Недавно мы сообщили о первых находках S. siberica Vyshkvartzeva 1994 в больших Норильских озерах, в частности Лама и Собачье (Дубовская, Глущенко, 2018), основываясь на старших стадиях копеподитов, найденных в летне-осенних пробах зоопланктона. Этих особей мы отнесли по ключам (Czaika, 1982) к конкретным копеподитным стадиям и предположили, что S. siberica в озерах Лама и Собачье размножается зимой (Дубовская, Глущенко, 2018). Цель данного сообщения – привести результаты обработки зимних проб зоопланктона, специально отобранных для уточнения таксономического статуса и изучения жизненного цикла этих популяций.
Пробы со льда были взяты на оз. Собачье 13.04.2018 г. в его западной части (69.03° с.ш., 90.99° в.д., 1 проба) и 6.05.2018 в западной (69.03° с.ш., 91.08° в.д., 1 проба) и средней частях (69.03°–69.04° с.ш., 91.14–91.31° в.д., 2 пробы) сетью Ланганса (Цеппелин) с диаметром входного отверстия 13 см и ячеей 82 мкм, протягиванием ее с глубины 70, 80 и 100 м до поверхности, и зафиксированы 4% формалином. Пробы обрабатывали в лаборатории под инвертированным микроскопом Leica DMIL LED (Германия) в осадочных камерах Утермеля (объемом 10 мл), объем просчитанных квот составлял 0.13–0.24 объема пробы, редкие виды просчитывались во всей пробе (под бинокуляром). Фотографии особей на постоянных препаратах в глицерине делали при помощи цветной цифровой камеры Leica DFC 295.
Норильские озера очищаются ото льда в июне, период открытой воды 3.5–4.5 месяца (Богданов, 1985). Температура воды летом в верхних слоях 7–15°С и в гиполимнионе 3.8–9°С (Вершинин, 1963; наши данные), зимой соответственно 0.1–0.5 и 1.5–4° С (Останин, 1981). Анализы единичных проб (Богданов, 1985) показывают, что воды Норильских озер гидрокарбонатно-кальциевые, иногда с большим содержанием сульфатов (гидрокарбонатно-сульфатные (Вершинин, 1963)), а также натрия и калия, маломинерализованные (сумма ионов 39–140 мг/л), мягкие (Са2+ 7–23, Mg2+ 1–13 мг/л). Согласно результатам разового отбора воды (05.09.2018) из оз. Собачье, концентрация минерального фосфора ниже концентрации порога обнаружения – <0.002 мг/л (неопубликованные данные ИБФ СО РАН).
В составе сетного зоопланктона обнаружены коловратки рода Synchaeta, Kellicottia longispina (Kellicott), Keratella cochlearis (Gosse), но преобладали по численности и биомассе веслоногие раки, а именно, самки и самцы, науплиусы и копеподиты Limnocalanus macrurus Sars, Cyclops lacustris Sars и Senecella. Доминировал L. macrurus, составляя 74–90% биомассы зоопланктона (табл. 1). Максимальная доля Senecella в биомассе зоопланктона отмечена в апреле – 16.20%. Биомасса всего сетного зоопланктона в 1 м3 столба воды высотой 70–100 м была низкой (табл. 1), уменьшалась от апреля к маю от 34 до 11.73 ± 4.25 мг/м3.
Таблица 1.
Доля (%) отдельных видов и групп в общей биомассе (мг/м3) сетного зоопланктона в оз. Собачье (Норильские озера) в подледный период 2018 г.
| Таксон | Стадия | 13 апреля | 6 мая | ||
|---|---|---|---|---|---|
| запад. ч. | запад. ч.* | сред. ч. | сред. ч.** | ||
| 0–70 м | 0–80 м | 0–100 м | 0–100 м | ||
| Rotifera | – | 0.06 | 0.31 | 0.57 | 0.42 |
| Limnocalanus macrurus |
Половозрелые и копеподиты | 79.30 | 84.62 | 67.57 | 79.35 |
| Науплиусы | 0.80 | 5.33 | 6.92 | 1.87 | |
| Cyclops | Половозрелые и копеподиты | 0.68 | 2.26 | 7.82 | 1.63 |
| Науплиусы | 2.97 | 6.56 | 11.68 | 3.55 | |
| Senecella | Самцы | 10.32 | 0 | 3.18 | 4.45 |
| Cамки | 5.87 | 0 | 0 | 7.77 | |
| Науплиусы (N 5–6) | 0.03 | 0.72 | 1.13 | 0.60 | |
| Копеподиты (C1) | 0 | 0.21 | 1.13 | 0.36 | |
| Общая биомасса, мг/м3 | 33.71 | 9.75 | 8.82 | 16.61 | |
В апрельской пробе по сравнению с майскими пробами обнаружено максимальное количество (8 экз./м3) половозрелых особей Senecella, причем одна самка была с прикрепленным сперматофором, в теле одного самца он тоже просматривался. Крупных науплиусов Senecella 5–6-й стадий, хорошо отличимых по ключам Czaika (1982) от науплиусов циклопа, было обнаружено всего 3, а копеподитов – ни одного. В майских же пробах количество половозрелых особей было меньше (0–4), но старших науплиусов гораздо больше (18–25), при этом появились копеподиты С1 (1–4 экз./м3). Такая динамика свидетельствует о том, что созревание копеподитов С5, обнаруженных нами ранее в сентябре (Дубовская, Глущенко, 2018), происходит зимой и наступает период размножения, при этом копуляция заканчивается поздней зимой – в апреле; выход науплиусов из яиц и достижение ими 6-й стадии происходит, по-видимому, в марте–апреле, а в мае (но еще подо льдом) некоторое количество науплиусов уже превращается в копеподиты (С1). В конце подледного периода и в период открытой воды происходит основной рост копеподитов – к сентябрю–октябрю до 5-й стадии. В некоторых холодных ультраолиготрофных озерах Северной Америки популяция S. calanoides представлена двумя поколениями, одно из которых развивается медленнее – два года вместо одного и особи которого мельче (Carter et al., 1984). Поскольку в пробах из оз. Собачье Senecella представлена всегда одной стадией – С5 в сентябре (Дубовская, Глущенко, 2018) или соседними стадиями – науплиусами N5–6 и копеподитами С1 в мае, постольку Senecella в этом озере является моноциклическим видом с периодом развития генерации один год и, по-видимому, с несколько растянутым в течение зимы периодом размножения. Таким образом, наше предположение (Дубовская, Глущенко, 2018) о том, что этот вид в Норильских озерах размножается в зимний период и является моноциклическим с длительным временем развития генерации, как и S. calanoides в Северной Америке (например, Carter, 1969; Selgeby, 1975) и S. siberica в зоне опресненных вод эстуариев Оби и Енисея (например, Dritz et al., 2016) и морского прибрежья дельты Лены (Пирожников, 1958), нашло подтверждение.
Наличие половозрелых самцов и самок в зимних пробах позволило сопоставить их основные признаки с таковыми в табл. 1 Вышкварцевой (Vyshkvartzeva, 1994, с. 117) у S. siberica, а именно: левый эндоподит 5-й ноги самца значительно длиннее, чем первый членик экзоподита этой ноги (рис. 1a–1с); количество внешних шипов на 3-м членике экзоподита 2–4-й плавательных ног (и самца и самки) – 3, генитальный сегмент самки едва заметно асимметричен. Таким образом, по описанию Вышкварцевой и по ключам в определителе Мархасевой (Markhaseva, 1996), Senecella из оз. Собачьего определяется как S. siberica. Основное отличие особей из оз. Собачьего от описанных Вышкварцевой (Vyshkvartzeva, 1994) заключается в их линейных размерах – длина первых меньше, чем вторых: самки 2.23–2.35 против 3.00–3.30 мм, самцы 1.68–2.10 против 2.80–2.88 мм. Однако отмечено, что размеры особей из пресных озер меньше, чем из солоноватых местообитаний, например длина самца из оз. Ямбуто 2.36 мм (Смирнов, 1938; цит. по: Vyshkvartzeva, 1994).
Рис. 1.
Детали строения 5-й пары ног самца Senecella siberica из западной части оз. Собачье (Норильские озера), 13.04.2018 (а – левая нога с двухчлениковым экзоподитом и треугольным эндоподитом с шипом; b – она же другого самца из этой же пробы, эндоподит наложился на первый членик экзоподита – видно, что даже без учета шипа длина первого больше длины второго) и средней части оз. Собачье, 6.05.2018 (c – общий вид, эндоподит левой ноги оторвался от места прикрепления на базиподите, обозначенном чертой); а также 5-й пары ног самца Senecella calanoides из оз. Кайюга (штат Нью-Йорк, США), 09.11.1950 (d – слева часть правой ноги, справа – левая нога с двухчлениковым экзоподитом и треугольным эндоподитом с шипом; e – общий вид этой же пары ног, базиподит правой ноги оторвался от коксоподита).
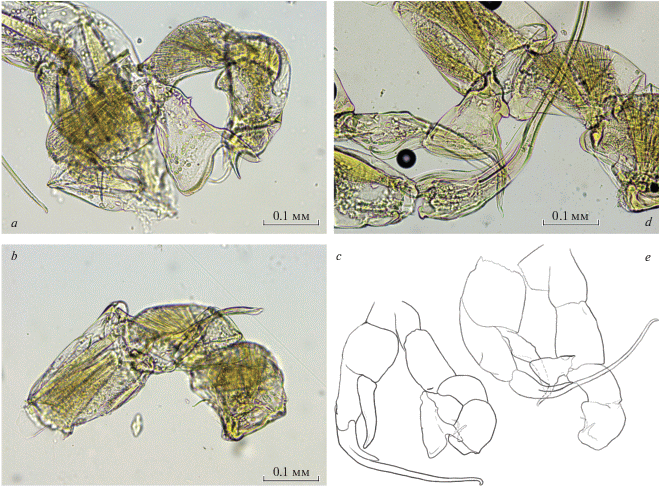
Автор данного сообщения имела возможность изучить в Смитсонианском Национальном Музее Естественной Истории (г. Вашингтон, США) препараты половозрелых особей S. calanoides из оз. Кайюга (Cayuga, штат Нью-Йорк) (№ 92 134). Эндоподит левой ноги самца (рис. 1d–1e) у них, действительно, существенно короче, чем таковой у S. siberica (рис. 1a–1c), но длина его вместе с шипом чуть больше, чем таковая первого членика экзоподита (рис. 1d–1e), хотя в табл. 1 Вышкварцевой (Vyshkvartzeva, 1994, с. 117) указано, что они равны. Согласно описанию S. calanoides (Juday, 1925, Plate 3 , Fig. 20 ), они также равны. По-видимому, длина этого шипа варьирует у особей внутри популяции или между популяциями из разных озер. Судя по приведенным иллюстрациям (рис. 1a–1c), его длина несколько варьирует и в популяции S. siberica в оз. Собачье.
Существует мнение (Khlebovich, Abramova, 2000), что выделение отдельного вида S. siberica преждевременно, так как морфологические различия могут быть обусловлены обитанием эвригалинного вида (S. calanoides) в разных условиях солености (в пресных водах Северной Америки и солоноватых водах в Сибири) с образованием соответствующих морф. И хотя сравнение пресноводных особей из Сибири (оз. Собачьего, рис. 1a–1c) и Северной Америки (оз. Кайюга, рис. 1d–1e) подтверждает основные различия по описанию Вышкварцевой (Vyshkvartzeva, 1994) как видовые, по-видимому, назрела необходимость генетического анализа популяций Senecella из американских и сибирских озер, прибрежных районов морей Карского и Лаптевых. Очевидно, это позволит выявить филогенетические связи и уточнить классификацию рода Senecella, которые считаются неясными (Boxshall, Jaume, 2000).
Список литературы
Богданов А.Л., 1985. История изучения, морфометрия и гидрология озер // География озер Таймыра. Л.: Наука. С. 184–194.
Вершинин Н.В., 1963. Норильские озера и их донная фауна // Труды Всесоюзного гидробиологического общества АН СССР. Т. 13. С. 63–72.
Дубовская О.П., Глущенко Л.А., 2018. Первые находки Senecella siberica Vyshkvartzeva 1994 (Copepoda, Calanoida) в больших Норильских озерах (бассейн реки Пясина, Центральная Сибирь) // Зоологический журнал. Т. 97. Вып. 10. С. 1264–1271.
Останин Л.И., 1981. Термический режим озер // Озера северо-запада Сибирской платформы. Новосибирск: Наука. С. 70–80.
Пирожников П.Л., 1958. Об ареале и экологии копеподы Senecella calanoides Juday // Зоологический журнал. Т. 37. Вып. 4. С. 625–629.
Boxshall G.A., Jaume D., 2000. Making waves: The repeated colonization of fresh water by copepod crustaceans // Advances in Ecological Research. V. 31. P. 61–79.
Carter J.C.H., 1969. Life Cycles of Limnocalanus macrurus and Senecella calanoides, and seasonal abundance and vertical distributions of various planktonic copepods, in Parry Sound, Georgian Bay // Journal of the Fisheries Research Board of Canada. V. 262. P. 2543–2560.
Carter J.G.H., Dadswell M.J., Goudie K., 1984. Univoltine and semivoltine life histories in Senecella calanoides (Copepoda: Galanoida) and their relationship to body size // Canadian Journal of Fisheries and Aquatic Sciences. V. 41. P. 1167–1175.
Czaika S.C., 1982. Identification of nauplii N1–N6 and copepodids CI–CVI of the Great Lakes calanoids and cyclopoid copepods (Calanoida, Cyclopoida, Copepoda) // Journal of Great Lakes Research. V. 8. P. 439–469.
Drits A.V., Pasternak A.F., Nikishina A.B., Semenova T.N., Sergeeva V.M., et al., 2016. The dominant copepods Senecella siberica and Limnocalanus macrurus in the Ob Estuary: ecology in a high-gradient environment // Polar Biology. V. 39. P. 1527–1538.
Juday Ch., 1925. Senecella calanoides, a recently described fresh-water copepod // Proceedings of the U.S. National Museum. V. 66. Art. 4 (№ 2541). P. 1–6.
Khlebovich V.V., Abramova E.N., 2000. Some problems of crustacean taxonomy related to the phenomenon of Horohalinicum // Hydrobiologia. V. 417. P. 109–113.
Markhaseva E.L., 1996. Calanoid copepods of the family Aetideidae of the World Ocean. St. Petersburg: Zoological Institute of Russian Academy of Science. 331 p.
Selgeby J.H., 1975. Life histories and abundance of crustacean zooplankton in the outlet of Lake Superior, l97l–72 // Journal of the Fisheries Research Board of Canada. V. 32. P. 461–470.
Vyshkvartzeva N.V., 1994. Senecella siberica n. sp. and the position of the genus Senecella in Calanoida classification // Hydrobiologia. V. 292/293. P. 113–121.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


