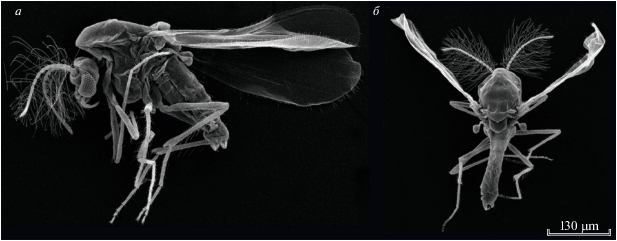
Зоологический журнал, 2020, T. 99, № 12, стр. 1398-1410
Влияние миниатюризации на анатомию Corynoneura scutellata Winnertz 1846 (Diptera, Chironomidae) – одного из мельчайших двукрылых
Е. Н. Веко a, *, А. А. Полилов a
a Биологический факультет Московского государственного университета
имени М.В. Ломоносова
119234 Москва, Россия
* E-mail: vekoegor@gmail.com
Поступила в редакцию 02.08.2019
После доработки 30.08.2019
Принята к публикации 02.12.2019
Аннотация
Миниатюризация – широко распространенное направление эволюции животных. Для насекомых описаны эффекты миниатюризации на всех уровнях организации организма, от крупных перестроек систем органов до принципиальных изменений на клеточном уровне. Результаты изучения анатомии миниатюрных жесткокрылых, перепончатокрылых, сеноедов, трипсов и веерокрылых внесли существенный вклад в понимание процесса миниатюризации животных. Однако на данный момент не все отряды микронасекомых являются достаточно изученными. В этой работе впервые детально описано внутреннее строение имаго самца одного из мельчайших длинноусых двукрылых Corynoneura scutellata Winnertz 1846 (Diptera, Chironomidae), изученное по сериям гистологических срезов с использованием трехмерных компьютерных реконструкций. Обнаружено, что вопреки миниатюрным размерам тела, большинство систем органов сохраняют типичный план строения, характерный для крупных представителей родственных групп. Трахейная система C. scutellata не утрачивает высокий уровень организации и представлена крупными трахейными стволами и ветвящейся системой трахей. У C. scutellata наблюдается концентрация ганглиев центральной нервной системы, редуцируется мускулатура головы и мускулатура, связанная с кишечником. Произведен анализ изменения относительных объемов систем органов миниатюрного двукрылого и проведено сравнение с микронасекомыми других отрядов. Показано, что общие закономерности аллометрии органов, выявленные ранее, справедливы и для миниатюрных двукрылых, однако половая система C. scutellata занимает значительно меньший относительный объем по сравнению с таковой у миниатюрных насекомых из других отрядов.
Миниатюризация наблюдается во многих группах животных. Она может влиять на строение позвоночных и беспозвоночных, водных и наземных форм, но масштабы изменений различаются в разных таксонах. Во многих группах беспозвоночных животных уменьшение размеров тела тесно связано с дегенерацией, однако у мельчайших насекомых этого не наблюдается, а в некоторых группах возможно приобретение новых структур (Polilov, 2016). Несмотря на детальную изученность морфологии и анатомии микронасекомых из многих отрядов (Polilov, 2016; Minelli, Fusco, 2019), работ по изучению анатомии миниатюрных двукрылых, в том числе и семейства Chironomidae, практически нет. На данный момент известно, что самыми маленькими размерами среди двукрылых обладают два представителя семейства Phoridae: Megapropodiphora arnoldi (0.395 мм) и Euryplatea nanaknihali (0.41 мм) (Brown, 2012, 2018). В этих работах приводится краткое морфологическое описание, но о внутреннем строении ничего неизвестно. В настоящее время Mayetiola destructor (Diptera: Cecidomyiidae) является единственным миниатюрным двукрылым, для которого есть данные по анатомии, но только головы (Schneeberg et al., 2013).
Одними из мельчайших двукрылых являются Chironomidae. Это наиболее широко распространенная и часто самая многочисленная группа насекомых в пресных водоемах (Rosenberg, 1992). За счет поведенческих и физиологических адаптаций, виды хирономид способны существовать в пресных и соленых водоемах, в среде с высокой и низкой концентрацией кислорода, в широких диапазонах температур и рН, а также на больших высотах (Hashimoto, 1976; Cannings, Scudder, 1978; Pinder, 1986; Armitage et al., 2012). Все эти аспекты делают Chironomidae основным объектом исследований популяционной экологии и изучения производительности водоемов и мониторинга их состояния (Назарова и др., 2011; Большаков, 2015; Жиров, Мыльников, 2016; Назарова и др., 2018; Gibson, 1945). Морфологии хирономид посвящено значительно меньше работ, и в них детально описаны характеристики признаков, использующихся в таксономии (Hirvenoja, 1973; Hansen, Cook, 1976; Saether, 1980). Одной из мельчайших Chironomidae с длиной тела 0.8–1.9 мм является Corynoneura scutellata, ее наружное строение описано в таксономических работах (Makarchenko et al., 2019), а анатомия оставалась не изученной.
В большинстве исследований, которые посвящены внутреннему строению двукрылых, рассматриваются одна или несколько систем органов. Так, имеются сведения о строении кровеносной системы (Jones, 1954; Wasserthal, 1999), описана морфология половой системы крупных представителей двукрылых, таких как Scatophagidae, Muscidae, Asilidae (Degrugillier, Leopold, 1973; Hosken et al., 1999; Winterton et al., 1999; Mattei et al., 2015), проводились исследования выделительной системы Sarcophagidae, Calliphoridae, Glossinidae и Chironomidae (Alkassis, Schoeller, 1984; Kongoro, Odhiambo, 1988; Jarial, 1988; Pal, Kumar, 2013; Pacheco et al., 2014), детально изучена мускулатура груди Drosophila melanogaster и Сrataerina pallida (Fabian et al., 2016; Liu et al., 2018). Строение гениталий и мускулатуры, ассоциированной с ними, хорошо изучены как для самок, так и для самцов Chironomidae (Зорина, 2004; Полуконова, 2005; Ovtshinnikova et al., 2018; Makarchenko et al., 2019).
Цель работы – провести первое детальное исследование внутреннего строение одного из мельчайших представителей двукрылых C. scutellata (Diptera, Chironomidae) и выявить особенности, связанные с миниатюризацией.
МАТЕРИАЛ И МЕТОДИКА
Имаго Corynoneura scutellata Winnertz 1846 собраны в августе 2014 г. в Московской обл. в окрестностях пос. Володарского с помощью энтомологического сачка во время роения (около 200 особей, все самцы). Материал фиксировали в ФСУ (формальдегид, спирт, уксусная кислота) и хранили в 70% этаноле. Объекты были определены А.А. Пржиборо (Зоологический институт РАН). Скелетные структуры были изучены с помощью сканирующего электронного микроскопа (СЭМ) Jeol JSM-6380 после высушивания образцов в критической точке (Hitachi HCP-2) и напыления золотом (Giko IB-3). Для изучения внутреннего строения фиксированный в ФСУ материал был обезвожен и заключен в аралдит (Araldite M). Из полученных блоков были сделаны полные серии поперечных и продольных срезов толщиной 1 мкм на микротоме Leica RM2255. Срезы окрашивали толуидиновым синим и пиронином.
Для трехмерного компьютерного моделирования (3D) серии срезов были сфотографированы на микроскопе Motic BA410. После выравнивания и калибровки полученного стека проводили реконструкцию в программе Bitplane Imaris. Все структуры были сегментированы вручную. Готовые реконструкции обрабатывали в программе Autodesk Maya, используя функции сглаживания поверхности и рендеринга. Для подсчета объемов внутренних органов использовался статистический модуль программы Bitplane Imaris. Более подробное описание методов приведено в предыдущих работах (Polilov, 2016, 2017).
Номенклатура основных систем органов приведена по Б.Н. Шванвичу (1949), с некоторыми дополнениями из более современных работ по двукрылым (Fabian et al., 2016; Liu et al., 2018). Использована номенклатура мускулатуры головы по Випфлеру (Wipfler et al., 2011), грудного отдела – по Фридриху и Бойтелю (Friedrich, Beutel, 2008). При описании мышц использованы сокращения: O – origin – место отхождения мышцы, I – insertion – место прикрепления мышцы.
РЕЗУЛЬТАТЫ
Общая анатомия
Длина тела 0.81–0.93 мм (M = 0.87, n = 5) (рис. 1). Общий план внутренних органов: значительная доля объема головной капсулы приходится на мозг вместе с подглоточным ганглием; большая часть груди занята мускулатурой, в этой части тела также располагаются крупные грудные ганглии; в медиальной части тела размещен кишечник, имеющий вид прямой трубки; половая система, расположенная целиком в брюшке, занимает значительную ее часть; сердце с аортой находятся на дорсальной стороне брюшка (рис. 2, 3). Объем тела 36.7 нл.
Рис. 2.
Внутреннее строение Corynoneura scutellata, 3D-реконструкция: а – вид сбоку изнутри; б – вид снаружи, покровы полупрозрачные; в – вид снизу; г – вид сверху; ag – брюшной ганглий, agl – придаточные железы, cer – мозг, gg1.2.3 – про-, мезо- и метаторакальный ганглий, hg – задняя кишка, ht – сердце, mg – средняя кишка, mt – мальпигиевые сосуды, ос – глаз, rc – ректум, soeg – подглоточный ганглий, te – семенники. Обозначения мускулатуры см. в тексте.
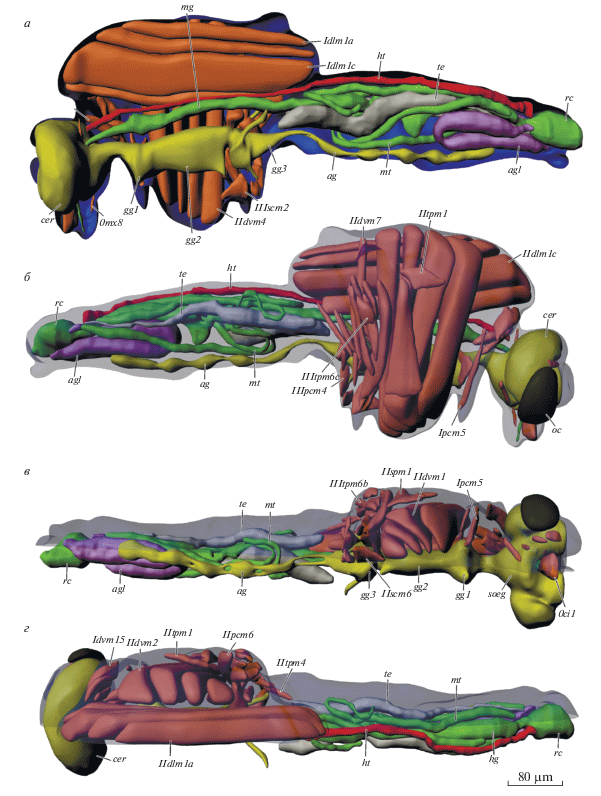
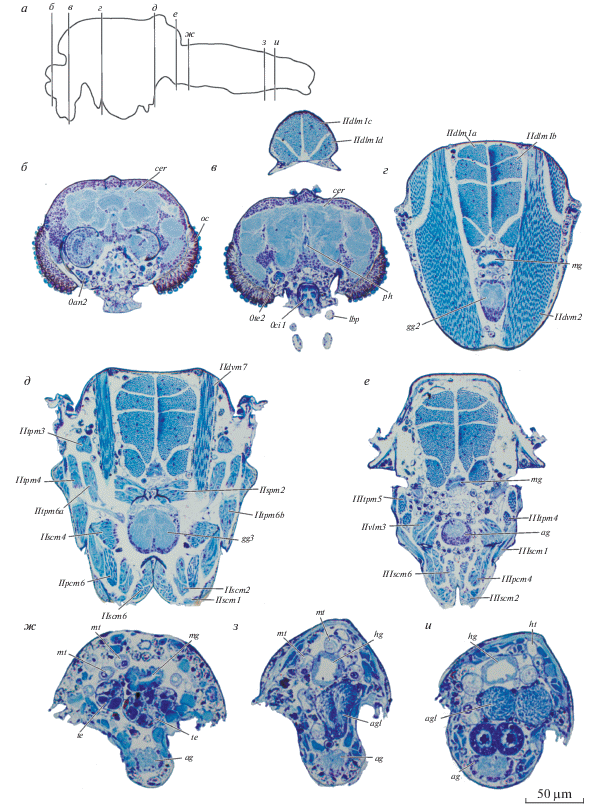
Рис. 3.
Внутреннее строение Corynoneura scutellata, гистология: а – схема срезов; б–и – поперечные срезы на разных уровнях; ag – брюшной ганглий, agl – придаточные железы, cer – мозг, gg2.3 – про-, мезо- и метаторакальный ганглий, hg – задняя кишка, lbp – нижнегубной щупик, mg – средняя кишка, mt – мальпигиевы сосуды, ос – глаз, ph – глотка, rc – ректум, te – семенники.
Скелет
Головная капсула хорошо склеротизирована, имеет эллипсоидную форму, слегка сплюснутую в латеральном направлении. Фронто-клипеальный шов хорошо развит. Фронтальные и субгенальные швы отсутствуют. Тенториум состоит из пары почти прямых рук, которые начинаются от передних тенториальных ямок, и к вершине руки утоньшаются, не доходя до головной капсулы. Задние и верхние руки, а также тенториальный мост отсутствуют.
Переднегрудь является самым маленьким грудным сегментом. Два небольших цервикальных склерита, располагающихся по бокам затылочного отверстия, соединяют переднегрудь с головой. В состав проторакса входит пронотум, который представлен узкой полосой. С дорсальной стороны он слабо различим, поскольку его накрывает передний край среднегруди. Плейриты переднегруди имеют хорошо развитый анаплейральный гребень. Он разделяет плейрит на проэпистернит и проэпимерит. Последний коротким швом разделяется на анэпимерит и дорсальный катэпимерит. Профурка имеет V-образную форму с уплощенными руками.
Среднегрудь – наиболее развитый сегмент груди. Выпуклый мезонотум состоит из мезопрескутума, мезоскутума, скутеллюма и мезопостнотума. Мезоплейральный гребень хорошо развит, в виде прямой линии он разделяет плейрит на мезоанэпистернит и мезоанэпимерит. Вдаваясь внутрь груди, гребень формирует мезопрейральные апофизы, которые служат местом прикрепления некоторых мышц. Мезофурка хорошо развита, имеет широко расставленные руки.
Небольшая заднегрудь представлена узким кольцом заднеспинки. Плейральный шов разделяет плейрит на две части – заднегрудной эпистерн и метаэпимер. Внутри груди под этим швом формируется гребень, дающий начало метапрейральным апофизам. Внутренние элементы скелета представлена метафуркой, имеющей длинное основание и короткие руки.
Брюшко состоит из 9 видимых тергитов и 7 видимых стернитов.
Толщина кутикулы от 1.22 до 3.06 мкм (М = = 1.74, n = 80). Объем скелета 1.55 нл, что составляет 4.2% от объема тела.
Пищеварительная и выделительная системы
Кишечник C. scutellata дифференцирован на переднюю, среднюю и заднюю кишки (рис. 2а). Слюнные железы и зоб отсутствуют. Передняя кишка устроена просто, она состоит из небольшой глотки и пищевода прямой формы. Глотка имеет U-образную форму в поперечном сечении и от ротового отверстия идет вертикально вверх по направлению ко лбу. Диаметр глотки 7 мкм. В лобной части головной капсулы глотка изгибается и продолжается прямым пищеводом. Затем пищевод переходит в кардиальное расширение. Стенки всех отделов передней кишки представлены однослойным эпителием, внутренняя поверхность которого выстлана кутикулой. Снаружи эпителий кишки имеет два слоя мышц – продольные и поперечные кольцевые. Средняя кишка начинается с небольшого расширения в переднегруди, далее продолжается в виде прямой трубки без морфологической дифференцировки (рис. 4д–4е). Диаметр средней кишки 25 мкм. На границе второго и третьего сегмента брюшка средняя кишка переходит в заднюю. Последняя дифференцируется на тонкий кишечник, имеющий вид удлиненной трубки, и прямую кишку грушевидной формы. Ее диаметр составляет 37 мкм. Снаружи заднюю кишку окружает кольцевая и продольная мускулатура.
Рис. 4.
Строение ЦНС (а, б), половой (в, г), пищеварительной и выделительной систем (д, е) Corynoneura scutellata, 3D‑реконструкция: ag – брюшной ганглий, agl – придаточные железы, cer – мозг, gg1.2.3 – про-, мезо- и метаторакальный ганглий, hg – задняя кишка, mg – средняя кишка, mt – мальпигиевы сосуды, ос – глаз, оes – пищевод, ph – глотка, rc – ректум, soeg – подглоточный ганглий, te – семенники.
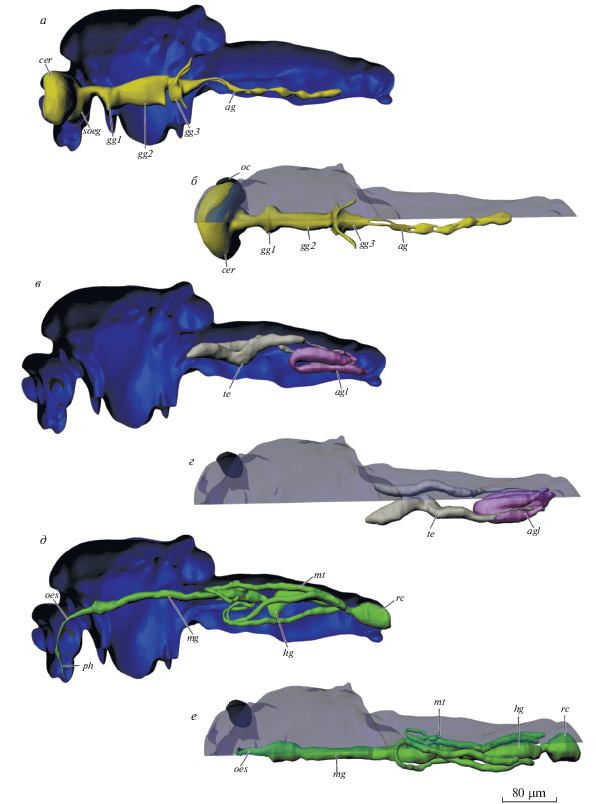
Выделительные органы C. scutellata представлены четырьмя мальпигиевыми сосудами (рис. 4д–4е). Они округлые в поперечном сечении, их диаметр около 12 мкм, а длина 320 мкм.
Объем пищеварительной системы 0.75 нл (2.0% от объема тела), а мальпигиевых сосудов – 0.32 нл (0.87% от объема тела).
Ткани внутренней среды
Кровеносная система C. scutellata состоит из сердца и длинной аорты (рис. 2а). Сердце, состоящее из восьми камер, идет от вершины 7-го сегмента брюшка до 1-го сегмента. Диаметр сердца около 19 мкм. Аорта в виде тонкой трубки продолжается до границы шеи и головы, ее диаметр 7 мкм. Дополнительные пульсирующие органы отсутствуют. Гемолимфа занимает значительные объемы между органами в груди и небольшие свободные объемы в брюшке и голове.
Значительная часть жирового тела располагается в брюшке между органами, однако небольшое количество клеток можно также обнаружить и в груди рядом с крупными мышечными волокнами. В голове жировое тело представлено единичными крупными клетками.
Объем тканей внутренней среды 19.4 нл (52.9% от объема тела).
Трахейная система
C. scutellata имеет хорошо развитую систему трахей и трахейных стволов. На одном поперечном срезе головы можно визуализировать около 40 трахей, а в груди приблизительно 400. Воздушные мешки отсутствуют.
Нервная система
Большая часть головной капсулы занята мозгом и подглоточным ганглием (рис. 4а–4б). Они целиком располагаются в голове. Передне- и среднегрудные ганглии почти слиты. Лишь заднегрудной ганглий явно обособлен. В состав брюшной нервной цепочки входят шесть ганглиев, соединенных тонкими коннективами. В проксимальной части брюшной нервной цепочки ганглии овальной формы, затем они постепенно увеличиваются в размерах и приобретают округлую форму.
Объем нервной системы 3.02 нл (8.2% от объема тела).
Мускулатура головы (рис. 5а–5б)
Рис. 5.
Строение мускулатуры Corynoneura scutellata, 3D-реконструкция: а – вид головы сбоку; б – вид фронтально, покровы полупрозрачные; в – вид груди сбоку; г – вид снаружи, покровы полупрозрачные; д – вид сверху; е – вид снизу; oes – пищевод, ph – глотка, tnt – тенториум. Обозначения мускулатуры см. в тексте.
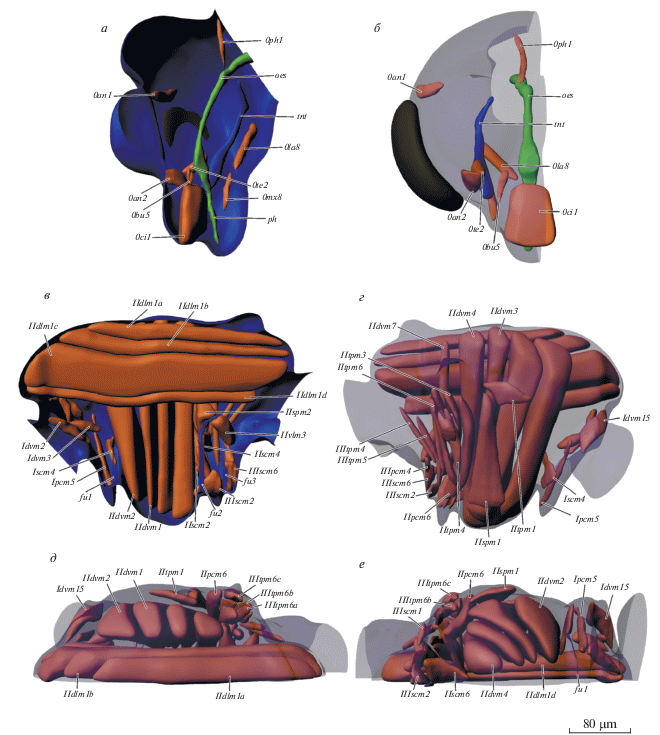
0an1 (M. tentorioscapalis anterior): O, передние руки тенториума; I, вентральная сторона скапуса. 0an2 (M. tentorioscapalis posterior): O, дорсальные руки тенториума; I, дорсальная сторона скапуса. 0la8 (M. submentopraementalis): O, задняя часть щеки, латеральнее затылочного отверстия; I, задний край прементума. 0ci1 (M. clypeopalatalis): O, дорсальная сторона клипеуса; I, крыша цибариума. 0bu5 (M. tentoriobuccalis anterior): O, передние руки тенториума; I, латеральная сторона гипофаринкса, непосредственно перед анатомическим ртом. 0ph1 (M. verticopharyngalis): O, срединная часть затылка; I, дорсальная стенка глотки. 0te2 (M.tentoriofrontalis anterior): O, дорсальная часть тенториума; I, срединная часть лба.
Мускулатура груди (рис. 5в–5е)
Переднегрудь. Idvm2 (M. cervico-occipitalis medialis): O, медиальная часть шейного склерита; I, дорсолатеральная часть затылка. Idvm3 (M. cervico-occipitalis posterior): O, латеральная часть шейного склерита; I, дорсолатеральная часть затылка. Idvm4 (M. pronoto-cervicalis lateralis): O, передняя часть пронотума; I, латеральная часть шейного склерита. Idvm15 (M. pronoto-trochantinocoxalis): O, передняя часть пронотума; I, передний край коксы. Ipcm5 (M. propleuro-coxalis inferior): O, вентральная часть плейрального гребня; I, передний край коксы. Iscm1 (M. profurca-coxalis anterior): O, дорсальная сторона профурки; I, передний край коксы Iscm4 (M. profurca-coxalis lateralis): O, профурка; I, латеральный край коксы.
Среднегрудь. IIdlm1 (M. prophragma-mesophragmalis): O, a, b, мезоскутум, c, d, мезопрескутум; I, a, b, мезопостнотум, c, d, постфрагма. IIdvm1 (M. mesonoto-sternalis): O, переднебоковая часть мезонотума; I, переднебоковая часть мезостернита. IIdvm4 (M. mesonoto-coxalis anterior): O, центральная часть мезоскутума; I, мезокатэпимер. IItpm1 (M. prophragma-mesanepisternalis): O, нотоплейральный гребень; I, базалярная апофиза. IItpm4 (M. mesonoto-pleuralis anterior): O, основание мезоплейрального гребня; I, первый аксиллярный склерит. IItpm6 (M. mesonoto-pleuralis posterior): O, а, мезоплейральная апофиза, b, основание мезоплейральной апофизы, c, мезанэпимер; I, четвертый аксиллярный склерит. IItpm7 (M. mesanepisterno-axillaris): O, анаплейральный гребень; I, третий аксиллярный склерит. IIspm2 (M. mesofurca-pleuralis): O, мезофурка; I, мезоплейральная апофиза. IIpcm5 (M. mesanepisterno-trochanteralis): O, дорсальная часть мезанэпистерна; I, передний край трохантера. IIscm1 (M. mesofurca-coxalis anterior): O, мезофурка; I, передний край коксы. IIscm2 (M. mesofurca-coxalis posterior): O, задний край мезофурки; I, задний край коксы. IIscm6 (M. mesofurca-trochanteralis): O, вентральная часть мезофурки; I, передний край трохантера. IIvlm3 (M. mesofurca-metafurcalis): O, мезофурка; I, метафурка. IIspm1 (M. mesopleura-sternalis): O, передняя часть мезанэпистернита; I, базалярный склерит основания крыла.
Заднегрудь. IIIscm1 (M. metafurca-coxalis anterior): O, базистернит; I, передний край коксы. IIIscm2 (M. metafurca-coxalis posterior): O, задняя часть метафурки; I, задний край коксы. IIIscm6 (M. metafurca-trochanteralis): O, вентральная часть метафурки; I, задний край трохантера. IIIpcm4 (M. metanepisterno-coxalis posterior): O, латеральная часть метаплейрального гребня; I, задний край коксы. IIItpm4 (M. mesonoto-pleuralis anterior): O, метаплейральная апофиза; I, передняя часть метанотума. IIItpm5 (M. metanoto-pleuralis medialis): O, метаплейральная апофиза; I, латеральная часть метанотума.
Мускулатура брюшка. Дорсальные продольные мышцы (Mm. dorsales), O, передняя фрагма; I, задняя фрагма. Вентральные продольные мышцы (Mm. ventrales), O, передний край сегмента; I, задний край сегмента. Дорсовентральные мышцы (Mm. dorso-ventrales), O, боковая часть тергита; I, боковая часть стернита.
Объем мускулатуры 10.7 нл (29.1% от объема тела).
Половая система
Половая система самца C. scutellata включает парные семенники и придаточные железы (рис. 4в–4г). Удлиненные семенники трубчатой формы располагаются в брюшке и тонкими длинными семенными протоками открываются в семяизвергательный канал, расположенный в седьмом стерните. Дистальный отдел придаточной железы, занимающий дорсальное положение, раздвоен, проксимально придаточная железа образует непарный вентральный проток, в который открываются тонкие семенные протоки.
Объем половой системы 0.94 нл (2.5% от объема тела).
ОБСУЖДЕНИЕ
Как правило, у микронасекомых, в том числе у C. scutellata, сохраняется довольно сложное строение, в отличие от многих миниатюрных беспозвоночных (Swedmark, 1964; Rundell, Leander, 2010).
Пищеварительная и выделительная системы
Тенденция к упрощению мало отражается на строении пищеварительной системы – все отделы имеют явные границы и четко дифференцированы. Однако стоит отметить, что в пищеварительной системе C. scutellata отсутствуют слюнные железы и зоб. Отсутствие зоба характерно и для других представителей двукрылых – семейства Oestridae (Шванвич, 1949). Вероятно, редукция желез, участвующих в обработке пищи, и зоба, как органа для ее временного хранения, связана именно с афагией имаго хирономид.
Со средним и задним кишечником крупных представителей родственных двукрылых ассоциирована мускулатура, которая поддерживает его, имея место прикрепления стенку тела и непосредственно сам пищеварительный канал (Day, Bennetts, 1953; Vo et al., 2010). У C. scutellata отсутствует мускулатура средней кишки, что характерно для многих других микронасекомых (Polilov, 2016).
Количество мальпигиевых сосудов у C. scutellata, равное четырем, является типичным и для крупных представителей родственных групп (Chen et al., 2013; Kongoro, Odhiambo, 1988; Pal, 2013; Pacheco, 2014).
В строении пищеварительной системы микронасекомых других отрядов также не происходит значительных перестроек, и она сохраняет типичный уровень организации. Изменения могут быть в выделительной системе микронасекомых. Так, у паразитических наездников мимарид и трихограмматид мальпигиевых сосудов меньше, чем у крупных представителей родственных перепончатокрылых (Polilov, 2016).
Дыхательная система
В голове и во всех сегментах груди у C. scutellata присутствует большое количество ветвящихся трахей, также в тораксе обнаружены более крупные продольные и поперечные трахейные стволы. Воздушные мешки полностью отсутствуют. В головной капсуле Tipula paludosa имеется два небольших воздушных мешка (Schneeberg, 2011). В голове D. melanogaster содержится большое количество воздушных мешков, от которых отходят многочисленные трахеи (Whitten, 1957).
Дыхательная система микронасекомых из других отрядов подвержена более сильным изменениям, а у некоторых она вообще отсутствует (Polilov, 2016).
Кровеносная система C. scutellata сохраняет уровень организации, который наблюдается и у более крупных двукрылых (Wasserthal, 1999). У миниатюрных перепончатокрылых и жесткокрылых кровеносная система, напротив, претерпевает значительные изменения — сердце и аорта либо рудиментарны, либо вовсе отсутствуют (Polilov, 2016).
Центральная нервная система является одной из тех систем органов, которая претерпевает значительные изменения при миниатюризации (Polilov, 2016). ЦНС C. scutellata демонстрирует умеренную степень олигомеризации. Мозг и подглоточный ганглий располагаются в головной капсуле, заднегрудной ганглий обособлен, лишь терминальные ганглии брюшной нервной цепочки сливаются в единый синганглий.
В строении мозга и подглоточного ганглия Mayetiola destructor также не происходит значительных изменений (Schneeberg et al., 2013).
Среди микронасекомых в наибольшей мере олигомеризованы ганглии у микрожесткокрылых Corylophydae, у Megaphragma происходит слияние средне- и заднегрудного ганглия, а брюшная нервная цепочка представлена единым синганглием (Полилов, 2011; Макарова, Полилов, 2013).
Мускулатура
В головной капсуле C. scutellata находится 8 мышц. В отличие от крупных представителей длинноусых двукрылых, у C. scutellata наблюдается редукция глоточной мускулатуры. Так, работу глотки Tipulomorpha, Cecidomyiidae, Deuterophlebiidae, Axymyiidae обеспечивает три пары крупных мыщц – 0bu3, 0ph1 и 0ph2 (Schneeberg, Beutel, 2011; Schneeberg et al., 2011; Schneeberg et al., 2013; Schneeberg et al., 2013), в то время как с глоткой C. scutellata связана лишь единственная мышца 0ph1. Видимо, это связано с афагией данного семейства (Rohdendorf, 1974). В головной капсуле Mayetiola destructor находится 23 мышцы (Schneeberg et al., 2013), что немногим меньше, чем у крупных двукрылых : Tipula paludosa и Trichocera saltator имеют 28 мышц в голове, Limonia sp. – 25 мышц (Schneeberg et al., 2011). Однако у Deuterophlebia coloradensis в головной капсуле найдено всего 9 мышц (Schneeberg et al., 2011), а у Axymyia furcata – 12 (Schneeberg et al., 2013). У микронасекомых из других отрядов количество мышц также различно. В голове Liposcelis bostrychophila (Psocoptera, Liposcelididae) находится 29 мышц, у Heliothrips haemorrhoidalis (Thysanoptera, Thripidae) – 20 мышц, Micado sp. (Coleoptera, Ptiliidae) – 19 мышц, Megaphragma mymaripenne (Hymenoptera, Trichogrammatidae) – 18 мышц, Trichogramma evanescens (Hymenoptera, Trichogrammatidae) – 17 мышц (Polilov, 2016).
В переднегруди C. scutellata расположено 7 пар мышц, в то время как у крупных представителей родственных групп в этом сегменте груди может быть от 7 мышц, как у Anisopus sp., и до 25 пар у Tabanus sp. (Bonhag, 1951; Smart, 1959). Стоит отметить полное отсутствие дорсальных продольных мышц у C. scutellata, тогда как у крупных двукрылых всегда присутствует мускулатура этого типа: одна пара Idlm1 у Crataerina pallida, Idlm1 и Idlm2 у D. melanogaster, а у Tabanus sp. (Bonhag, 1951; Fabian et al., 2016; Liu et al., 2018) в протораксе сохраняется полный набор из 6 пар мышц Idlm1 – Idlm6. Крупные дорсовентральные мышцы Idvm2, Idvm3, Idvm4 и Idvm15 присутствуют у C. scutellata и крупных представителей родственных двукрылых. Вентральные продольные мышцы в полном наборе обнаружены у Crataerina pallida (Liu et al., 2018), так же три пары этих мышц есть у Tabanus sp. и Orthelia sp. (Maki, 1938; Bonhag, 1951), а в переднегруди C. scutellata полностью отсутствуют данный тип мускулатуры. У C. scutellata выявлено две пары стернококсальных мышц проторакса – Iscm1 и Iscm4, отсутствуют Iscm2, Iscm3, Iscm6, которые обнаружены у крупных родственных двукрылых. Самая крупная мышца IIdlm1, состоящая из 6 четко разделенных волокон, занимают значительную часть груди у C. scutellata и крупных представителей родственных групп. Также общим является и наличие других больших мышц – IIdvm1, IIdvm2 и IIdvm4. По сравнению с переднегрудью, набор мускулатуры среднегруди практически не отличается от такового у крупных представителей родственных двукрылых: сохраняются крупные тергоплейральные, стернококсальные, стерноплейральные, вентральные продольные группы мышц. Набор мускулатуры заднегруди C. scutellata, включающий 6 пар мышц, также не претерпевает изменений по сравнению с двукрылыми из родственных групп: присутствуют основные движители коксы: IIIpcm4, IIIscm1, IIIscm4 и IIIscm6, и пара IIItpm мышц (Maki, 1938; Bonhag, 1951; Fabian, 2016; Liu et al., 2018). Всего в груди C. scutellata располагается 26 мышц, а у D. melanogaster – 45 мышц, Crataerina pallida – 33 мышц (Fabian, 2016; Liu et al., 2018). У микронасекомых из других отрядов мускулатура груди значительно богаче, чем у двукрылых. В груди Liposcelis bostrychophila находится 56, у Heliothrips haemorrhoidalis – 60, Micado sp. – 48, Megaphragma mymaripenne – 48, а Trichogramma evanescens – 54 мышцы (Polilov, 2016).
Число мышц в голове C. scutellata в 3.5 раза меньше, чем у некоторых крупных представителей двукрылых, и сравнимо с числом мышц у двукрылых-афагов (Schneeberg, Beutel, 2011). Набор мускулатуры в голове двукрылых на 2.1–3.6 раза меньше, чем у микронасекомых из других отрядов, с различными типами ротовых аппаратов. Число мышц во всей груди крупных представителей двукрылых на 21–42% больше, чем у C. scutellata. У ранее изученных микронасекомых грудных мышц на 46–57% больше, чем у C. scutellata. Таким образом, можно утверждать, что набор мускулатуры C. scutellata заметно обеднен, по сравнению с крупными представителями родственных групп. Видимо, причина уменьшения количества мышц в головной капсуле C. scutellata в первую очередь определяется афагией, а сокращение числа мышц в грудном отделе может быть связано с миниатюризацией.
В строении половой системы самцов C. scutellata не происходит значительных изменений. Она имеет типичное строение, представлена симметричными семенниками и придаточными железами (Abul-Nasr, 1950). Значительные перестройки в половой системе миниатюрных насекомых обнаружены лишь у ранее изученных жуков-перокрылок Ptiliidae, у которых половые железы самцов и самок непарные (Полилов, 2005). У перепончатокрылых выявлено уменьшение число овариол. В каждом яичнике самки Megaphragma mymaripenne находится всего лишь четыре овариолы, а в единственном яичнике микрожесткокрылых из трибы Nanosellini всего две (Полилов, 2008).
На основании трехмерных компьютерных реконструкций были проанализированы относительные объемы органов у C. scutellata и проведен сравнительный анализ с данными по другим микронасекомым (Polilov, Makarova, 2017). Обнаружено, что C. scutellata обладает самым маленьким относительным объемом скелета среди изученных микронасекомых того же размерного класса. Тем не менее мускулатура занимает значительный объем тела, уступая по этому показателю лишь жесткокрылым. Самые крупные мышцы в груди у C. scutellata – дорсальные продольные и дорсо-вентральные – мышцы непрямого летательного действия, обеспечивают движение крыльев путем деформации грудных склеритов. Видимо, значительное увеличение объема мускулатуры C. scutellata связано с постоянным пребыванием в полете во время роения. Просто устроенная пищеварительная система C. scutellata занимает очень небольшой относительный объем, значительно меньший, чем у других микронасекомых. Отсутствие питания на стадии имаго, вероятно, также влияет и на повышение объема тканей внутренней среды, которые используются для жизнедеятельности. Относительный объем кровеносной системы, жирового тела, мальпигиевых сосудов и центральной нервной системы C. scutellata практически не отличается от такового у микрожесткокрылых и микроперепончатокрылых. Относительный объем половой системы C. scutellata в четыре раза меньше, чем у перепончатокрылых, и в шесть раз меньше, чем у жесткокрылых того же размерного класса, что не характерно для миниатюрных насекомых.
Таким образом, у C. scutellata не наблюдается значительного упрощения строения, что характерно и для большинства микронасекомых. Малые размеры этого вида сопряжены с рядом особенностей, известных и для других микронасекомых: редукцией мускулатуры кишечника, упрощением кровеносной системы, большим относительным объемом ЦНС. Кроме того, у C. scutellata в значительной степени сокращены набор мускулатуры головы и первого грудного сегмента, а также относительный объем половой системы.
Список литературы
Большаков В.В., 2015. К методике содержания личинок Chironomus dilutus (Diptera, Chironomidae) на бактоагаре // Зоологический журнал. Т. 94. Вып. 9. С. 1108–1113.
Жиров С.В., Мыльников С.В., 2016. О подходах к изучению микроэволюционных явлений в природных популяциях хирономид. Неравновесность популяций как стабильное состояние // Экологическая генетика. Т. 14. Вып. 3. С. 35–46.
Зорина O.B., 2004. Хирономиды рода Paratendipes Kieffer (Diptera, Chironomidae, Chironominae) российского Дальнего Востока // Евразиатский энтомологический журнал. Т. 3. Вып. 4. С. 318–324.
Макарова А.А., Полилов А.А., 2013. Особенности строения и ультраструктуры головного мозга насекомых, связанные с миниатюризацией. II. Мельчайшие перепончатокрылые (Hymenoptera, Mymaridae, Trichogrammatidae) // Зоологический журнал. Т. 92. Вып. 6. С. 695–706.
Назарова Л.Б., Голубев А.И., Андреев А.А., 2011. Методические подходы к использованию биологических индикаторов в палеоэкологии. Казань: Казанский университет. С. 280.
Назарова Л.Б., Субетто Д.А., Сырых Л.С., Греков И.М., Леонтьев П.А., 2018.
Реконструкции палеоэкологических и палеоклиматических условий позднего плейстоцена и голоцена по результатам хирономидного анализа донных отложений оз. Медведевское (Карельский перешеек) // Доклады Академии наук. Федеральное государственное бюджетное учреждение “Российская академия наук”. Т. 480. Вып. 5. С. 568–572.
Полилов А.А., 2005. Анатомия жуков-перистокрылок Acrotrichis montandoni и Ptilium myrmecophilum (Coleoptera, Ptiliidae) // Зоологический журнал. Т. 84. № 2. С. 181–189.
Полилов А.А., 2008. Анатомия мельчайших жесткокрылых – жуков-перистокрылок трибы Nanosellini (Coleoptera, Ptiliidae) и пределы миниатюризации насекомых // Зоологический журнал. Т. 87. Вып. 2. С. 181–188.
Полилов А.А., 2011. Мускулатура грудных сегментов Sericoderus lateralis (Coleoptera, Corylophidae): эффект миниатюризации и дегенерация крыловых мышц, связанная с развитием половой системы // Зоологический журнал. Т. 90. Вып. 6. С. 698–705.
Полуконова Н.В., 2005. Сравнительный морфологический анализ комаров-звонцов Chironomus curabilis и Сh. nuditarsis (Chironomidae, Diptera). 2. Самцы и самки комаров // Зоологический журнал. Т. 84. №. 3. С. 371–376.
Шванвич Б.Н., 1949. Курс общей энтомологии. Введение в изучение строения и функций тела насекомых. М.: Советская наука. С. 899.
Abul-Nasr S.E., 1950. Structure and development of the reproductive system of some species of Nematocera (order Diptera: suborder Nematocera) // Philosophical Transactions of the Royal Society B: Biological Sciences. V. 234. P. 339–396.
Alkassis W., Schoeller J., 1984. Ultrastructure of the Malpighian tubules of blow fly larva, Calliphora erythtocephala Meigen (Diptera: Calliphoridae) // International Journal of Insect Morphology and Embryology. V. 13. P. 215–223.
Armitage P.D., Pinder L.C., Cranston P.S., 2012. The Chironomidae: biology and ecology of non-biting midges. Berlin: Springer Science & Business Media. P. 572.
Bonhag P.F., 1951. The skeleto-muscular mechanism of the head and abdomen of the adult horsefly (Diptera: Tabanidae) // Transactions of the American Entomological Society. V. 77. P. 131–202.
Brown B.V., 2012. Small Size No Protection for Acrobat Ants: World’s Smallest Fly Is a Parasitic Phorid (Diptera: Phoridae) // Annals of the Entomological Society of America. V. 105. P. 550–554.
Brown B.V., 2018. A second contender for “world’s smallest fly” (Diptera: Phoridae) // Biodiversity Data Journal. V. 6. P. 7.
Cannings R.A., Scudder G.G.E., 1978. The littoral Chironomidae (Diptera) of saline lakes in central British Columbia // Canadian Journal of Zoology. V. 56. P. 1144–1155.
Chen Y.O., Zhang D., Wang Q.K., 2013. Alimentary canal of the lesser house fly, Fannia canicularis (Linnaeus) (Diptera: Fanniidae) // Entomologica Fennica. V. 24. P. 35–42.
Day M.F., Bennetts M.J., 1953. Healing of gut wound in the mosquito Aedes aegypti (L.) and the leafhopper Orosius argenatus (Ev.) // Australian Journal of Biological Sciences. V. 6. P. 580–585.
Degrugillier M.E., Leopold R.A., 1973. Internal genitalia of the female house fly, Musca domestica L. (Diptera: Muscidae): Analysis of copulation and oviposition // International Journal of Insect Morphology and Embryology. V. 2. P. 313–325.
Fabian B., Schneeberg K., Beutel R.G., 2016. Comparative thoracic anatomy of the wild type and wingless (wg(1)cn(1)) mutant of Drosophila melanogaster (Diptera) // Arthropod Structure & Development. V. 45. P. 1–26.
Friedrich F., Beutel R.G., 2008. The thorax of Zorotypus (Hexapoda, Zoraptera) and a new nomenclature for the musculature of Neoptera // Arthropod Structure & Development. V. 37. P. 29–54.
Gibson N.H.E., 1945. On the mating swarms of certain Chironomidae (Diptera) // Transactions of the Royal Entomological Society of London. V. 95. P. 263–294.
Hansen D.C., Cook E.F., 1976. The systematics and morphology of the Nearctic species of Diamesa Meigen, 1835 (Diptera: Chironomidae) // Memoirs of the American Entomological Society. V. 30. P. 1–203.
Hashimoto H., 1976. Non-biting midges of marine habitats (Diptera: Chironomidae) // Marine insects. V. 1. P. 377–414.
Hirvenoja M., 1973. Revision der Gattung Cricotopus van der Wulp und ihrer Verwandten (Diptera, Chironomidae) // Annales Zoologici Fennici. Bd 10. P. 1–363.
Hosken D.J., Meyer E.P., Ward P.I., 1999. Internal female reproductive anatomy and genital interactions during copula in the yellow dung fly, Scathophaga stercoraria (Diptera: Scathophagidae) // Canadian Journal of Zoology. V. 77. P. 1975–1983.
Jarial S.M., 1988. Fine structure of the Malpighian tubules of Chironomus larva in relation to glycogen storage and fate of hemoglobin // Tissue and Cell. V. 20. P. 355–380.
Jones J.C., 1954. The heart and associated tissues of Anopheles quadrimaculatus Say (Diptera: Culicidae) // Journal of Morphology. V. 94. P. 71–123.
Kongoro J.A., Odhiambo T.R., 1988. Functional Ultrastructure of Malpighian Tubules of Tsetse, Glossina morsitans morsitans Westwood (Diptera: Glossinidae) // International Journal of Tropical Insect Science. V. 9. P. 563–571.
Liu S.P., Friedrich F., Petersen D.S., Busse S., Gorb S.N., Beutel R.G., 2018. The thoracic anatomy of the swift lousefly Crataerina pallida (Diptera)–functional implications and character evolution in Hippoboscoidea // Zoological Journal of the Linnean Society. V. 20. P. 1–21.
Makarchenko E.A., Makarchenko M.A., Semenchenko A.A., 2019. Towards the taxonomy of Corynoneura Winnertz (Diptera: Chironomidae: Orthocladiinae) from the Russian Far East and Eastern Siberia // Zootaxa. V. 4612. P. 221–236.
Maki T., 1938. Studies of the thoracic musculature of insects // Memoirs of the Faculty of Science and Agriculture Taihoku Imperial University. V. 24. P. 1–343.
Mattei A.L., Riccio M.L., Avila F.W., Wolfner M.F., 2015. Integrated 3D view of postmating responses by the Drosophila melanogaster female reproductive tract, obtained by micro-computed tomography scanning // PNAS. V.112. P. 1–6.
Minelli A., Fusco G., 2019. No limits: Breaking constrains in insect miniaturization // Arthropod Structure & Development. V. 48. P. 4–11
Ovtshinnikova O.G., Galinskaya T.V., Lukashevich E.D., 2018. Skeleton and musculature of the male abdomen in Tanyderidae (Diptera, Nematocera) of the Southern Hemisphere // ZooKeys. V. 809. P. 55–77.
Pacheco C.A., Alevi K.C., Ravazi A., Oliveira M.T., 2014. Review: Malpighian Tubule, an Essential Organ for Insects // Entomology, Ornithology & Herpetology. V. 3. P. 1–3.
Pal R., Kumar K., 2013. Malpighian tubules of adult flesh fly, Sarcophaga ruficornis Fab. (Diptera: Sarcophagidae): An ultrastructural study // Tissue and Cell. V. 45. P. 312–317.
Pinder L.C.V., 1986. Biology of freshwater Chironomidae // Annual review of entomology. V. 31. P. 1–23.
Polilov A.A., 2016. At the Size Limit – Effects of Miniaturization in Insects // Springer International Publishing. P. 325.
Polilov A.A., 2017. Anatomy of adult Megaphragma (Hymenoptera: Trichogrammatidae), one of the smallest insects, and new insight into insect miniaturization // PLoS ONE. V. 12. P. 20.
Polilov A.A., Makarova A.A., 2017. The scaling and allometry of organ size associated with miniaturization in insects: A case study for Coleoptera and Hymenoptera // Scientific Reports. V. 7. P. 7.
Rohdendorf B.B, 1974. The historical development of Diptera // University of Alberta Press. P. 360.
Rosenberg D.M., 1992. Freshwater biomonitoring and Chironomidae // Netherland Journal of Aquatic Ecology. V. 26. P. 101–122.
Rundel R.G., Leander B.S., 2010. Masters of miniaturization: Convergent evolution among interstitial eukaryotes // BioEssays. V. 32. P. 430–437.
Saether O.A. 1980. Glossary of chironomid morphology terminology (Chironomidae, Diptera) // Entomologica scandinavica. Suppl. 14. P.1–51.
Schaller F.I., 1970. Uberordnung und I. Ornung Collembola (Springschwanze) // Handb. Zool. Berlin. P. 72.
Schneeberg K., Beutel R.G., 2011. The adult head structures of Tipulomorpha (Diptera, Insecta) and their phylogenetic implications // Acta Zoologica. V. 92. P. 316–343.
Schneeberg K., Courtney G.W., Beutel R.G., 2011. Adult head structures of Deuterophlebiidae (Insecta), a highly derived «ancestral» dipteran lineage // Arthropod Structure & Development. V. 40. P. 93–104.
Schneeberg K., Krause K., Beutel R.G., 2013. The adult head of Axymyia furcata (Insecta: Diptera: Axymyiidae) // Arthropod Systematics & Phylogeny. V. 71. P. 91–102.
Schneeberg K., Polilov A., Harris O.M., Beutel R.G., 2013. The Adult Head Morphology of the Hessian Fly Mayetiola destructor (Diptera, Cecidomyiidae) // Journal of Morphology. V. 274. P. 1299–1311.
Smart J., 1959. Notes on the mesothoracic musculature of Diptera // Smithson. misc. Collns. V. 137. P. 331–364.
Swedmark B., 1964. The interstitial fauna of marine sand // Biological Reviews. V. 39. P. 1–42.
Vo M., Linser P.J., Bowers D.F., 2010. Organ-Associated Muscles in Aedes albopictus (Diptera: Culicidae) Respond Differentially to Sindbis Virus // Journal of medical entomology. V. 47. P. 215–225.
Wasserthal L.T., 1999. Functional morphology of the heart and of a new cephalic pulsatile organ in the blowfly Calliphora vicina (Diptera: Calliphoridae) and their roles in hemolymph transport and tracheal ventilation // International Journal of Insect Morphology. V. 28. P. 111–129.
Whitten J.M., 1957. The Post-embryonic Development of the Tracheal System in Drosophila melanogaster // Journal of Cell Science. V. 98. P. 123–150.
Winterton S.L., Merritt D.J., O’Toole A., Yeates D.K., Irwin M.E., 1999. Morphology and histology of the spermathecal sac, a novel structure in the female reproductive system of Therevidae (Diptera: Asiloidea) // International Journal of Insect Morphology and Embryology. V. 28. P. 273–27.
Wipfler B., Machida R., Müller B., Beutel R.G., 2011. On the head morphology of Grylloblattodea (Insecta) and the systematic position of the order, with a new nomenclature for the head muscles of Dicondylia // Systematic Entomology. V. 36. P. 241–266.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал