Зоологический журнал, 2020, T. 99, № 2, стр. 165-177
Мальформации структур ротового аппарата личинок Chironomus riparius (Diptera, Chironomidae) при действии металлсодержащих наночастиц
И. И. Томилина a, *, Л. П. Гребенюк a
a Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Ярославская обл., Некоузский район, поселок Борок, Россия
* E-mail: i_tomilina@mail.ru
Поступила в редакцию 06.12.2008
После доработки 26.04.2019
Принята к публикации 15.05.2019
Аннотация
В условиях хронического эксперимента отмечено тератогенное действие металлсодержащих наночастиц на возникновение мальформаций ротового аппарата личинок хирономид Chironomus riparius Meigen. Антенны составляли основную часть деформированных структур. Значительное увеличение доли деформированных антенн отмечено при действии наночастиц диоксида титана: в среднем 65.8–66.5%. При действии наночастиц серебра, золота и оксида цинка – 46.8, 46.2 и 53.3 соответственно. Наибольшим тератогенным действием обладали наночастицы серебра и диоксида титана в модификации анатаз: доля личинок хирономид с деформациями различных структур ротового аппарата личинок без учета концентраций составила 44.6 и 45.3% соответственно.
Комары-звонцы (Diptera, Chironomidae) – массовые и повсеместно распространенные в природе двукрылые насекомые. Они являются не только кормовым объектом рыб, но и играют важную роль в самоочищении водоемов. Хирономид используют и в качестве биоиндикаторных организмов. Неоднократно отмечалось, что патоморфологические изменения структур ротового аппарата личинок хирономид возникают в условиях загрязнения среды обитания тяжелыми металлами и токсическими органическими соединениями (Bhattacharyay et al., 2005; Bird, 1994; Dickman et al., 1992; Janssens de Bisthoven et al., 1998). Водоем считается чистым, если доля личинок хирономид с аномалиями составляет от 3–5 (Warwick, 1985) до 8–10% (Wiederholm, 1984). В популяции Chironomus riparius, содержащейся длительное время в лабораторной культуре, доля деформированных личинок выше, чем в природных популяциях, и может достигать 10–14% (Гребенюк, Томилина, 2006).
Многие исследования по индукции мальформаций различными загрязняющими веществами проведены с использованием лабораторных культур хирономид. Возникновение деформаций было связано с влиянием тяжелых металлов, таких как кадмий, медь, свинец, цинк и ртуть (Janssens de Bisthoven et al., 1998а; Janssens de Bisthoven et al., 2001; Kosalwat, Knight, 1987; Martinez et al., 2004; Van Urk et al., 1989; Vermeulen et al., 2000;Williams et al., 1986), а также ксилола и толуола (Janssens de Bisthoven et al., 1997), пестицидов (Madden et al., 1992). Мета-анализ 41 лабораторного исследования по влиянию химических веществ на индукцию мальформаций личинок рода Chironomus (Savic-Zdravkovic et al., 2018), с одной стороны, не выявил значительных по частоте деформаций структур ротового аппарата, как например, при воздействии нонилфенола и свинца (Arambourou et al., 2012). С другой стороны, показана зависимость частоты возникновения деформаций от концентрации тяжелых металлов и наночастиц (Savic-Zdravkovic et al., 2018).
В последнее время из-за роста производства инженерных наноматериалов и их широкого применения в различных сферах возрастает опасность попадания в среду обитания человека и животных нового абиотического фактора – техногенных наночастиц. К приоритетным наночастицам (НЧ) относятся фуллерены, одно- и многослойные нанотрубки, НЧ серебра, золота, железа, оксида титана, оксида алюминия, оксида церия, диоксида кремния, оксида цинка, дендримеры и наноглины (Об утверждении концепции …, 2007), к наиболее изученным относятся фуллерены, оксиды цинка и титана. Объем производства НЧ Ag, ТiO2, SiO2 и ZnO в настоящее время составляет cотни тонн в год. Поведение НЧ в экосистемах изучено слабо и практически ничего не известно об их влиянии на организмы в живой природе. Особенно это актуально для водных экосистем, которые в значительной степени аккумулируют разнообразные вещества, входящие в состав промышленных и бытовых стоков.
Уникальные полезные свойства НЧ имеют и обратную сторону – не менее феноменальные и пока что трудно прогнозируемые риски (Фролов, Cтратулат, 2010). Именно на их выявление, анализ и нормирование должны быть направлены усилия биологов и экологов. Проблема токсичности наноматериалов все больше привлекает внимание исследователей. Такие работы в основном выполнены на культурах клеток и отдельных видах животных и растений (Krysanov et al., 2010; Моргалев и др., 2010). Для абсолютного большинства наноматериалов не известны механизмы их поступления в живой организм, биосовместимости, биотрансформации, транслокации в органах и тканях, элиминации и, что особенно важно, их токсичности (Blaise et al., 2008; Griffitt et al., 2008; Khlebtsov, Dykman, 2011; Shi et al., 2013). Информации по токсичности НЧ в отношении гидробионтов различной систематической принадлежности на сегодняшний день недостаточно. Открытым остается и вопрос влияния различных НЧ на возникновение терратогенного эффекта.
Цель работы – изучить возникновение деформаций структур ротового аппарата личинок Chironomus riparius при воздействии металлических (Au, Ag) и металлооксидных (ZnO, TiО2) наночастиц в условиях эксперимента.
МАТЕРИАЛ И МЕТОДИКА
Исследования проводили на личинках комара-звонца Chironomus riparius Meigen 1804, культивируемых в лаборатории на чистом грунте и отстоянной артезианской воде. Личинок хирономид первой стадии на следующий день после вылупления высаживали в количестве 30 шт. в чашки Петри, содержащие 30 мл экспериментальных растворов (Ingersoll, Nelson, 1990). Стадии развития личинок определяли по ширине и длине гулярно-лабиального склерита согласно методике (Шилова, 1966). Животных в ходе опытов кормили суспензией кормовых дрожжей из расчета 0.25 мг/личинку, корм добавляли по мере выедания.
Для изучения индукции деформированных структур ротового аппарата личинок хирономид при действии НЧ использовали коллоидные растворы серебра и золота, суспензии НЧ оксида цинка, диоксида титана в модификации анатаз и рутил. Для снижения слипания частиц растворы перемешивали в течение 2–3 мин на ультразвуковом диспергаторе УЗДН-2Тв режиме 0.5 А, 44 кГц непосредственно перед опытом (Томилина и др., 2011). Образцы НЧ были получены из “банка стандартных образцов наноматериалов”, созданного в рамках федеральной целевой программы “Создание проектов нормативно-правового и методического обеспечения комплексной системы безопасности в процессе исследований, освоения, производства, обращения и утилизации наноматериалов в Российской Федерации”. Металлооксидные микрочастицы произведены компанией “Strem Chemicals Inc.” (США). Форму и размеры металлсодержащих нано- и микрочастиц определяли на электронном трансмиссионном микроскопе JEM с использованием сеточек, покрытых слоем формвара (Томилина и др., 2011).
Для приготовления растворов использовали отстоянную артезианскую воду (рН 7.6 ± 0.4, перманганатная окисляемость <3.0 мг О/дм3, жесткость 4.9 мг-экв/дм3, железо общее 0.7 ± 0.23, нитраты 1.1 ± 0.31, хлориды 7.9 ± 0.80, сульфаты 17.9 ± 1.79 мг/л – по данным аналитического центра ИБВВ РАН). По результатам предварительных экспериментов были выбраны концентрации, не оказывающие острого летального действия, т.е. смертность личинок не должна превышать 50% за 96 ч экспозиции. Величина 20% была принята за нормальную долю естественного отхода (Константинов, 1958). В нашем исследовании максимальная гибель личинок (50%) была зафиксирована в суспензии НЧ диоксида титана в концентрации 0.002 мг/л в модификации анатаз за 20 суток эксперимента.
Характеристика НЧ и диапазон исследованных концентраций приведены в табл. 1.
Таблица 1.
Характеристика исследованных наночастиц
| Наночастицы | Форма | Размеры, нм | Диапазон исследованных концентраций, мг/л |
|---|---|---|---|
| Ag | Сферическая, эллипсоидальная или неправильная | 5–85 | 0.005–0.0000002 |
| Au | Сферическая | 5–6 | 0.0001–1.0 |
| TiO2 (анатаз) | Близкая к сферической | 25–50 | 0.02–200 |
| TiO2 (рутил) | Палочки или стержни | 10–350 | 0.02–400 |
| ZnO | Шестиугольная, булавовидная, веретенообразная и цилиндрическая | 15–350 | 0.02–200 |
Продолжительность эксперимента ~20 сут, до достижения личинками IV возраста.
Все эксперименты проводили в двух повторностях. Поддерживали оптимальные условия среды: температуру воды 22 ± 2°С, рН 7.0–8.0, растворенный кислород на уровне насыщения, фотопериод: свет : темнота 16 : 8. Контрольные группы тест-животных содержали в отстоянной артезианской воде.
Исследовали три группы структур ротового аппарата (терминология по: Saether, 1980): сильнохитинизированные структуры (ментум, мандибулы), комплекс верхней губы (премандибулы, эпифарингс, верхнегубной гребень) и антенны. Деформированными считали те части ротового аппарата, в которых обнаруживали любую морфологическую аномалию; механические повреждения в результате абразии и слома деформациями не считали (Saether, 1980). Изучение проводили на постоянных препаратах головных капсул, изготовленных по общепринятой методике с использованием жидкости Фора–Берлезе (Шилова, 1976). Препараты просматривали под микроскопом МБИ-3 (×200, ×280, ×400). Аномалии в строении структур зарисовывали с помощью рисовального аппарата РА-4 и фотографировали на цифровом микроскопе KEYENCE VHX-1000, объектив VH-Z250R. Рассчитывали относительную численность личинок с деформациями, долю личинок с деформациями отдельных структур ротового аппарата, соотношение этих структур, индексы тяжести антеннальной деформации ISAD (Index of Severity of Antennal Deformation) (Warwick, 1985) и индексы деформаций сильнохитинизированных структур ISMMD (Index of Severity of Mandibular and Mentum Deformations) (Гребенюк, Томилина, 2014). Значения этих индексов у контрольных личинок находятся в пределах 0.25 ≤ ≤ ISAD ≤ 0.55 и 0.03 ≤ ISMMD ≤ 0.20.
Данные представляли в виде средних значений и их ошибок (x ± SE). Достоверность различий оценивали методом дисперсионного анализа (ANOVA, LSD-тест) при уровне значимости р = = 0.05 (Sokal, 1995), с использованием программного обеспечения Microsoft Office Excell и STATGRAPHICS Plus 2.1.
РЕЗУЛЬТАТЫ
Деформации мандибул при экспонировании личинок хирономид в растворах металлсодержащих НЧ разнообразны и в ряде случаев имели высокую степень тяжести. Наиболее часто встречаемые отклонения в строении – это прогиб дорcальной части мандибулы: от сравнительно небольшого (рис. 2Д), до сильно выраженного, с дополнительными уродливыми образованиями (рис. 1В, 2В). Выявлены случаи мультипликации нижних пигментированных зубцов мандибул, имеющих аномальное строение (рис. 1Г; 2Б). Иногда число пигментированных зубцов нормального строения сокращено до трех. Либо при наличии четырех зубцов они деформированы и мандибула приобретает уродливую форму (рис. 2А). Имели место случаи грубого скульптурирования дорсальной части мандибул (рис. 2А, 2В, 2Г). Число, расположение и форма верхних непигментированных зубцов также претерпевали различные изменения (рис. 1Д, 1Е; 2В, 2Г).
Рис. 1.
Мандибулы личинок Chironomus riparius: А, Б – нормальное строение (Б – апикальная часть мандибулы, вид изнутри); В–Е – деформированные мандибулы; а – нижние, или наружные пигментированные зубцы (а1–а4 – порядковые номера зубцов); б – верхние, или внутренние непигментированные зубцы (б1–б2 – порядковые номера зубцов); в – мандибулярный гребешок (pecten mandibularis); г – субдентальная щетинка (seta subdentalis); д – дорсальные щетинки (dorsal setae); е – базальные шипики (basal thorns); ж – прогиб дорсальной части мандибулы; з – структуры неизвестной гомологии; и – мультипликация пигментированных зубцов. А, Б – ×200; В–Е –×400. (А, Б, Г–Е – IV возраст; В – III возраст).
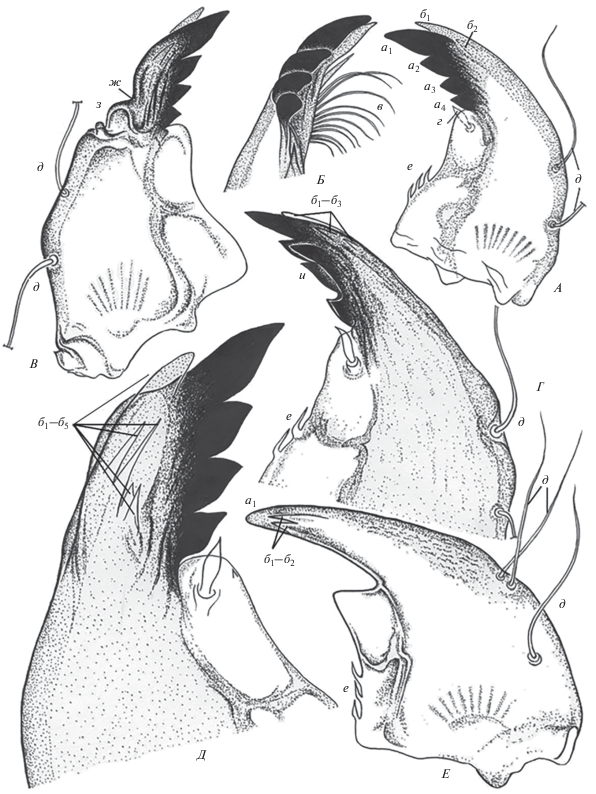
Рис. 2.
Деформированные мандибулы личинок Ch. riparius. к – аномальные искривления дорсальной части мандибулы. А–В, Д – ×400; Г –×280. (А, В, Г – IV возраст; Б, Д – III возраст). Обозначения те же, что на рис. 1.
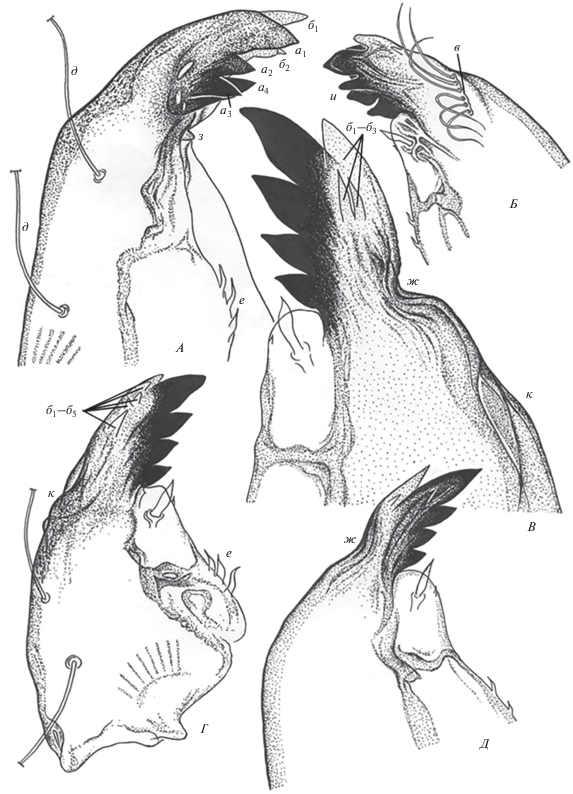
Аномальные отклонения в строении и расположении щетинок мандибул были представлены следующими формами: сокращением числа щетинок в ряду мандибулярного гребешка (рис. 2Б) вплоть до полного исчезновения ряда; увеличением числа дорсальных щетинок мандибулы до трех (рис. 1Е); искривлением вентральных шипиков (рис. 2Г); исчезновением субдентальной щетинки (рис. 1В, 1Е; 2А).
Отмечен редко встречаемый тип деформации: у личинки из двух мандибул одна имела нормальное строение, вторая была полностью депигментирована и трансформирована в уродливое образование, вытянутое в один длинный зубец (рис. 1Е).
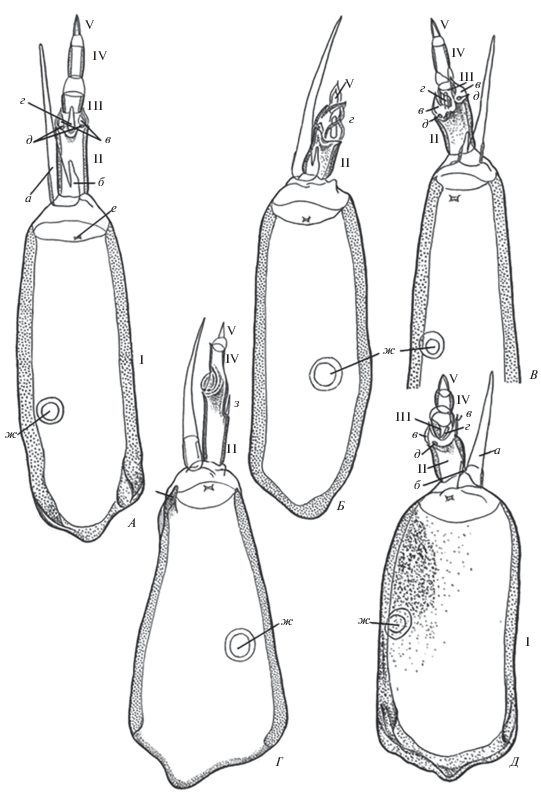
При анализе патоморфологических отклонений в строении ментума были зафиксированы два вида деформаций – срединные, когда аномальное строение имеет собственно срединный зубец (рис. 3Б, 3Д, 3Е), и латеральные, затрагивающие только боковые зубцы ментума (рис. 3В, 3Г). Основной зубец может быть слегка раздвоен (рис. 3Д), либо иметь хорошо выраженную двузубчатую структуру (рис. 3Б). Иногда в трехзубчатом срединном зубце появляется дополнительный зубчик (рис. 3Е). Число латеральных зубцов может быть больше (рис. 3Г) или меньше обычного (рис. 3В). Отклонения в строении ментума при действии НЧ многочисленны, но имеют невысокую степень тяжести.
Рис. 3.
Ментум личинок Ch. riparius. А – нормальное строение, Б–Е – деформации ментума; а – срединный трехзубчатый зубец (а1 – основной; б1–б2 – добавочные); l1–l6 – латеральные, или боковые зубцы; в – раздвоение основного зубца; г – дополнительный зубчик между основным и добавочным; д – дополнительный латеральный зубец. Масштаб 1 мкм.

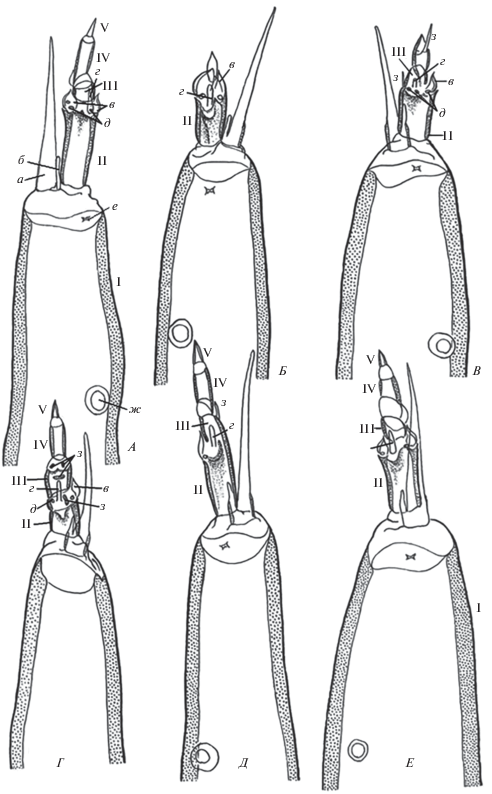
Мальформации в строении антенн в основном сосредоточены в области “жгута” антенны (II–V членики). Несмотря на отклонения в строении члеников просматривается 4-члениковая структура “жгута” (рис. 4Д; 5А, 5Г, 5Е). В ряде случаев уродливые преобразования были настолько велики, что не позволяли идентифицировать изначальное строение (рис. 4Б, 4Г; 5Б, 5В, 5Д). Сенсиллы антенны подвергались различным преобразованиям таким как: редукция, деформация, смещение лаутерборновых органов (рис. 4Г, 4Д; 5А–5Д); изменение местоположения “грифелька” (style) (рис. 4Б, 4Д; 5А, 5Е); изменение числа, смещение peg sensilium (PS) (рис. 4Д; 5А, 5В, 5Д) и кольцевого органа (RO) (рис. 4Д). Значительно реже встречались аномалии в строении базального, I-го членика. Примером может служить антенна при экспозиции личинок хирономид в суспензии НЧ диоксида титана – основной членик укорочен, массивный, грубо скульптурированный (рис. 4Д). Следует отметить, что самый большой спектр мальформаций антенн был выявлен именно в эксперименте с наночастицами диоксида титана.
Рис. 4.
Антенны личинок Ch. riparius IV возраста. А – нормальное строение; Б–Д – деформированные антенны; I–V –членики антенны (I – основной, или базальный членик; II–V – “жгут”); а – лациния (blade); б – добавочная лациния (accessory blade); в – лаутерборновы органы (Lauterborn organs); г – грифелек (stile); д – peg sensillum; е – базиконический орган (basiconic organ); ж – кольцевой орган (ring organ); з – структуры неизвестной гомологии. А–Д –×400.
Доля личинок с патоморфологическими изменениями структур ротового аппарата достигала высоких значений при действии всех исследованных наночастиц и была в 2.2–8.4 раза выше значений в условиях контроля (табл. 2). Максимальная величина отмечена для TiO2 в модификации анатаз и концентрации 0.002 мг/л – 72.7% и Ag – 60.0% (0.00002 мг/л). В общем доля личинок хирономид с патоморфологическими нарушениями составила: для НЧ серебра 44.6%, диоксида титана 42.5% (контроль 8.7%).
Таблица 2.
Морфологические показатели личинок Chironomus riparius при действии различных наночастиц
| Наночастицы | Концентрация, мг/л |
Доля личинок с морфологическими деформациями, % | Соотношение деформированных структур ротового аппарата, % |
ISAD | ISMMD | ||
|---|---|---|---|---|---|---|---|
| ментум, мандибулы |
комплекс верхней губы |
aнтенны | |||||
| Ag | 0.000002 | 23.8 | 38.5 | 15.4 | 46.2 | 1.05 | 1.05 |
| 0.00002 | 60.0 | 26.1 | 21.7 | 52.2 | 3.80 | 1.80 | |
| 0.00005 | 50.0 | 26.3 | 31.6 | 42.1 | 2.63 | 1.25 | |
| Au | 1.0 | 18.8 | 10.7 | 39.3 | 50.0 | 2.40 | 0.60 |
| 10.0 | 35.9 | 22.8 | 27.8 | 49.4 | 2.40 | 1.80 | |
| 100.0 | 38.6 | 34.9 | 25.8 | 39.4 | 1.2 | 1.20 | |
| TiO2 (анатаз) | 0.00002 | 42.9 | 8.4 | 25.3 | 66.4 | 4.55 | 0.61 |
| 0.0002 | 32.1 | 11.8 | 26.6 | 61.6 | 3.22 | 0.74 | |
| 0.002 | 72.7 | 5.3 | 15.8 | 78.9 | 4.63 | 0.42 | |
| 0.02 | 46.0 | 16.7 | 23.1 | 60.2 | 4.81 | 0.88 | |
| 0.2 | 36.3 | 10.6 | 17.4 | 72.1 | 4.13 | 0.77 | |
| 2.0 | 41.9 | 15.5 | 24.8 | 59.8 | 3.46 | 0.89 | |
| TiO2 (рутил) | 0.002 | 40.9 | 11.6 | 21.3 | 67.1 | 4.16 | 0.41 |
| 0.02 | 43.3 | 11.1 | 13.9 | 75.0 | 4.53 | 1.00 | |
| 0.2 | 33.8 | 13.6 | 23.2 | 63.3 | 3.30 | 0.43 | |
| 2.0 | 35.9 | 17.4 | 24.6 | 58.0 | 3.07 | 1.36 | |
| ZnO | 0.2 | 25.6 | 16.8 | 23.4 | 61.5 | 1.20 | 0.32 |
| 2.0 | 20.1 | 23.5 | 23.8 | 52.8 | 0.90 | 1.64 | |
| 10.0 | 40.6 | 42.7 | 15.0 | 48.1 | 1.80 | 2.32 | |
| 20.0 | 28.7 | 19.0 | 30.4 | 50.7 | 1.20 | 0.91 | |
| Контроль | 8.7 | 12.1 | 30.1 | 57.9 | 0.55 | 0.17 | |
Чаще отмечается деформация антенн, но и у жестких структур доля мальформаций высока, особенно в экспериментах с НЧ Ag, Au и ZnO. Доля деформаций ментума и мандибул при экспонировании личинок в НЧ Ag достигала 38.5% (0.000002 мг/л), а в эксперименте с НЧ ZnO – 42.7% (10.0 мг/л), и была практически равна таковой для антенн.
Индексы ISAD и ISMMD превышали контрольные значения в 1.4–7.4 и 1.9–13.6 раза соответственно и выходили за пределы нормы (0.25 ≤ ≤ ISAD ≤ 0.55 и 0.03 ≤ ISMMD ≤ 0.20) (табл. 2). Максимальные значения ISAD (3.07–4.80) зарегистрированы при экспозиции личинок в суспензии НЧ диоксида титана в обеих модификациях. Максимальные значения ISMMD отмечены при действии НЧ ZnO в концентрации 10.0 мг/л – 2.32, 0.0002 мг/л НЧ Ag – 1.80 и 10.0 мг/л НЧ Au – 1.80.
Установлена статистически значимая отрицательная зависимость между индексом ISMMD и концентрацией НЧ диоксида титана без учета модификации вещества (r = –0.45, p = 0.04). Корреляций между концентрацией НЧ и относительной численностью личинок с деформациями не выявлено.
ОБСУЖДЕНИЕ
Экспериментально подтверждено тератогенное воздействие металлических и металлооксидных НЧ на структуры ротового аппарата личинок хирономид. Один из показателей тератогенного действия – увеличение доли личинок с деформациями, которая возрастала во всех экспериментальных группах животных в 3–5 раз. Характер деформаций ротового аппарата зависел от состава экспериментальной среды. Антенны составляли основную часть деформированных структур. Значительное увеличение доли деформированных антенн отмечено при действии НЧ TiO2: в среднем 65.8–66.5% в зависимости от изоформы. При действии НЧ серебра, золота и оксида цинка – 46.8, 46.2 и 53.3 соответственно. Известно, что основным механизмом токсического действия НЧ является индукция активных форм кислорода, причем реактивность зависит не только от размеров НЧ, но и от морфологической формы (Андрусишина, 2011). В нашем исследовании количество деформированных личинок и доля деформированных антенн при их экспозиции в TiO2 в модификации анатаз с размерами частиц 25–50 нм была несколько выше, чем при экспозиции в рутиле с размерами частиц 10–350 нм.
Частота встречаемости деформаций антенн, как правило, выше, чем ментума и мандибул. Возможно, такие сенсорные структуры, как антенны, начиная с определенных концентраций токсических веществ, перестают на них реагировать, и деформации начинают проявляться на более жестких морфологических структурах (Bhattacharyay et al., 2005; Vermeulen et al., 2000). При высоких концентрациях токсикантов число деформированных антенн не увеличивается, а число деформированных ментума и мандибул – возрастает (Odume et al., 2012). Результаты наших экспериментов c НЧ золота и диоксида титана служат дополнительным подтверждением данного предположения.
Многочисленные деформации жестких ротовых структур личинок зарегистрированы при действии НЧ серебра, золота и оксида цинка; 30.3, 22.8 и 26.3 соответственно. Вопрос о механизме действия НЧ серебра на живые организмы является одним из наиболее сложных в вопросах токсичности этих наночастиц и вызывает много споров и сомнений. Известно, что серебро в наноразмерном состоянии усиливает свои цитотоксические и эмбриотоксические свойства (Сho et al., 2005; Hermsen et al., 2011). Согласно имеющимся гипотезам, НЧ серебра могут воздействовать на организмы как напрямую, так и косвенно (Miao et al., 2009). Реакции, обусловливающие токсичность, при прямом воздействии протекают на поверхности наночастиц и зависят от их размера. Данные реакции включают образование активных форм кислорода, денатурацию белков, повреждение мембран и ДНК. Взаимодействие молекул на поверхности НЧ приводит к образованию свободных радикалов, т.е. нестабильных атомов и соединений, действующих как агрессивные окислители, повреждающие структуры организма, прежде всего клеточные мембраны, ДНК (Cui, Mumper, 2002). Повреждение ДНК – наиболее существенный фактор токсического действия НЧ, так как определяет возможное проявление наноматериалами генотоксических, канцерогенных и мутагенных свойств (Trouiller et al., 2009; Shi et al., 2013). Многочисленные тератогенные изменения структур ротового аппарата личинок Ch. riparius могут иметь ту же природу.
Известно, что несмотря на химическую инертность, НЧ золота обладают мутагенными и генотоксическими свойствами (Khlebtsov, Dykman, 2011). Золотые НЧ диаметром менее 10 нм, как в нашем исследовании, могут иметь потенциально более высокую токсичность за счет возможности необратимого связывания с биополимерами клеток (Kunzmann et al., 2011).
Личинки хирономид могут накапливать в своем теле различные химические элементы, в том числе ионы тяжелых металлов (Никаноров и др., 1985). Самая высокая интенсивность накопления, вычисляемая по отношению концентрации элемента в организме (мг/кг сухой массы) к концентрации этого элемента в природной воде (мг/л), отмечена для Cd 4000–45 000, Ni 29271, Zn 11 890–24 368. Высокий уровень накопления этих элементов может вызывать токсический эффект, проявляющийся в уродствах, нарушениях в развитии и метаморфозе (Клишко и др., 2005). При экспонировании личинок хирономид на донных отложениях, загрязненных ионами цинка, доля деформированных личинок возрастала от 2.3% в контроле до 14% при концентрации 1.7 мг Zn/г сухой массы (Martinez et al., 2001; 2004). В нашем исследовании при действии НЧ ZnO деформированные ментум и мандибулы в среднем составляли 48.7% от общего числа уродливых структур.
Токсичность наночастиц зависит не только от их физической природы, способа получения, размеров и структуры, но и от вида, на котором проводятся исследования. Хирономиды доминируют среди тест-объектов, используемых в исследованиях по изучению морфологических деформаций (Johnson et al., 1993). Изученные в настоящем исследовании концентрации металлсодержащих наночастиц не оказывали влияния на выживаемость личинок Ch. riparius, но влияли на возникновение мальфомаций структур ротового аппарата. Т.е. мальформации проявляются при более низких концентрациях и могут служить сублетальной реакцией хирономид на негативное воздействие наночастиц, что позволит использовать деформации в качестве индикатора токсичности. Кроме того, поллютант-специфичность морфологических откликов важна для идентификации химических веществ или классов соединений (Назарова, 2002; Гремячих и др., 2009).
Рис. 5.
Деформированные антенны личинок Ch. riparius IV возраста. А–Е – ×400. Обозначения те же, что на рис. 4.
ЗАКЛЮЧЕНИЕ
Экспериментально подтверждено тератогенное действие металлических и металлооксидных НЧ на возникновение патоморфологических изменений структур ротового аппарата личинок хирономид. Доля личинок с мальформации была в 2.2–8.4 раза выше доли личинок в условиях контроля. Наибольшим тератогенным действием обладали НЧ серебра и диоксида титана в модификации анатаз: доля личинок хирономид с деформациями без учета концентраций составила 44.6 и 45.3% соответственно.
Наиболее часто встречаемые отклонения в строении мандибул – это прогиб дорсальной части мандибулы, в строении ментума – срединные и латеральные деформации. Мальформации в строении антенн в основном сосредоточены в области “жгута” антенны (II–V членики). Самый большой спектр деформаций антенн был выявлен при экспозиции личинок в суспензии наночастиц диоксида титана.
Список литературы
Андрусишина И.Н., 2011. Наночастицы металлов: способы получения, физико-химические свойства, методы исследования и оценка токсичности // Сучаснi проблеми токсикологii. № 3. С. 5–14.
Гребенюк Л.П., Томилина И.И., 2006. Изменение физиологических и морфологических показателей личинок Chironomus riparius Meigen (Diptera: Chironomidae) при действии токсических веществ различной природы // Биология внутренних вод. № 3. С. 81–90.
Гребенюк Л.П., Томилина И.И., 2014. Морфологические деформации сильнохитинизированных структур ротового аппарата личинок рода Chironomus riparius как показатель органического загрязнения пресных водоемов // Биология внутренних вод. № 3. С. 79–91.
Гремячих В.А., Томилина И.И., Гребенюк Л.П., 2009. Влияние хлорида ртути на морфо-функциональные показатели личинок Chironomus riparius Meigen (Diptera: Chironomidae) // Биология внутренних вод. № 1. С. 94–101.
Клишко О.К., Авдеев Д.В., Зазулина В.Е., Борзенко С.В., 2005. Роль хирономид (Diptera, Chironomidae) в биологической миграции химических элементов в экосистеме антропогенных водоемов // Чтения памяти Владимира Яковлевича Леванидова. Вып. 3. С. 361–367.
Константинов А.С., 1958. Биология хирономид и их разведение // Труды Саратовского отд. Всесоюз. НИИ озерного и речного рыбного хозяйства. Т. 5. 362 с.
Моргалёв Ю.Н., Хоч Н.С., Моргалёва Т.Г., Гулик Е.С., Борило Г.А. и др., 2010. Биотестирование наноматериалов: о возможности транслокации наночастиц в пищевые сети // Российские нанотехнологии. Т. 5. № 11–12. С. 131–135.
Назарова Л.Б., 2002. Морфологические деформации личинок комаров-звонцов (Diptera, Chironomidae) в гидробиологических исследованиях // Успехи современной биологии. Т.122. №5. С. 505–512.
Никаноров А.М., Жулидов А.В., Покаржевский А.Д., 1985. Биомониторинг тяжелых металлов в пресноводных экосистемах. Л.: Гидрометеоиздат. 144 с.
Об утверждении концепции токсикологических исследований, методологии оценки риска, методов идентификации и количественного определения наноматериалов. Пост. гл. гос. сан. врача РФ № 79 от 31 октября 2007 г. // Российская газета. Федеральный выпуск № 4533.
Томилина И.И., Гремячих В.А., Мыльников А.П., Комов В.Т., 2011. Влияние металлооксидных наночастиц (СеО2, ТiO2, ZnO) на биологические параметры пресноводных нанофлагеллят и ракообразных // Доклады Академии наук. Т. 436. № 5. С. 715–717.
Фролов Д.П., Стратулат В.П., 2010. Развитие наноиндустрии и экономическая безопасность // Экономист. № 12. С. 16–21.
Шилова А.И., 1966. К систематике Cryptochironomus exgr. Defectus Kieff. (Diptera, Chironomidae) // Труды Института биологии внутренних вод АН СССР. Вып.12 (15). С. 214–238.
Шилова А.И., 1976. Хирономиды Рыбинского водохранилища. Л.: Наука. 251 с.
Arambourou H., Beisel J.N., Branchu P., Debat V., 2012. Patterns of fluctuating asymmetry and shape variation of Chironomus riparius (Diptera: Chironomidae) exposed to nonyphenol or lead // PLosOne. № 7 (11). E 48 844.
Bhattacharyay G., Sadhu A.K., Mazumdar A., Chaudhuri P.K., 2005. Antennal deformities of chironomid larvae and their use in biomonitoring of heavy metal pollutants in the river Damodar of West Bengal, India // Environmental Monitoring and Assessment. V. 108. P. 67–84.
Blaise C., Gagne F., Ferard J.F., Fullaffroy P., 2008. Ecotoxicity of selected nano-materials to aquatic organisms // Environmental Toxicology. V. 23 (5). P. 591–598.
Bird G.A., 1994. Use of chironomid deformities to assess environmental degradation in the Yamaska river, Quebec // Environmental Monitoring and Assessment. V. 30. P. 163–175.
Cho K.H., Park J.E., Osaka T., Park S.G., 2005.The study of antimicrobial activity and preservative effects of nanosilver ingredient // Electrochemical Acta. V. 51. P. 956–960.
Cui Z., Mumper R.J., 2002. Plasmid DNA-entrapped nano-particles engineered from microemulsion precursors: in vitro and in vivo evaluation // Bioconjugate Chemistry. V. 13. P. 1319–1327.
Dickman M., Brindle I., Benson M., 1992. Evidence of teratogens in sediments of the Niagara River Watershed as reflected by chironomid (Diptera: Chironomidae) deformities // Journal of Great Lakes Research. V. 18. P. 467–480.
Griffitt R.J., Luo J., Gao J., Bonzongo J.C., Barber D.S., 2008. Effects of particle composition and species on toxicity of metallic nanomaterials in aquatic organisms // Enviromental Toxicology and Chemistry. V. 27. № 9. P. 1972–1978.
Hermsen S.A., van den Brandhof J.E., van der Ven L.T., Piersma A.H., 2011. Relative embryotoxicity of two classes of chemicals in a modified zebrafish embryotoxicity test and comparison with their in vivo potencies // Toxicology in Vitro. V. 25. № 3. P. 745–753.
Ingersoll C.G., Nelson M.K., 1990. Testing sediment toxicity with Hyalella azteca (Amphipoda) and Chironomus riparius (Diptera) // Aquatic Toxicology and Risk Assessment. Philadelphia: Amer. Soc. Test. and Mater. V. 13. P. 93–109.
Janssens de Bisthoven L., Huysmans C., Goemans G., Vannevel R., Ollevier F., 1997. Field and experimental morphological response of Chironomus larvae to xylene and toluene // Netherlands Journal of Zoology. V. 47. P. 227–239.
Janssens de Bisthoven L.G., Goddeeris B., Ollevier F., 1998. Sublethal parameters in morphologically deformed Chironomus larvae: clues to understand their bioindicator value // Freshwater Biology. V. 39. P. 179–191.
Janssens de Bisthoven L., Vermeulen A., Ollevier F., 1998a. Experimental induction of morphological deformities in Chironomus riparius larvae by chronic exposure to copper and lead // Archives of Environmental Contamination and Toxicology. V. 35. P. 249–256.
Janssens de Bisthoven L., Postma, A., Vermuellen A.,Goemans G.,OllevierF., 2001. Morphological deformities in Chironomus riparius Meigen larvae after exposure the cadmium over several generations // Water, Air and Soil Pollution. V. 129. P. 169–179.
Johnson R.K., Wiederholm T., Rosenberg D.M., 1993. Freshwater biomonitoring using individual organisms, populations and species assemblages of benthic macroinvertebrates // Freshwater biomonitoring and benthic macroinvertebrates. N.Y.: Chapman and Hall. P. 40–158.
Khlebtsov N., Dykman L., 2011. Biodistribution and toxicity of engineered gold nanoparticles: a review of in vitro and in vivo studies //Chemical Society Reviews. V. 40. P. 1647–1671.
Kosalwat P., Knight A.W., 1987. Chronic toxicity of copper to a partial life cycle of the midge Chironomus decorus // Archives of Environmental Contamination and Toxicology. V. 16. P. 283–290.
Krysanov E.Y., Pavlov D.S., Demidova T.B., Dgebyadze Y.Y., 2010. Effect of nanoparticles on aquatic organisms // Biology Bulletin. V. 37. № 4. P. 406–412.
Kunzmann A., Andersson B., Thurnherr T., Krug H., Scheynius A., Fadeel B., 2011. Toxicology of engineered nanomaterials: Focus on biocompatibility, biodistribution and biodegradation // Biochimica et Biophysica Acta (BBA) // General subjects. V. 1810. № 3. P. 361–373.
Madden C.P., Suter P.J., Nicholson B.C., Austin A.D., 1992. Deformities in chironomid larvae as indicators of pollution (pesticide) stress// Netherlands Journal of Aquatic Ecology. V. 26. P. 551–557.
Martinez E.A., Moore B.C., Schaumloffel J., Dasgupta N., 2001. Induction of morphological deformities in Chironomus tentans exposed to zinc and lead spiked sediment // Environmental Toxicology and Chemistry. V. 20(11). P. 2475–2481.
Martinez E.A., Moore B.C., Schaumloffel J., Dasgupta N., 2004. Teratogenic Versus Mutagenic Abnormalities in Chironomid Larvae Exposed to Zinc and Lead // Archives of Environmental Contamination and Toxicology. V. 47. P. 193–198.
Miao A.J., Schwehr K.A., Xu C., Zhang S.J., Luo Z., Quigg A., Santschi P.H., 2009. The algal toxicity of silver engineered nanoparticles and detoxification by exopolymeric substances // Environmental Pollution. V. 157. № 11. P. 3034‒3041.
Odume O.N., Muller W.J., Palmer C.G., Arimoro F.O., 2012. Mentum deformities in Chironomidae communities as indicators of anthropogenic impacts in Swartkops River // Physics and Chemistry of the Earth. V. 50–52. P. 140–148.
Saether O.A., 1980. Glossary of chironomid morphology terminology (Diptera: Chironomidae) // Entomologica Scandinavica Supplementum. № 14. 151 p.
Savic-Zdravkovic D., Jovanovic B., Durdevic A., Stojkovic M., Savic A., Vidmar J., Milošević D., 2018. An environmentally relevant concentration of titanium dioxidae (TiO2) nanoparticles induces morphological changes in mouthparts of Chironomus tentans // Chemosphere. V. 211. P. 489–499.
Shi H., Magaye R., Castoranova V., Zhao J., 2013. Titanium dioxide nanoparticles: a review of current toxicological data // Particle and Fibre Toxocology. № 10. P. 15–48.
Sokal R.R., Rohlf F.J., 1995. Biometry. The principals and practice of statistics in biological research. N.Y.: W.H. Freeman and Co. 887 p.
Trouiller B., Reliene R., Westbrook A. SolaimaniP., Schiestl R.H., 2009. Titanium dioxide nanoparticles induce DNA damage and genetic stability in vivo in mice // Cancer Research. V. 69. P. 8784–8789.
Van Urk G., Kerkum F.C.M., Smit H., 1992. Life cycle patterns, density and frequency of deformities in Chironomus larvae (Diptera: Chironomidae) // Canadian Journal of Fisheries and Aquatic Sciences. V. 49. P. 2291–2299.
Vermeulen A.C., Liberloo G., Dumont P., Ollevier F., Goddeeris B., 2000. Exposure of Chironomus riparius larvae (diptera) to lead, mercury and beta-sitosterol: effects on mouthpart deformation and moulting // Chemosphere. V. 41. P. 1581–1591.
Warwick W.F., 1985. Morphological abnormalities in Chironomidae (Diptera) larvae as measures of toxic stress in freshwater ecosystems: indexing antennal deformities in Chironomus Meigen // Canadian Journal of Fisheries and Aquatic Sciences. V. 42. № 12. P. 1881–1914.
Wiederholm T., 1984. Incidence of deformed chironomid larvae (Diptera:Chironomidae) in Swedish lakes // Hydrobiologia. V. 109. P. 243–249.
Williams K.A., Green D.W.J., Paseoe D., Gower D.E., 1986. The acute toxicity of cadmium to different larval stages of Chironomus riparius (Diptera: Chironomidae) and its ecological significance for pollution regulation // Oecologia. V. 70. P. 362–366.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


