Зоологический журнал, 2020, T. 99, № 3, стр. 290-300
О плодовитости креветки Alpheus lobidens De Haan 1849 (Decapoda, Alpheidae) с литорали Оманского моря
Р. Н. Буруковский a, *, З. Ансари a, **, А. Махсюдлю b, ***
a Калининградский государственный технический университет
236022
, Калининград, Россия
b Иранский национальный институт океанографических
и атмосферных знаний, № 3
Tehran, I, R, Iran
* E-mail: burukovsky@klgtu.ru
** E-mail: zeinab6228@gmail.com
*** E-mail: Wahab@inio.ac.ir
Поступила в редакцию 26.03.2019
После доработки 07.06.2019
Принята к публикации 10.06.2019
Аннотация
Для креветки Alpheus lobidens, обитателя индо-вестпацифической каменистой литорали, описаны следующие показатели: абсолютные индивидуальная плодовитость (количество зрелых ооцитов в преднерестовой гонаде – АИП), абсолютная реализованная плодовитость (количество яиц, вынашиваемых самкой на плеоподах – АРП) и удельная минимальная популяционная реализованная плодовитость – ПРП; определение ниже). Материал собран в 2014–2015 гг. на литорали Оманского моря на станциях Джод (25°26′58″ с.ш., 59°30′28″ в.д) и Тисс (25°21′10″ с.ш., 60°36′08″ в.д.). Исследованы 443 самки, из них 48 были преднерестовыми (10.8%) и 309 – (69.7%.) яйценосными. В гонадах преднерестовых креветок длиной 23–46 мм имелось от 32 до 1011 зрелых ооцитов. Их число быстро возрастало с увеличением размеров самок. Яйца почти сферические, их диаметр 0.6 мм. Относительные размеры яйца составляют 1% от наибольшей общей длины креветки, поэтому A. lobidens относится к видам с K-r репродуктивной стратегией. АРП варьирует от 37 (самка длиной 16 мм) до 1843 (длина самки 43 мм). Потери яиц невелики. Они возникают во время поимки и фиксации креветок. АРП резко возрастает до достижения креветками длины 43 мм, потом АРП уменьшается. A. lobidens живет около года, поэтому удельной минимальной популяционной плодовитостью можно считать долю (в процентах, т.е. приходящуюся на 100 яйценосных особей) вклада каждой размерной группы креветок в общий пул откладываемых яиц. Вкладом мелких самок (16–23 мм) можно пренебречь, т.к. их вклад составляет лишь 3.5%. Среднеразмерные особи (24–35 мм – около половины всех яйценосных самок) доминируют с конца предмуссонного периода и в течение всего лета (муссонный период) со средним АРП 127–358 яиц. Их вклад в ПРП составляет 46.8% всех яиц. Крупные самки (36–47 мм – составляют около 20%) со средним АРП 519–722 яиц, появляющиеся в ноябре – в постмуссонный период, приносят в ПРП тоже около 50% яиц. Следовательно, эти две группы самок вносят в ПРП примерно одинаковое количество яиц, но среднеразмерные это делают в муссонный период (“летненерестовые”), а крупные, менее многочисленные, – в пост- и предмуссонный периоды (“зимненерестовые”). Они не просто более плодовитые самки, а особи, прошедшие через сито естественного отбора, что не может не сказаться на оставляемом ими потомстве.
Род Alpheus Fabricius 1798 – один из крупнейших родов креветок, насчитывающий более 300 видов (De Grave, Fransen, 2011; WORMS, 2019). Яркая окраска, уникальные, так называемые “пистолетные клешни”, сложное поведение многих представителей рода, участие некоторых видов из-за этой их особенности в качестве “героев” в популярных литературе и видеофильмах, контрастируют с общим низким уровнем знаний о них. Это вызвано чрезвычайной сложностью их таксономии (Anker, 2001). Как одно из следствий этого, до недавнего времени был очень низок уровень изученности объекта нашего исследования – Alpheus lobidens. Довольно большой список работ о местах его находок контрастирует с бедностью информации о его биологии. Такие публикации единичны, а об A. lobidens в водах Ирана, кроме упоминания его в видовых списках, существуют три публикации, одна из которых затрагивает лишь некоторые аспекты его поведения (Dabbagh et al., 2012), а две другие принадлежат нам (Буруковский и др., 2017, 2018). В них подробно рассмотрены особенности морфологии этого вида в водах Оманского моря, которые необходимо использовать для его идентификации (Буруковский и др., 2017), а по результатам исследования было доказано, что A. lobidens – санитар литорали этого региона (Буруковский и др., 2018). Предлагаемая здесь работа представляет логическое продолжение наших исследований и посвящена описанию различных аспектов плодовитости A. lobidens в водах Оманского моря.
МАТЕРИАЛ И МЕТОДИКА
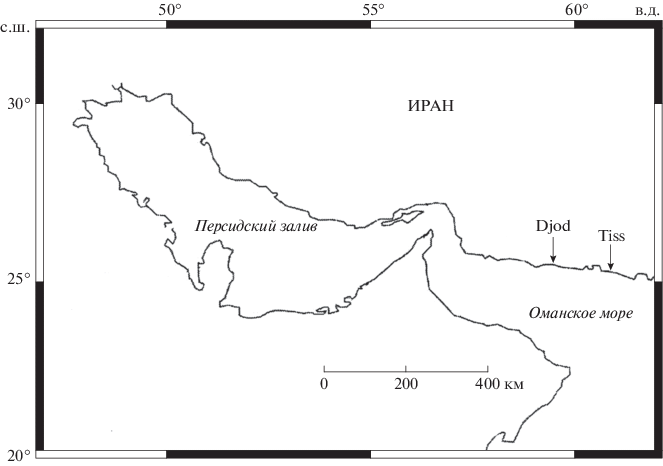
Материал был собран в 2014–2015 гг. на двух станциях литорали Оманского моря: Джод (Djod): 25°26′58″ с.ш., 59°30′28″ в.д.) и Тисс (Tiss): 25°21′10″ с.ш., 60°36′08″ в.д.). Расстояние между станциями 110 км (рис. 1).
Станция Тисс располагается в заливе Чехбахар, к северо-западу от крупного одноименного морского порта, на типичном берегу эрозионного происхождения с хорошо развитыми клифом и бенчем (по: Сафьянов, 1996). Бенч сложен из камней и песка, образующих чередующиеся участки длиной 200–300 м и шириной 50–70 м. Каменистые участки имели относительно небольшую илистую фракцию. Они тянутся ближе к урезу высокой воды. Далее в сторону моря, литораль к ее середине становится каменистой, сложенной из гравия, голышей и крупных камней. Нижняя сизигийная граница литорали образует ступеньку – причину возникновения мощного штормового прибоя в зимнее время. Этот тип литорали разделяется участками чисто песчаного грунта аккумулятивного происхождения примерно такой же протяженности. Именно участки песчано-илистой литорали с галькой и мелкими валунами служат биотопом A. lobidens.
Станция Джод находится северо-западнее предыдущей станции. Это участок побережья аккумулятивного происхождения, клиф отсутствует. Однако, как и на станции Тисс, средняя часть литорали сложена галечно-каменистыми породами эрозионного происхождения, образующими полосы примерно такой же протяженности и ширины, как и на предыдущей станции. Количество камней и их размеры несколько меньше. Вмещающая часть субстрата скорее илисто-песчаная. Макрофиты – как живые, так и в виде выбросов – отсутствовали.
Общее количество собранных и исследованных креветок – 872 экз, из которых 443 были самками. Последние и послужили объектами для нашего исследования.
Для отлова креветок раскапывали грунт лопатой или руками, или же вручную удаляли крупные валуны и гальку на песчано-илистых и илисто-песчаных островках галечно-валунного поля литорали. Освободившиеся участки с мелкими фракциями субстрата и образовавшиеся при удалении крупных камней ямы тут же заполнялись водой. В них, вручную, отлавливали креветок и фиксировали их в 4%-ном нейтрализованном растворе формалина.
В лабораторных условиях креветок подвергали биологическому анализу. В него входили: измерение длины тела, определение пола, стадий зрелости гонад у самок, стадий эмбрионального развития яиц в кладке у яйценосных особей (Буруковский, 1992). За размеры тела принята его общая длина, измеренная от конца рострума до заднего края тельсона вдоль спинной стороны. Измерение креветок и диаметра ооцитов и яиц производили с помощью окуляр-микрометра стереоскопического микроскопа МБС-10 с точностью до 0.1 мм.
Каридные креветки во время нереста откладывают яйца на плеоподы. Поэтому у них различают два вида плодовитости: разовая абсолютная индивидуальная плодовитость (АИП), или количество ооцитов в гонаде, готовой к нересту, и разовая абсолютная реализованная плодовитость (АРП), т.е. количество яиц в кладке, вынашиваемой на плеоподах (Буруковский, 1998; Буруковский, Андреева, 2010; Судник, 2017). Для определения стадий зрелости гонад и стадий эмбрионального развития яиц на плеоподах мы использовали пятибалльные шкалы (Буруковский, 1992).
Стадии зрелости самок:
I стадия – гонада кажется отсутствующей, так как чаще всего совершенно неразличима на фоне других органов;
II стадия – гонада в виде маленького, прозрачного и с трудом различимого листика;
III стадия – гонада утолщается, несколько вытягивается в длину и теперь занимает примерно 1/3 длины карапакса;
IV стадия – гонада еще больше увеличивается в размерах и занимает от ½ до ¾ длины карапакса;
V стадия – гонада очень крупная и у живых и только что зафиксированных особей хорошо видна сквозь экзоскелет. Занимает всю спинную часть головогруди, и ее дистальный конец немного заходит в 1-й сегмент абдомена;
Шкала для определения стадий эмбрионального развития (Буруковский, 1992 с изменениями, обусловленными особенностями развития яиц у исследуемого вида).
1 стадия – яйца полупрозрачные. Желток гомогенный, без следов дробления;
2 стадия – яйца полупрозрачные, заметна зародышевая полоска в виде полумесяца. Желток занимает три четверти объема яйца;
3 стадия – зачаток глаза в виде тоненькой черной полоски; желток занимает от одной трети до половины объема яйца, остальное пространство занято эмбрионом;
4 стадия – отличается от предыдущей стадии наличием хорошо выраженных глаз. Количество желтка меньше, чем в предыдущей стадии;
5 стадия – внутри яйцевой оболочки полностью сформированная личинка, готовая к вылуплению. Остатки желтка заключены внутри ее карапакса.
Поскольку у A. lobidens оказалась относительно невысокая плодовитость, АИП и АРП были определены прямым подсчетом количества ооцитов в преднерестовой гонаде и количества эмбрионов в яйцекладке. Гонадо-соматический индекс определить не удалось, т.к. из-за высокой повреждаемости конечностей невозможно корректное определение массы тела креветок.
Некоторые другие методические аспекты исследования будут освещены в соответствующем разделе.
РЕЗУЛЬТАТЫ
Абсолютная разовая индивидуальная плодовитость (АИП)
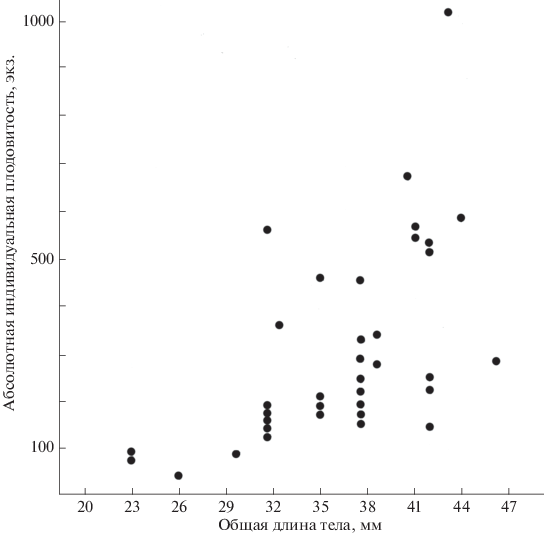
Из 443 исследованных самок лишь 48 (10.8%) имели преднерестовые гонады (находящиеся в V стадии зрелости). Количество ооцитов варьировало от 32 до 1011, то есть примерно в 30 раз. Однако лишь 4 особи с длиною тела 23–31 мм имели в гонадах менее 100 зрелых ооцитов, и лишь единственная особь длиною 43 мм имела в гонаде 1011 ооцитов (диапазон варьирования длины тела у преднерестовых самок примерно в 2 раза, и в 30 с небольшим раз диапазон варьирования АИП). У большинства преднерестовых особей, имевших длину тела 31–46 мм, в гонадах было 133–689 зрелых ооцитов. Следовательно, реальный диапазон варьирования уменьшается до 5 раз.
Зависимость АИП от размеров тела креветок хорошо выражена (рис. 2). Особи с длиной тела 23–26 мм имеют в гонаде не более 100 зрелых ооцитов. Среди самок с длиной тела 30–40 мм лишь единственная (с длиной 31 мм) имела в гонаде 88 ооцитов. У остальных их количество варьировало от 133 до 689. Обращает на себя внимание высокая индивидуальная изменчивость АИП у одноразмерных особей A. lobidens. Имеются признаки, что у самых крупных особей АИП уменьшается (рис. 2).
Абсолютная реализованная плодовитость (АРП)
Только что отложенные на плеоподы яйца A. lobidens не окрашены, как это наблюдается, например, у креветок из семейств Penaeidae, Aristeidae, Pandalidae (Буруковский, 1992). Они типично желтоватые, имеют почти сферическую форму и диаметр 0.6 мм. В процессе эмбрионального развития форма яиц меняется несущественно, а диаметр становится равен примерно 0.7 мм.
Нами были исследованы 443 самки, из которых яйца на плеоподах несли 309 особей, или 69.7%. У 196 самок (63.4% от всех яйценосных особей) они были только что отложены (стадии 1 и 2 эмбрионального развития). Количество яиц на плеоподах варьирует от 4 до 1843. В преднерестовой гонаде наименьшее количество зрелых ооцитов варьирует (в зависимости от размеров тела, от 33 до 133 ооцитов (см. выше), следовательно, меньшее количество яиц на плеоподах по сравнению с таковым в преднерестовой гонаде говорит об их утрате. Но по какой причине? С первого взгляда кажется бесспорным, что в процессе вынашивания. Действительно, у креветки с наибольшим АРП (1843 яиц) они находились на стадии 1 эмбрионального развития. У самок с яйцами на следующей стадии их наибольшее число чуть ли не вдвое меньше (1091 яйцо), примерно столько же (954 яйца) у креветок с яйцами в стадии развития 3. Но у одной особи с яйцами в стадии развития 4 на плеоподах оказалось 1610 яиц. А в следующей по величине кладке с яйцами в стадии 4 их было почти на 700 меньше (975). Наибольшее количество яиц с эмбрионами, готовыми к вылуплению (стадия 5 эмбрионального развития), было равно 768.
Однако лишь у 8 самок величина кладки превышала 1000 яиц (1002–1843 яйца). Это всего 2.6% от всех яйценосных самок. Из них у шести особей яйца были только что отложены (на 1 стадии), у одной они находились на второй, и у последней – на 4 стадии эмбрионального развития. Все остальные креветки имели 942–975 яиц и меньше. Следовательно, потери яиц самками не зависят от времени их нахождения на плеоподах.
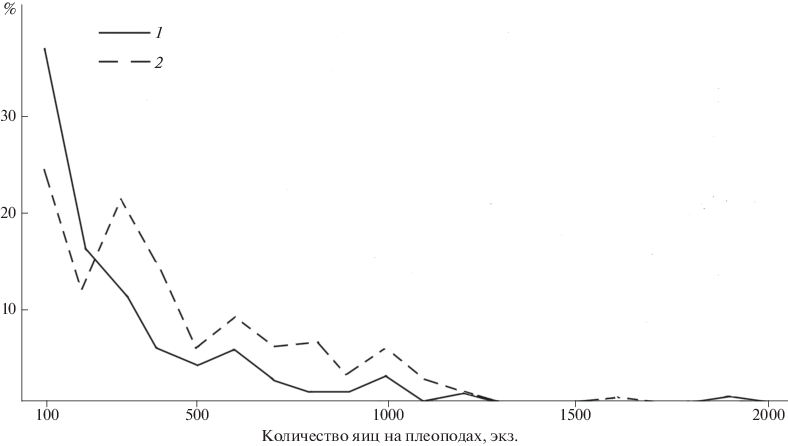
Еще лучше это демонстрирует рис. 3, где показана АРП креветок с только что отложенными (стадии 1 и 2) и продвинутыми в развитии (стадии 3–5) яйцами. Распределение частоты встречаемости креветок с кладками разных размеров у тех и других категорий идет почти параллельно. Различия определяются не потерями яиц, а количеством самок, несущих только что отложенные и относительно давно вынашиваемые яйца. Следовательно, можно предположить, что потеря яиц происходит во время их поимки и фиксации. Это подтверждается обнаружением некоторого количества яиц на дне банок, в которых креветок фиксировали.
Рис. 3.
Частота встречаемости самок креветок с только что отложенными (эмбрионы на стадиях развития 1 и 2) (1) и самок с продвинутыми в развитии яйцами (эмбрионы на стадиях 3–5) (2).
У преднерестовых самок с длиной тела до 29 мм в гонаде не было встречено менее 33, а у более крупных самок – менее 133 зрелых ооцитов. Поэтому можно считать, что у яйценосных особей с такой же длиной тела не должно быть меньшее количества яиц. Исходя из этого, если на плеоподах яйценосных самок встречается меньшее количество яиц, чем ооцитов в гонаде преднерестовых самок, значит, это – артефакт. При расчете среднего АРП (см. следующий раздел) самок с таким количеством яиц мы исключали из подсчета во избежание занижения результатов.
Наименьшая общая длина яйценосной самки 16 мм. Таких особей было всего две (0.7%), и они несли на плеоподах 37 и 48 (т.е. меньше 50) яиц. Из 14 самок с длиной тела 19–21 мм 10 самок (71.4%) имели на плеоподах менее 50 яиц. Оставшиеся четыре – более 50, но менее ста (55–82) яиц. Далее облако точек демонстрирует резкое возрастание максимальной АРП каждой последующей размерной группы креветок.
У яйценосных самок с длиной тела более 33 мм АРП не бывает менее 100, а у самок с длиной тела 36–39 мм – менее 200. Поэтому четыре особи из размерной группы 39–45 мм, имеющие в кладке менее 300 яиц, можно без сомнения тоже считать жертвами потерь части кладки (рис. 4).
Рис. 4.
Онтогенетическая изменчивость абсолютной реализованной плодовитости. Встречены: 1 –единственная особь, 2 – 2–5 особей, 3 – 6–9 особей, 4 – 10 и более особей.
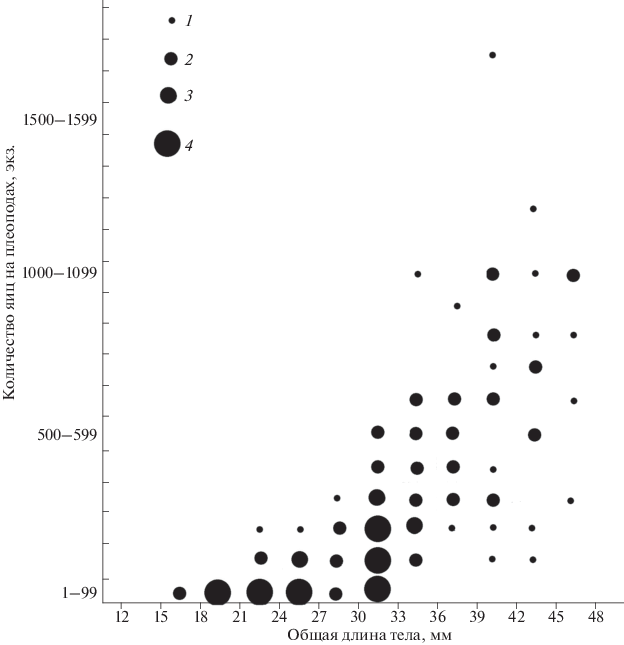
Максимальная АРП, как и максимальная АИП, обнаружена у особи с длиной тела 43 мм. У большинства самок число только что отложенных яиц варьирует от 82 до 975. Сходство формы облаков точек АИП и АРП на рис. 2 и 4 и сильная вариабельность их у одноразмерных самок, возможно, имманентное свойство данного вида.
Удельная минимальная популяционная реализованная плодовитость (ПРП)
Под популяционной плодовитостью рыб понимают количество икринок, выметываемых всеми самками популяции за один нерестовый сезон (Козлов, Абрамович, 1982). У A. lobidens нерестящиеся самки встречались в течение всех семи месяцев наблюдений. Длительность жизни у него составляет около одного года (см. ниже), в течение которого самка может откладывать яйца на плеоподы до трех-четырех раз. Поэтому у данного вида под популяционной плодовитостью мы понимаем всю совокупность яиц, откладываемых креветками в течение жизни. Исходя из этого, при расчете ПРП мы предполагаем, что (1) суммарная кривая размерного состава яйценосных самок отражает их соотношение в населении креветок на станциях Джод и Тисс и (2) креветки обеих станций относятся к одной популяции. Следовательно, если рассчитать среднюю АРП для каждой размерной группы яйценосных самок и перемножить полученные результаты на долю в процентах каждой такой группы самок, мы получим относительную удельную минимальную АРП каждой размерной группы самок. Их суммирование дает нам АРП ста яйценосных самок, а перевод ее в проценты – относительный вклад каждой размерной группы самок в общий популяционный пул отложенных ими яиц, т.е. удельную минимальную ПРП (рис. 5).
Рис. 5.
Вклад креветок разных размеров в популяционную плодовитость: 1 – размерный состав самок, 2 – средняя удельная реализованная плодовитость, 3 – средняя удельная популяционная реализованная плодовитость.
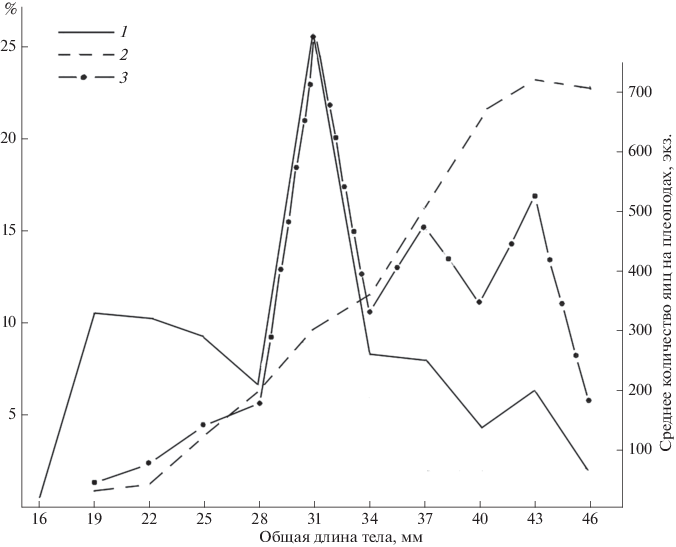
Общая длина самок варьирует от 11 до 59 мм. Яйца на плеоподах имеют самки от 16 (две особи или 0.7%; мы их не учитываем) до 47 мм. Среди более крупных особей встречена единственная самая крупная яйценосная самка с длиной 59 мм. Прочие яйценосные самки могут быть разделены на четыре хорошо различимые размерные группы (рис. 5). Первая, с длиной тела от 18 до 29 мм, составляет 30.7% всех самок. Вторая охватывает очень узкую группу особей (30–32 мм), но она составляет 25.9% всех яйценосных особей. Следовательно, это модальная группа. Следующая группа имеет длину 33–38 мм (16.2%). Наконец, последняя имеет длину тела 39–47 мм (12.8%).
Взнос самок первой группы, составляющих почти треть всех яйценосных особей, в общий пул яиц равен лишь 13.6%, тогда как особи с длиной тела 30–32 мм откладывают 25.6% яиц. Почти столько же (26.0%) вносят значительно менее многочисленные самки с длиной 33–38 мм. Наконец, последняя группа, самые крупные и самые малочисленные особи, вносят в общий пул 34.4% яиц. Следовательно, почти 100% яиц откладывают средне- и крупноразмерные особи.
Размерный состав креветок имеет хорошо выраженную сезонную динамику (рис. 6). У побережья Оманского моря господствуют юго-западные муссоны. В зависимости от их активности год подразделяется на муссонный (май–сентябрь), постмуссонный (октябрь–февраль) и предмуссонный (март–апрель) периоды (Робинсон, 1974; География Ирана, 2016; Chiffings, 1995; Fatemi, 2006; Taheri et al., 2010).
Рис. 6.
Сезонная динамика размерного (мм) состава креветок на станции Тисс в апреле–ноябре 2015 г.: 1 – 12–23, 2 – 24–35, 3 – 36–47, 4 – экстраполяция от сентябрьских к ноябрьским данным.
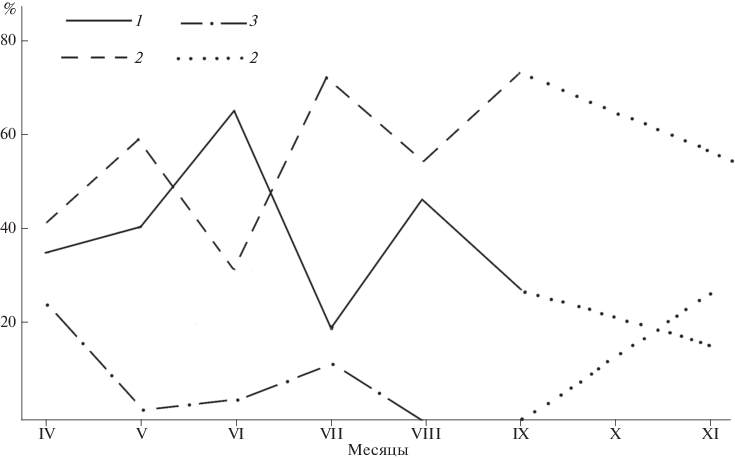
С этим связана цикличность сезонных колебаний размерного состава (рис. 6). Ее особенности подтверждают предположение о том, что креветки живут около года. Об этом свидетельствуют постепенное, но полное выклинивание крупных особей к середине муссонного периода, их замещение более мелкими креветками, растущими в течение муссонного периода, и их появление вновь и увеличение относительной численности к началу постмуссонного периода. Что происходит в декабре–феврале, нам неизвестно из-за мощного штормового прибоя, захлестывающего участки литорали с биотопом A. lobidens. Это препятствовало сбору материалов. Закономерно предположить, что крупные особи в зимнее время если не доминируют, то играют значительно более существенную роль в населении креветок, чем летом.
Итак, мелкие (12–23 мм) и среднеразмерные особи (24–35 мм) доминируют среди креветок с конца предмуссонного периода. Вкладом в ПРП первых можно пренебречь, т.к. он составляет лишь около 3.5% яиц. В течение всего лета (муссонный период) главную роль в формировании пула яиц в популяции имеют среднеразмерные креветки, средний АРП которых 127–358 яиц. Их вклад в ПРП составляет 46.8% всех яиц. Наконец, “зимние” крупные особи со средним АРП 519–722 яиц, появляющиеся вновь в ноябре – в постмуссонный период, приносят в ПРП около 50%, и его большая часть должна приходиться именно на зиму.
Следовательно, существуют две группы самок, которые вносят в ПРП примерно одинаковое количество яиц, но среднеразмерные (”летненерестящиеся”) делают это летом (в муссонный период), а крупные (“зимненерестящиеся”), менее многочисленные, – в пост- и предмуссонный периоды.
ОБСУЖДЕНИЕ
Сравнение полученных нами данных об АИП и АРП A. lobidens с литературными невозможно или чрезвычайно затруднено по целому ряду причин. Не с чем сравнивать, например, наши результаты исследования АИП, т.к. в известной нам литературе такие данные отсутствуют. Наличие яиц на плеоподах и преобладание среди альфеусов мелких и очень мелких видов не стимулируют исследователей вскрывать карапакс, определять состояние гонад и подсчитывать число зрелых ооцитов в преднерестовых яичниках. К тому же у A. lobidens не только очень сильная онтогенетическая вариабельность числа зрелых ооцитов, но и у одноразмерных особей число их варьирует в несколько раз (от трех до почти 10), и, конечно, эта особенность сохраняется и в вариациях величины АРП. Это предъявляет повышенные требования к объему материалов исследования.
К тому же в известной нам литературе очень мало данных и об АРП у креветок рода Alpheus. Немногочисленные исследователи ограничиваются подсчетами яиц, отложенных отдельными самками на плеоподы у небольшого числа видов, т.е. мы имеем дело со спорадическими определениями, поэтому провести сравнительный анализ с другими видами нам не представилось возможности. В одной из работ, претендующей на некие обобщения (Corey, Reid, 1991), приводятся данные об АРП 33 видов каридных креветок из девяти семейств, в том числе трех видов из рода Alpheus, но количество исследованных креветок для каждого вида составило 4–7 экз. Среди них экземпляры A. heterochaelis Say 1818, максимальная длина которого 55 мм (Ratliff, 2014) сравнима с таковой A. lobidens (59 мм), были представлены относительно мелкими особями. Поэтому в упомянутой статье АРП этого вида составляет всего лишь 133–336 яиц, что явно занижено по отношению к возможной реальной АРП.
Значительно продуктивнее подход Судник (2017), которая подразделила креветок по их репродуктивным стратегиям на два типа в зависимости от уровня заботы о потомстве: со слаборазвитым (I тип – инфраотряд Dendrobranchiata) и хорошо развитым уровнями заботы о потомстве (II тип – инфраотряд Pleocyemata, к которому относится и семейство Alpheidae). Креветки внутри этого типа подразделяются на классы в зависимости от морфологии и анатомии гонад, особенностей распределения в гонадах ооцитов на разных стадиях их созревания, абсолютной индивидуальной плодовитости, абсолютной реализованной плодовитости и, наконец, абсолютному и относительному диаметру преднерестовых ооцитов. Именно эти последние параметры репродуктивных стратегий (коэффициент относительного размера ооцитов – КОРЗО) являются предметом обсуждения в нашей статье. КОРЗО выражается в процентах большого диаметра зрелого ооцита от максимальной длины самки.
Исходя из вышесказанного, Судник (2017, стр. 449) внутри типа II выделила следующие классы (цитирую): “2.1. K-стратеги с тенденцией к r-стратегии (K-r): КОРЗО 0.38–1.17%; 2.2. Средневыраженные K-стратеги (K): КОРЗО 1.2–2.4%. 2.3. Сильно выраженные (экстремальные) K-стратеги (KK): КОРЗО 1.5–5.6%. 2.4. Смена K-r-стратегии на r-стратегию (отказ от заботы о потомстве) (гидротермальные Alvinocarididae): КОРЗО около 0.9–1.5%”.
Креветки из рода Alpheus в круг исследованных С.А. Судник видов не попали. Это дало нам возможность искать их место в классификации репродуктивных стратегий. К сожалению, ооциты, выделенные нами из гонад во время макроскопического исследования, очень сильно деформированы при фиксации формалином и их измерение неточно. Поэтому мы использовали для сравнения относительную длину только что отложенных яиц, с поправкой на то, что диаметр яйца больше зрелых ооцитов (табл. 1). Виды креветок, относительная длина яиц которых была использована для сравнения с таковой у A. lobidens, выбраны практически случайно. Их круг, к сожалению, довольно узкий, был ограничен доступной нам литературой.
Таблица 1.
Сравнительная характеристика относительных размеров только что отложенных яиц у некоторых видов рода Alpheus
| Вид рода Alpheus |
Ареал | Максимальная общая длина, мм |
Большой диаметр яйца, мм | Относительная длина яйца, % | Источник |
|---|---|---|---|---|---|
| lobidens De Haan 1849 |
Индо-Вестпацифика | 59 | 0.6 | 1.0 | Наши данные |
| euphrosyne De Man 1897 |
Индо-Вестпацифика | 45 | 0.5 | 1.1 | Yeo, Ng, 1996 |
| formosus Gibbes 1850 |
Троп. Зап. Атлантика | 27 | 0.5 | 1.8 | Anker, 2001 |
| heterochaelis Say, 1818 |
Троп. Зап. Атлантика | 55 | 1.75 | 3.2 | Ratliff, 2014 |
| cyanoteles Yeo et Ng 1996 |
Малайзия, пресноводный |
46 | 1.5 | 3.2 | Yeo, Ng, 1996 |
| schmitti Chace 1972 |
Троп. Зап. Атлантика | 20 | 0.7 | 3.9 | Anker, 2001 |
| paracrinitus Miers 1881 |
Пантропический | 17.4 | 0.68 | 3.9 | Anker, 2001 |
| paludicola Kemp 1915 |
Озеро Чилка, Индия | 22 | 1.3 | 5.9 | Yeo, Ng, 1996 |
| malleodigitus (Bate 1888) |
Индо-Вестпацифика | 12.5 | 0.9 | 7.2 | Anker, 2001 |
| alcyone De Man 1902 |
Индо-Вестпацифика | 11 | 1.4 | 7.8 | Anker, 2001 |
Среди видов, выбранных нами для сравнения, были обитатели литорали в манграх, эстуариях, между камней, в песке и илу: A. lobidens, A. formosus и A. heterochaelis (Anker, 2001). Кроме них попались литоральные-сублиторальные виды, тяготеющие к мертвым и живым кораллам, роющие в них туннели, демонстрирующие некоторые признаки симбиоза с живыми кораллами, с седентарными полихетами (A. schmitti, A. malleodigitatus, A. paracrinitus – по: Anker, 2001). Еще два вида (A. paludicola, A. cyanoteles) перешли к обитанию в пресных водах. Первый живет в солоноватоводной лагуне Чилка (Индия, штат Орисса), соединяющейся с океаном, а второй – в мелководных пресных потоках п-ова Малайзия и севера о-ва Борнео (Yeo, Ng, 1996).
Наконец, A. alcyone живет в губках и мертвых кораллах, а также совместно с полипоидом Stephanoscyphus racemosus (Scyphozoa, Cnidaria), а A. saxidomus – в базальтовых скалах, в которых ухитряется сверлить для себя норы (Anker, 2001).
У упомянутых выше креветок рода Alpheus относительные размеры только что отложенных яиц варьируют от вида к виду от 1.0 до 8.3% (табл. 1), т.е. перекрывая КОРЗО всех классов, выделенных Судник (2017), не считая, конечно, гидротермальных креветок. Альфеусы, на основании данных табл. 1, образуют три группы: 1 – A. lobidens, A. euphrosyne и A. formosus, с коэффициентами 1.0–1.8% (их можно считать представителями класса K-стратегов с тенденцией к r-стратегии), 2 – A. schmitti, A. malleodigitatus, A. paracrinitus, A. heterochaelis с коэффициентами 3.2-3.9% (представители класса средневыраженных K-стратегов), а также: 3 – A. paludicola, A. cyanoteles, A. alcyone и A. saxidomus с коэффициентами 5.9–8.3% (ярко выраженные экстремальные K-стратеги или KK).
Следовательно, креветки рода Alpheus по ширине спектра их репродуктивных стратегий превосходят всех прочих креветок (не считая гидротермальных Alvinocarididae), т.к. они имеют все переходы от K-r– стратегии к стратегиям K и KK (по: Судник, 2017).
Нам неизвестны другие работы, в которых описывали бы популяционную плодовитость креветок. Они, вероятно, просто отсутствуют так же, как сравнимые с нашей работы по исследованию плодовитости креветок рода Alpheus. Поэтому нам не с чем сравнить наши результаты. На данном этапе изученности этой проблемы мы просто хотели бы обратить внимание на то, что, во-первых, разделение всех самок на две неравнозначные по величине группы – массовые летненерестящиеся и относительно немногочисленные зимненерестящиеся – приводит к тому, что из-за разной величины АРП у каждой из этих групп они делают практически одинаковый вклад в популяционный пул яиц. А, во-вторых, летом это впервые и вторично нерестящиеся самки, существенная часть которых гибнет по тем или иным причинам. В зимний же период яйца на плеоподы откладывают не просто более плодовитые самки. Это выжившие особи, прошедшие через сито естественного отбора, что не может не сказаться на качестве оставляемого ими потомства.
Список литературы
Буруковский Р.Н., 1992. Методика биологического анализа некоторых тропических и субтропических креветок // Промыслово-биологические исследования морских беспозвоночных. М.: ВНИРО. С. 77–84.
Буруковский Р.Н., 1998. О биологии креветки Acanthephyra purpurea A. Milne-Edwards 1881 (Decapoda, Natantia, Oplophoridae) // Бюллетень Московского общества испытателей природы. Отд. биол. Т. 103. № 6. С. 17–25.
Буруковский Р.Н., 2012. Глубоководные креветки семейства Nematocarcinidae: история изучения, систематика, географическое распространение, биологическая характеристика. СПб.: Проспект Науки. 288 с.
Буруковский Р.Н., Андреева В.М., 2010. О географическом распространении, батиметрическом распределении и биологии креветки Acanthephyra pelagica (Risso 1816) (Decapoda, Oplophoridae) // Journal Siberian Federal University. Biology. V. 3. № 3. P. 303–321.
Буруковский Р.Н., Ансари З., Махсюдлю А., 2017. Морфология креветки Alpheus lobidens De Haan, 1849 с литорали Оманского моря (Иран) // Известия КГТУ. № 45. С. 72–82.
Буруковский Р.Н., Ансари З., Махсюдлю А., 2018. Состав пищи у креветки Alpheus lobidens De Haan, 1849 (Decapoda: Crustacea: Alpheidae) с литорали Оманского моря // Invertebrate zoology. 15(4). P. 383–401.
География Ирана, 2016. [Электронный ресурс]. Режим доступа: https://ru.wikipedia. org/wiki. Дата обновления: 04.12.2016
Козлов В.И., Абрамович Л.С., 1982. Краткий словарь рыбовода. М.: Россельхозиздат. 160 с.
Робинсон М.К., 1974. Аравийское море // Океанографическая энциклопедия. Л.: Гидрометеоиздат. С. 22–25.
Сафьянов Г.А., 1996. Геоморфология морских берегов. М.: МГУ. 400 с.
Судник С.А., 2017. Эволюционные аспекты репродуктивных стратегий креветок // Ученые записки Казанского университета. Серия естественных наук. Т. 159. Кн. 3. С. 443–454.
Anker A., 2001. Taxonomie et évolution des Alpheidae (Crustacea: Decapoda). Thèse pour l’obtention du grade de Docteur. Fasc. II. Paris: Muséum National d’Histoire Naturelle. 365 p.
Chiffings A.W., 1995. Arabian Seas. A global representative system of Marine Protected Areas // Kelleher G., Bleakley C., Wells S. (eds). Central Indian Ocean, Arabian Seas, East Africa and East Asian Seas. Great Barrier Reef Marine Park Authority. International Union for Conservation of Nature/World Bank 3. P. 39–70.
Corey S., Reid D.M., 1991. Comparative fecundity of decapod crustaceans. I. The fecundity of thirty-three species of nine families of caridean shrimp // Crustaceana. № 60. P. 270–294.
Dabbagh A.-R., Kamrani E., Taherzadeh M.R., 2012. Studies on Social Monogamy in the Snapping Shrimp, Alpheus lobidens De Haan, 1849 // Asian Journal of Animal and Veterinary Advances. V. 7. № 4. P. 361–365.
De Grave S., Fransen C.H.J.M., 2011. Carideorum catalogus the recent species of the dendrobranchiate, stenopodidean, procarididean and caridean shrimps (Crustacea, Decapoda) // Zoologische Mededelingen. V. 85. № 9. Leiden: NCB Naturalis. P. 195–588.
Fatemi M.R., 2006. Ecology of Oman Sea // Publication Department of Environment. Iran. 16 p.
Ratliff S., 2014. “Alpheus heterochaelis” (Online), animal diversity web [Электронный ресурс] Режим доступа: http://animaldiversity.org/accounts/Alpheus_heterochaelis. Дата обновления: 20.02.2017
Taheri M., Foshtomi Y., Bagheri H., 2010. Community structure and biodiversity of intertidal sandy beach macrofauna in Chabahar Bay, Northeast of Oman Gulf, IR Iran // Journal Persian Gulf. P. 19–25.
WORMS register of Marine species. 2019. Alpheus Fabricius, 1798. [Электронный ресурс] http://www.marinespecies.org/aphia.php?p=taxdetails&id=106978. Дата обновления: 17.03.2019
Yeo D.C.G., Ng P.K.L.N., 1996. A new species of freshwater snapping shrimp, Alpheus cyanoteles (Decapoda: Caridea: Alpheidae) from peninsular Malaysia and a redescription of Alpheus paludicola Kemp, 1915 // The Raffle Bulletin Zoology. V. 44. № 1. P. 37–63.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал