Зоологический журнал, 2020, T. 99, № 3, стр. 243-252
Материалы по фауне и экологии коловраток Урала. Семейство Brachionidae (Rotifera, Eurotatoria, Ploima). Рода Kellicottia, Plationus, Platyias
А. Г. Рогозин *
Ильменский государственный заповедник
456317 Челябинская обл., Миасс, Россия
* E-mail: rogozin57@gmail.com
Поступила в редакцию 03.04.2019
После доработки 25.05.2019
Принята к публикации 31.05.2019
Аннотация
Обобщен материал по распространению на Урале коловраток (Rotifera) из семейства Brachionidae родов Kellicottia, Plationus и Platyias на основе исследований автора и анализа литературных источников. Указаны места находок, приведены данные по морфологии, биологии, количественному развитию и индикаторным свойствам видов в водоемах Урала.
Настоящая работа – завершение обобщения материала по коловраткам семейства Brachionidae на Урале. В предыдущих работах были рассмотрены рода Anuraeopsis, Brachionus, Notholca, Keratella на основе исследований автора и анализа литературных источников. Мы продолжаем сведение в единое целое накопленных за столетие данных по фауне и экологии коловраток Урала на основе материалов, опубликованных в период с 1910 г. по настоящее время, а также собственных данных автора, полученных на водоемах Южного Урала и Зауралья.
По тем видам, по которым у нас было достаточно количественных данных для расчетов, приведена индивидуальная индикаторная значимость, характеризующая особенности биологии видов (отношение к температуре воды (Рогозин и др., 2015), сапробности (Рогозин, 2018) и трофическому типу водоема (Рогозин, 2018а)). Полученные на местном материале, эти данные наиболее объективны в региональных географических условиях. В случае отсутствия подобных сведений использованы литературные данные, применимость которых, конечно, ограничена.
Род Kellicottia Ahlstrom 1938. В роде два вида, из которых в Палеарктике известен один (K. bostoniensis Rousselet 1908 – инвазивный североамериканский вид, на Урале пока не обнаружен).
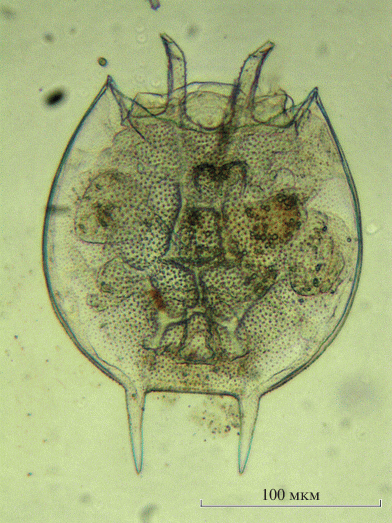
Kellicottia longispina (Kellicott 1879) (рис. 1; 2a)
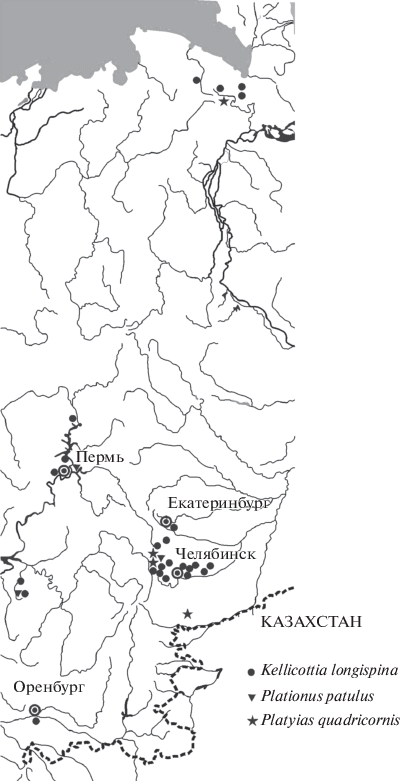
Рис. 1.
Карта-схема распространения на Урале Kellicottia longispina (Kellicott 1879), Plationus patulus (Müller 1783) и Platiyas quadricornis (Ehrenberg 1832).
Один из первых видов коловраток, найденных в водоемах Урала. В самом начале 20 века был обнаружен в южноуральском оз. Тургояк (Щелкановцев, 1903). Вскоре K. longispina нашли в других эрозионно-тектонических озерах восточных предгорий Уральского хребта – Акакуль, Алабуга, Б. Кисегач, Увильды (Фурман, Тиебо, 1910). В настоящее время широко известен из всех исследованных предгорных озер Южного Урала, из озер предлесостепного Зауралья (Кундравинское – Козлова, 1966; Чебаркуль – Подлесный, Троицкая, 1941), водохранилищ на р. Миасс (Козлова, Шилкова, 1966; Огородникова, 1977), в р. Урал в районе Оренбурга (Муравейский, 1923), в водоемах западного макросклона Южного Урала (Рогозин, 2007). На Среднем Урале неоднократно обнаружен в р. Кама, реках и озерах ее бассейна, в оз. Песчаное в окрестностях Екатеринбурга (Таусон, 1934, 1936 и др.). Распространен вплоть до Полярного Урала, где встречается в бассейнах рек Кара (Богданова, 2003) и Малая Обь (Богданов и др., 2004, форма K. longispina taymirica Grese 1955). Один из наиболее широко распространенных на Урале видов коловраток. Согласно нашим данным, общая длина панциря колеблется от 585 до 790 мкм, длина туловища – от 100 до 163 мкм. Длина шипов: боковых спинных 120–158, центрального длинного 200–282, центрального короткого 28–32, промежуточных 16–20, заднего 190–276 мкм.
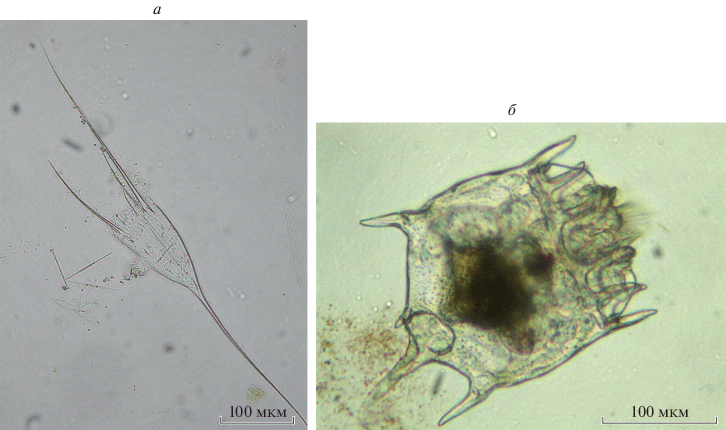
Рис. 2.
Брахиониды из уральских водоемов: a – Kellicottia longispina (Kellicott 1879) из оз. Большое Миассово, б – Plationus patulus (Müller 1783) из Миньярского пруда на р. Сим.
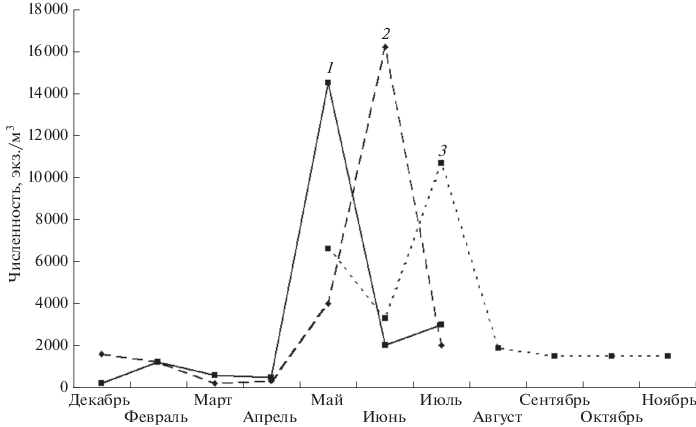
Kellicottia longispina встречается чаще в холодноводных глубоких озерах, нежели в мелких хорошо прогреваемых. Это объясняется относительной криофильностью вида (индивидуальный термоиндекс 1.1), хотя по отношению к термическому фактору он очень терпим и может встречаться и в прогретых водах. Для него получен довольно низкий индекс стено–/эвритермности (SEI = 2.0; стенотермные виды имеют SEI более 2.5). Например, Галковская (Galkovskaja, 1987) указывает, что K. longispina сохраняется в планктоне и при 29°С. Мнение о стенотермности K. longispina, встречающееся в литературе (например, Jersabek, Bolortsetseg, 2010), можно считать преувеличенным. Несмотря на высокую в целом встречаемость в планктоне (до 90% в некоторых озерах – Огородникова, 1977), согласно литературным данным редко достигает высокой численности, обычно на уровне 1–7 тыс. экз./м3 (Грезе, Карпова, 1941; Рогозин, 1995 и др.). Максимальная отмеченная нами численность K. longispina – 290 тыс. экз./м3 (залив оз. Б. Миассово в восточных предгорьях Южного Урала, май 2003 г.). В качестве примера типичной сезонной динамики и уровня развития K. longispina в уральских озерах приведем сводные данные по предгорным олиготрофным южноуральским озерам Большой Кисегач, Большое Миассово и Тургояк (рис. 3). Прежде всего, отметим, что K. longispina встречается в планктоне круглогодично. Численность вида большую часть года стабильна и не превышает 2 тыс. экз./м3. Весной и в начале лета K. longispina дает резкую вспышку численности, которая быстро сходит на нет по мере прогрева воды до максимальных значений. В холодноводном оз. Тургояк пик численности может приходиться даже на июль. Впрочем, температурный фактор вряд ли имеет большое значение для динамики плотности популяции коловратки.
Рис. 3.
Сезонная динамика средневзвешенной численности Kellicottia longispina в озерах Южного Урала Большое Миассово (1), Большой Кисегач (2), Тургояк (3).
Пик численности K. longispina весной был отмечен многими исследователями и, скорее всего, связан с особенностями питания и конкуренцией с другими коловратками, ракообразными и с хищничеством. Kellicottia longispina – один из немногих видов, способных эффективно потреблять бактериопланктон и мелкие безжгутиковые водоросли наряду с Keratella cochlearis и Conochilus unicornis (Bogdan, Gilbert, 1987). С учетом того, что сход ледяного покрова (и массовое поступление биогенных веществ и органики в воду) наблюдается на глубоких озерах Южного Урала в середине–конце мая, весенне-летний период наиболее благоприятен для эвритермных и криофильных коловраток–детритофагов в пищевом отношении. Влияние доминирующего вида K. cochlearis на K. longispina может быть проиллюстрировано рис. 4а, который отражает зимне-весенне-летнюю динамику этих видов в оз. Большое Миассово. Начало роста обилия K. longispina совпадает с резким падением численности керателлы. Хищная коловратка Asplanchna priodonta (рис. 4b), выедает керателлу, но на хорошо защищенную длинными шипами Kellicottia подобного влияния не оказывает. Похожая картина взаимоотношений этих трех видов коловраток была описана для северогерманского оз. Pluβsee (Hofmann, 1987). Единственный в годовой динамике пик развития K. longispina и в последующем невысокая численность вида определяются, вероятно, дальнейшей неуспешной конкуренцией за пищевые ресурсы с кладоцерами и K. cochlearis, как, например, показал Грюндстрём (Grundström, 1987). В ряде случаев вспышка численности K. longispina может наблюдаться не только весной и в начале лета, но и в конце зимы, причем дальнейший спад может быть связан и с внутрипопуляционными причинами (Threlkeld, 1983).
Рис. 4.
Динамика численности, экз./м3Kellicottia longispina (1), Keratella cochlearis (2) и Asplanchna priodonta (3) в оз. Б. Миассово: а – Kellicottia longispina и Keratella cochlearis, б – Keratella cochlearis и Asplanchna priodonta.
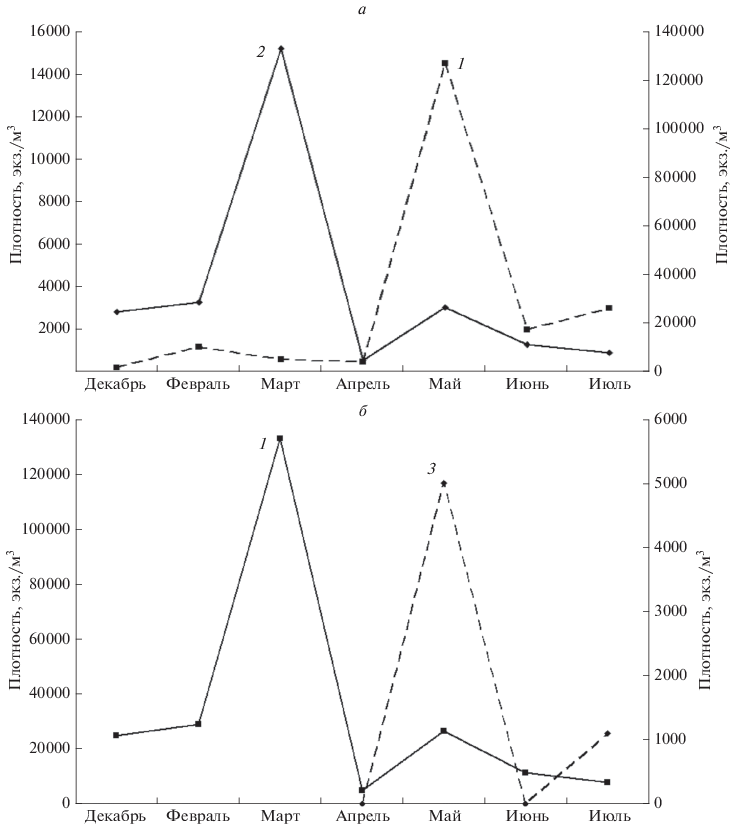
Свою роль может играть и конкуренция с коловратками, питающимися более крупными водорослями в летне-осеннее время (Synchaeta, Polyarthra vulgaris, см. Rublee, 1992). Во всяком случае, именно такой тип сезонной динамики K. longispina преимущественно наблюдается в олиготрофных и мезотрофных озерах Урала. Имеются, однако, указания на массовое развитие вида осенью, например, в сентябре (олиготрофное оз. Тургояк – Грезе, Карпова, 1941). Такое же явление мы наблюдали в политрофном оз. Малый Теренкуль, где численность K. longispina в 2015 г. постепенно увеличивалась от 130 экз./м3 в марте, до 600 в мае, 4.5 тыс. в июне и 48 тыс. экз./м3 в сентябре. В эвтрофном Аргазинском водохранилище численность K. longispina вообще примерно одинакова и в течение года, и по всей акватории и колеблется в пределах 0.5–2 тыс. экз./м3, такие же сведения приводят и Козлова, Шилкова (1966). В минерализованном эвтрофном оз. Смолино мы находили K. longispina начиная с июля, когда наблюдался максимум численности (5 тыс. экз./м3), в последующие месяцы до периода ледостава вид встречался при обычной численности около 1.2 экз./м3. Таким образом, сезонная динамика численности K. longispina в уральских водоемах в целом однотипна и характеризуется единственным и очень большим пиком численности в течение года. Этот пик свойствен преимущественно весне и началу лета, однако его положение в течение года может меняться, что определяется, видимо, как типологией водоема, так и специфическими условиями года. Известны случаи, когда K. longispina дает два пика численности (весной и в конце лета), например, в оз. Глубоком в Московской обл. (Matveeva, 1987).
Вертикальное распределение K. longispina мы наблюдали в 2007–2008 гг. в оз. Большое Миассово, имеющем наибольшую глубину в 21 м. В апреле, подо льдом, наибольшее развитие вид имеет на горизонте 15 м. В мае после схода льда, а также иногда в июне K. longispina концентрируется преимущественно в верхнем пятиметровом слое воды. В последующем максимальная численность обычно отмечается на глубине 10 м и остается на этом горизонте до начала осени. Примечательно, что в 2007 г, K. longispina в теплое время года не встречалась выше, а в 2008 – ниже 10 м. В конце осени K. longispina может попадаться на всех горизонтах водной толщи, т.е. для распределения вида по вертикали температурный и кислородный факторы не имеют значения. Согласно некоторым литературным данным для K. longispina характерно относительно равномерное распределение по водной толще (Primicerio, 2000) или приуроченность к гиполимниону (Yamamoto, 1959). Некоторые авторы считают, что вид избегает прогрева воды и опускается летом в более глубокие слои (Вецлер, 2008; Собакина, Соломонов, 2013).
Обобщая данные по отношению K. longispina к трофности водоемов, вид следует считать эврибионтным мезотрофом, т.е. приуроченным преимущественно к мезотрофным условиям при довольно широком диапазоне предпочитаемой трофности (трофическая индикаторная значимость вида по нашим данным – 1.0, SEI = 2.01). Как показано выше, вид развивается успешно как в олиго-, так и эвтрофных озерах и водохранилищах. Это, в общем, согласуется с данными других исследователей (Jersabek, Bolortsetseg, 2010). Некоторые специалисты считают его индикатором олигомезотрофных условий (Haberman, Halnda, 2014).
Согласно нашим материалам сапробная индикаторная значимость K. longispina 1.3. Это значение что согласуется с данными европейских исследователей (Sladeček, 1983) и показывает, что вид является олигосапробом с невысоким индикаторным весом (3.55). По отношению к солености эвригалинность вида (Jersabek, Bolortsetseg, 2010) в основном подтверждается нашими исследованиями: в солоноватых озерах нередко многочислен (например, свыше 15 тыс. экз./м3 в оз. Селезян при солености 1.7‰). В соленых озерах с минерализацией выше 2‰ он никогда не встречался в наших пробах.
Kellicottia longispina – одна из обычнейших планктонных коловраток, встречающаяся в России повсеместно. Распространение вида голарктическое.
Род Plationus Segers, Murugat et Dumont 1993. Из трех известных видов рода все встречаются в Палеарктике, но пока только один известен на территории России.
Plationus patulus (Müller 1783) (рис. 1; 2б)
Первая находка на Урале сделана Опариной (1923) в оз. Источном в окрестностях Перми. На Южном Урале (строго говоря, уже вне его западных пределов) P. patulus обнаружен впервые в р. Урал (Акатова, 1954). В дальнейшем он (в виде типичной формы) был встречен в восточных предгорьях Южного Урала (бассейн оз. Большое Миассово – Рогозин, 1995), а также на его западном склоне (Миньярский пруд на р. Сим – Рогозин, 2007). По нашим данным, длина панциря 200–216, ширина 110–125 мкм, длина передних центральных спинных шипов 40–44, промежуточных 30–35, боковых 30–36 мкм, длина задних боковых шипов 30–41, малого центрального 8–10, большого центрального 24–36 мкм.
Согласно литературным данным P. patulus приурочен к бентосным и перифитонным местообитаниям, изредка попадается в планктоне. Нам он встречался в зарослях погруженных макрофитов, тростника, фонтиналиса на мелководье рек и стоячих водоемов. Согласно литературным данным P. patulus – эвритермный вид, переносит диапазон от 12 до 40°С (Arora, 1966; Jersabek, Bolortsetseg, 2010), однако в определенных пределах – при температуре воды ниже 15 и выше 32°С температурный фактор становится основным, регулирующим численность популяции, по крайней мере, при низкой обеспеченности пищевыми ресурсами (Sarma, Rao, 1990). Наши исследования показывают, что в природных условиях Урала P. patulus – стенотермобионт (термоиндекс 2.3, SEI 4.05), это не противоречит приведенным выше данным – прогрев воды до более чем 25°С встречается в озерах умеренных широтах редко и коловратка явно предпочитает верхние пределы оптимальных температур.
По одним данным, P. patulus предпочитает эвтрофные воды и устойчив к низкому содержанию растворенного кислорода (например, Jersabek, Bolortsetseg, 2010), по другим данным он приурочен к олиго- и мезотрофным водам (например, Perbiche-Neves et al., 2013). Можно предположить, что вид эврибионтен, либо его свойства меняются в разных природных зонах. Наши данные показывают, что коловратка приспособлена к широкому диапазону трофности водоемов, формально является мезотрофом (индивидуальный трофический индекс 1.0), но распределена почти равномерно по всем зонам от олиго- до эвтрофной и имеет низкий индекс стено/эврибионтности (2.08). Для P. patulus характерна хорошая устойчивость к высокому содержанию в воде гуминовых веществ (Pejler, Bērziņš, 1989).
Отнесен к галофобам (Rico-Martinez, 1998), что, однако, можно считать спорным. Например, при исследовании озер северного Казахстана P. patulus был обнаружен как в пресных, так и в соленых (минерализация 2.9 г/дм3) озерах (Ермолаева, 2013). По данным Сладечека (Sladeček, 1983) – бетамезосапроб.
Количественных данных об обилии P. patulus в водоемах Урала немного. В Миньярском пруду на р. Сим численность популяции составляла 1 тыс. экз./м3 (Рогозин, 2007), в оз. Савелькуль (восточные предгорья Ильменских гор) – 6 тыс. экз./м3 (неопубликованные данные автора), в р. Караганке (приток р. Урал) – 800 экз./м3 (неопубликованные данные автора). “В массе” вид встречался в зарослях макрофитов р. Няшевка (Рогозин, 1995), впадающей в оз. Большое Миассово (восточные предгорья Ильменских гор). Согласно литературным источникам коловратка может быть очень многочисленной (например, популяция в индийском пруду достигала 1.2 млн экз./м3 (Vanjare, Pai, 2013).
Животное питается одноклеточными водорослями и детритом, часто прикрепляясь к субстрату слизистыми тяжами (Hampton, Gilbert, 2001). Среди других видов P. patulus отличается способностью успешно потреблять цианобактерии (например, доля клеток Microcystis aeruginosa в общем отфильтрованном коловраткой объеме может достигать 75% – Pérez-Morales et al., 2014). При этом отмечено отрицательное действие токсинов цианобактерий на популяционные показатели P. patulus (Barrios et al., 2015; Lin et al., 2014). Численность популяции регулируется беспозвоночными хищниками – планктонными коловратками рода Asplanchna (Gilbert, 2001) и обитателями фитали – турбелляриями (Nandini et al., 2011), насекомыми (Hampton, Gilbert, 2001), причем пресс хищников приводит к удлинению шипов панциря. Любопытно, что присутствие хищников, например, Asplanchna sieboldi может стимулировать рост популяции P. patulus в химически загрязненных водах (Sarma et al., 2009).
Plationus patulus широко используется в экотоксикологических экспериментах и демонстрирует хорошую устойчивость к ионам тяжелых металлов, в том числе к их кумулятивному воздействию (Ríos-Arana et al., 2007; Sarma et al., 2008 и др.). Тем не менее, этот вид ни разу не был нами встречен в загрязненных водах в зоне импакта Карабашского медеплавильного комбината (Южный Урал).
Вид имеет всесветное распространение, в России известен повсеместно. При этом в водоемах Урала встречается редко. Причиной может быть слабая изученность литоральной зоны, в частности фитали – основного биотопа, в котором обитает P. patulus. Большинство работ уральских гидробиологов было посвящено эупланктонным сообществам, поэтому при более углубленном изучении прибрежной зоны водоемов можно ожидать гораздо большее число находок этого вида. Также можно предполагать нахождение этого вида в техногенно загрязненных и антропогенно эвтрофированных водоемах, которые на Урале до сих пор мало охвачены гидробиологическими исследованиями.
Род Platiyas Harring 1913. Из трех видов рода в Палеарктике и на территории России известен только один.
Platiyas quadricornis (Ehrenberg 1832) (рис. 1; 5)
Впервые встречен в степном оз. Сары (Саруй) в окрестностях одноименного сельского поселения Троицкого р-на Челябинской обл. (Зиновьев, 1931). В дальнейшем несколько раз попадался в озерах и речках восточных предгорий Южного Урала в районе г. Миасс (Рогозин, 1995), а также в лесостепном оз. Мисяш (неопубликованные материалы А.О. Таусон). Последняя по времени находка – в притоках нижней Оби на Полярном Урале (Богданов и др., 2004). Во всех случаях отмечена типичная форма quadricornis. По нашим данным, длина панциря 180–253, ширина 120–148 мкм, длина передних шипов 42–50, задних 40–48 мкм.
Ввиду малочисленности находок мы не можем охарактеризовать экологические свойства вида на Урале. Его местообитания приурочены к зарослям макрофитов в прибрежной зоне водоемов, в том числе текучих и временных, к заросшим водоемам и озерным дериватам, встречается в перифитоне, среди открытой воды обнаруживается редко (Duggan, 2001). Согласно литературным данным предпочитает теплые воды (Jersabek, Bolortsetseg, 2010), однако имеются данные об отрицательной корреляции численности P. quadricornis с температурой воды (Athibai et al., 2013; Sharma, 2010). В водоемах Урала P. quadricornis обнаруживался только в теплое время года, в середине–конце лета на мелководьях при максимальном прогреве воды, что соответствует мнению о его термофильности. Устойчив к низкой концентрации O2 (Pejler, Bērziņš, 1989), но все же предпочитает воды, хорошо снабженные кислородом (Sharma, 2010). Численность P. quadricornis положительно коррелирует с жесткостью, щелочностью воды и высоким содержанием фосфатов (Gutiérrez et al., 2017; Sharma, 2010). Как ß-мезосапроб (Sladeček, 1983) переносит умеренное органическое загрязнение воды. Исходя из таких биологических свойств можно было ожидать предпочтение P. quadricornis эвтрофных вод, что частично подтверждено специальными исследованиями (Dorak, 2013). Согласно нашим предварительным данным по уральским водоемам, P. quadricornis стенобионтный эвтроф (2.0).
Считается эвригалинным видом (Jersabek, Bolortsetseg, 2010), однако в одном и том же географическом районе гораздо чаще приурочен к пресным, нежели солоноватым водам (Baloch, Soomro, 2004).
По нашим данным, в заросшем заболоченном оз. Карасье в предгорьях Ильменского хребта на Южном Урале (окрестности г. Миасс) среди тростниково-осокового кочкарника он достигал численности 60.6 тыс. экз./м3 и биомассы свыше 0.19 г/м3. В заросшем прибрежье мезотрофного оз. Большое Миассово (восточные предгорья Ильменского хребта на Южном Урале в начале сентября – 8 тыс. экз./м3 и биомассы 0.015 г/м3, в середине сентября численность упала до 130 экз./м3. Численность 143 экз./м3 отмечена в прибрежных зарослях в олиготрофном оз. Тургояк (октябрь). Согласно глазомерным оценкам обилия в других водоемах встречался “редко” или “единично” (озера Бараус, Мисяш; Рогозин, 1995 и неопубликованные данные А.О. Таусон и автора). Наиболее часто встречающаяся в литературе оценка численности P. quadricornis – 400–1200, максимальная – 35 тыс. экз./м3 (Adeniyi, Adedeji, 2007; Saunders, Lewis, 1988 и др.).
Platiyas quadricornis встречается в России повсеместно, чаще всего в умеренных широтах. Имеет всесветное распространение.
Семейство Brachionidae представлено в фауне Урала 7 родами с 33 видами, из которых 13 приходится на род Brachionus и 10 – на род Keratella. Оба эти рода содержат наиболее широко распространенные и многочисленные в водах региона виды коловраток, такие как B. angularis, B. calyciflorus, K. cochlearis, K. quadrata, K. tecta. Брахиониды часто составляют основу зоопланктона по численности в течение всего годового цикла. Этому способствует то, что для этих видов характерно образование форм, приспособленных для обитания в разных условиях среды. Они населяют практически все типы исследованных на Урале водоемов – от глубоких олиготрофных до мелких гипертрофных озер и заболоченных озерных дериватов. Специфика изучения коловраток на Урале была такова, что большинство сведений получено об эупланктонных видах, обитателях пелагиали озер. Многие биотопы и типы водоемов были слабо охвачены или совсем не были охвачены гидробиологическими работами, не говоря уже о специальных исследованиях Rotifera. Вероятно, поэтому некоторые распространенные виды брахионид на Урале представляются редкими или были встречены единично. Можно не сомневаться, что в фауне Урала будут обнаружены Brachionidae, известные на данный момент в сопредельных регионах. Например, Brachionus forficula Wierzejski 1891 – теплолюбивый вид, известный из Западного Казахстана, в связи с изменением климата и потеплением уральских водоемов вполне может быть обнаружен на Южном Урале. Это же предположение можно сделать для субтропических видов B. bidentata Anderson 1889, B. budapestinensis Daday 1885 и B. falcatus Zacharias 1898, которые были найдены западнее Урала в южных регионах и распространились, доходя до географической широты Московской обл. (Кутикова, 1970), соответствующей широте Южного Урала, и даже севернее. Обнаружен в бассейне р. Урал, но пока за географическими пределами Урала и B. leydigii Cohn 1862. При более тщательном изучении болотистых водоемов может быть найден Plationus polyacanthus (Ehrenberg 1834), который известен как западнее (на европейской территории России), так и восточнее Урала (в Сибири). На западной границе Предуралья встречен Keratella mixta (Oparina-Charitonova 1925), который со временем, конечно же, будет обнаружен в заболоченных водоемах Южного Урала. Прудовой теплолюбивый вид K. tropica (Apstein 1907) известен из водоемов Северного Казахстана, и на фоне происходящих климатических изменений вполне вероятно его обитание на Южном Урале. Фауна многочисленных степных озер в этом регионе до настоящего времени фактически не изучена. Вероятно, произойдет инвазия в озера Урала североамериканского вида Kellicottia bostoniensis Rousselet 1908, который активно заселяет водоемы Поволжья (Жданова и др., 2016; Шурганова и др., 2017).
Следует констатировать, что фауна коловраток вообще и Brachionidae в частности обширного Уральского региона еще далеко не выявлена в приемлемом объеме. Настоящий цикл работ лишь закладывает основу для выявления биологического разнообразия брахионид и других Rotifera на Урале.
Работа сделана в рамках выполнения государственного задания Ильменского государственного заповедника ЮУ ФНЦ МИГ УРО РАН № 0432-2019-0001.
Список литературы
Акатова Н.А., 1954. Исследование зоопланктона р. Урала и некоторых водоемов поймы в районе дер. Январцево Западно-Казахстанской области // Труды Зоологического ин-та АН СССР. Т. 16. С. 517–531.
Богданова Е.Н., 2003. К изучению зоопланктона Полярного Урала (зоопланктон бассейна р. Кара) // Научный вестник. Биологические ресурсы Полярного Урала. Вып. 3. Ч. 2. Салехард. С. 23–29.
Богданов В.Д., Богданова Е.Н., Госькова О.А., Мельниченко И.П., Степанов Л.Н., Ярушина М.И., 2004. Биоресурсы водных экосистем Полярного Урала. Екатеринбург: УрО РАН. 168 с.
Вецлер Н.М., 2008. Сезонные изменения вертикального распределения зоопланктонных организмов в озере Дальнее (Камчатка) // Чтения памяти В.Я. Леванидова. Вып. 4. С. 208–223.
Грезе Б.С., Карпова К.И., 1941. О планктоне озера Тургояк // Труды Уральского отделения ВНИИОРХ. Т. 3. С. 175–205.
Ермолаева Н.И., 2013. Некоторые результаты исследования зоопланктона озер Северного Казахстана // Аридные экосистемы. Т. 19. № 4. С. 91–103.
Жданова С.М., Лазарева В. И., Баянов Н.Г. и др., 2016. Распространение и пути расселения американской коловратки Kellicottia bostoniensis (Rousselet, 1908 (Rotifera: Brachionidae) в водоемах Европейской России // Российский журнал биологических инвазий. № 3. С. 8–22.
Зиновьев А.П., 1931. Водоемы Троицкого лесостепного заповедника и их фауна (Copepoda и Phillopoda) // Труды Биологического научно-исследовательского ин-та при Пермском гос. ун-те. Т. 3. Вып. 4. С. 281–367.
Козлова И.В., 1966. Планктон озера Кундравинского // Труды Уральск. отд. СибНИИРХ. Т. 7. С. 77–83.
Козлова И.В., 1979. Зоопланктон Каслинской группы озер и его продукция // Сб. науч. трудов НИИ оз. и реч. рыб. х-ва. № 10. С. 118–124.
Козлова И.В., Шилкова Е.В., 1966. Планктон Аргазинского водохранилища // Труды Уральского отделения СибНИИРХ. Т. 7. С. 17–24.
Кутикова Л.А., 1970. Коловратки фауны СССР. Л.: Наука. 744 с.
Муравейский С.Д., 1923. Наблюдения над весенним планктоном реки Урала и его стариц // Русский гидробиологический журнал. Т. 2. С. 14–23.
Огородникова Е.М., 1977. Зоопланктон Шершневского водохранилища и его роль в оценке качества воды // Вопросы биогенного загрязнения и регулирования качества вод Урала. Красноярск: Изд-во СибНИИ гидротехники и мелиорации. С. 27–39.
Опарина Н.Я., 1923. К фауне коловраток окрестностей г. Перми // Труды Биологического научно-исследовательского ин-та при Пермском государственном ун-те. Т. 1. Вып. 9–10. С. 165–175.
Подлесный А.В., Троицкая В.И., 1941. Ильменские озера и их рыбохозяйственная оценка // Труды Уральского отделения ВНИИОРХ. Т. 3. С. 121–174.
Рогозин А.Г., 1995. Коловратки Челябинской области. Миасс: ИГЗ УрО РАН. 128 с.
Рогозин А.Г., 2007. О зоопланктоне водоемов западных предгорий Южного Урала (Миньярский пруд на реке Сим) // Известия Челябинского научного центра. Вып. 3. С. 75–79.
Рогозин А.Г., 2018. Виды зоопланктона – индикаторы сапробности в водоемах Урала // Вода: химия и экология. № 7–9. С. 103–109.
Рогозин А.Г., 2018а. О системе биоиндикации трофических условий в водоемах // Химия, физика, биология, математика: теоретические и прикладные исследования: Сборник статей по материалам XI–XII Международной научно-практической конференции “Химия, физика, биология, математика: теоретические и прикладные исследования”. № 5–6(6). М.: Интернаука. С. 10–15.
Рогозин А.Г., Снитько Л.В., Тимошкин О.А., 2015. Термоиндикаторные свойства видов зоопланктона и их измерение // Водные ресурсы. Т. 42. № 1. С. 85–91.
Собакина И.В., Соломонов Н.М., 2013. К изучению зоопланктона озера Большое Токко // Международный журнал прикладных и фундаментальных исследований. № 8 (часть 2). С. 180–182.
Таусон А.Г., 1934. Гидробиологический очерк озер верхней Камы // Труды Пермского биологического ин-та. Т. 6. Вып. 1–2. С. 103–118.
Таусон А.О., 1936. Гидробиологический очерк озер и рек Гаринского района Свердловской области и их рыбохозяйственная оценка // Уч. зап. Пермского гос. ун-та. Т. 2. Вып. 1. С. 85–165.
Фурман О., Тиебо М., 1910. Фауна некоторых озер Урала: Предварительная заметка // Труды Уральского о-ва любителей естествознания. Т. 30. С. 69–82.
Шурганова Г.В., Гаврилко Д.Е., Ильин М.Ю., Кудрин И.А., Макеев И.С., Золотарева Т.В., Жихарев В.С., Голубева Д.О., Горьков А.С., 2017. Распространение коловратки Kellicottia bostoniensis Rousselet, 1908 (Rotifera: Brachionidae) в водоемах и водотоках Нижегородской области // Российский журнал биологических инвазий. № 3. С. 122–133.
Щелкановцев П.Я., 1903. О некоторых озерах в бассейне р. Миасса (Южного Урала) // Землеведение. Т. 2–3. С. 48–73.
Adeniyi I.F., Adedeji A.A., 2007. The Rotifera fauna of Gongola river basin, northeast Nigeria // Ife Journal of Science. V. 9. № 1. P. 1–15.
Arora H.C., 1966. Responses of rotifera to variations in some ecological factors // Proceedings of the Indian Academy of Science, Section B. V. 63. P. 57–66.
Athibai S., Segers H.H., Sanoamuang L., 2013. Diversity and distribution of Brachionidae (Rotifera) in Thailand, with a key to the species // Journal of Limnology. V. 72. P. 345–360.
Baloch W.A., Soomro A.N., 2004. Planktonic Rotifers Occurring in the Adjacent Areas of Hyderabad // Pakistan Journal of Zoology. V. 36. Iss. 4. P. 319–322.
Barrios C., Nandini S., Sarma S., 2015. Effect of crude extracts of Dolichospermum planctonicum on the demography of Plationus patulus (Rotifera) and Ceriodaphnia cornuta (Cladocera) // Ecotoxicology. V. 24. Issue 1. P. 85–93.
Bogdan K.G., Gilbert J.J., 1987. Quantitative comparison of food niches in some freshwater zooplankton: A multitracer-cell approach // Oecologia. V. 72. P. 331–340.
Dorak Z., 2013. Zooplankton abundance in the lower Sakarya River Basin (Turkey): impact of environmental variables // Journal of the Black Sea / Mediterranean Environment. V. 19. P. 1–22.
Duggan I.C., 2001. The ecology of periphytic rotifers // Hydrobiologia. V. 466/467. P. 139–148.
Galkovskaja G.A., 1987. Planktonic rotifers and temperature // Hydrobiologia. V. 147. P. 307–317.
Gilbert J.J., 2001. Spine development in Brachionus quadridentatus from an Australian billabong: genetic variation and induction by Asplanchna // Developments in Hydrobiology. V. 153. P. 19–28.
Grundström R., 1987. Changes in the population dynamics of Keratella cochlearis (Gosse), Kellicottia longispina (Gosse) and Polyarthra vulgaris Carlin in a fertilized enclosure // Hydrobiologia. V. 147. P. 215–219.
Gutiérrez S.G., Sarma S.S.S., Nandini S., 2017. Seasonal variations of rotifers from a high altitude urban shallow water body, La Cantera Oriente (Mexico City, Mexico) // Chinese Journal of Oceanology and Limnology. V. 35. Iss. 6. P. 1387–1397.
Haberman J., Halnda M., 2014. Indices of zooplankton community as valuable tools in assessing the trophic state and water quality of eutrophic lakes: long term study of Lake Võrtsjärv // Journal of Limnology. V. 73. № 2. P. 263–273.
Hampton S.E., Gilbert J.J., 2001. Observations on insect predation on rotifers // Hydrobiologia. V. 446–447. P. 115–121.
Hofmann W., 1987. Population dynamics of hypolimnetic rotifers in the Pluss-see (North Germany) // Hydrobiologia. V. 147. P. 197–201.
Jersabek C.D., Bolortsetseg E., 2010. Mongolian rotifers (Rotifera, Monogononta) – a checklist with annotations on global distribution and autecology // Proceedings of the Academy of Natural Sciences of Philadelphia. V. 159. P. 119–168.
Lin Q., Sarma S.S.S., Nandini S., Han B.-P., 2014. Effect of cyanobacterium on competition between rotifers: a population growth study // Inland Waters. V. 4. P. 319–326.
Matveeva L.K., 1987. Pelagic rotifers of Lake Glubokoe from 1897 to 1984 // Hydrobiologia. V. 141. P. 45–54.
Nandini S., Sarma S.S.S., Dumont H.J., 2011. Predatory and toxic effects of the turbellarian (Stenostomum cf leucops) on the population dynamics of Euchlanis dilatata, Plationus patulus (Rotifera) and Moina macrocopa (Cladocera) // Hydrobiologia. V. 662. P. 171–177.
Pejler B., Bērziņš B., 1989. On choice of substrate and habitat in brachionid rotifers // Hydrobiologia. V. 186. P. 137–144.
Perbiche-Neves G., Fileto C., Laco-Portinho J., Troguer A., Serafim-Junior M., 2013. Relations among planktonic rotifers, cyclopoid copepods, and water quality in two Brazilian reservoirs // Latin american journal of aquatic research. V. 41. № 1. P. 138–149.
Pérez-Morales A., Sarma S.S.S., Nandini S., 2014. Feeding and filtration rates of zooplankton (rotifers and cladocerans) fed toxic cyanobacterium (Microcystis aeruginosa) // Journal of Environmental Biology. V. 35. № 6. P. 1013–1020.
Primicerio R., 2000. Seasonal changes in vertical distribution of zooplankton in an oligotrophic, subarctic lake (Lake Takvatn, Norway) // Limnologica. V. 30. P. 301–310.
Rico-Martinez R., 1998. Cross-mating tests re-discovered: a tool to assess species boundaries in rotifers // Hydrobiologia. V. 387/388. P. 109–115.
Ríos-Arana J.V., Walsh E.J., Ortiz M., 2007. Interaction effects of multi-metal solutions (As, Cr, Cu, Ni, Pb and Zn) on life history traits in the rotifer Plationus patulus // Journal of Environmental Science and Health Part A. V. 42. № 10. P. 1473–1481.
Rublee P.A, 1992. Community structure and bottom-up regulation of heterotrophic microplankton in Arctic LTER lakes // Hydrobiologia. V. 240. P. 133–141.
Sarma S.S.S., Brena-Bustamante P., Nandini S., 2008. Body size and population growth of Brachionus patulus (Rotifera) in relation to heavy metal (copper and mercury) concentrations // Journal of Environmental Science and Health Part A. V. 43. № 5. P. 547–553.
Sarma S.S.S., Nandini S., 2009. Effects of asplanchnin allelochemical on the toxicity of triasulphuron herbicide to rotifer Brachionus patulus (Rotifera: Brachionidae) // Allelopathy Journal. V. 23. № 2. P. 485–492.
Sarma S.S.S., Rao T.R., 1990. Population dynamics of Brachionus patulus Muller (Rotifera) in relation to food and temperature // Proceedings of the Indian Academy of Science. Animal Sciences. V. 99. № 4. P. 335–343.
Sharma B.K., 2010. Rotifer communities of Deepor Beel, Assam, India: richness, abundance and ecology // Journal of Threatened Taxa. V. 2. № 8. P. 1077–1086.
Saunders J.F., Lewis W.M., 1988. Zooplankton abundance in the Caura river, Venezuela // Biotropica. V. 20. № 3. P. 206–214.
Sladeček V., 1983. Rotifers as indicators of water quality // Hydrobiologia. V. 100. P. 169–201.
Threlkeld S.T., 1983. Empty loricas and the dynamics of Kellicottia longispina in a subalpine, oligotrophic lake // Hydrobiologia. V. 104. P. 367–372.
Vanjare A., Pai K. 2013. Ecology of freshwater Rotifera in a seasonal pond of the University of Pune (Maharashtra, India) // Applied Ecology and Environmental Research. V. 11. № 4. P. 525–539.
Yamamoto K., 1959. On the distribution of Kellicottia longispina (Kellicott) (Rotatoria) in Japanese lakes // Japanese Journal of Limnology. V. 20. P. 21–26.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал