Зоологический журнал, 2020, T. 99, № 6, стр. 670-683
Краниометрическая изменчивость обыкновенной бурозубки (Sorex araneus, Eulipotyphla) на северо-востоке европейской части России: оценка влияния разных факторов
А. В. Бобрецов a, b, *, А. Н. Петров b, **, Н. М. Быховец b, Н. А. Щипанов c, ***
a Печоро-Илычский государственный природный заповедник
169436 Якша, Россия
b Институт биологии Коми НЦ УрО РАН
167982 Сыктывкар, Россия
c Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Россия
* E-mail: avbobr@mail.ru
** E-mail: tpetrov@ib.komisc.ru
*** E-mail: shchipa@mail.ru
Поступила в редакцию 01.03.2019
После доработки 30.04.2019
Принята к публикации 19.05.2019
Аннотация
Для анализа краниометрической изменчивости обыкновенной бурозубки (Sorex araneus) на Северо-Востоке европейской части России использовано 613 черепов молодых животных из 10 локалитетов Республики Коми и Ненецкого автономного округа. Сравнение проводили по 16 признакам. Обсуждается роль разных факторов в формировании краниометрической изменчивости вида. Выявлена значительная межпопуляционная изменчивость размеров черепов. Морфологические дистанции (расстояние Махаланобиса) между выборками внутри расы часто превышают межрасовые. По ряду признаков показано своеобразие некоторых хромосомных рас. Значительный вклад в межпопуляционную изменчивость вносят широта и высота местности. В первом случае отмечено уменьшение размеров черепа землероек с юга на север, во втором случае − увеличение размеров черепа с высотой местности. Оценка вклада того или иного фактора осложняется тем, что разные факторы воздействуют в различных сочетаниях.
Для обыкновенной бурозубки (Sorex araneus L.) характерна значительная морфологическая изменчивость. Она обусловлена целым рядом факторов − климатическими условиями (температура и осадки), высотой местности, кариотипическими различиями, а также “изоляцией расстоянием”. Однако влияние их на краниометрические признаки часто оценивается неоднозначно.
Климатические факторы во многом определяют локальные и региональные различия в размерах землероек (Frafjord, 2008). По данным Мишты (Mishta, 2007), на эти факторы приходится около 60% всей краниометрической изменчивости обыкновенной бурозубки на Украине. Температурные эффекты лежат в основе известного экогеографического правила Бергмана, согласно которому размеры животных увеличиваются с юга на север в направлении понижения температуры воздуха (Clauss et. al., 2013). Это правило применимо для обыкновенной бурозубки Центральной Европы (Stefen, 2013), а также для некоторых видов североамериканских бурозубок (Huggins, Kennedy, 1989). Вместе с тем, среди землероек часто наблюдается и обратная тенденция: их размеры на севере меньше, чем в более южных регионах (Carraway, Verts, 2005; Ochocińska, Taylor, 2003; Polly, 2007; Щипанов и др., 2011; Vega et al., 2016).
Следствием правила Бергмана является также тенденция увеличения размера тела животных с высотой местности. Для землероек отмечена положительная корреляция длины черепа с высотой над уровнем моря (Homolka, 1980; Polly, 2007; Щипанов и др., 2011). Наиболее крупные черепа принадлежат землеройкам, обитающим в горах.
Наиболее спорным является вопрос о сопряженности морфологической и хромосомной изменчивости. Если подобная связь между ними существует, то она может существенно отражаться на влиянии широтных и высотных градиентов среды на размеры животных. В ряде работ отмечено, что между разными хромосомными расами обыкновенной бурозубки отсутствуют краниометрические различия (Meyer, Searle, 1994; Wojcik et al., 2000; Basset et al., 2006; Mishta, 2007; Крищук, 2017). В других исследованиях существование этих различий подтверждается. Они были обнаружены между семью хромосомными расами этого вида в России (Окулова и др., 2004). Определенная сопряженность морфологической и хромосомной изменчивости была выявлена у обыкновенной бурозубки на Северо-Востоке европейской части России (Бобрецов и др., 2012). Наиболее четкие краниометрические различия были найдены между двумя сибирскими хромосомными расами Томск и Новосибирск (Polyakov et al., 2002).
Часто разные факторы воздействуют на морфологию землероек одновременно, так что выделить влияние какого-то одного из них бывает очень сложно. Например, на Северо-Востоке европейской части России ареалы некоторых хромосомных рас вытянуты в широтном направлении, поэтому полученные морфологические различия могут быть объяснены как следствием влияния широты местности, так и кариотипическими особенностями животных. Сибирские хромосомные расы локализованы на разных высотах − раса Новосибирск на равнине, а раса Томск в горной части (Polyakov et al., 2003), что также затрудняет интерпретацию данных. Поэтому для получения адекватных выводов о влиянии отдельных факторов необходимо определенным образом организовать выборки из разных локалитетов.
Целью данной работы является анализ влияния широты местности и высоты над уровнем моря на краниометрическую изменчивость обыкновенной бурозубки на Северо-Востоке европейской части России. При этом учитывается кариотипическая дифференциация этого вида в регионе.
МАТЕРИАЛ И МЕТОДЫ
Для оценки морфологической изменчивости обыкновенной бурозубки в регионе проанализированы выборки из 10 локалитетов (рис. 1). Восемь из них расположены в пределах Русской равнины (на широтном отрезке от 61° до 68° с.ш.): тундра − Воркута, Ненецкий автономный округ (НАО) в районе Коровинской губы, северная тайга − Вожгора, Уляшово, средняя тайга − Малая Слуда, Сторожевск, Верхняя Пузла, Якша. Два размещены на Северном Урале − Гаревка, Яныпупунер. Характеристика локалитетов представлена в табл. 1. Принадлежность выборки к той или иной хромосомной расе указана по литературным данным (Щипанов и др., 2008; Pavlova, Shchipanov, 2018).
Рис. 1.
Места сбора материала. Локалитеты: 1 – Воркута (Республика Коми), 2 – НАО (Ненецкий автономный округ, Коровинская губа), 3 – Вожгора (Лешуконский р-н Архангельской обл.), 4 – Уляшово (Печорский р-н Республики Коми), 5 − Малая Слуда (Сыктывдинский р-н Республики Коми), 6 – Сторожевск (Усть-Куломский р-н Республики Коми), 7 – Верхняя Пузла (Усть-Куломский р-н Республики Коми), 8 – Якша (Троицко-Печорский р-н Республики Коми), 9 – Гаревка (Троицко-Печорский р-н Республики Коми), 10 – Яныпупунер (Троицко-Печорский р-н Республики Коми).
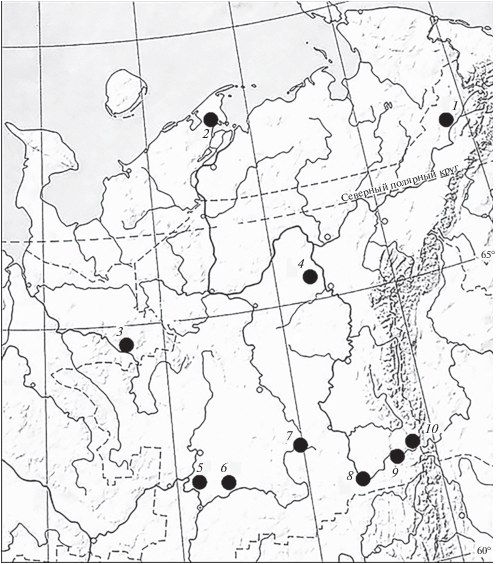
Таблица 1.
Объемы выборок, хромосомная раса и характеристика локалитетов
| № | n | Раса | Широта местности | Высота местности, м | Средняя температура года, °C |
Количество осадков за год, мм |
|---|---|---|---|---|---|---|
| 1 | 35 | Серов | 67°29′ | 202 | –6.8 | 417 |
| 2 | 95 | Не определена | 68°20′ | 10 | –3.8 | 438 |
| 3 | 33 | Печора | 64°32′ | 70 | –0.9 | 580 |
| 4 | 86 | Печора | 65°25′ | 60 | –2.3 | 543 |
| 5 | 47 | Сок | 62°01′ | 102 | +0.6 | 571 |
| 6 | 33 | Сок | 61°57′ | 121 | +0.4 | 594 |
| 7 | 25 | Сок | 62°26′ | 180 | –0.8 | 647 |
| 8 | 81 | Серов | 61°49′ | 122 | –0.7 | 675 |
| 9 | 90 | Серов | 62°03′ | 220 | –1.5 | 710 |
| 10 | 88 | Серов | 62°05′ | 518 | –2.0 | 880 |
Примечания. Номера и названия локалитетов приведены на рис. 1.
Использовано 613 черепов молодых зверьков (сборы августа–начала сентября). Анализ проводили без учета половой принадлежности. Судя по литературным данным, половые различия по краниометрическим признакам у бурозубок отсутствуют (Долгов, 1985; Mishta, 2007). Хотя в некоторых популяциях по ряду признаков они все же имеются (Балакирев, 2003; Wojcik et al., 2000; Nováková, Vohralík, 2017). Однако эта изменчивость в общей дисперсии этого вида на Урале невелика и составляет лишь 2.8%, что в 30 раз меньше размаха географических различий (Васильев, Шарова, 1992).
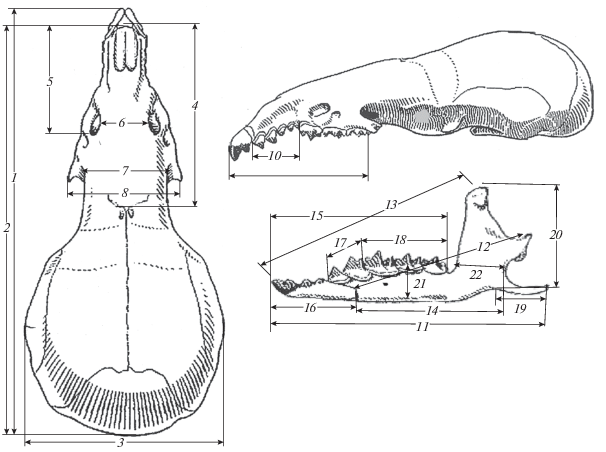
Краниометрическая изменчивость обыкновенной бурозубки оценивалась по 22 признакам черепа (рис. 2): 1 − общая длина черепа (ОДЧ) – расстояние от наиболее выступающей вперед до наиболее выдающейся назад точки черепа, 2 − кондилобазальная длина черепа (КБД) – расстояние от заднего края затылочной до переднего края верхнечелюстной кости, 3 − наибольшая ширина черепа (ШЧ), 4 − длина лицевой части черепа (ДЛЧ) – расстояние от переднего края надглазничных отверстий до переднего края верхнечелюстной кости, 5 − длина рострума (ДР) – расстояние от заднего края предглазничного отверстия до переднего края верхнечелюстной кости, 6 − предглазничная ширина (ПГШ) – наименьшее расстояние между назоорбитальными отверстиями, 7 − межглазничная ширина (МГШ) – наименьшая ширина лобных костей в глазничной области на границе с верхнечелюстной костью, 8 − скуловая ширина (СШ) – расстояние между наружными краями скуловых отростков верхнечелюстной кости, 9 − длина верхнего зубного ряда (ДВЗР) – наибольшая длина верхнего зубного ряда, 10 − длина верхнего ряда промежуточных зубов (ДВПЗ) – измерялась у основания зубов, 11 − длина нижней челюсти (ДНЧ) – расстояние от передней части нижнего резца до конца углового отростка, 12 − расстояние от основания резца нижней челюсти до вершины сочленовного отростка (РСО), 13 − расстояние от передней части резца нижней челюсти до вершины венечного отростка (РВО), 14 − длина основания нижней челюсти (ДОНЧ) – расстояние от основания нижнего резца до заднего края челюсти между угловым и сочленовным отростками, 15 − длина нижнего зубного ряда (ДНЗР) – наибольшая длина нижнего зубного ряда вместе с резцом, 16 − длина нижнего резца (ДНР), 17 − длина ряда нижних предкоренных зубов (ДНПЗ), 18 − длина ряда нижних коренных зубов (ДРКЗ), 19 − длина углового отростка нижней челюсти (ДУО), 20 − высота нижней челюсти (ВНЧ) – расстояние от вершины венечного отростка до нижнего края челюсти в области отхождения углового отростка (высота восходящей ветви нижнее челюсти), 21 − высота нижней челюсти в области коренных зубов (ВНЧК) – расстояние от основания второго коренного зуба до нижней части челюсти. 22 − ширина основания венечного отростка (ШВО).
Рис. 2.
Схема промеров черепа обыкновенной бурозубки. Обозначения признаков 1−22 приведены в тексте.
Для выявления различий между разными выборками по всем признакам применяли канонический дискриминантный анализ (Тюрин, Щеглов, 2015). При этом использовали пошаговую процедуру отбора признаков. Этот метод позволяет выделить наиболее информативные признаки и их сочетания. Достоверность обнаруженных различий оценивалась при помощи лямбда-критерия Уилкса. Степень различий между выборками (их центроидами) рассчитывалась на основе квадратов расстояния Махаланобиса, которые являются в данном случае обобщенными морфологическими дистанциями. Влияние внешних факторов на морфологическую изменчивость оценивалось с помощью однофакторного дисперсионного анализа (ANOVA). Предварительно проводилась проверка на нормальное распределение и гомогенность (однородность) дисперсий по критерию Левена. При множественных сравнениях применяли метод HSD для неравных размеров выборок. Достоверность результатов проверяли по F-критерию (частному от деления факториальной дисперсии на остаточную дисперсию). Для изучения эффектов влияния отдельных факторов на всю совокупность переменных применяли многомерный дисперсионный анализ (MANOVA). При этом их влияние оценивалось при помощи многомерного аналога F-критерия − критерия λ-Уилкса. Вся статистическая обработка материала выполнена в программе STATISTICA 6.0 для Windows.
РЕЗУЛЬТАТЫ
Межпопуляционная изменчивость. Средние значения признаков черепа обыкновенной бурозубки из разных локалитетов Северо-Востока европейской части России представлены в табл. 2. Для их сравнения были исключены малозначимые переменные (МГШ, РСО, ДНПЗ, ДРКЗ, ШВО и ВНЧК), в результате число анализируемых признаков сократилось с 22 до 16. При проведении дискриминантного анализа по комплексу признаков было выявлено, что большую часть различий описывают первые две дискриминантные функции (комбинации переменных). Первая переменная учитывает 58.4% изменчивости, вторая − 23.5%. В сумме они характеризуют 83% всей дисперсии. Наибольший вклад в различение выборок (рассчитывали по сумме значений стандартизованных коэффициентов первых двух дискриминантных функций) вносят семь признаков: КБД, ОДЧ, РВО, ДОНЧ, ПГШ, ДНЗР и ДНЧ. Статистически значимые различия по всему комплексу признаков отмечены практически между всеми выборками за исключением лишь М. Слуды и Сторожевска. Во всех других множественных сравнениях число значимых признаков (p < < 0.05) изменялось от 1 до 16. Точность классификации − принадлежности особей к той или иной выборке по комплексу признаков, варьировала для разных популяций от 27.3 (Сторожевск) до 89.4% (НАО).
Таблица 2.
Краниометрические показатели (M ± m) обыкновенной бурозубки из разных локалитетов Северо-Востока европейской части России
| Признак | Локалитеты | ||||
|---|---|---|---|---|---|
| Воркута | НАО | Вожгора | Уляшово | Малая Слуда | |
| ОДЧ | 19.78 ± 0.05 | 19.86 ± 0.03 | 19.93 ± 0.04 | 20.04 ± 0.03 | 19.95 ± 0.03 |
| КБД | 19.08 ± 0.05 | 19.06 ± 0.03 | 19.31 ± 0.04 | 19.36 ± 0.03 | 19.34 ± 0.03 |
| ШЧ | 9.28 ± 0.03 | 9.15 ± 0.03 | 9.51 ± 0.03 | 9.42 ± 0.02 | 9.45 ± 0.03 |
| ДЛЧ | 8.85 ± 0.05 | 8.95 ± 0.03 | 9.02 ± 0.03 | 9.15 ± 0.01 | 9.07 ± 0.04 |
| ДР | 5.44 ± 0.03 | 5.33 ± 0.02 | 5.51 ± 0.02 | 5.51 ± 0.01 | 5.60 ± 0.02 |
| ПГШ | 2.59 ± 0.02 | 2.47 ± 0.01 | 2.49 ± 0.02 | 2.48 ± 0.01 | 2.49 ± 0.01 |
| МГШ | 3.53 ± 0.02 | 3.48 ± 0.01 | 3.54 ± 0.02 | 3.53 ± 0.01 | 3.55 ± 0.02 |
| СШ | 4.81 ± 0.02 | 4.80 ± 0.01 | 4.97 ± 0.02 | 4.90 ± 0.01 | 4.86 ± 0.02 |
| ДВЗР | 8.58 ± 0.03 | 8.50 ± 0.02 | 8.63 ± 0.02 | 8.58 ± 0.02 | 8.60 ± 0.03 |
| ДВПЗ | 2.80 ± 0.02 | 2.85 ± 0.01 | 2.90 ± 0.01 | 2.81 ± 0.01 | 2.86 ± 0.01 |
| ДНЧ | 12.66 ± 0.04 | 12.69 ± 0.02 | 12.80 ± 0.03 | 12.84 ± 0.02 | 12.79 ± 0.03 |
| РСО | 8.37 ± 0.03 | 8.03 ± 0.03 | 8.33 ± 0.02 | 8.26 ± 0.02 | 8.37 ± 0.02 |
| РВО | 10.27 ± 0.04 | 9.68 ± 0.05 | 10.57 ± 0.03 | 10.39 ± 0.02 | 10.45 ± 0.03 |
| ДОНЧ | 6.88 ± 0.03 | 6.75 ± 0.01 | 6.84 ± 0.03 | 6.78 ± 0.02 | 6.89 ± 0.02 |
| ДНЗР | 7.94 ± 0.02 | 7.87 ± 0.02 | 8.07 ± 0.02 | 8.19 ± 0.01 | 8.06 ± 0.01 |
| ДНР | 3.98 ± 0.02 | 4.03 ± 0.01 | 3.99 ± 0.02 | 4.07 ± 0.01 | 3.98 ± 0.02 |
| ДНПЗ | 1.70 ± 0.01 | 1.68 ± 0.01 | 1.76 ± 0.01 | 1.78 ± 0.01 | 1.77 ± 0.01 |
| ДРКЗ | 3.71 ± 0.01 | 3.65 ± 0.01 | 3.78 ± 0.01 | 3.78 ± 0.01 | 3.74 ± 0.01 |
| ДУО | 2.52 ± 0.02 | 2.51 ± 0.01 | 2.57 ± 0.01 | 2.59 ± 0.01 | 2.49 ± 0.01 |
| ВНЧ | 4.38 ± 0.02 | 4.36 ± 0.01 | 4.48 ± 0.01 | 4.45 ± 0.01 | 4.49 ± 0.01 |
| ШВО | 2.18 ± 0.01 | 2.15 ± 0.01 | 2.16 ± 0.01 | 2.13 ± 0.01 | 2.15 ± 0.01 |
| ВНЧК | 1.14 ± 0.01 | 1.16 ± 0.01 | 1.15 ± 0.01 | 1.13 ± 0.01 | 1.15 ± 0.01 |
| Признак | Локалитеты | ||||
| Сторожевск | Верхняя Пузла | Якша | Гаревка | Яныпупунер | |
| ОДЧ | 19.92 ± 0.05 | 20.12 ± 0.04 | 20.18 ± 0.03 | 20.57 ± 0.03 | 20.64 ± 0.03 |
| КБД | 19.34 ± 0.05 | 19.57 ± 0.04 | 19.42 ± 0.03 | 19.87 ± 0.03 | 19.94 ± 0.03 |
| ШЧ | 9.47 ± 0.03 | 9.56 ± 0.03 | 9.44 ± 0.02 | 9.67 ± 0.02 | 9.71 ± 0.02 |
| ДЛЧ | 9.04 ± 0.04 | 9.03 ± 0.03 | 9.04 ± 0.03 | 9.44 ± 0.03 | 9.25 ± 0.03 |
| ДР | 5.59 ± 0.02 | 5.65 ± 0.02 | 5.46 ± 0.02 | 5.67 ± 0.02 | 5.62 ± 0.02 |
| ПГШ | 2.50 ± 0.01 | 2.55 ± 0.02 | 2.78 ± 0.01 | 2.78 ± 0.01 | 2.79 ± 0.01 |
| МГШ | 3.54 ± 0.02 | 3.61 ± 0.03 | 3.68 ± 0.01 | 3.68 ± 0.01 | 3.75 ± 0.01 |
| СШ | 4.86 ± 0.02 | 5.02 ± 0.02 | 4.89 ± 0.02 | 5.03 ± 0.02 | 5.04 ± 0.02 |
| ДВЗР | 8.62 ± 0.03 | 8.77 ± 0.03 | 8.76 ± 0.02 | 8.97 ± 0.02 | 8.98 ± 0.02 |
| ДВПЗ | 2.90 ± 0.02 | 2.96 ± 0.02 | 2.86 ± 0.01 | 2.96 ± 0.01 | 2.97 ± 0.01 |
| ДНЧ | 12.82 ± 0.04 | 12.90 ± 0.03 | 12.99 ± 0.02 | 13.37 ± 0.02 | 13.44 ± 0.03 |
| РСО | 8.39 ± 0.04 | 8.49 ± 0.03 | 8.59 ± 0.01 | 8.59 ± 0.01 | 8.86 ± 0.02 |
| РВО | 10.48 ± 0.04 | 10.64 ± 0.03 | 10.72 ± 0.03 | 11.04 ± 0.03 | 11.10 ± 0.03 |
| ДОНЧ | 6.91 ± 0.04 | 7.00 ± 0.03 | 7.10 ± 0.02 | 7.31 ± 0.02 | 7.34 ± 0.02 |
| ДНЗР | 8.08 ± 0.02 | 8.12 ± 0.03 | 8.20 ± 0.02 | 8.41 ± 0.02 | 8.42 ± 0.02 |
| ДНР | 3.99 ± 0.02 | 3.98 ± 0.03 | 4.04 ± 0.01 | 4.15 ± 0.01 | 4.15 ± 0.01 |
| ДНПЗ | 1.78 ± 0.01 | 1.79 ± 0.01 | 1.80 ± 0.01 | 1.83 ± 0.01 | 1.85 ± 0.01 |
| ДРКЗ | 3.76 ± 0.01 | 3.82 ± 0.02 | 3.82 ± 0.01 | 3.87 ± 0.01 | 3.89 ± 0.01 |
| ДУО | 2.50 ± 0.01 | 2.53 ± 0.01 | 2.44 ± 0.01 | 2.60 ± 0.01 | 2.57 ± 0.01 |
| ВНЧ | 4.46 ± 0.02 | 4.55 ± 0.02 | 4.55 ± 0.01 | 4.71 ± 0.01 | 4.76 ± 0.01 |
| ШВО | 2.16 ± 0.01 | 2.19 ± 0.02 | 2.22 ± 0.01 | 2.29 ± 0.01 | 2.31 ± 0.01 |
| ВНЧК | 1.14 ± 0.01 | 1.20 ± 0.01 | 1.21 ± 0.01 | 1.23 ± 0.01 | 1.25 ± 0.01 |
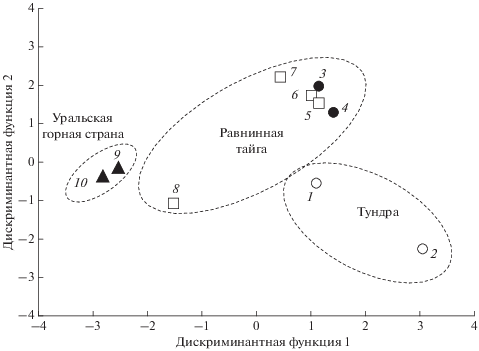
В результате дискриминации выборки разделились на группы (рис. 3). По первой канонической оси обособились две их совокупности. Первую из них составили две горные выборки и одна равнинная (Якша), примыкающая к горам. Расстояние Махаланобиса между ними было незначительным и варьировало от 2.62 до 6.59 единиц. Во вторую группу вошли две тундровые и таежные равнинные выборки. Однако по второй дискриминантной оси они разошлись на две обособленные группы. Одну очень компактную группу сформировали пять таежных равнинных локалитетов. Расстояние Махаланобиса между ними изменялось от 0.48 до 7.53 единиц. На некотором удалении от этой группы расположена Верхняя Пузла. Среди тундровых выборок эти различия составили 12.21 единиц. Максимальное расхождение наблюдалось между горными (Гаревка, Яныпупунер) и равнинными локалитетами. Расстояние Махаланобиса изменялось в этом случае от 23.8 до 44.2 единиц.
Рис. 3.
Положение центроидов выборок обыкновенной бурозубки в пространстве первых двух дискриминантных функций. Обозначения выборок на рис. 1.
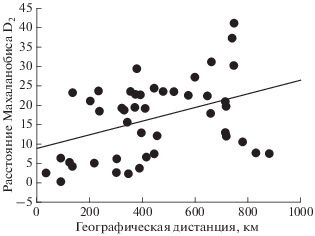
Многомерный дисперсионный анализ выявил значительное влияние локальных (местных) условий на размеры черепа: критерий λ-Уилкса = = 0.014, F = 22.9, p < 0.001. По совокупности всех признаков почти все выборки статистически достоверно (p < 0.001) отличались друг от друга. Однако связь между морфологическими (дистанциями Махаланобиса) и географическими расстояниями была относительно слабой, но статистически значимой (r = 0.40, t = 2.85, p = 0.007). У самых удаленных (более 700 км) друг от друга популяций дистанция Махаланобиса изменялась от 7.53 до 41.14 единиц (рис. 4). Даже у относительно близко расположенных выборок (около 200 км) значения морфологических дистанций колебались от 5.22 до 23.74 единиц. Все это указывает на значительную межпопуляционную краниометрическую изменчивость и на роль в ней локальных средовых факторов.
Различия между расами. Анализируемые выборки относятся к нескольким хромосомным расам: Серов (Яныпупунер, Гаревка, Якша и Воркута), Сок (Малая Слуда, Сторожевск, Верхняя Пузла), Печора (Вожгора, Уляшово). Расовая принадлежность выборки НАО в настоящее время не идентифицирована. Этот локалитет расположен севернее в 75 км от г. Нарьян-Мар, из окрестностей которого известны кариотипы двух зверьков. Один из них был классифицирован как новый хромосомный вариант под названием “Нарьян-Мар”, другой оказался гибридом между новым вариантом и расой Печора (Pavlova, Shchipanov, 2018). Выборка НАО в пространстве двух дискриминантных функций оказалась удалена от других локалитетов на более значительное расстояние, что свидетельствует о своеобразии ее морфологии. Поэтому мы выделили ее в ранге неопределенной расы, оставив за ней название НАО.
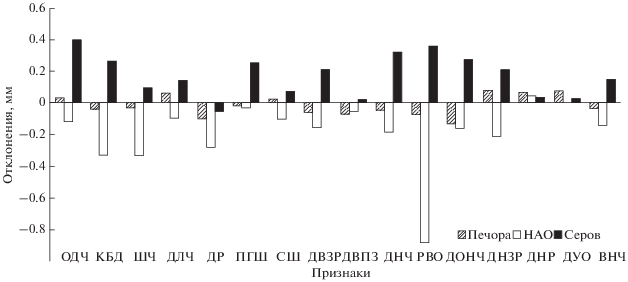
Значение многомерного критерия λ-Уилкса равнялось 0.064 (F = 22.9, p < 0.001), что свидетельствует об определенном уровне различий между расами, но эти различия оказались меньше межпопуляционных. Представители расы Серов отличаются более крупными размерами (рис. 5), что уже отмечалось в литературе (Бобрецов и др., 2012; Shchipanov et al., 2014). Однако на самом севере (тундра) землеройки данной расы были мельче, чем из таежных локалитетов. По целому ряду признаков (10 из 16) они не отличались от представителей другой тундровой популяции (НАО). Различия отмечены по ПГШ, РВО, ДОНЧ, ДНР, ДУО и ВНЧ, которые имели более крупные размеры. Землеройки из разных локалитетов расы Сок и Печора морфологически были близки между собой.
Рис. 5.
Различия хромосомных рас обыкновенной бурозубки по отдельным признакам черепа. Отклонения рассчитаны исходя из средних значений расы Сок.
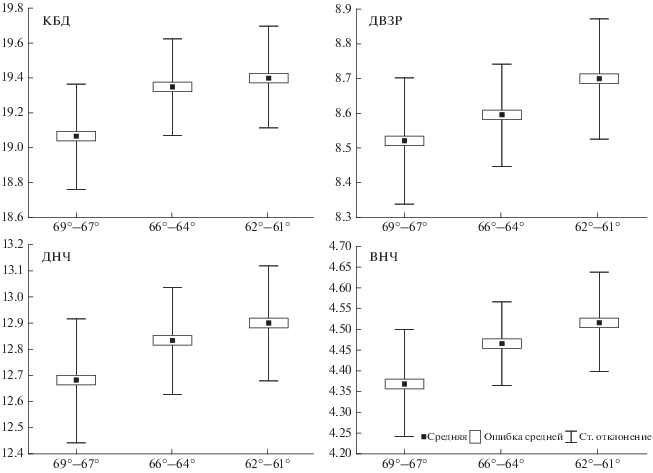
Влияние широты местности. Для анализа влияния широты местности на изменчивость краниометрических признаков использованы только равнинные выборки. Это позволило исключить влияние фактора высоты, Все выборки были сгруппированы в три широтные группы − 69°–67°, 64°–66° и 61°–62°. По своему положению они совпали с ландшафтными зонами: тундрой, северной тайгой и средней тайгой.
Результаты дисперсионного анализа по комплексу признаков показали достоверное влияние широты местности на морфологию животных (критерий λ-Уилкса = 0.174, F = 36.20, p < 0.0001). Особенно сильно (по 12 признакам из 16) отличаются землеройки из тундры (Воркута, НАО): они значительно меньше по размерам, чем животные из таежной зоны. В более низких широтах (62°−61°) таких отличительных признаков восемь. Для выборок, приуроченных к этому широтному отрезку, специфичными признаками являются ПГШ, ДВПЗ и ДОНЧ. Для семи признаков (ОДЧ, КБД, ДР, ДВЗР, ДНЧ, РВО, ВНЧ) отмечен тренд в уменьшении их размеров от средней тайги к тундре (рис. 6).
Рис. 6.
Изменчивость некоторых признаков черепа (мм) обыкновенной бурозубки на Северо-Восто\ке европейской части России в зависимости от широты местности.
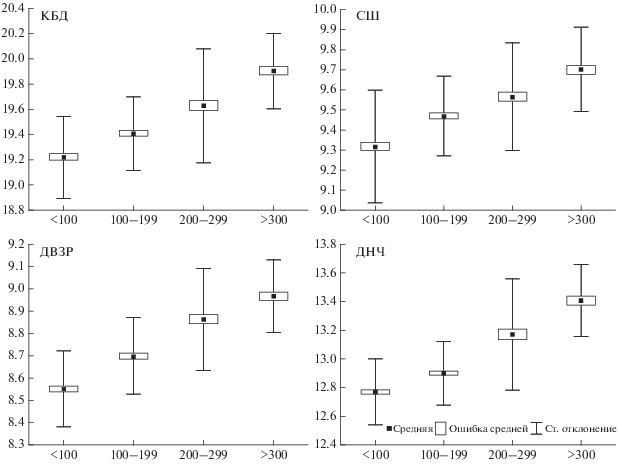
Влияние высоты местности. Для анализа влияния высоты местности локалитеты были разбиты на четыре группы с определенным интервалом высот: <100 (НАО, Уляшово, Вожгора), 100–199 (Малая Слуда, Сторожевск, Верхняя Пузла, Якша), 200-299 (Воркута, Гаревка) и > 300 м (Яныпупунер). В результате такого группирования дисперсионный анализ по комплексу признаков выявил достоверное влияние этого фактора (критерий λ-Уилкса = 0.209, F = 25.3, p < 0.0001). Из них 10 признаков по своим средним значениям статистически значимо (p < 0.0001) отличались на разных высотах одни от другого. Кроме того, отмечено увеличение размеров таких признаков как ОДЧ, КБД, ШЧ, ПГШ, ДВЗР, ДНЧ, РВО, ДОНЧ, ДНЗР и ВНЧ с повышением высоты местности (рис. 7).
Рис. 7.
Изменчивость некоторых признаков черепа (мм) обыкновенной бурозубки на Северо-Востоке европейской части России в зависимости от высоты местности.
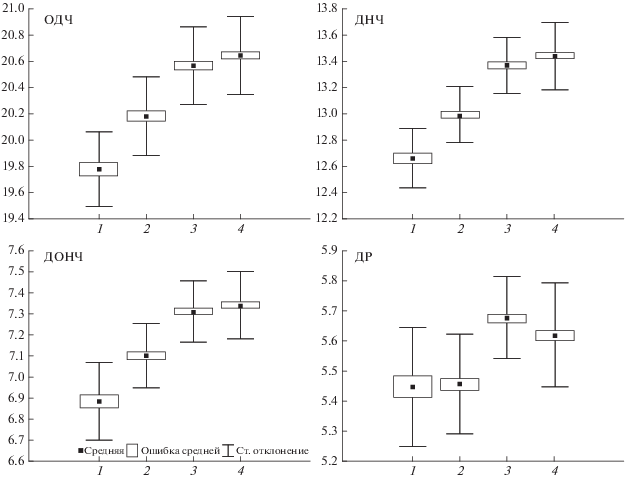
Для устранения влияния кариотипа сравнили землероек, относящихся только к расе Серов, из трех локалитетов − Якши, Гаревки и Яныпупунер. Якша (122 м над ур. м.) расположена в равнинной части, Гаревка (220 м) − в предгорьях, а Яныпупунер (518 м) − в горах. Животные из локалитетов Яныпупунер и Гаревка по большинству признаков не отличаются друг от друга, тогда как достоверные различия (по 13 признакам из 16) выявлены между ними и равнинными землеройками.
ОБСУЖДЕНИЕ
Приведенные выше результаты выявили достоверное влияние на размеры черепа обыкновенной бурозубки на Северо-Востоке европейской части России нескольких факторов − локальных средовых условий, широты местности и высоты над уровнем моря и кариотипических особенностей. Однако их вклад в краниометрическую изменчивость различен.
Ведущую роль в формировании морфологических особенностей землероек играют местные экологические условия среды. Межпопуляционная изменчивость может превышать межрасовые различия или примерно им соответствовать (Polly, 2007; Щипанов и др., 2011, 2016; Shchipanov et al., 2014; Stefen, 2013). Между выборками этого вида из разных локалитетов на Северо-Востоке европейской части России отмечены статистически значимые различия. Исключение составляют лишь две сравниваемые пары − Малая Слуда и Сторожевск. Различия между ними отсутствовали по всем признакам: расстояние Махаланобиса составляет всего лишь 0.48 единиц. Эти два локалитета расположены на расстоянии 90 км друг от друга, находятся на одной высоте и широте, и землеройки из них относятся к одной хромосомной расе Сок. Однако при другой ситуации с горными выборками (Яныпупунер, Гаревка), которые расположены в непосредственной близости друг от друга (33 км) и относятся к одной расе Серов, различия были хотя и небольшими (расстояние Махаланобиса = 2.63), но уже статистически достоверными. Животные из этих локалитетов различались по ДЛЧ и ДР.
В целом ряде работ отмечено, что между разными хромосомными расами обыкновенной бурозубки отсутствуют краниометрические различия (Meyer, Searle, 1994; Wojcik et al., 2000; Basset et al., 2006; Mishta, 2007; Крищук, 2017). В ряде случаев выявлена определенная сопряженность между морфологическими и кариотипическими различиями животных (Chętnicki et al., 1996; Polyakov et al., 2002; Окулова и др., 2004). По ряду промеров нижней челюсти землероек найдены статистически достоверные различия между хромосомными расами Москва, Селигер, Западная Двина и С.-Петербург на Валдайской возвышенности (Орлов и др., 2013).
Наши данные указывают на то, что выделить кариотипическую составляющую в краниометрической изменчивости довольно сложно. В пределах расы региональные различия могут быть значительными и могут скрывать расовые различия (Stefen, 2013). Так, тундровые популяции обыкновенной бурозубки (Воркута, НАО) на Северо-Востоке европейской части России, относящиеся к двум разным расам, достоверно отличаются друг от друга только по 6 из 16 признаков. А землеройки из одной и той же расы Серов из тундры отличаются от таежных популяций уже по 12 признакам (рис. 8). Черепа особей тундровых популяций оказались мелкими (ОДЧ, КБД, ДЛЧ, ДВЗР, ДОНЧ) и узкими (ШЧ, ПГШ). Но среди них животные из локалитета НАО (предположительно раса Нарьян-Мар) имеют минимальные размеры признака РВО. Среднее значение этого признака составляет здесь 9.68 мм, когда в других локалитетах оно выше и колеблется от 10.27 до 11.10 мм.
Рис. 8.
Изменчивость размеров некоторых признаков черепа (мм) обыкновенной бурозубки в разных локалитетах хромосомной расы Серов. Локалитеты: 1 – Воркута, 2 – Якша, 3 – Гаревка, 4 – Яныпупунер.
Влияние широты местности на размеры животных связано с устойчивым трендом изменения температуры воздуха от низких к высоким широтам. Эта закономерность лежит в основе известного экогеографического правила Бергмана (Meiri, 2011): животные в более холодном климате (как правило, в более высоких широтах) имеют более крупные средние размеры тела, чем в более теплых регионах (в более низких широтах). В данном случае широта выступает как относительный показатель средней годовой температуры воздуха и часто используется для тестирования правила Бергмана (Ashton, 2004). Коэффициент корреляции между этими двумя показателями на Северо-Востоке европейской части России (без учета горных локалитетов) составляет –0.86 (t = 35.44, p < 0.0001).
В отношении применимости правила Бергмана к землеройкам существуют противоречивые мнения. В одних работах подтверждается эта закономерность (Zeveloff, Boyce, 1988; Huggins, Kennedy, 1989; Clauss et al., 2013; Stefen, 2013), в других нет (Clauss et al., 2013). В ряде других исследований было показано, что размеры этих животных на севере мельче, чем в более южных регионах (Polly, 2007; Щипанов и др., 2011; Vega et al., 2016). Так, у евро-азиатских землероек Sorex araneus, S. caecutiens и S. minutus кондилобазальная длина черепа (КБД) уменьшается с юга на север (Ochocińska, Taylor, 2003). Такая же закономерность обнаружена и у американских землероек − Blarina brevicauda (Ashton et al., 2000), Sorex trowbridgii (Carraway, Verts, 2005) и Sorex cinereus (Yom-Tov, Yom-Tov, 2005), а также у обыкновенной бурозубки в Норвегии (Frafjord, 2008). Землеройки с севера Урала оказались мельче животных с южной части Урала (Большаков и др., 1996). Однако в последних работах существование этих закономерностей ставится под сомнение (Stanchak, Santana, 2018).
Размеры черепа обыкновенной бурозубки на Северо-Востоке европейской части России также уменьшаются с юга на север. Получены достоверные (p < 0.0001) отрицательные значения коэффициента корреляции между большинством признаков и широтой: КБД (–0.42), ШЧ (–0.45), ПГШ (–0.39), ДВЗР (–0.42), РВО (–0.66), ДОНЧ (–0.50). У тундровых популяций среднее значение КБД меньше 19.00 мм, тогда как у таежных равнинных популяций оно колеблется от 19.31 до 19.57 мм.
Увеличение размера тела животных с высотой является следствием правила Бергмана (Teplitsky, Millien, 2014). Для землероек отмечена положительная корреляция длины черепа с высотой над уровнем моря (Homolka, 1980; Polly, 2007; Щипанов и др., 2011). У кавказской бурозубки (Sorex caucasica) КБД черепа в горах (Соколов, Темботов, 1989) выше (18.6 мм), чем на прилегающей возвышенности (17.8 мм). В Северной Америке у Blarina brevicauda самая большая величина КДБ характерна тоже для горных популяций (Braun, Kennedy, 1983). Однако в ряде исследований получены и противоположные данные. Так, размеры тела кротовой белозубки (Anourosorex squamipes) с высотой уменьшались (Liao et al., 2011).
Результаты нашей работы демонстрируют увеличение многих краниометрических признаков (ОДЧ, КБД, ШЧ, ПГШ, ДВЗР, ДНЧ, РВО, ДОНЧ, ДНЗР и ВНЧ) с увеличением высоты местности. Так, среднее значение КБД на высоте 0−99 м составляет 19.21 мм, на высоте 100−199 м − 19.41 мм, на высоте 200−299 м − 19.63 мм, а свыше 300 м − 19.90 мм. Для ДНЧ эти значения равняются, соответственно, 12.78, 12.90, 13.17 и 13.40 мм. Показательно, что в пределах одной расы Серов землеройки из горных локалитетов (Яныпупунер, Гаревка) значительно превышают по размерам животных из равнинного локалитета (Якша), расположенного в непосредственной близости от них. Так, КДБ черепа в Якше составляет 19.42 мм, на Гаревке − 19.87 мм, а на Яныпупунер – 19.94 мм.
Однако выделить влияние того или иного фактора на изменчивость краниометрических признаков в “чистом” виде часто бывает крайне сложно. Нередко разные факторы пространственно налагаются друг на друга и воздействуют одновременно и в разных сочетаниях. Так, морфологические дистанции между выборками Воркута и НАО, с одной стороны, и Воркута и Якша, с другой стороны, примерно одинаковые (12.21 и 12.16 единиц). При этом расстояние Махаланобиса между НАО и Якшей достигает уже 30.36 единиц. Если близость тундровых выборок еще можно интерпретировать влиянием широты местности, то значительные расхождения в дистанциях между ними и Якшой вызваны уже другими факторами.
Противоположно направленные тренды в изменчивости размеров обыкновенной бурозубки в зависимости от широты и высоты местности объяснить при помощи правила Бергмана невозможно. Влияние этих факторов часто оценивается неоднозначно. Во многом эти противоречия снимаются, если считать, что размеры тела землероек зависят от обилия и доступности кормов (Ochocinska, Taylor, 2003; Yom-Tov, Yom-Tov, 2005; McNab, 2010; Щипанов и др., 2016). Анализ климатических колебаний и размеров тела у землероек за последние 50 тыс. лет показал отсутствие корреляции между ними (Prost et al., 2013), поэтому авторы полагают, что размеры тела связаны в основном с изменениями в питании.
В районах с богатыми и доступными кормовыми ресурсами землеройки имеют более крупные размеры, в районах бедными ресурсами − более мелкие. Эту закономерность Макнабб (McNab, 2010) предложил назвать “правилом ресурсов”. Она хорошо документирована для обыкновенной бурозубки Норвегии (Frafjord, 2008). Животные с крупными размерами тела обнаружены в районах, богатых дождевыми червями − основным кормом для данного вида. Этим можно объяснить разные оценки влияния гор на размеры животных. Самые крупные особи обыкновенной бурозубки на Северо-Востоке европейской части России выявлены на западном макросклоне Северного Урала. Здесь в условиях значительного увлажнения большие площади занимают лесные и открытые высокотравные экосистемы, богатые дождевыми червями. Численность их в горных почвах достигает 83 экз. на 1 м2 , тогда как в равнинных лесах их запасы в 3–5 раз ниже (Смирнова и др., 2007; Крылова и др., 2011). Вместе с тем уменьшение размеров кротовой белозубки с высотой, отмеченное в Западном Китае, связано с дефицитом кормовых ресурсов (Liao et al., 2011).
На морфологическую дифференциацию землероек влияют также средовые условия местообитаний. На северо-востоке Польши обнаружены статистически значимые различия в размерах нижней челюсти обыкновенной бурозубки из трех местообитаний − суходольного луга, низинного болота и пойменного леса. При этом наиболее крупные особи обитали на осоковом болоте, которое здесь представляет собой лучшее местообитание (Wójcik et al., 2003). В Беларуси у особей, обитающих на лугах, размеры черепа больше, чем у особей, обитающих на низинных болотах (Крищук, 2017). В Центральной России самые мелкие обыкновенные бурозубки обитали в долгомошно-зеленомошном ельнике − местообитании бореального типа (Щипанов и др., 2016). Авторы считают, что в этом случае краниометрические различия связаны в первую очередь с размерами основных жертв.
ЗАКЛЮЧЕНИЕ
Анализ краниометрической изменчивости обыкновенной бурозубки на Северо-Востоке европейской части России показал, что эта изменчивость формируется под влиянием целого ряда факторов. При этом оценить роль каждого из них в отдельности зачастую сложно, так как они действуют совместно и в разных сочетаниях друг с другом. Кроме того, эта оценка во многом будет зависеть от того, как организованы выборки, и от их числа (Щипанов и др., 2016). Этим во многом объясняются противоречия, возникающие при оценке роли отдельных факторов.
Межпопуляционная изменчивость размеров черепа обыкновенной бурозубки в регионе значительна. Морфологические дистанции между локалитетами внутри одной хромосомной расы часто больше, чем различия между локалитетами разных рас. Четко выделить влияние кариотипических особенностей на размеры животных затруднительно, так как оно “затушевывается” другими факторами. Однако отдельные признаки указывают на своеобразие некоторых хромосомных рас. Во всяком случае, в сходных условиях в выборках разных рас может быть обнаружена морфологическая специфика. По мнению Полли (Polly, 2007), морфологическая дифференциация наиболее четко выражена на уровне кариотипических групп, чем собственно между расами. Поэтому вопрос о возможности различения рас остается открытым и требует дальнейшего изучения.
Значительный вклад в межпопуляционную изменчивость вносит широта (уменьшение размеров черепа с юга на север) и высота (увеличение размеров с высотой) местности. Объяснить эти противоположные тренды изменчивости прямым влиянием температуры среды невозможно. Климатические факторы (температура, осадки) влияют на размеры землероек опосредованно через обилие и доступность кормовых ресурсов. Значение этих факторов продемонстрировано на обыкновенной бурозубке Печоро-Илычского заповедника, где размеры черепа животных коррелируют с обилием кормов, запасы которых возрастают от равнины к горам.
Список литературы
Балакирев А.Е., 2003. О проявлении полового диморфизма краниометрических характеристик обыкновенной бурозубки (Sorex araneus L.) разных хромосомных рас // Териологические исследования. Вып. 2. С. 3−11.
Бобрецов А.В., Куприянова И.Ф., Калинин А.А., Петров А.Н., Павлова С.В., Щипанов Н.А., 2012. Морфологическая дифференциация обыкновенной бурозубки (Sorex araneus) на северо-востоке Европейской части России // Зоологический журнал. Т. 91. № 5. С. 605−618.
Большаков В.Н., Васильев А.Г., Шарова Л.П., 1996. Фауна и популяционная экология землероек Урала (Mammalia, Soricidae). Екатеринбург: Екатеринбург. 268 с.
Васильев А.Г., Шарова Л.П., 1992. Соотношение географической и хронографической изменчивости обыкновенной бурозубки на Урале // Морфологическая и хромосомная изменчивость мелких млекопитающих. Екатеринбург: Наука. С. 94−108.
Долгов В.А., 1985. Бурозубки Старого Света. М.: МГУ. 221 с.
Крищук И.А., 2017. Изменчивость морфометрических характеристик черепа в полиморфных популяциях хромосомных рас обыкновенной бурозубки (Sorex araneus L.) на территории Беларуси // Веснiк Мазырскага дзяржаўнага педагагiчнага ўнiверсiтэта імя І. П. Шамякіна. № 1 (49). С. 57−64.
Крылова Л.П., Акулова Л.И., Долгин М.М., 2011. Дождевые черви (Oligochaeta, Lumbricidae) таежной зоны Республики Коми. Сыктывкар: Коми пединститут. 104 с.
Окулова Н.М., Балакирев А.Е., Орлов В.Н., 2004. Краниометрические особенности некоторых хромосомных рас обыкновенной бурозубки (Sorex araneus, Insectivora) // Зоологический журнал. Т. 83. № 12. С. 1476−1487.
Орлов В.Н., Сычева В.Б., Черепанова Е.В., Борисов Ю.М., 2013. Краниометрические различия контактирующих хромосомных рас обыкновенной бурозубки Sorex araneus (Mammalia) как следствие их ограниченной гибридизации // Генетика. Т. 49. № 4. С. 479−490.
Смирнова О.В., Бобровский М.В., Ханина Л.Г., Смирнов В.Э., 2007. Биоразнообразие и сукцессионный статус темнохвойных лесов Шежимопечорского и Большепорожного ботанико-географических районов Печоро-Илычского заповедника // Труды Печоро-Илычского заповедника. Сыктывкар. Вып. 15. С. 28−47.
Соколов В.Е., Темботов А.К., 1989. Млекопитающие Кавказа: Насекомоядные. М.: Наука. 548 с. (Позвоночные Кавказа).
Тюрин В.В., Щеглов С.Н., 2015. Дискриминантный анализ в биологии: монография. Краснодар: Кубанский государственный университет. 126 с.
Щипанов Н.А., Бобрецов А.В., Куприянова И.Ф., Павлова С.В., 2011. Межрасовая и межпопуляционная изменчивость фенотипических (краниальных) признаков обыкновенной бурозубки (Sorex araneus L., 1758) // Генетика. Т. 47. № 1. С. 76−88.
Щипанов Н.А., Булатова Н.Ш., Демидова Т.Б., Бобрецов А.В., 2008. Хромосомные расы обыкновенной бурозубки на Европейском Северо-Востоке России. Ограничивают ли внешние преграды распространение расы? // Доклады РАН. Т. 422. № 5. С. 714−717.
Щипанов Н.А., Сычёва В.Б., Тумасьян Ф.А., 2016. Морфометрические дистанции и структурирование населения обыкновенной бурозубки Sorex araneus L. (Lipotyphla: Soricidae) // Известия Российской академии наук. Серия биологическая. № 5. С. 511−524.
Ashton K.G., 2004. Sensitivity of intraspecific latitudinal clines for tetrapods to sampling, latitude and body size // Integrative and Comparative Biology. V. 44. № 6. P. 403−412.
Ashton K.G., Tracy M.C., Queiroz A.D., 2000. Is Bergmann’s rule valid for mammals? // American Naturalist. V. 156. № 4. P. 390–415.
Basset P., Yannic G., Brünner H., 2006. Restricted gene flow at specific parts of the shrew genome in chromosomal hybrid zones // Evolution. V. 60. № 8. P. 1718–1730.
Braun J.K., Kennedy M.L., 1983. Systematic of the genus Blarina in Tennessee and adjacent areas // Journal of Mammalogy. V. 64. № 3. P. 414–425.
Carraway L.N., Verts B.J., 2005. Assessment of variation in cranial and mandibular dimensions in geographic races of Sorex trowbridgii // Advances in the biology of shrews II. Eds. Merritt J.F., Churchfield S., Hutterer R., Sheftel B.I. New York: Special publication of the international society of shrew biologists. P. 139−153.
Chętnicki W., Fedyk S., Banaszek A., Szalaj K.A., Ratkiewicz M., 1996. Morphometrical characteristics of the common shrew (Sorex araneus L.) from interracial hybrid zones // Hereditas. V. 125. № 2−3. P. 201−207.
Clauss M., Dittmann M.T., Müller D.W., Meloro C., Codron D., 2013. Bergmann’s rule in mammals: A cross-species interspecific pattern // Oikos. V. 122. № 10. P. 1465–1472.
Frafjord K., 2008. Can environmental factors explain size variation in the common shrew (Sorex araneus)? // Mammalian Biology. V. 73. № 6. P. 415–422.
Homolka M., 1980. Biometrischer vergleich zweier populationen Sorex araneus // Acta scientiarum naturalium Academiae Scientiarum Bohemicae, Brno. V. 14. № 10. P. 1–34.
Huggins J.A., Kennedy M.L., 1989. Morphological variation in the masked shrew (Sorex cinereus) and the smoky shrew (S. fumeus) // American Middle Naturalist. V. 122. № 1. P. 11−25.
Liao W.B., Zhou C.Q., Hu J.C., 2011. Head-body length variation in the mole-shrew (Anourosorex squamipes) in relation to annual temperature and elevation // North-Western Journal Zoology. V. 7. № 1. P. 47−54.
McNab B.K., 2010. Geographic and temporal correlations of mammalian size reconsidered: a resource rule // Oecologia. V. 164. № 1. P. 13–23.
Meiri S., 2011. Bergmann’s rule − what’s in a name? // Global Ecology Biogeography. V. 20. № 1. P. 203−207.
Meyer A., Searle J.B., 1994. Morphological studies on British common shrews // Folia zoological. V. 43. Suppl. 1. 115 p.
Mishta A.V., 2007. Morphometric variation of the common shrew Sorex araneus in Ukraine, in relation to geoclimatic factors and karyotype // // Russian Journal of Theriology. V. 6. № 1. P. 51–62.
Nováková L., Vohralík V., 2017. Age and sex skull variation in a model population of the common shrew (Sorex araneus) // Folia Zoologica. V. 66. № 4. P. 254−261.
Ochocińska D., Taylor J.R.E., 2003. Bergmann’s rule in shrews: geographical variation of body size in Palearctic Sorex species // Biological Journal of the Linnean Society. V. 78. № 3. P. 365–381.
Pavlova S.V., Shchipanov N.A., 2018. New karyotypes of the common shrew Sorex araneus (Lipotyphla, Mammalia) at the northern periphery of the species range in European Russia // Mammal Research. V. 63. [Электронный ресурс]. Режим доступа: https://doi.org/10.1007/ s13364-018-0409-6. Дата обновления: 25.02.2019.
Polly P.D., 2007. Phylogeographic differentiation in Sorex araneus: morphology in relation to geography and karyotype // Russian Journal of Theriology. V. 6. № 1. P. 73–81.
Polyakov A.V., Onischenko S.S., Ilyashenko V.B., Searle J.B., Borodin P.M., 2002. Morphometric difference between the Novosibirsk and Tomsk chromosome races of Sorex araneus in a zone of parapatry // Acta Theriologica. V. 47. № 4. P. 381−387.
Polyakov A.V., Volobouev T.V., Aniskin V.M., Zima J., Searle J.B., Borodin P.M., 2003. Altitudinal partitioning of two chromosome races of the common shrew (Sorex araneus) in West Siberia // Mammalia. V. 67. № 2. P. 201–207.
Prost S., Klietman J., van Kolfschoten T., Guralnick R.P., Waltari E., Vrieling K., Stiller M., Nagel D., Rabeder G., Hofreiter M., Sommer R.S., 2013. Effects of late quaternary climate change on Palearctic shrews // Global Change Biology. V. 19. № 6. P. 1865–1874.
Shchipanov N.A., Voyta L.L., Bobretsov A.V., Kuprianova I.F., 2014. Intra-species structuring in the common shrew Sorex araneus (Lipotyphla: Soricidae) in European Russia: morphometric variability could give evidence of limitation of interpopulation migration // Russian Journal of Theriology. V. 13. № 2. P. 119–140.
Stanchak K.E., Santana S.E., 2018. Do ecogeographical rules explain morphological variation in a diverse, Holarctic genus of small mammals? // Journal of Biogeography. V. 46. № 1. P. 110−122.
Stefen C., 2013. Craniometric study of the common shrew (Sorex araneus L. 1758) from different localities and chromosomal races across Germany and Europe // Acta Theriologica. V. 58. № 3. P. 245–254.
Teplitsky C., Millien V., 2014. Climate warming and Bergmann’s rule through time: is there any evidence? // Evolutionary Applicatios. V. 7. № 1. P. 156–168.
Vega R., McDevitt A., Kryštufek B., Searle J., 2016. Ecogeographical patterns of morphological variation in pygmy shrews Sorex minutus (Soricomorpha: Soricinae) within a phylogeographical and continental-and-island framework // Biological Journal of the Linnean Society. V. 119. № 4. P. 799–815.
Wojcik J.M., Bogdanowicz W., Pucek Z., Wojcik A.M., Zalewska H., 2000. Morphometric variation of the common shrew Sorex araneus in Poland, in relation to karyotype // Acta Theriologica. V. 45. Suppl. 1. P.161−172.
Wójcik J.M., Wójcik A.M., Sikorski M.D., 2003. Morphometric variation of the common shrew, Sorex araneus, in different habitats // Mammalia. V. 67. № 2. P. 225−232.
Yom-Tov Y., Yom-Tov J., 2005. Global warming, Bergmann’s rule and body size in the masked shrew Sorex cinereus Kerr in Alaska // Journal of Animal Ecology. V. 74. № 5. P. 803−808.
Zeveloff S.I., Boyce M.S., 1988. Body size patterns in North American mammal faunas // Evolution of life histories of mammals: theory and pattern. Ed. M. Boyce. New Haven: Yale University Press. P. 123–146.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал