Зоологический журнал, 2020, T. 99, № 7, стр. 819-837
Бентосные сообщества прибрежных водоемов на разных стадиях изоляции от моря в окрестностях беломорской биостанции МГУ (Кандалакшский залив Белого моря)
М. В. Мардашова a, *, Д. А. Воронов b, c, Е. Д. Краснова d
a Центр морских исследований Московского государственного университета им. М.В. Ломоносова
119992 Москва, Россия
b Федеральное государственное бюджетное учреждение науки
Институт проблем передачи информации им. А.А. Харкевича РАН
127051 Москва, Россия
c Научно-исследовательский институт Физико-Химической биологии им. А.Н. Белозерского
119992 Москва, Россия
d Беломорская биологическая станция им. Н.А. Перцова Биологического факультета
Московского государственного университета им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: buccinum@mail.ru
Поступила в редакцию 12.11.2019
После доработки 20.01.2020
Принята к публикации 09.03.2020
Аннотация
Рассмотрены сообщества макрозообентоса в беломорских прибрежных водоемах, частично или полностью потерявших связь с морем в результате постгляциального поднятия суши. Устойчивая вертикальная стратификация с тенденцией к меромиксии и постепенное опреснение по мере усиления изоляции от моря создают условия для формирования необычного набора макрофауны и сукцессии – от нормального или обедненного морского биома до полностью пресноводного. Приведены сведения, собранные в 2012–2017 гг., о составе сообществ макрозообентоса пяти морских лагун и четырех меромиктических озер в сравнении с морскими сообществами губы Кислой, с которой сообщаются два изучаемых водоема, и пресными озерами Киндо-полуострова. Проведена типологизация водоемов по степени отделения с учетом гидрологического режима и различия фаун. По мере усиления изоляции водоема от моря происходит закономерная смена донных сообществ. В морских соленых лагунах, регулярно заливаемых приливами, присутствует сообщество видов Macoma balthica (L. 1758) – Pontonema vulgare (Bastian 1865) Filipjev 1916, широко распространенных на морской литорали. В более изолированных лагунного типа водоемах при сходном наборе видов основу биомассы помимо M. balthica составляют Mytilus edulis L. 1758 и Mya arenaria L. 1758. Большее развитие получают улитки Hydrobia ulvae (Pennant 1777). Уже на этом этапе фауна содержит больше литоральных эврибионтов (H. ulvae, M. balthica, M. arenaria, M. edulis, Arenicola marina (L. 1758), Tubificoides benedeni (d’Udekem 1855), хирономид и т.д.) и меньше сублиторальных стеногалинных форм. На следующем этапе доминантом по биомассе становится H. ulvae и больший вес получают хирономида Chironomus gr. salinarius и олигохета T. benedeni. На мелководных участках поселяются насекомые и их личинки (жуки, хирономиды и другие двукрылые). В меромиктических озерах, где под пикноклином еще сохраняется соленый аэробный слой, фауна миксолимниона состоит в основном из личинок насекомых, а от морской фауны остаются эвригалинные формы: бокоплав Gammarus duebeni Lilljeborg 1852 и хирономида Ch. gr. salinarius. При полной изоляции от моря ниже пикноклина условия анаэробные и, несмотря на подходящую соленость, морская фауна отсутствует. В таких водоемах бентос представлен исключительно пресноводными формами, в основном насекомыми и моллюсками. В полностью пресных водоемах основу биомассы составляют хирономиды, для каждого озера характерен свой набор видов, меняющийся год от года. В пресной воде оз. Нижнего Ершовского сохраняется популяция G. duebeni в наиболее близкой к морю части водоема. Видовое разнообразие снижается по мере отделения водоемов от моря: максимальное число видов встречено в морских лагунах близ о-ва Соностров (23–34 вида); в оз. Кисло-Сладком отмечается 10–15 видов за съемку. В оз. Большие Хрусломены аэробная часть монимолимниона приходится на критическую соленость и разнообразие минимально (6–10 видов). После появления в водоеме стабильного пресного слоя число видов снова возрастает. Аналогичным образом изменяются количественные характеристики макробентофауны. Максимальные значения численности отмечены в морских лагунах; в оз. Кисло-Сладком среднее значение численности существенно ниже. В меромиктических водоемах с пресным миксолимнионом максимумы численности и биомассы приурочены к верхнему полуметру, тогда как в морских лагунах максимумы расположены в диапазоне глубин 1–2.5 м, причем в менее изолированных водоемов – глубже, чем в более отделенных. Этот слой характеризуется наибольшим содержанием растворенного кислорода, а нередко и пересыщением. Пресноводные водоемы сильно варьируют по численности бентоса.
По мере постгляциального изостатического поднятия берега, морские заливы и проливы могут отделяться от моря и превращаться в озера (Шапоренко, 2004; Олюнина, Романенко, 2007). В окрестностях Беломорской биостанции МГУ им. Н.А. Перцова обнаружено большое число отделяющихся водоемов, частично или полностью потерявших связь с морем, но еще не превратившихся в пресные континентальные водоемы (Краснова и др., 2013).
Подобные водоемы встречаются по всему миру, и для их обозначения используются различные названия в зависимости от происхождения и от задач классификации. В некоторых случаях их называют реликтовыми; примерами служат оз. Могильное на о-ве Кильдин, Каспийское море (Соколов, 1952). Беломорские прибрежные водоемы по способу происхождения тоже реликтовые, однако возраст в несколько сотен лет не позволяет применять этот термин к столь молодым образованиям (Краснова и др., 2016). Важная особенность этих водоемов – устойчивая стратификация с тенденцией к меромиксии, что роднит их с меромиктическими водоемами эктогенного и креногенного происхождения с выходами солевых источников на дне (Горбунов и др., 2007). Строгое толкование термина “меромиктический водоем” подразумевает полное отсутствие перемешивания, в то время как беломорские озера подвергаются возмущениям с разной периодичностью (Краснова и др., 2016). Наиболее известно реликтовое меромиктическое оз. Могильное на о-ве Кильдин Баренцева моря, в котором баланс морских и пресных вод не только создал условия для взаимодействия морской и континентальной фауны, но и способствовал эволюционным процессам, приведшим к формированию специфических и уникальных форм (Реликтовое озеро Могильное …, 2002; Strelkov et al., 2014). Показано, что скорость гидрологической и биологической эволюции отделяющихся лагун отличается значительно больше таковой прилегающего морского побережья (Естественная история Сахалина …, 2014).
Типовая структура отделяющего водоема включает верхний слой – миксолимнион, подверженный ветровому перемешиванию и зачастую опресненный (рис. 1а), но в лагунах может обладать нормальной морской соленостью. Ниже располагается соленый аэробный слой с застойной водой. В этом слое, как правило, вода не только насыщена кислородом, а пересыщена вплоть до 300%. Придонная водная толща насыщена сероводородом и не населена донной фауной. Между аэробным и анаэробным слоями располагается узкая редокс-зона с резким перепадом окислительно-восстановительного потенциала, на границе часто могут развиваться цветные слои, окрашенные сообществами микроводорослей или прокариот (Krasnova et al., 2015).
Рис. 1.
Отделяющиеся водоемы беломорского побережья: а – типовая структура отделяющегося водоема, б – схема эволюции морского залива по мере изоляции от моря и роста влияния континентального стока. Водоемы разделены на группы в соответствии с этапом эволюции.
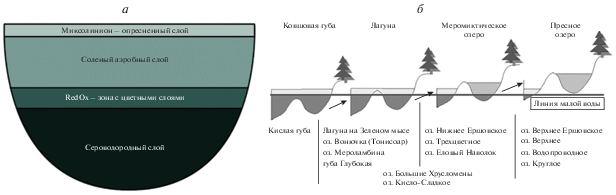
По мере отделения водоема во всех его слоях происходят определенные изменения. Миксолимнион постепенно опресняется за счет материкового стока и осадков; в нем происходит закономерная смена сообществ с морских на эвригалнные и солоноватоводные, и затем пресноводные. Толщина соленого аэробного слоя постепенно снижается вплоть до полного исчезновения, что приводит к формированию двухслойной структуры водоема, который таким образом лишается морской фауны нижних горизонтов. Морское влияние на водоем, по мере трансгрессии суши, ослабевает, возрастает роль континентального стока, верхний слой водной толщи постепенно опресняется, и он становится все толще. В итоге озеро трансформируется в полностью пресное. Еще в 1930-х годах Гурвич указывал на наличие исторической связи между ковшовыми и лагунными губами с прибрежными озерами (Наумов, Мартынова, 2016). Продолжительность меромиктической стадии измеряется в сотнях лет (Субетто и др., 2012).
Семенов (1988) предложил двумерную классификацию морских бассейнов по степени их изоляции (от класса I – открытые водоемы со свободным водообменом – до класса VII – полностью отделенные от моря) и размеру (от 1 – океанические бассейны до 4 – небольшие заливы (менее 8 миль протяженностью)). Согласно этой классификации, залив Бабье море, расположенный недалеко от района наших исследований (Белое море, Кандалакшский залив), относится к классу IV–4 – “Внутренние бассейны-ковши”; реликтовые озера вроде оз. Могильное попадают в класс VI – “Реликтовые водоемы”; а большая часть беломорских отделяющихся водоемов лежит между категориями V–4 – “Верхние бассейны губ, ковши” и VII – “Пресные озера морского генезиса”, однако еще меньшего размера, нежели предусмотрено этой классификацией.
Некоторое сходство с беломорскими отделяющимися водоемами имеют фьорды – узкие, глубокие и длинные заливы, отделенные от моря порогом и, как правило, обладающие крутыми скалистыми берегами (Семенов, 1988). В заливах глубоких фьордов бореальной зоны могут возникать более холодноводные условия, способствующие сохранению арктической фауны. Такие явления показаны для норвежских фьордов еще в начале 20 в (Семенов, 1988а). Основные отличия фьордов заключаются в относительно бóльшей их глубине, наличии привычной морской литорали и сублиторали с возможным смещением зон и выпадением частей литорали, чего не наблюдается в беломорских отделяющихся водоемах в силу их мелководности. Температура придонного водного слоя фьордов отрицательная, потому невозможно накопление сероводорода (Семенов, 1988а), напротив, характерного для нижних горизонтов изучаемых водоемов.
Некоторые водоемы, находящиеся на ранних стадиях отделения, попадают в категорию ковшовых губ – относительно больших и глубоких акваторий, отделенных от моря узким мелководным порогом, в которых сохраняется приливно-отливный режим с соотношением глубин порога и водоема менее 1/12 (Гурвич, Соколова, 1939). Семенов (1988а) объясняет модель 1/12 нарушением аэрации, приводящим к накоплению придонного сероводорода. Среди беломорских отделяющихся озер большинство – мелководные, до 5 м в наиболее глубокой точке, что не позволяет применять к ним этот критерий. Еще одно понятие – “лагуна” – определяется как неглубокий естественный водоем, соединенный с морем узким проливом (не обязательно мелким, в отличие от ковшовой губы) или отделенный от него грядой из песка, гальки и т.д. (Краснова и др., 2016). Те из беломорских водоемов, которые находятся на начальной стадии изоляции, соответствуют этому определению с той разницей, что понятие лагуны не предполагает круглогодичного отсутствия аэрации в придонном слое, а это – характерная черта прибрежных меромиктических водоемов (Гурвич, Соколова, 1939; Краснова и др., 2016). По мере подъема берега расстояние, отделяющее водоем от моря, увеличивается и может достигать 100 м и более, что выводит его из категории лагун.
В юго-западной части Баренцева моря обследованы два соленых озера (Сисяярви и Линьялампи) лагунного типа, соединенные с морем узким мелководным проливом (Деарт и др., 2018). Эти озера – довольно глубокие (до 20 м) и слабо подвержены опреснению континентальным стоком. Донная фауна водоемов слабо отличается по своему составу и количественным характеристикам от окружающих кутовых частей баренцевоморских заливов.
В Белом море губы ковшового типа исследовались еще с конца 19 в: г. Долгая на Соловецком о-ве описана Книповичем в 1893 г., залив Бабье море исследовали начиная с 1934 г.; Лов губа, Палкина, Колвица и Никольская губы, а также Чупа и Канда привлекли внимание во второй половине 20 в. (Наумов, Мартынова, 2016).
Две небольшие лагуны вблизи пос. Умба были исследованы в 1933–1934 гг., в том числе на предмет донной фауны. Тогда было отмечено сочетание в лагунах типичной литоральной фауны (M. balthica, Littorina spp. и др.) с такими пресноводными и солоноватоводными формами, как личинки ручейников Limnephilus spp. и хирономид. В целом сообщество удаленной от порога части лагун охарактеризовано как сильно обедненное литоральное с преобладанием H. ulvae, Gammarus spp. и редкими M. balthica и хирономидами (Гурвич, Соколова, 1939).
Залив Бабье море, являющийся ковшовой губой, исследован в ходе нескольких мультидисциплинарных экспедиций (Комплексные исследования Бабьего моря…, 2016). Фауна его литорали существенно обеднена по сравнению с морской литоральной за счет выпадения инфауны. Доминируют формы с высокой миграционной активностью. По плотности преобладают арктические полихеты Micronephthys minuta (Théel 1879) и бореальные моллюски H. ulvae. Основу биомассы составляют Alitta virens (M. Sars 1835), M. edulis и M. balthica – характерные обитатели беломорской литорали (Макаров и др., 2016). Наумов с соавторами (2016) причисляет к ковшовым водоемам и пролив Великая Салма, хоть и с менее отчетливым порогом на входе.
Для ковшовых губ отмечается характерная картина “смещения” зон литоральной и сублиторальной фауны; причем возможны оба направления: как уход литоральных и верхнесублиторальных форм на глубину, так и поднятие целых глубоководных биоценозов в верхнюю сублитораль (Семенов, 1988а). В Бабьем море, в частности, происходит смещение максимума плотности долгоживущих видов (M. arenaria, M. balthica, Arenicola marina) в верхние отделы сублиторали (Мокиевский и др., 2016).
Отличие ковшовых губ заключается в том, что они, как правило, более глубокие, нежели большинство прибрежных водоемов, отделяющихся от Белого моря, и обладают полноценными приливами. Пикноклин располагается глубоко, и верхний слой водной толщи не выделяется резко. В них нередко возникает застойная придонная зона, насыщенная сероводородом.
Подробно исследованы лагуны и прибрежные озера о-ва Сахалин, где обнаружены разнообразные промежуточные и переходные формы между морскими и пресными экосистемами (Естественная история Сахалина …, 2014). Сахалинские лагуны интересны тем, что среди них так же, как и в случае беломорских отделяющихся водоемов, присутствует вся линейка от морского водоема до пресноводного. По солености выделяются следующие категории: соленые (морские) водоемы – свыше 22–26‰; солоноватоводные – от 5–7 до 22–26‰; олигогалинные – от 0.01–0.1‰ до 5–7‰; пресноводные – менее 0.01–0.1‰. Таким образом, все беломорские водоемы в этой линейке укладываются в диапазон от солоноватоводных до пресных озер. В сахалинских солоноватоводных водоемах исчезают многие формы иглокожих и ракообразных; в олигогалинных озерах значимыми таксонами являются олигохеты, моллюски, бокоплавы, изоподы, мизиды, десятиногие раки и двукрылые насекомые. Пресные водоемы по составу фауны близки к олигогалинным, в них более значима роль других групп насекомых (ручейники, стрекозы, жуки).
Лагуны эстуарного типа распространены на Камчатке (Кравчуновская, Горин, 2010). Камчатские лагуны весьма изменчивы: песчаные косы, отделяющие их от моря, то нарастают, то прорываются, и водные сообщества в них, могут эволюционировать в обоих направлениях – как в сторону опреснения, так и в сторону осолонения. При этом осолонение в сочетании с низким уровнем водообмена вызывают заморные явления в результате развития сероводорода (Чебанова, 2013).
Континентальные меромиктические водоемы аридной зоны, такие как оз. Шира и Шунет в Хакасии, также обладают некоторым сходством с беломорскими меромиктическими водоемами: выраженной стратификацией водной толщи и тенденцией к опреснению верхнего слоя. В оз. Шира наблюдается повышение мощности перемешиваемого слоя одновременно с его опреснением, что негативно сказывается на составе и количественных характеристиках макрозообентоса (Tolomeev et al., 2018).
Отделяющиеся водоемы Белого моря могут служить модельными объектами при исследовании процессов, сопутствующих изоляции водоема как искусственной (строительство приливных электростанций, рыбохозяйственные заводы), так и при естественных процессах. В макромасштабе процессы, протекающие при отделении подобных водоемов, сходны с таковыми при формировании структуры внутренних морей и позволяют экстраполировать знания о причинно-следственных связях различных природных и антропогенных явлений (Наумов, 1979; Семенов, 1988а).
В силу высокой скорости поднятия берега (Романенко, Шилова, 2012) и особой комбинации климатических условий, беломорские прибрежные водоемы обладают уникальным гидрологическим режимом (Kharcheva et al., 2014; Mardashova et al., 2014) и создают условия для развития необычного набора макрофауны (Столяров, 2016) – от обедненного или нормального морского биома (Столяров, Мардашова, 2017) до полностью пресноводных сообществ (Мардашова и др., 2015а). Обеднение фауны и флоры по мере удаления от океана параллельно с уменьшением размеров водоема отмечено еще в работе Семенова (1988). Среди угнетающих разнообразие факторов перечисляют опреснение, изменение приливного режима, усиление температурных колебаний, снижение интенсивности круговорота биогенов и усиление льдообразования (Семенов, 1988а; Мокиевский и др., 2016). Для Белого моря характерна высокая концентрация донной фауны подо льдом, поскольку промерзает лишь верхний горизонт литорали. В то же время в отделяющихся водоемах влияние промерзания распространяется вглубь, и большая часть фауны уходит в сублитораль (Макаров и др., 2016).
Первым отделяющимся водоемом, исследованным вблизи окрестностей ББС МГУ, стало оз. Кисло-Сладкое, где была обнаружена нетипичная для морских заливов гидрологическая структура (Шапоренко, 2004). С 2010 г. на Беломорской биостанции МГУ развернуты исследования этого и других аналогичных водоемов, которые включают инвентаризацию прибрежных меромиктических водоемов в Кандалакшском заливе и мониторинг нескольких объектов по гидрологическим, гидрохимическим и прочим абиотическим параметрам (Краснова и др., 2013). Тогда же начались первые сборы макрозообентоса в ближайших к биостанции водоемах, первые количественные съемки осуществлены в 2014 г. Целью настоящей работы стала классификация сообществ макрозообентоса 13 водоемов, находящихся на различных стадиях отделения от моря, соотнесение их с гидрологическими характеристиками, выделение сообществ в разных функциональных зонах водоемов и построение возможных сукцессионных рядов донной фауны от морского залива до пресного озера.
МАТЕРИАЛ И МЕТОДЫ
Работа выполнена на базе Беломорской биологической станции им. Н.А. Перцова МГУ им. М.В. Ломоносова. Здесь приведены накопленные с 2012 по 2017 гг. сведения о составе сообществ макрозообентоса четырех морских лагун: лагуны на Зеленом мысе и трех водоемов вблизи ур. Соностров; соленого оз. Кисло-Сладкого, а также четырех меромиктических озер, одно из которых имеет солоноватый поверхностный слой (оз. Большие Хрусломены на о-ве Олений в Ковденской губе), и три озера с пресным поверхностным слоем (оз. Еловый Наволок, Трехцветное и Нижнее Ершовское). В качестве морского эталона выбрана губа Кислая, с которой сообщаются два отделяющихся водоема – лагуна на Зеленом мысе и оз. Н. Ершовское. Финальная пресноводная стадия эволюции водоема изучена на примере трех озер на п-ве Киндо, которые в разное время тоже проходили через меромиктическую стадию: Круглого, Верхнего и Водопроводного (рис. 1б, 2, табл. 1).
Рис. 2.
Карта расположения исследуемых озер Кандалакшского залива Белого моря. Кругами отмечены морские водоемы, ромбами – меромиктические, квадратами – пресноводные.
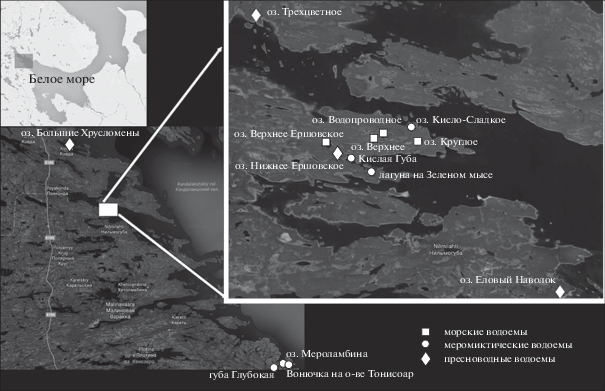
Таблица 1.
Характеристики исследованных водоемов и количество собранного материала
| Водоем | Координаты | Характеристики | Колич. проб | Годы исследований | ||
|---|---|---|---|---|---|---|
| N | E | макс. глубина | глубина галоклина | |||
| Оз. Кисло-Сладкое | 66.548277 | 33.134998 | 4.5 | 1.0 | 155 | 2014–2017 |
| Лагуна на Зеленом мысе | 66.530553 | 33.095275 | 6.5 | 1.5 | 85 | 2015–2017 |
| Оз. Вонючка на о. Тонисоар | 66.160829 | 34.225164 | 9.5 | 1.5 | 12 | 2017 |
| Оз. Мероламбина | 66.166933 | 34.184756 | 8.0 | 1.0 | 13 | 2017 |
| Вершина губы Глубокой | 66.167539 | 34.152208 | 8.0 | – | 11 | 2017 |
| Оз. Большие Хрусломены | 66.719274 | 32.857978 | 21.0 | 2.0 | 16 | 2017 |
| Оз. Еловый Наволок | 66.481975 | 33.279250 | 5.5 | 1.0 | 38 | 2015–2017 |
| Оз. Трехцветное | 66.592496 | 32.978618 | 8.0 | 1.5 | 54 | 2015–2017 |
| Оз. Нижнее Ершовское | 66.537012 | 33.059855 | 2.7 | 2.0 | 39 | 2015–2017 |
| Оз. Круглое | 66.542965 | 33.139459 | 3.0 | – | 3 | 2017 |
| Оз. Верхнее | 66.543721 | 33.097063 | 3.0 | – | 10 | 2015 |
| Оз. Водопроводное | 66.545675 | 33.104521 | 2.5 | – | 2 | 2015 |
| Оз. Верхнее Ершовское | 66.541773 | 33.050251 | 2.5 | – | 3 | 2015 |
Пробы макрозообентоса собирали дночерпателем Экмана-Берджи площадью 210.25 см2, летом (июнь–октябрь) – с лодки и с берега, зимой (январь–март) – со льда через пробуренные майны, а также качественных пробы отбирали донным скребком и вручную с различных субстратов.
Отобранные пробы донного грунта промывали на сите с размером ячеи 1 мм. В лаборатории из проб вручную извлекали донных животных. Большая часть проб разобрана в живом виде, в исключительных случаях пробы промытого грунта фиксировали 7% раствором формальдегида. Беспозвоночных определяли с максимально возможной точностью, в большинстве случаев до вида, согласно соответствующим определителям (Определитель фауны и флоры…, 1948; Гурьянова, 1951; Ушаков, 1955; Цветкова, 1975; Моллюски Белого моря, 1987; Определитель пресноводных …, 1994, 2001; Жирков, 2001; Чертопруд, Чертопруд, 2003; Наумов, 2006; Иллюстрированные определители …, 2009, 2010). В ходе видовой идентификации определяли численность каждого таксона. Организмы одного вида взвешивали совместно на весах Jewelry Scale ML-CF3 с точностью до 1 мг. Животных, формирующих вокруг себя секреционные защитные структуры (известковые, белковые и хитиновые раковины и трубочки), взвешивали вместе с домиками; агглютинированные защитные структуры (песчаные трубочки Pectinariidae, Spionidae, Trichoptera и др.) перед взвешиванием удалялись. Биомасса соответствует сырому весу животных. Для определения доминирующих форм использовали индекс функционального обилия, определяемый как ИФО = N 0.25B 0.75, где N – численность вида, B – его биомасса. Для статистической обработки полученных данных использовали программу Past 3 (Hammer et al., 2003).
РЕЗУЛЬТАТЫ
Лагуна на Зеленом мысе – морская лагуна, сообщающаяся с Кислой губой при каждом приливном цикле. Подвержена небольшим (0.1–0.5 м) приливным колебаниям. Начиная с глубины 2.5 м соленость выше, нежели на окружающей морской акватории.
В озере обнаружено 47 видов донной макрофауны (табл. 2). Наибольшая встречаемость характерна для брюхоногих моллюсков H. ulvae (89%), хирономид Ch. gr. salinarius (76%), нематод Pontonema vulgare (74%), олигохет T. benedeni (70%), а также двустворчатых моллюсков M. balthica (55%) и M. arenaria (43%). Видовой список состоит из морских литоральных и сублиторальных форм. На валунах порога лагуны отмечены колонии мшанок Electra crustulenta var. balthica Borg 1931 и Bowerbankia caudata (Hincks 1877). В лагуну далеко заходят морские звезды Asterias rubens L. 1758, на средних глубинах многочисленны асцидии Molgula manhattensis (De Kay 1843). По берегам озера в массе плавают жуки Enochrus bicolor (F. 1792), а вблизи небольшого впадающего в озеро ручья обнаруживаются ручейники Limnephilus sp.
Таблица 2.
Список видов, отмеченных в некоторых исследованных водоемах с условным обозначением встречаемости
| Вид | Губа Глубокая | Тонисоар | Меро-ламбина | Зеленый Мыс | Кисло-Сладкое | Б. Хрус-ломены | Еловый Наволок | Н. Ершовское | Трех-цветное | Верхнее |
|---|---|---|---|---|---|---|---|---|---|---|
| Micronephthys minuta | об. | |||||||||
| Mysis sp. | ред. | |||||||||
| Mysis oculata | ред. | |||||||||
| Molgula retortiformis | домин. | |||||||||
| Pontoporeia femorata | об. | |||||||||
| Hiatella arctica juv. | ред. | |||||||||
| Diastylis rathkei | об. | |||||||||
| Molgula manhattensis | об. | |||||||||
| Oedicerotidae gen. sp. | ред. | |||||||||
| Paraonidae gen. sp. | ед. | |||||||||
| Lysianassidae gen. sp. | ред. | ред. | ||||||||
| Caprella sp. juv. | ед. | |||||||||
| Phyllodoce maculata | об. | ред. | ||||||||
| Prionospio cirrifera | ред. | ед. | ||||||||
| Scoloplos gr. armiger | об. | ред. | ред. | |||||||
| Mya arenaria | ред. | об. | домин. | |||||||
| Pectinaria koreni | ред. | домин. | об. | |||||||
| Littorina obtusata | ред. | ед. | ||||||||
| Littorina littorea | ред. | ред. | ||||||||
| Littorina saxatilis | ред. | |||||||||
| Limapontia cocksi | ед. | |||||||||
| Nemertini gen. sp. | об. | об. | об. | |||||||
| Tetrastemma sp. | ред. | |||||||||
| Poseidon viridis | об. | |||||||||
| Poseidon ruber | об. | об. | ||||||||
| Cephalothrix linearis | ред. | |||||||||
| Nais elinguis | ред. | ред. | ед. | |||||||
| Macrorhynchus crocea | ред. | ред. | ед. | |||||||
| Euchone analis | ред. | |||||||||
| Castalia punctata | ред. | ред. | ед. | |||||||
| Pygospio elegans | ред. | ед. | ||||||||
| Asterias rubens | об. | |||||||||
| Harmothoe imbricata | об. | |||||||||
| Spionidae gen. sp. | ед. | |||||||||
| Crassicorophium bonnellii | об. | масс. | масс. | |||||||
| Polydora ciliata | масс. | масс. | ||||||||
| Macoma balthica | домин. | масс. | домин. | домин. | ||||||
| Capitella capitata | масс. | об. | ||||||||
| Heteromastus filiformis | домин. | ред. | масс. | |||||||
| Priapulus caudatus | об. | |||||||||
| Jaera gr. albifrons | ред. | ред. | ||||||||
| Enoplus communis | домин. | |||||||||
| Pontonema vulgare | домин. | домин. | масс. | домин. | ||||||
| Arenicola marina | домин. | ред. | ред. | |||||||
| Pholoe assimilis | об. | ред. | ||||||||
| Fabriciola balthica | об. | об. | об. | |||||||
| Mytilus edulis | ред. | домин. | домин. | ед. | ||||||
| Alitta virens | ред. | домин. | об. | ред. | ||||||
| Monocelis fusca | ед. | |||||||||
| Tubificoides benedeni | масс. | домин. | об. | домин. | масс. | ред. | ||||
| Hydrobia ulvae | домин. | домин. | домин. | домин. | домин. | |||||
| Orthocladius gr. saxicola | об. | об. | ред. | ред. | ||||||
| Chironomus gr. salinarius | масс. | масс. | масс. | масс. | домин. | домин. | ||||
| Gammarus duebeni | об. | ред. | ед. | об. | об. | |||||
| Gammarus sp. juv. | ед. | |||||||||
| Polychaeta rest | ед. | |||||||||
| Bowerbankia caudata | ред. | ред. | ||||||||
| Electra crustulenta var. balthica | ред. | ред. | ||||||||
| Chironomidae gen. sp. | об. | об. | ред. | об. | об. | об. | об. | об. | об. | об. |
| Psilotanypus sp. | об. | ред. | об. | об. | масс. | масс. | об. | |||
| Acari gen. sp. | ед. | ед. | ред. | ред. | ред. | об. | ||||
| Nematoda gen. sp. | ед. | ед. | ред. | ед. | ||||||
| Enochrus bicolor | ред. | ред. | ||||||||
| Ephydridae gen. sp. | ред. | об. | ||||||||
| Macroplea mutica | об. | |||||||||
| Limnephilus sp. | ед. | ред. | ||||||||
| Polypedilum sp. | ред. | ред. | ед. | ред. | ||||||
| Limnochironomus gr. tritomus | ед. | об. | ред. | |||||||
| Manajunkia aestuarina | ед. | |||||||||
| Enochrus quadripunctatus | ед. | |||||||||
| Aeschna juncea | ед. | |||||||||
| Dytiscidae gen. sp. | ед. | |||||||||
| Corixidae gen. sp. 1 | ед. | |||||||||
| Corixidae gen. sp. 2 | ед. | |||||||||
| Aedes sp. | ед. | |||||||||
| Pseudochironomus sp. | ед. | |||||||||
| Cladotanytarsus gr. mancus | ред. | ред. | об. | масс. | ||||||
| Haliplus immaculatus | об. | ред. | ||||||||
| Naididae gen. sp. | об. | ред. | ||||||||
| Baetis sp. | об. | |||||||||
| Athripsodes sp. | об. | |||||||||
| Microspectra gr. phaecos | ед. | |||||||||
| Corixidae gen. sp. | ед. | |||||||||
| Phryganea sp. | ед. | |||||||||
| Pseudochironomus gr. prasinatus | домин. | ред. | ||||||||
| Gammarus lacustris | об. | об. | ||||||||
| Molanna angustata | ред. | ред. | ||||||||
| Endochironomus albipennis | ред. | масс. | ||||||||
| Endochironomus impar | ред. | ред. | ||||||||
| Tanytarsus gr. gregarius | ред. | масс. | ред. | |||||||
| Cryptochironomus gr. viridulus | ред. | об. | ред. | |||||||
| Cryptochironomus gr. defectus | ред. | ред. | ред. | |||||||
| Lymnaea stagnalis | об. | об. | об. | |||||||
| Ceratopogonidae gen. sp. | ред. | ред. | ||||||||
| Caenis horaria | ред. | ред. | ||||||||
| Pisidiidae gen. sp. | об. | об. | ред. | ред. | ||||||
| Chironomus gr. plumosus | масс. | домин. | домин. | домин. | ||||||
| Anisus sp. | ред. | * | ред. | |||||||
| Trichoptera gen. sp. | ред. | ред. | ||||||||
| Microtendipes gr. pedellus | масс. | |||||||||
| Sialis morio | ред. | |||||||||
| Cryptochironomus gr. anomalus | ред. | |||||||||
| Agrypnia obsoleta | ед. | |||||||||
| Trissocladius sp. | ед. | |||||||||
| Parachironomus sp. | ед. | |||||||||
| Glyptotendipes sp. | ед. | |||||||||
| Mystacides sp. | ред. | |||||||||
| Tanypus sp. | ед. | |||||||||
| Oligochaeta gen. sp. | ред. | об. | ||||||||
| Limnochironomus gr. nervosus | ред. | |||||||||
| Intercloeon spiniventre | ред. | |||||||||
| Parachironomus gr. pararostratum | ед. | |||||||||
| Ablabesmyia sp. | ед. | |||||||||
| Bezzia sp. | ед. | |||||||||
| Ischnura pumilio | ед. | |||||||||
| Erpobdella octoculata | ед. | |||||||||
| Tanypus villipennis | ед. | |||||||||
| Phryganea bipunctata | ед. | |||||||||
| Coenagrion sp. | ед. | |||||||||
| Ephemeroptera gen. sp. | об. |
Средняя численность бентоса составляла 11 000 ± 3000 экз./м2 (табл. 3). Наибольшей численностью обладали P. vulgare (35%), H. ulvae (24%) и T. benedeni (17%). Биомасса 200 ± 50 г/м2; 83% суммарной биомассы бентоса приходилось на двустворчатых моллюсков M. edulis, M. arenaria и M. balthica, еще 7% приходится на долю гидробий. Численность и биомасса бентоса резко уменьшаются на глубинах от 3 м, при этом снижается вклад H. ulvae, Ch. gr. salinarius, M. balthica в функциональное обилие, и доминирующими формами становятся полихеты Heteromastus filiformis (Claparède 1864; 34%), Polydora ciliata (Johnston 1838; 33%) и олигохета T. benedeni (16%).
Таблица 3.
Характеристики макрозообентоса исследованных водоемов
| Водоем | Число видов | Плотность, экз./м2 | Биомасса, г/м2 | Доминанты по ИФО |
|---|---|---|---|---|
| Лагуна на Зеленом мысе | 47 | 11 000 ± 3000 | 200 ± 50 | Mya arenaria (29%), Mytilus edulis (25%), Macoma balthica (17%), Hydrobia ulvae (13%) |
| Оз. Мероламбина | 20 | 3000 ± 2000 | 200 ± 170 | Hydrobia ulvae (76%), Macoma balthica (21%) |
| Оз. Вонючка на о-ве Тонисоар | 34 | 10 000 ± 3000 | 50 ± 10 | Hydrobia ulvae (52%), Pontonema vulgare (24%), Tubificoides benedeni (12%) |
| Вершина г. Глубокой | 25 | 16 000 ± 9000 | 50 ± 20 | Hydrobia ulvae (63%), Heteromastus filiformis (34%) |
| Оз. Кисло-Сладкое | 29 | 4100 ± 800 | 50 ± 10 | Hydrobia ulvae (91%) |
| Оз. Большие Хрусломены | 9 | 1600 ± 600 | 6 ± 2 | Chironomus gr. salinarius (98%) |
| Оз. Еловый Наволок | 26 | 1400 ± 1100 | 3 ± 2 | Pseudochironomus gr. prasinatus (90%) |
| Оз. Трехцветное | 25 | 450 ± 200 | 7 ± 4 | Chironomus gr. plumosus (95%) |
| Оз. Нижнее Ершовское | 27 | 1300 ± 300 | 10 ± 2 | Chironomus gr. plumosus (55%), Endochironomus albipennis (23%) |
| Оз. Круглое | 12 | 800 ± 300 | 6 ± 4 | Chironomus gr. plumosus (59%), Pisidiidae gen. sp. (12%) |
Оз. Вонючка на острове Тонисоар – соленая лагуна, отгороженная от моря порогом, с повышенной соленостью придонного слоя, начиная с 2.5 м. Приливные колебания 0.5–0.7 м. Водоем по своей морфологии напоминает лагуну на Зеленом мысе.
Всего в бентосе встречено 34 вида макрозообентоса, представленного исключительно морскими литоральными и сублиторальными формами. Только здесь отмечаются мизиды Mysis oculata (F. 1780), двустворчатые моллюски Hiatella arctica (L. 1767), асцидии Molgula retortiformis Verrill 1871. Средняя численность бентоса 10 000 ± 3000 экз./м2, преобладали нематоды P. vulgare (44%) и Enoplus communis Bastian 1865 (15%), а также олигохета T. benedeni (15%). Биомасса в среднем составляла 50 ± 10 г/м2; ее основу составляли гидробии (26%), пескожилы A. marina (16%), асцидии M. retortiformis (13%) и полихеты Pectinaria koreni (Malmgren 1866; 10%). По ИФО в верхнем, менее соленом, слое доминировали гидробии (61%), нематоды P. vulgare (21%) и олигохеты T. benedeni (14%). Глубже 1.5 м плотность поселения бентоса снижалась, и доминирующими по ИФО формами становились P. vulgare (47%), полихеты Polydora ciliata (18%) и пескожил (13%).
Вершина губы Глубокой – соленая лагуна с летней стратификацией и ослабленными (1 м) приливными колебаниями. Визуально сходна с типичными морскими заливами наподобие Кислой губы.
В макрозообентосе водоема отмечено 25 морских литоральных и сублиторальных видов. Только здесь встречены кумовые раки Diastylis rathkei (Kröyer 1841), сидячие полихеты Euchone analis (Kröyer 1856). Плотность бентоса составляла в среднем 16 000 ± 9000 экз./м2, наибольшей численностью обладали полихеты Heteromastus filiformis (41%), гидробии (38%) и нематоды P. vulgare (15%). Биомасса в среднем 50 ± 20 г/м2; ее основу составляли гидробии (37%), полихеты H. filiformis (25%), двустворчатые моллюски M. balthica (18%). До 1.5 м по ИФО абсолютный доминант – H. ulvae (93%), глубже ее сменяет полихета H. filiformis (95%).
Оз. Мероламбина – эстуарий лагунного типа; перемычка, отделяющая его от моря, была наращена при строительстве шлюза для накопления бревен при лесосплаве. Верхний метровый слой опреснен, придонная водная масса – соленая. Приливные колебания 0.3–0.5 м. Несмотря на опреснение верхнего слоя, озеро в целом напоминает остальные соностровские водоемы.
В озере обнаружены 20 видов донных макробеспозвоночных, все относятся к типично морским формам. Среди обитателей водоема отмечена арктическая форма Micronephthys minuta, также только здесь найдены бокоплавы Pontoporeia femorata Kröyer 1842. Средняя численность бентоса 3000 ± 2000 экз./м2, 85% приходится на H. ulvae. Биомасса бентоса сильно варьировала и составляла 200 ± 170 г/м2; 86% вносили мидии. В верхнем, опресненном, метровом слое, доминировали H. ulvae (97% суммарного ИФО); глубже полутора метров их сменяли M. balthica (87%) и молодь полихет Alitta virens (7%).
Оз. Кисло-Сладкое представляет собой морскую лагуну с неполным перемешиванием и опресненным в весенний период метровым верхним слоем, в котором соленость восстанавливается в течение гидрологического лета. Визуально водоем напоминает морской в его северной части, а с юга берег заболочен и напоминает растительностью берег пресноводного водоема.
В озере обнаружено 29 видов донных макробеспозвоночных. Среди них два вида мшанок встречены только на валунах на пороге, отделяющем озеро от моря, эти виды не распространялись внутрь водоема. Основу видового списка составляли морские эвригалинные формы с небольшой примесью сезонных личинок насекомых континентального происхождения. Наиболее часто встречались гидробии и Ch. gr. salinarius. Также характерными видами для водоема являлись олигохеты T. benedeni, личинки жуков-листоедов Macroplea mutica (F. 1793) и плавунчики Haliplus immaculatus Gerhardt 1877. Здесь впервые появляется заметное разнообразие различных насекомых, в особенности разнообразных двукрылых, и в меньшей степени жуков и полужесткокрылых.
Средняя численность бентоса составляла 4100 ± ± 800 экз./м2, в основном за счет гидробий (78%) и Ch. gr. salinarius (13%). Биомасса составляла 50 ± 10 г/м2; на глубинах до 3 м более 90% биомассы приходилось на гидробий, глубже больший вклад начинают вносить Ch. gr. salinarius, а в отдельные годы и T. benedeni.
Оз. Большие Хрусломены – самое большое из известных нам прибрежных меромиктических озер. Озеро было искусственно изолировано от моря в начале 20 века с целью сбора пресной воды, необходимой для работы паровых машин лесозавода. Однако поверхностный слой озера опреснен лишь до 4–7‰, что соответствует экологическому уровню критической солености. Озеро подвержено регулярным приливам с высотой колебаний уровня около 0.2 м.
В озере обнаружено всего 9 видов донных макробеспозвоночных; это самый бедный видами водоем среди исследованных. Он населен морскими эвригалинными формами (G. duebeni, Ch. gr. salinarius, T. benedeni) наряду с личинками насекомых – поденок и ручейников. Средняя численность бентоса 1600 ± 600 экз./м2, в основном за счет Ch. gr. salinarius (92% общей плотности макрозообентоса). Биомасса в среднем составляла 6 ± ± 2 г/м2; наибольшая – 26 г/м2 на глубине 1 м. 98% биомассы приходится на долю доминанта Ch. gr. salinarius. Мелководная (до 1.5 м) зона вблизи порога выстлана крупным валунником, затрудняющим пробоотбор. Поверхность камней покрыта тонким слоем детрита, населенного массой мелких хирономид и поденками Baetidae gen. sp.
Оз. Еловый Наволок – меромиктическое озеро с пресным метровым верхним слоем и соленой придонной водной толщей. Визуально озеро походит на пресноводный водоем, лишь прилегающая к ручью часть, изредка подвергаемая морским заплескам, напоминает о связи водоема с морем.
В нем отмечено 26 типично пресноводных озерных видов. Средняя плотность бентоса 1400 ± ± 1100 экз./м2, средняя биомасса 3 ± 2 г/м2. И по численности, и по биомассе преобладал один вид хирономид – Pseudochironomus gr. prasinatus (90 и 87% соответственно). Донная фауна отмечена лишь в верхнем пресном метре озера, отдельные экземпляры встречались в пробах до глубины 2 м.
Оз. Трехцветное – меромиктическое озеро с устойчивой стратификацией и метровым пресным слоем. Начиная с глубины 2 м располагается анаэробная зона с морской соленостью. Визуально озеро соответствует пресноводным водоемам региона.
В озере обнаружено 25 видов, все типично пресноводные.
Средняя численность 450 ± 200 экз./м2. По плотности макрозообентоса доминировал Chironomus gr. plumosus (74%), второстепенную роль играл Cladotanytarsus gr. mancus (9%). Биомасса в среднем 7 ± 4 г/м2. По биомассе бентоса преобладал Ch. gr. plumosus (97%). Донная фауна встречалась до глубины 3 м, глубже макробеспозвоночные не обнаружены.
Оз. Нижнее Ершовское – меромиктическое озеро; большая часть водной толщи пресная, но в донных ямах сохраняется солоноватая вода. Визуально водоем соответствует пресным озерам региона.
В озере обнаружены 27 видов донных макробеспозвоночных, все – типичные пресноводные представители озерной фауны. Средняя численность 1300 ± 300 экз./м2, ее основу составляли хирономиды Endochironomus albipennis (Meigen 1830; 26%), Chironomus gr. plumosus (15%), Tanytarsus gr. gregarius (11%) и другие виды (суммарно 17%). Биомасса невелика: 10 ± 2 г/м2; 66% из которых приходилось на долю Ch. gr. plumosus, 17% – на долю E. albipennis. Соленый водный слой анаэробен и не населен донной фауной.
Озера Верхнее, Водопроводное, Круглое и Верхнее Ершовское представляют собой типичные для региона пресные водоемы, населенные исключительно пресноводной фауной.
Численность бентоса в оз. Круглое 800 ± ± 300 экз./м2, наиболее многочисленны хирономиды Ch. gr. plumosus (33%), Tanytarsus gr. gregarius (23%) и двустворчатые моллюски семейства Pisidiidae (17%). Биомасса низка: 6 ± 4 г/м2; 58% приходилось на долю доминанта Ch. gr. plumosus. В оз. Верхнее биомасса 6 ± 3 г/м2, 78% вносил Ch. gr. plumosus. В оз. В. Ершовское биомасса бентоса 4 ± 2 г/м2, 72% приходилось на Ch. gr. plumosus. В оз. Водопроводное пробы были пустыми, что также отмечалось в работе Извековой с соавторами (1970).
Губа Кислая имеет хорошее сообщение с морем и населена типичной морской фауной. Ее кут частично отделен от основной части губы порогами, что затрудняет водообмен с внешней акваторией. В сублиторали ее кутовой части обнаружены 17 видов макрозообентоса. Общая численность бентоса 1000 ± 300 экз./м2, биомасса 100 ± 50 г/м2. По численности преобладают бокоплавы Pontoporeia femorata (20%), гидробии H. ulvae (20%), полихеты Scoloplos gr. armiger (18%) и Micronephthys minuta (15%). Основу биомассы составляют M. balthica (45%), полухордовое Saccoglossus mereschkowskii Wagner 1885 (14%), двустворчатый моллюск Astarte montagui (Dillwyn 1817; 12%) и полихета Pectinaria koreni (10%).
Характеристика грунта
В морских водоемах лагунного типа (лагуна на Зеленом мысе, вершина губы Глубокой, оз. Меролабмина и оз. Вонючка на о. Тонисоар) грунт представлен в основном илисто-песчаной фракцией, в верхних горизонтах заросшей зостерой и нитчаткой. В донных ямах грунт более заилен; ближе к порогам и вблизи ручьев лучше промыт. В озерах с мощным водотоком (Б. Хрусломены, Еловый Наволок, в меньшей степени – Трехцветное и Кисло-Сладкое) от порога в глубь водоема распространяются россыпи валунов, затрудняющие пробоотбор. Озера Кисло-Сладкое, Трехцветное, Еловый Наволок, Н. Ершовское характеризуются в основном илистыми грунтами; пресные же водоемы выстланы заиленными растительными остатками и торфом. На аналогичных грунтах беломорского побережья макрозообентос представлен богатой разнообразной инфауной наряду с подвижными формами.
ОБСУЖДЕНИЕ
Сопоставление бентосных сообществ исследованных водоемов позволило выявить несколько закономерностей: 1) видовое разнообразие снижается по мере отделения водоемов от моря; 2) состав бентоса зависит от солености слоя, пригодного для обитания аэробной фауны; 3) количественные характеристики бентоса иллюстрируют концепцию критической солености; 4) максимальные численность и биомасса донной макрофауны в водоемах, частично изолированных от моря, приходятся на верхний слой водной толщи; 5) особенно благоприятной для морского бентоса является зона с застойной соленой водой, перенасыщенной кислородом, которая располагается ниже пикноклина.
Состав сообществ
По мере ослабевания влияния моря на гидрологический режим водоема происходит закономерная смена донных сообществ.
В трех соностровских соленых озерах, регулярно заливаемых приливами, а также в лагуне на Зеленом мысе, донная фауна близка к типичной беломорской. В целом ее можно охарактеризовать как сообщество M. balthica – P. vulgare, широко распространенных на морской литорали (рис. 3а). Интересно, что сообщество с доминированием M. balthica характерно и для лагун Сахалина (Естественная история Сахалина …, 2014). В оз. Мероламбина высокой встречаемостью обладают арктические полихеты Micronephtys minuta, что указывает на сходство этого, относительно мелкого, озера глубиной 8 м, с ковшовыми губами (Макаров и др., 2016). Также в этом водоеме многочисленна характерная форма Pontoporeia femorata, именем которой названо сообщество многих подобных лагун в работе Гурвича и Соколовой (1939) и отмеченной также в Бабьем море (Макаров и др., 2016).
Рис. 3.
Схема донной экосистемы отделяющихся водоемов. а – Водоем лагунного типа. Преобладают двустворчатые моллюски, видовое разнообразие относительно высоко, б – оз. Кисло-Сладкое. Видовое разнообразие снижено, преобладают гидробии и хирономиды. в – оз. Большие Хрусломены. Видовое разнообразие наименьшее среди всех водоемов, преобладают хирономиды. г – Меромиктические водоемы. Видовое разнообразие возрастает, преобладают хирономиды и появляющиеся на этом этапе пресноводные моллюски. д – Пресные водоемы. Видовое разнообразие и количественные характеристики возрастают еще больше, преобладают моллюски.
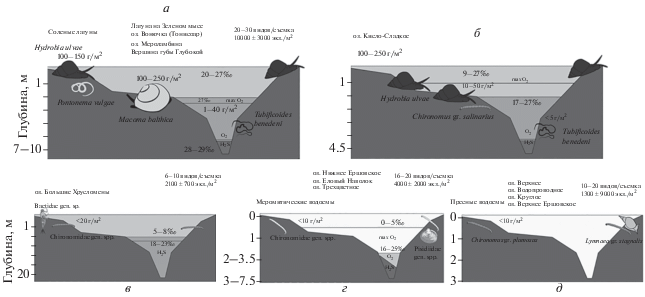
В лагуне на Зеленом мысе в нижних слоях водной толщи отмечается даже более высокая соленость, нежели в прилежащей Кислой губе (Краснова и др., 2013); при сходном наборе видов основу биомассы в ней, помимо M. balthica, составляют M. edulis и M. arenaria. Большее развитие в этой лагуне и в оз. Мероламбина получают H. ulvae. Некоторое превышение солености окружающего моря отмечается также в оз. Вонючка на о-ве Тонисоар, наиболее сходной с лагуной на Зеленом мысе. По биомассе в ней доминируют M. balthica и M. edulis наряду с полихетами A. virens; похожее сообщество существует на литорали Бабьего моря (Макаров и др., 2016). Сообщество макрофауны беспозвоночных этих лагун сходно с таковым прилежащих к порогу частей лагун вблизи пос. Умба (Гурвич, Соколова, 1939). Видовой состав макрофауны исследованных соленых лагун практически повторяет списки губы Ермолинской – открытого прибрежного морского водоема лагунного типа (Столяров, 2016).
Губа Ермолинская в силу особенностей батиметрии представляет собой “затравку” для будущего отделяющегося водоема, и уже на этом этапе содержит больше литоральных эврибионтов (H. ulvae, M. balthica, M. arenaria, M. edulis, A. marina, T. benedeni, хирономид и т.д.) и меньше сублиторальных стеногалинных форм (Pholoe minuta (F. 1780), Asterias rubens, асцидии), нежели окружающие промывные лагуны Кислой губы, хотя в целом фауны очень похожи (Столяров, Мардашова, 2017). Массовые в Бабьем море и в исследованных лагунах виды-оппортунисты (M. minuta, Capitellidae gen. spp.) характерны для краевых биотопов со сниженным видовым разнообразием (Макаров и др., 2016). В верхних горизонтах уменьшение амплитуды приливно-отливных колебаний и промерзание дна приводят к исчезновению многолетних малоподвижных организмов (двустворчатые моллюски) и развитию подвижных форм, таких как амфиподы, хирономиды и др. (Мокиевский и др., 2016). Те же явления отмечаются в лагунах Сахалина (Естественная история Сахалина …, 2014) и связаны, как предполагается, в первую очередь с особенностями льдообразования.
Оз. Кисло-Сладкое изолировано в большей степени, нежели описанные лагуны, в нем уже отсутствуют регулярные приливные колебания, а забросы свежей морской воды происходят лишь во время сизигии (Краснова и др., 2013). Из бентоса выпадают двустворчатые моллюски, что аналогично таким искусственно отделенным водоемам, как баренцевоморская Кислая губа после строительства Кислогубской ПЭС (Шилин, 2009), существенно снижается разнообразие полихет. Доминантом по биомассе становится H. ulvae, и больший вес получают хирономида Ch. gr. salinarius и олигохета T. benedeni (рис. 3б). Это сообщество напоминает эврибионтный биотоп детритофагов заиленных участков прибрежных лагун с замедленной гидродинамикой, описанный Столяровым (2016). Сходное сообщество с преобладанием H. ulvae и субдоминированием других эвригалинных форм развивается и в водоемах лагунного типа, находящихся на более ранней стадии отделения (лагуна на Зеленом мысе, Соностровские водоемы) в зонах, соответствующих верхним опресненным слоям, а также в лагунах вблизи пос. Умба (Гурвич, Соколова, 1939). Мелководные участки озера осваивают разнообразные насекомые (жуки, хирономиды и другие двукрылые). Снижение разнообразия моллюсков и повышение доли амфибиотических насекомых аналогично тому, что зарегистрировано в лагунах Сахалина со сходными значениями солености (Естественная история Сахалина …, 2014). В отдельные годы, при значительном распреснении верхнего слоя водной толщи, вблизи уреза воды в массе появляются личинки ручейников рода Limnephilus. Такое же явление отмечалось в лагунах вблизи пос. Умба (Гурвич, Соколова, 1939).
В озерах Б. Хрусломены и Еловый Наволок верхний слой водной толщи сильно распреснен, и на долю соленого аэробного слоя приходится лишь небольшая часть донной поверхности. Фауна этих водоемов в основном состоит из личинок насекомых, а от морской фауны остаются лишь эвригалинные формы – бокоплав G. duebeni и хирономида Ch. gr. salinarius. В оз. Б. Хрусломены преобладает Ch. gr. salinarius (рис. 3в); доминантной формой в оз. Еловый Наволок является хирономида Pseudochironomus gr. prasinatus (рис. 3г).
В двух оставшихся прибрежных водоемах соленая водная масса (монимолимнион) по всей толще заражена сероводородом, нет условий для обитания морских или эвригалинных форм. Поэтому бентос представлен только пресноводными формами, в основном насекомыми и моллюсками континентального происхождения. Лишь в меромиктическом оз. Н. Ершовском сохраняется популяция G. duebeni в наиболее близкой к морю части водоема.
Основу биомассы в оз. Н. Ершовском и оз. Трехцветном составляют хирономиды, для каждого озера характерен свой набор видов, меняющийся год от года. Например, в оз. Н. Ершовское в 2015 г. зарегистрирована вспышка численности Endochironomus albipennis, больше в массе не встреченного ни в одном из озер; летом 2017 г. уже преобладал Ch. gr. plumosus. В пресном миксолимнионе оз. Трехцветное макрофауна типично пресноводная: преобладают хирономиды, в особенности Ch. plumosus.
Пресные водоемы по фауне в целом похожи на пресный миксолимнион меромиктических озер, однако разнообразие насекомых (стрекозы, жуки, клопы, двукрылые) в них выше и больший вклад в биомассу вносят двустворчатые моллюски (рис. 3д), что согласуется с данными предыдущих исследователей (Извекова и др., 1970).
Состав фауны меняется в соответствии с соленостью верхнего слоя (рис. 4). Наиболее соленые водоемы – лагуна на Зеленом мысе (23.4 ± 0.04 psu), Вонючка на острове Тонисоар (21.1 ± 0.05) и Губа Глубокая (17 ± 7) обладают близкой к типичной беломорской фауной. Оз. Мероламбина, несмотря на мощный пресный сток и соответствующее распреснение верхнего слоя водной толщи, обладает близкой по составу и количественным характеристикам к предыдущим трем водоемам. Оз. Кисло-Сладкое (16.7 ± 0.7) уже существенно отличается как по составу, так и по количественным характеристикам бентоса в сторону обеднения. Тенденция продолжается и далее: оз. Большие Хрусломены (5.3 ± 0.5) населяет самая бедная фауна среди исследованных водоемов. Меромиктические водоемы: оз. Еловый Наволок (0.5 ± 0.3), Нижнее Ершовское (0.2 ± 0.05) и Трехцветное (0.5 ± 0.1) уже вполне соответствуют по фауне пресноводным водоемам.
Рис. 4.
Ординация водоемов методом многомерного шкалирования. Водоемы расходятся согласно фактору оси солености верхнего слоя водной толщи.
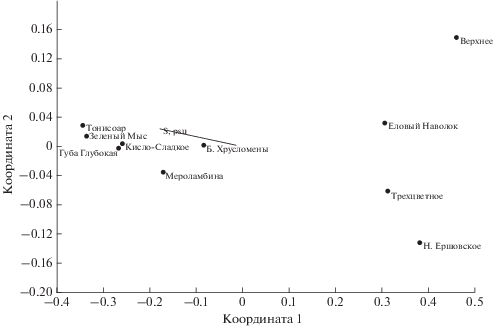
В том же порядке отделяющиеся водоемы выстраиваются и по показателю удельного водосбора (отношение площади водосбора к площади озера (Краснова и др., 2016)). Наиболее изолированный и соленый водоем – лагуна на Зеленом мысе – обладает наименьшим показателем удельного водосбора (7.2). Кисло-Сладкое оз. имеет больший показатель: 9.72; у озер Трехцветного и Нижнего Ершовского эти показатели наибольшие (19.8 и 15.1).
Количественные характеристики
Максимальное число видов отмечается в соностровских лагунах (23–34 вида); в оз. Кисло-Сладком встречается 10–15 видов за съемку. В оз. Б. Хрусломены аэробный слой приходится на критическую соленость, и число видов минимально (6–10); при появлении в водоеме стабильного пресного слоя видовое разнообразие снова возрастает в соответствии с классическими представлении о критической солености (Khlebovich, Aladin, 2010). То же наблюдается в олигогалинных лагунах о-ва Сахалин (Естественная история Сахалина …, 2014). В целом, частичная изоляция водоема на ранних этапах приводит к некоторому снижению видового разнообразия, которое усугубляется по мере повышения застойности и заиления литорали, как при естественных процессах, так и при искусственном отделении водоема (Марфенин и др., 1995). Во фьордах и ковшовых губах, в том числе, и в силу больших размеров, снижение разнообразия выражено слабее и больше характерно для литоральной зоны (Макаров и др., 2016; Деарт и др., 2018). При дальнейшей изоляции изменения становятся более выраженными и начинают затрагивать сублиторальную зону (Гурвич, Соколова, 1939).
Количественные характеристики макробентофауны изменяются в том же направлении. Максимальная численность отмечена в морских лагунах (до 100 тыс. экз./м2), в среднем около 10 тыс. экз./м2 (Грачев и др., 2015), что соответствует или лишь немного меньше, нежели на открытых участках литорали (Макаров и др., 2016). В оз. Кисло-Сладком среднее значение численности существенно ниже (около 3 тыс. экз./м2 (Buvalyy et al., 2015; Крылова и др., 2015)). На соседних участках литорали численность донных беспозвоночных обычно несколько ниже, чем в морских лагунах, и варьирует от 500 до 3000 экз./м2. Те же значения характерны и для литорали Бабьего моря (Макаров и др., 2016). Наименьшие значения плотности бентоса отмечаются в меромиктических водоемах (оз. Б. Хрусломены, Еловый Наволок, Трехцветное) – около 1000 экз./м2. Пресноводные водоемы сильно варьируют по численности бентоса (1300–9000 экз./м2 (Косенков и др., 2015)).
Максимум биомассы – 200–300 г/м2 – отмечается на морской литорали открытых лагун (Столяров, Мардашова, 2017), что вполне соответствует продуктивности макрозообентоса беломорской литорали или даже немного превышает эту продуктивность (Макаров и др., 2016). Несколько меньшие значения биомассы – 50–170 г/м2 – в лагунах на ранних стадиях отделения (Грачев и др., 2015; Мардашова и др., 2015б), 20–60 г/м2 – в оз. Кисло-Сладком (Buvalyy et al., 2015; Мардашова и др., 2015). Биомасса в крупных ковшовых губах, например в Бабьем море, занимает промежуточное положение между морскими лагунами и оз. Кисло-Сладким (50–60 г/м2 (Макаров и др., 2016)). Еще ниже биомасса (10–40 г/м2) в пресноводных и меромиктических озерах (Косенков и др., 2015; Мардашова и др., 2015а). На примере о-ва. Сахалин показано, что в лагунах количественные показатели бентоса зачастую выше, нежели на окружающем прибрежье (Естественная история Сахалина …, 2014). В случае беломорских лагун это справедливо лишь для самых начальных стадий отделения. Значения биомассы бентоса достигают 200–300 г/м2 лишь в лагуне на Зеленом мысе и оз. Мероламбина в поясах крупных скоплений двустворчатых моллюсков. В среднем для Кислой губы, прилегающей к лагуне на Зеленом мысе, характерны значения биомассы бентоса 114 ± 9 г/м2 (Столяров, Мардашова, 2017).
В водоемах с пресным миксолимнионом максимум численности и биомассы приурочен к верхнему полуметру (Косенков и др., 2015; рис. 5), в то время как в морских лагунах он расположен в диапазоне глубин 1–2.5 м, причем в менее изолированных водоемах он находится глубже, чем в более отделенных. Любопытно, что максимум количественных характеристик приходится на слой с наибольшим кислородным насыщением. Наумов с соавторами (2016) предполагают возможность определяющего влияния кислородного режима на вековые изменения фауны, по крайней мере, в глубоководном арктическом комплексе.
Рис. 5.
Количественные характеристики макрозообентоса. а – Распределение общей биомассы макрозообентоса по глубинам в соленых лагунах на примере лагуны на Зеленом мысе. Максимум приходится не на самый верхний горизонт, в отличие от меромиктических и пресноводных водоемов, а на зону с повышенным содержанием кислорода. б – Распределение общей численности макрозообентоса по глубинам на примере трех водоемов.
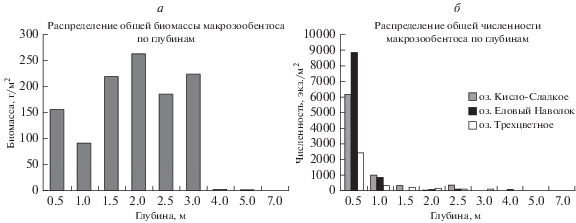
Приуроченность пресноводных форм к самым верхним горизонтам и существенное снижение разнообразия и плотности поселения бентоса в нижележащих зонах отмечалась и в пресных озерах о-ва Великий. К примеру, в оз. Малом Кумяжьем средняя численность бентоса на литорали 900 экз./м2 при биомассе 2 г/м2, что согласуется с нашими данными в верхнем полуметре пресных водоемов, в то время как на глубинах свыше 3 м эти показатели составляют 60 экз./м2 и 0.2 г/м2 соответственно (Извекова и др., 1970). Исследованные нами пресные водоемы обладают меньшими глубинами, чем озера острова Великий, с чем мы и связываем меньшее разнообразие форм и еще большую приуроченность к береговой линии. В сопоставимых по размеру водоемах число встреченных видов (6–27) соответствует данным Извековой с соавторами (1970). В оз. Верхнее они также отмечали преобладание хирономид. Пресные озера в сравнении с отделяющимися водоемами нами исследованы пока недостаточно тщательно, чтобы судить о полноте видовых списков. Однако видно, что массовые формы хирономид могут меняться год от года независимо в разных водоемах.
ЗАКЛЮЧЕНИЕ
Сообщества макрозообентоса отделяющихся водоемов Белого моря изменяются в процессе эволюции водоема сходным образом и сообразно смене гидрологического режима. По мере отделения водоема сначала происходит обеднение литоральной и сублиторальной фауны, в первую очередь за счет инфауны, затем фауна сменяется эврибионтными формами, после чего видовое разнообразие начинает снова возрастать, благодаря развитию личинок насекомых, и, наконец, происходит смена на пресноводные формы.
Видовой состав макрозообентоса определяется соотношением влияния берегового стока и моря на гидрологическую структуру водоема и зависит от солености слоя, пригодного для обитания аэробной фауны. Количественные характеристики бентоса в ряду отделяющихся водоемов иллюстрируют концепцию критической солености. Вертикальное распределение бентоса связано с гидрологической зональностью водоема. В меромиктических водоемах с пресным миксолимнионом максимумы численности и биомассы приурочены к верхнему полуметру, тогда как в морских лагунах максимумы расположены в диапазоне глубин 1–2.5 м с наибольшим содержанием растворенного кислорода, а нередко и пересыщением. Таким образом, наиболее благоприятной для морского бентоса является зона с застойной соленой водой, перенасыщенной кислородом, которая располагается ниже пикноклина. На ранних стадиях отделения плотность и биомасса бентоса могут сначала возрастать с глубиной, и лишь затем снижаться; на более поздних стадиях бентос все более приурочен к миксолимниону.
Типологический ряд водоемов на разных стадиях изоляции от материнского водоема можно продолжить в макромасштабе на Белое море, которое может быть рассмотрено в качестве своеобразной ковшовой губы Баренцева моря. Соленость Белого моря снижена в сравнении с океанической и сопоставима со значениями солоноватоводных лагун Сахалина. Этому порядку изоляции соответствует выпадение из биоценоза многих форм иглокожих, ракообразных и других групп, что наблюдается как в ряду Баренцево – Белое моря, так и в сравнении морских и солоноватоводных лагун Сахалина (Естественная история Сахалина …, 2014).
Список литературы
Грачев Д.И., Лялина Е.М., Ситников К.М., Трифанов П.В., Крылова М.А., Мардашова М.В., 2015. Количественное распределение моллюсков и других массовых беспозвоночных по глубинам в лагуне на Зеленом мысу (Белое море) // Водные ресурсы, экология и гидрологическая безопасность: Сборник трудов IX Международной научной конференции молодых ученых и талантливых студентов, 30 ноября 2 декабря 2015 г. Москва. С. 24–27.
Горбунов М.Ю., Уманская М.В., Краснова Е.С., 2007. Характеристика абиотических условий в экосистеме Нижнего пруда Ботанического сада Самарского университета // Самарская Лука: проблемы региональной и глобальной экологии. № 1–2 (19–20). С. 131–143.
Гурвич Г.С., Соколова Е.В., 1939. К познанию реликтовых водоемов Белого моря // Труды Государственного гидрологического института. Вып. 8. Т. 15. С. 142–161.
Гурьянова В.Ф., 1951. Бокоплавы морей СССР и сопредельных вод (Amphipoda-Gammaridea). М.–Л.: Изд-во АН СССР. 1031 с.
Деарт Ю.В., Переладов М.В., Спиридонов В.А., Антохина Т.И., Ржавский А.В., Бритаев Т.А., 2018. Донные сообщества мягких грунтов соленых озер Сисяярви и Линьялампи (Баренцево море) // Доклады Академии Наук. Т. 478. № 5. С. 608–612.
Естественная история Сахалина и Курильских островов, 2014. Водоемы острова Сахалин: от лагун к озерам / Лабай В.С., Атаманова И.А., Заварзин Д.С., Мотылькова И.В., Мухаметова О.Н., Никитин В.Д. Южно-Сахалинск: ГБУ культуры “Сахалинский областной краеведческий музей”. 208 с.
Жирков И.А., 2001. Полихеты Северного Ледовитого Океана. М.: Янус-К. 631 с.
Извекова Э.И., Качанова-Львова А.А., Соколова Н.Ю., 1970. Фауна озер острова Великого и полуострова Киндо Кандалакшского залива Белого моря // Биология Белого моря. Труды Беломорской биологической станции МГУ. Т. 3. Москва. С. 113–149.
Иллюстрированные определители свободноживущих беспозвоночных евразийских морей и прилежащих глубоководных частей Арктики, 2009. Т. 1. Коловратки, морские пауки, ракообразные: усоногие, тонкопанцирные, эуфаузииды, неполнохвостные, мизиды, капреллиды / Сиренко Б.И. (ред.). М.: Товарищество научных изданий КМК. 189 с.
Иллюстрированные определители свободноживущих беспозвоночных евразийских морей и прилежащих глубоководных частей Арктики, 2010. Т. 2 Немертины, головохоботные (приапулиды, киноринхи), малощетинковые черви, пиявки, погонофоры, эхиуры, сипункулы, форониды, плеченогие / Бужинская Г.Н. (ред.). М.–СПб.: Товарищество научных изданий КМК. 186 с.
Комплексные исследования Бабьего моря, полуизолированной беломорской лагуны: геология, гидрология, биота – изменения на фоне трансгрессии берегов (Труды Беломорской биостанции МГУ, т. 12), 2016. Мокиевский В.О., Исаченко А.И., Дгебуадзе П.Ю., Цетлин А.Б. (ред.). М.: Товарищество научных изданий КМК. 243 с.
Косенков А.В., Мардашова М.В., Крылова М.А., Изъюров И.В., Виноградов Д.С., Краснова Е.Д., 2015. Количественное распределение макрозообентоса в озере Трехцветном // VII Молодежный Конгресс по итогам практик: тезисы докладов. Москва. С. 179–180.
Кравчуновская Е.А., Горин С.Л., 2010. Формирование и динамика блокирующих аккумулятивных форм в лагунных эстуариях Камчатки // Учение о развитии морских берегов: вековые традиции и идеи современности: материалы конференции. Санкт-Петербург. С. 216–218.
Краснова Е.Д., Воронов Д.А., Демиденко Н.А., Кокрятская Н.М., Пантюлин А.Н. и др., 2016. К инвентаризации реликтовых водоемов, отделяющихся от Белого моря // Комплексные исследования Бабьего моря, полу-изолированной беломорской лагуны: геология, гидрология, биота изменения на фоне трансгрессии берегов. Т. 12. Труды Беломорской биостанции МГУ. М.: Товарищество научных изданий КМК. С. 211–241.
Краснова Е.Д., Пантюлин А.Н., Рогатых Т.А., Воронов Д.А., 2013. Инвентаризация отделяющихся от моря водоемов на Карельском берегу Белого моря // Проблемы изучения, рационального использования и охраны природных ресурсов Белого моря. Петрозаводск. С. 164–167.
Крылова М.А., Мардашова М.В., Изъюров И.В., Косенков А.В., Виноградов Д.С. и др., 2015. Исследование бентосного сообщества Кисло-Сладкого озера в июле 2015 г. // VII Молодежный Конгресс по итогам практик: тезисы докладов. Москва. С. 181–182.
Макаров А.В., Симаков М.И., Басин А.Б., Удалов А.А., 2016. Макробентос литорали и верхней сублиторали Бабьего моря // Комплексные исследования Бабьего моря, полуизолированной беломорской лагуны: геология, гидрология, биота изменения на фоне трансгрессии берегов. Труды Беломорской Биостанции МГУ. Т. 12. С. 144–154.
Мардашова М.В., Балабин Ф.А., Косенков А.В., Краснова Е.Д., 2015. Исследование бентосного сообщества Кисло-Сладкого озера, отделяющегося от Белого моря, зимой 2015 г., // Биоразнообразие наземных и водных животных. Зооресурсы.: III Всероссийская научная Интернет-конференция с международным участием: материалы конф. (Казань, 24 февраля2015 г.) / Сервис виртуальных конференций PaxGrid, ИП Синяев Д.Н. Казань. С. 41– 49.
Мардашова М.В., Крылова М.А., Изъюров И.В., Воронов Д.А., Краснова Е.Д., 2015а. Исследование бентосного сообщества озера Нижнего Ершовского в марте 2015 г. // Сборник тезисов IV международной научно-практической конференции Морские исследования и образование: MARESEDU-2015. Москва. С. 84–85.
Мардашова М.В., Крылова М.А., Изъюров И.В., Воронов Д.А., Краснова Е.Д., 2015а. Исследование макрозообентоса озера на Зеленом мысу в июле 2015 г. // Сборник тезисов IV международной научно-практической конференции Морские исследования и образование: MARESEDU-2015. Москва. С. 148–150.
Марфенин Н.Н., Малютин О.И., Перцова Н.М., Пантюлин А.Н., Усачев И.Н., 1995. Влияние приливных электростанций на окружающую среду. М.: Изд-во МГУ. 125 с.
Мокиевский В.О., Дгебуадзе П.Ю., Неретин Н.Ю., 2016. О зональности литорали Бабьего моря // Комплексные исследования Бабьего моря, полу-изолированной беломорской лагуны: геология, гидрология, биота изменения на фоне трансгрессии берегов. Т. 12. Труды Беломорской биостанции МГУ. М.: Товарищество научных изданий КМК. С. 154–162.
Моллюски Белого моря, 1987. Л.: Наука. 328 с.
Наумов А.Д., 1979. Донная фауна губы Лов (Белое море, Кандалакшский залив) и ее особенности // Экология донного населения шельфовой зоны. С. 128–136.
Наумов А.Д., 2006. Двустворчатые моллюски Белого моря. Опыт эколого-фаунистического анализа. СПб. 367 с.
Наумов А.Д., Мартынова Д.М., 2016. Летняя структура вод Бабьего моря. Сравнительный анализ данных двух разных десятилетий // Комплексные исследования Бабьего моря, полу-изолированной беломорской лагуны: геология, гидрология, биота изменения на фоне трансгрессии берегов. Т. 12. Труды Беломорской биостанции МГУ. М.: Товарищество научных изданий КМК. С. 55–67.
Наумов А.Д., Мокиевский В.О., Исаченко А.И., Савченко О.Н., Биягов К.Л., Аристов Д.А., 2016. Сублиторальные сообщества макробентоса Бабьего моря // Комплексные исследования Бабьего моря, полу-изолированной беломорской лагуны: геология, гидрология, биота изменения на фоне трансгрессии берегов. Т. 12. Труды Беломорской биостанции МГУ. М.: Товарищество научных изданий КМК. С. 122–143.
Олюнина О.С., Романенко Ф.А., 2007. Поднятие Карельского берега Белого моря в голоцене по результатам изучения торфяников. Материалы V Всерос. совещ. по изучению четвертичного периода: “Фундаментальные проблемы квартера: итоги изучения и основные направления дальнейших исследований”. М.: ГЕОС. С. 312–315.
Определитель пресноводных беспозвоночных России и сопредельных территорий, 2001. Под общ. ред. Цалолихина С.Я. Т. 5. Высшие насекомые. СПб.: Наука. 825 с.
Определитель пресноводных беспозвоночных России и сопредельных территорий, 1994. Под общ. ред. Цалолихина С.Я. Т. 1. Низшие беспозвоночные. СПб.: Наука. 394 с.
Определитель фауны и флоры северных морей СССР, 1948. Под ред. Гаевской Н.С. М.: Советская наука. 740 с.
Реликтовое озеро Могильное (исследования 1997–2000 гг.), 2002. Мурманск: Изд-во ПИНРО. 164 с.
Романенко Ф.А., Шилова О.С., 2012. Послеледниковое поднятие Карельского берега Белого моря по данным радиоуглеродного и диатомового анализов озерно-болотных отложений полуострова Киндо // Доклады Академии наук. Т. 442. № 4. С. 544–548.
Семенов В.Н., 1988. Классификация морских бассейнов бореально-арктической зоны: экологический подход. Апатиты: изд-во КФ АН СССР. 26 с.
Семенов В.Н., 1988а. Систематика и экология морских бассейнов Севера на разных этапах изоляции. Апатиты: ММБИ. 45 с.
Соколов А.А., 1952. Гидрография СССР. Л.: Гидрометеоиздат. URL: http://www.abratsev.narod.ru/biblio/sokolov/content.html
Столяров А.П., 2016. Макробентос лагунной экосистемы Ермолинской губы (Кандалакшский залив, Белое море): особенности структуры, разнообразие и тенденции изменений // Вестник Тверского государственного университета: Биология и экология. Т. 4. С. 130–150.
Столяров А.П., Мардашова М.В., 2017. Особенности структуры и разнообразие сообществ макробентоса в прибрежных лагунных экосистемах (Кандалакшский залив, Белое море) // Бюллетень Московского общества испытателей природы. Отдел биологический. Т. 122. № 3. С. 18–27.
Субетто Д.А., Шевченко В.П., Лудикова А.В., Кузнецов Д.Д., Сапелко Т.В. и др., 2012. Хронология изоляции озер Соловецкого архипелага и скорости современного озерного осадконакопления // Доклады Академии Наук, Серия “Геология”. Т. 446. № 2. С. 183–190.
Ушаков П.В., 1955. Многощетинковые черви Дальневосточных морей СССР (Polychaeta). М.–Л.: ЗИН АН СССР. 446 с.
Цветкова Н.Л., 1975. Прибрежные гаммариды северных и дальневосточных морей СССР и сопредельных вод. Л.: Наука. 257 с.
Чебанова В.В., 2013. Динамика распределения и обилия макрозообентоса в озерной системе Нерпичье–Култучное (эстуарий р. Камчатки) // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Т. 31. С. 89–97.
Чертопруд М.В., Чертопруд Е.С., 2003. Краткий определитель беспозвоночных пресных вод центра Европейской России. М.: МАКС Пресс. 196 с.
Шапоренко С.И., 2004. Кисло-Сладкие озера у Полярного круга // Природа. № 11. С. 23–31.
Шилин М.Б., 2009. Кислогубская приливная электростанция: возвращаясь снова и снова // Ученые записки Российского государственного гидрометеорологического университета. Научно-теоретический журнал. Т. 11. С. 101–112.
Buvalyy S., Garmaeva S., Mardashova M., Krasnova E., Menshenina L., 2015. Macrobenthos composition at the shoreline of Kislo-Sladkoye lake, separating from the White sea. EARSeL eProceedings. V. 14(S1). P. 63–70.
Hammer O., Harper D.A.T., Ryan P.D., 2003. PAST – Palaeontological Statistics, ver. 1.12. November 27. http: // folk.uio.no/ohammer/past
Kharcheva A.V., Meschankin A.V., Lyalin I.I., Krasnova E.D., Voronov D.A., Patsaeva S.V., 2014. The study of coastal meromictic water basins in the Kandalaksha Gulf of the White Sea by spectral and physicochemical methods // Proceedings of SPIE – The International Society for Optical Engineering. № 9031. P. 1–6.
Khlebovich V.V., Aladin N.V., 2010. The salinity factor in animal life. Herald of the Russian Academy of Sciences. V. 80(3). P. 299–304.
Krasnova E.D., Kharcheva A.V., Milyutina I.A., Voronov D.A., Patsaeva S.V., 2015 Study of microbial communities in redox zone of meromictic lakes isolated from the White Sea using spectral and molecular methods // Journal of the Marine Biological Association of the United Kingdom. V.95(8). P. 1579–1590.
Mardashova M.V., Balabin F.A., Buvaly S.E., Garmaeva S.B., Grigorieva A.A. et al., 2014. Investigation of separating sea bays: an integrated approach (bathymetry, structure of the water column, benthic communities, ecology of indicator benthic and terrestrial species) on the model Kislo-Sladkoye and Lower Ershovskoye lakes. // Abstracts of lectures and poster presentations of the International White Sea Student Workshop on Optics of Coastal Waters; N. Pertsov White Sea Biological Station of MSU; Republic of Karelia, Russia,30 August 7 September, 2014. WSBS Moscow. P. 23–24.
Strelkov P., Shunatova N., Fokin M., Usov N., Fedyuk M., et al., 2014. Marine Lake Mogilnoe (Kildin Island, the Barents Sea): one hundred years of solitude // Polar biology. V. 37 (3). P. 297–310.
Tolomeev A.P., Shulepina S.P., Makhutova O.N., Ageev A.V., Drobotov A.V., Sushchik N.N., 2018. Taxonomic composition and biomass of zoobenthos in saline Lake Shira: shifts that happened in 65 years // Journal of Siberian Federal University. Biology. № 11(4). P. 367–383.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


