Зоологический журнал, 2020, T. 99, № 7, стр. 801-818
Ковшовые губы Баренцева моря как модельные объекты изучения динамики прибрежных сообществ с чужеродным камчатским крабом (Paralithodes camtschaticus, Decapoda, Lithodidae)
В. А. Спиридонов a, *, А. К. Залота a, М. В. Переладов b, Ю. В. Деарт c, А. В. Тиунов c, Т. А. Бритаев c
a Институт океанологии им. П.П. Ширшова РАН
117997 Москва, Россия
b Всероссийский научно-исследовательский институт
рыбного хозяйства и океанографии (ВНИРО)
107140 Москва, Россия
c Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Россия
* E-mail: vspiridonov@ocean.ru
Поступила в редакцию 26.11.2019
После доработки 11.01.2020
Принята к публикации 15.03.2020
Аннотация
Донные сообщества частично изолированных ковшовых губ (лагун) кута губы Амбарной (Линьялампи и Сисяярви) отражают влияние ограничения водообмена и волнения в сочетании с другими абиотическими и биотическими факторами. Среди последних особенно важную роль может играть присутствие многочисленной группировки камчатского краба (Paralithodes camtschaticus), акклиматизированного в южной части Баренцева моря во второй половине 20-го века. Медианная плотность молоди и взрослых крабов в лагунах (42.5–52 экз./1000 м2 в большинство лет наблюдений) сопоставима с плотностью в соседних открытых частях Варангер-фьорда. Узкий и мелководный пролив, связывающий лагуны с морем, может ограничивать перемещение крабов между ними. Таким образом, взрослые крабы присутствуют в лагунах и в те сезоны, когда в своих обычных местообитаниях они мигрируют от берега на большие глубины. Охарактеризованы пищевые цепи, ведущие от фитопланктона и макрофитов к донным хищникам – камчатскому крабу, крабу-пауку (Hyas araneus) и раку-отшельнику (Pagurus pubescens). Трофический уровень взрослых камчатских крабов в лагунах (2.88) ниже уровня, на котором находятся крабы-пауки (3.16–3.42) и камчатские крабы в открытой части прибрежной зоны (3.44). Это указывает на различия характера питания крабов в лагунах и в открытых прибрежных водах. В трофической сети лагун не выражена характерная для прибрежной зоны Баренцева моря пищевая цепь “ламинариевые водоросли–морские ежи–камчатские крабы”. Низкая численность и особенности распределения морских ежей в лагунах могут быть обусловлены выеданием их камчатскими крабами в течение длительного времени. Хотя ковшовые губы Линьялампи и Сисяярви являются полноценными морскими водоемами, они в ряде характеристик сходны с настоящими озерами. Так же как озера они являются удобными моделями для изучения долговременной динамики сообществ и экосистем.
На фьордовых и фиардовых побережьях Фенноскандии и Кольского п-ова в Баренцевом и Белом морях встречаются ковшовые губы площадью порядка 0.1–10 км2, в которых глубокие внутренние части отделены от моря узкими и мелководными протоками. Они характеризуются специфическим гидрологическим режимом, определяемым геоморфологическими особенностями водоемов и условиями их водообмена с сопредельными районами моря (Книпович, 1893; Гурвич, 1934; Соколова, 1934; Семенов, 1988; Бобков и др., 2010; Комплексные исследования…, 2016; Краснова и др., 2016). Благодаря этому в таких водоемах удается легче вычленить ведущие физические факторы, определяющие условия существования биоты, и оценивать их изменения в многолетнем аспекте даже при ограниченных регулярных наблюдениях. Донные сообщества частично изолированных водоемов представляют результат своеобразного естественного эксперимента, отражающего влияние разного уровня ограничения водообмена в сочетании с другими абиотическими и биотическими факторами.
В прибрежье Баренцева моря в качестве такого существенного биотического фактора может рассматриваться присутствие многочисленной популяции камчатского краба (Paralithodes camtschaticus), интродуцированного в прибрежную зону Мурмана в 1960-е гг. (Кузьмин, Гудимова, 2002; Беренбойм, 2003; Орлов, 2004; Orlov, Ivanov, 1978). Это активный мигрирующий хищник с очень широким спектром питания, аналога которого в экосистеме Баренцева моря среди донных беспозвоночных не существовало (Анисимова, Манушин, 2003; Бритаев и др., 2007; Britayev et al., 2010; Falk-Petersen et al., 2011). Ряд наблюдений указывают, что эффект, связанный с потреблением камчатским крабом донной фауны, наиболее явственно проявляется в глубоких частично обособленных фьордах (Фролова и др, 2003; Britayev et al., 2010; Oug et al., 2011; Jørgensen, Spiridonov, 2013).
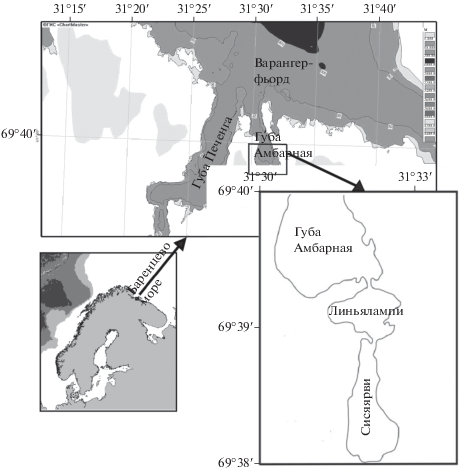
В куту губы Амбарной (Варангер-фьорд) располагаются две небольшие ковшовые губы, или лагуны, соединенные между собой и с морем узкими мелководными проливами. Они известны под названием соленых озер Линьялампи и Сисяярви (рис. 1, 2). В дальнейшем обозначения “ковши”, “ковшовые губы”, “лагуны” и “соленые озера” по отношению к ним используются как синонимы. Эти водоемы, в которых обитает камчатский краб, могут рассматриваться как пример модификации донных сообществ под воздействием ограничения водообмена с морем и низкой волновой нагрузки, на которую наложилось появление нового активного донного хищника, способного оказать воздействие на популяции ряда групп донных животных, в частности иглокожих (Переладов и др., 2013). В отличие от некоторых губ Восточного Мурмана (см. Бритаев и др., 2007; Деарт и др., 2017), для лагун Линьялами и Сисяярви отсутствуют опубликованные данные по сублиторальному макрозообентосу, полученные несколько десятилетий назад, до вселения камчатского краба. Тем не менее, наблюдения за наиболее крупными формами бентоса, включая камчатского краба, проводимые ВНИРО с 2001 г. (Переладов, 2003; Вилкова, Сабурин, 2006), исследования макробентоса в 2010–2012 гг. с ежегодными сборами на ряде стандартных станций (Переладов и др., 2013; Деарт и др., 2018; Pereladov et al., 2014) и исследования трофических связей в донном сообществе методом изотопного анализа позволяют дать интерпретацию факторам, влияющим на многолетние изменения донных сообществ.
Рис. 2.
Вид на губу Амбарную и лагуны Линьялампи и Сисяярви (северная часть) с юго-востока. Фото Т.И. Антохиной.

Настоящее исследование направлено на решение следующих задач: 1) оценку плотности популяции камчатского краба в ковшах кута губы Амбарной в разные годы и сезоны наблюдений; 2) предварительную характеристику пищевых цепей, ведущих от фитопланктона и макрофитов в лагунах, оценку трофического уровня камчатского краба в этих водоемах в сравнении с его трофическим уровнем в прибрежной экосистеме открытого фьорда, а также с трофическим уровнем нативных видов десятиногих ракообразных. Полученные данные и опубликованные ранее материалы по сообществам макрозообентоса (Переладов и др., 2013; Деарт и др., 2018) позволяют обсудить возможные изменения донных сообществ лагун Линьялампи и Сисяярви в многолетнем аспекте и значение этих лагун как модельного полигона для исследования прибрежных сообществ и экосистем юга-запада Баренцева моря.
МАТЕРИАЛ И МЕТОДИКА
Характеристика района исследования, биотопов и донных сообществ в ковшовых губах (лагунах) Линьялампи и Сисяярви (2010–2013 гг.)
Ковшовые губы (лагуны) губы Амбарной с их котловинами являются структурой тектонического происхождения, в формировании которой приняли участие четыре системы разломов (Бобков и др., 2013; Переладов и др., 2013). Общая площадь ковшовых губ составляет около 1 км2, при этом площадь лагуны Сисяярви почти в два раза превышает площадь Линьялампи (табл. 1). Пролив, соединяющий лагуну Линьялампи с губой Амбарной, характеризуется небольшой шириной (рис. 1, 2) и глубиной, не превышающей 1 м на малой воде. При этом максимальная глубина самого ковша составляет более 30 м. Пролив между лагунами Линьялампи и Сисяярви сходен по ширине с внешним проливом (рис. 1, 2), но несколько глубже, а сама лагуна Сисяярви имеет бóльшую глубину (табл. 1). Берега представлены клифами с высотой до 80 м и валунно-галечными пляжами; обширные осушки с песчаными осадками формируются только в районе устья реки, впадающей с восточной стороны в лагуну Линьялампи (рис. 2), и ручья на юге лагуны Сисяярви. Для большинства участков характерен крутой береговой склон, за которым следует относительно полого понижающееся дно в лагуне Линьялампи, а затем происходит более резкое снижение глубины в направлении центральной депрессии в ковше Сисяярви. В осадках преобладают галька, гравий, ракуша, обломки литотамния и заиленные песчаные фракции (рис. 3А–3Б) (Бобков и др., 2013; Переладов и др., 2013).
Таблица 1.
Морфометрические характеристики лагун Линьялампи и Сисяярви (Переладов и др., 2013) и максимальные скорости течений в проливах (Бобков и др., 2013)
| Показатель | Лагуна | ||
|---|---|---|---|
| Линьялампи | Сисяярви | ||
| Площадь, м2 | 394 234 | 393 380* | 629 899 |
| Береговая линии, м | 3041 | 3150* | 4209 |
| Минимальная ширина входного (северного) пролива, м | 43.7 | 43.6 | |
| Минимальная глубина входного пролива на малой воде, м | <1 | 1.5–2.0 | |
| Максимальная глубина, измеренная в 2011 г., м | 31 | 41 | |
| Максимальная скорость течения в j входном проливе (прилив/отлив, м/с) | 1.2/2.3 | 0.6/1.5 | |
Рис. 3.
Облик некоторых донных биотопов лагун Линьялампи и Сисяярви и обитающих в них крабов и раков-отшельников: А – участок дна у нижней границы зарослей ламинариевы водорослей (келпа); Б – участок заиленного песчаного дна с ракушей; В – мидиевая банка у входа в лагуну; Г – камчатский краб (Paralithodes camtschaticus) (Pc), питание инфауной у мыса Ристиниеми, Варангер-фьорд; Д – заросли келпа на крутых береговых склонах лагуны Сисяярви с крабами-пауками Hyas araneus (Ha), сидящими на водорослях; Е – камчатский краб (P. camtschaticus) (Pc), питание инфауной в лагуне Линьялампи; Ж – H. araneus (Ha) на донном субстрате в губе Амбарной; рак-отшельник Pagurus pubescens (Рр) в губе Амбарной. Фото: Т.И. Антохина (А, Б); С.Е. Аносов (В, Ж, З), М.В. Переладов (Г, Е), В.А. Спиридонов (Ж).

Приливный цикл в ковшовых губах в целом соответствует циклу в соседней открытой губе Печенга. Однако амплитуда прилива в лагуне Сисяярви почти в два раза меньше в силу трансформации приливной волны, проходящей через узкие и мелкие пороги. Во внутреннем ковше уровень моря растет заметно быстрее, чем падает, а в проливе, соединяющем Сисяярви и Линьялампи, существует постоянное стоковое течение у восточного берега (Бобков и др., 2013). Течение во внешнем проливе лагуны Линьялампи характеризуется высокими скоростями (табл. 1).
Влияние волнения в ковшах кута губы Амбарной на гидрологические и биологические процессы незначительно. Приливные течения перемешивают толщу воды в лагуне Линьялампи и северной части лагуны Сисяярви (Переладов и др., 2013). Здесь устанавливаются практически гомотермические условия, близкие к условиям кутовой части губы Амбарной, с более низкой, чем во внешних частях губ Амбарная и Печенга температурой весной (<1.5°C) (Сапожников и др., 2017) и более высокой в конце лета (10–12°C). При отсутствии значительных источников пресной воды (в лагуны впадает небольшая речка и ручей) соленость от зимней межени к лету меняется в пределах 33.9–33.1‰ (Бобков и др., 2013; Сапожников и др., 2017). В глубокой части ковша Сисяярви летом наблюдается выраженная стратификация. Верхний перемешанный слой простирается до глубины 15–16 м и подстилается слоем термоклина и галоклина с падением температуры до 2°С на глубине около 20 м. Соленость ниже термоклина сохраняет максимальные для кута губы Амбарной значения около 33.8, наблюдается существенное недонасыщение воды кислородом (Сапожников и др., 2017; А.К. Грузевич, личное сообщение). Зимой часть лагуны Сисяярви покрывается льдом (данные авторов).
Поясность донных сообществ лагун в целом соответствует той, что наблюдается в закрытых губах Баренцева моря. Пояс Fucus serratus L. развит на литорали и в верхнем горизонте сублиторали (где к нему добавляется Chorda sp.). Береговой склон покрыт сплошными зарослями ламинариевых водорослей, или келпом Saccharina latissimi (L.) C.E. Lane, C. Mayes, G. Druehl, G.W. Saunders, Laminaria hyperborea (Gunn.) Foslie и Desmarestia sp. до глубины 11–13 м (рис. 3А–3Д). Ниже (до глубины 20–25 м) располагаются биотопы и сообщества песчано-гравийного-галечного дна (рис. 3Б), на котором встречаются крупные двустворчатые моллюски модиолус (Modiolus modiolus), гребешок исландский (Chlamys islandica), другие фильтраторы-сестонофаги, такие как асцидии и балянусы, а также местами литотамний (Переладов и др., 2013). По данным дночерпательной съемки, здесь встречаются три типа сообществ (Деарт и др., 2018): сообщество обитателей смешанных грунтов на глубине 17–19 м; мелководное сообщество рыхлых грунтов, расположенное над летним термоклином на глубине от 8 до 15 м; и сообщество рыхлых грунтов, расположенное под термоклином глубже 15 м (в лагуне Сисяярви). Существенно, что иглокожие не представлены сколь-нибудь заметно ни в одном из этих сообществ, как и в сообществе ламинариевых водорослей, хотя иглы морских ежей встречаются в осадке повсеместно (Переладов и др., 2013; Деарт и др., 2018). Во всем исследованном диапазоне глубин для донных сообществ характерно присутствие и часто доминирование мидий (Mytilus edulis), особенно плотные поселения (банки) которых располагаются в проливах (рис. 3В) и на литорали вблизи устья речки, впадающей в лагуну Линьялампи с востока (Романова, 1969; Переладов и др., 2013; Деарт и др., 2018). Только на мидиевой банке в районе соединяющего Линьялампи и Сисяярви пролива были обнаружены морские ежи Strongylocentrotus sp., предположительно S. droebachiensis (Деарт и др., 2018) с плотностью поселения до 10 экз./м2. Там же в массе встречались офиуры, которые практически полностью заполняли собой все пространство между щетками мидий (М.В. Переладов, личное сообщение).
Учет камчатских крабов
Наблюдения за камчатскими крабами в соленых озерах Линьялампи и Сисяярви проводились в период с конца июля по первую половину сентября в 2006, 2007, 2010, 2011, 2012 и 2013 гг. в рамках общей гидробиологической съемки, проводимой ВНИРО в прибрежной зоне Варангер-фьорда для изучения многолетней динамики состояния запасов промысловых беспозвоночных и водорослей и основных характеристик прибрежной экосистемы с 2001 г. (Переладов, 2003; Вилкова, Сабурин, 2006). В мае 2006, мае 2010 г., августе 2011, и сентябре 2012 г. были проведены детальные учеты камчатских крабов на двух и более трансектах в обеих лагунах (табл. 2). При следовании по трансекте водолазом-исследователем визуально определялась плотность скоплений камчатского краба (экз./м2) с шириной карапакса (ШК) от 14 мм, с учетом протяженности разреза и видимости под водой. Непосредственно под водой определяли пол и измеряли ширину карапакса (с помощью мерной линейки) части взрослых крабов.
Таблица 2.
Данные учета камчатских крабов в лагунах Линьялампи и Сисяярви по отдельным разрезам
| Лагуна, положение разреза | Субстрат | Плотность популяции, экз./1000 м2 | ||||
|---|---|---|---|---|---|---|
| 2006 г., май |
2010 г., май |
2011 г., август |
2012 г., сентябрь |
Среднее значение и медиана (в скобках) | ||
| Линьялампи, у входного пролива | Галечник, песок | 21 | 159 | 50 | 23 | 63.2 ± 32.6 (36.5) |
| Линьялампи, порог у пролива, ведущего в лагуну Сисяярви | Валуны | 130 | 78 | 40 | 8 | 64 ± 26.2 (59) |
| Линьялампи, центральная часть | Ракуша | нд | нд | 80 | 2 | 41 |
| Сисяярви, кут | Валуны, песок | 52 | 10 | 45 | 4 | 27.5 ± 12.1 (27.5) |
| Сисяярви, вблизи входного (северного) пролива, западный берег | Скалы | нд | нд | 30 | 3 | 16.5 |
| Сисяярви, вблизи входного (северного) пролива, восточный берег | Скалы | нд | 18 | 6 | 6 | 10.0 ± 4.0 (6) |
Для сравнения оценок плотности популяции в соленых озерах и прилегающей части Варангер-фьорда были использованы данные ВНИРО, полученные в соответствующие периоды наблюдений на стандартных разрезах в губе Амбарной (у Белой скалы, старого финского причала и в бухте Пайтахамина), у мыса Ристиниеми (3 разреза), у мыса Палтусово Перо (1 разрез) и в бухте Малонемецкой (2 разреза).
Изучение трофических характеристик бентоса с помощью анализа состава стабильных изотопов азота и углерода
Сбор материала для изотопного анализа выполняли в августе 2013 г. Образцы водорослей (нижняя часть пластины ламинарии и верхние части таллома остальных водорослей) были собраны в лагуне Линьялампи вблизи пролива, соединяющего ее с губой Амбарной. Они были очищены скальпелем и промыты в морской воде. У животных были отобраны образцы мышечной (у всех крабов, раков-отшельников и моллюсков) и соединительной ткани. В табл. 3 приведен список видов и полученных от них проб использованных в анализе. Они включают представителей первичных продуцентов – красных и бурых водорослей, моллюсков и иглокожих, характер питания которых описан в литературе, и всех представителей рептантных Decapoda, которые встречены в лагунах и в сопредельных участках губы Амбарной – для сравнения с данными по камчатскому крабу. Все собранные камчатские крабы из губы Амбарная (8 особей: 3 самца и 5 самок с кладкой) и 3 самца из лагун были крупными половозрелыми особями (ШК более 100 мм).
Таблица 3.
Виды проанализированных организмов (Вид), собранных в лагунах Линьялампи и Сисяярви губы Амбарная Баренцева моря в начале сентября 2013 г.
| Вид | Сокращение | Часть тела | Лагуны Линьялампи и Сисяярви | Открытая часть губы Амбарная | ||||
|---|---|---|---|---|---|---|---|---|
| δ13C ‰ | δ15N ‰ | n | δ13C ‰ | δ15N ‰ | n | |||
| Paralithodes camtschaticus (Tilesius 1815) | ParCam | Мышечная ткань | –17.8 ± 0.5 | 9.9 ± 0.2 | 3 | –18.8 ± 0.5 | 10.7 ± 0.4 | 8 |
| Hyas araneus (L. 1758) | HyasAran | Мышечная ткань | –17.8 ± 1.1 | 10.8 ± 0.9 | 5 | –18.9 ± 0.3 | 10.5 ± 0.4 | 4 |
| Hyas coarctatus Leach 1815 | HyasCoar | Мышечная ткань | нд | нд | нд | –18.7 ± 1.1 | 10.6 ± 0.4 | 5 |
| Pagurus pubescens Krøyer 1838 | PagPub | Мышечная ткань | –16.9 ± 0.4* | 9.8 ± 0.4 | 4 | –18.0 ± 0.6 | 8.6 ± 0.4 | 4 |
| Strongylocentrotus sp. | Strong | Соединительная ткань Аристотелева фонаря | –16.1 ± 0.6 | 7.9 ± 0.7 | 5 | –18.0 ± 0.4 | 6.2 ± 0.8 | 4 |
| Asterias rubens L. 1758 | AsterRub | Амбулакральные ножки | –18.5 ± 0.4 | 7.9 ± 0.6 | 4 | нд | нд | |
| Littorina littorea (L. 1758) | LitLit | Ткань ноги | –16.8 ± 0.5 | 7.3 ± 0.6 | 4 | нд | нд | |
| Littorina cf. saxatilis | LitSax | Ткань ноги | –16.4 ± 0.3 | 6.9 ± 0.2 | 5 | нд | нд | |
| Buccinum undatum L. 1758 | Buccin | Ткань ноги | –18.9 ± 0.3 | 9.1 ± 0.3 | 3 | нд | нд | |
| Mytilus edulis L. 1758 | MytEdul | Мантия | –19.4 ± 0.5 | 6.3 ± 0.6 | 5 | нд | нд | |
| Macoma balthica (L. 1758) | MacomBal | Мускул | –15.3 ± 0.8 | 9.2 ± 0.3 | 4 | нд | нд | |
| Chlamys islandica (O. F. Müller 1776) | ChlamIsl | Мышца | –18.7 ± 0.9 | 8.6 ± 0.8 | 5 | нд | нд | |
| Chorda sp. | Chorda | Таллом | –14.3 ± 1.6 | 5.7 ± 0.7 | 5 | нд | нд | |
| Fucus vesiculosus L. 1767 | Fucus | Молодые растения | –16.9 ± 0.4 | 5.0 ± 0.3 | 4 | нд | нд | |
| Saccharina latissima (L.) C.E. Lane, C. Mayes, G. Druehl, G.W. Saunders 2006 | Saccharina | Нижняя часть пластины | –18.5 ± 1.0 | 5.0 ± 0.4 | 5 | нд | нд | |
| Palmaria sp. | Palmaria | Таллом | –19.5 ± 0.8 | 5.2 ± 0.2 | 4 | нд | нд | |
| Porphyra sp. | Porphyra | Таллом | –14.3 ± 1.6 | 5.4 ± 0.1 | 3 | нд | нд | |
Примечания. Сокращенное название, используемое на рис. 4, часть тела, использованная в анализе, средние величины δ13С и δ15N ± стандартное отклонение, количество (n) проанализированных особей, нд – нет данных.
Собранный материал был заморожен (–20°С) в пластиковых пробирках и перевезен в лабораторию. Перед анализом образцы были высушены до постоянного веса в течение 5–7 дней при 80°C, перетерты в порошок в ступке и упакованы в оловянную фольгу (по 200–500 мкг животных и около 1500 мкг растительных тканей).
Изотопный анализ был проведен с помощью изотопного масс-спектрометра Thermo Delta V Plus и элементного анализатора Thermo Flash 1112 в Центре коллективного пользования при ИПЭЭ РАН.
Соотношение стабильных изотопов (13С/12С и 15N/14N) представлено в тысячных долях (δ, ‰) отклонения от международных стандартов (VPDB для δ13C и атмосферный N2 для δ15N). Аналитическая погрешность определения изотопного состава (SD при анализе лабораторного стандарта, n = 6–8) не превышала 0.2‰. Корректировка результатов определения δ13С на содержание липидов не проводилась, так как массовое соотношение C : N в пробах варьировало незначительно (3.49 ± 0.2) и не превышало 4. Единственным исключением были мантии мидий (C : N 4.26 ± 0.23), для которых была применена поправка δ13С по формуле 3 Поста с соавторами (Post et al., 2007).
Для оценки трофического уровня (ТУ) камчатского краба и других декапод в лагунах и в открытой части залива Амбарная были выбраны относительно долгоживущие консументы первого порядка: морские ежи Strongylocentrotus droebachiensis, собранные среди ламинариевых водорослей (вблизи входа в соленые озера в губе Амбарной), и мидии. Для морских ежей этого вида многократно продемонстрировано преимущественное потребление (вплоть до выедания на значительной площади) ламинариевых водорослей (Кузнецов, 1946; Бажин, Степанов, 2012; Евсеева, 2016; Norderhaug, Christie, 2009; Fagerli et al., 2014), а мидии являются преимущественно потребителями фитопланктона (Verwey, 1952; Wiedemeyer, Schwamborn, 1996; Wong, Levinton, 2006; Jacobs et al., 2015). Мидии были собраны из пролива, разделяющего лагуну Линьялампи и губу Амбарную. При фильтрационном питании во время прилива и отлива они должны были потреблять фитопланктон, как из лагун, так и из моря. Трофический уровень (λ) этих видов принят за 2-й трофический уровень для последующих расчетов по формуле Поста (Post, 2002):
С или Nконсумент – δ13C или δ15N интересующего организма,
ΔN – трофическое фракционирование, равное 3.4‰.
Различия изотопного состава отдельных видов между разными местами сбора и с другими видами оценивались с помощью критерия Стьюдента (если нормальность распределения данных подтверждалась критерием Шапиро–Вилкса) или непараметрического критерия Манна–Уитни–Уилкоксона. Все статистические анализы были выполнены при помощи системы статистического анализа данных R (R Core Team, 2013).
РЕЗУЛЬТАТЫ
Межгодовые изменения численности и особенности размерного состава камчатских крабов
В 2006–2011 гг. оценки численности камчатских крабов в соленых озерах Линьялампи и Сисяярви по разрезам значительно варьировали (табл. 2, 4), средняя плотность популяции находилась в пределах 41.8–67.7 экз./1000 м2. При этом медианная плотность популяции менялась от 52 до 42.5 экз./1000 м2 (табл. 2). В 2012 г. отмечено снижение средней и медианной плотности популяции на порядок (табл. 4).
Таблица 4.
Сравнение плотности популяции (среднее и медианное количество на 1000 м2; ± ошибка средней) камчатского краба в лагунах Линьялампи и Сисяярви (лагуны) и прилегающей открытой части Варангер-фьорда (фьорд)
| Дата | Лагуны | Фьорд | Тест | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Cредняя | К | Медиана | n | Cредняя | К | Медиана | n | ||
| 2006 май | 67.7 ± 32.4 | 83 | 52 | 3 | 26.7 ± 2.7 | 30 | 30 | 9 | 0.31 |
| 2010 май | 66.3 ± 34.4 | 101 | 48 | 4 | 74 ± 13.3 | 54 | 80 | 9 | 0.64 |
| 2011 август | 41.8 ± 9.9 | 58 | 42.5 | 6 | 28.3 ± 14.2 | 133 | 9 | 7 | 0.3 |
| 2012 сентябрь | 7.7 ± 3.2 | 101 | 5 | 6 | 41.8 ± 9.9 | 58 | 42.5 | 6 | 0.02* |
Учеты, проведенные в 2010–2012 гг., когда выполнялось по несколько разрезов на каждое из соленых озер, показали, что плотность популяции крабов в лагуне Линьялампи была выше, чем в лагуне Сисяярви (табл. 2). Однако для 2011 и 2012 гг., когда учеты проводились на одном и том же количестве определенным образом расположенных разрезов в каждом соленом озере, непараметрический тест Манна–Уитни не показал статистически значимых различий. У входа в лагуну Линьялампи в 2010 г. отмечали поддинг – плотное скопление неполовозрелых особей, поэтому численность на единицу площади оказалась там максимальной (табл. 2).
В 2006, 2010 и 2011 гг. оценки плотности популяции камчатских крабов не обнаруживали статистически значимых различий между лагунами и прилежащей прибрежной зоной Варангер-фьорда (табл. 4). В 2012 г. плотность популяции крабов в лагунах была заметно меньше, чем во фьорде, и различия были статистически значимы. При этом ни средняя, ни медианная плотности популяции в соленых озерах и прилежащей части фьорда в одни и те же сроки наблюдений не обнаруживали статистически значимой корреляции.
Группировка крабов в соленых озерах была представлена практически всеми размерно-возрастными группами обоих полов. Наиболее мелкая и плохо учитываемая при водолазных работах молодь Paralithodes camtschaticus (ШК 3–6 мм в августе-сентябре) отмечена единично. Эти экземпляры, очевидно, были сеголетками, оседание которых произошло в текущем сезоне (Переладов, 2003). Максимальный размер встреченных крабов составил около 220 мм, при этом в августе и сентябре в лагунах Линьялампи были обычны как самки с кладкой, так и крупные самцы в размерном диапазоне ШК 150–200 мм, редко встречавшиеся в открытом прибрежье Варангер-фьорда на глубинах до 40 м.
Содержание стабильных изотопов углерода и азота в тканях и трофический уровень камчатского краба и ряда других видов в экосистеме лагун и губы Амбарной
В губе Амбарной и лагуне Линьялампи величина δ13С первичных продуцентов (водорослей-макрофитов) варьировала в пределах от –24.2 до –14.26‰ (табл. 3, рис. 4). В то же время величина δ15N всех проанализированных водорослей была почти одинакова, около 5.3 ± 0.3‰. Из всех консументов мидии оказались наиболее обеднены тяжелым изотопом углерода (–19.4 ± 0.5‰) и имели одну из наименьших величин δ15N (6.3 ± ± 0.6). Немного (но статистически достоверно) различающееся (табл. 5, 6) содержание 13С и более высокое содержание 15N наблюдалось у другого вида двустворчатых моллюсков-фильтраторов – исландского гребешка (Chlamys islandica; табл. 3, рис. 4). Близкое к гребешкам положение по величине δ13С и δ15N занимали морские звезды Asterias rubens и моллюски-трубачи (Buccimum undatum). Относительно обогащены 13С (на уровне высоких значений, свойственных ламинариевым водорослям и фукусам) оказались литорины, морские ежи и макома. Два последних вида из лагуны Линьялампи имели и более высокое, чем у мидий и литорин, значение δ15N – на уровне гребешков и морских звезд (табл. 3, 5, 6; рис. 4).
Рис. 4.
Изотопный состав углерода и азота (величины δ13С и δ15N) донных беспозвоночных, собранных в частично отделенной лагуне Линьялампи (квадраты) и губе Амбарная (кружки) Баренцева моря в 2013 г. Треугольники – изотопные характеристики макрофитов. Расшифровка сокращенных названий подписей приведена в табл. 3.
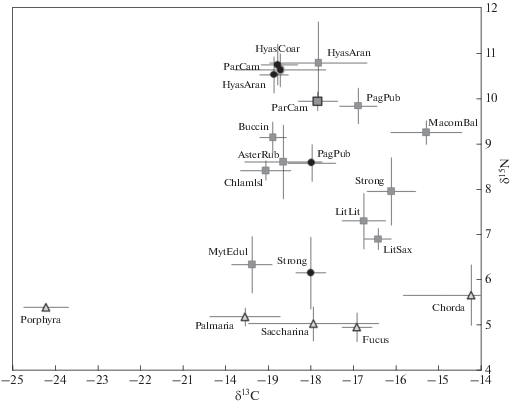
Таблица 5.
Результаты теста Шапиро–Уилкса (W) для сравнения δ13С и δ15N у организмов, собранных в губе Амбарная и лагунах Линьялампи и Сисяярви
| Вид | Губа Амбарная | Лагуны | ||||||
|---|---|---|---|---|---|---|---|---|
| δ13С | δ15N | δ13С | δ15N | |||||
| W | p | W | p | W | p | W | p | |
| HyasAran | 0.76 | 0.04 | 0.89 | 0.37 | 0.95 | 0.73 | 0.99 | 0.98 |
| Strong | 0.95 | 0.77 | 0.88 | 0.31 | 0.95 | 0.73 | 0.90 | 0.42 |
| PagPub | 0.88 | 0.35 | 0.86 | 0.26 | 0.95 | 0.73 | 0.96 | 0.79 |
| ParCam | 0.92 | 0.41 | 0.89 | 0.25 | 0.91 | 0.42 | 0.91 | 0.42 |
| ChlamIsl | нд | нд | нд | нд | 0.93 | 0.58 | 0.92 | 0.55 |
| AsterRub | нд | нд | нд | нд | 0.88 | 0.34 | 0.96 | 0.80 |
| Buccin | нд | нд | нд | нд | 0.81 | 0.14 | 0.81 | 0.14 |
| LitLit | нд | нд | нд | нд | 0.95 | 0.69 | 0.74 | 0.03 |
| LitSax | нд | нд | нд | нд | 0.95 | 0.77 | 0.96 | 0.79 |
| MacomBal | нд | нд | нд | нд | 0.88 | 0.35 | 0.75 | 0.04 |
| MytEdul | нд | нд | нд | нд | 0.78 | 0.05 | 0.97 | 0.86 |
Примечания. Сокращения названий и количество проанализированных организмов соответствуют табл. 3. p – уровень статистической значимости, нд – нет данных.
Таблица 6.
Результаты теста t-критерий Стьюдента (T) для сравнения δ13С и δ15N у одинаковых организмов, собранных в губе Амбарная и лагунах Линьялампи и Сисяярви (Лагуны–Губа), и у разных организмов в лагунах (Лагуны–Лагуны)
| Лагуны–Губа | Изотопы | p | T | df | |
|---|---|---|---|---|---|
| Strong | Strong | δ13С | >0.05 | –5.39 | 7.54 |
| δ15N | 0.29 | –1.18 | 5.30 | ||
| PagPub | PagPub | δ13С | 0.02 | –3.06 | 5.62 |
| δ15N | >0.05 | –4.45 | 5.99 | ||
| ParCam | ParCam | δ13С | 0.04 | –3.02 | 3.65 |
| δ15N | >0.05 | 4.05 | 8.08 | ||
| HyasAran | HyasAran | δ13С | 0.29 | W = 5 | нд |
| δ15N | 0.59 | –0.57 | 5.74 | ||
| Лагуны–Лагуны | Изотопы | p | T | df | |
| Strong | MytEdul | δ13С | 2.07e-06 | –12.89 | 7.55 |
| δ15N | 0.01 | –3.72 | 7.73 | ||
| ChlamIsl | MytEdul | δ13С | 0.01 | –3.61 | 5.82 |
| δ15N | >0.05 | –4.95 | 7.45 | ||
| ChlamIsl | AsterRub | δ13С | 0.44 | 0.82 | 6.81 |
| δ15N | 0.64 | 0.50 | 4.68 | ||
| ChlamIsl | Buccin | δ13С | 0.61 | 0.54 | 5.33 |
| δ15N | 0.25 | –1.29 | 5.70 | ||
| MytEdul | Macom | δ13С | >0.05 | –10.82 | 4.35 |
| δ15N | 0.02 | W = 0 | нд | ||
Примечания. Сокращения названий и количество проанализированных организмов соответствуют табл. 3. р – уровень статистической значимости, df – число степеней свободы, нд – нет данных.
Десятиногие ракообразные в лагунах занимали более высокое по отношению к указанным группам положение по содержанию тяжелого изотопа азота, имея большее относительное содержание 13С, чем потребители фитопланктона мидии. Трофические уровни камчатского краба и раков-отшельников (Pagurus pubescens) не достигали 3 и были близки, однако ткани раков-отшельников содержали больше 13С (табл. 3, 5, 6; рис. 3). Наиболее высокий трофический уровень занимали крабы-пауки (Hyas araneus) (табл. 7).
Таблица 7.
Трофический уровень основных видов декапод, собранных в губе Амбарная и лагунах Линьялампи и Сисяярви Баренцева моря в сентябре 2013 г.
| Вид | Трофический уровень | |
|---|---|---|
| Лагуны | Губа | |
| Paralithodes camtschaticus | 2.88 | 3.44 |
| Hyas araneus | 3.16 | 3.42 |
| Hyas coarctatus | нд | 3.46 |
| Pagurus bernhardus | нд | 3.28 |
| Pagurus pubescens | 2.72 | 2.81 |
В губе Амбарной изотопные подписи морских ежей, обитавших в келпе, существенно отличались от подписей морских ежей, обитавших на мидиевой банке c северной стороны пролива между лагунами Линьялампи и Сисяярви. Вне лагун ткани морских ежей имели более низкое содержание 13С, а содержание тяжелого изотопа азота у них соответствовало мидиям в лагунах (табл. 3, 5, 6; рис. 4). Камчатские крабы в губе имели более высокое значение δ15N (табл. 3, 5, 6; рис. 4) и трофический уровень (>3), чем в лагунах (табл. 7). В открытой части губы трофический уровень взрослых P. camtschaticus был сходен с трофическим уровнем крабов-пауков H. araneus (в губе и в лагунах) и Hyas coarctatus (встречался только в губе). Трофический уровень раков-отшельников в губе был ниже, чем в лагунах (рис. 4, табл. 7).
ОБСУЖДЕНИЕ
Популяционная группировка камчатских крабов в лагунах губы Амбарной
Особенностью жизненного цикла Paralithodes camtschaticus является смена биотопов в прибрежье по мере роста молодью до перехода к протяженными миграциям взрослых особей. Личинки камчатского краба в Баренцевом море оседают, в основном, на красные и бурые водоросли в прибрежье, где обитают и сеголетки (Переладов, 2003). Находки последних в келпе в соленых озерах указывают, что здесь происходит оседание личинок. Наблюдения летом 2003 г., когда в соленых озерах было отмечено большое количество осевшей молоди, указывают на то, что условия здесь (отсутствие волнения, прогреваемость воды) особенно благоприятны для оседания (Переладов, 2003). Годовики и более старшие неполовозрелые особи обитают на твердых и смешанных субстратах с развитым микрорельефом, обеспечивающим укрытие от хищников, также часто в поясе ламинарий (Матюшкин, 2003; Переладов, 2003; Соколов, 2003; Соколов, Штрик, 2003). Предпочитаемые местообитания взрослых крабов в Баренцевом море – в основном илисто-песчаные шельфовые участки с богатой инфауной (Соколов, Штрик, 2003), но в период обитания в прибрежной зоне они могут быть встречены в самых различных биотопах, включая вертикальные скальные стенки (Переладов, 2003). Для взрослых камчатских крабов характерны сезонные миграции, имеющие значительную региональную специфику и протекающие различным образом у самцов и самок (Виноградов, 1945; Кузьмин, Гудимова, 2002; Тальберг, 2005; Sundet, 2014). В Варангер-фьорде половозрелые крабы зимуют в нижней части шельфа и внутришельфовых депрессиях, в конце зимы–начале весны поднимаясь в прибрежную зону, где происходят линька, спаривание и размножение. Уже летом большая часть самцов покидает прибрежье, а самки с кладкой яиц на плеоподах остаются здесь дольше (Переладов, 2003; Тальберг, 2005; Sundet, 2014). Наличие крупных самцов в лагунах Линьялампи и Сисяярви в августе и сентябре весьма необычно. Оно свидетельствует, что сезонная миграция половозрелых особей из лагун, по крайней мере, ограничена. Очевидно, ограничения создаются узким и мелководным проливом, который крабам, возможно, непросто найти при своих обычных разнонаправленных перемещениях (Jörgensen et al., 2007). Кроме того, пролив может оказаться непроходимым для крабов в определенные фазы приливного цикла, например, при сильном встречном течении. В озере Сисяярви, двигаясь в конце лета от берегов на глубину, крабы оказываются в достаточно глубокой впадине, где и могут остаться зимовать. В других ковшовых губах с мелководными порогами такие “не нашедшие выхода” половозрелые особи также могут встречаться в конце лета на большой глубине (Деарт и др., 2017). Таким образом, лагуны Линьялампи и Сисяярви являются одним из тех немногих мест, в прибрежье Мурмана, где взрослые особи камчатского краба присутствуют вместе с другими возрастными группами в течение большей части или всего года, перераспределяясь по дну небольших обособленных участков. В настоящее время трудно сказать, происходит ли в ковшах губы Амбарной местное воспроизводство P. camtschaticus, и, если происходит, играет ли какую-либо роль в поддержании локальной популяционной группировки. Альтернативный сценарий предполагает, что эта группировка крабов формируется, в основном, за счет приноса и оседания личинок и миграции неполовозрелых и взрослых крабов через пролив извне. Отсутствие корреляции между медианной плотностью популяции в лагунах и в сопредельной части Варангер-фьорда может указывать на существенные отличия динамики численности популяционной группировки камчатского краба в лагунах от общей динамики численности крабов в прибрежной зоне моря. Так или иначе, в годы высокой численности камчатских крабов в лагунах постоянное присутствие всех возрастных групп на небольшой площади дна соленых озер должно оказывать более значительное, чем в других районах воздействие на сообщества бентоса за счет выедания крабами донных организмов.
Особенности трофических цепей и трофический уровень камчатских крабов в соленых озерах по данным анализа стабильных изотопов углерода и азота
Относительно закрытая система лагун Линьялампи и Сисяярви отличается от более открытых прибрежных районов Баренцева моря отсутствием фактора сильного волнения (влияющего, в частности на распределение макрофитов), необычным распределением морских ежей (не представленных в келпе) и постоянным присутствием всех возрастных групп крупного донного хищника – камчатского краба. Данные изотопного анализа обсуждаются ниже в свете общих для всей прибрежной зоны и особенных черт трофических связей донных организмов в лагунах и, в частности, трофического уровня камчатского краба и других декапод.
Исследования трофических характеристик экосистем Норвежского и Баренцева морей с помощью метода стабильных изотопов пока немногочисленны (Fredriksen, 2003; Zmudczyńska-Skarbek et al., 2015; Fuhrmann et al., 2017; Zmudczyńska-Skarbek, Balazy, 2017). Изотопный состав ламинариевых водорослей – основных макрофитов – продуцентов прибрежной зоны исследован для Laminaria hyperborea у побережья западной Норвегии (Fredriksen, 2003). Несмотря на различия видов, и районов наши данные для Sacharina latissima показывали близкие значения δ15N, а по δ13С были близки к величинам для крупных и более старых растений L. hyperborea. Красные водоросли у берегов западной Норвегии были обеднены тяжелым изотопом углерода (Fredriksen, 2003), что, соответствует нашим измерениям для Porphyra sp. и Palmaria palmata, которые имели и сходный показатель δ15N (5.03–5.3). Относительное обеднение 13С характерно в исследованном случае и для фитопланктона, о содержании изотопа углерода в котором можно судить по мидиям (рис. 4). Таким образом, изотопные подписи основных первичных продуцентов в разных районах Баренцева моря достаточно близки, а различия подписей консументов связаны с разным характером питания. Данное обстоятельство позволяет нам сравнивать и выявлять особенности пищевых путей от продуцентов к консументам в закрытых губах и открытых районах Баренцева моря.
Продукция фитопланктона прослеживается через изотопный состав таких видов как исландский гребешок, который, как и мидия, является фильтратором. Необычным представляется достаточно высокий уровень δ15N в мышцах гребешков, что не соответствует представлению о них как о потребителях пищи только растительного происхождения. Сходное обогащение тяжелым изотопом азота было отмечено во внутренней (по сравнению с внешней) части Пурсангер-фьорда в северной Норвегии (Fuhrmann et al., 2017). Можно предположить большее по сравнению с мидиями включение в пищу Chlamys islandica организмов зоопланктона или придонной взвеси смешанного происхождения. К пищевой цепи, идущей от фитопланктона через мидий, относятся и обыкновенные морские звезды Asterias rubens, хорошо известные как потребители мидий (Hancock, 1955; Dare, 1982). Моллюски-трубачи (Buccinum undatum) по доле изотопа углерода также могут быть преимущественно отнесены к пищевой цепи, идущей от фитопланктона. Повышенное содержание 15N в тканях этих моллюсков (хотя и меньшее, чем в Пурсангер-фьорде, см. Fuhrmann et al., 2017) и в Исфьорде, архипелаг Шпицберген (Zmudczyńska-Skarbek, Balazy, 2017) согласуется с представлением об этих животных как хищниках и падальщиках, в частности потребляющих двустворчатых моллюсков (Nielsen, 1974), связанных с пелагической пищевой цепью (Zmudczyńska-Skarbek, Balazy, 2017).
Литорины Littorina cf. saxatilis известны как оппортунистические потребители микроводорослей (диатомовых), нитчаток, а также в некоторых случаях макроводорослей (Sacchi et al., 1981; Norton et al., 1990; Voltolina, Sacchi, 1990; Otero-Schmitt et al., 1997). Более крупные Littorina littorea в большей степени потребляют макро-, но также и микроводоросли (Watson, Norton, 1985; Davies, Falconer, 2001). Мы рассматриваем Littorina spp. как консументов первого порядка в бентической трофической цепи, ведущей от различных донных микро- и макроводорослей (обогащенных 13С) в литоральной и верхнее-сублиторальной зоне. Сходное положение занимают морские ежи (Strongylocentrotus sp.) и макомы (Macoma balthica) (рис. 4). Эти последние, собирающие пищевые частицы с поверхности грунта или отфильтровывающие их из придонного слоя (Герасимова, 1988), являются, в соответствии со своим изотопным составом, потребителями детрита различного происхождения.
Морские ежи рода Strongylocentrotus в Баренцевом море известны, в первую очередь, как активные консументы ламинариевых и других водорослей (Кузнецов, 1946; Бажин, Степанов, 2012; Евсеева, 2016). В пограничных с лагуной Линьялампи участках губы Амбарной они характеризуются практически той же величиной δ13С, что и средняя для Saccharina latissima, по содержанию изотопа азота соответствуя консументам самого низшего уровня – мидиям (рис. 4). Сходное содержание тяжелого изотопа углерода обнаружено у S. droebachiensis в Пурcангер-фьорде (Fuhrmann et al., 2017). Иная ситуация в лагуне Линьялампи, где морские ежи отличаются по содержанию тяжелого изотопа углерода от ламинариевых водорослей и имеют более высокое содержание изотопа азота (рис. 4), сходное с величиной, определенной для морских ежей в Пурсангер-фьорде (Fuhrmann et al., 2017). Впрочем, и участки обитания морских ежей в районе мидиевой банки у пролива, соединяющего ковши Линьялампи и Сисяярви, и зона келпа пространственно разобщены. Точно определить источник пищи морских ежей в лагунах по имеющимся данным затруднительно. Он может быть связан с часто наблюдающимся потреблением морскими ежами остатков различных водорослей, сносимых течением (Евсеева, 2016), и добавлением в пищу животных компонентов, повышающих δ15N.
В экосистеме губы Амбарной раки-отшельники, камчатский краб и крабы-пауки являются консументами близкого к третьему уровня (табл. 7). При этом раки-отшельники Pagurus pubescens в самой губе Амбарной имеют несколько более низкий трофический уровень, чем камчатский краб, а в лагуне Линьялампи сходный. В целом для раков-отшельников характерна оппортунистическая стратегия питания (Hazlett, 1981). В атлантических водах Канады в составе пищи P. pubescens зафиксированы фитобентос, фораминиферы, амфиподы, остракоды, гидроиды, фрагменты двустворчатых моллюсков, полихеты и офиуры (Squires, 1990). В прибрежье Мурмана Соколов (2003) наблюдали питание раков-отшельников организмами эпибиоза ламинариевых водорослей – гидроидами и мшанками. Таким образом, наряду с животными, которые как связаны, так и не связаны с келпом, P. pubescens может потреблять фитобентос и, в некоторых случаях, даже растительный материал наземного происхождения (Zmudczyńska-Skarbek et al., 2015). Это объясняет его более низкий трофический уровень по сравнению с другими рептантными Decapoda. Интересно отметить схожие различия изотопных подписей раков-отшельников и морских ежей между открытой частью губы Амбарной и лагунами (от 1 до 1.8‰ насыщение 13С, и от 1.2 до 1.8‰ насыщение 15N соответственно). Точно определить источники пищи рассматриваемых организмов по имеющимся данным затруднительно, однако маловероятно, что данная ситуация связана с различиями в фоновых соотношениях изотопов, так как у других видов ракообразных изотопные подписи в лагунах и вне их существенно не различаются. Скорее всего, различаются именно пищевые цепи, в которые входят морские ежи и раки-отшельники в лагунах и губе Амбарной.
В составе пищи крабов-пауков растительные компоненты не отмечены, зато присутствует широкий набор донных организмов, указывающий на активное хищничество: гидроиды, полихеты, панцирные, брюхоногие и двустворчатые моллюски, включая молодь морских гребешков и мидии, амфиподы, копеподы, эвфаузииды, небольшие крабы, морские звезды, офиуры, молодь морских ежей, и рыбы (Hancock, 1955; Squires, 1990; Arsenault, Himmelman, 1996; Fagerli et al., 2014; Р.Н. Буруковский, личное сообщение). Эти наблюдения согласуются с наиболее высоким среди изученных декапод трофическим уровнем крабов-пауков как в открытых частях губы Амбарной, так и в ковшах. Приуроченность к зарослям ламинариевых водорослей и значительная концентрация H. araneus в лагунах Линьялампи и Сисяярви (наблюдения авторов; рис. 3Д) указывают, что эти крабы могут быть ключевыми для экосистемы лагун хищниками, связанными с поясом фитали.
Полученные в данном исследовании изотопные характеристики взрослых камчатских крабов по δ13С очень близки для выборки из Пурсангер-фьорда (16.5–19‰) (Fuhrmann et al., 2017), что может указывать на использование крабами в пищу организмов как из планктической, так и бентической пищевых цепей. Так обычными группами, потребляемыми крабами в Варангер-фьорде в целом, являются мидии (планктическая пищевая цепь), морские ежи (бентическая цепь) и гастроподы (Ржавский, Переладов, 2003). Однако, если в самой губе Амбарной морские ежи являются консументами первого порядка и по содержанию стабильного изотопа углерода близки к P. camtschaticus, что может указывать на их прямое потребление камчатским крабом, то в лагунах Линьялампи и Сисяярви морские ежи, судя их изотопному составу, вряд ли играют столь существенную роль в питании крабов (рис. 4). Трофический уровень, вычисленный для камчатских крабов из губы Амбарной (3.44), несколько превышает средние величины (3.10–3.15) для крабов с шириной карапакса более 70 мм из Пурсангер-фьорда и близок к максимальным индивидуальным значениям 3.5 (Fuhrmann et al., 2017). В то же время крупные крабы из лагун занимают более низкий трофический уровень (табл. 7). Это может быть связано с большей долей водорослей (которые так или иначе почти всегда представлены в желудках крабов; см. Ржавский, Переладов, 2003; Fuhrmann et al., 2017) в составе пищи или с неоднократно наблюдавшимся в ковшах губы Амбарной питанием Paralithodes camtschaticus инфауной на рыхлых грунтах (Ржавский, Переладов, 2003; наблюдения авторов; рис 3Г, 3Е). Такой тип питания менее избирателен, чем потребление эпифауны (Ржавский, Переладов, 2003; Jørgensen, Spiridonov, 2013) и может приводить к заглатыванию и усваиванию растительных остатков и детрита.
Наиболее важным отличием трофической сети ковшовых губ кута губы Амбарной является отсутствие выраженной пищевой цепи, ведущей от келпа через его основных пастбищных потребителей морских ежей к донным хищникам крабам, которые могут быть представлены разными видам. Эта пищевая цепь характерна для более открытых участков прибрежной зоны Баренцева и Норвежского морей с выраженным поясом ламинариевых водорослей (Павлова, 2009; Norderhaug, Christie, 2009; Fagerli et al., 2014). В связи с ограниченностью распространения морских ежей и выедания ими келпа в соленых озерах, большая по сравнению с характерными морскими сообществами часть продукции макрофитов может уходить в детритные пищевые цепи и уже через них – к консументам более высоких уровней. Возможно, что с этим связано общее обогащение 13С тканей декапод – консументов третьего трофического уровня в лагунах по сравнению с открытой частью губы (рис. 4), однако этот вопрос требует дальнейших исследований.
Многолетние изменения в донных сообществах
Являются ли современные особенности донных сообществ лагун Линьялампи и Сисяярви исключительно результатом действия особых условий лагун, или в них внесло вклад многолетнее всесезонное присутствие камчатского краба? Повсеместная встречаемость игл морских ежей в осадках соленых озер (Переладов и др., 2013; Деарт и др., 2018) наводит на мысль о возможно более широком распространении Strongylocentrotus spp. в этих водоемах в прошлом. Учитывая, что наиболее активно потребляют морских ежей взрослые особи P. camtschaticus, в особенности самки (Павлова, 2009), можно предположить, что присутствие этих особей в соленых озерах в течение значительной части года увеличило пресс хищничества, который и до вселения камчатского краба мог быть значительным за счет потребления молоди морских ежей многочисленной популяцией крабов-пауков. Режим водообмена лагун с морем, а именно более продолжительный период стока по сравнению с притоком воды в ходе приливного цикла (Бобков и др., 2013), должен приводить к ограниченному пополнению местной субпопуляции морских ежей за счет экспорта личинок из моря. Для лагун, по сравнению с прибрежной зоной моря, также характерен недостаток убежищ, которые важны для выживания молоди морских ежей (Шацкий, 2012). Необходимые для формирования убежищ валуны в ламинариевом поясе часто занесены осадком, а глубже зоны келпа встречаются редко (наблюдения авторов). Биотопы со сложным микрорельефом, такие как пороги и мидиевые банки в районе проливов, могут отчасти восполнять недостаток убежищ для небольшого поселения морских ежей, но, возможно, не могут компенсировать выедания на других участках. Для другой ковшовой губы Баренцева моря – губы Зеленой – сравнение современных данных с данными, полученными до вселения камчатского краба, показывает, что в условиях значительной численности крабов морские ежи на большей части характерных для них биотопов малочисленны. Они концентрируются только на ограниченных участках в поясе Alaria esculenta (L.) Greville на границе литорали и сублиторали, реже посещаемой крабами, который обычно обитают глубже (Деарт и др., 2017).
Альтернативное объяснение ограниченного распространения морских ежей в лагунах Линьялампи и Сисяярви предполагает действие каких-либо лимитирующих факторов физической среды. Ими, очевидно, не могут быть термогалинные характеристики придонной воды, которые на глубинах до 20 м не отличаются существенно от условий губы Амбарной (Бобков и др., 2013; Сапожников и др., 2017). Возможно, отрицательное влияние на донные организмы оказывает недонасыщение воды кислородом: оно отмечено для сентября – начала осени (Сапожников и др., 2017) и может быть связано с бактериальной деструкцией обильного макрофитного детрита. Повсеместная встречаемость и относительно высокая численность полихеты Scalibregma inflatum в соленых озерах рассматривалась как индикатор возникновения время от времени неблагоприятных для большинства донных организмов условий дефицита кислорода (Деарт и др., 2018). Проверка этого предположения требует более детальных исследований пространственной и временнóй изменчивости гидролого-гидрохимических условий, чем те, которые проводились до настоящего времени, когда соленые озера рассматривались лишь как периферия обширной акватории губ Печенга и Амбарная (Сапожников и др., 2017).
Соленые озера Линьялампи и Сисяярви как полигон для многолетних исследований прибрежных экосистем и объект охраны
Описание и объяснение долговременных изменений донных сообществ в море осложнены высокой степенью открытости морских экосистем, сложностью выделения действующих факторов и достижения необходимого масштаба наблюдений. Существенна и высокая стоимость соответствующих работ с использованием исследовательских судов. Озера представляют собой более удобные объекты, где при известном уровне стационарности исследований оказывается возможным детально зафиксировать происходящие изменения в условиях среды и биоте, исследовать стоящие за этими изменениями процессы и, в конечном счете, подняться до понимания общих закономерностей долговременной динамики водных экосистем. Замечательный пример такого модельного подхода со всеми его историческими особенностями дает более чем столетняя работа гидробиологической станции на оз. Глубоком в Московской обл. (см. Коровчинский, 2017; Коровчинский и др., 2017).
Будучи полноценными морскими биотопами, ковшовые губы Линьялампи и Сисяярви допускают выделение и измерение факторов, определяющих долговременную динамику сообществ и экосистем во многих отношениях так же, как это возможно при изучении озер. Здесь могут быть получены оценки таких показателей как водообмен, экспорт и импорт биогенных элементов, растворенного и взвешенного органического вещества и планктона (включая личинок донных беспозвоночных) через проливы, детальное распределения бентоса и планктона, локальной первичной продукции, бактериальной деструкции и трофических отношений, контроль численности популяций донных организмов “снизу” (за счет кормовой базы) и “сверху” (за счет таких хищников как камчатский краб и другие декаподы). Особый интерес ковшовые губы кута губы Амбарной представляют для сравнительного исследования важных для всего побережья Скандинавии и Мурмана биоценотических отношений между келпом, морскими ежами и крабами (Britayev et al., 2010; Fagerli et al., 2014). Предыдущие результаты (Бобков и др., 2013; Переладов и др., 2013; Деарт и др., 2018) и данное исследование представляют собой лишь первую попытку характеристики некоторых процессов в среде и донных сообществах лагун и неизбежно ставят больше вопросов, чем дают ответов. В то же время они создают точку отсчета для дальнейшего изучения соленых озер Линьялампи и Сисяярви.
Как примечательный и даже уникальный (не встречается в других ковшовых губах Баренцева и Белого морей сочетание большой глубины ковшей и мелководности и узости внешнего пролива) природный объект, лагуны Линьялампи и Сисяярви безусловно заслуживают особой охраны в сочетании с регулярным мониторингом и исследованиями. Данные по ним вошли в обоснование выделения района особой биологической и экологической значимости “Побережье Мурмана и Варангер-фьорд” для целей Конвенции о биологическом разнообразии (СBD) (UNEP/CBD, 2014) и приоритетного в масштабах морей российской Арктики для охраны района “Варангер-фьорд и прибрежная зона п-ва Рыбачий” (Solovyev et al., 2017). В настоящее время соленые озера губы Амбарной не имеют природоохранного статуса. На их биоту может оказывать воздействие неконтролируемая добыча морского гребешка и камчатского краба, наблюдавшаяся авторами во время полевых исследований. По соседству в губе Амбарной находится хозяйство лососевой аквакультуры, потенциально способное оказать серьезное воздействие на гидрохимический режим прибрежной зоны (Сапожников и др., 2017). Оптимальным решением проблемы охраны лагун Линьялампи и Сисяярви и обеспечения продолжения исследования динамики прибрежной экосистемы было бы создание здесь природного заказника под управлением государственного природного заповедника Кандалакшский, в состав которого входят Айновы о-ва в Варангер-фьорде, и в сотрудничестве с научными учреждениями Российской Академии наук и Федерального агентства по рыболовству создание на базе заповедника научного стационара для работы в этом районе.
Список литературы
Анисимова Н.А., Манушин И.Е., 2003. Питание камчатского краба в Баренцевом море // Камчатский краб в Баренцевом море. Второе издание. Отв. ред. Беренбойм Б.И. Мурманск: Изд. ПИНРО. С. 170–189.
Бажин А.Г., Степанов В.Г., 2012. Морские ежи семейства Strongylocentrotidae морей России. Петропавловск-Камчатский: Изд-во КамчатНИРО. 196 с.
Беренбойм Б.И., 2003. Миграции и расселение камчатского краба в Баренцевом море // Камчатский краб в Баренцевом море. Второе издание. Отв. ред. Беренбойм Б.И. Мурманск: Изд. ПИНРО. С. 65–69.
Бобков А.А., Май Р.И., Лазарева Е.И., Спиридонов В.А., 2013. Геоморфологические особенности берегов и гидрологический режим кутовой части губы Амбарной (Кольский полуостров) // Известия Русского Географического общества. Т. 145. Вып. 6. С. 44–52.
Бобков А.А., Стрелков П.П., Ильина А.Н., 2010. Приливная изменчивость океанологических условий сублиторали губы Ивановской // Вестник СПбГУ. Серия 7. Геология. География. Вып. 2. С.86–99.
Бритаев Т.А., Ржавский А.В., Павлова Л.В., и др., 2007. Современное состояние донных сообществ и поселений макрозообентоса на мелководье Баренцева моря и роль антропогенного фактора в их динамике // Динамика морских экосистем и современные проблемы сохранения биологического потенциала морей России. Владивосток: Дальнаука. С. 314–356.
Вилкова О.Ю., Сабурин М.Ю., 2006. О состоянии запасов камчатского краба в прибрежной зоне Баренцева моря в весенний период 2006 г. // Рыбное хозяйство. № 3. С. 56–59.
Виноградов Л.Г., 1945. Годичный цикл жизни и миграции краба в северной части западнокамчатского шельфа // Известия ТИНРО. Т. 19. С. 3–54.
Герасимова О.В., 1988. Пищевое поведение Macoma balthica (L.) и его зависимость от некоторых факторов внешней среды // Количественное и качественное распределение бентоса. Кормовая база бентосоядных рыб. М.: ВНИРО. С. 149–153.
Гурвич Г.С., 1934. Распространение животных на литорали и в сублиторали Бабьего моря // Работы Беломорской методологической станции ГГИ. Исследования морей СССР. Т. 20. № 2. С. 15–32.
Деарт Ю.В., Антохина Т.И., Спиридонов В.А., Ржавский А.В., 2017. Динамика гидрологического режима и распределение макрозообентоса в губе Зеленой (Восточный Мурман) Баренцева моря // Труды VI Международной научно-практической конференции “Морские исследования и образование (MARESEDU-2017)”, Москва, 30.11–02.2017 г. Тверь: ООО “ПолиПРЕСС”. С. 447–451.
Деарт Ю.В., Переладов М.В., Спиридонов В.А., Антохина Т.И., Ржавский А.В., Бритаев Т.А., 2018. Донные сообщества мягких грунтов соленых озер Линьялампи и Сисяярви // ДАН. Т. 478. № 5. С. 608–612.
Евсеева Н.В., 2016. Питание морских ежей рода Strongylocentrotus в губе Ура (Западный Мурман) // Труды ВНИРО. Т. 161. С. 52–54.
Книпович Н.М., 1893. Несколько слов относительно фауны Долгой Губы Соловецкаго острова и физико-географических ее условий // Вестник естествознания. Т. 1–2. С. 44–57.
Комплексные исследования Бабьего моря, полуизолированной беломорской лагуны: геология, гидрология, биота – изменения на фоне трансгрессии берегов, 2016. Труды Беломорской биостанции МГУ. Т. 12. Под ред. Мокиевского В.О., Исаченко А.И., Дгебуадзе П.Ю., Цетлина А.Б. М.: Товарищество научных изданий КМК. 243 с. 17 цв. вкл.
Коровчинский Н.М., 2017. Предисловие // Труды Гидробиологической станции на оз. Глубоком им. Н.Ю. Зографа. Под ред. Коровчинского Н.М. Т. 11. М.: Товарищество научных изданий КМК. С. 7–12.
Коровчинский Н.М., Бойкова О.С., Мнацаканова Е.А., 2017. Долговременные наблюдения пелагического зоопланктона озера Глубокого и некоторые проблемы мониторинговых исследований // Труды Гидробиологической станции на оз. Глубоком им. Н.Ю. Зографа. Под ред. Коровчинского Н.М. Т. 11. М.: Товарищество научных изданий КМК. С. 39–62.
Краснова Е.Д., Воронов Д.А., Демиденко Н.А., Кокрятская Н.М., Пантюлин А.Н., Рогатых Т.А., Самсонов Т.Е., Фролова Н.Л., Шапоренко С.И., 2016. К инвентаризации реликтовых водоемов, отделяющихся от Белого моря // Комплексные исследования Бабьего моря, полу-изолированной беломорской лагуны: геология, гидрология, биота — изменения на фоне трансгрессии берегов. Под. ред. Мокиевского В.О., Исаченко А.И., Дгебуадзе П.Ю., Цетлина А.Б. Труды Беломорской биостанции МГУ. Т. 12. М.: Товарищество научных изданий КМК. С. 211–241.
Кузнецов В.В., 1946. Питание и рост растениеядных морских беспозвоночных Восточного Мурмана // Известия АН СССР, сер. Биологическая. № 4. С. 431–452.
Кузьмин С.А., Гудимова Е.Н., 2002. Вселение камчатского краба в Баренцево море. Особенности биологии, перспективы промысла. Апатиты: Изд. Кольского научного центра РАН. 236 с.
Матюшкин В.Б., 2003. Ранняя молодь камчатского краба в районах Западного Мурмана // Камчатский краб в Баренцевом море. Второе издание. Отв. ред. Беренбойм Б.И. Мурманск: Изд. ПИНРО. С. 140–152.
Орлов Ю.И., 2004. Камчатский краб в Атлантике: как вам это удалось? М.: Изд. А.А. Зусман, ISBN 5-93076-038-4. 90 с.
Павлова Л.В., 2009. Оценка выедания морского ежа Strongylocentrotus droebachiensis (Echinoidea: Echinoida) камчатским крабом Paralithodes camtschaticus (Malacostraca: Decapoda) в прибрежье Баренцева моря // Биология моря. Т. 35. Вып. 3. С. 191–198.
Переладов М.В., 2003. Особенности распределения и поведения камчатского краба (Paralithodes camtschaticus), на прибрежных мелководьях Баренцева моря // Донные экосистемы Баренцева моря (под ред. Соколова В.И.). Труды ВНИРО. Т. 142. С. 103–119.
Переладов М.В., Спиридонов Василий А., Аносов С.Е., Бобков А.А., Бритаев Т.А., Деарт Ю.В., Лабутин А.В., Симакова У.В., Спиридонов Виктор А., 2013. Исследование лагун Линьялампи и Сисяярви (Варангер-фьорд, юго-западная часть Баренцева моря): общая характеристика, донные сообщества и влияние на них интродуцированного камчатского краба (Paralithodes camtschaticus) // Материалы научной конференции “Морская биология, геология, океанология – междисциплинарные исследования на морских стационарах”, посвященной 75-летию Беломорской биологической станции МГУ (Москва, МГУ им. М.В. Ломоносова, 27 февраля–1 марта 2013 г.). М.: Товарищество научных изданий КМК. С. 241–245.
Пропп М.В., Денисов А.В., Погребов В.Б., Рябушко В.И., 1975. Экологическая система фиордовой губы Баренцева моря. 1. Гидрологическая и гидрохимическая характеристика // Биология моря. № 3. С. 44–56.
Ржавский А.В., Переладов М.В., 2003.Питание камчатского краба (Paralithodes camtschaticus) на мелководье Варангер-фьорда (Баренцево море): изучение содержимого пищеварительного тракта и визуальные наблюдения // Донные экосистемы Баренцева моря (под ред. Соколова В.И.). Труды ВНИРО. Т. 142. С. 120–131.
Романова Н.Н., 1969. О промысловых моллюсках Баренцева моря // Труды ВНИРО. Т. 65. С. 436–448.
Сапожников В.В., Аржанова Н.В., Грузевич А.К., Зозуля Н.М., Столярский С.И., Торгунова Н.И., Храмцова А.М., 2017. Гидролого-гидрохимическая характеристика среды обитания водных биоресурсов в губе Печенга // Труды ВНИРО. Т. 165. С. 83–100.
Семенов В.Н., 1988. Систематика и экология морских бассейнов Севера на разных этапах изоляции. Апатиты: Кольский филиал АН СССР. 46 с.
Соколов В.И., 2003. Распределение и некоторые особенности биологии массовых видов десятиногих ракообразных (Crustacea, Decapoda) в губе Териберка Баренцева моря // Донные экосистемы Баренцева моря. Труды ВНИРО. Т. 142. С. 77–91.
Соколов В.И., Штрик В.А., 2003. Биоценотический анализ донного поселения прибрежной зоны губы Териберка Баренцева моря и возможность его применения для оценки воздействия камчатского краба на экосистемы // Донные экосистемы Баренцева моря. Труды ВНИРО. Т. 142. С. 6–24.
Соколова Е.В., 1934. Материалы к гидрологии Бабьего моря // Работы Беломорской методологической станции ГГИ. Исследования морей СССР. Т. 20. № 2. С. 33–42.
Тальберг Н.Б., 2005. Сравнительная характеристика особенностей миграций камчатского краба на прибрежных акваториях Баренцева и Охотского морей // Прибрежные гидробиологические исследования. Труды ВНИРО. Т. 144. С. 91–101.
Фролова Е.А., Анисимова Н.А., Фролов А.А., Любина О.С., Гарбуль Е.В., Гудимов А.В., 2003. Донная фауна Мотовского залива // Фауна беспозвоночных животных Баренцева, Карского и Белого морей. Апатиты: Изд-во Кольского научного центра РАН. С. 219–239.
Шацкий А.В., 2012. Морские ежи рода Strongylocentrotus Мурманского побережья Баренцева моря: биология, распределение, перспективы промысла. Автореф. дис. … канд. биол. наук. М.: ВНИРО. 23 с.
Arsenault D.J., Himmelman J.H., 1996. Size-related changes in vulnerability to predators and spatial refuge use by juvenile Iceland scallops Chlamys islandica // Marine Ecology Progress Series. V. 140. P. 115–122.
Britayev T.A., Rzhavsky A.V., Pavlova L.V., Dvoretskij A.G., 2010. Studies on impact of the alien Red King Crab (Paralithodes camtschaticus) on the shallow water benthic communities of the Barents Sea // Journal of Applied Ichtyology. V. 26 (suppl. 2). P. 66–73.
Dare P.J., 1982. Notes on the swarming behaviour and population density of Asterias rubens L. (Echinodermata: Asteroidea) feeding on the mussel, Mytilus edulis L. // ICES Journal of Marine Science. V. 40. P. 112–118.
Davies M.S., Falconer F., 2001. The consumption of algae Ulva lactuca, by the snail Littorina littorea, in relation to colliery waste contamination // Marine Freshwater Behavior and Physiology. V. 34. P. 249–255.
Falk-Petersen J., Renaud P., Anisimova N., 2011. Establishment and ecosystem effects of the alien invasive red king crab (Paralithodes camtschaticus) in the Barents Sea–a review // ICES Journal of Marine Science. V. 68. P. 479–488.
Fagerli C.W., Norderhaug K.M., Christie H., Pedersen M.F., Fredriksen S., 2014. Predators of the destructive sea urchin Strongylocentrotus droebachiensis on the Norwegian coast // Marine Ecology Progress Series. V. 502. P. 207–218.
Fredriksen S., 2003. Food web studies in a Norwegian kelp forest based on stable isotope (δ13C and δ15N) analysis // Marine Ecology Progress Series. V. 260. P. 71–81.
Fuhrmann M., Pedersen T., Niessen E.M., 2017. Trophic niche of the invasive red king crab Paralithodes camtschaticus in a benthic food web // Marine Ecology Progress Series. V. 565. P. 113–129.
Hancock D.A., 1955. The feeding behaviour of starfish on Essex oyster beds // Journal Marine Biological Association UK. V. 34. P. 313–331.
Hazlett B.A., 1981. The behavioural ecology of hermit crabs // Annual Review of Ecology, Evolution and Systematics. V. 12. P. 1–22.
Jacobs P., Troost K., Riegman R., van der Meer J., 2015. Length and weight-dependent clearance rates of juvenile mussels (Mytilus edulis) on various planktonic prey items // Helgoland Marine Research. V. 69. P. 101–112.
Jörgensen T., Løkkeborg S., Fernö A., Hufthammer M., 2007. Walking speed and area utilization of red king crab (Paralithodes camtschaticus) introduced to the Barents Sea coastal ecosystem // Hydrobiologia. V. 582. P. 17–24.
Jørgensen L.L., Spiridonov V. (eds.), 2013. Effect from the king- and snow crab on Barents Sea benthos. Results and conclusions from the Norwegian–Russian Workshop in Tromsш 2010. Fisken og Havet nr.8/2013. Bergen: Institute of Marine Research. 41 p.
Nielsen C., 1974. Observations on Buccinum undatum L. attacking bivalves and on prey responses, with a short review on attack methods of other prosobranchs // Ophelia. V. 13. P. 87–108.
Norderhaug K.M., Christie H.C., 2009 Sea urching grazing and kelp re-vegetation in the North-East Atlantic // Marine Biology Research. V. 5. P. 515–528.
Norton T.A., Hawkins S.J., Manley N.L., Williams G.A., Watson D.C., 1990. Scraping and living, a review of littorinid grazing // Hydrobiologia. V. 193. P. 117–38.
Orlov Y.I., Ivanov B.G., 1978. On the introduction of the Kamchatka king crab Paralithodes camtschatica (Decapoda: Anomura: Lithodidae) into the Barents Sea // Marine Biology. V. 48. P. 373–375.
Otero-Schmitt J., Cruz R., Garcia C., Rolán-Alvarez E., 1997. Feeding strategy and habitat choice in Littorina saxatilis (Gastropoda: Prosobranchia) and their role in the origin and maintenance of a sympatric polymorphism // Ophelia. V. 46. P. 205–216.
Oug E., Cochrane S., Sundet J.H., Norling K. Nilsson H.C., 2011. Effects of the invasive red king crab (Paralithodes camtschaticus) on soft-bottom fauna in Varangerfjorden, northern Norway // Marine Biodiversity. V. 41. P. 467–479.
Pereladov M.V., Labutin A.V., Deart Yu.V., Brutayev T.A. Chikina M.V., Spiridonov V.A., 2014. Semi-isolated fjordic lagoons in the Barents Sea and the studies of impact of the introduced red king crab (Paralithodes camtschaticus) on benthic communities // A variety of interactions in marine environment. Abstract volume from 49th European Marine Biology Symposium. September 8–12, 2014. St. Petersburg, Russia. P. 38.
Post D.M., 2002. Using stable isotopes to estimate trophic position: models, methods and assumptions // Ecology. V. 83. P. 703–718.
Post D.M., Layman C.A., Arrington D.A., Takimoto G., Quattrochi J., Montaña C.G., 2007. Getting to the fat of the matter: models, methods and assumptions for dealing with lipids in stable isotope analyses // Oecologia. V. 152. P. 179–189.
R Core Team, 2018. R: a language and environment for statistical computing. Vienna: R Foundation for Statistical Computing. [Электронный ресурс]. Условия доступа: https://www.R-project.org/ [Последнее обращение 18.10.2018].
Sacchi C., Occhipinti Ambrogi A., Voltolina D., 1981. Recherches sur le spectre trophique compare de Littorina saxatilis (Olivi) et de L. nigrolineata (Gray) (Gastropoda, Prosobranchia) sur la greve de Roscoff. Cas de populations vivant au milieu d’algues macroscopiques // Cahiers Biologie marine. V. 22. P. 83–88.
Solovyev B., Spiridonov V., Onufrenya I., Belikov S., Chernova N., Dobrynin D., Gavrilo M., Glazov D., Krasnov Yu., Mujaramova S., Pantyulin A., Platonov N., Saveliev A., Stishov M., Tertitsky G., 2017. Identifying a network of priority areas for conservation in the Arctic seas: Practical lessons from Russia // Aquatic Conservation. Marine and Freshwater Ecosystems. V. 27. Supplement 1. P. 30–51.
Squires H.J., 1990. Decapod Crustacea of the Atlantic coast of Canada. Canadian Bulletin Fishery Aquatic Science. V. 221. P. 1–532.
Sundet J.H., 2014. Red king crab in the Barents Sea // Stevens B.G. (ed.) King crabs of the World. Biology and Fisheries Management. Boca Raton, Fl.: CRC Press. P. 485–500.
Sundet J.H., Rafter E.E., Nilssen E.M., 2000. Stomach content of the red king crab (Paralithodes camtschaticus) (Tilesius, 1815) in the Southern Barents Sea // F.R. Schram and C. von Vaupel Klein, editors. The biodiversity crisis and Crustacea. Crustacean Issues. V. 12. Part 2. Leiden: Brill. P. 193–201.
UNEP/CBD/EBSA/WS/2014/1/5, 2014. Report of the Arctic regional workshop to facilitate the description of ecologically and biologically significant marine areas (Helsinki, 3-7 March 2014) [Электронный ресурс]. https://www.cbd.int/doc/meetings/mar/ebsaws-201401/ official/ebsaws-2014-01-05-en.pdf. Дата обращения: 19.03.2020.
Verwei J., 1952. On the ecology of distribution of cockle and mussel in the Dutch Wadden Sea, their role in sedimentation and the source of their food supply // Archive Neederlandische Zoologie. V. 10. P. 171–239.
Voltolina D., Sacchi C.F., 1990. Field observations on the feeding habits of Littorina scutulata Gould and L. sitkana Philippi (Gastropoda, Prosobranchia) of southern Vancouver Island (British Columbia, Canada) // Hydrobiologia. V. 193. P. 147–154.
Watson, D.C., Norton, T.A., 1985. Dietary preferences of the common periwinkle, Littorina littorea (L.) // Journal Experimental Marine Biology Ecology. V. 88. P. 193–211.
Wiedemeyer W. L., Schwamborn R., 1996. Detritus derived from eelgrass and macroalgae as potential carbon source for Mytilus edulis in Kiel Fjord, Germany: a preliminary carbon isotopic study // Helgoländer Meeresuntersuchungen. V. 50. P. 409–413.
Wong W. H., Levinton J. S., 2006. The trophic linkage between zooplankton and benthic suspension feeders: direct evidence from analyses of bivalve fecal pellets // Marine Biology. V. 148. P. 799–805.
Zmudczyńska-Skarbek K., Balazy P., 2017. Following the flow of ornithogenic nutrients through the Arctic marine coastal food webs // Journal of Marine Systems. V. 168. P. 31–37.
Zmudczyńska-Skarbek K., Balazy P., Kuklinsky P., 2015. An assessment of seabird influence on Arctic coastal benthic communities // Journal of Marine Systems. V. 144. P. 48–56.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал